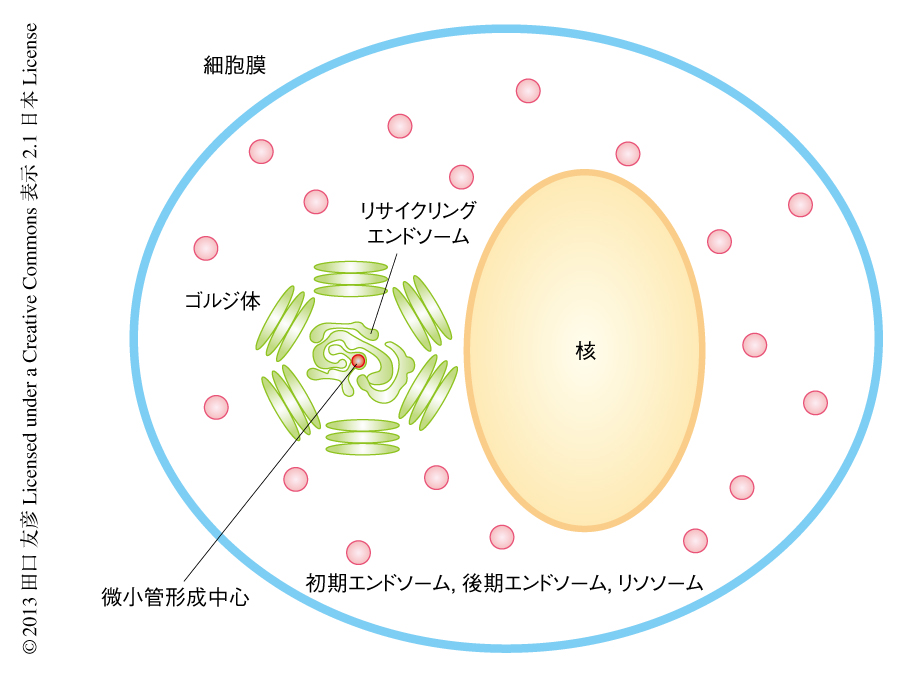
リサイクリングエンドソームにより構成される物質輸送のネットワーク
2013/11/29
田口 友彦
(東京大学大学院薬学系研究科 疾患細胞生物学)
email:田口友彦
領域融合レビュー, 2, e015 (2013) DOI: 10.7875/leading.author.2.e015
Tomohiko Taguchi: A new aspect of membrane traffic through recycling endosomes.

リサイクリングエンドソームは,1980年代に,細胞膜から取り込まれた物質がふたたび細胞膜へとリサイクルされる際に通過するオルガネラとして同定された.発見から長期にわたり“物質のリサイクルに特化したエンドソーム”という位置づけで扱われてきたが,近年,リサイクルとは異なる点で物質輸送にかかわる機能がつぎつぎに明らかにされ,リサイクリングエンドソームに対する見方は大きく変わってきている.ここでは,進展のいちじるしいリサイクリングエンドソームによる細胞内物質輸送について解説し,今後の展望と課題を論じる.
1908年にノーベル医学生理学賞を受賞したロシアの細菌学者Elie Metchnikoffにより,細胞が外界から物質を取り込み(エンドサイトーシス),細胞にある酸性の環境においてこれを分解することが発見されてから100年以上が経過した.今日では,エンドサイトーシスは細胞の外から取り込んだ物質を分解するだけでなく,細胞の外へと物質をもどす再利用(リサイクル)も行うこと,そして,細胞極性の形成および維持,細胞内シグナル伝達,細胞移動など,多彩な機能に関与していることが明らかになってきた.細胞に取り込まれた物質はエンドソームとよばれる一連のオルガネラにより選別され輸送される.ここでは,エンドソームのうち,とくにリサイクリングエンドソーム(recycling endosome)にスポットをあて,近年,進展のいちじるしいこのオルガネラについての知見を解説する.
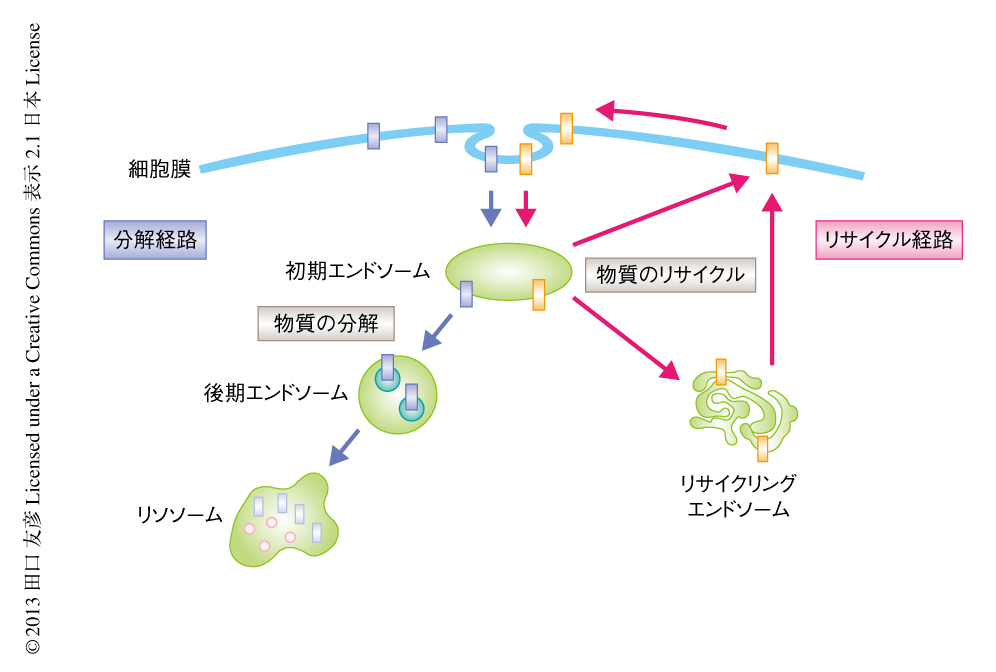
細胞膜から取り込まれた物質は2~3分のあいだに初期エンドソーム(early endosome)とよばれるエンドソームに輸送される(図1).物質はここで選別をうけ,分解経路あるいはリサイクル経路などの輸送経路をとおってさらに細胞のなかを移動していく1,2).その物質を選別する機能に着目して,初期エンドソームは選別エンドソーム(sorting endosome)とよばれることもある.
分解経路をとおる代表的なタンパク質として,活性化した上皮成長因子受容体がある.細胞膜において上皮成長因子と結合した上皮成長因子受容体は,細胞質内の領域にユビキチンによる修飾をうけ,このユビキチンを認識するタンパク質により,後期エンドソーム(late endosome),ついで,リソソームへと輸送されることにより,最終的に分解をうける.この系は,活性化された増殖因子の受容体から増殖シグナルが出つづけることにより細胞が過増殖することを防ぐための重要な負の制御機構である.後期エンドソームは内部に多くの小胞をもつことから,多胞体(multivesicular body:MVB)とよばれることもある.また,細胞膜に結合していない可溶性の物質も分解経路をとおることが明らかになっている.その代表的な物質として,低密度リポタンパク質がある.低密度リポタンパク質は細胞膜に存在する低密度リポタンパク質受容体により捕捉され,初期エンドソームへと輸送される.初期エンドソームにおいて両者は解離し,低密度リポタンパク質受容体はリサイクル経路をとおり細胞膜へ,一方,遊離した低密度リポタンパク質は分解経路をとおりリソソームへと輸送されていく.低密度リポタンパク質は最終的に加水分解酵素により分解されて遊離のコレステロールを生じるが,これはコレステロール合成能をもたない末梢組織の細胞が外界からコレステロールを獲得する重要な手段である.
初期エンドソームから細胞膜へと物質をもどす経路は2つあり,初期エンドソームから細胞膜へと直接にもどる経路と,リサイクリングエンドソームを通過して細胞膜へともどる経路が知られている.前者を速いリサイクリング(fast recycling),後者を遅いリサイクリング(slow recycling)とよび区別することもある.リサイクリングエンドソームは多くの細胞において核の近縁部に存在し,その内部のpHは6.5と弱酸性である3).細胞膜に結合した物質のうち分解経路をとおるためのシグナルをもたないものは,一般的にリサイクルされると考えられている.速いリサイクリングおよび遅いリサイクリングとも,物質はチューブ状の膜担体により輸送されることが知られている.球形をとる初期エンドソームと比較すると,チューブ状の構造物ではその内部の空間(可溶性の物質の存在する空間)は膜の表面積に比して小さくなっている.そのために,可溶性の物質は膜に結合した物質と比較して相対的にリサイクル経路から排他され,分解経路へとむかうと考えられている.リサイクル経路の最大の利点は,細胞の外からの物質の取り込みに利用される受容体を分解することなしに何回も使うことにより,受容体をあらためて生合成しないですむことである.
細胞が2つのリサイクル経路をもつ生物学的な意義については明確ではないが,グルコーストランスポーターであるGlut4の輸送は示唆的である.細胞においてGlut4貯蔵小胞に局在しているGlut4は,インスリンによる刺激によりすみやかに細胞膜へと移行し,グルコースの細胞への取り込みを行う.ついで,Glut4はエンドサイトーシスにより細胞膜から取り込まれ,ふたたびGlut4貯蔵小胞へと移行しつぎのインスリンによる刺激に備える.細胞膜からGlut4貯蔵小胞へと輸送される際には,Glut4はリサイクリングエンドソームを通過することが必要である4).すなわち,Glut4は遅いリサイクリング経路の一部を利用してGlut4貯蔵小胞へと輸送される.抗利尿ホルモンによる刺激により細胞膜と細胞のなかのコンパートメントとを往来する水チャンネルAquaporin 2についても,細胞膜からの移行においてリサイクリングエンドソームの通過が必要であることが示唆されている5).
なお,2000年以前には,速いリサイクリング経路に関与しているという観点から,初期エンドソームをリサイクリングエンドソームとよんでいる論文が多々あり,混乱をまねいている(現在でも,なお,混同されていることがある).2000年以前の文献については,とくに注意が必要である.
エキソサイトーシスは分泌経路とも称され,小胞体→ゴルジ体→細胞膜という細胞のなかから細胞の外への物質の輸送経路である.ところがここ10年,ゴルジ体から細胞膜へと直接に輸送されず,いったんリサイクリングエンドソームを通過したのちに細胞膜へ輸送される物質,すなわち,小胞体→ゴルジ体→リサイクリングエンドソーム→細胞膜という経路で輸送される物質のあることが明らかになってきた.
2004年,ウイルスのエンベロープタンパク質であるVSV-GのエキソサイトーシスをMDCK細胞を用いて追跡している過程において,ゴルジ体を通過した数分のち,培地から取り込ませた蛍光標識トランスフェリンにより可視化されたリサイクリングエンドソームにVSV-Gが流入してくることが見い出された6).さらに,トランスフェリン-西洋ワサビペルオキシダーゼ融合タンパク質を用いてリサイクリングエンドソームの内側のタンパク質を架橋し膜の流動性を低下させたときには,VSV-Gの細胞膜への輸送は劇的に低下することが示された.これらのことから,VSV-Gのエキソサイトーシスにはリサイクリングエンドソームの通過が必須であることが明らかになった.
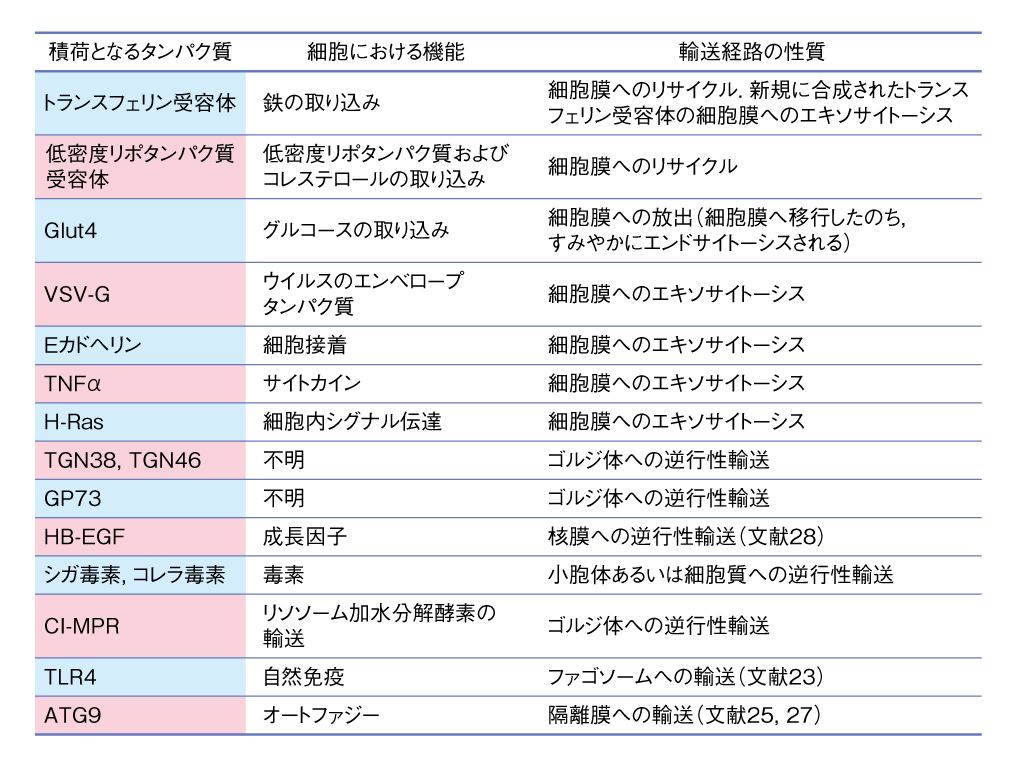
現在までに,細胞接着因子であるEカドヘリン7),サイトカインであるTNFα8),小胞体あるいはゴルジ体における脂質修飾により膜に結合した低分子量Gタンパク質H-RasおよびN-Ras 9) などが,ゴルジ体を通過したのちリサイクリングエンドソームを経由して細胞膜へと輸送されることが示されている(表1).ゴルジ体とリサイクリングエンドソームとは多くの細胞において核の近縁部に非常に近接して存在しており,通常の光学顕微鏡の解像度では両者を分離して観察することはむずかしい10).今後,リサイクリングエンドソームに特異的な機能の阻害を用いることにより,ゴルジ体を通過したのちリサイクリングエンドソームをへて細胞膜へと輸送されるタンパク質がつぎつぎと明らかになると期待される.
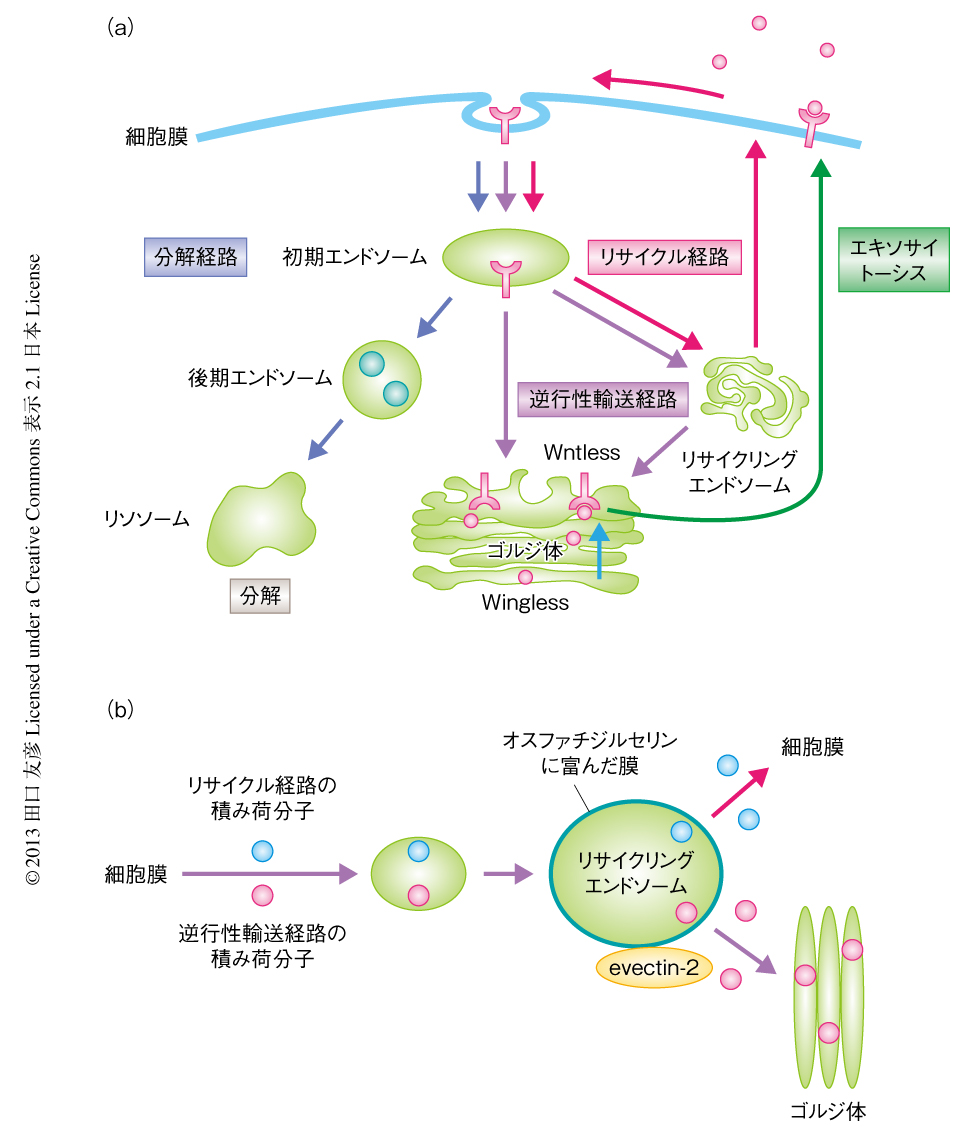
初期エンドソームからゴルジ体へといたる輸送経路を逆行性輸送経路(retrograde transport)とよぶ11,12).この輸送経路はエキソサイトーシスとは逆の方向性をもつためこのようによばれている(図2a).この経路の発見は比較的最近であることもあり,逆行性輸送経路により輸送される物質はまだあまり多くは知られていないが,近年,遺伝学的な研究からこの経路の重要性が明らかにされた.Winglessとよばれる形態形成決定タンパク質を細胞の外へと放出するには,Wntlessという受容体が必須である.このWntlessはおもにゴルジ体に局在すること,ゴルジ体と細胞膜とのあいだをつねに行き来していること,さらに,初期エンドソームにおいて逆行性輸送経路を制御するレトロマーとよばれるタンパク質複合体のはたらきを抑制することにより,Wntlessのゴルジ体への局在が損なわれWinglessの放出が失われること,が示されたのである.この分子機構は,さきに述べた細胞膜に局在するタンパク質のリサイクル経路と表裏一体の関係ととらえることができる.すなわち,エキソサイトーシスと逆行性輸送経路との組合せにより,ゴルジ体に局在するタンパク質のリサイクルが保証されているのである13).
レトロマーは初期エンドソームに局在することなどから,逆行性輸送経路は初期エンドソームからゴルジ体へと直接にいたる経路と考えられてきた.しかしながら,近年,逆行性輸送経路により輸送されるいくつかの物質は,初期エンドソームからいちどリサイクリングエンドソームへと輸送され,ついで,ゴルジ体へと輸送されていることが明らかになってきた.コレラ毒素やシガ毒素などのタンパク質性の毒素は逆行性輸送経路を利用して細胞に侵入し,エンドソームを通過してゴルジ体あるいは小胞体,そしてさらに,細胞質へと輸送されることにより毒性を発揮する.リサイクリングエンドソームに局在するタンパク質evectin-2のノックダウンにより,コレラ毒素の輸送がリサイクリングエンドソームにおいて遅延し,ゴルジ体への到達が劇的にさまたげられること,また,逆行性輸送経路を利用してゴルジ体への局在を維持するタンパク質TGN46およびGP73の局在が完全に失われることが示された14).その一方で,リサイクリングエンドソームから細胞膜へともどるトランスフェリンのリサイクル経路には影響は認められなかった.すなわち,evectin-2はリサイクリングエンドソームからゴルジ体へとむかう逆行性輸送経路において特異的な制御タンパク質であることが示されたのである(図2b).
また,evectin-2の作用機構を解析するなかで,低分子量Gタンパク質であるArfのGAP(GTPase activating protein,GTPase活性化タンパク質)であるSMAP2のリサイクリングエンドソームへの局在は,evectin-2に依存していることが見い出された15).SMAP2のノックダウンは,evcetin-2と同様に,コレラ毒素の輸送をリサイクリングエンドソームにおいていちじるしく遅延させたが,トランスフェリンのリサイクル経路には影響を及ぼさなかった.evectin2およびSMAP2によるArfの活性制御により,リサイクルエンドソームからゴルジ体への逆行性輸送経路が制御されていることが示唆された.
このように,近年,エキソサイトーシスや逆行性輸送経路への関与など,古典的なリサイクル経路にとどまらないリサイクリングエンドソームの物質輸送における機能が明らかにされた.逆行性輸送経路においても,ゴルジ体とリサイクリングエンドソームとが核の近縁部に非常に近接して存在しているため,初期エンドソームからゴルジ体へ直接に輸送されていると解釈されている事例が多々あるものと思われる.evectin-2の機能を阻害することなどにより,今後,リサイクリングエンドソームを経由してゴルジ体へと輸送されるタンパク質がつぎつぎと同定されると期待される.
evectin-2は酸性脂質,とくにホスファチジルイノシトールリン酸と高い親和性で結合するPHドメインをN末端にもつ.evectin-2のリサイクリングエンドソームへの局在化の機構を解析するなかで,予期せぬことに,evectin-2のPHドメインはホスファチジルイノシトールリン酸には親和性を示さず,ホスファチジルセリンに特異性をもつことが見い出された14).evectin-2のリサイクリングエンドソームへの局在にはこのPHドメインが必須であったことから,リサイクリングエンドソームにはホスファチジルセリンが豊富に存在することが示唆されたが,これは,ホスファチジルセリンのプローブであるラクトアドヘリンC2ドメインを細胞質に発現させたときにこのプローブがリサイクリングエンドソームに集積することから確認された.
リサイクリングエンドソームを通過する輸送経路におけるホスファチジルセリンの重要性は,リサイクリングエンドソームへのevectin-2の局在において示唆されたが,それとは別に,ホスファチジルセリンの合成能の低下しているCHO細胞の変異株において,逆行性輸送経路を利用してゴルジ体への局在を維持するTGN38の局在が失われており,これは,逆行性輸送経路の特異的な阻害に起因することが示された16).さらに,ホスファチジルセリンの前駆体であるエタノールアミンの培地への添加によりこの異常は回復したことから,ホスファチジルセリンの減少と逆行性輸送経路の阻害との因果関係が明確に示された.
細胞内シグナル伝達の要であり,エキソサイトーシスにより細胞膜へと輸送されることのわかっていたパルミトイル修飾化Ras(H-RasおよびN-Ras)の挙動を解析するなかで,以下のことが見い出された9).1)パルミトイル修飾化Rasはおもにリサイクリングエンドソームおよび細胞膜に局在する.2)Rasのパルミトイル修飾はリサイクリングエンドソームへの局在に必須である.3)パルミトイル修飾化Rasはゴルジ体を通過したのち,細胞膜へと輸送されるまえにリサイクリングエンドソームに滞留する.4)Rasのパルミトイル修飾をうけるC末端の20アミノ酸残基からなるペプチドだけで,リサイクリングエンドソームおよび細胞膜への局在は再現される.4)の結果は,リサイクリングエンドソームの細胞質側を構成する脂質は,パルミトイル基との親和性が高いことを示唆した.パルミトイル基は16炭素鎖の飽和脂肪酸であることから,リサイクリングエンドソームの細胞質側を構成する脂質は飽和度の高い“ラフト様”脂質の性質をもつことが示唆された17).
蛍光性のコレステロールアナログと消光剤を用いて,細胞膜の内外におけるステロールの分布が解析された.その結果,細胞においてコレステロールの集積しているのは細胞膜とリサイクリングエンドソームであり,リサイクリングエンドソームではコレステロールのほとんどは細胞質の側にむいているという結論が得られた18).コレステロールはラフト脂質ドメインを形成する主要な分子であることから,この結果は,さきのRasの局在化の結果と合致するものであった.
スフィンゴミエリンを認識するEquinatoxin IIを細胞の染色に応用することにより,リサイクリングエンドソームがスフィンゴミエリンに非常に富んでいることが示された19).スフィンゴミエリンもコレステロールと同じくラフト脂質ドメインを形成する主要な分子であり,リサイクリングエンドソームの細胞質の側を構成する脂質の環境が飽和度の高い“ラフト様”であることがあらためて示唆された.
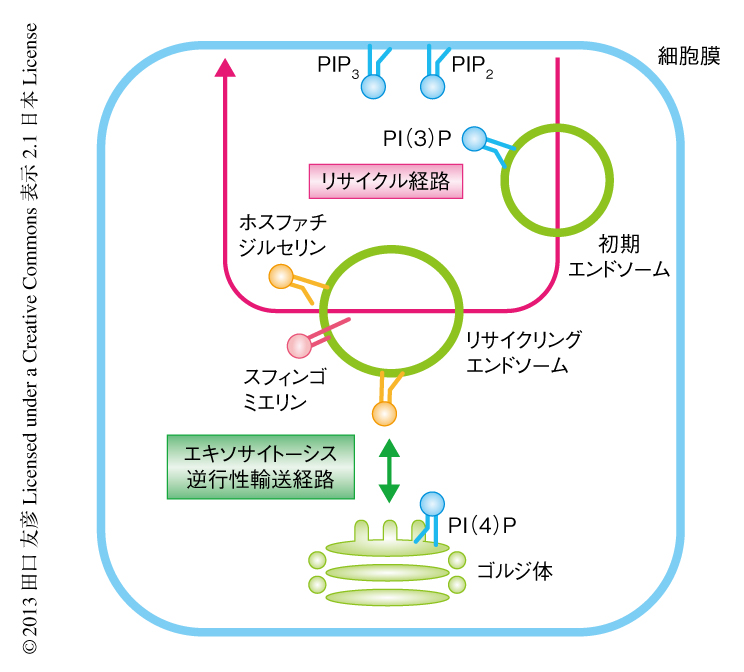
近年,特異的なホスファチジルイノシトールリン酸をもつことによりオルガネラの機能が規定される例が明らかにされている.細胞膜のホスファチジルイノシトール4,5-ビスリン酸およびホスファチジルイノシトール3,4,5-トリスリン酸,初期エンドソームのホスファチジルイノシトール3-リン酸,ゴルジ体のホスファチジルイノシトール4-リン酸がその例である.これらのホスファチジルイノシトールリン酸は,細胞質に存在する特異的な結合タンパク質をつうじオルガネラに固有の機能の発現に貢献している20).興味深いことに,リサイクリングエンドソームは初期エンドソームおよびゴルジ体と逆行性輸送経路やエキソサイトーシスにより密接に結びついているのにもかかわらず,ホスファチジルイノシトールリン酸の局在はほとんど報告されていない(図3).その一方で,さきに述べたように,リサイクリングエンドソームはホスファチジルセリンやラフト脂質に富んでいる.未同定のホスファチジルセリンに特異的な結合タンパク質がevectin-2のほかにも存在し,リサイクリングエンドソームの機能の発現に重要なはたらきをもつことが期待される.
さきにも述べたが,多くの細胞においてリサイクリングエンドソームは核の近縁部に存在する.核の近縁部はゴルジ体などほかのオルガネラが入り混じる領域であり,物質の輸送を精密に解析することはむずかしい.リサイクリングエンドソームの解析に適した細胞を探す過程で,アフリカミドリザルの腎臓に由来するCOS-1細胞がリサイクリングエンドソームとほかのオルガネラとの空間的な分離を高く示すことが明らかになった10)(図4).COS-1細胞ではゴルジ体は球形の構造をとり,その内側の空間にリサイクリングエンドソームが,その外部に初期エンドソーム,後期エンドソーム,リソソームが位置していた.共焦点顕微鏡により光学的に切片として観察すると,ゴルジ体はリング状の構造として,そして,その内部にリサイクリングエンドソームが観察された.リサイクリングエンドソームのしめる空間のさらに内側には微小管形成中心(microtubule organizing center:MTOC)が局在していた.
ゴルジ体のかたちづくる構造の内側の空間にさらにオルガネラが存在することは,リサイクリングエンドソームへのアクセスを考えるとたいへん奇異に思えるが,ゴルジ体の層板を貫通する穴が開いていて,そこを通過する微小管を利用することにより細胞質とゴルジ体の内部とのあいだで物質輸送の行われている可能性がある21).リサイクリングエンドソームのしめる空間のさらに内側に微小管形成中心が存在することは,この微小管をつうじた物質輸送の観点から興味深い.
COS-1細胞のみならず,PC12細胞,T細胞,HEK293細胞,単核細胞など,ゴルジ体が球形をとりその内側にリサイクリングエンドソームの配置されている細胞の報告があいついでいる22-24).今後,このような細胞を利用することにより,リサイクリングエンドソームを通過する物質輸送の解析が飛躍的に進歩することが期待される.
ここでまとめたように,この10年の研究により,リサイクリングエンドソームはリサイクル経路にかぎらず広範囲な物質輸送にかかわっていることが明らかになってきた.さらに最近になり,刺激的なことに,リサイクリングエンドソームを通過する物質輸送がオートファジーに関与していることも示唆されてきている25-27).リサイクリングエンドソームの機能の本質は,オルガネラに“膜”を供給し,同時に,それらオルガネラに局在するタンパク質をリサイクルすることにより,オルガネラの恒常性を維持することにあるのかもしれない.その意味で,微小管形成中心の近傍につねに位置するリサイクリングエンドソームの局在は,多くの物質輸送が微小管を使っていることを考えると示唆的である.リサイクリングエンドソームは微小管にそって流入してくる小胞に保持された物質を効率よく補捉して選別し,ついで,個々のオルガネラにむけ微小管にそって物質を発送できるという“地の利”がある.また,逆に考えれば,微小管形成中心の近傍に受動的または必然的に,リサイクリングエンドソームのような物質の配送センターが生じてくるのかもしれない.オルガネラの形成という観点からこの問題はたいへん興味深い.
リサイクリングエンドソームの研究はほかのオルガネラの研究に比較するとまだまだ遅れている.その最大の原因は,リサイクリングエンドソームに局在するタンパク質の情報が圧倒的に少ないこと(いまだ生化学的に満足できる精度では単離されていない),そしてそのために,特異的な機能阻害の手法が限定されていることである.COS-1細胞における観察において,evectin-2およびSMAP2とトランスフェリン受容体はともにリサイクリングエンドソームに局在するものの,完全に同一の場所に存在することはなく,リサイクリングエンドソームのなかで異なるドメインに局在していた14,15).実験的に容易であるがため,トランスフェリンの取り込みによりリサイクリングエンドソームの全体の可視化ができていると考えるのは明らかにまちがいであり,これまでの,トランスフェリンと共局在するかどうかでリサイクリングエンドソームの局在性を判定してきた知見は精査する必要がある.今後,ホスファチジルセリンやスフィンゴミエリンなどリサイクリングエンドソームを構成する脂質を利用した可視化ツールを用いて,リサイクリングエンドソームに局在するタンパク質が多く同定され,その個々の機能解析をつうじリサイクリングエンドソームの機能の全貌が明らかになってくるであろう.
略歴:1997年 東京大学大学院理学系研究科 修了,理化学研究所 基礎科学特別研究員,米国Yale大学 研究員,大阪大学大学院医学系研究科 特任准教授,オーストラリアQueensland大学 上級研究員を経て,東京大学大学院薬学系研究科 准教授.
研究テーマ:物質のリサイクルを物質の分解と対比しながら理解する.とくに,リサイクリングエンドソームの構造と機能を,細胞生物学な手法および生化学的な手法を使って明らかにしていきたい.
© 2013 田口 友彦 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 疾患細胞生物学)
email:田口友彦
領域融合レビュー, 2, e015 (2013) DOI: 10.7875/leading.author.2.e015
Tomohiko Taguchi: A new aspect of membrane traffic through recycling endosomes.
要 約
リサイクリングエンドソームは,1980年代に,細胞膜から取り込まれた物質がふたたび細胞膜へとリサイクルされる際に通過するオルガネラとして同定された.発見から長期にわたり“物質のリサイクルに特化したエンドソーム”という位置づけで扱われてきたが,近年,リサイクルとは異なる点で物質輸送にかかわる機能がつぎつぎに明らかにされ,リサイクリングエンドソームに対する見方は大きく変わってきている.ここでは,進展のいちじるしいリサイクリングエンドソームによる細胞内物質輸送について解説し,今後の展望と課題を論じる.
はじめに
1908年にノーベル医学生理学賞を受賞したロシアの細菌学者Elie Metchnikoffにより,細胞が外界から物質を取り込み(エンドサイトーシス),細胞にある酸性の環境においてこれを分解することが発見されてから100年以上が経過した.今日では,エンドサイトーシスは細胞の外から取り込んだ物質を分解するだけでなく,細胞の外へと物質をもどす再利用(リサイクル)も行うこと,そして,細胞極性の形成および維持,細胞内シグナル伝達,細胞移動など,多彩な機能に関与していることが明らかになってきた.細胞に取り込まれた物質はエンドソームとよばれる一連のオルガネラにより選別され輸送される.ここでは,エンドソームのうち,とくにリサイクリングエンドソーム(recycling endosome)にスポットをあて,近年,進展のいちじるしいこのオルガネラについての知見を解説する.
1.古典的なエンドサイトーシス経路
細胞膜から取り込まれた物質は2~3分のあいだに初期エンドソーム(early endosome)とよばれるエンドソームに輸送される(図1).物質はここで選別をうけ,分解経路あるいはリサイクル経路などの輸送経路をとおってさらに細胞のなかを移動していく1,2).その物質を選別する機能に着目して,初期エンドソームは選別エンドソーム(sorting endosome)とよばれることもある.
分解経路をとおる代表的なタンパク質として,活性化した上皮成長因子受容体がある.細胞膜において上皮成長因子と結合した上皮成長因子受容体は,細胞質内の領域にユビキチンによる修飾をうけ,このユビキチンを認識するタンパク質により,後期エンドソーム(late endosome),ついで,リソソームへと輸送されることにより,最終的に分解をうける.この系は,活性化された増殖因子の受容体から増殖シグナルが出つづけることにより細胞が過増殖することを防ぐための重要な負の制御機構である.後期エンドソームは内部に多くの小胞をもつことから,多胞体(multivesicular body:MVB)とよばれることもある.また,細胞膜に結合していない可溶性の物質も分解経路をとおることが明らかになっている.その代表的な物質として,低密度リポタンパク質がある.低密度リポタンパク質は細胞膜に存在する低密度リポタンパク質受容体により捕捉され,初期エンドソームへと輸送される.初期エンドソームにおいて両者は解離し,低密度リポタンパク質受容体はリサイクル経路をとおり細胞膜へ,一方,遊離した低密度リポタンパク質は分解経路をとおりリソソームへと輸送されていく.低密度リポタンパク質は最終的に加水分解酵素により分解されて遊離のコレステロールを生じるが,これはコレステロール合成能をもたない末梢組織の細胞が外界からコレステロールを獲得する重要な手段である.
初期エンドソームから細胞膜へと物質をもどす経路は2つあり,初期エンドソームから細胞膜へと直接にもどる経路と,リサイクリングエンドソームを通過して細胞膜へともどる経路が知られている.前者を速いリサイクリング(fast recycling),後者を遅いリサイクリング(slow recycling)とよび区別することもある.リサイクリングエンドソームは多くの細胞において核の近縁部に存在し,その内部のpHは6.5と弱酸性である3).細胞膜に結合した物質のうち分解経路をとおるためのシグナルをもたないものは,一般的にリサイクルされると考えられている.速いリサイクリングおよび遅いリサイクリングとも,物質はチューブ状の膜担体により輸送されることが知られている.球形をとる初期エンドソームと比較すると,チューブ状の構造物ではその内部の空間(可溶性の物質の存在する空間)は膜の表面積に比して小さくなっている.そのために,可溶性の物質は膜に結合した物質と比較して相対的にリサイクル経路から排他され,分解経路へとむかうと考えられている.リサイクル経路の最大の利点は,細胞の外からの物質の取り込みに利用される受容体を分解することなしに何回も使うことにより,受容体をあらためて生合成しないですむことである.
細胞が2つのリサイクル経路をもつ生物学的な意義については明確ではないが,グルコーストランスポーターであるGlut4の輸送は示唆的である.細胞においてGlut4貯蔵小胞に局在しているGlut4は,インスリンによる刺激によりすみやかに細胞膜へと移行し,グルコースの細胞への取り込みを行う.ついで,Glut4はエンドサイトーシスにより細胞膜から取り込まれ,ふたたびGlut4貯蔵小胞へと移行しつぎのインスリンによる刺激に備える.細胞膜からGlut4貯蔵小胞へと輸送される際には,Glut4はリサイクリングエンドソームを通過することが必要である4).すなわち,Glut4は遅いリサイクリング経路の一部を利用してGlut4貯蔵小胞へと輸送される.抗利尿ホルモンによる刺激により細胞膜と細胞のなかのコンパートメントとを往来する水チャンネルAquaporin 2についても,細胞膜からの移行においてリサイクリングエンドソームの通過が必要であることが示唆されている5).
なお,2000年以前には,速いリサイクリング経路に関与しているという観点から,初期エンドソームをリサイクリングエンドソームとよんでいる論文が多々あり,混乱をまねいている(現在でも,なお,混同されていることがある).2000年以前の文献については,とくに注意が必要である.
2.エキソサイトーシスとリサイクリングエンドソーム
エキソサイトーシスは分泌経路とも称され,小胞体→ゴルジ体→細胞膜という細胞のなかから細胞の外への物質の輸送経路である.ところがここ10年,ゴルジ体から細胞膜へと直接に輸送されず,いったんリサイクリングエンドソームを通過したのちに細胞膜へ輸送される物質,すなわち,小胞体→ゴルジ体→リサイクリングエンドソーム→細胞膜という経路で輸送される物質のあることが明らかになってきた.
2004年,ウイルスのエンベロープタンパク質であるVSV-GのエキソサイトーシスをMDCK細胞を用いて追跡している過程において,ゴルジ体を通過した数分のち,培地から取り込ませた蛍光標識トランスフェリンにより可視化されたリサイクリングエンドソームにVSV-Gが流入してくることが見い出された6).さらに,トランスフェリン-西洋ワサビペルオキシダーゼ融合タンパク質を用いてリサイクリングエンドソームの内側のタンパク質を架橋し膜の流動性を低下させたときには,VSV-Gの細胞膜への輸送は劇的に低下することが示された.これらのことから,VSV-Gのエキソサイトーシスにはリサイクリングエンドソームの通過が必須であることが明らかになった.
現在までに,細胞接着因子であるEカドヘリン7),サイトカインであるTNFα8),小胞体あるいはゴルジ体における脂質修飾により膜に結合した低分子量Gタンパク質H-RasおよびN-Ras 9) などが,ゴルジ体を通過したのちリサイクリングエンドソームを経由して細胞膜へと輸送されることが示されている(表1).ゴルジ体とリサイクリングエンドソームとは多くの細胞において核の近縁部に非常に近接して存在しており,通常の光学顕微鏡の解像度では両者を分離して観察することはむずかしい10).今後,リサイクリングエンドソームに特異的な機能の阻害を用いることにより,ゴルジ体を通過したのちリサイクリングエンドソームをへて細胞膜へと輸送されるタンパク質がつぎつぎと明らかになると期待される.
3.逆行性輸送経路とリサイクリングエンドソーム
初期エンドソームからゴルジ体へといたる輸送経路を逆行性輸送経路(retrograde transport)とよぶ11,12).この輸送経路はエキソサイトーシスとは逆の方向性をもつためこのようによばれている(図2a).この経路の発見は比較的最近であることもあり,逆行性輸送経路により輸送される物質はまだあまり多くは知られていないが,近年,遺伝学的な研究からこの経路の重要性が明らかにされた.Winglessとよばれる形態形成決定タンパク質を細胞の外へと放出するには,Wntlessという受容体が必須である.このWntlessはおもにゴルジ体に局在すること,ゴルジ体と細胞膜とのあいだをつねに行き来していること,さらに,初期エンドソームにおいて逆行性輸送経路を制御するレトロマーとよばれるタンパク質複合体のはたらきを抑制することにより,Wntlessのゴルジ体への局在が損なわれWinglessの放出が失われること,が示されたのである.この分子機構は,さきに述べた細胞膜に局在するタンパク質のリサイクル経路と表裏一体の関係ととらえることができる.すなわち,エキソサイトーシスと逆行性輸送経路との組合せにより,ゴルジ体に局在するタンパク質のリサイクルが保証されているのである13).
レトロマーは初期エンドソームに局在することなどから,逆行性輸送経路は初期エンドソームからゴルジ体へと直接にいたる経路と考えられてきた.しかしながら,近年,逆行性輸送経路により輸送されるいくつかの物質は,初期エンドソームからいちどリサイクリングエンドソームへと輸送され,ついで,ゴルジ体へと輸送されていることが明らかになってきた.コレラ毒素やシガ毒素などのタンパク質性の毒素は逆行性輸送経路を利用して細胞に侵入し,エンドソームを通過してゴルジ体あるいは小胞体,そしてさらに,細胞質へと輸送されることにより毒性を発揮する.リサイクリングエンドソームに局在するタンパク質evectin-2のノックダウンにより,コレラ毒素の輸送がリサイクリングエンドソームにおいて遅延し,ゴルジ体への到達が劇的にさまたげられること,また,逆行性輸送経路を利用してゴルジ体への局在を維持するタンパク質TGN46およびGP73の局在が完全に失われることが示された14).その一方で,リサイクリングエンドソームから細胞膜へともどるトランスフェリンのリサイクル経路には影響は認められなかった.すなわち,evectin-2はリサイクリングエンドソームからゴルジ体へとむかう逆行性輸送経路において特異的な制御タンパク質であることが示されたのである(図2b).
また,evectin-2の作用機構を解析するなかで,低分子量Gタンパク質であるArfのGAP(GTPase activating protein,GTPase活性化タンパク質)であるSMAP2のリサイクリングエンドソームへの局在は,evectin-2に依存していることが見い出された15).SMAP2のノックダウンは,evcetin-2と同様に,コレラ毒素の輸送をリサイクリングエンドソームにおいていちじるしく遅延させたが,トランスフェリンのリサイクル経路には影響を及ぼさなかった.evectin2およびSMAP2によるArfの活性制御により,リサイクルエンドソームからゴルジ体への逆行性輸送経路が制御されていることが示唆された.
このように,近年,エキソサイトーシスや逆行性輸送経路への関与など,古典的なリサイクル経路にとどまらないリサイクリングエンドソームの物質輸送における機能が明らかにされた.逆行性輸送経路においても,ゴルジ体とリサイクリングエンドソームとが核の近縁部に非常に近接して存在しているため,初期エンドソームからゴルジ体へ直接に輸送されていると解釈されている事例が多々あるものと思われる.evectin-2の機能を阻害することなどにより,今後,リサイクリングエンドソームを経由してゴルジ体へと輸送されるタンパク質がつぎつぎと同定されると期待される.
4.リサイクリングエンドソームとホスファチジルセリン
evectin-2は酸性脂質,とくにホスファチジルイノシトールリン酸と高い親和性で結合するPHドメインをN末端にもつ.evectin-2のリサイクリングエンドソームへの局在化の機構を解析するなかで,予期せぬことに,evectin-2のPHドメインはホスファチジルイノシトールリン酸には親和性を示さず,ホスファチジルセリンに特異性をもつことが見い出された14).evectin-2のリサイクリングエンドソームへの局在にはこのPHドメインが必須であったことから,リサイクリングエンドソームにはホスファチジルセリンが豊富に存在することが示唆されたが,これは,ホスファチジルセリンのプローブであるラクトアドヘリンC2ドメインを細胞質に発現させたときにこのプローブがリサイクリングエンドソームに集積することから確認された.
リサイクリングエンドソームを通過する輸送経路におけるホスファチジルセリンの重要性は,リサイクリングエンドソームへのevectin-2の局在において示唆されたが,それとは別に,ホスファチジルセリンの合成能の低下しているCHO細胞の変異株において,逆行性輸送経路を利用してゴルジ体への局在を維持するTGN38の局在が失われており,これは,逆行性輸送経路の特異的な阻害に起因することが示された16).さらに,ホスファチジルセリンの前駆体であるエタノールアミンの培地への添加によりこの異常は回復したことから,ホスファチジルセリンの減少と逆行性輸送経路の阻害との因果関係が明確に示された.
5.リサイクリングエンドソームとラフト脂質
細胞内シグナル伝達の要であり,エキソサイトーシスにより細胞膜へと輸送されることのわかっていたパルミトイル修飾化Ras(H-RasおよびN-Ras)の挙動を解析するなかで,以下のことが見い出された9).1)パルミトイル修飾化Rasはおもにリサイクリングエンドソームおよび細胞膜に局在する.2)Rasのパルミトイル修飾はリサイクリングエンドソームへの局在に必須である.3)パルミトイル修飾化Rasはゴルジ体を通過したのち,細胞膜へと輸送されるまえにリサイクリングエンドソームに滞留する.4)Rasのパルミトイル修飾をうけるC末端の20アミノ酸残基からなるペプチドだけで,リサイクリングエンドソームおよび細胞膜への局在は再現される.4)の結果は,リサイクリングエンドソームの細胞質側を構成する脂質は,パルミトイル基との親和性が高いことを示唆した.パルミトイル基は16炭素鎖の飽和脂肪酸であることから,リサイクリングエンドソームの細胞質側を構成する脂質は飽和度の高い“ラフト様”脂質の性質をもつことが示唆された17).
蛍光性のコレステロールアナログと消光剤を用いて,細胞膜の内外におけるステロールの分布が解析された.その結果,細胞においてコレステロールの集積しているのは細胞膜とリサイクリングエンドソームであり,リサイクリングエンドソームではコレステロールのほとんどは細胞質の側にむいているという結論が得られた18).コレステロールはラフト脂質ドメインを形成する主要な分子であることから,この結果は,さきのRasの局在化の結果と合致するものであった.
スフィンゴミエリンを認識するEquinatoxin IIを細胞の染色に応用することにより,リサイクリングエンドソームがスフィンゴミエリンに非常に富んでいることが示された19).スフィンゴミエリンもコレステロールと同じくラフト脂質ドメインを形成する主要な分子であり,リサイクリングエンドソームの細胞質の側を構成する脂質の環境が飽和度の高い“ラフト様”であることがあらためて示唆された.
近年,特異的なホスファチジルイノシトールリン酸をもつことによりオルガネラの機能が規定される例が明らかにされている.細胞膜のホスファチジルイノシトール4,5-ビスリン酸およびホスファチジルイノシトール3,4,5-トリスリン酸,初期エンドソームのホスファチジルイノシトール3-リン酸,ゴルジ体のホスファチジルイノシトール4-リン酸がその例である.これらのホスファチジルイノシトールリン酸は,細胞質に存在する特異的な結合タンパク質をつうじオルガネラに固有の機能の発現に貢献している20).興味深いことに,リサイクリングエンドソームは初期エンドソームおよびゴルジ体と逆行性輸送経路やエキソサイトーシスにより密接に結びついているのにもかかわらず,ホスファチジルイノシトールリン酸の局在はほとんど報告されていない(図3).その一方で,さきに述べたように,リサイクリングエンドソームはホスファチジルセリンやラフト脂質に富んでいる.未同定のホスファチジルセリンに特異的な結合タンパク質がevectin-2のほかにも存在し,リサイクリングエンドソームの機能の発現に重要なはたらきをもつことが期待される.
6.リサイクリングエンドソームの空間的な配置
さきにも述べたが,多くの細胞においてリサイクリングエンドソームは核の近縁部に存在する.核の近縁部はゴルジ体などほかのオルガネラが入り混じる領域であり,物質の輸送を精密に解析することはむずかしい.リサイクリングエンドソームの解析に適した細胞を探す過程で,アフリカミドリザルの腎臓に由来するCOS-1細胞がリサイクリングエンドソームとほかのオルガネラとの空間的な分離を高く示すことが明らかになった10)(図4).COS-1細胞ではゴルジ体は球形の構造をとり,その内側の空間にリサイクリングエンドソームが,その外部に初期エンドソーム,後期エンドソーム,リソソームが位置していた.共焦点顕微鏡により光学的に切片として観察すると,ゴルジ体はリング状の構造として,そして,その内部にリサイクリングエンドソームが観察された.リサイクリングエンドソームのしめる空間のさらに内側には微小管形成中心(microtubule organizing center:MTOC)が局在していた.
ゴルジ体のかたちづくる構造の内側の空間にさらにオルガネラが存在することは,リサイクリングエンドソームへのアクセスを考えるとたいへん奇異に思えるが,ゴルジ体の層板を貫通する穴が開いていて,そこを通過する微小管を利用することにより細胞質とゴルジ体の内部とのあいだで物質輸送の行われている可能性がある21).リサイクリングエンドソームのしめる空間のさらに内側に微小管形成中心が存在することは,この微小管をつうじた物質輸送の観点から興味深い.
COS-1細胞のみならず,PC12細胞,T細胞,HEK293細胞,単核細胞など,ゴルジ体が球形をとりその内側にリサイクリングエンドソームの配置されている細胞の報告があいついでいる22-24).今後,このような細胞を利用することにより,リサイクリングエンドソームを通過する物質輸送の解析が飛躍的に進歩することが期待される.
おわりに
ここでまとめたように,この10年の研究により,リサイクリングエンドソームはリサイクル経路にかぎらず広範囲な物質輸送にかかわっていることが明らかになってきた.さらに最近になり,刺激的なことに,リサイクリングエンドソームを通過する物質輸送がオートファジーに関与していることも示唆されてきている25-27).リサイクリングエンドソームの機能の本質は,オルガネラに“膜”を供給し,同時に,それらオルガネラに局在するタンパク質をリサイクルすることにより,オルガネラの恒常性を維持することにあるのかもしれない.その意味で,微小管形成中心の近傍につねに位置するリサイクリングエンドソームの局在は,多くの物質輸送が微小管を使っていることを考えると示唆的である.リサイクリングエンドソームは微小管にそって流入してくる小胞に保持された物質を効率よく補捉して選別し,ついで,個々のオルガネラにむけ微小管にそって物質を発送できるという“地の利”がある.また,逆に考えれば,微小管形成中心の近傍に受動的または必然的に,リサイクリングエンドソームのような物質の配送センターが生じてくるのかもしれない.オルガネラの形成という観点からこの問題はたいへん興味深い.
リサイクリングエンドソームの研究はほかのオルガネラの研究に比較するとまだまだ遅れている.その最大の原因は,リサイクリングエンドソームに局在するタンパク質の情報が圧倒的に少ないこと(いまだ生化学的に満足できる精度では単離されていない),そしてそのために,特異的な機能阻害の手法が限定されていることである.COS-1細胞における観察において,evectin-2およびSMAP2とトランスフェリン受容体はともにリサイクリングエンドソームに局在するものの,完全に同一の場所に存在することはなく,リサイクリングエンドソームのなかで異なるドメインに局在していた14,15).実験的に容易であるがため,トランスフェリンの取り込みによりリサイクリングエンドソームの全体の可視化ができていると考えるのは明らかにまちがいであり,これまでの,トランスフェリンと共局在するかどうかでリサイクリングエンドソームの局在性を判定してきた知見は精査する必要がある.今後,ホスファチジルセリンやスフィンゴミエリンなどリサイクリングエンドソームを構成する脂質を利用した可視化ツールを用いて,リサイクリングエンドソームに局在するタンパク質が多く同定され,その個々の機能解析をつうじリサイクリングエンドソームの機能の全貌が明らかになってくるであろう.
文 献
- Mellman, I.: Endocytosis and molecular sorting. Annu. Rev. Cell Dev. Biol., 12, 575-625 (1996)[PubMed]
- Maxfield, F. R. & McGraw, T. E.: Endocytic recycling. Nat. Rev. Mol. Cell Biol., 5, 121-132 (2004)[PubMed]
- Yamashiro, D. J., Tycko, B., Fluss, S. R. et al.: Segregation of transferrin to a mildly acidic (pH 6.5) para-Golgi compartment in the recycling pathway. Cell, 37, 789-800 (1984)[PubMed]
- Leto, D. & Saltiel, A. R.: Regulation of glucose transport by insulin: traffic control of GLUT4. Nat. Rev. Mol. Cell Biol., 13, 383-396 (2012)[PubMed]
- Takata, K., Matsuzaki, T., Tajika, Y. et al.: Localization and trafficking of aquaporin 2 in the kidney. Histochem. Cell Biol., 130, 197-209 (2008)[PubMed]
- Ang, A. L., Taguchi, T., Francis, S. et al.: Recycling endosomes can serve as intermediates during transport from the Golgi to the plasma membrane of MDCK cells. J. Cell Biol., 167, 531-543 (2004)[PubMed]
- Lock, J. G. & Stow, J. L.: Rab11 in recycling endosomes regulates the sorting and basolateral transport of E-cadherin. Mol. Biol. Cell, 16, 1744-1755 (2005)[PubMed]
- Murray, R. Z., Kay, J. G., Sangermani, D. G. et al.: A role for the phagosome in cytokine secretion. Science, 310, 1492-1495 (2005)[PubMed]
- Misaki, R., Morimatsu, M., Uemura, T. et al.: Palmitoylated Ras proteins traffic through recycling endosomes to the plasma membrane during exocytosis. J. Cell Biol., 191, 23-29 (2010)[PubMed]
- Misaki, R., Nakagawa, T., Fukuda, M. et al.: Spatial segregation of degradation- and recycling-trafficking pathways in COS-1 cells. Biochem. Biophys. Res. Commun., 360, 580-585 (2007)[PubMed]
- Bonifacino, J. S. & Rojas, R.: Retrograde transport from endosomes to the trans-Golgi network. Nat. Rev. Mol. Cell Biol., 7, 568-579 (2006)[PubMed]
- Johannes, L. & Popoff, V.: Tracing the retrograde route in protein trafficking. Cell, 135, 1175-1187 (2008)[PubMed]
- Eaton, S.: Retromer retrieves wntless. Dev. Cell, 14, 4-6 (2008)[PubMed]
- Uchida, Y., Hasegawa, J., Chinnapen, D. et al.: Intracellular phosphatidylserine is essential for retrograde membrane traffic through endosomes. Proc. Natl. Acad. Sci. USA, 108, 15846-15851 (2011)[PubMed]
- Matsudaira, T., Uchida, Y., Tanabe, K. et al.: SMAP2 regulates retrograde transport from recycling endosomes to the Golgi. PLoS One, 8, e69145 (2013)[PubMed]
- Lee, S., Uchida, Y., Emoto, K. et al.: Impaired retrograde membrane traffic through endosomes in a mutant CHO cell defective in phosphatidylserine synthesis. Genes Cells, 17, 728-736 (2012)[PubMed]
- Simons, K. & Gerl, M. J.: Revitalizing membrane rafts: new tools and insights. Nat. Rev. Mol. Cell Biol., 11, 688-699 (2010)[PubMed]
- Mondal, M., Mesmin, B., Mukherjee, S. et al.: Sterols are mainly in the cytoplasmic leaflet of the plasma membrane and the endocytic recycling compartment in CHO cells. Mol. Biol. Cell, 20, 581-588 (2009)[PubMed]
- Yachi, R., Uchida, Y., Balakrishna, B. H. et al.: Subcellular localization of sphingomyelin revealed by two toxin-based probes in mammalian cells. Genes Cells, 17, 720-727 (2012)[PubMed]
- Di Paolo, G. & De Camilli, P.: Phosphoinositides in cell regulation and membrane dynamics. Nature, 443, 651-657 (2006)[PubMed]
- Marsh, B. J., Mastronarde, D. N., Buttle, K. F. et al.: Organellar relationships in the Golgi region of the pancreatic beta cell line, HIT-T15, visualized by high resolution electron tomography. Proc. Natl. Acad. Sci. USA, 98, 2399-2406 (2001)[PubMed]
- Finetti, F., Paccani, S. R., Riparbelli, M. G. et al.: Intraflagellar transport is required for polarized recycling of the TCR/CD3 complex to the immune synapse. Nat. Cell Biol., 11, 1332-1339 (2009)[PubMed]
- Husebye, H., Aune, M. H., Stenvik, J. et al.: The Rab11a GTPase controls Toll-like receptor 4-induced activation of interferon regulatory factor-3 on phagosomes. Immunity, 33, 583-596 (2010)[PubMed]
- Greaves, J., Carmichael, J. A. & Chamberlain, L. H.: The palmitoyl transferase DHHC2 targets a dynamic membrane cycling pathway: regulation by a C-terminal domain. Mol. Biol. Cell, 22, 1887-1895 (2011)[PubMed]
- Puri, C., Renna, M., Bento, C. F. et al.: Diverse autophagosome membrane sources coalesce in recycling endosomes. Cell, 154, 1285-1299 (2013)[PubMed]
- Knaevelsrud, H., Soreng, K., Raiborg, C. et al.: Membrane remodeling by the PX-BAR protein SNX18 promotes autophagosome formation. J. Cell Biol., 202, 331-349 (2013)[PubMed]
- Longatti, A., Lamb, C. A., Razi, M. et al.: TBC1D14 regulates autophagosome formation via Rab11- and ULK1-positive recycling endosomes. J. Cell Biol., 197, 659-675 (2012)[PubMed]
- Hieda, M., Isokane, M., Koizumi, M. et al.: Membrane-anchored growth factor, HB-EGF, on the cell surface targeted to the inner nuclear membrane. J. Cell Biol., 180, 763-769 (2008)[PubMed]
著者プロフィール
略歴:1997年 東京大学大学院理学系研究科 修了,理化学研究所 基礎科学特別研究員,米国Yale大学 研究員,大阪大学大学院医学系研究科 特任准教授,オーストラリアQueensland大学 上級研究員を経て,東京大学大学院薬学系研究科 准教授.
研究テーマ:物質のリサイクルを物質の分解と対比しながら理解する.とくに,リサイクリングエンドソームの構造と機能を,細胞生物学な手法および生化学的な手法を使って明らかにしていきたい.
© 2013 田口 友彦 Licensed under CC 表示 2.1 日本