ホスファチジルイノシトール4-リン酸による細胞機能の制御
2016/10/03
中津 史
(新潟大学大学院医歯学系総合研究科 神経生化学)
email:中津 史
領域融合レビュー, 5, e008 (2016) DOI: 10.7875/leading.author.5.e008
Fubito Nakatsu: Role of phosphatidylinositol 4-phosphate in cellular function.

イノシトールリン脂質は生体膜を構成するリン脂質の一種であり,イノシトール環がリン酸化あるいは脱リン酸化されることにより7種類の異なるイノシトールリン脂質が産生される.これらイノシトールリン脂質は細胞膜やオルガネラ膜に独自の特異性にて局在し,シグナル伝達,細胞骨格,メンブレントラフィックなどさまざまな細胞機能に密接に関与する.なかでも,ホスファチジルイノシトール4-リン酸は細胞膜やゴルジ体に豊富に存在し,種々のエフェクタータンパク質をリクルートすることにより膜ダイナミクスを制御したり,ホスファチジルイノシトール4,5-ビスリン酸の前駆体として機能したりする.さらに近年,ホスファチジルイノシトール4-リン酸は小胞体と細胞膜との接触部位あるいは小胞体とゴルジ体との接触部位を介した脂質輸送において必須の役割を担うことが明らかにされた.このレビューにおいては,イノシトールリン脂質のなかでもあまり機能のわかっていなかったホスファチジルイノシトール4-リン酸に着目し,その細胞機能について,とくに膜接触部位を介した脂質輸送の分子実体とその機能にふれつつ,筆者らによる最近の研究の成果をまじえて解説する.
イノシトールリン脂質は生体膜を構成するリン脂質の一種であり,親水基としてイノシトール環をもつ.細胞において生体膜におけるリン脂質の総量にしめる割合は約1割と微量であるが,さまざまな細胞機能をつかさどる重要な脂質である.イノシトールリン脂質の特徴として,細胞質の側に表出したイノシトール環の3位,4位,5位に可逆的にリン酸化あるいは脱リン酸化が起こり,その組合せにより7種類の異なるイノシトールリン脂質が産生されることがあげられる1).これらのイノシトールリン脂質は細胞膜やオルガネラ膜などの生体膜において均一に分布するのではなく,特定の生体膜に濃縮して分布する2).たとえば,ホスファチジルイノシトール4,5-ビスリン酸は細胞膜に,ホスファチジルイノシトール4-リン酸は細胞膜およびゴルジ体に,ホスファチジルイノシトール3-リン酸やホスファチジルイノシトール3,5-ビスリン酸はエンドソーム膜およびリソソーム膜に,それぞれ多く存在する(図1).これは,おのおののイノシトールリン脂質の合成あるいは代謝を制御するキナーゼおよびホスファターゼが特定の生体膜に異なる特異性にて局在することに起因する1,3).
イノシトールリン脂質は生体膜を構成する脂質のひとつとしての役割のほか,いくつかの重要な生理的な役割を担う.古くから知られる機能のひとつは,セカンドメッセンジャーの産生を介したシグナル伝達の制御である.細胞膜に存在するGタンパク質共役受容体が活性化するとホスホリパーゼCによりホスファチジルイノシトール4,5-ビスリン酸がイノシトール1,4,5-トリスリン酸とジアシルグリセロールに分解されセカンドメッセンジャーの産生が促進される4-6).
さらに,イノシトールリン脂質は細胞においておのおのの生体膜の目印としてのランドマーク的な役割も担う.リン酸化部位の異なるイノシトールリン脂質はそれぞれの特異性にしたがい異なる生体膜に分布する.そして,これら異なるイノシトールリン脂質にはそれぞれ特異的に結合するエフェクタータンパク質が存在する.たとえば,ホスファチジルイノシトール4,5-ビスリン酸に結合するPHドメインをもつタンパク質は,細胞膜におけるホスファチジルイノシトール4,5-ビスリン酸の局所的な濃度の上昇にともない細胞膜にリクルートされる.また,ホスファチジルイノシトール3-リン酸に結合するPXドメインやFyveドメインをもつタンパク質は,局所的なホスファチジルイノシトール3-リン酸の濃度の上昇にともないエンドソーム膜に局在する7).このように,おのおののイノシトールリン脂質の異なる局在はエフェクタータンパク質の時空間的に特異的なリクルートを可能にし,さまざまなタンパク質を適切な場所に的確なタイミングでリクルートすることにより種々の生理反応に秩序をもたらす.この特性により,イノシトールリン脂質は細胞の局所におけるシグナル伝達の場やスイッチとして機能したり,輸送小胞の形成や膜ダイナミクスをともなうメンブレントラフィックなどの複雑なカスケードに秩序をもたらしたりする.このように,イノシトールリン脂質は細胞膜やオルガネラ膜にアイデンティティをあたえることにより細胞機能を制御する.
このほかにも,イノシトールリン脂質はほかの脂質の前駆体としての機能をもち,また,細胞内における脂質輸送および脂質ホメオスタシスにおいてきわめて重要な役割を担うことが明らかにされつつある.また,細胞骨格の制御,チャネルの機能の制御,細胞の走化性など,さまざまな生理反応に関与することも明らかにされている.このように,イノシトールリン脂質は細胞機能をささえる重要な因子となっている.
ホスファチジルイノシトール4-リン酸は細胞における存在量のもっとも多いイノシトールリン脂質のひとつであるにもかかわらず,その機能の詳細に関してはいまだに多くの謎が残されている.ホスファチジルイノシトール4-リン酸はホスファチジルイノシトールを基質とし,イノシトール環の4位をリン酸化するPI4キナーゼにより新規に合成される.これまで,出芽酵母においては3種類,哺乳類においては4種類のPI4キナーゼが同定されている8,9)(図2).哺乳類においては,PI4キナーゼは構造および生化学的な特性によりタイプIIとタイプIIIに分類されており,それぞれにαおよびβの2種類が存在する.もともとはタイプIも存在したが,これはのちにイノシトール環の3位をリン酸化するPI3キナーゼであることが判明した.これらのPI4キナーゼはそれぞれが異なる生体膜に局在し,独自の機能を担うことが明らかにされている.
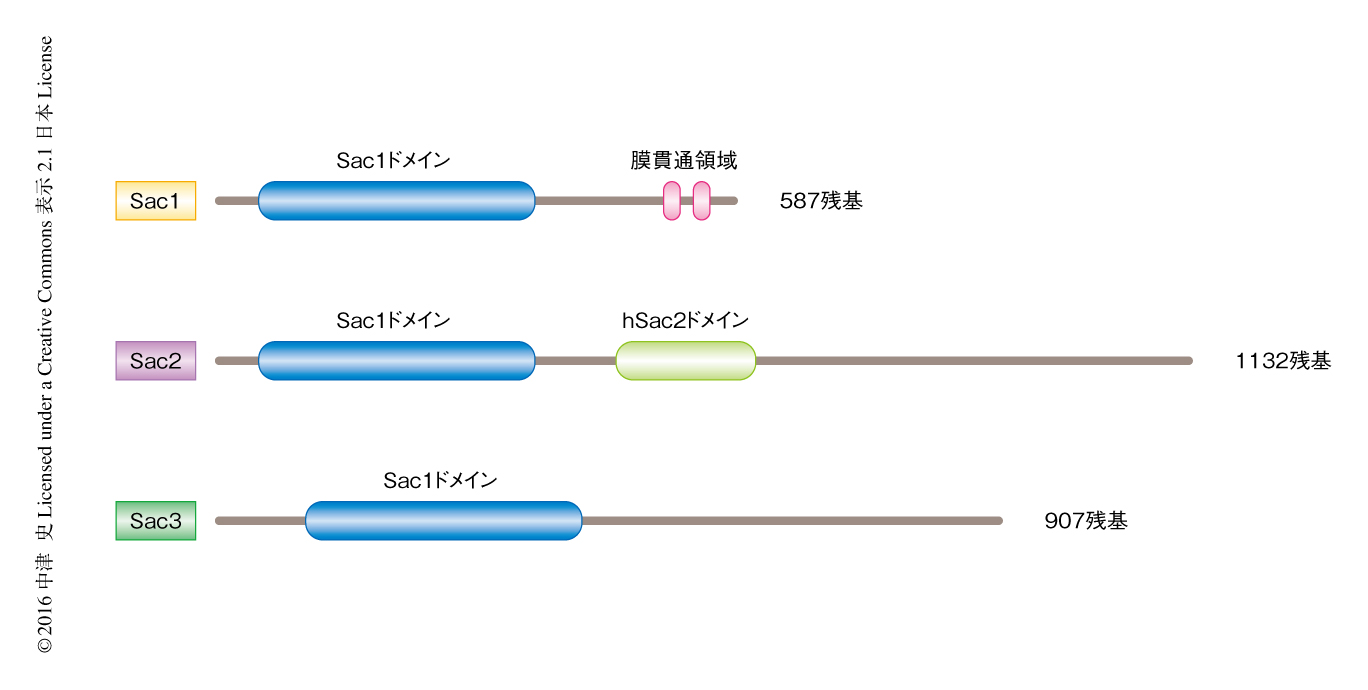
一方,イノシトール環の4位を脱リン酸化するホスファターゼも複数が同定されており,Sac1ドメインを共通してもつ10)(図3).Sac1は小胞体,および,細胞の状態に応じゴルジ体11) に局在する膜タンパク質であり,細胞膜およびゴルジ体において合成されたホスファチジルイノシトール4-リン酸の脱リン酸化を担う.小胞体に局在する膜タンパク質がどのように細胞膜およびゴルジ体のホスファチジルイノシトール4-リン酸を制御するのか,その分子機構は議論の的であったが,Sac1が小胞体と細胞膜との接触部位に局在することによりトランス側の細胞膜に局在するホスファチジルイノシトール4-リン酸を脱リン酸化することが出芽酵母および動物細胞において示された12,13).しかし最近,筆者らを含む複数の研究グループは,Sac1は小胞体と細胞膜との接触部位あるいは小胞体とゴルジ体との接触部位を介して小胞体に輸送されてきたホスファチジルイノシトール4-リン酸を,シス側である小胞体において脱リン酸化することを見い出した14-16).また,小胞体とゴルジ体との接触部位に局在し,オキシステロール結合タンパク質であるOSBPと複合体を形成してゴルジ体のラフト構造の形成に寄与することも示されている17).Sac1ドメインをもつほかのホスファターゼのうち,synaptojanin 18) およびSac2 19) はエンドサイトーシス経路においてホスファチジルイノシトール4-リン酸のホスファターゼとして機能することが知られている.
ゴルジ体はホスファチジルイノシトール4-リン酸が豊富に存在するオルガネラのひとつである.出芽酵母においてはPI4キナーゼであるPik1がゴルジ体におけるホスファチジルイノシトール4-リン酸の産生を担う20,21).pik1欠損株においてはホスファチジルイノシトール4-リン酸の量が50%ほど減少することから,Pik1がゴルジ体において産生するホスファチジルイノシトール4-リン酸は細胞におけるホスファチジルイノシトール4-リン酸の総量の約半分をしめるとされる22,23).また,pik1欠損株は致死となることから,Pik1の機能は細胞膜においてホスファチジルイノシトール4-リン酸の産生を担うStt4とは独立しており,機能的に重複しないと考えられている.Pik1はFrq1に依存してゴルジ体にリクルートされる24).Pik1のゴルジ体へのリクルートはArf1によっても制御される.pik1欠損株においてはゴルジ体の形態の異常,動物細胞のリソソームに相当する液胞の断片化,細胞分裂の異常などが生じる.また,ホスファチジルイノシトール4-リン酸はゴルジ体からの小胞輸送において必須である.
動物細胞においては,Pik1のホモログであるPI4キナーゼIIIβがゴルジ体におけるホスファチジルイノシトール4-リン酸の産生を担う.PI4キナーゼIIαもゴルジ体におけるホスファチジルイノシトール4-リン酸の産生に関与するという報告もある.PI4キナーゼIIIβのゴルジ体への局在には,Pik1と同様に,出芽酵母Frq1のホモログでNCS1ともよばれるfrequeninやArf1が関与すると考えられている25,26).また,PI4キナーゼIIIβの結合タンパク質であるACBD3のノックダウンによりPI4キナーゼIIIβが細胞質に散在したことから,ACBD3もまたPI4キナーゼIIIβのゴルジ体への局在に関与するという報告もある27,28).
ゴルジ体において,ホスファチジルイノシトール4-リン酸は種々のエフェクタータンパク質をリクルートすることによりその機能を制御する.クラスリンのアダプタータンパク質であるAP1は,ホスファチジルイノシトール4-リン酸によりゴルジ体にリクルートされることにより積み荷となるタンパク質の選別およびクラスリン被覆小胞の形成を促進し,ゴルジ体からの小胞輸送を制御する29).GOLPH3もまた,ホスファチジルイノシトール4-リン酸と結合することによりゴルジ体にリクルートされ,アクチン骨格の制御を介してゴルジ体の形態形成に関与する30,31).また,脂質輸送に関与するタンパク質はホスファチジルイノシトール4-リン酸に依存してゴルジ体へと局在することにより機能を発揮する.CERTは小胞体からゴルジ体へのセラミドの輸送を担うタンパク質であるが,CERTのもつPHドメインがゴルジ体においてホスファチジルイノシトール4-リン酸を特異的に認識して結合することにより,ゴルジ体へのセラミドの輸送を制御する32).そのほか,FAPP1およびFAPP2はグリコスフィンゴ脂質の輸送を担うが,やはり,それぞれのもつPHドメインがゴルジ体においてホスファチジルイノシトール4-リン酸を認識することによりその輸送を制御する.さらに,オキシステロール結合タンパク質であるOSBPもやはりPHドメインをもち,ゴルジ体においてホスファチジルイノシトール4-リン酸を認識することによりゴルジ体へと局在する.このOSBPは小胞体とゴルジ体との膜接触部位に局在し,小胞体からコレステロールを輸送すると同時に,ゴルジ体からホスファチジルイノシトール4-リン酸を輸送する.
細胞膜はゴルジ体とならんでホスファチジルイノシトール4-リン酸の豊富に存在する生体膜である.出芽酵母において細胞膜におけるホスファチジルイノシトール4-リン酸の産生はStt4が担う.Stt4はプロテインキナーゼCの阻害剤であるstaurosporineに感受性を示す変異体のスクリーニングにより単離された33).Stt4はEfr3およびYpp1と複合体を形成することにより細胞膜に局在しホスファチジルイノシトール4-リン酸を産生する34).stt4遺伝子の温度感受性変異を抑圧する遺伝子の産物として単離された膜貫通型の細胞膜タンパク質であるSfk1もまた,Stt4の細胞膜へのリクルートに関与することが報告されている35).遺伝学的,細胞生物学的,生化学的な解析により,Stt4は細胞膜におけるホスファチジルイノシトール4-リン酸の産生において必須であることが判明している23).stt4欠損株においては細胞におけるホスファチジルイノシトール4-リン酸の総量が半減し致死となる.これは,ゴルジ体においてホスファチジルイノシトール4-リン酸を産生するPik1の強制発現によりレスキューされないことから,Stt4とPik1は同じPI4キナーゼでありながら機能的には重複せず独立していること,そして,細胞膜とゴルジ体のホスファチジルイノシトール4-リン酸プールは異なることが示された23).stt4遺伝子の温度感受性変異株はプロテインキナーゼCシグナル伝達系,アクチン骨格,細胞壁など細胞膜におけるホスファチジルイノシトール4,5-ビスリン酸の生理機能に密接した機能に異常を示すことから,Stt4により産生されるホスファチジルイノシトール4-リン酸はホスファチジルイノシトール4,5-ビスリン酸の前駆体としての役割を担うことが明らかにされている.しかしながら,stt4遺伝子の温度感受性変異株においては液胞の形態に異常がみられることから,細胞膜に存在するホスファチジルイノシトール4,5-ビスリン酸とはいっけんして直接の関係のない生体膜における機能の存在も示唆されている.
動物細胞においてはPI4キナーゼIIIαがStt4のホモログとして機能する.PI4キナーゼIIIαをコードするcDNAのクローニングは1996年に報告された36).PI4キナーゼIIIαはアミノ酸配列の相同性から機能的にもStt4と同様に細胞膜におけるホスファチジルイノシトール4-リン酸の産生を介した生理機能を担うと予想された.事実,アンギオテンシンII受容体への刺激ののちホスファチジルイノシトール4,5-ビスリン酸が再合成され,その供給源として必要なホスファチジルイノシトール4-リン酸の産生にPI4キナーゼIIIαが関与することが報告されたが37,38),詳細な機能解析は遅々として進まなかった.その理由のひとつに,PI4キナーゼIIIαの局在がながらく不明であることがあった.それまで,PI4キナーゼIIIαの細胞膜への局在を示すデータは得られておらず,代わりに,小胞体,ゴルジ体,核に局在するなど諸説が提唱されていた8).
2012年,それまで開始コドンであると信じられていたMetをコードするコドンがじつは開始コドンではなく,全長のcDNAとされていた配列にはN末端側の59アミノ酸残基をコードする配列が欠けていることが判明した39).さらに,新たなPI4キナーゼIIIα結合タンパク質としてEFR3A/BおよびTTC7A/Bが同定され,全長のPI4KIIIαはこれらのタンパク質と複合体を形成することにより細胞膜に局在することが示された.PI4キナーゼIIIαをノックアウトした細胞において,クラスリン被覆小胞の形成の異常やアクチン骨格の形成の異常など細胞膜におけるホスファチジルイノシトール4,5-ビスリン酸の欠損にともなう異常がみられたことから,PI4キナーゼIIIαは細胞膜に存在するホスファチジルイノシトール4,5-ビスリン酸の前駆体であるホスファチジルイノシトール4-リン酸の産生に必須であることが示された.また,PI4キナーゼIIIαをノックアウトした細胞においては細胞膜におけるコレステロールの減少や細胞膜に局在するタンパク質の異所的な局在化が生じたことから,PI4キナーゼIIIαにより産生されるホスファチジルイノシトール4-リン酸は細胞膜のアイデンティティの確立に重要な役割を担うことが明らかにされた39).さらに,Stt4の細胞膜へのリクルートを促進するSfk1のホモログであるTMEM150AがやはりPI4キナーゼIIIαと結合し細胞膜におけるホスファチジルイノシトール4-リン酸の産生に寄与すること40),そして,新たなPI4キナーゼIIIαの結合タンパク質としてFMA126A/Bが単離され41),PI4キナーゼIIIαはEFR3A/B,TTC7A/B,TMEM150A,FAM126A/Bと複合体を形成することが判明した.FAM126A(別名:Hyccin)は神経の脱髄を生じる遺伝性の疾患である白質ジストロフィーの原因遺伝子の産物であり,PI4キナーゼIIIα複合体を介した細胞膜におけるホスファチジルイノシトール4-リン酸の産生がミエリンの形成において重要な役割を担うことが明らかにされた41).このほか,細胞膜に存在するホスファチジルイノシトール4-リン酸はホスファチジルイノシトール4,5-ビスリン酸とともに細胞膜における負電荷の形成に寄与し,種々のタンパク質の細胞膜へのリクルートやチャネルの機能の制御に関与することも報告された42).
これまで,細胞膜に存在するホスファチジルイノシトール4-リン酸はホスファチジルイノシトール4,5-ビスリン酸の前駆体としての役割がおもな機能であると考えられてきた.しかしながら近年になり,ホスファチジルイノシトール4-リン酸は細胞内における脂質輸送の制御をつうじ,細胞における脂質ホメオスタシスの制御にきわめて深い関連をもつことが徐々に明らかにされつつある.細胞内における脂質輸送には,メンブレントラフィックにより制御される小胞輸送に依存的な経路のほか,小胞輸送に非依存的な経路が存在し,これは脂質輸送タンパク質(lipid transfer protein)と総称される一連のタンパク質により制御される.脂質輸送タンパク質は脂質と結合するリガンド結合ドメインをもち,それが疎水性ポケットとして機能することにより特定の脂質を囲い込み,脂質を保持することができる.この特性により,脂質輸送タンパク質は一方の生体膜から脂質を抽出し,その脂質を別の生体膜へと輸送することにより,異なる生体膜のあいだの脂質輸送を媒介することができる.
オキシステロール結合タンパク質ファミリーは脂質輸送タンパク質のなかでも比較的大きなファミリーを構成し,酵母からヒトにいたるまで保存されている43).そのプロトタイプであるOSBPはオキシステロールに結合するタンパク質として1984年に同定された.これをきっかけに多数のホモログの存在が判明し,現在では,出芽酵母において7種,ヒトにおいて12種のオキシステロール結合タンパク質ファミリーのメンバーの存在が確認されている44).オキシステロール結合タンパク質ファミリーには共通してリガンド結合ドメインが存在し,このドメインが疎水性ポケットとして機能することにより特定の脂質を囲い込む45).当初は,すべてのオキシステロール結合タンパク質ファミリーのもつリガンド結合ドメインは共通してステロール(出芽酵母においてはエルゴステロール,動物細胞においてはオキシステロールおよびコレステロール)が囲い込まれると考えられていたが,最近では,ホスファチジルイノシトール4-リン酸やホスファチジルセリンと特異的に結合するリガンド結合ドメインの存在も判明している.さらに,オキシステロール結合タンパク質ファミリーには細胞内における局在を規定するドメインやモチーフがいくつか存在し,なかでも,FFATモチーフとよばれる配列が多く存在する.FFATモチーフは小胞体膜タンパク質であるVAP-AおよびVAP-BのもつMSPドメインと結合し,これによりオキシステロール結合タンパク質ファミリーは小胞体膜に繋留される.また,ほぼすべてのオキシステロール結合タンパク質ファミリーにはPHドメインが存在し,脂質を輸送すべき生体膜の認識やそれ自体の局在においてきわめて重要な役割を担う.
このような構造における特徴から,オキシステロール結合タンパク質ファミリーは機能的にはステロールの脂質の輸送や脂質ホメオスタシスの制御に関与すると予想されていた.事実,組換えタンパク質として発現し精製したリガンド結合ドメインをin vitroにおいてリポソームと混合すると,一方のリポソームから他方のリポソームへのコレステロールの輸送活性が認められたことから,オキシステロール結合タンパク質ファミリーはコレステロールなどの脂質の輸送に関与する可能性が示唆された.他方,出芽酵母を用いた解析においては,ステロールの輸送ではなく脂質ホメオスタシスに関与するという報告やシグナル伝達に関与するという報告がなされ,細胞レベルにおける詳細な機能の解析は遅れていた.
出芽酵母におけるオキシステロール結合タンパク質ファミリーのメンバーであるOsh4は,以前より,in vitroにおけるリポソームを用いたアッセイにおいてステロールを一方のリポソームから他方のリポソームへと輸送する活性をもつことが知られていた45).2011年,類似のin vitro脂質輸送アッセイ系を用いて,Osh4によるステロールの輸送活性がホスファチジルイノシトール4-リン酸により特異的に阻害されること,そして,このホスファチジルイノシトール4-リン酸によるステロールの輸送の阻害はホスファチジルイノシトール4-リン酸がOsh4のリガンド結合ドメインに入り込むことによる拮抗阻害であることが見い出された46).つまり,Osh4のリガンド結合ドメインはステロールだけでなくホスファチジルイノシトール4-リン酸もリガンドとすることが示唆され,実際に,Osh4はin vitroにおいてホスファチジルイノシトール4-リン酸を輸送する活性ももつことが示された.このホスファチジルイノシトール4-リン酸がOsh4の新たなリガンドであるというアイディアは,リガンド結合ドメインとホスファチジルイノシトール4-リン酸との共結晶のX線結晶構造解析により証明された46).Osh4のリガンド結合ドメインにはステロールとホスファチジルイノシトール4-リン酸のどちらも結合が可能であるが,どちらか一方のみが入り込む空間しか存在しないことも判明した.これらのデータをもとに,Osh4はステロールとホスファチジルイノシトール4-リン酸を交換輸送するのではないかと提唱され,この仮説は,その2年後,同じ研究グループにより動物細胞を用いて証明された.
2013年,Osh4の哺乳類におけるホモログであるOSBPが,ゴルジ体に存在するホスファチジルイノシトール4-リン酸とのPHドメインによる結合,および,小胞体膜タンパク質であるVAPとのFFATモチーフを介した結合によりゴルジ体と小胞体との接触部位に局在し,小胞体おいて合成されたコレステロールをゴルジ体へと輸送すると同時に,ゴルジ体に豊富に存在するホスファチジルイノシトール4-リン酸を小胞体へと逆輸送することが証明された14).この輸送の形式は交換輸送であり,輸送される脂質の方向性は一定であった.つまり,コレステロールは小胞体からゴルジ体へ,ホスファチジルイノシトール4-リン酸はゴルジ体から小胞体へと輸送されていた.
細胞膜もホスファチジルイノシトール4-リン酸が豊富な生体膜であるが,ここでもホスファチジルイノシトール4-リン酸が脂質の輸送に重要な役割を担うことが明らかにされた.ORP5およびORP8はほかのオキシステロール結合タンパク質ファミリーのメンバーとは異なり膜貫通領域をもち,小胞体に局在する43).ORP5は小胞体とリソソームとの接触部位においてNPC1と結合することによりコレステロールの代謝および輸送に関与することが報告されていたが47),ORP8の機能についてはほとんど知られていなかった.一方で,ORP5およびORP8と比較的相同性の高いOsh6およびOsh7はステロールではなくホスファチジルセリンの輸送をつかさどるという報告もなされており48),動物細胞におけるORP5あるいはORP8の機能はその局在も含め解明されていなかった.
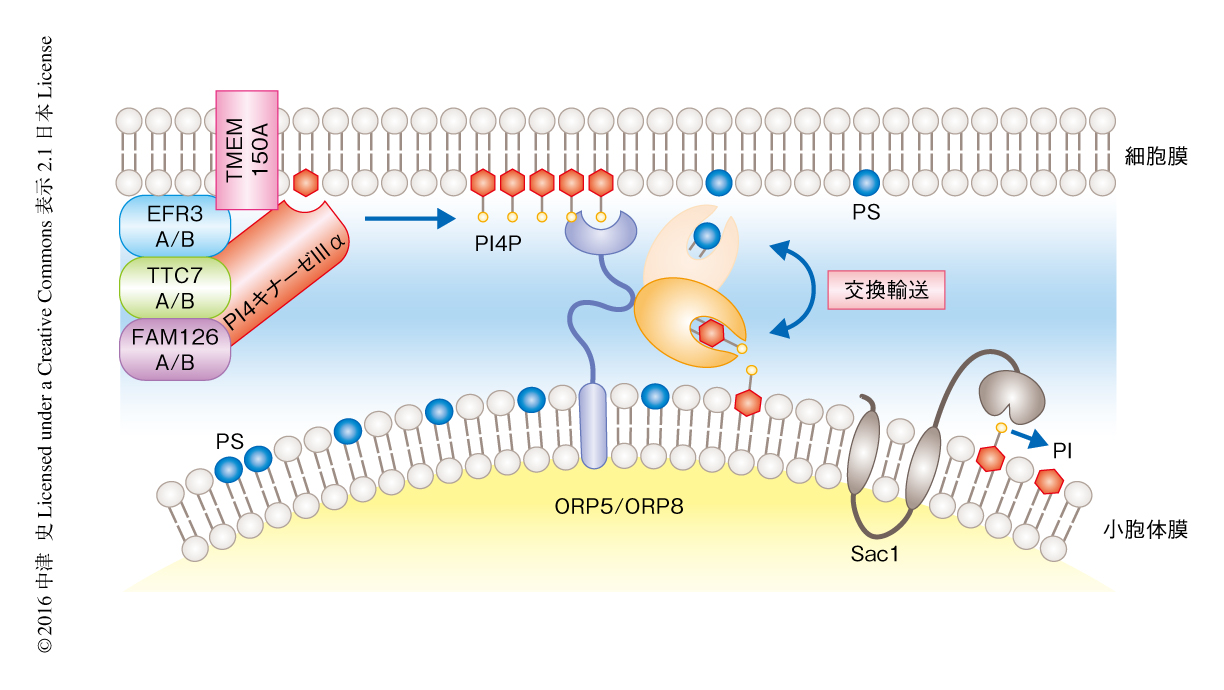
ORP5およびORP8はHeLa細胞において小胞体と細胞膜との接触部位に局在し,この局在は,N末端側に存在するPHドメインによる細胞膜に存在するホスファチジルイノシトール4-リン酸の認識によるものであることが明らかにされた.機能を知るうえで,ORP5あるいはORP8のリガンドとなる脂質の同定は欠かせない.そこで,ORP5のリガンド結合ドメインを動物細胞に発現させたのち精製し,質量分析法により結合している脂質の同定を試みたところ,ホスファチジルイノシトール4-リン酸およびホスファチジルセリンが生理的なリガンドとして同定された.これは,ORP5およびORP8に比較的相同性の高いOsh6およびOsh7がステロールではなくホスファチジルセリンをリガンドとするという報告48) と一致した.in vitroにおけるリポソーム脂質輸送アッセイおよび培養細胞を用いた機能解析により,ORP5およびORP8はホスファチジルイノシトール4-リン酸とホスファチジルセリンの交換輸送を媒介することが判明した16).すなわち,ORP5およびORP8は,1)細胞膜に存在するホスファチジルイノシトール4-リン酸とのPHドメインによる結合を介して小胞体と細胞膜をつなぎとめ膜接触部位を形成し,2)PI4キナーゼIIIαにより産生されたホスファチジルイノシトール4-リン酸を細胞膜からそれ自体のもつリガンド結合ドメインへと囲い込み,3)ホスファチジルイノシトール4-リン酸を小胞体へと輸送する.つづいて,4)小胞体において合成されたホスファチジルセリンと結合し,5)ホスファチジルセリンを細胞膜へと逆輸送する(図4).このように,ホスファチジルイノシトール4-リン酸が細胞膜から小胞体へと輸送されることにより,ホスファチジルセリンの小胞体から細胞膜への輸送が成立する.すなわち,ORP5およびORP8によるホスファチジルセリンの輸送はホスファチジルイノシトール4-リン酸が駆動していたのである.
それでは,この脂質輸送の方向性はどのような分子機構により説明されるのだろうか? それにはホスファチジルイノシトール4-リン酸が重要な鍵をにぎっている.ホスファチジルイノシトール4-リン酸は細胞膜およびゴルジ体に豊富に存在する.これは,細胞膜に局在するPI4キナーゼIIIα,および,ゴルジ体に局在するPI4キナーゼIIIβの作用による.一方で,小胞体にはホスファチジルイノシトール4-リン酸はほとんど存在しない.それは,小胞体に局在するホスファチジルイノシトール4-リン酸のホスファターゼであるSac1の作用による.つまり,細胞膜およびゴルジ体と小胞体とのあいだにはホスファチジルイノシトール4-リン酸の濃度勾配が存在するため,ホスファチジルイノシトール4-リン酸は高濃度である細胞膜およびゴルジ体から低濃度である小胞体へと一方向に輸送される.これが,ホスファチジルセリンやコレステロールの逆輸送,つまり,小胞体から細胞膜およびゴルジ体への輸送を規定する,というモデルである.このモデルは,細胞膜で合成されたホスファチジルイノシトール4-リン酸がなぜ小胞体で代謝されるのかという別の問題も説明しうる.すなわち,ホスファチジルイノシトール4-リン酸が細胞膜から小胞体へと輸送される力が,別の脂質の逆輸送に利用されているからである.
ホスファチジルイノシトール4-リン酸は動物細胞においてもっとも多いイノシトールリン脂質のひとつであり,ゴルジ体や細胞膜,そして,エンドサイトーシス経路を構成するオルガネラ膜においては,メンブレントラフィックの制御に欠かせないイノシトールリン脂質として知られていた.しかしながら,それ以外のホスファチジルイノシトール4-リン酸のもつ本来の機能についてはほとんどわかっていなかった.とくに,細胞膜においては単純にホスファチジルイノシトール4,5-ビスリン酸の前駆体としての存在意義のみが明確な機能として認識されていた.そのような背景のもと,ホスファチジルイノシトール4-リン酸はオキシステロール結合タンパク質ファミリーによる膜接触部位を介した脂質の交換輸送に必須の役割を担うことが明らかにされた.このホスファチジルイノシトール4-リン酸により駆動される脂質の交換輸送の分子機構や生理的な意義についてはまだまだ不明な点が多い.しかし最近,ホスファチジルセリンの代謝異常を呈するLenz-Majewski症候群において,オキシステロール結合タンパク質ファミリーを介したホスファチジルイノシトール4-リン酸とホスファチジルセリンの交換輸送が関与する可能性が示唆された49).さらに,細胞膜やゴルジ体だけでなく,エンドソームと小胞体との接触部位においてもホスファチジルイノシトール4-リン酸の関与する膜ダイナミクスの制御機構が明らかにされつつある50).そして,オキシステロール結合タンパク質ファミリーのほかにも膜接触部位を介した脂質輸送を制御するタンパク質が多く存在することも明らかにされている.今後のさらなる解析により,ホスファチジルイノシトール4-リン酸による膜ダイナミクスの制御や膜接触部位を介したたくみな脂質輸送のしくみ,それらの生理機能がより一層解明されることを期待したい.
略歴:2001年 千葉大学大学院医学研究科 修了,同年 金沢大学がん研究所 博士研究員,2002年 理化学研究所 研究員,2006年 米国Yale大学School of Medicine研究員を経て,2014年より新潟大学大学院医歯学総合研究科 准教授.
研究テーマ:イノシトールリン脂質による膜ダイナミクスの制御機構を中心に,最近は,オルガネラの膜接触部位の生物学に興味をもっている.
© 2016 中津 史 Licensed under CC 表示 2.1 日本
(新潟大学大学院医歯学系総合研究科 神経生化学)
email:中津 史
領域融合レビュー, 5, e008 (2016) DOI: 10.7875/leading.author.5.e008
Fubito Nakatsu: Role of phosphatidylinositol 4-phosphate in cellular function.
要 約
イノシトールリン脂質は生体膜を構成するリン脂質の一種であり,イノシトール環がリン酸化あるいは脱リン酸化されることにより7種類の異なるイノシトールリン脂質が産生される.これらイノシトールリン脂質は細胞膜やオルガネラ膜に独自の特異性にて局在し,シグナル伝達,細胞骨格,メンブレントラフィックなどさまざまな細胞機能に密接に関与する.なかでも,ホスファチジルイノシトール4-リン酸は細胞膜やゴルジ体に豊富に存在し,種々のエフェクタータンパク質をリクルートすることにより膜ダイナミクスを制御したり,ホスファチジルイノシトール4,5-ビスリン酸の前駆体として機能したりする.さらに近年,ホスファチジルイノシトール4-リン酸は小胞体と細胞膜との接触部位あるいは小胞体とゴルジ体との接触部位を介した脂質輸送において必須の役割を担うことが明らかにされた.このレビューにおいては,イノシトールリン脂質のなかでもあまり機能のわかっていなかったホスファチジルイノシトール4-リン酸に着目し,その細胞機能について,とくに膜接触部位を介した脂質輸送の分子実体とその機能にふれつつ,筆者らによる最近の研究の成果をまじえて解説する.
はじめに
イノシトールリン脂質は生体膜を構成するリン脂質の一種であり,親水基としてイノシトール環をもつ.細胞において生体膜におけるリン脂質の総量にしめる割合は約1割と微量であるが,さまざまな細胞機能をつかさどる重要な脂質である.イノシトールリン脂質の特徴として,細胞質の側に表出したイノシトール環の3位,4位,5位に可逆的にリン酸化あるいは脱リン酸化が起こり,その組合せにより7種類の異なるイノシトールリン脂質が産生されることがあげられる1).これらのイノシトールリン脂質は細胞膜やオルガネラ膜などの生体膜において均一に分布するのではなく,特定の生体膜に濃縮して分布する2).たとえば,ホスファチジルイノシトール4,5-ビスリン酸は細胞膜に,ホスファチジルイノシトール4-リン酸は細胞膜およびゴルジ体に,ホスファチジルイノシトール3-リン酸やホスファチジルイノシトール3,5-ビスリン酸はエンドソーム膜およびリソソーム膜に,それぞれ多く存在する(図1).これは,おのおののイノシトールリン脂質の合成あるいは代謝を制御するキナーゼおよびホスファターゼが特定の生体膜に異なる特異性にて局在することに起因する1,3).
1.細胞機能を制御するイノシトールリン脂質
イノシトールリン脂質は生体膜を構成する脂質のひとつとしての役割のほか,いくつかの重要な生理的な役割を担う.古くから知られる機能のひとつは,セカンドメッセンジャーの産生を介したシグナル伝達の制御である.細胞膜に存在するGタンパク質共役受容体が活性化するとホスホリパーゼCによりホスファチジルイノシトール4,5-ビスリン酸がイノシトール1,4,5-トリスリン酸とジアシルグリセロールに分解されセカンドメッセンジャーの産生が促進される4-6).
さらに,イノシトールリン脂質は細胞においておのおのの生体膜の目印としてのランドマーク的な役割も担う.リン酸化部位の異なるイノシトールリン脂質はそれぞれの特異性にしたがい異なる生体膜に分布する.そして,これら異なるイノシトールリン脂質にはそれぞれ特異的に結合するエフェクタータンパク質が存在する.たとえば,ホスファチジルイノシトール4,5-ビスリン酸に結合するPHドメインをもつタンパク質は,細胞膜におけるホスファチジルイノシトール4,5-ビスリン酸の局所的な濃度の上昇にともない細胞膜にリクルートされる.また,ホスファチジルイノシトール3-リン酸に結合するPXドメインやFyveドメインをもつタンパク質は,局所的なホスファチジルイノシトール3-リン酸の濃度の上昇にともないエンドソーム膜に局在する7).このように,おのおののイノシトールリン脂質の異なる局在はエフェクタータンパク質の時空間的に特異的なリクルートを可能にし,さまざまなタンパク質を適切な場所に的確なタイミングでリクルートすることにより種々の生理反応に秩序をもたらす.この特性により,イノシトールリン脂質は細胞の局所におけるシグナル伝達の場やスイッチとして機能したり,輸送小胞の形成や膜ダイナミクスをともなうメンブレントラフィックなどの複雑なカスケードに秩序をもたらしたりする.このように,イノシトールリン脂質は細胞膜やオルガネラ膜にアイデンティティをあたえることにより細胞機能を制御する.
このほかにも,イノシトールリン脂質はほかの脂質の前駆体としての機能をもち,また,細胞内における脂質輸送および脂質ホメオスタシスにおいてきわめて重要な役割を担うことが明らかにされつつある.また,細胞骨格の制御,チャネルの機能の制御,細胞の走化性など,さまざまな生理反応に関与することも明らかにされている.このように,イノシトールリン脂質は細胞機能をささえる重要な因子となっている.
2.さまざまな生体膜ダイナミクスを制御するホスファチジルイノシトール4-リン酸
ホスファチジルイノシトール4-リン酸は細胞における存在量のもっとも多いイノシトールリン脂質のひとつであるにもかかわらず,その機能の詳細に関してはいまだに多くの謎が残されている.ホスファチジルイノシトール4-リン酸はホスファチジルイノシトールを基質とし,イノシトール環の4位をリン酸化するPI4キナーゼにより新規に合成される.これまで,出芽酵母においては3種類,哺乳類においては4種類のPI4キナーゼが同定されている8,9)(図2).哺乳類においては,PI4キナーゼは構造および生化学的な特性によりタイプIIとタイプIIIに分類されており,それぞれにαおよびβの2種類が存在する.もともとはタイプIも存在したが,これはのちにイノシトール環の3位をリン酸化するPI3キナーゼであることが判明した.これらのPI4キナーゼはそれぞれが異なる生体膜に局在し,独自の機能を担うことが明らかにされている.
一方,イノシトール環の4位を脱リン酸化するホスファターゼも複数が同定されており,Sac1ドメインを共通してもつ10)(図3).Sac1は小胞体,および,細胞の状態に応じゴルジ体11) に局在する膜タンパク質であり,細胞膜およびゴルジ体において合成されたホスファチジルイノシトール4-リン酸の脱リン酸化を担う.小胞体に局在する膜タンパク質がどのように細胞膜およびゴルジ体のホスファチジルイノシトール4-リン酸を制御するのか,その分子機構は議論の的であったが,Sac1が小胞体と細胞膜との接触部位に局在することによりトランス側の細胞膜に局在するホスファチジルイノシトール4-リン酸を脱リン酸化することが出芽酵母および動物細胞において示された12,13).しかし最近,筆者らを含む複数の研究グループは,Sac1は小胞体と細胞膜との接触部位あるいは小胞体とゴルジ体との接触部位を介して小胞体に輸送されてきたホスファチジルイノシトール4-リン酸を,シス側である小胞体において脱リン酸化することを見い出した14-16).また,小胞体とゴルジ体との接触部位に局在し,オキシステロール結合タンパク質であるOSBPと複合体を形成してゴルジ体のラフト構造の形成に寄与することも示されている17).Sac1ドメインをもつほかのホスファターゼのうち,synaptojanin 18) およびSac2 19) はエンドサイトーシス経路においてホスファチジルイノシトール4-リン酸のホスファターゼとして機能することが知られている.
3.ゴルジ体に存在するホスファチジルイノシトール4-リン酸
ゴルジ体はホスファチジルイノシトール4-リン酸が豊富に存在するオルガネラのひとつである.出芽酵母においてはPI4キナーゼであるPik1がゴルジ体におけるホスファチジルイノシトール4-リン酸の産生を担う20,21).pik1欠損株においてはホスファチジルイノシトール4-リン酸の量が50%ほど減少することから,Pik1がゴルジ体において産生するホスファチジルイノシトール4-リン酸は細胞におけるホスファチジルイノシトール4-リン酸の総量の約半分をしめるとされる22,23).また,pik1欠損株は致死となることから,Pik1の機能は細胞膜においてホスファチジルイノシトール4-リン酸の産生を担うStt4とは独立しており,機能的に重複しないと考えられている.Pik1はFrq1に依存してゴルジ体にリクルートされる24).Pik1のゴルジ体へのリクルートはArf1によっても制御される.pik1欠損株においてはゴルジ体の形態の異常,動物細胞のリソソームに相当する液胞の断片化,細胞分裂の異常などが生じる.また,ホスファチジルイノシトール4-リン酸はゴルジ体からの小胞輸送において必須である.
動物細胞においては,Pik1のホモログであるPI4キナーゼIIIβがゴルジ体におけるホスファチジルイノシトール4-リン酸の産生を担う.PI4キナーゼIIαもゴルジ体におけるホスファチジルイノシトール4-リン酸の産生に関与するという報告もある.PI4キナーゼIIIβのゴルジ体への局在には,Pik1と同様に,出芽酵母Frq1のホモログでNCS1ともよばれるfrequeninやArf1が関与すると考えられている25,26).また,PI4キナーゼIIIβの結合タンパク質であるACBD3のノックダウンによりPI4キナーゼIIIβが細胞質に散在したことから,ACBD3もまたPI4キナーゼIIIβのゴルジ体への局在に関与するという報告もある27,28).
ゴルジ体において,ホスファチジルイノシトール4-リン酸は種々のエフェクタータンパク質をリクルートすることによりその機能を制御する.クラスリンのアダプタータンパク質であるAP1は,ホスファチジルイノシトール4-リン酸によりゴルジ体にリクルートされることにより積み荷となるタンパク質の選別およびクラスリン被覆小胞の形成を促進し,ゴルジ体からの小胞輸送を制御する29).GOLPH3もまた,ホスファチジルイノシトール4-リン酸と結合することによりゴルジ体にリクルートされ,アクチン骨格の制御を介してゴルジ体の形態形成に関与する30,31).また,脂質輸送に関与するタンパク質はホスファチジルイノシトール4-リン酸に依存してゴルジ体へと局在することにより機能を発揮する.CERTは小胞体からゴルジ体へのセラミドの輸送を担うタンパク質であるが,CERTのもつPHドメインがゴルジ体においてホスファチジルイノシトール4-リン酸を特異的に認識して結合することにより,ゴルジ体へのセラミドの輸送を制御する32).そのほか,FAPP1およびFAPP2はグリコスフィンゴ脂質の輸送を担うが,やはり,それぞれのもつPHドメインがゴルジ体においてホスファチジルイノシトール4-リン酸を認識することによりその輸送を制御する.さらに,オキシステロール結合タンパク質であるOSBPもやはりPHドメインをもち,ゴルジ体においてホスファチジルイノシトール4-リン酸を認識することによりゴルジ体へと局在する.このOSBPは小胞体とゴルジ体との膜接触部位に局在し,小胞体からコレステロールを輸送すると同時に,ゴルジ体からホスファチジルイノシトール4-リン酸を輸送する.
4.細胞膜に存在するホスファチジルイノシトール4-リン酸
細胞膜はゴルジ体とならんでホスファチジルイノシトール4-リン酸の豊富に存在する生体膜である.出芽酵母において細胞膜におけるホスファチジルイノシトール4-リン酸の産生はStt4が担う.Stt4はプロテインキナーゼCの阻害剤であるstaurosporineに感受性を示す変異体のスクリーニングにより単離された33).Stt4はEfr3およびYpp1と複合体を形成することにより細胞膜に局在しホスファチジルイノシトール4-リン酸を産生する34).stt4遺伝子の温度感受性変異を抑圧する遺伝子の産物として単離された膜貫通型の細胞膜タンパク質であるSfk1もまた,Stt4の細胞膜へのリクルートに関与することが報告されている35).遺伝学的,細胞生物学的,生化学的な解析により,Stt4は細胞膜におけるホスファチジルイノシトール4-リン酸の産生において必須であることが判明している23).stt4欠損株においては細胞におけるホスファチジルイノシトール4-リン酸の総量が半減し致死となる.これは,ゴルジ体においてホスファチジルイノシトール4-リン酸を産生するPik1の強制発現によりレスキューされないことから,Stt4とPik1は同じPI4キナーゼでありながら機能的には重複せず独立していること,そして,細胞膜とゴルジ体のホスファチジルイノシトール4-リン酸プールは異なることが示された23).stt4遺伝子の温度感受性変異株はプロテインキナーゼCシグナル伝達系,アクチン骨格,細胞壁など細胞膜におけるホスファチジルイノシトール4,5-ビスリン酸の生理機能に密接した機能に異常を示すことから,Stt4により産生されるホスファチジルイノシトール4-リン酸はホスファチジルイノシトール4,5-ビスリン酸の前駆体としての役割を担うことが明らかにされている.しかしながら,stt4遺伝子の温度感受性変異株においては液胞の形態に異常がみられることから,細胞膜に存在するホスファチジルイノシトール4,5-ビスリン酸とはいっけんして直接の関係のない生体膜における機能の存在も示唆されている.
動物細胞においてはPI4キナーゼIIIαがStt4のホモログとして機能する.PI4キナーゼIIIαをコードするcDNAのクローニングは1996年に報告された36).PI4キナーゼIIIαはアミノ酸配列の相同性から機能的にもStt4と同様に細胞膜におけるホスファチジルイノシトール4-リン酸の産生を介した生理機能を担うと予想された.事実,アンギオテンシンII受容体への刺激ののちホスファチジルイノシトール4,5-ビスリン酸が再合成され,その供給源として必要なホスファチジルイノシトール4-リン酸の産生にPI4キナーゼIIIαが関与することが報告されたが37,38),詳細な機能解析は遅々として進まなかった.その理由のひとつに,PI4キナーゼIIIαの局在がながらく不明であることがあった.それまで,PI4キナーゼIIIαの細胞膜への局在を示すデータは得られておらず,代わりに,小胞体,ゴルジ体,核に局在するなど諸説が提唱されていた8).
2012年,それまで開始コドンであると信じられていたMetをコードするコドンがじつは開始コドンではなく,全長のcDNAとされていた配列にはN末端側の59アミノ酸残基をコードする配列が欠けていることが判明した39).さらに,新たなPI4キナーゼIIIα結合タンパク質としてEFR3A/BおよびTTC7A/Bが同定され,全長のPI4KIIIαはこれらのタンパク質と複合体を形成することにより細胞膜に局在することが示された.PI4キナーゼIIIαをノックアウトした細胞において,クラスリン被覆小胞の形成の異常やアクチン骨格の形成の異常など細胞膜におけるホスファチジルイノシトール4,5-ビスリン酸の欠損にともなう異常がみられたことから,PI4キナーゼIIIαは細胞膜に存在するホスファチジルイノシトール4,5-ビスリン酸の前駆体であるホスファチジルイノシトール4-リン酸の産生に必須であることが示された.また,PI4キナーゼIIIαをノックアウトした細胞においては細胞膜におけるコレステロールの減少や細胞膜に局在するタンパク質の異所的な局在化が生じたことから,PI4キナーゼIIIαにより産生されるホスファチジルイノシトール4-リン酸は細胞膜のアイデンティティの確立に重要な役割を担うことが明らかにされた39).さらに,Stt4の細胞膜へのリクルートを促進するSfk1のホモログであるTMEM150AがやはりPI4キナーゼIIIαと結合し細胞膜におけるホスファチジルイノシトール4-リン酸の産生に寄与すること40),そして,新たなPI4キナーゼIIIαの結合タンパク質としてFMA126A/Bが単離され41),PI4キナーゼIIIαはEFR3A/B,TTC7A/B,TMEM150A,FAM126A/Bと複合体を形成することが判明した.FAM126A(別名:Hyccin)は神経の脱髄を生じる遺伝性の疾患である白質ジストロフィーの原因遺伝子の産物であり,PI4キナーゼIIIα複合体を介した細胞膜におけるホスファチジルイノシトール4-リン酸の産生がミエリンの形成において重要な役割を担うことが明らかにされた41).このほか,細胞膜に存在するホスファチジルイノシトール4-リン酸はホスファチジルイノシトール4,5-ビスリン酸とともに細胞膜における負電荷の形成に寄与し,種々のタンパク質の細胞膜へのリクルートやチャネルの機能の制御に関与することも報告された42).
5.ホスファチジルイノシトール4-リン酸による膜接触部位における脂質輸送の制御
これまで,細胞膜に存在するホスファチジルイノシトール4-リン酸はホスファチジルイノシトール4,5-ビスリン酸の前駆体としての役割がおもな機能であると考えられてきた.しかしながら近年になり,ホスファチジルイノシトール4-リン酸は細胞内における脂質輸送の制御をつうじ,細胞における脂質ホメオスタシスの制御にきわめて深い関連をもつことが徐々に明らかにされつつある.細胞内における脂質輸送には,メンブレントラフィックにより制御される小胞輸送に依存的な経路のほか,小胞輸送に非依存的な経路が存在し,これは脂質輸送タンパク質(lipid transfer protein)と総称される一連のタンパク質により制御される.脂質輸送タンパク質は脂質と結合するリガンド結合ドメインをもち,それが疎水性ポケットとして機能することにより特定の脂質を囲い込み,脂質を保持することができる.この特性により,脂質輸送タンパク質は一方の生体膜から脂質を抽出し,その脂質を別の生体膜へと輸送することにより,異なる生体膜のあいだの脂質輸送を媒介することができる.
6.オキシステロール結合タンパク質ファミリーによるホスファチジルイノシトール4-リン酸を介した脂質輸送の制御
オキシステロール結合タンパク質ファミリーは脂質輸送タンパク質のなかでも比較的大きなファミリーを構成し,酵母からヒトにいたるまで保存されている43).そのプロトタイプであるOSBPはオキシステロールに結合するタンパク質として1984年に同定された.これをきっかけに多数のホモログの存在が判明し,現在では,出芽酵母において7種,ヒトにおいて12種のオキシステロール結合タンパク質ファミリーのメンバーの存在が確認されている44).オキシステロール結合タンパク質ファミリーには共通してリガンド結合ドメインが存在し,このドメインが疎水性ポケットとして機能することにより特定の脂質を囲い込む45).当初は,すべてのオキシステロール結合タンパク質ファミリーのもつリガンド結合ドメインは共通してステロール(出芽酵母においてはエルゴステロール,動物細胞においてはオキシステロールおよびコレステロール)が囲い込まれると考えられていたが,最近では,ホスファチジルイノシトール4-リン酸やホスファチジルセリンと特異的に結合するリガンド結合ドメインの存在も判明している.さらに,オキシステロール結合タンパク質ファミリーには細胞内における局在を規定するドメインやモチーフがいくつか存在し,なかでも,FFATモチーフとよばれる配列が多く存在する.FFATモチーフは小胞体膜タンパク質であるVAP-AおよびVAP-BのもつMSPドメインと結合し,これによりオキシステロール結合タンパク質ファミリーは小胞体膜に繋留される.また,ほぼすべてのオキシステロール結合タンパク質ファミリーにはPHドメインが存在し,脂質を輸送すべき生体膜の認識やそれ自体の局在においてきわめて重要な役割を担う.
このような構造における特徴から,オキシステロール結合タンパク質ファミリーは機能的にはステロールの脂質の輸送や脂質ホメオスタシスの制御に関与すると予想されていた.事実,組換えタンパク質として発現し精製したリガンド結合ドメインをin vitroにおいてリポソームと混合すると,一方のリポソームから他方のリポソームへのコレステロールの輸送活性が認められたことから,オキシステロール結合タンパク質ファミリーはコレステロールなどの脂質の輸送に関与する可能性が示唆された.他方,出芽酵母を用いた解析においては,ステロールの輸送ではなく脂質ホメオスタシスに関与するという報告やシグナル伝達に関与するという報告がなされ,細胞レベルにおける詳細な機能の解析は遅れていた.
7.小胞体とゴルジ体膜との接触部位におけるホスファチジルイノシトール4-リン酸とコレステロールの交換輸送
出芽酵母におけるオキシステロール結合タンパク質ファミリーのメンバーであるOsh4は,以前より,in vitroにおけるリポソームを用いたアッセイにおいてステロールを一方のリポソームから他方のリポソームへと輸送する活性をもつことが知られていた45).2011年,類似のin vitro脂質輸送アッセイ系を用いて,Osh4によるステロールの輸送活性がホスファチジルイノシトール4-リン酸により特異的に阻害されること,そして,このホスファチジルイノシトール4-リン酸によるステロールの輸送の阻害はホスファチジルイノシトール4-リン酸がOsh4のリガンド結合ドメインに入り込むことによる拮抗阻害であることが見い出された46).つまり,Osh4のリガンド結合ドメインはステロールだけでなくホスファチジルイノシトール4-リン酸もリガンドとすることが示唆され,実際に,Osh4はin vitroにおいてホスファチジルイノシトール4-リン酸を輸送する活性ももつことが示された.このホスファチジルイノシトール4-リン酸がOsh4の新たなリガンドであるというアイディアは,リガンド結合ドメインとホスファチジルイノシトール4-リン酸との共結晶のX線結晶構造解析により証明された46).Osh4のリガンド結合ドメインにはステロールとホスファチジルイノシトール4-リン酸のどちらも結合が可能であるが,どちらか一方のみが入り込む空間しか存在しないことも判明した.これらのデータをもとに,Osh4はステロールとホスファチジルイノシトール4-リン酸を交換輸送するのではないかと提唱され,この仮説は,その2年後,同じ研究グループにより動物細胞を用いて証明された.
2013年,Osh4の哺乳類におけるホモログであるOSBPが,ゴルジ体に存在するホスファチジルイノシトール4-リン酸とのPHドメインによる結合,および,小胞体膜タンパク質であるVAPとのFFATモチーフを介した結合によりゴルジ体と小胞体との接触部位に局在し,小胞体おいて合成されたコレステロールをゴルジ体へと輸送すると同時に,ゴルジ体に豊富に存在するホスファチジルイノシトール4-リン酸を小胞体へと逆輸送することが証明された14).この輸送の形式は交換輸送であり,輸送される脂質の方向性は一定であった.つまり,コレステロールは小胞体からゴルジ体へ,ホスファチジルイノシトール4-リン酸はゴルジ体から小胞体へと輸送されていた.
8.小胞体と細胞膜との接触部位におけるホスファチジルイノシトール4-リン酸とホスファチジルセリンの交換輸送
細胞膜もホスファチジルイノシトール4-リン酸が豊富な生体膜であるが,ここでもホスファチジルイノシトール4-リン酸が脂質の輸送に重要な役割を担うことが明らかにされた.ORP5およびORP8はほかのオキシステロール結合タンパク質ファミリーのメンバーとは異なり膜貫通領域をもち,小胞体に局在する43).ORP5は小胞体とリソソームとの接触部位においてNPC1と結合することによりコレステロールの代謝および輸送に関与することが報告されていたが47),ORP8の機能についてはほとんど知られていなかった.一方で,ORP5およびORP8と比較的相同性の高いOsh6およびOsh7はステロールではなくホスファチジルセリンの輸送をつかさどるという報告もなされており48),動物細胞におけるORP5あるいはORP8の機能はその局在も含め解明されていなかった.
ORP5およびORP8はHeLa細胞において小胞体と細胞膜との接触部位に局在し,この局在は,N末端側に存在するPHドメインによる細胞膜に存在するホスファチジルイノシトール4-リン酸の認識によるものであることが明らかにされた.機能を知るうえで,ORP5あるいはORP8のリガンドとなる脂質の同定は欠かせない.そこで,ORP5のリガンド結合ドメインを動物細胞に発現させたのち精製し,質量分析法により結合している脂質の同定を試みたところ,ホスファチジルイノシトール4-リン酸およびホスファチジルセリンが生理的なリガンドとして同定された.これは,ORP5およびORP8に比較的相同性の高いOsh6およびOsh7がステロールではなくホスファチジルセリンをリガンドとするという報告48) と一致した.in vitroにおけるリポソーム脂質輸送アッセイおよび培養細胞を用いた機能解析により,ORP5およびORP8はホスファチジルイノシトール4-リン酸とホスファチジルセリンの交換輸送を媒介することが判明した16).すなわち,ORP5およびORP8は,1)細胞膜に存在するホスファチジルイノシトール4-リン酸とのPHドメインによる結合を介して小胞体と細胞膜をつなぎとめ膜接触部位を形成し,2)PI4キナーゼIIIαにより産生されたホスファチジルイノシトール4-リン酸を細胞膜からそれ自体のもつリガンド結合ドメインへと囲い込み,3)ホスファチジルイノシトール4-リン酸を小胞体へと輸送する.つづいて,4)小胞体において合成されたホスファチジルセリンと結合し,5)ホスファチジルセリンを細胞膜へと逆輸送する(図4).このように,ホスファチジルイノシトール4-リン酸が細胞膜から小胞体へと輸送されることにより,ホスファチジルセリンの小胞体から細胞膜への輸送が成立する.すなわち,ORP5およびORP8によるホスファチジルセリンの輸送はホスファチジルイノシトール4-リン酸が駆動していたのである.
それでは,この脂質輸送の方向性はどのような分子機構により説明されるのだろうか? それにはホスファチジルイノシトール4-リン酸が重要な鍵をにぎっている.ホスファチジルイノシトール4-リン酸は細胞膜およびゴルジ体に豊富に存在する.これは,細胞膜に局在するPI4キナーゼIIIα,および,ゴルジ体に局在するPI4キナーゼIIIβの作用による.一方で,小胞体にはホスファチジルイノシトール4-リン酸はほとんど存在しない.それは,小胞体に局在するホスファチジルイノシトール4-リン酸のホスファターゼであるSac1の作用による.つまり,細胞膜およびゴルジ体と小胞体とのあいだにはホスファチジルイノシトール4-リン酸の濃度勾配が存在するため,ホスファチジルイノシトール4-リン酸は高濃度である細胞膜およびゴルジ体から低濃度である小胞体へと一方向に輸送される.これが,ホスファチジルセリンやコレステロールの逆輸送,つまり,小胞体から細胞膜およびゴルジ体への輸送を規定する,というモデルである.このモデルは,細胞膜で合成されたホスファチジルイノシトール4-リン酸がなぜ小胞体で代謝されるのかという別の問題も説明しうる.すなわち,ホスファチジルイノシトール4-リン酸が細胞膜から小胞体へと輸送される力が,別の脂質の逆輸送に利用されているからである.
おわりに
ホスファチジルイノシトール4-リン酸は動物細胞においてもっとも多いイノシトールリン脂質のひとつであり,ゴルジ体や細胞膜,そして,エンドサイトーシス経路を構成するオルガネラ膜においては,メンブレントラフィックの制御に欠かせないイノシトールリン脂質として知られていた.しかしながら,それ以外のホスファチジルイノシトール4-リン酸のもつ本来の機能についてはほとんどわかっていなかった.とくに,細胞膜においては単純にホスファチジルイノシトール4,5-ビスリン酸の前駆体としての存在意義のみが明確な機能として認識されていた.そのような背景のもと,ホスファチジルイノシトール4-リン酸はオキシステロール結合タンパク質ファミリーによる膜接触部位を介した脂質の交換輸送に必須の役割を担うことが明らかにされた.このホスファチジルイノシトール4-リン酸により駆動される脂質の交換輸送の分子機構や生理的な意義についてはまだまだ不明な点が多い.しかし最近,ホスファチジルセリンの代謝異常を呈するLenz-Majewski症候群において,オキシステロール結合タンパク質ファミリーを介したホスファチジルイノシトール4-リン酸とホスファチジルセリンの交換輸送が関与する可能性が示唆された49).さらに,細胞膜やゴルジ体だけでなく,エンドソームと小胞体との接触部位においてもホスファチジルイノシトール4-リン酸の関与する膜ダイナミクスの制御機構が明らかにされつつある50).そして,オキシステロール結合タンパク質ファミリーのほかにも膜接触部位を介した脂質輸送を制御するタンパク質が多く存在することも明らかにされている.今後のさらなる解析により,ホスファチジルイノシトール4-リン酸による膜ダイナミクスの制御や膜接触部位を介したたくみな脂質輸送のしくみ,それらの生理機能がより一層解明されることを期待したい.
文 献
- Balla, T.: Phosphoinositides: tiny lipids with giant impact on cell regulation. Physiol. Rev., 93, 1019-1137 (2013)[PubMed]
- Di Paolo, G. & De Camilli, P.: Phosphoinositides in cell regulation and membrane dynamics. Nature, 443, 651-657 (2006)[PubMed]
- Sasaki, T., Takasuga, S., Sasaki, J. et al.: Mammalian phosphoinositide kinases and phosphatases. Prog. Lipid Res., 48, 307-343 (2009)[PubMed]
- Takenawa, T. & Nagai, Y.: Purification of phosphatidylinositol-specific phospholipase C from rat liver. J. Bio. Chem., 256, 6769-6775 (1981)[PubMed]
- Nishizuka, Y.: The role of protein kinase C in cell surface signal transduction and tumour promotion. Nature, 308, 693-698 (1984)[PubMed]
- Berridge, M. J. & Irvine, R. F.: Inositol trisphosphate, a novel second messenger in cellular signal transduction. Nature, 312, 315-321 (1984)[PubMed]
- Lemmon, M. A.: Membrane recognition by phospholipid-binding domains. Nat. Rev. Mol. Cell Biol., 9, 99-111 (2008)[PubMed]
- Balla, A. & Balla, T.: Phosphatidylinositol 4-kinases: old enzymes with emerging functions. Trends Cell Biol., 16, 351-361 (2006)[PubMed]
- Balla, T.: Phosphatidylinositol 4-kinases. Biochim. Biophys. Acta, 1436, 69-85 (1998)[PubMed]
- Hsu, F. & Mao, Y.: The Sac domain-containing phosphoinositide phosphatases: structure, function, and disease. Front. Biol., 8, 395-407 (2013)[PubMed]
- Blagoveshchenskaya, A., Cheong, F. Y., Rohde, H. M. et al.: Integration of Golgi trafficking and growth factor signaling by the lipid phosphatase SAC1. J. Cell Biol., 180, 803-812 (2008)[PubMed]
- Stefan, C. J., Manford, A. G., Baird, D. et al.: Osh proteins regulate phosphoinositide metabolism at ER-plasma membrane contact sites. Cell, 144, 389-401 (2011)[PubMed]
- Dickson, E. J., Jensen, J. B., Vivas, O. et al.: Dynamic formation of ER-PM junctions presents a lipid phosphatase to regulate phosphoinositides. J. Cell Biol., 213, 33-48 (2016)[PubMed]
- Mesmin, B., Bigay, J., Moser von Filseck, J. et al.: A four-step cycle driven by PI(4)P hydrolysis directs sterol/PI(4)P exchange by the ER-Golgi tether OSBP. Cell, 155, 830-843 (2013)[PubMed]
- Moser von Filseck, J., Copic, A., Delfosse, V. et al.: Phosphatidylserine transport by ORP/Osh proteins is driven by phosphatidylinositol 4-phosphate. Science, 349, 432-436 (2015)[PubMed]
- Chung, J., Torta, F., Masai, K. et al.: PI4P/phosphatidylserine countertransport at ORP5- and ORP8-mediated ER-plasma membrane contacts. Science, 349, 428-432 (2015)[PubMed]
- Wakana, Y., Kotake, R., Oyama, N. et al.: CARTS biogenesis requires VAP-lipid transfer protein complexes functioning at the endoplasmic reticulum-Golgi interface. Mol. Biol. Cell, 26, 4686-4699 (2015)[PubMed]
- McPherson, P. S., Garcia, E. P., Slepnev, V. I. et al.: A presynaptic inositol-5-phosphatase. Nature, 379, 353-357 (1996)[PubMed]
- Nakatsu, F., Messa, M., Nandez, R. et al.: Sac2/INPP5F is an inositol 4-phosphatase that functions in the endocytic pathway. J. Cell Biol., 209, 85-95 (2015)[PubMed]
- Flanagan, C. A., Schnieders, E. A., Emerick, A. W. et al.: Phosphatidylinositol 4-kinase: gene structure and requirement for yeast cell viability. Science, 262, 1444-1448 (1993)[PubMed]
- Flanagan, C. A. & Thorner, J.: Purification and characterization of a soluble phosphatidylinositol 4-kinase from the yeast Saccharomyces cerevisiae. J. Biol. Chem., 267, 24117-24125 (1992)[PubMed]
- Walch-Solimena, C. & Novick, P.: The yeast phosphatidylinositol-4-OH kinase Pik1 regulates secretion at the Golgi. Nat. Cell Biol., 1, 523-525 (1999)[PubMed]
- Audhya, A., Foti, M. & Emr, S. D.: Distinct roles for the yeast phosphatidylinositol 4-kinases, Stt4p and Pik1p, in secretion, cell growth, and organelle membrane dynamics. Mol. Biol. Cell, 11, 2673-2689 (2000)[PubMed]
- Hendricks, K. B., Wang, B. Q., Schnieders, E. A. et al.: Yeast homologue of neuronal frequenin is a regulator of phosphatidylinositol-4-OH kinase. Nat. Cell Biol., 1, 234-241 (1999)[PubMed]
- Godi, A., Pertile. P., Meyers, R. et al.: ARF mediates recruitment of PtdIns-4-OH kinase-β and stimulates synthesis of PtdIns(4,5)P2 on the Golgi complex. Nat. Cell Biol., 1, 280-287 (1999)[PubMed]
- Hilfiker, S.: Neuronal calcium sensor-1: a multifunctional regulator of secretion. Biochem. Soc. Trans., 31, 828-832 (2003)[PubMed]
- Sasaki, J., Ishikawa, K., Arita, M. et al.: ACBD3-mediated recruitment of PI4KB to picornavirus RNA replication sites. EMBO J., 31, 754-766 (2012)[PubMed]
- Klima, M., Toth, D. J., Hexnerova, R. et al.: Structural insights and in vitro reconstitution of membrane targeting and activation of human PI4KB by the ACBD3 protein. Sci. Rep., 6, 23641 (2016)[PubMed]
- Wang, Y. J., Wang, J., Sun, H. Q. et al.: Phosphatidylinositol 4 phosphate regulates targeting of clathrin adaptor AP-1 complexes to the Golgi. Cell, 114, 299-310 (2003)[PubMed]
- Wood, C. S., Schmitz, K. R., Bessman, N. J. et al.: PtdIns4P recognition by Vps74/GOLPH3 links PtdIns 4-kinase signaling to retrograde Golgi trafficking. J. Cell Biol., 187, 967-975 (2009)[PubMed]
- Dippold, H. C., Ng, M. M., Farber-Katz, S. E. et al.: GOLPH3 bridges phosphatidylinositol-4- phosphate and actomyosin to stretch and shape the Golgi to promote budding. Cell, 139, 337-351 (2009)[PubMed]
- Hanada, K., Kumagai, K., Yasuda, S. et al.: Molecular machinery for non-vesicular trafficking of ceramide. Nature, 426, 803-809 (2003)[PubMed]
- Yoshida, S., Ohya, Y., Goebl, M. et al.: A novel gene, STT4, encodes a phosphatidylinositol 4-kinase in the PKC1 protein kinase pathway of Saccharomyces cerevisiae. J. Biol. Chem., 269, 1166-1172 (1994)[PubMed]
- Baird, D., Stefan, C., Audhya, A. et al.: Assembly of the PtdIns 4-kinase Stt4 complex at the plasma membrane requires Ypp1 and Efr3. J. Cell Biol., 183, 1061-1074 (2008)[PubMed]
- Audhya, A. & Emr, S. D.: Stt4 PI 4-kinase localizes to the plasma membrane and functions in the Pkc1-mediated MAP kinase cascade. Dev. Cell, 2, 593-605 (2002)[PubMed]
- Nakagawa, T., Goto, K. & Kondo, H.: Cloning, expression, and localization of 230-kDa phosphatidylinositol 4-kinase. J. Biol. Chem., 271, 12088-12094 (1996)[PubMed]
- Balla, A., Tuymetova, G., Tsiomenko, A. et al.: A plasma membrane pool of phosphatidylinositol 4-phosphate is generated by phosphatidylinositol 4-kinase type-III alpha: studies with the PH domains of the oxysterol binding protein and FAPP1. Mol. Biol. Cell, 16, 1282-1295 (2005)[PubMed]
- Balla, A., Kim, Y. J., Varnai, P. et al.: Maintenance of hormone-sensitive phosphoinositide pools in the plasma membrane requires phosphatidylinositol 4-kinase IIIα. Mol. Biol. Cell 19, 711-721 (2008)[PubMed]
- Nakatsu, F., Baskin, J. M., Chung, J. et al.: PtdIns4P synthesis by PI4KIIIα at the plasma membrane and its impact on plasma membrane identity. J. Cell Biol., 199, 1003-1016 (2012)[PubMed]
- Chung, J., Nakatsu, F., Baskin, J. M. et al.: Plasticity of PI4KIIIα interactions at the plasma membrane. EMBO Rep., 16, 312-320 (2015)[PubMed]
- Baskin, J. M., Wu, X., Christiano, R. et al.: The leukodystrophy protein FAM126A (hyccin) regulates PtdIns(4)P synthesis at the plasma membrane. Nat. Cell Biol., 18, 132-138 (2016)[PubMed]
- Hammond, G. R., Fischer, M. J., Anderson, K. E.: PI4P and PI(4,5)P2 are essential but independent lipid determinants of membrane identity. Science, 337, 727-730 (2012)[PubMed]
- Olkkonen, V. M. & Li, S.: Oxysterol-binding proteins: sterol and phosphoinositide sensors coordinating transport, signaling and metabolism. Prog. Lipid Res., 52, 529-538 (2013)[PubMed]
- Lehto, M., Laitinen, S., Chinetti, G. et al.: The OSBP-related protein family in humans. J. Lipid Res., 42, 1203-1213 (2001)[PubMed]
- Raychaudhuri, S. & Prinz, W. A.: The diverse functions of oxysterol-binding proteins. Annu. Rev. Cell Dev. Biol., 26, 157-177 (2010)[PubMed]
- de Saint-Jean, M., Delfosse, V., Douguet, D. et al.: Osh4p exchanges sterols for phosphatidylinositol 4-phosphate between lipid bilayers. J. Cell Biol., 195, 965-978 (2011)[PubMed]
- Du, X., Kumar, J., Ferguson, C. et al.: A role for oxysterol-binding protein-related protein 5 in endosomal cholesterol trafficking. J. Cell Biol., 192, 121-135 (2011)[PubMed]
- Maeda, K., Anand, K., Chiapparino, A. et al.: Interactome map uncovers phosphatidylserine transport by oxysterol-binding proteins. Nature, 501, 257-261 (2013)[PubMed]
- Sohn, M., Ivanova, P., Brown, H. A. et al.: Lenz-Majewski mutations in PTDSS1 affect phosphatidylinositol 4-phosphate metabolism at ER-PM and ER-Golgi junctions. Proc. Natl. Acad. Sci. USA, 113, 4314-4319 (2016)[PubMed]
- Dong, R., Saheki, Y., Swarup, S. et al.: Endosome-ER contacts control actin nucleation and retromer function through VAP-dependent regulation of PI4P. Cell, 166, 408-423 (2016)[PubMed]
著者プロフィール
略歴:2001年 千葉大学大学院医学研究科 修了,同年 金沢大学がん研究所 博士研究員,2002年 理化学研究所 研究員,2006年 米国Yale大学School of Medicine研究員を経て,2014年より新潟大学大学院医歯学総合研究科 准教授.
研究テーマ:イノシトールリン脂質による膜ダイナミクスの制御機構を中心に,最近は,オルガネラの膜接触部位の生物学に興味をもっている.
© 2016 中津 史 Licensed under CC 表示 2.1 日本