Argonaute:RNAサイレンシングの構造基盤
2012/09/01
佐々木 浩・泊 幸秀
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:佐々木 浩,泊 幸秀
領域融合レビュー, 1, e001 (2012) DOI: 10.7875/leading.author.1.e001
Hiroshi M. Sasaki & Yukihide Tomari: Argonaute: the structural basis of RNA silencing.

RNAサイレンシングの発見から10年以上を経た2012年,その中心的なタンパク質である真核生物型Argonauteの立体構造が,わずか1カ月のあいだに3つの研究グループから報告された.ここでは,Argonauteに生じるダイナミックな立体構造の変化と標的に特異的なRNAサイレンシングとの密接なかかわりに焦点をあて,RNAサイレンシングの構造生物学における最新の知見を紹介する.
RNAサイレンシングとは,20~30塩基長の小分子RNA(small RNA)を介して,それと相補的な配列領域をもつ遺伝子の発現が抑制される現象である.RNAサイレンシングは1998年,線虫についてはじめて報告され1),2001年には,真核生物に特異的な遺伝子発現の制御機構として広く保存されていることが知られるようになった2).また,応用的な観点からみると,RNAサイレンシングは特定の遺伝子産物の発現を人為的に抑制する方法として,高い選択性と汎用性とを兼ね備えたアプローチである.すでに,実験室レベルでは遺伝子の機能を解明するうえで欠かせないツールとして生命科学の実験に幅広く利用されている.
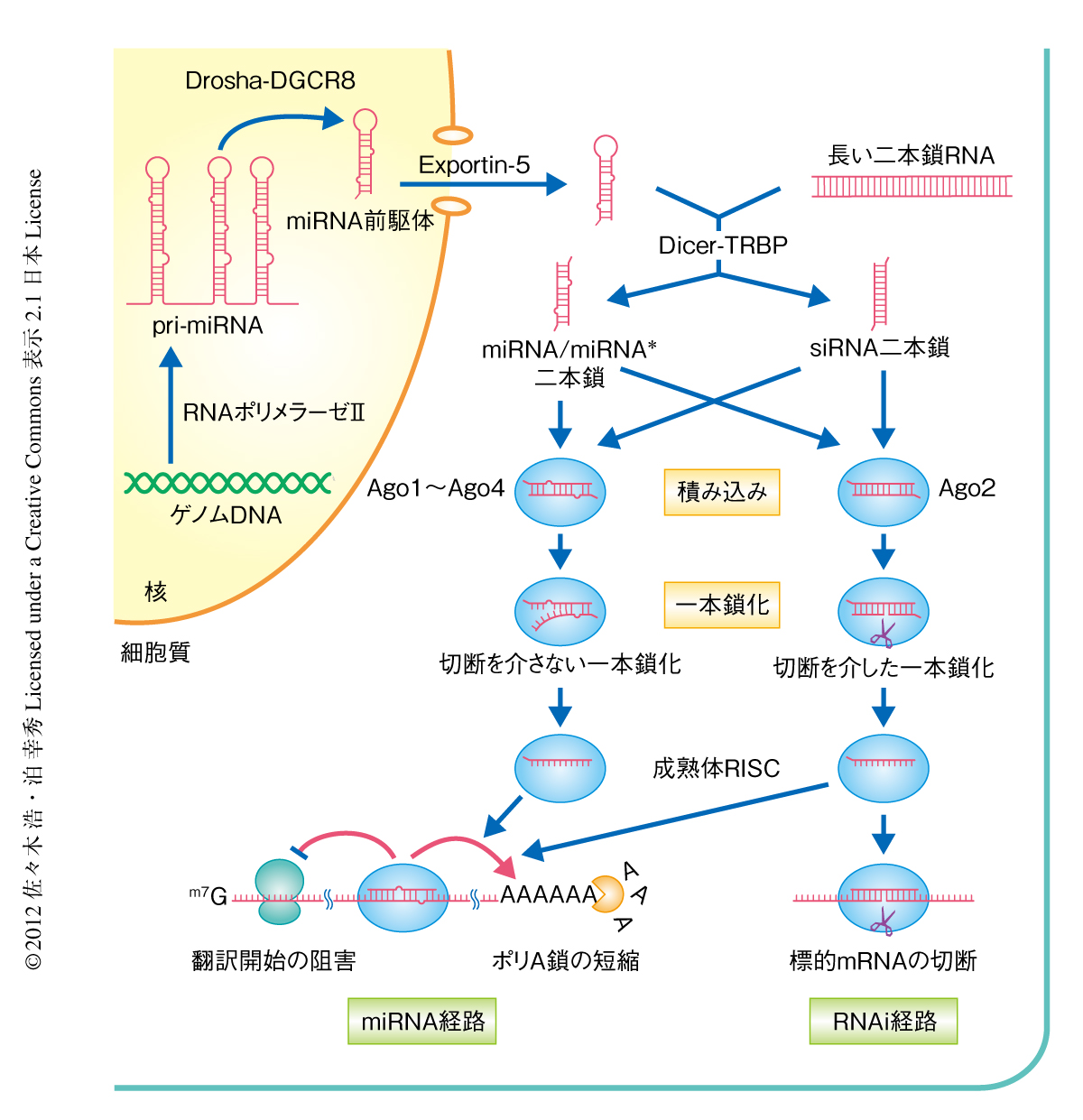
RNAサイレンシングのなかでもとくにくわしく調べられている経路として,おもにウイルスなど外因性の長い二本鎖RNAに由来するsmall interfering RNA(siRNA)が原始的な防御システムとしてはたらくRNAi経路,および,ヘアピン型をとる前駆体RNAとしてゲノムにコードされていてさまざまな生命現象の制御を行うmicroRNA(miRNA)のかかわるmiRNA経路の2つがある3-6)(図1).どちらの経路でも,生合成された21~23塩基長のRNAがRISC(RNA-induced silencing complex)とよばれるRNA-タンパク質複合体を形成し,相補的な配列領域をもつmRNAの発現を抑制するという共通点がある.このRNAサイレンシングの機能複合体であるRISCにおいて,中心的な役割をはたしているのがArgonaute(Ago)とよばれる一群のタンパク質である7).
Agoは,4つのドメイン(Nドメイン,PAZドメイン,MIDドメイン,PIWIドメイン)と2つのリンカー(L1リンカーとL2リンカー)から構成される,分子量が約100 kDaのタンパク質である.siRNAやmiRNAなどのsmall RNAは,通常,二本鎖RNAとして生合成され,二本鎖のままAgoに積み込まれる(図1).つぎに,Agoのなかで二本鎖RNA鎖の片方の鎖(パッセンジャー鎖)が引きはがされ捨てられることにより,もう片方の鎖(ガイド鎖)のみがAgoに取り込まれた成熟体RISCが形成される3-6).こうして形成されたRISCは,ガイド鎖の配列相補性を利用して特異的な標的mRNAをみつけだし,翻訳の抑制やポリA鎖の短縮による不安定化をひき起こす(miRNA経路).また,Agoファミリーに属するタンパク質のなかには“スライサー”とよばれるエンドヌクレアーゼ活性をもつものがあり,こうしたAgoは標的mRNAを切断することもできる(RNAi経路).
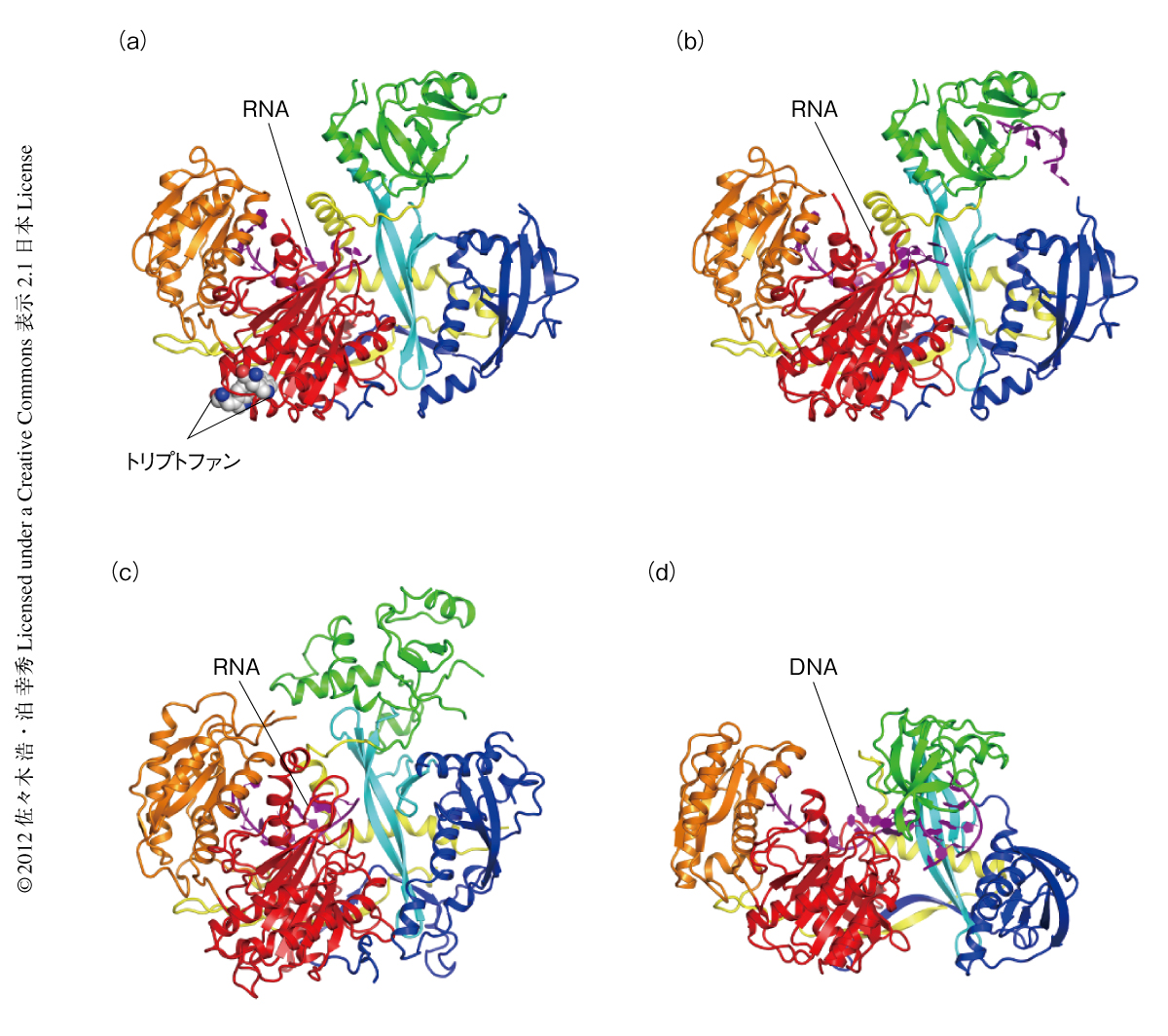
ガイド鎖RNAとの結合様式や標的mRNAの認識および切断の分子機構をさぐるうえで,Agoに対する構造生物学的な理解は欠かすことができない.これまでに報告されていたAgoについての構造生物学的な知見は,個々のドメインを切り分けたレベルでの構造解析8-22) か,あるいは,生理的な機能のわかっていない原核生物のAgoホモログ23-29) にかぎられていた.しかし,2012年4月から5月にかけて,ヒトに由来するAgo2 30,31),および,出芽酵母の一種であるKluyveromyces polysporusに由来するAgo 32)(新着論文レビュー でも掲載)の全長の結晶構造が報告され,真核生物におけるRNAサイレンシングの核心が明らかになった(図2).
特筆すべきことに,今回,3つの研究グループから報告された真核生物型Agoの立体構造は,どれも一本鎖RNAと複合体を形成した状態において構造が決定されており(図2),成熟体RISCの構造を反映したものと考えられた.K. polysporus AgoおよびヒトAgo2の報告の一方では,タンパク質を発現させたときに非特異的に短いRNAが取り込まれていた31,32).また,ヒトAgo2のもうひとつの報告では,RNAを含まない空のAgo2を精製することに成功し,そこに単一のRNA(ヒトのmiRNAの一種であるmiR-20a)を取り込ませ結晶化を行った30).
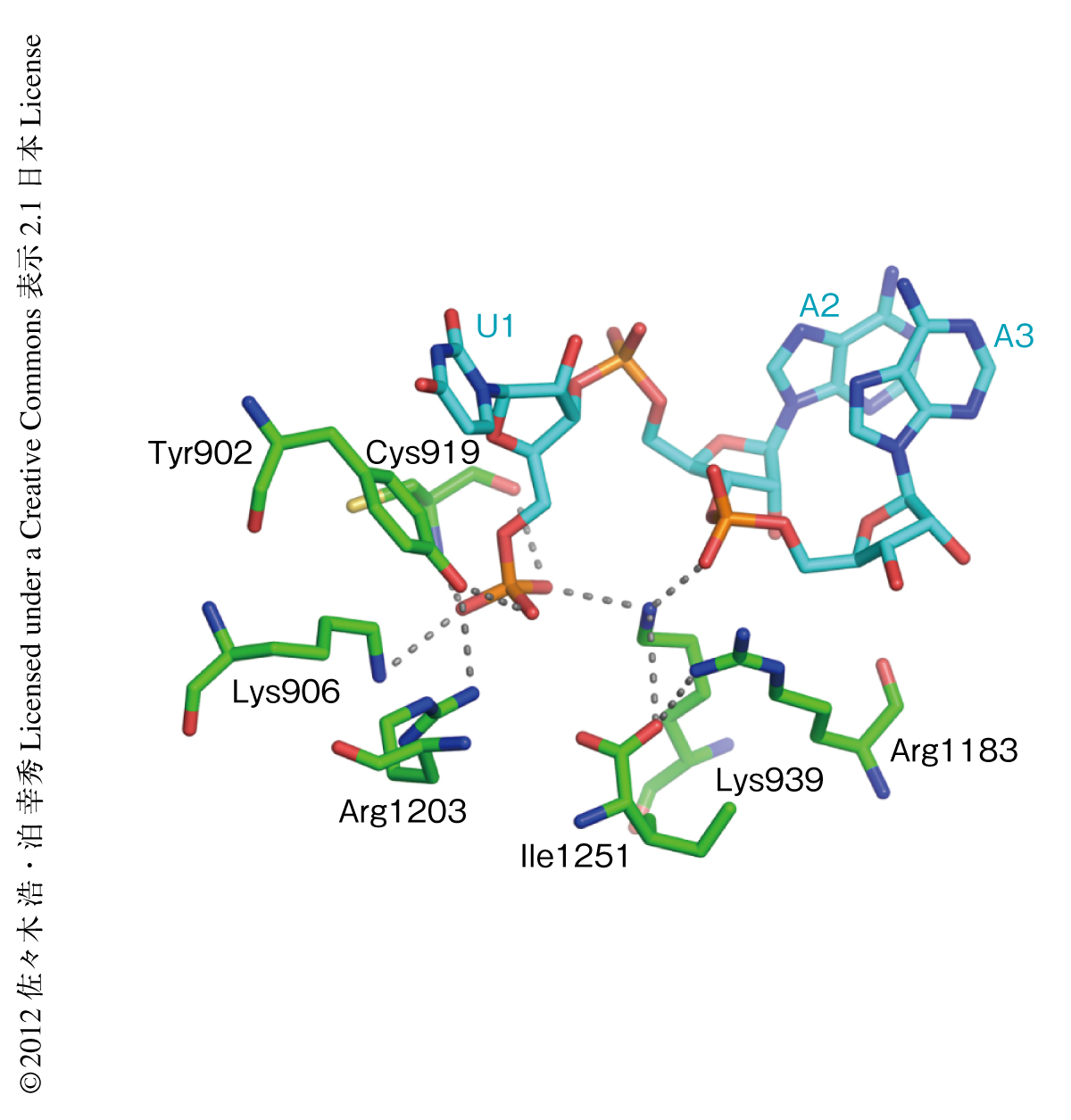
いずれの構造においても,ガイド鎖RNAは,おもに5’末端から1~7番目のヌクレオチドにおいてAgoと結合していた30-32).5’末端の塩基とモノリン酸基は,MIDドメインとPIWIドメインとの境界部分にある5’末端結合ポケットにより認識されていた.原核生物のAgoホモログと真核生物型Agoの構造を比較すると,ガイド鎖の5’-モノリン酸がMIDドメインとPIWIドメインとの境界部分にある結合ポケットに認識される様式に明らかな違いがみられた.興味深いことに,原核生物のAgoホモログはリン酸基との相互作用にMg2+を用いていたが14,15,27),真核生物型Agoではこのような二価イオンの代わりに真核生物でのみ保存されているリジン残基の側鎖のもつアミノ基により同じ役割がはたされていた(図3).
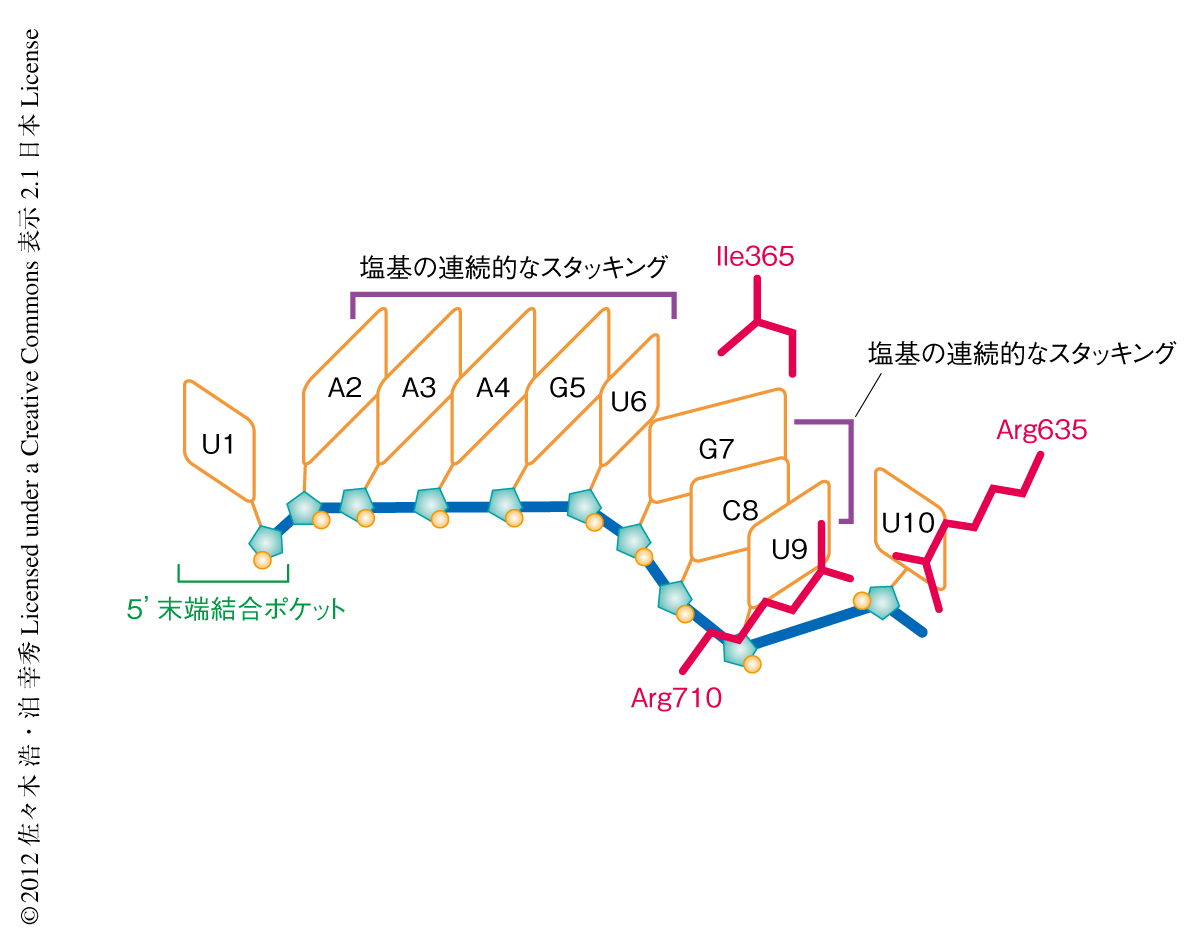
Agoは,あらかじめガイド鎖のseed領域をA型ヘリックス様の構造に整列させることで,標的RNAとの塩基対の形成の際に生じる立体配置のエントロピーコストを低減させ,標的RNAとの塩基対の形成を開始するための“核”となる部位を提供していると考えられている16,27-29).実際に,今回,決定された真核生物型Agoの3つの構造すべてにおいて,ガイド鎖RNAの2~6番目のリン酸-糖骨格はA型らせん構造によく重ね合わさる配置をとって整列されており,塩基の部分は連続的にスタッキングしていた(図4).その一方で,6番目と7番目の塩基のあいだ30-32),および,9番目と10番目の塩基のあいだに30),それぞれイソロイシン残基およびアルギニン残基が挿入されることによりねじれが生じており,RNA塩基のスタッキングが途切れていることがわかった(図4).ガイド鎖と標的RNAとのあいだで整列したらせん構造をとりながら塩基対の形成が伸長する際には,これらのねじれが解消される必要がある.seed領域における塩基対の形成がねじれを解消しながら段階的に進むとすれば,このような段階的な対合は標的RNAの認識における校正機能をはたすと考えられる.実際に,真核生物型Agoと同じようなねじれ構造は,高度好熱性細菌Thermus thermophilusのAgoホモログのガイド鎖を含む構造の7番目と8番目の塩基のあいだにも弱いながらみられる27).さらには,9番目と10番目の塩基のあいだのアルギニン残基の挿入は,Agoが活性型の構造をとるためのスイッチとしての役割をはたしている可能性も考えられる.
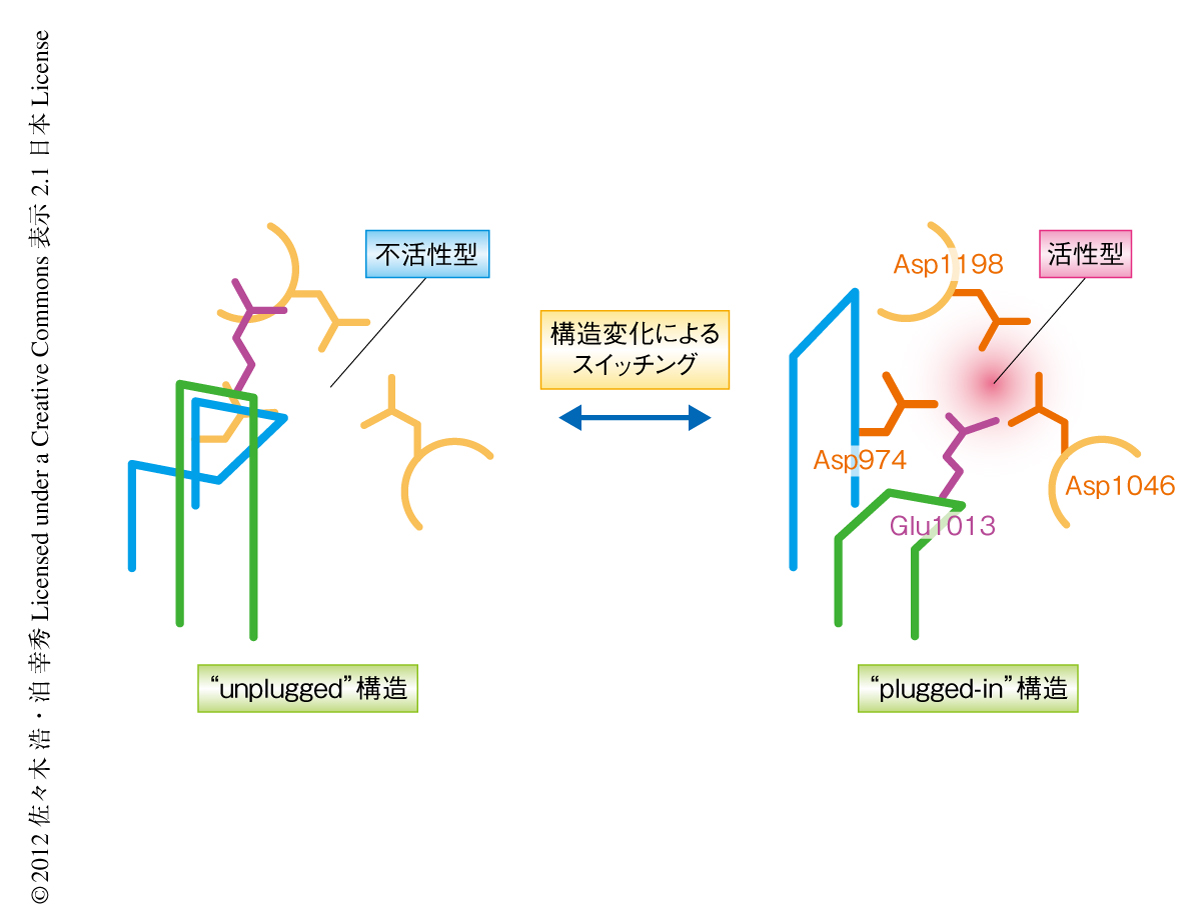
AgoのPIWIドメインはAsp-Asp-His(DDH)またはAsp-Asp-Asp(DDD)という3残基の触媒中心を使って標的RNAを切断すると長らく信じられてきた12,14,15,19,23,24,27-29).しかしながら,K. polysporus Agoの構造において,PIWIドメインのループに存在するグルタミン酸残基が活性中心に挿入されており,RNase Hに似たAsp-Glu-Asp-Asp(DEDD)という4残基触媒中心の形成されていることが見い出された32)(図5).この観点から再度,これまでに構造決定された原核生物のAgoホモログやAgoの部分構造を検証してみると,新たにみつかった活性残基を含むループが活性中心に挿入された“plug-in”構造をとっているものがみられる一方で28,29),活性中心に別のループが挿入され4残基触媒中心の形成がブロックされている“unplugged”構造がいくつかのAgoの結晶構造においてみられることが判明した19,27)(図5).ヒトAgo2においても,K. polysporus Agoと同様に,新たにみつかった活性残基を含むループが活性中心に挿入された“plug-in”構造がみられた30,31).現時点では,活性部位の構造がどのようにplug-inとunpluggedとのあいだで切り替わっているのかはわかっていないが,RNAとの結合状態に対応して全体的なドメインの配置が変化することにより,活性型の4残基触媒中心がダイナミックに形成されている可能性がある.このように,4番目の活性残基の発見はAgoの構造変化と生物学的な機能との密接な結びつきを示している.
Agoは標的RNAの切断を触媒するだけではなく,下流でRNAサイレンシングに機能するタンパク質を動員するプラットフォームとしても機能する.これらのタンパク質の多くはグリシン残基とトリプトファン残基に富んだ領域(GWリッチ領域)をもつという特徴がある.このようなRNAサイレンシングに機能するタンパク質としてもっとも研究の進んでいるGW182(TNRC6としても知られている)は,GWリッチ領域を介してAgoに結合し,miRNA経路における翻訳の抑制やポリA鎖の短縮に重要な役割をはたしている33).では,GW182はどのようにしてAgoと結合するのだろうか? ヒトAgo2の報告の一方では,L-トリプトファンとの共結晶構造解析によりPIWIドメインに2つ並んで存在するトリプトファン結合ポケットが同定された31)(図6).この2つのポケットのあいだの距離は柔軟なアミノ酸リンカーの長さおよそ8残基分に相当しており,複数のトリプトファン残基が点在しているGWリッチ領域に対する結合ポケットという性質に合致していた.過去の変異体解析の結果によると,今回,同定されたトリプトファン結合ポケットを破壊するような変異の導入は,AgoのRNA結合能には影響をあたえずGW182との結合を阻害する一方で19,34),PAZドメインやMIDドメインへの変異の導入では,small RNAの結合を阻害するもののGW182への結合に影響はみられない34-37).これらの結果は,Agoにおいてsmall RNAの取り込みとGW182との結合とは独立して起こることを示している.
今回,報告された真核生物型Agoの構造に関する3つの論文により,標的RNAを正確に認識し遺伝子の発現を負に制御するというRISCの作用機序について,Agoの立体構造とその構造変化との密接なかかわりに新たな光があてられた.しかし,RISCそのものの形成過程についてはまだ多くの謎が残されている.RNAサイレンシングにおけるつぎの大きな課題は,RNAの取り込み,パッセンジャー鎖の放出,機能複合体の形成,標的RNAのサイレンシング,そして,ターンオーバーの過程を解明することにほかならない.構造生物学のさらなる進歩が“RISCの一生”におけるAgoとRNAとの動的な相互作用をより精密な視点から解き明かすことに期待したい.
略歴:2011年 東京大学大学院理学系研究科博士課程 修了,同年より東京大学分子細胞生物学研究所 助教.
研究テーマ:1分子イメージングによるRISC形成の解析.
関心事:何を研究するかというテーマ以上に,どうやって研究するかというアプローチのことをいつも考えてしまいがちです.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 准教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/tomari/
© 2012 佐々木 浩・泊 幸秀 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 RNA機能研究分野)
email:佐々木 浩,泊 幸秀
領域融合レビュー, 1, e001 (2012) DOI: 10.7875/leading.author.1.e001
Hiroshi M. Sasaki & Yukihide Tomari: Argonaute: the structural basis of RNA silencing.
要 約
RNAサイレンシングの発見から10年以上を経た2012年,その中心的なタンパク質である真核生物型Argonauteの立体構造が,わずか1カ月のあいだに3つの研究グループから報告された.ここでは,Argonauteに生じるダイナミックな立体構造の変化と標的に特異的なRNAサイレンシングとの密接なかかわりに焦点をあて,RNAサイレンシングの構造生物学における最新の知見を紹介する.
はじめに
RNAサイレンシングとは,20~30塩基長の小分子RNA(small RNA)を介して,それと相補的な配列領域をもつ遺伝子の発現が抑制される現象である.RNAサイレンシングは1998年,線虫についてはじめて報告され1),2001年には,真核生物に特異的な遺伝子発現の制御機構として広く保存されていることが知られるようになった2).また,応用的な観点からみると,RNAサイレンシングは特定の遺伝子産物の発現を人為的に抑制する方法として,高い選択性と汎用性とを兼ね備えたアプローチである.すでに,実験室レベルでは遺伝子の機能を解明するうえで欠かせないツールとして生命科学の実験に幅広く利用されている.
1.RNAi経路とmiRNA経路
RNAサイレンシングのなかでもとくにくわしく調べられている経路として,おもにウイルスなど外因性の長い二本鎖RNAに由来するsmall interfering RNA(siRNA)が原始的な防御システムとしてはたらくRNAi経路,および,ヘアピン型をとる前駆体RNAとしてゲノムにコードされていてさまざまな生命現象の制御を行うmicroRNA(miRNA)のかかわるmiRNA経路の2つがある3-6)(図1).どちらの経路でも,生合成された21~23塩基長のRNAがRISC(RNA-induced silencing complex)とよばれるRNA-タンパク質複合体を形成し,相補的な配列領域をもつmRNAの発現を抑制するという共通点がある.このRNAサイレンシングの機能複合体であるRISCにおいて,中心的な役割をはたしているのがArgonaute(Ago)とよばれる一群のタンパク質である7).
Agoは,4つのドメイン(Nドメイン,PAZドメイン,MIDドメイン,PIWIドメイン)と2つのリンカー(L1リンカーとL2リンカー)から構成される,分子量が約100 kDaのタンパク質である.siRNAやmiRNAなどのsmall RNAは,通常,二本鎖RNAとして生合成され,二本鎖のままAgoに積み込まれる(図1).つぎに,Agoのなかで二本鎖RNA鎖の片方の鎖(パッセンジャー鎖)が引きはがされ捨てられることにより,もう片方の鎖(ガイド鎖)のみがAgoに取り込まれた成熟体RISCが形成される3-6).こうして形成されたRISCは,ガイド鎖の配列相補性を利用して特異的な標的mRNAをみつけだし,翻訳の抑制やポリA鎖の短縮による不安定化をひき起こす(miRNA経路).また,Agoファミリーに属するタンパク質のなかには“スライサー”とよばれるエンドヌクレアーゼ活性をもつものがあり,こうしたAgoは標的mRNAを切断することもできる(RNAi経路).
2.3つの研究グループから報告された真核生物型Agoの立体構造
ガイド鎖RNAとの結合様式や標的mRNAの認識および切断の分子機構をさぐるうえで,Agoに対する構造生物学的な理解は欠かすことができない.これまでに報告されていたAgoについての構造生物学的な知見は,個々のドメインを切り分けたレベルでの構造解析8-22) か,あるいは,生理的な機能のわかっていない原核生物のAgoホモログ23-29) にかぎられていた.しかし,2012年4月から5月にかけて,ヒトに由来するAgo2 30,31),および,出芽酵母の一種であるKluyveromyces polysporusに由来するAgo 32)(新着論文レビュー でも掲載)の全長の結晶構造が報告され,真核生物におけるRNAサイレンシングの核心が明らかになった(図2).
特筆すべきことに,今回,3つの研究グループから報告された真核生物型Agoの立体構造は,どれも一本鎖RNAと複合体を形成した状態において構造が決定されており(図2),成熟体RISCの構造を反映したものと考えられた.K. polysporus AgoおよびヒトAgo2の報告の一方では,タンパク質を発現させたときに非特異的に短いRNAが取り込まれていた31,32).また,ヒトAgo2のもうひとつの報告では,RNAを含まない空のAgo2を精製することに成功し,そこに単一のRNA(ヒトのmiRNAの一種であるmiR-20a)を取り込ませ結晶化を行った30).
3.真核生物型Agoの立体構造の特徴
いずれの構造においても,ガイド鎖RNAは,おもに5’末端から1~7番目のヌクレオチドにおいてAgoと結合していた30-32).5’末端の塩基とモノリン酸基は,MIDドメインとPIWIドメインとの境界部分にある5’末端結合ポケットにより認識されていた.原核生物のAgoホモログと真核生物型Agoの構造を比較すると,ガイド鎖の5’-モノリン酸がMIDドメインとPIWIドメインとの境界部分にある結合ポケットに認識される様式に明らかな違いがみられた.興味深いことに,原核生物のAgoホモログはリン酸基との相互作用にMg2+を用いていたが14,15,27),真核生物型Agoではこのような二価イオンの代わりに真核生物でのみ保存されているリジン残基の側鎖のもつアミノ基により同じ役割がはたされていた(図3).
4.RNA塩基のスタッキングとねじれ構造
Agoは,あらかじめガイド鎖のseed領域をA型ヘリックス様の構造に整列させることで,標的RNAとの塩基対の形成の際に生じる立体配置のエントロピーコストを低減させ,標的RNAとの塩基対の形成を開始するための“核”となる部位を提供していると考えられている16,27-29).実際に,今回,決定された真核生物型Agoの3つの構造すべてにおいて,ガイド鎖RNAの2~6番目のリン酸-糖骨格はA型らせん構造によく重ね合わさる配置をとって整列されており,塩基の部分は連続的にスタッキングしていた(図4).その一方で,6番目と7番目の塩基のあいだ30-32),および,9番目と10番目の塩基のあいだに30),それぞれイソロイシン残基およびアルギニン残基が挿入されることによりねじれが生じており,RNA塩基のスタッキングが途切れていることがわかった(図4).ガイド鎖と標的RNAとのあいだで整列したらせん構造をとりながら塩基対の形成が伸長する際には,これらのねじれが解消される必要がある.seed領域における塩基対の形成がねじれを解消しながら段階的に進むとすれば,このような段階的な対合は標的RNAの認識における校正機能をはたすと考えられる.実際に,真核生物型Agoと同じようなねじれ構造は,高度好熱性細菌Thermus thermophilusのAgoホモログのガイド鎖を含む構造の7番目と8番目の塩基のあいだにも弱いながらみられる27).さらには,9番目と10番目の塩基のあいだのアルギニン残基の挿入は,Agoが活性型の構造をとるためのスイッチとしての役割をはたしている可能性も考えられる.
5.4番目の活性残基の発見
AgoのPIWIドメインはAsp-Asp-His(DDH)またはAsp-Asp-Asp(DDD)という3残基の触媒中心を使って標的RNAを切断すると長らく信じられてきた12,14,15,19,23,24,27-29).しかしながら,K. polysporus Agoの構造において,PIWIドメインのループに存在するグルタミン酸残基が活性中心に挿入されており,RNase Hに似たAsp-Glu-Asp-Asp(DEDD)という4残基触媒中心の形成されていることが見い出された32)(図5).この観点から再度,これまでに構造決定された原核生物のAgoホモログやAgoの部分構造を検証してみると,新たにみつかった活性残基を含むループが活性中心に挿入された“plug-in”構造をとっているものがみられる一方で28,29),活性中心に別のループが挿入され4残基触媒中心の形成がブロックされている“unplugged”構造がいくつかのAgoの結晶構造においてみられることが判明した19,27)(図5).ヒトAgo2においても,K. polysporus Agoと同様に,新たにみつかった活性残基を含むループが活性中心に挿入された“plug-in”構造がみられた30,31).現時点では,活性部位の構造がどのようにplug-inとunpluggedとのあいだで切り替わっているのかはわかっていないが,RNAとの結合状態に対応して全体的なドメインの配置が変化することにより,活性型の4残基触媒中心がダイナミックに形成されている可能性がある.このように,4番目の活性残基の発見はAgoの構造変化と生物学的な機能との密接な結びつきを示している.
6.2つのトリプトファン結合ポケット
Agoは標的RNAの切断を触媒するだけではなく,下流でRNAサイレンシングに機能するタンパク質を動員するプラットフォームとしても機能する.これらのタンパク質の多くはグリシン残基とトリプトファン残基に富んだ領域(GWリッチ領域)をもつという特徴がある.このようなRNAサイレンシングに機能するタンパク質としてもっとも研究の進んでいるGW182(TNRC6としても知られている)は,GWリッチ領域を介してAgoに結合し,miRNA経路における翻訳の抑制やポリA鎖の短縮に重要な役割をはたしている33).では,GW182はどのようにしてAgoと結合するのだろうか? ヒトAgo2の報告の一方では,L-トリプトファンとの共結晶構造解析によりPIWIドメインに2つ並んで存在するトリプトファン結合ポケットが同定された31)(図6).この2つのポケットのあいだの距離は柔軟なアミノ酸リンカーの長さおよそ8残基分に相当しており,複数のトリプトファン残基が点在しているGWリッチ領域に対する結合ポケットという性質に合致していた.過去の変異体解析の結果によると,今回,同定されたトリプトファン結合ポケットを破壊するような変異の導入は,AgoのRNA結合能には影響をあたえずGW182との結合を阻害する一方で19,34),PAZドメインやMIDドメインへの変異の導入では,small RNAの結合を阻害するもののGW182への結合に影響はみられない34-37).これらの結果は,Agoにおいてsmall RNAの取り込みとGW182との結合とは独立して起こることを示している.
おわりに
今回,報告された真核生物型Agoの構造に関する3つの論文により,標的RNAを正確に認識し遺伝子の発現を負に制御するというRISCの作用機序について,Agoの立体構造とその構造変化との密接なかかわりに新たな光があてられた.しかし,RISCそのものの形成過程についてはまだ多くの謎が残されている.RNAサイレンシングにおけるつぎの大きな課題は,RNAの取り込み,パッセンジャー鎖の放出,機能複合体の形成,標的RNAのサイレンシング,そして,ターンオーバーの過程を解明することにほかならない.構造生物学のさらなる進歩が“RISCの一生”におけるAgoとRNAとの動的な相互作用をより精密な視点から解き明かすことに期待したい.
文 献
- Fire, A., Xu, S., Montgomery, M. K. et al.: Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature, 391, 806-811 (1998)[PubMed]
- Elbashir, S. M., Harborth, J., Lendeckel, W. et al.: Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature, 411, 494-498 (2001)[PubMed]
- Tomari, Y. & Zamore, P. D.: Perspective: machines for RNAi. Genes Dev., 19, 517-529 (2005)[PubMed]
- Hutvagner, G. & Simard, M. J.: Argonaute proteins: key players in RNA silencing. Nat. Rev. Mol. Cell Biol., 9, 22-32 (2008)[PubMed]
- Ghildiyal, M. & Zamore, P. D.: Small silencing RNAs: an expanding universe. Nat. Rev. Genet., 10, 94-108 (2009)[PubMed]
- Kawamata, T. & Tomari, Y.: Making RISC. Trends Biochem. Sci., 35, 368-376 (2010)[PubMed]
- Hammond, S. M., Boettcher, S., Caudy, A. A. et al.: Argonaute2, a link between genetic and biochemical analyses of RNAi. Science, 293, 1146-1150 (2001)[PubMed]
- Lingel, A., Simon, B., Izaurralde, E. et al.: Structure and nucleic-acid binding of the Drosophila Argonaute 2 PAZ domain. Nature, 426, 465-469 (2003)[PubMed]
- Yan, K. S., Yan, S., Farooq, A. et al.: Structure and conserved RNA binding of the PAZ domain. Nature, 426, 468-474 (2003)[PubMed]
- Song, J. J., Liu, J., Tolia, N. H. et al.: The crystal structure of the Argonaute2 PAZ domain reveals an RNA binding motif in RNAi effector complexes. Nat. Struct. Biol., 10, 1026-1032 (2003)[PubMed]
- Ma, J. B., Ye, K. & Patel, D. J.: Structural basis for overhang-specific small interfering RNA recognition by the PAZ domain. Nature, 429, 318-322 (2004)[PubMed]
- Parker, J. S., Roe, S. M. & Barford, D.: Crystal structure of a PIWI protein suggests mechanisms for siRNA recognition and slicer activity. EMBO J., 23, 4727-4737 (2004)[PubMed]
- Lingel, A., Simon, B., Izaurralde, E. et al.: Nucleic acid 3'-end recognition by the Argonaute2 PAZ domain. Nat. Struct. Mol. Biol., 11, 576-577 (2004)[PubMed]
- Parker, J. S., Roe, S. M. & Barford, D.: Structural insights into mRNA recognition from a PIWI domain-siRNA guide complex. Nature, 434, 663-666 (2005)[PubMed]
- Ma, J. B., Yuan, Y. R., Meister, G. et al.: Structural basis for 5'-end-specific recognition of guide RNA by the A. fulgidus Piwi protein. Nature, 434, 666-670 (2005)[PubMed]
- Parker, J. S., Parizotto, E. A., Wang, M. et al.: Enhancement of the seed-target recognition step in RNA silencing by a PIWI/MID domain protein. Mol. Cell, 33, 204-214 (2009)[PubMed]
- Frank, F., Sonenberg, N. & Nagar, B.: Structural basis for 5'-nucleotide base-specific recognition of guide RNA by human AGO2. Nature, 465, 818-822 (2010)[PubMed]
- Boland, A., Tritschler, F., Heimstadt, S. et al.: Crystal structure and ligand binding of the MID domain of a eukaryotic Argonaute protein. EMBO Rep., 11, 522-527 (2010)[PubMed]
- Boland, A., Huntzinger, E., Schmidt, S. et al.: Crystal structure of the MID-PIWI lobe of a eukaryotic Argonaute protein. Proc. Natl. Acad. Sci. USA, 108, 10466-10471 (2011)[PubMed]
- Tian, Y., Simanshu, D. K., Ma, J. B. et al.: Structural basis for piRNA 2'-O-methylated 3'-end recognition by Piwi PAZ (Piwi/Argonaute/Zwille) domains. Proc. Natl. Acad. Sci. USA, 108, 903-910 (2011)[PubMed]
- Zeng, L., Zhang, Q., Yan, K. et al.: Structural insights into piRNA recognition by the human PIWI-like 1 PAZ domain. Proteins, 79, 2004-2009 (2011)[PubMed]
- Simon, B., Kirkpatrick, J. P., Eckhardt, S. et al.: Recognition of 2'-O-methylated 3'-end of piRNA by the PAZ domain of a Piwi protein. Structure, 19, 172-180 (2011)[PubMed]
- Song, J. J., Smith, S. K., Hannon, G. J. et al.: Crystal structure of Argonaute and its implications for RISC slicer activity. Science, 305, 1434-1437 (2004)[PubMed]
- Yuan, Y. R., Pei, Y., Ma, J. B. et al.: Crystal structure of A. aeolicus argonaute, a site-specific DNA-guided endoribonuclease, provides insights into RISC-mediated mRNA cleavage. Mol. Cell, 19, 405-419 (2005)[PubMed]
- Rivas, F. V., Tolia, N. H., Song, J. J. et al.: Purified Argonaute2 and an siRNA form recombinant human RISC. Nat. Struct. Mol. Biol., 12, 340-349 (2005)[PubMed]
- Rashid, U. J., Paterok, D., Koglin, A. et al.: Structure of Aquifex aeolicus argonaute highlights conformational flexibility of the PAZ domain as a potential regulator of RNA-induced silencing complex function. J. Biol. Chem., 282, 13824-13832 (2007)[PubMed]
- Wang, Y., Sheng, G., Juranek, S. et al.: Structure of the guide-strand-containing argonaute silencing complex. Nature, 456, 209-213 (2008)[PubMed]
- Wang, Y., Juranek, S., Li, H. et al.: Structure of an argonaute silencing complex with a seed-containing guide DNA and target RNA duplex. Nature, 456, 921-926 (2008)[PubMed]
- Wang, Y., Juranek, S., Li, H. et al.: Nucleation, propagation and cleavage of target RNAs in Ago silencing complexes. Nature, 461, 754-761 (2009)[PubMed]
- Elkayam, E., Kuhn, C.-D., Haase, A. D. et al.: The structure of human Argonaute-2 in complex with miR-20a. Cell, 150, 100-110 (2012)[PubMed]
- Schirle, N. T. & MacRae, I. J.: The crystal structure of human Argonaute2. Science, 336, 1037-1040 (2012)[PubMed]
- Nakanishi, K., Weinberg, D. E., Bartel, D. P. et al.: Structure of yeast Argonaute with guide RNA. Nature, 486, 368-374 (2012)[PubMed] [新着論文レビュー]
- Huntzinger, E. & Izaurralde, E.: Gene silencing by microRNAs: contributions of translational repression and mRNA decay. Nat. Rev. Genet., 12, 99-110 (2011)[PubMed]
- Eulalio, A., Helms, S., Fritzsch, C. et al.: A C-terminal silencing domain in GW182 is essential for miRNA function. RNA, 15, 1067-1077 (2009)[PubMed]
- Liu, J., Rivas, F. V., Wohlschlegel, J. et al.: A role for the P-body component GW182 in microRNA function. Nat. Cell. Biol., 7, 1261-1266 (2005)[PubMed]
- Miyoshi, K., Okada, T. N., Siomi, H. et al.: Characterization of the miRNA-RISC loading complex and miRNA-RISC formed in the Drosophila miRNA pathway. RNA, 15, 1282-1291 (2009)[PubMed]
- Rudel, S., Wang, Y., Lenobel, R. et al.: Phosphorylation of human Argonaute proteins affects small RNA binding. Nucleic Acids Res., 39, 2330-2343 (2011)[PubMed]
著者プロフィール
略歴:2011年 東京大学大学院理学系研究科博士課程 修了,同年より東京大学分子細胞生物学研究所 助教.
研究テーマ:1分子イメージングによるRISC形成の解析.
関心事:何を研究するかというテーマ以上に,どうやって研究するかというアプローチのことをいつも考えてしまいがちです.
泊 幸秀(Yukihide Tomari)
東京大学分子細胞生物学研究所 准教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/tomari/
© 2012 佐々木 浩・泊 幸秀 Licensed under CC 表示 2.1 日本