プログラム細胞死:その分子機序と発生における生理的な役割
2012/09/01
三浦 正幸
(東京大学大学院薬学系研究科 遺伝学教室)
email:三浦正幸
領域融合レビュー, 1, e002 (2012) DOI: 10.7875/leading.author.1.e002
Masayuki Miura: Molecular mechanisms and physiological functions of programmed cell death during development.

受精から発生の進むなか,細胞が死んでいく現象が知られている.しかし,発生という新たなものをつくっていくプロセスにおいて,つくられたものをわざわざ取り除いていくという,いっけん,むだとも思える現象が市民権を得るまでには時間がかかった.20世紀初頭,発生のしくみを研究していた一大研究グループは胚の誘導現象を発見したSpemannらであったが,この一派は,新しい細胞を発展的に生み出していく発生のプロセスに細胞死が含まれることを,はじめは受け入れられなかったようであった.しかし,のちの神経細胞死の研究から細胞の生存に必要な神経栄養因子の存在が明らかになり,さらに,線虫を用いた遺伝学的な研究からアポトーシスの遺伝学的な制御機構が明らかになった.そして,アポトーシスを遺伝学的に操作することができるようになったことで,細胞死の生体における機能を問う研究が可能になってきた.ここでは,アポトーシスを中心としたプログラム細胞死の発生における生体機能について解説する.
Hamburgerの総説によると1),発生において細胞死を意識して研究を行ったのはドイツHeidelberg大学のKallius一派が最初で,そのなかには,すぐれた総説を書いたErnstやGl?cksmannがいた.Gl?cksmannは1930年および1951年の総説において,脊椎動物の発生における細胞死の役割を機能面から以下の3つにまとめている2).1)形態形成における細胞死:初期胚における陥入や膨出といった細胞運動にともなって起こる細胞死,2)組織形成における細胞死:組織や器官の形成において分化した細胞ができてくる過程にみられる細胞死,3)系統発生における細胞死:進化的に上位な生物では発生のときにそれより下位の生物に存在する構造が一過性に出現しのちに失われる.形態形成における細胞死は上皮の変形や融合において広汎に観察され,神経管の閉鎖あるいは眼包や耳包の形成の際の細胞死が例としてあげられている.組織形成における細胞死の役割を論じている箇所では興味深い考察がなされている.死んだ細胞から放出されるリボ核酸がまわりの細胞になんらかの誘導的な作用をもたらすのではないかというものである.細胞死が不要な細胞の除去という消極的な生命現象であることをこえ,発生の進行に積極的にかかわることを議論している点で注目される.この考えは,いわばSpemann一派の,発生のしくみを一連の誘導的な現象の連続による因果関係にもとめる考えに類似している.
Gl?cksmannの総説にみられるように,先見性のある考えはあったが,発生における細胞死はアポトーシスの形態をとる静かな細胞死であり,まわりに影響することなく不要な細胞として除去されるものと一般には理解されていた.しかし,のちに述べるように,近年,ショウジョウバエにおける代償性増殖の実験やヒドラにおける再生の実験から,アポトーシスを起こした細胞はまわりに積極的に増殖因子を放出して細胞の増殖を促すことが明らかにされた.
脊椎動物においては,形態形成に必要なモルフォゲンを分泌する組織の一部がしばしば細胞死により失われていくことが観察されている.たとえば,肢を形成する際にFGFを分泌する外胚葉性頂堤や,それに応答してShhを分泌する極性化活性帯は,形態形成に必要なシグナルを分泌するシグナルセンターとしての役割をもつが,これらの領域はシグナルを発したあとは細胞死により失われていく(図1).
1900年代中ごろ,Spemann一派の発生学者は,分裂,分化,そして,誘導を発生プロセスの基本と考えていた.ゆえに,発生において細胞死により生じる現象を観察しても,それに対し異なった解釈をあたえていた.つまり,発生の途中の脊髄の知覚神経節や運動神経核における細胞数の減少は,細胞が必要とされる部位へと移動したことによるとの解釈である.同じ現象を観察した,Spemann学派の影響をうけなかったイタリアの神経科学者Levi-Montalciniの解釈は異なった.細胞数の減少は神経細胞死によると考えたのである.そののち,Levi-MontalciniとHamburgerらの研究から,神経の支配する標的組織からの影響により神経の生存は維持されているとのコンセプトが提出された.そして,神経栄養因子(nerve growth factor:NGF)が発見され,神経細胞死はその制御機構とともに注目されるようになった.1972年,Kerr,Wyllie,Currieは,さまざまな組織の観察から,細胞死には2つのタイプがあるとした.アポトーシス(apoptosis)とネクローシス(necrosis)である.アポトーシスはギリシャ語で落葉を意味する言葉である.Kerrらが,さまざまな組織の細胞死をていねいに観察しその形態に共通な性質があるとし,アポトーシスという名称をつけ概念化した意味は大きい3).1992年,Raffは,すべての細胞はその生存を細胞社会に依存しているとの総説を書き,生存因子の作用の一般性をいった.
神経細胞死はNGFにより制御可能であったことから,そのしくみに関する研究が培養神経細胞を用いて行われた.1988年,Johnsonらは,NGFの除去による交感神経の細胞死は,RNAやタンパク質の活発な生合成を必要とする現象であると発表した4).アポトーシスが遺伝子の制御をうけることを示唆する結果である.そして,アポトーシスの遺伝的な制御に関するより直接的な研究が,線虫を用いて行われた.
NGFの除去による神経細胞死に遺伝子の発現が必要なことは実験的に示されたが,プログラム細胞死の実行における遺伝的な制御については,皆目見当のつかない状態であった.この状況に終止符をうったのは,線虫を用いた分子遺伝学的な研究であった.線虫Caenorhabditis elegansは体が透明で発生が観察しやすく,受精卵からの細胞系譜がすべて明らかにされている唯一の多細胞動物である.線虫のからだづくりでは,必ず決まった細胞系譜から1090個の細胞が生まれ131個の細胞が死んでいく.まさに,遺伝的にプログラムされた細胞死が発生において実行されているわけである.
線虫の細胞死に注目した研究は1980年代からはじまった.Hedgecockらは,細胞死のプロセスに異常を示すはじめての変異体,ced-1変異体とced-2変異体(ced:cell death abnormal)を発表し,細胞死が遺伝的に制御されていることを示した.このとき得られた変異体は,細胞死の実行ではなく,死んだ細胞の貪食に影響するものであった.線虫の細胞死のプロセスを観察すると,死ぬべき細胞が生まれて死んで貪食されるまで2時間もかからないので,からだの異なった場所で散発的に起こる細胞死の全体を観察するのはむずかしい.しかし,ced-1変異体およびced-2変異体では死細胞が貪食されず生体に残るため,過去に細胞死の起こったことを知るのが容易になったのである.つづいて,Horvitzの研究室において,ced-1変異体を用い細胞死の実行されない変異体(つまり,細胞の死骸の出てこない変異体)のスクリーニングが行われ,画期的な変異体ced-3が得られた5).egl-1変異体では陰門にある産卵に必要な筋肉を支配する神経が細胞死を起こして失われるため産卵ができなくなる.このegl-1変異体とced-3変異体との二重変異体は,細胞死が抑制されるため産卵不全の表現型が回復する.egl-1変異体の表現型は観察しやすく,ced-3遺伝子の対立遺伝子を同定するスクリーニングに好都合であった.egl-1変異体との二重変異により産卵が可能になる変異体をスクリーニングすることにより,ced-3遺伝子の対立遺伝子が得られたほか,新規の遺伝子ced-4も同定された5).そしてさらに,細胞死の制御における機能獲得型の変異体としてced-9変異体が得られた6).
そののち,それぞれの変異体の原因遺伝子がクローニングされると,そのすべてが哺乳類においても保存された遺伝子であり,アポトーシスの制御の中心となるタンパク質がこの一連のスクリーニングにより同定された.Ced-3はタンパク質分解酵素のひとつカスパーゼ,Ced-4はその活性化タンパク質Apaf-1,Ced-9はCed-4の活性化を阻害するBcl-2ファミリータンパク質,Egl-1はBcl-2ファミリータンパク質のはたらきを抑制するタンパク質BH3 only proteinをコードしていた.2002年,線虫遺伝学の基礎を構築したBrenner,線虫の細胞系譜を明らかにしたSulston,線虫における細胞死の経路を明らかにしたHorvitzの3名に,ノーベル医学生理学賞が授与された.
線虫ではプログラム細胞死に必要なカスパーゼはCed-3のみであるのに対し,ショウジョウバエや哺乳類では複数のカスパーゼが細胞死にかかわっている.すべてのカスパーゼは活性のほとんどない前駆体として生合成される.N末端からプロドメイン,p20,p10に分けられるが,カスパーゼはプロドメインの構造と基質の特性からサブタイプに分類される.長いプロドメインはタンパク質間の相互作用を担うCARDあるいはDEDから構成されていて,細胞死の刺激に依存してこのCARDあるいはDEDにほかのアダプタータンパク質が結合することによりカスパーゼは多量体となり活性化する.このタイプのカスパーゼはイニシエーターカスパーゼとよばれ,その活性化がカスパーゼ活性化カスケードの開始シグナルとなる.短いプロドメインをもつカスパーゼ3,カスパーゼ6,カスパーゼ7は,上流のイニシエーターカスパーゼによりp20とp10に切断されて強い活性をもつようになる.これらエフェクターカスパーゼが活性化されると,さまざまな基質が切断されて細胞死が実行される.現在までに,1000以上のエフェクターカスパーゼの基質が見い出されている.イニシエーターカスパーゼに分類されるカスパーゼ8の基質としてはBH3 only proteinであるBidが知られ,この切断産物であるtBidがミトコンドリア経路のアポトーシスを開始させる.しかし,エフェクターカスパーゼと比較して,イニシエーターカスパーゼの基質は下流のエフェクターカスパーゼやBid以外ほとんど知られていない.
線虫では,ミトコンドリアに局在するBcl-2ファミリータンパク質CED-9にCED-4が結合している.プログラム細胞死を起こす細胞ではBH3 only proteinであるEgl-1の発現が誘導される.その結果,Ced-9とCed-4との結合がCed-9とEgl-1とに置き換わり7),ミトコンドリアから離れたCed-4がCed-3と結合することによりCed-3が活性化され細胞死が実行される8,9)(図2).
Wangらは,生化学的な手法により哺乳類におけるカスパーゼ活性化の機構を明らかにした.彼らは,HeLa細胞の細胞質画分の抽出液にハムスターの肝臓に由来する核を入れ,dATPをくわえるとカスパーゼ3が活性化されて核の凝縮が起こるというin vitro細胞死誘導系を構築した.dATPに依存的なカスパーゼ3の活性化に必要なタンパク質をHeLa細胞の細胞質画分の抽出液から精製し,3つのApaf(apoptotic protease-activating factor)タンパク質がカスパーゼ3の活性化に必要なことを示した.それぞれのタンパク質を精製して構造を決めたところ,Apaf-1はCED-4のホモログ,Apaf-2はシトクロムc,Apaf-3はカスパーゼ9であった.アポトーシスのシグナルをうけた細胞では,シトクロムcがミトコンドリアから細胞質へと放出されてアダプタータンパク質Apaf-1と複合体を形成する.シトクロムcの放出を制御するのがBcl-2ファミリータンパク質である.七量体をとるApaf-1-シトクロムc複合体(この複合体を,アポプトソームとよぶ)にイニシエーターカスパーゼであるカスパーゼ9がリクルートされ,これが多量体化することで活性化する(図2).Apaf-1はシトクロムcと結合するWD40リピートをもつが,線虫のCED-4にこのドメインはない.ショウジョウバエおよびマウスにはWD40リピートのないApaf-1のスプライシングバリアントが存在し,このバリアントはシトクロムcに非依存的にカスパーゼを活性化できる.
ショウジョウバエのApaf-1はほかのタンパク質を必要とせずに八量体を形成し,イニシエーターカスパーゼDroncをリクルートしてこれを活性化する.しかし,生体においてはDiap1がDroncに結合しその活性を抑制しているため細胞死は誘導されない.Diap1はRINGドメインをもつユビキチンリガーゼであり,結合したカスパーゼの安定性も制御している.細胞死の刺激をうけた細胞ではreaper遺伝子,hid遺伝子,grim遺伝子(RHG遺伝子とよばれる)が発現し,これらの遺伝子産物がDiap1と結合することでその自己ユビキチン化を促進し分解へと導く.その結果,Droncの活性化,そして,下流のエフェクターカスパーゼDriceやDcp1が活性化されアポトーシスが誘導される10)(図2).
カスパーゼ活性化経路に関しては,細胞外からのリガンドにより開始される外因性経路(これに対して,ミトコンドリアを経由するカスパーゼ活性化経路を内因性経路という)がある.Fasリガンド-Fas,TNF-TNF受容体がそのプロトタイプとして知られている.線虫では外因性経路は知られていないが,ショウジョウバエにはTNFのホモログEigerとその受容体Wengenがある.しかし,カスパーゼ活性化経路が保存されているわけではなく,JNKの活性化に依存した細胞死を誘導する11).
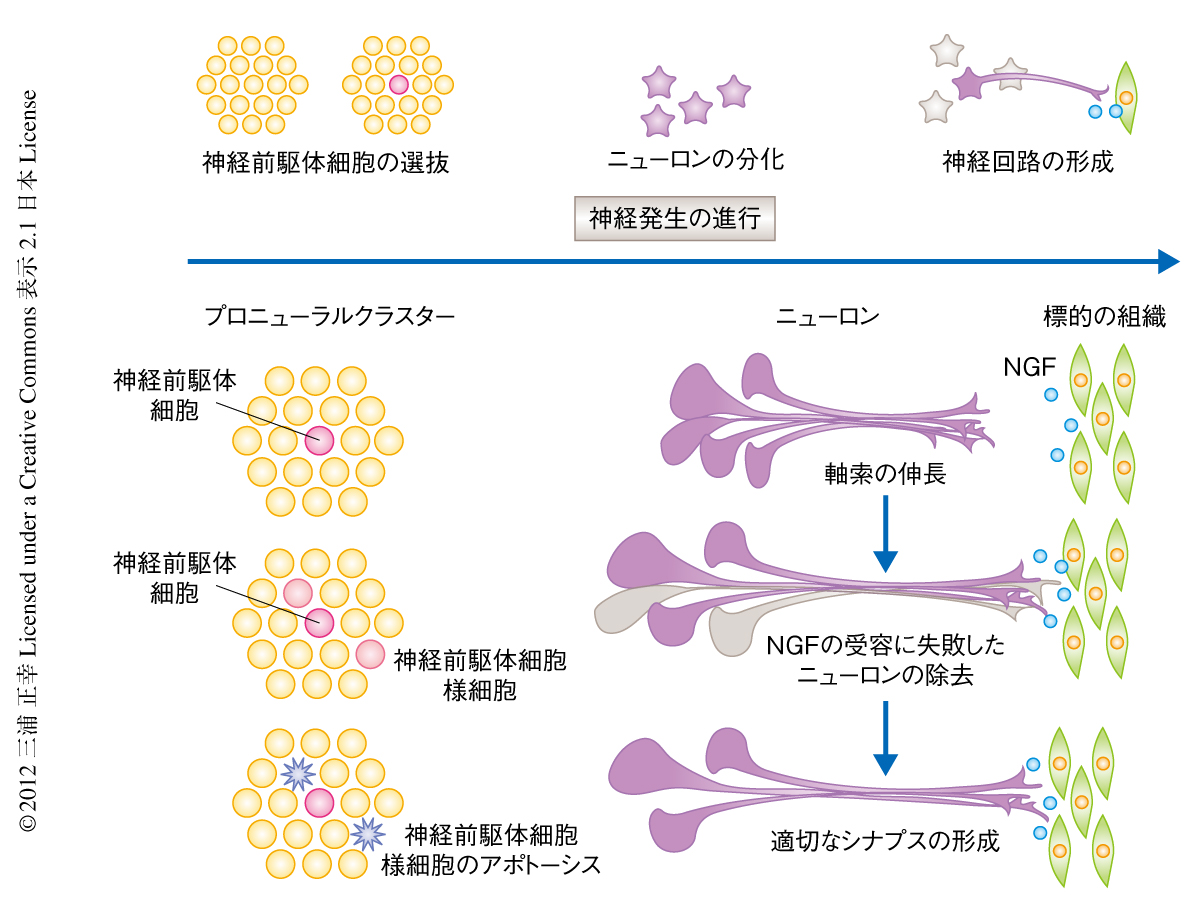
多細胞生物の発生においては散発的に細胞死が起こるが,このような死細胞はいったいどのような性質をもつ細胞なのだろうか.細胞の増殖や分化の際にエラーが生じ,そのような細胞が発生の過程で取り除かれることは想像にかたくないが,はたしてそうなのか.生体において細胞分化のプロセスを細かに観察することが,分化の際にエラーの生じた細胞を調べるいちばん直接的な方法である.このような研究には,1細胞の解像度での生体イメージングが可能で,かつ,多様な分化マーカーの利用できる細胞系譜が有効である.ショウジョウバエの蛹期に形成される中胸背毛は,機械受容器としてはたらく末梢感覚器である.感覚器前駆体細胞(sensory organ precursor:SOP)がプロニューラルクラスターに生じ,そののち,非対称分裂により感覚器が形成される.このしくみに関しては遺伝学的な研究の豊富な蓄積があり,分化マーカーも充実している.さらに,感覚器前駆体細胞からの外感覚器の全発生過程は蛹期においてからだの表面で起こるので,長時間の安定した生体イメージングが可能である.感覚器前駆体細胞の生じたことはneuralized(neu)遺伝子(ユビキチンリガーゼをコードし,Notchの活性化に必要なDeltaのエンドサートーシスを促進する)の発現がオンになることでわかる.感覚器前駆体細胞が生まれるとその細胞はDeltaを発現し,まわりの細胞のNotchを活性化してそれらが神経系細胞となるのを抑制するため(側方抑制),近接した細胞に感覚器前駆体細胞は出現しないことが遺伝学的な研究から示されている.ところが,感覚器前駆体細胞の出現をneu遺伝子の発現を指標に生体イメージングにより観察したところ,将来,感覚器前駆体細胞となる細胞の近傍にneu陽性の細胞が出現することが明らかになった.このような感覚器前駆体細胞様細胞のほとんどは,いちど分裂したのちアポトーシスにより生体から除かれた.
感覚器前駆体細胞様細胞は非対称分裂をせず,neu遺伝子の発現が持続しなかった.正常に感覚器前駆体細胞となった細胞ではまわりの細胞に比べNotchの活性がすみやかに低下していくが,感覚器前駆体細胞様細胞にはまわりの細胞と同様に高いNotchの活性がみられた.この観察結果は,神経系細胞のマーカーであるneu遺伝子を発現した感覚器前駆体細胞様細胞は,その性質に矛盾の生じた,分化に失敗した細胞であることを示していた.このような感覚器前駆体細胞様細胞は本来の感覚器前駆体細胞に対し20%の割合で生じ,そのほとんどはアポトーシスにより失われた.Notchヘテロ変異体では20%多くに感覚器前駆体細胞が生じ,その分だけ余分な中胸背毛が生じたことから,感覚器前駆体細胞様細胞の出現とアポトーシスの制御にはNotch遺伝子のかかわっていることが考えられた.このように,生体イメージングにより分化に失敗した細胞の存在が明らかになり,外感覚器の配置パターンは,側方抑制だけでなく,発生において生じるエラーをアポトーシスが取り除くことで完成することが示された.アポトーシスの機能として,発生の過程で生じた不要な細胞あるいは危険な細胞の除去がいわれてきたが,それにくわえ,細胞社会のなかで細胞が特殊化していくプロセスにおいて,分化に不具合の生じた細胞を除去することにより発生において生じるノイズの消去を行っていることが明らかになった12)(図3).
大量のアポトーシスが観察される発生現象のひとつに,Gl?cksmannも形態形成における細胞死の例としてとりあげている神経管の閉鎖がある.神経管とは脳や脊髄のもととなる器官であり,板状の神経板の左右の両端が筒状の神経管となるよう融合する神経管閉鎖をへて形成される.致死的な先天的奇形である外脳症や無脳症,発症率の高い水頭症や二分脊椎の原因のひとつは,神経管閉鎖の異常であると考えられている.アポトーシスを起こした細胞は通常はすぐに除去されてしまい,取り出した胚を固定して調べるというこれまでの研究手法により検出できるものはごく一部にすぎない.さらに,哺乳類の神経管閉鎖は子宮の内部で進行するため生体イメージングによる観察はむずかしく,既存の組織学的な研究手法ではアポトーシスの有無と神経管閉鎖の成否という結果の判定しかできず,両者の関係性を詳細に解析することはむずかしかった.
そこで,細胞死誘導シグナルの流れを調べる目的で,蛍光共鳴エネルギー移動(fluorescence resonance energy transfer:FRET)によりカスパーゼの活性化を可視化できるプローブを用いた生体イメージング解析が行われた.その結果,頭部の神経管閉鎖の過程においてアポトーシスを起こした細胞には,少なくとも2種類のふるまいがあることがわかった.通常,カスパーゼ3を活性化しアポトーシスを起こした細胞は断片化し,すぐに近傍の組織に飲み込まれることで取り除かれることが知られている.しかし,頭部の神経管閉鎖の過程ではこれらの断片化する死細胞にくわえ,断片化せずに組織から脱落し長時間そこにとどまる細胞のあることが明らかになった.さらに,生体イメージングにより頭部の神経管閉鎖においてその速度の測定が可能となったが,アポトーシスを阻害した場合には神経管閉鎖の速度が顕著に減少することが明らかになった.また,アポトーシスを欠損したときには神経管の閉鎖が一進一退するようすも観察された.これらの結果から,アポトーシスは頭部の神経板の形態変化に寄与することで神経管閉鎖の円滑な進行に貢献していることが示唆された13).
正常な発生の過程では,頭部の神経管閉鎖ののち急激な脳室の拡大が生じるため,神経管閉鎖が一定の時間内に終了することはのちの脳の発生にとり非常に重要だと考えられる.このように,アポトーシスは円滑な形態形成運動の遂行にはたらくことで,正常な脳のかたちづくりに貢献している.アポトーシスによる細胞死が,不要な細胞の除去にくわえ,形態形成運動に必要な力の制御にもかかわることは,ショウジョウバエの胚における背部の閉鎖14) や,雄の外生殖器の回転運動15) でも示唆されている.さらに,後述するように,シグナルタンパク質の分泌によっても発生の進行に積極的にかかわることが考えられる.
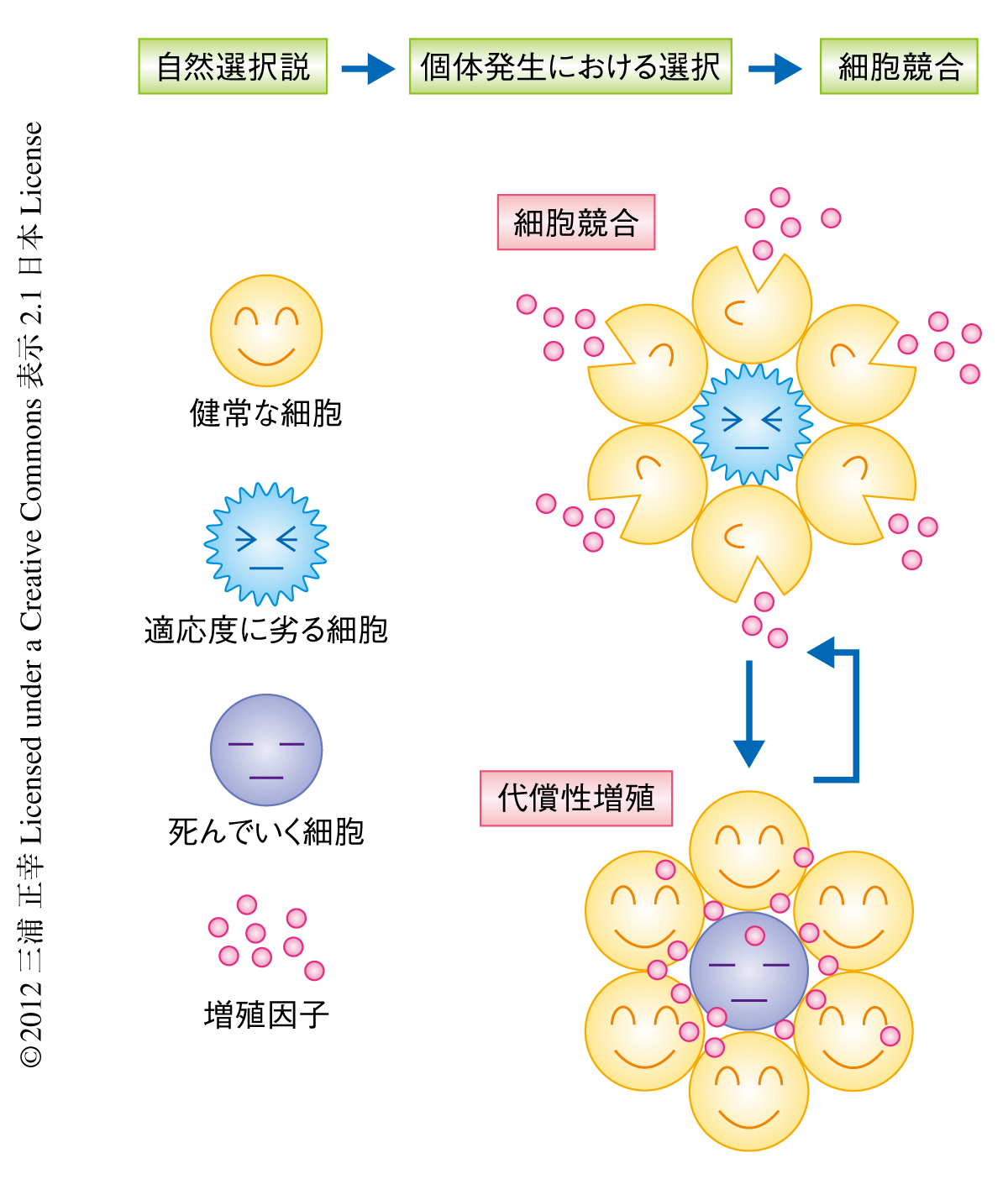
19世紀後半,Rouxは,個体発生においても細胞間の競合があって,適切なものが選択されていくというダーウィン進化論に影響をうけた考えを提示した.そののち,細胞競合という現象が実験的に知られるようになったのは,Morataらの,ショウジョウバエを用いたMinute変異クローンの解析による.Minute変異ではリボソームの合成が低下し,そのヘテロ接合体は野生型に比べ細胞の増殖能が劣る.Minuteヘテロ変異体のクローンを野生型のショウジョウバエにおいて未分化な上皮細胞の集団である翅成虫原基に形成させると,そのクローンははじめ小さな細胞集団をつくるが,そののち,細胞集団から積極的に失われていく.翅成虫原基の細胞すべてがMinuteヘテロ変異体であるときにはこのような現象は観察されないことから,Minuteヘテロ変異体のクローンの除去は増殖能の異なる細胞集団(野生型とMinuteヘテロ変異体)が共存した場合に細胞競合が起こるためであると解釈された.この現象はカスパーゼ阻害タンパク質p35の発現により抑制の可能であったことから,カスパーゼによるアポトーシスの誘導の関与していることがわかった16).
細胞競合はMinute変異クローンでのみ起こるわけではなく,増殖能の異なる細胞集団が共存した場合に観察される例が報告されている.翅成虫原基においてdMyc遺伝子の発現量の異なるクローンを形成すると,dMyc遺伝子の発現量の少ないクローンの周辺の細胞集団が除去された.このようなdMyc遺伝子を過剰に発現した細胞は超競合者(super competitor)とよばれる.眼成虫原基を用いた細胞競合にかかわる遺伝子のスクリーニングにより,Wartsがん抑制遺伝子経路にかかわる遺伝子(expanded遺伝子,hippo遺伝子,Salvador遺伝子,mats遺伝子,fat遺伝子)に変異をもつと,それらの細胞集団は超競合者としてふるまうことが示された.一方,頂底極性遺伝子(scribble遺伝子,discs large遺伝子)は,その変異体は成虫原基の過増殖による腫瘍を形成するが,成虫原基において変異クローンを形成すると細胞競合により組織から除去された.Eigerによる細胞死経路はscribble変異クローンとの細胞競合による細胞死にかかわる17).細胞競合の起こる境界領域をくわしく調べた結果,細胞競合により死んでいく細胞は境界に限局して存在し,死んだ細胞はまわりの上皮細胞に貪食されることが示された.境界領域における細胞の貪食は,死んだ細胞の除去だけではなく,積極的に細胞死をひき起こす役割をもつことを示す結果も報告されている18).
完全変態をするショウジョウバエでは,幼虫でつくられた組織のほとんどが成虫細胞に置き換わる.この組織の入れ替わり(組織再構築)では,組織芽細胞の増殖と幼虫細胞の除去とが協調して起こるが,両者の関係は細胞競合に似たところがある.成虫の表皮をつくる組織芽細胞は,体節ごと前後2つの細胞集団として胚期のおわりに生じ,そののちの幼虫期にはG2期において細胞周期が休止している.エクジソンの発現により蛹化を開始すると再び細胞分裂をはじめ,蛹期15時間以降には組織芽細胞の細胞集団の拡張が顕著になり幼虫の表皮細胞と置き換わっていく.このとき,幼虫の表皮細胞のアポトーシスを抑制すると組織芽細胞の増殖が抑制され,逆に,組織芽細胞の増殖を遺伝学的に抑制すると幼虫の表皮細胞のアポトーシスは大幅に遅れたことから,アポトーシスと増殖とは相互にかかわりあった現象であることがわかった.
さきに述べた,カスパーゼの活性化を可視化できるFRETプローブを用いて生体イメージング解析を行ったところ,カスパーゼ3様の活性は幼虫の表皮にランダムにみられるのではなく,組織芽細胞と接する境界領域の幼虫の表皮細胞において高頻度に観察された.境界領域におけるカスパーゼの活性化は組織芽細胞の増殖を遺伝学的に抑制したこと,あるいは,近紫外線レーザーを用いて境界領域だけで増殖を遅らせるとこのカスパーゼの活性はみられなくなったことから,境界領域で増殖する組織芽細胞がカスパーゼ活性化の引き金を担っているものと考えられた.増殖とアポトーシスとの連関の起こる再編の境界が順次進行していくことは,組織全体のサイズを変更せずに組織の入れ替わりをなしとげる有効なしくみである.増殖しては境界領域において細胞死を誘導し,また,細胞死は境界領域においてつぎの増殖を促進することで,整然とした細胞の入れ替わりが起こる19).境界領域においてアポトーシスを起こした細胞から放出されたDppが,近傍の組織芽細胞に作用してその浸潤と拡張性を制御している20).
組織は一定の数の細胞により構成されていて,生体には発生や再生においてなんらかの方法により組織の定足数を保つしくみが備わっている.細胞競合では,競合により負けた細胞が翅成虫原基において失われても成虫原基のサイズに変化はない.これは失われた細胞のまわりの細胞が増殖し,適切な組織のサイズを認識して増殖を停止するからである.このような細胞死により誘導される増殖現象は代償性増殖とよばれている.
ショウジョウバエの翅成虫原基の後部区画にエフェクターカスパーゼ阻害タンパク質p35の遺伝子を発現させ,放射線を処理して翅成虫原基の全体にアポトーシスを誘導させた実験条件,あるいは,アポトーシス誘導遺伝子(reaper遺伝子やhid遺伝子)とp35遺伝子とを同時に発現させた実験条件では,翅成虫原基の後部区画において細胞死誘導シグナルはオンになるが,エフェクターカスパーゼが阻害されているためアポトーシスは阻止されている(ショウジョウバエのイニシエーターカスパーゼDroncはp35により阻害されない).この実験では,アポトーシスを起こさない細胞を人工的につくっていることになる.すると,後部区画において細胞の過増殖が観察された.この細胞ではJNKの活性化と細胞増殖を制御するwingless遺伝子やdpp遺伝子の発現の上昇が認められ,このアポトーシスを起こさない細胞は増殖シグナルを発していることが示唆された.しかし,DppやWinglessはアポトーシスを起こさない細胞の過増殖には必要であるが,傷害をうけた組織で起こる代償性増殖には必要ないことが報告され,現在のところ,発生や傷害のときの代償性増殖にどのような増殖シグナルがかかわるのかは不明である21).カスパーゼ変異体を用いた研究から,エフェクターカスパーゼの活性化か代償性増殖かの分岐は,イニシエーターカスパーゼDroncのレベルで起こることが明らかになった22).翅成虫原基の後部区画においてp35遺伝子とdronc遺伝子とを同時に発現させると,組織の激しい肥大とJNKの活性化,p53遺伝子の発現誘導が観察された.JNKは細胞ストレスにより活性化されるが,Droncの下流においてp53遺伝子の発現が誘導されたことは,p53遺伝子はDNAの傷害のみならず,細胞のストレスを感知して活性化されることを示唆していた23).
このように,増殖性の高い組織ではDroncの下流において増殖シグナルの発せられることが示されているが,G1期で細胞周期の停止している眼成虫原基の一部の細胞集団にhid遺伝子の発現による細胞死を誘導すると,その細胞集団からHedgehogが分泌されG1期で細胞周期の停止しているまわりの細胞に代償性増殖の誘導されることが示された24).この系にはdpp遺伝子もwingless遺伝子も関与せず,かつ,dronc遺伝子ではなくその下流のエフェクターカスパーゼをコードするdrice遺伝子およびdcp1遺伝子が代償性増殖に必要であった.このように,代償性増殖は細胞死の誘導される細胞集団により,異なるカスパーゼに依存して起こっていることがわかった.
細胞競合と代償性増殖はともに相補的な生命現象であると考えられる(図4).細胞競合(Minuteヘテロ変異体と野生型の接触,あるいは,dMyc遺伝子の発現量の異なる細胞集団の接触)の条件において死んでいく細胞集団にp35遺伝子を発現させて細胞死を抑制しても,過剰な代償性増殖は観察されない.細胞競合による細胞死はその境界領域で起こるが,アポトーシスを起こさない細胞の実験系ではクローンの全体において細胞死誘導シグナルがオンになっている.シグナルを発する細胞において集団効果(community effect)が生じているのかどうかの違いなのかもしれない.
定足数感知(quorum sensing,クオラムセンシング)は細菌においてみつかった現象で,分泌性の化学物質を用いて集団の密度を互いに感知し,化学物質(オートインデューサー)が一定の濃度をこえると一斉にそれに応答した行動をとるというものである.生物発光や病原性タンパク質の産生,細胞死の誘導による細菌集団の質的な管理が,この機構により制御されている25).定足数感知による細胞死の誘導は,利他的な行為により集団としての健常性を保つはたらきをもつものと考えられている26).多細胞動物でも同じようなしくみがはたらいているものと想定されるが,オートインデューサーのような定足数感知にかかわる分子の実体は明らかにされていない.
細胞競合や代償性増殖は,いわば,組織の修復による恒常性の維持機構ととらえることができ,再生と類似性がある.組織という細胞社会は細胞死と増殖とのバランスによりその恒常性が維持されている.アフリカツメガエルにおいてオタマジャクシの尾部を切断するとこれが再生するが,その際には再生芽の一部においてカスパーゼ3の活性化が観察され,その活性を阻害剤により抑制すると細胞死と細胞増殖の阻害が起こり再生しなくなる27).このことは,ショウジョウバエの変態の際の表皮の再編成と同様に,細胞死が増殖に積極的にかかわることを示唆している.
再生の際の代償性増殖はヒドラを用いた実験から示された.ヒドラを胃中央部(体のほぼ中央)で2分すると,頭部の再生領域にはアポトーシスが顕著にみられる.このアポトーシスを起こした細胞はWnt3を発現しまわりの細胞の増殖を促す.カスパーゼ阻害剤を処理するとアポトーシスが抑制され,かつ,再生が起こらなくなった.Wnt3をノックダウンするとやはり再生は阻害されたことから,ここでの代償性増殖にはWnt3が必要なことが示された28).
1900年代半ば,Hadornは,翅成虫原基の一部を切断してから成虫の腹腔にもどしてやると,数日で切断部位が再生するという実験系を確立した.切断端ではJNKの活性化が起こり,この活性を遺伝学的に抑制すると損傷の治癒が起こらなくなる.脚成虫原基の前後軸の境界においてDppが発現しているが,この領域のもっとも背側にweak pointとよばれる特別な場所がある.このweak pointにかかるように切断して成虫腹腔にもどすと,再生のとき脚から翅への分化の転換が高頻度に起こる.切断によるJNKの活性化はPolycomb群の遺伝子発現を抑制し,Polycomb群により転写の抑制されていた翅成虫原基のセレクター遺伝子vestigialの発現が誘導される29).この脚から翅への分化の転換は脚成虫原基にwingless遺伝子を過剰に発現させることによっても起こるが,この実験系においても切断のときと同様に増殖のさかんな芽体がweak pointに生じ30),vestigial遺伝子の発現誘導が起こる31).p53遺伝子やdronc遺伝子に変異のある場合,芽体の形成率は大きく低下したことから,再生のときの増殖や分化の転換にも代償性増殖において使われている細胞死誘導シグナルが関与しているものと考えられた23).眼成虫原基にカスパーゼ阻害遺伝子diap1の変異クローンを形成し,同時にp35遺伝子を発現させて代償性増殖を促すと,組織の肥大にくわえ複眼の一部に触角様の分化の転換が起こる32).
生物において恒常性を維持するしくみのなかで,負のフィードバックはなくてはないプロセスである.JacobとMonodが大腸菌において発見したラクトースオペロンは,代謝産物により遺伝子の発現抑制を制御するしくみである.恒常性を細胞集団という,よりマクロなレベルで考えると,大腸菌はEDFという5つのアミノ酸残基からなるペプチドをオートインデューサーとして細胞外に放出することにより,細胞死を誘導し集団としての過剰な増殖を負に制御している33).単細胞が増殖するのとは異なり,受精卵が分裂を重ねる発生の過程では,つくられる細胞の性質に変化が生じることにより,均一な細胞集団の増え過ぎに抑制のかかるしくみからまぬがれているようにみえる.しかし,ショウジョウバエの成虫原基の形成や,脊椎動物の咽頭胚期より以降のステージにおいてまとまった細胞集団である組織が生じるときには,組織を構成する細胞の定足数制御が必要になってくる.そこには組織の恒常性を保つため細胞死のしくみが内包されているはずであり,細胞競合や代償性増殖はその基本的なしくみと考えることができよう.発生によりつくられる細胞社会の頑強性や恒常性を理解するうえで,細胞死はつねに念頭におくべき生命現象なのである.
略歴:1988年 大阪大学大学院理学研究科博士課程 修了,同年 同 博士研究員,1989年 慶應義塾大学医学部 助手,1992年 米国Massachusetts General Hospital博士研究員,1995年 筑波大学基礎医学系 講師,1997年 大阪大学医学部 助教授,2001年 理化学研究所脳科学総合研究センター チームリーダーを経て,2003年より東京大学大学院薬学系研究科 教授.
研究テーマ:細胞死からみた細胞社会の成立と維持の機構.“分子のはたらきは細胞社会で調べる”をモットーに,個体レベルでの分子機能の解析を行っている.
研究室URL:http://www.f.u-tokyo.ac.jp/~genetics/index.html
© 2012三浦 正幸Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 遺伝学教室)
email:三浦正幸
領域融合レビュー, 1, e002 (2012) DOI: 10.7875/leading.author.1.e002
Masayuki Miura: Molecular mechanisms and physiological functions of programmed cell death during development.
要 約
受精から発生の進むなか,細胞が死んでいく現象が知られている.しかし,発生という新たなものをつくっていくプロセスにおいて,つくられたものをわざわざ取り除いていくという,いっけん,むだとも思える現象が市民権を得るまでには時間がかかった.20世紀初頭,発生のしくみを研究していた一大研究グループは胚の誘導現象を発見したSpemannらであったが,この一派は,新しい細胞を発展的に生み出していく発生のプロセスに細胞死が含まれることを,はじめは受け入れられなかったようであった.しかし,のちの神経細胞死の研究から細胞の生存に必要な神経栄養因子の存在が明らかになり,さらに,線虫を用いた遺伝学的な研究からアポトーシスの遺伝学的な制御機構が明らかになった.そして,アポトーシスを遺伝学的に操作することができるようになったことで,細胞死の生体における機能を問う研究が可能になってきた.ここでは,アポトーシスを中心としたプログラム細胞死の発生における生体機能について解説する.
はじめに:発生における細胞死研究のはじまり
Hamburgerの総説によると1),発生において細胞死を意識して研究を行ったのはドイツHeidelberg大学のKallius一派が最初で,そのなかには,すぐれた総説を書いたErnstやGl?cksmannがいた.Gl?cksmannは1930年および1951年の総説において,脊椎動物の発生における細胞死の役割を機能面から以下の3つにまとめている2).1)形態形成における細胞死:初期胚における陥入や膨出といった細胞運動にともなって起こる細胞死,2)組織形成における細胞死:組織や器官の形成において分化した細胞ができてくる過程にみられる細胞死,3)系統発生における細胞死:進化的に上位な生物では発生のときにそれより下位の生物に存在する構造が一過性に出現しのちに失われる.形態形成における細胞死は上皮の変形や融合において広汎に観察され,神経管の閉鎖あるいは眼包や耳包の形成の際の細胞死が例としてあげられている.組織形成における細胞死の役割を論じている箇所では興味深い考察がなされている.死んだ細胞から放出されるリボ核酸がまわりの細胞になんらかの誘導的な作用をもたらすのではないかというものである.細胞死が不要な細胞の除去という消極的な生命現象であることをこえ,発生の進行に積極的にかかわることを議論している点で注目される.この考えは,いわばSpemann一派の,発生のしくみを一連の誘導的な現象の連続による因果関係にもとめる考えに類似している.
Gl?cksmannの総説にみられるように,先見性のある考えはあったが,発生における細胞死はアポトーシスの形態をとる静かな細胞死であり,まわりに影響することなく不要な細胞として除去されるものと一般には理解されていた.しかし,のちに述べるように,近年,ショウジョウバエにおける代償性増殖の実験やヒドラにおける再生の実験から,アポトーシスを起こした細胞はまわりに積極的に増殖因子を放出して細胞の増殖を促すことが明らかにされた.
脊椎動物においては,形態形成に必要なモルフォゲンを分泌する組織の一部がしばしば細胞死により失われていくことが観察されている.たとえば,肢を形成する際にFGFを分泌する外胚葉性頂堤や,それに応答してShhを分泌する極性化活性帯は,形態形成に必要なシグナルを分泌するシグナルセンターとしての役割をもつが,これらの領域はシグナルを発したあとは細胞死により失われていく(図1).
1.プログラム細胞死の分子機構の探求
1900年代中ごろ,Spemann一派の発生学者は,分裂,分化,そして,誘導を発生プロセスの基本と考えていた.ゆえに,発生において細胞死により生じる現象を観察しても,それに対し異なった解釈をあたえていた.つまり,発生の途中の脊髄の知覚神経節や運動神経核における細胞数の減少は,細胞が必要とされる部位へと移動したことによるとの解釈である.同じ現象を観察した,Spemann学派の影響をうけなかったイタリアの神経科学者Levi-Montalciniの解釈は異なった.細胞数の減少は神経細胞死によると考えたのである.そののち,Levi-MontalciniとHamburgerらの研究から,神経の支配する標的組織からの影響により神経の生存は維持されているとのコンセプトが提出された.そして,神経栄養因子(nerve growth factor:NGF)が発見され,神経細胞死はその制御機構とともに注目されるようになった.1972年,Kerr,Wyllie,Currieは,さまざまな組織の観察から,細胞死には2つのタイプがあるとした.アポトーシス(apoptosis)とネクローシス(necrosis)である.アポトーシスはギリシャ語で落葉を意味する言葉である.Kerrらが,さまざまな組織の細胞死をていねいに観察しその形態に共通な性質があるとし,アポトーシスという名称をつけ概念化した意味は大きい3).1992年,Raffは,すべての細胞はその生存を細胞社会に依存しているとの総説を書き,生存因子の作用の一般性をいった.
神経細胞死はNGFにより制御可能であったことから,そのしくみに関する研究が培養神経細胞を用いて行われた.1988年,Johnsonらは,NGFの除去による交感神経の細胞死は,RNAやタンパク質の活発な生合成を必要とする現象であると発表した4).アポトーシスが遺伝子の制御をうけることを示唆する結果である.そして,アポトーシスの遺伝的な制御に関するより直接的な研究が,線虫を用いて行われた.
2.プログラム細胞死の分子機構の発見
NGFの除去による神経細胞死に遺伝子の発現が必要なことは実験的に示されたが,プログラム細胞死の実行における遺伝的な制御については,皆目見当のつかない状態であった.この状況に終止符をうったのは,線虫を用いた分子遺伝学的な研究であった.線虫Caenorhabditis elegansは体が透明で発生が観察しやすく,受精卵からの細胞系譜がすべて明らかにされている唯一の多細胞動物である.線虫のからだづくりでは,必ず決まった細胞系譜から1090個の細胞が生まれ131個の細胞が死んでいく.まさに,遺伝的にプログラムされた細胞死が発生において実行されているわけである.
線虫の細胞死に注目した研究は1980年代からはじまった.Hedgecockらは,細胞死のプロセスに異常を示すはじめての変異体,ced-1変異体とced-2変異体(ced:cell death abnormal)を発表し,細胞死が遺伝的に制御されていることを示した.このとき得られた変異体は,細胞死の実行ではなく,死んだ細胞の貪食に影響するものであった.線虫の細胞死のプロセスを観察すると,死ぬべき細胞が生まれて死んで貪食されるまで2時間もかからないので,からだの異なった場所で散発的に起こる細胞死の全体を観察するのはむずかしい.しかし,ced-1変異体およびced-2変異体では死細胞が貪食されず生体に残るため,過去に細胞死の起こったことを知るのが容易になったのである.つづいて,Horvitzの研究室において,ced-1変異体を用い細胞死の実行されない変異体(つまり,細胞の死骸の出てこない変異体)のスクリーニングが行われ,画期的な変異体ced-3が得られた5).egl-1変異体では陰門にある産卵に必要な筋肉を支配する神経が細胞死を起こして失われるため産卵ができなくなる.このegl-1変異体とced-3変異体との二重変異体は,細胞死が抑制されるため産卵不全の表現型が回復する.egl-1変異体の表現型は観察しやすく,ced-3遺伝子の対立遺伝子を同定するスクリーニングに好都合であった.egl-1変異体との二重変異により産卵が可能になる変異体をスクリーニングすることにより,ced-3遺伝子の対立遺伝子が得られたほか,新規の遺伝子ced-4も同定された5).そしてさらに,細胞死の制御における機能獲得型の変異体としてced-9変異体が得られた6).
そののち,それぞれの変異体の原因遺伝子がクローニングされると,そのすべてが哺乳類においても保存された遺伝子であり,アポトーシスの制御の中心となるタンパク質がこの一連のスクリーニングにより同定された.Ced-3はタンパク質分解酵素のひとつカスパーゼ,Ced-4はその活性化タンパク質Apaf-1,Ced-9はCed-4の活性化を阻害するBcl-2ファミリータンパク質,Egl-1はBcl-2ファミリータンパク質のはたらきを抑制するタンパク質BH3 only proteinをコードしていた.2002年,線虫遺伝学の基礎を構築したBrenner,線虫の細胞系譜を明らかにしたSulston,線虫における細胞死の経路を明らかにしたHorvitzの3名に,ノーベル医学生理学賞が授与された.
3.アポトーシスの実行に必須であるカスパーゼの活性化の機構
線虫ではプログラム細胞死に必要なカスパーゼはCed-3のみであるのに対し,ショウジョウバエや哺乳類では複数のカスパーゼが細胞死にかかわっている.すべてのカスパーゼは活性のほとんどない前駆体として生合成される.N末端からプロドメイン,p20,p10に分けられるが,カスパーゼはプロドメインの構造と基質の特性からサブタイプに分類される.長いプロドメインはタンパク質間の相互作用を担うCARDあるいはDEDから構成されていて,細胞死の刺激に依存してこのCARDあるいはDEDにほかのアダプタータンパク質が結合することによりカスパーゼは多量体となり活性化する.このタイプのカスパーゼはイニシエーターカスパーゼとよばれ,その活性化がカスパーゼ活性化カスケードの開始シグナルとなる.短いプロドメインをもつカスパーゼ3,カスパーゼ6,カスパーゼ7は,上流のイニシエーターカスパーゼによりp20とp10に切断されて強い活性をもつようになる.これらエフェクターカスパーゼが活性化されると,さまざまな基質が切断されて細胞死が実行される.現在までに,1000以上のエフェクターカスパーゼの基質が見い出されている.イニシエーターカスパーゼに分類されるカスパーゼ8の基質としてはBH3 only proteinであるBidが知られ,この切断産物であるtBidがミトコンドリア経路のアポトーシスを開始させる.しかし,エフェクターカスパーゼと比較して,イニシエーターカスパーゼの基質は下流のエフェクターカスパーゼやBid以外ほとんど知られていない.
線虫では,ミトコンドリアに局在するBcl-2ファミリータンパク質CED-9にCED-4が結合している.プログラム細胞死を起こす細胞ではBH3 only proteinであるEgl-1の発現が誘導される.その結果,Ced-9とCed-4との結合がCed-9とEgl-1とに置き換わり7),ミトコンドリアから離れたCed-4がCed-3と結合することによりCed-3が活性化され細胞死が実行される8,9)(図2).
Wangらは,生化学的な手法により哺乳類におけるカスパーゼ活性化の機構を明らかにした.彼らは,HeLa細胞の細胞質画分の抽出液にハムスターの肝臓に由来する核を入れ,dATPをくわえるとカスパーゼ3が活性化されて核の凝縮が起こるというin vitro細胞死誘導系を構築した.dATPに依存的なカスパーゼ3の活性化に必要なタンパク質をHeLa細胞の細胞質画分の抽出液から精製し,3つのApaf(apoptotic protease-activating factor)タンパク質がカスパーゼ3の活性化に必要なことを示した.それぞれのタンパク質を精製して構造を決めたところ,Apaf-1はCED-4のホモログ,Apaf-2はシトクロムc,Apaf-3はカスパーゼ9であった.アポトーシスのシグナルをうけた細胞では,シトクロムcがミトコンドリアから細胞質へと放出されてアダプタータンパク質Apaf-1と複合体を形成する.シトクロムcの放出を制御するのがBcl-2ファミリータンパク質である.七量体をとるApaf-1-シトクロムc複合体(この複合体を,アポプトソームとよぶ)にイニシエーターカスパーゼであるカスパーゼ9がリクルートされ,これが多量体化することで活性化する(図2).Apaf-1はシトクロムcと結合するWD40リピートをもつが,線虫のCED-4にこのドメインはない.ショウジョウバエおよびマウスにはWD40リピートのないApaf-1のスプライシングバリアントが存在し,このバリアントはシトクロムcに非依存的にカスパーゼを活性化できる.
ショウジョウバエのApaf-1はほかのタンパク質を必要とせずに八量体を形成し,イニシエーターカスパーゼDroncをリクルートしてこれを活性化する.しかし,生体においてはDiap1がDroncに結合しその活性を抑制しているため細胞死は誘導されない.Diap1はRINGドメインをもつユビキチンリガーゼであり,結合したカスパーゼの安定性も制御している.細胞死の刺激をうけた細胞ではreaper遺伝子,hid遺伝子,grim遺伝子(RHG遺伝子とよばれる)が発現し,これらの遺伝子産物がDiap1と結合することでその自己ユビキチン化を促進し分解へと導く.その結果,Droncの活性化,そして,下流のエフェクターカスパーゼDriceやDcp1が活性化されアポトーシスが誘導される10)(図2).
カスパーゼ活性化経路に関しては,細胞外からのリガンドにより開始される外因性経路(これに対して,ミトコンドリアを経由するカスパーゼ活性化経路を内因性経路という)がある.Fasリガンド-Fas,TNF-TNF受容体がそのプロトタイプとして知られている.線虫では外因性経路は知られていないが,ショウジョウバエにはTNFのホモログEigerとその受容体Wengenがある.しかし,カスパーゼ活性化経路が保存されているわけではなく,JNKの活性化に依存した細胞死を誘導する11).
4.分化に失敗した細胞を取り除くことによる発生において生じるノイズの除去
多細胞生物の発生においては散発的に細胞死が起こるが,このような死細胞はいったいどのような性質をもつ細胞なのだろうか.細胞の増殖や分化の際にエラーが生じ,そのような細胞が発生の過程で取り除かれることは想像にかたくないが,はたしてそうなのか.生体において細胞分化のプロセスを細かに観察することが,分化の際にエラーの生じた細胞を調べるいちばん直接的な方法である.このような研究には,1細胞の解像度での生体イメージングが可能で,かつ,多様な分化マーカーの利用できる細胞系譜が有効である.ショウジョウバエの蛹期に形成される中胸背毛は,機械受容器としてはたらく末梢感覚器である.感覚器前駆体細胞(sensory organ precursor:SOP)がプロニューラルクラスターに生じ,そののち,非対称分裂により感覚器が形成される.このしくみに関しては遺伝学的な研究の豊富な蓄積があり,分化マーカーも充実している.さらに,感覚器前駆体細胞からの外感覚器の全発生過程は蛹期においてからだの表面で起こるので,長時間の安定した生体イメージングが可能である.感覚器前駆体細胞の生じたことはneuralized(neu)遺伝子(ユビキチンリガーゼをコードし,Notchの活性化に必要なDeltaのエンドサートーシスを促進する)の発現がオンになることでわかる.感覚器前駆体細胞が生まれるとその細胞はDeltaを発現し,まわりの細胞のNotchを活性化してそれらが神経系細胞となるのを抑制するため(側方抑制),近接した細胞に感覚器前駆体細胞は出現しないことが遺伝学的な研究から示されている.ところが,感覚器前駆体細胞の出現をneu遺伝子の発現を指標に生体イメージングにより観察したところ,将来,感覚器前駆体細胞となる細胞の近傍にneu陽性の細胞が出現することが明らかになった.このような感覚器前駆体細胞様細胞のほとんどは,いちど分裂したのちアポトーシスにより生体から除かれた.
感覚器前駆体細胞様細胞は非対称分裂をせず,neu遺伝子の発現が持続しなかった.正常に感覚器前駆体細胞となった細胞ではまわりの細胞に比べNotchの活性がすみやかに低下していくが,感覚器前駆体細胞様細胞にはまわりの細胞と同様に高いNotchの活性がみられた.この観察結果は,神経系細胞のマーカーであるneu遺伝子を発現した感覚器前駆体細胞様細胞は,その性質に矛盾の生じた,分化に失敗した細胞であることを示していた.このような感覚器前駆体細胞様細胞は本来の感覚器前駆体細胞に対し20%の割合で生じ,そのほとんどはアポトーシスにより失われた.Notchヘテロ変異体では20%多くに感覚器前駆体細胞が生じ,その分だけ余分な中胸背毛が生じたことから,感覚器前駆体細胞様細胞の出現とアポトーシスの制御にはNotch遺伝子のかかわっていることが考えられた.このように,生体イメージングにより分化に失敗した細胞の存在が明らかになり,外感覚器の配置パターンは,側方抑制だけでなく,発生において生じるエラーをアポトーシスが取り除くことで完成することが示された.アポトーシスの機能として,発生の過程で生じた不要な細胞あるいは危険な細胞の除去がいわれてきたが,それにくわえ,細胞社会のなかで細胞が特殊化していくプロセスにおいて,分化に不具合の生じた細胞を除去することにより発生において生じるノイズの消去を行っていることが明らかになった12)(図3).
5.細胞死誘導シグナルと形態形成
大量のアポトーシスが観察される発生現象のひとつに,Gl?cksmannも形態形成における細胞死の例としてとりあげている神経管の閉鎖がある.神経管とは脳や脊髄のもととなる器官であり,板状の神経板の左右の両端が筒状の神経管となるよう融合する神経管閉鎖をへて形成される.致死的な先天的奇形である外脳症や無脳症,発症率の高い水頭症や二分脊椎の原因のひとつは,神経管閉鎖の異常であると考えられている.アポトーシスを起こした細胞は通常はすぐに除去されてしまい,取り出した胚を固定して調べるというこれまでの研究手法により検出できるものはごく一部にすぎない.さらに,哺乳類の神経管閉鎖は子宮の内部で進行するため生体イメージングによる観察はむずかしく,既存の組織学的な研究手法ではアポトーシスの有無と神経管閉鎖の成否という結果の判定しかできず,両者の関係性を詳細に解析することはむずかしかった.
そこで,細胞死誘導シグナルの流れを調べる目的で,蛍光共鳴エネルギー移動(fluorescence resonance energy transfer:FRET)によりカスパーゼの活性化を可視化できるプローブを用いた生体イメージング解析が行われた.その結果,頭部の神経管閉鎖の過程においてアポトーシスを起こした細胞には,少なくとも2種類のふるまいがあることがわかった.通常,カスパーゼ3を活性化しアポトーシスを起こした細胞は断片化し,すぐに近傍の組織に飲み込まれることで取り除かれることが知られている.しかし,頭部の神経管閉鎖の過程ではこれらの断片化する死細胞にくわえ,断片化せずに組織から脱落し長時間そこにとどまる細胞のあることが明らかになった.さらに,生体イメージングにより頭部の神経管閉鎖においてその速度の測定が可能となったが,アポトーシスを阻害した場合には神経管閉鎖の速度が顕著に減少することが明らかになった.また,アポトーシスを欠損したときには神経管の閉鎖が一進一退するようすも観察された.これらの結果から,アポトーシスは頭部の神経板の形態変化に寄与することで神経管閉鎖の円滑な進行に貢献していることが示唆された13).
正常な発生の過程では,頭部の神経管閉鎖ののち急激な脳室の拡大が生じるため,神経管閉鎖が一定の時間内に終了することはのちの脳の発生にとり非常に重要だと考えられる.このように,アポトーシスは円滑な形態形成運動の遂行にはたらくことで,正常な脳のかたちづくりに貢献している.アポトーシスによる細胞死が,不要な細胞の除去にくわえ,形態形成運動に必要な力の制御にもかかわることは,ショウジョウバエの胚における背部の閉鎖14) や,雄の外生殖器の回転運動15) でも示唆されている.さらに,後述するように,シグナルタンパク質の分泌によっても発生の進行に積極的にかかわることが考えられる.
6.細胞競合
19世紀後半,Rouxは,個体発生においても細胞間の競合があって,適切なものが選択されていくというダーウィン進化論に影響をうけた考えを提示した.そののち,細胞競合という現象が実験的に知られるようになったのは,Morataらの,ショウジョウバエを用いたMinute変異クローンの解析による.Minute変異ではリボソームの合成が低下し,そのヘテロ接合体は野生型に比べ細胞の増殖能が劣る.Minuteヘテロ変異体のクローンを野生型のショウジョウバエにおいて未分化な上皮細胞の集団である翅成虫原基に形成させると,そのクローンははじめ小さな細胞集団をつくるが,そののち,細胞集団から積極的に失われていく.翅成虫原基の細胞すべてがMinuteヘテロ変異体であるときにはこのような現象は観察されないことから,Minuteヘテロ変異体のクローンの除去は増殖能の異なる細胞集団(野生型とMinuteヘテロ変異体)が共存した場合に細胞競合が起こるためであると解釈された.この現象はカスパーゼ阻害タンパク質p35の発現により抑制の可能であったことから,カスパーゼによるアポトーシスの誘導の関与していることがわかった16).
細胞競合はMinute変異クローンでのみ起こるわけではなく,増殖能の異なる細胞集団が共存した場合に観察される例が報告されている.翅成虫原基においてdMyc遺伝子の発現量の異なるクローンを形成すると,dMyc遺伝子の発現量の少ないクローンの周辺の細胞集団が除去された.このようなdMyc遺伝子を過剰に発現した細胞は超競合者(super competitor)とよばれる.眼成虫原基を用いた細胞競合にかかわる遺伝子のスクリーニングにより,Wartsがん抑制遺伝子経路にかかわる遺伝子(expanded遺伝子,hippo遺伝子,Salvador遺伝子,mats遺伝子,fat遺伝子)に変異をもつと,それらの細胞集団は超競合者としてふるまうことが示された.一方,頂底極性遺伝子(scribble遺伝子,discs large遺伝子)は,その変異体は成虫原基の過増殖による腫瘍を形成するが,成虫原基において変異クローンを形成すると細胞競合により組織から除去された.Eigerによる細胞死経路はscribble変異クローンとの細胞競合による細胞死にかかわる17).細胞競合の起こる境界領域をくわしく調べた結果,細胞競合により死んでいく細胞は境界に限局して存在し,死んだ細胞はまわりの上皮細胞に貪食されることが示された.境界領域における細胞の貪食は,死んだ細胞の除去だけではなく,積極的に細胞死をひき起こす役割をもつことを示す結果も報告されている18).
完全変態をするショウジョウバエでは,幼虫でつくられた組織のほとんどが成虫細胞に置き換わる.この組織の入れ替わり(組織再構築)では,組織芽細胞の増殖と幼虫細胞の除去とが協調して起こるが,両者の関係は細胞競合に似たところがある.成虫の表皮をつくる組織芽細胞は,体節ごと前後2つの細胞集団として胚期のおわりに生じ,そののちの幼虫期にはG2期において細胞周期が休止している.エクジソンの発現により蛹化を開始すると再び細胞分裂をはじめ,蛹期15時間以降には組織芽細胞の細胞集団の拡張が顕著になり幼虫の表皮細胞と置き換わっていく.このとき,幼虫の表皮細胞のアポトーシスを抑制すると組織芽細胞の増殖が抑制され,逆に,組織芽細胞の増殖を遺伝学的に抑制すると幼虫の表皮細胞のアポトーシスは大幅に遅れたことから,アポトーシスと増殖とは相互にかかわりあった現象であることがわかった.
さきに述べた,カスパーゼの活性化を可視化できるFRETプローブを用いて生体イメージング解析を行ったところ,カスパーゼ3様の活性は幼虫の表皮にランダムにみられるのではなく,組織芽細胞と接する境界領域の幼虫の表皮細胞において高頻度に観察された.境界領域におけるカスパーゼの活性化は組織芽細胞の増殖を遺伝学的に抑制したこと,あるいは,近紫外線レーザーを用いて境界領域だけで増殖を遅らせるとこのカスパーゼの活性はみられなくなったことから,境界領域で増殖する組織芽細胞がカスパーゼ活性化の引き金を担っているものと考えられた.増殖とアポトーシスとの連関の起こる再編の境界が順次進行していくことは,組織全体のサイズを変更せずに組織の入れ替わりをなしとげる有効なしくみである.増殖しては境界領域において細胞死を誘導し,また,細胞死は境界領域においてつぎの増殖を促進することで,整然とした細胞の入れ替わりが起こる19).境界領域においてアポトーシスを起こした細胞から放出されたDppが,近傍の組織芽細胞に作用してその浸潤と拡張性を制御している20).
7.代償性増殖
組織は一定の数の細胞により構成されていて,生体には発生や再生においてなんらかの方法により組織の定足数を保つしくみが備わっている.細胞競合では,競合により負けた細胞が翅成虫原基において失われても成虫原基のサイズに変化はない.これは失われた細胞のまわりの細胞が増殖し,適切な組織のサイズを認識して増殖を停止するからである.このような細胞死により誘導される増殖現象は代償性増殖とよばれている.
ショウジョウバエの翅成虫原基の後部区画にエフェクターカスパーゼ阻害タンパク質p35の遺伝子を発現させ,放射線を処理して翅成虫原基の全体にアポトーシスを誘導させた実験条件,あるいは,アポトーシス誘導遺伝子(reaper遺伝子やhid遺伝子)とp35遺伝子とを同時に発現させた実験条件では,翅成虫原基の後部区画において細胞死誘導シグナルはオンになるが,エフェクターカスパーゼが阻害されているためアポトーシスは阻止されている(ショウジョウバエのイニシエーターカスパーゼDroncはp35により阻害されない).この実験では,アポトーシスを起こさない細胞を人工的につくっていることになる.すると,後部区画において細胞の過増殖が観察された.この細胞ではJNKの活性化と細胞増殖を制御するwingless遺伝子やdpp遺伝子の発現の上昇が認められ,このアポトーシスを起こさない細胞は増殖シグナルを発していることが示唆された.しかし,DppやWinglessはアポトーシスを起こさない細胞の過増殖には必要であるが,傷害をうけた組織で起こる代償性増殖には必要ないことが報告され,現在のところ,発生や傷害のときの代償性増殖にどのような増殖シグナルがかかわるのかは不明である21).カスパーゼ変異体を用いた研究から,エフェクターカスパーゼの活性化か代償性増殖かの分岐は,イニシエーターカスパーゼDroncのレベルで起こることが明らかになった22).翅成虫原基の後部区画においてp35遺伝子とdronc遺伝子とを同時に発現させると,組織の激しい肥大とJNKの活性化,p53遺伝子の発現誘導が観察された.JNKは細胞ストレスにより活性化されるが,Droncの下流においてp53遺伝子の発現が誘導されたことは,p53遺伝子はDNAの傷害のみならず,細胞のストレスを感知して活性化されることを示唆していた23).
このように,増殖性の高い組織ではDroncの下流において増殖シグナルの発せられることが示されているが,G1期で細胞周期の停止している眼成虫原基の一部の細胞集団にhid遺伝子の発現による細胞死を誘導すると,その細胞集団からHedgehogが分泌されG1期で細胞周期の停止しているまわりの細胞に代償性増殖の誘導されることが示された24).この系にはdpp遺伝子もwingless遺伝子も関与せず,かつ,dronc遺伝子ではなくその下流のエフェクターカスパーゼをコードするdrice遺伝子およびdcp1遺伝子が代償性増殖に必要であった.このように,代償性増殖は細胞死の誘導される細胞集団により,異なるカスパーゼに依存して起こっていることがわかった.
細胞競合と代償性増殖はともに相補的な生命現象であると考えられる(図4).細胞競合(Minuteヘテロ変異体と野生型の接触,あるいは,dMyc遺伝子の発現量の異なる細胞集団の接触)の条件において死んでいく細胞集団にp35遺伝子を発現させて細胞死を抑制しても,過剰な代償性増殖は観察されない.細胞競合による細胞死はその境界領域で起こるが,アポトーシスを起こさない細胞の実験系ではクローンの全体において細胞死誘導シグナルがオンになっている.シグナルを発する細胞において集団効果(community effect)が生じているのかどうかの違いなのかもしれない.
定足数感知(quorum sensing,クオラムセンシング)は細菌においてみつかった現象で,分泌性の化学物質を用いて集団の密度を互いに感知し,化学物質(オートインデューサー)が一定の濃度をこえると一斉にそれに応答した行動をとるというものである.生物発光や病原性タンパク質の産生,細胞死の誘導による細菌集団の質的な管理が,この機構により制御されている25).定足数感知による細胞死の誘導は,利他的な行為により集団としての健常性を保つはたらきをもつものと考えられている26).多細胞動物でも同じようなしくみがはたらいているものと想定されるが,オートインデューサーのような定足数感知にかかわる分子の実体は明らかにされていない.
8.組織の再生と細胞死誘導シグナル
細胞競合や代償性増殖は,いわば,組織の修復による恒常性の維持機構ととらえることができ,再生と類似性がある.組織という細胞社会は細胞死と増殖とのバランスによりその恒常性が維持されている.アフリカツメガエルにおいてオタマジャクシの尾部を切断するとこれが再生するが,その際には再生芽の一部においてカスパーゼ3の活性化が観察され,その活性を阻害剤により抑制すると細胞死と細胞増殖の阻害が起こり再生しなくなる27).このことは,ショウジョウバエの変態の際の表皮の再編成と同様に,細胞死が増殖に積極的にかかわることを示唆している.
再生の際の代償性増殖はヒドラを用いた実験から示された.ヒドラを胃中央部(体のほぼ中央)で2分すると,頭部の再生領域にはアポトーシスが顕著にみられる.このアポトーシスを起こした細胞はWnt3を発現しまわりの細胞の増殖を促す.カスパーゼ阻害剤を処理するとアポトーシスが抑制され,かつ,再生が起こらなくなった.Wnt3をノックダウンするとやはり再生は阻害されたことから,ここでの代償性増殖にはWnt3が必要なことが示された28).
1900年代半ば,Hadornは,翅成虫原基の一部を切断してから成虫の腹腔にもどしてやると,数日で切断部位が再生するという実験系を確立した.切断端ではJNKの活性化が起こり,この活性を遺伝学的に抑制すると損傷の治癒が起こらなくなる.脚成虫原基の前後軸の境界においてDppが発現しているが,この領域のもっとも背側にweak pointとよばれる特別な場所がある.このweak pointにかかるように切断して成虫腹腔にもどすと,再生のとき脚から翅への分化の転換が高頻度に起こる.切断によるJNKの活性化はPolycomb群の遺伝子発現を抑制し,Polycomb群により転写の抑制されていた翅成虫原基のセレクター遺伝子vestigialの発現が誘導される29).この脚から翅への分化の転換は脚成虫原基にwingless遺伝子を過剰に発現させることによっても起こるが,この実験系においても切断のときと同様に増殖のさかんな芽体がweak pointに生じ30),vestigial遺伝子の発現誘導が起こる31).p53遺伝子やdronc遺伝子に変異のある場合,芽体の形成率は大きく低下したことから,再生のときの増殖や分化の転換にも代償性増殖において使われている細胞死誘導シグナルが関与しているものと考えられた23).眼成虫原基にカスパーゼ阻害遺伝子diap1の変異クローンを形成し,同時にp35遺伝子を発現させて代償性増殖を促すと,組織の肥大にくわえ複眼の一部に触角様の分化の転換が起こる32).
おわりに
生物において恒常性を維持するしくみのなかで,負のフィードバックはなくてはないプロセスである.JacobとMonodが大腸菌において発見したラクトースオペロンは,代謝産物により遺伝子の発現抑制を制御するしくみである.恒常性を細胞集団という,よりマクロなレベルで考えると,大腸菌はEDFという5つのアミノ酸残基からなるペプチドをオートインデューサーとして細胞外に放出することにより,細胞死を誘導し集団としての過剰な増殖を負に制御している33).単細胞が増殖するのとは異なり,受精卵が分裂を重ねる発生の過程では,つくられる細胞の性質に変化が生じることにより,均一な細胞集団の増え過ぎに抑制のかかるしくみからまぬがれているようにみえる.しかし,ショウジョウバエの成虫原基の形成や,脊椎動物の咽頭胚期より以降のステージにおいてまとまった細胞集団である組織が生じるときには,組織を構成する細胞の定足数制御が必要になってくる.そこには組織の恒常性を保つため細胞死のしくみが内包されているはずであり,細胞競合や代償性増殖はその基本的なしくみと考えることができよう.発生によりつくられる細胞社会の頑強性や恒常性を理解するうえで,細胞死はつねに念頭におくべき生命現象なのである.
文 献
- Hambruger, V.: History of the discovery of neuronal death in embryos. J. Neurobiol., 23, 1116-1123 (1992)[PubMed]
- Glucksmann, A.: Cell death in normal vertebrate ontogeny. Biol. Rev., 26, 59-86 (1951)
- Kerr, J. F., Wyllie, A. H. & Currie, A. R.: Apoptosis: basic biological phenomenon with wide-ranging implications in tissue kinetics. Br. J. Cancer, 26, 239-257 (1972)[PubMed]
- Martin, D. P., Schmidt, R. E., DiStefano, P. S. et al.: Inhibitors of protein synthesis and RNA synthesis prevent neuronal death caused by nerve growth factor deprivation. J. Cell Biol., 106, 829-844 (1988)[PubMed]
- Ellis, H. M. & Horvitz, H. R.: Genetic control of programmed cell death in the nematode C. elegans. Cell, 44, 817-829 (1986)[PubMed]
- Hengartner, M. O., Ellis, R. E. & Horvitz, H. R.: Caenorhabditis elegans gene ced-9 protects cells from programmed cell death. Nature, 356, 494-499 (1992)[PubMed]
- Yan, N., Chai, J., Lee, E. S. et al.: Structure of the CED-4-CED-9 complex provides insights into programmed cell death in Caenorhabditis elegans. Nature, 437, 831-837 (2005)[PubMed]
- Chinnaiyan, A. M., O’Rourke, K., Lane, B. R. et al.: Interaction of CED-4 with CED-3 and CED-9: a molecular framework for cell death. Science, 275, 1122-1126 (1997)[PubMed]
- Yang, X., Chang, H. Y. & Baltimore, D.: Essential role of CED-4 oligomerization in CED-3 activation and apoptosis. Science, 281, 1355-1357 (1998)[PubMed]
- Kuranaga, E. & Miura, M.: Nonapoptotic function of caspases: caspases as regulatory molecules for immunity and cell-fate determination. Trends Cell Biol., 17, 135-144 (2007)[PubMed]
- Kanda, H., Igaki, T., Okano, H. et al.: Conserved metabolic energy production pathways govern Eiger/TNF-induced non-apoptotic cell death. Proc. Natl. Acad. Sci. USA, 108, 18977-18982 (2011)[PubMed]
- Koto, A., Kuranaga, E. & Miura, M.: Apoptosis ensures spacing pattern formation of Drosophila sensory organs. Curr. Biol., 21, 278-287 (2011)[PubMed]
- Yamaguchi, Y., Shinotsuka, N., Nonomura, K. et al.: Live imaging of apoptosis in a novel transgenic mouse highlights its role in neural tube closure. J. Cell Biol., 195, 1047-1060 (2011)[PubMed]
- Toyama, Y., Peralta, X. G., Wells, A. R. et al.: Apoptotic force and tissue dynamics during Drosophila embryogenesis. Science, 321, 1683-1686 (2008)[PubMed]
- Kuranaga, E., Matsunuma, T., Kanuka, H. et al.: Apoptosis controls the speed of looping morphogenesis in Drosophila male terminalia. Development, 138, 1493-1499 (2011)[PubMed]
- Moreno, E., Basler, K. & Morata. G.: Cells compete for decapentaplegic survival factor to prevent apoptosis in Drosophila wing development. Nature, 416, 755-759 (2002)[PubMed]
- Igaki, T., Pastor-Pareja, J. C., Aonuma, H. et al.: Intrinsic tumor suppression and epithelial maintenance by endocytic activation of Eiger/TNF signaling in Drosophila. Dev. Cell, 16, 458-465 (2009)[PubMed]
- Ohsawa, S., Sugimura, K., Takino, K. et al.: Elimination of oncogenic neighbors by JNK-mediated engulfment. Dev. Cell, 20, 315-328 (2011)[PubMed] [新着論文レビュー]
- Nakajima, Y. -I., Kuranaga, E., Sugimura, K. et al.: Non-autonomus apoptosis is triggered by local cell cycle progression during epithelial replacement in Drosophila. Mol. Cell Biol., 31, 2499-2512 (2011)[PubMed]
- Ninov, N., Menezes-Cabral, S., Prat-Rojo, C. et al.: Dpp signaling directs cell motility and invasiveness during epithelial morphogenesis. Curr. Biol., 20, 513-520 (2010)[PubMed]
- Perez-Garijo, A., Shlevkov, E. & Morata, G.: The role of Dpp and Wg in compensatory proliferation and in the formation of hyperplastic overgrowths caused by apoptotic cells in the Drosophila wing disc. Development, 136, 1169-1177 (2009)[PubMed]
- Kondo, S., Senoo-Matsuda, N., Hiromi, Y. et al.: DRONC coordinates cell death and compensatory proliferation. Mol. Cell. Biol., 26, 7258-7268 (2006)[PubMed]
- Wells, B., Yoshida, E. & Johnston, L.: Compensatory proliferation in Drosophila imaginal discs requires Dronc-dependent p53 activity. Curr. Biol., 16, 1606-1615 (2006)[PubMed]
- Fan, Y. & Bergmann, A.: Distinct mechanisms of apoptosis-induced compensatory proliferation in proliferating and differentiating tissues in the Drosophila eye. Dev. Cell, 14, 399-410 (2008)[PubMed]
- Bassler, B. L. & Losick, R.: Bacterially speaking. Cell, 125, 237-246 (2006)[PubMed]
- Erental, A., Sharon, I., Engelberg-Kulka, H.: Two programmed cell death systems in Escherichia coli: an apoptotic-like death is inhibited by the mazEF-mediated death pathway. PLoS Biol., 10, e1001281 (2012)[PubMed]
- Tseng, A., Adams, D., Qiu, D. et al.: Apoptosis is required during early stages of tail regeneration in Xenopus laevis. Dev. Biol, 301, 62-69 (2007)[PubMed]
- Chera, S., Ghila, L., Dobretz, K. et al.: Apoptotic cells provide an unexpected source of Wnt3 signaling to drive hydra head regeneration. Dev. Cell, 17, 279-289 (2009)[PubMed]
- Lee, N., Maurange, C., Ringrose, L. et al.: Suppression of Polycomb group proteins by JNK signalling induces transdetermination in Drosophila imaginal discs. Nature, 438, 234-237 (2005)[PubMed]
- Johnston, L. A. & Schubiger, G.: Ectopic expression of wingless in imaginal discs interferes with decapentaplegic expression and alters cell determination. Development, 122, 3519-3529 (1996)[PubMed]
- Sustar, A. & Schubiger, G.: A transient cell cycle shift in Drosophila imaginal disc cells precedes multipotency. Cell, 120, 383-393 (2005)[PubMed]
- Ryoo, H. D., Gorenc, T. & Steller, H.: Apoptotic cells can induce compensatory cell proliferation through the JNK and the Wingless signaling pathways. Dev. Cell, 7, 491-501 (2004)[PubMed]
- Kolodkin-Gal, I., Hazan, R. & Gaathon, A.: A linear pentapeptide is a quorum-sensing factor required for mazEF-mediated cell death in Escherichia coli. Science, 318, 652-655 (2007)[PubMed]
参考図書
辻本賀英 編: 細胞死・アポトーシス集中マスター. 羊土社 (2006)
三浦正幸 編: 細胞死研究総集編(実験医学増刊). 羊土社 (2010)
Douglas R. Green著, 長田重一 監訳: 結末への道筋:アポトーシスとさまざまな細胞死. メディカル・サイエンス・インターナショナル (2012)
Miura, M. (ed.): Cell death in development and regeneration. Dev. Growth Differ. 53(2) (2011)
著者プロフィール
略歴:1988年 大阪大学大学院理学研究科博士課程 修了,同年 同 博士研究員,1989年 慶應義塾大学医学部 助手,1992年 米国Massachusetts General Hospital博士研究員,1995年 筑波大学基礎医学系 講師,1997年 大阪大学医学部 助教授,2001年 理化学研究所脳科学総合研究センター チームリーダーを経て,2003年より東京大学大学院薬学系研究科 教授.
研究テーマ:細胞死からみた細胞社会の成立と維持の機構.“分子のはたらきは細胞社会で調べる”をモットーに,個体レベルでの分子機能の解析を行っている.
研究室URL:http://www.f.u-tokyo.ac.jp/~genetics/index.html
© 2012三浦 正幸Licensed under CC 表示 2.1 日本