骨免疫学の歴史と新たな展開
2012/09/01
岡本一男・高柳 広
(東京大学大学院医学系研究科 免疫学教室)
email:岡本一男,高柳 広
領域融合レビュー, 1, e003 (2012) DOI: 10.7875/leading.author.1.e003
Kazuo Okamoto & Hiroshi Takayanagi: The history of osteoimmunology and its recent progress.

骨の恒常性は骨代謝細胞だけでなく,ほかの組織や細胞種との相互作用をつうじ複雑に制御されている.とくに,骨と免疫系はサイトカインなど多くの制御タンパク質を共有し不可分な関係を築いている.関節リウマチにおける炎症性骨破壊の研究はこうした骨と免疫系との相互作用に光をあて,両者の融合領域である“骨免疫学”発展の契機をもたらした.また,自己免疫炎症において重要なヘルパーT細胞のサブセットであるTh17細胞は,関節リウマチにおいて骨破壊を誘導する破骨細胞誘導性T細胞として機能することが明らかになり,骨免疫学の視点は臨床においても重要性を増してきている.さらに近年,骨髄を構成する細胞と造血幹細胞との関係性が指摘され,骨免疫学は多方面に発展しつつある.
骨組織の恒常性は骨の古い組織が分解されて新しい組織に置き替えられること(骨リモデリング)により維持され,それは骨芽細胞による骨形成と破骨細胞による骨吸収とのバランスにより制御されている.このバランスの破綻は,関節リウマチ,閉経後骨粗鬆症,がん骨転移などの骨量減少性の疾患や,骨硬化症,大理石骨病などをひき起こすことになり,高齢化社会をむかえた現代において,こうしたロコモティブシンドローム(運動器症候群)の克服は医療における大きな課題である.このように骨代謝細胞の連携により生涯をつうじ骨組織が再構築されるわけだが,骨組織はほかの組織や細胞によっても複雑に制御をうけている.
なかでも,骨と免疫系は骨髄の微小環境,また,サイトカインやシグナル伝達分子など多くの制御タンパク質を共有し密接に関係している.“骨免疫学”(osteoimmunology)はこうした骨と免疫系との相互作用にフォーカスした融合領域として発展してきた1).そもそも“osteoimmunology”という呼称は,2000年,T細胞による破骨細胞の制御に関する筆者らの報告の際にNature誌の論説記事において使用されたことにはじまる2).いまでは多くの免疫系サイトカインが骨代謝にかかわることがわかっているが,なかでもRANKL(receptor activation of nuclear factor-κB ligand)は骨と免疫系とをつなぐもっとも重要なタンパク質である3).RANKLはT細胞に発現する樹状細胞の活性化タンパク質として免疫学においてすでに同定されていたサイトカインであった.のちに,破骨細胞の分化において必須のタンパク質であることが解明され,その発見は免疫系と骨代謝とをつなぐ大きな契機になった.また,破骨細胞の分化機序が解明されていくにつれ,意外にも,免疫系の細胞で機能する多くのシグナル伝達分子や転写因子が破骨細胞にとっても重要であることが判明し,骨と免疫系における共有性がよりいっそう明るみになった.
ここでは,これまでの骨免疫学の発展の経緯を概説しつつ,関節リウマチの病態の理解へむけた骨免疫学の研究,さらには,骨髄の微小環境における骨と造血幹細胞ニッチについての最新の知見を紹介し,この学際領域の新展開について述べる.
破骨細胞は単球/マクロファージ系前駆細胞に由来する多核巨細胞であり,骨基質に接着すると極性化し酸やタンパク質分解酵素を分泌することで骨を吸収する.破骨細胞の分化には,破骨細胞前駆細胞が骨芽細胞や滑膜線維芽細胞など間葉系の支持細胞と接触し分化誘導シグナルを受け取ることが必要であり,1990年代後半に,その分化に必須のサイトカインとしてRANKLが同定された.RANKLは破骨細胞前駆細胞において受容体であるRANKと結合し分化誘導シグナルを伝達する.最近,骨リモデリングにかかわるRANKLの発現細胞として,骨組織に埋没した骨細胞の重要性が明らかにされた4).これまで,その単離の困難さのため骨細胞の生理機能の研究は不十分であったが,骨細胞において特異的にGFPを発現する遺伝子改変マウスの作製により,骨細胞がRANKLを高く発現していることが判明し,さらに,骨細胞において特異的にRANKLを欠損させたマウスでは破骨細胞の分化障害により大理石骨病を呈することが示された4).
RANKLノックアウトマウスおよびRANKノックアウトマウスは重篤な大理石骨病と歯の萌出不全を呈する3).さきに述べたように,当初,RANKLは樹状細胞を制御する機能をもつサイトカインとして報告されたが,RANKLノックアウトマウスおよびRANKノックアウトマウスでは樹状細胞の機能に差は認められない.一方,RANKLノックアウトマウスおよびRANKノックアウトマウスではリンパ節の形成不全や胸腺の髄質上皮細胞の分化障害といった免疫組織の異常が認められる.胸腺の髄質上皮細胞の分化には胸腺細胞やリンパ組織誘導細胞,γδT細胞からのRANKLシグナル伝達の必要性が論じられており5,6),中枢性免疫寛容の成立にもRANKL-RANK経路がかかわっている.また,表皮細胞に由来するRANKLが制御性T細胞の増殖を誘導し,アレルギー性接触皮膚炎や自己免疫性皮膚疾患の抑制にはたらくという報告もある7).さらに最近,制御性T細胞が産生するRANKLは乳がんの転移にかかわるという報告もなされており8),RANKLは骨に限定されず免疫系においても実に多彩な機能をもつ.
1990年代末まで,大理石骨病マウスを呈するNF-κB p50とNF-κB p52のダブルノックアウトマウス,c-Fosノックアウトマウス,TRAF6ノックアウトマウスの解析により,破骨細胞の分化におけるこれらのタンパク質の重要性が明らかにされていた1).しかし,これらはインターロイキン1やToll様受容体など破骨細胞の分化が誘導されないような刺激でさえも活性化されるタンパク質であり,RANKL刺激に対し特異的なシグナル伝達分子とはいえなかった.筆者らは,破骨細胞を用いた網羅的なトランスクリプトーム解析により,RANKL刺激により特異的に誘導される転写因子としてNFATc1(nuclear factor of activated T cell c1)を見い出し,このNFATc1が破骨細胞の分化におけるマスター転写因子であることを明らかにした9,10).NFATc1は分化の過程で起こる一連のダイナミックな形態変化や骨吸収の機能にかかわる遺伝子の発現を誘導することができ,破骨細胞の分化における中枢的な機能を担う.最初,NFATファミリーはT細胞の活性化にかかわるとして同定された転写因子であり,この発見によっても,骨と免疫系との共通項目が見い出された.
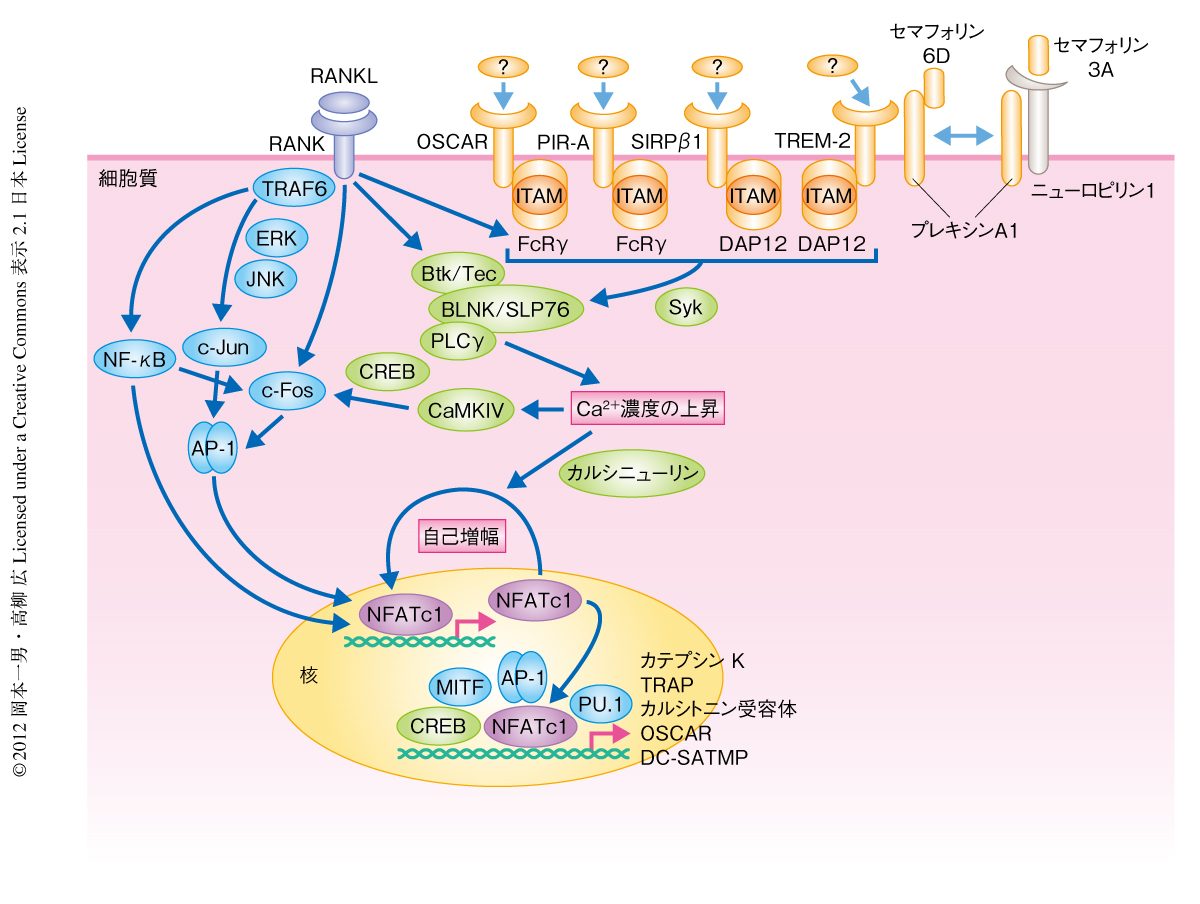
そののち,ITAM(immuno-receptor tyrosine-based activation moitif)配列をもつITAMアダプタータンパク質であるDAP12(DNAX-activating protein 12)およびFc受容体共通γサブユニットと会合する免疫グロブリン様受容体が,NFATc1の誘導と活性化に必須のCa2+シグナルを惹起する共刺激受容体であること11),さらに,TecおよびBtkがRANKとITAMアダプタータンパク質会合性免疫受容体からのシグナルの統合に必須であることを明らかにした12)(図1).実際,DAP12とFc受容体共通γサブユニットとのダブルノックアウトマウスや,BtkとTecとのダブルノックアウトマウスでは破骨細胞の分化の障害が原因で重篤な大理石骨病を呈する.特筆すべき点は,これら一連の破骨細胞の制御タンパク質が免疫系と共有されていることである.ほかにも,SHP-1やSHIPなどの脱リン酸化酵素,Blimp1,IRF8,Bcl6といった免疫系において重要な役割を担うタンパク質が破骨細胞の分化にかかわることが見い出されている1).
Fc受容体共通γサブユニットと会合する免疫グロブリン様受容体としてPIR-A(paired immunoglobulin-like receptor-A)とOSCAR(osteoclast-associated receptor)が,DAP12と会合する免疫グロブリン様受容体としてTREM-2(triggering receptor expressed in myeloid cells-2)とSIRPβ1(signal-regulatory protein β1)が同定されている11).また,DAP12遺伝子とTREM-2遺伝子の機能喪失変異は,多発性骨嚢胞による病的な骨折と白質脳症による若年性認知症を主徴とするNasu-Hakola病の成因として同定されている.マウスにおける骨の表現型とNasu-Hakola病患者でみられる骨の症状は完全に一致しないが,患者に由来する末梢血単核球では破骨細胞の分化に障害が認められる点からも,破骨細胞の分化における共刺激シグナルの重要性が理解できる.
近年,神経軸索の反発や初期胚の発生にかかわるプレキシンA1が,破骨細胞においてTREM-2とDAP12に会合しセマフォリン6Dシグナルを伝達することで破骨細胞の機能制御に関与していることが報告された13)(図1).実際,プレキシンA1ノックアウトマウスは破骨細胞の分化障害により大理石骨病を呈し,プレキシンA1-TREM-2-DAP12複合体を介した制御機構が破骨細胞の分化において重要であることがわかる.さらに最近,このプレキシンA1-TREM-2-DAP12複合体による分化制御に関して新たな制御機構が明らかとなった.破骨細胞前駆細胞では骨芽細胞の産生するセマフォリン3Aによりニューロピリン1とプレキシンA1からなるセマフォリン3A受容体複合体が形成され,プレキシンA1-TREM-2-DAP12複合体の形成が阻害されて破骨細胞の分化が抑制される.しかしながら,ニューロピリン1の発現はRANKL刺激により著明に低減するため,RANKL刺激ののちにはプレキシンA1-TREM-2-DAP12複合体が形成されセマフォリン6Dシグナルが伝達できるようになる14)(図1).興味深いことに,セマフォリン3Aは古典的Wnt経路をつうじて骨芽細胞の分化を促進し,脂肪細胞の分化を抑制する機能をもつことも判明した.すなわち,骨吸収の抑制と骨形成の促進という二重の作用をもつことから,セマフォリン3Aが骨関連疾患の新規の治療薬となることが期待される.
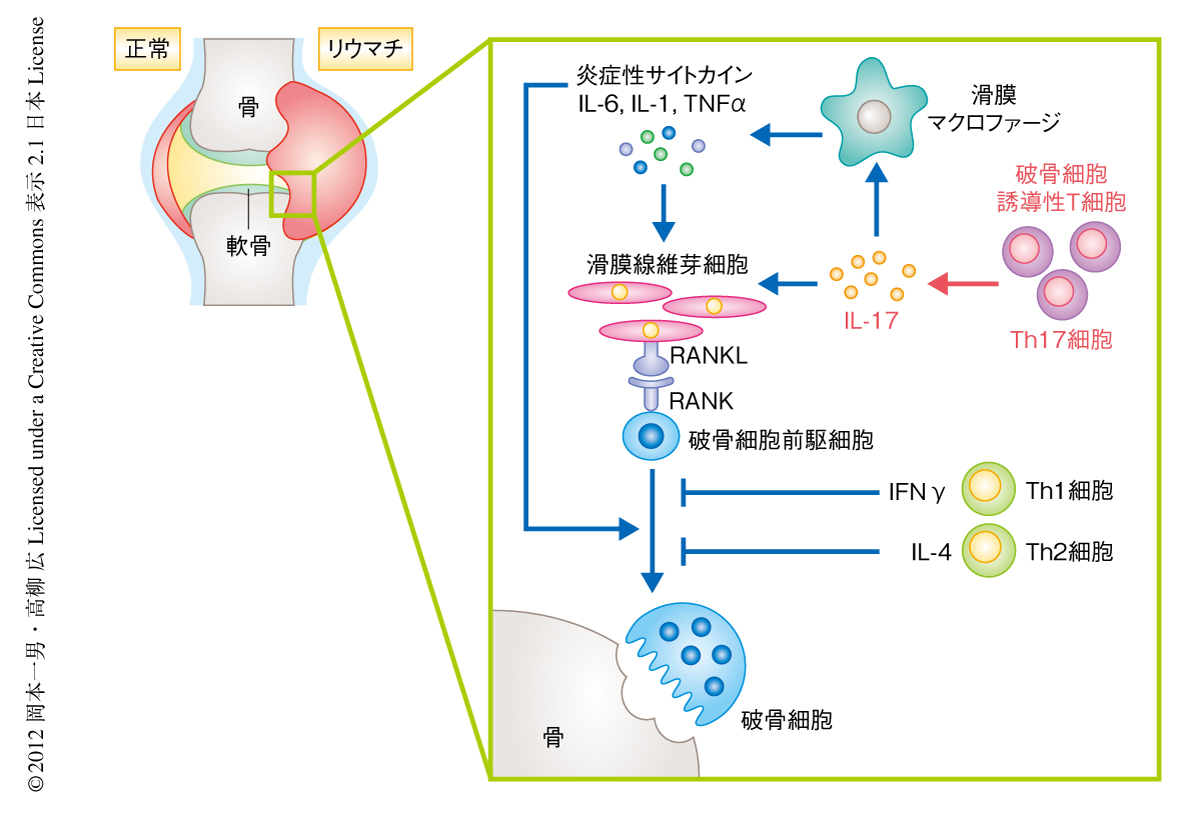
関節リウマチにおける骨破壊は骨と免疫系の密接な関係がもっともうきぼりとなる病態である.関節リウマチの発症初期の滑膜においてはT細胞などの炎症性細胞の浸潤が認められ,活動期では腫瘍様に増殖した滑膜組織(パンヌス)が骨の内部に侵入する像が認められる.滑膜組織にはT細胞,滑膜線維芽細胞,滑膜マクロファージなどが存在し,インターロイキン6,インターロイキン1,TNFαなどの炎症性サイトカインやタンパク質分解酵素が大量に産生されている.さらに,関節破壊病巣には多数の破骨細胞が観察され,破骨細胞の欠損マウスならびに破骨細胞の機能が障害されたマウスに実験的に関節炎を誘導しても骨破壊が認められないことから,破骨細胞は炎症性骨破壊において重要であることが実証されている15).
自己免疫応答の中枢となるT細胞に関して,骨破壊との関係は長年にわたり不明であった.活性化T細胞それ自体がRANKLを発現し直接的に破骨細胞の分化を促進するという報告があったが16),のちの筆者らの解析により,正常な活性化T細胞は大量に産生するインターフェロンγの作用により破骨細胞の分化を阻害することがわかった2)(この報告をうけて,さきにも述べたように,Nature誌の論説記事にて“osteoimmunology”という言葉が生まれた).CD4陽性T細胞は抗原刺激により活性化すると,周囲のサイトカインの環境により異なるヘルパーT細胞サブセットへと分化する.Th1細胞はおもにインターフェロンγを産生し,マクロファージの活性化などを介して炎症応答を誘導し細胞に侵入した細菌の排除にかかわる.また,Th2細胞はインターロイキン4やインターロイキン13などを産生し,寄生虫に対する感染防御やアレルギーにかかわる.そして近年,新規のサブセットとして同定されたTh17細胞はインターロイキン17やインターロイキン22を産生し,自己免疫性の炎症や細胞外の細菌あるいは真菌の感染に対する防御に必要とされている17).
現在ではそれぞれのヘルパーT細胞サブセットの性質に関し理解が深まったものの,筆者らが破骨細胞誘導性T細胞の同定に取り組みはじめた当時は,まだTh1/Th2パラダイムにより免疫病態が説明されていた時分であり関節リウマチはTh1型の疾患であると考えられていた.そこで実際に,それぞれのヘルパーT細胞サブセットが破骨細胞の分化へ及ぼす効果を個別に検討したところ,Th1細胞およびTh2細胞はともに破骨細胞の分化を強く抑制し,それぞれインターフェロンγおよびインターロイキン4がおもな抑制因子であることが判明した.一方,当時,同定されたばかりのTh17細胞について検討したところ,Th17細胞は骨芽細胞と骨髄細胞との共存培養系において破骨細胞の分化を顕著に誘導できることが確認された.また,インターロイキン17ノックアウトマウスに由来するTh17細胞ではその破骨細胞の分化誘導能は著しく低かった.インターロイキン17は滑膜細胞においてRANKLの発現を誘導する活性をもっており,Th17細胞はインターロイキン17の産生を介して骨芽細胞におけるRANKLの発現を誘導することが明らかになった18).Th17細胞は,1)局所の炎症を惹起する,2)インターロイキン17や局所の炎症の惹起により滑膜線維芽細胞においてRANKLを誘導する,3)Th17細胞それ自体がRANKLを発現する,といった特性をもち,破骨細胞誘導性T細胞サブセットとして骨破壊にかかわることが明らかになった(図2).
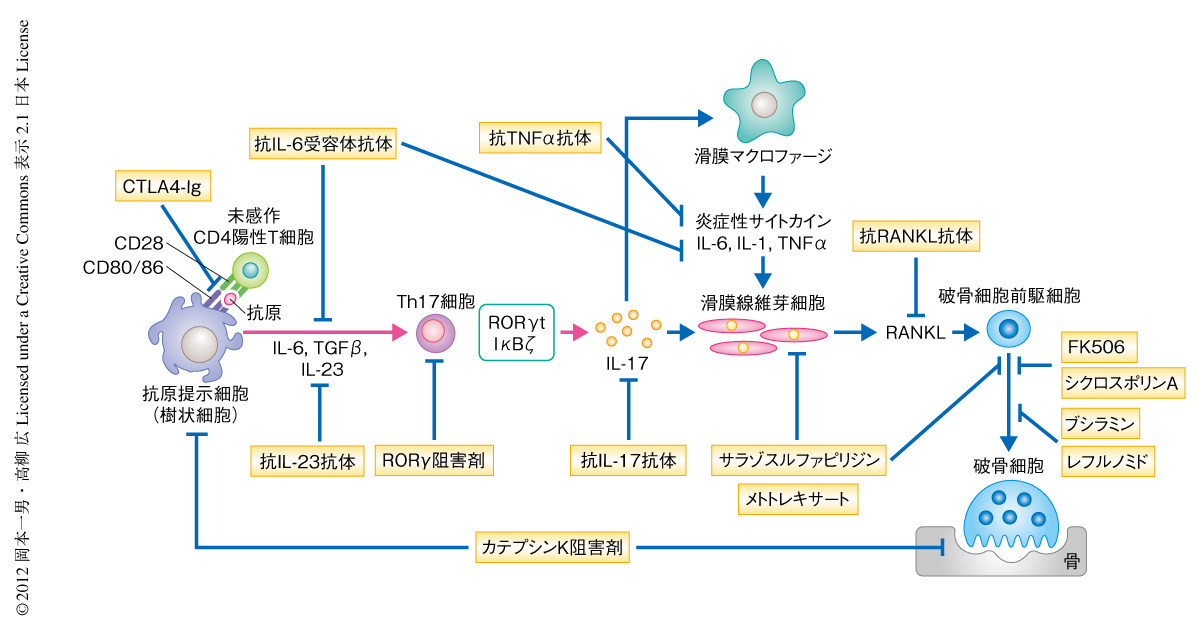
遅効性抗リウマチ薬は炎症の抑制効果を指標に開発されてきたが,筆者らは,メトトレキサート,レフルノミド,サラゾスルファピリジン,ブシラミン,タクロリムスなどがRANKLシグナルの抑制やRANKL発現の抑制効果をもつことを示した19)(図3).TNFαに対する中和抗体や可溶性受容体は臨床においてもっとも長い実績をもつ生物学的な製剤であり,すでに炎症に対する顕著な抑制能だけでなく,骨破壊にも効果を示すことが実証されている15).また,日本発の製剤である抗IL-6受容体抗体tocilizumabも一連の臨床試験から関節破壊に対する強い抑制効果が認められている.抗IL-6受容体抗体はTNFα阻害療法と同様に破骨前駆細胞や分化支持細胞への作用が期待され,また,Th17細胞の阻害といった自己免疫炎症の上流に作用をもつ可能性がある.最近,Th17細胞の産生するインターロイキン17が炎症の局所においてインターロイキン6の産生増幅をひき起こすことが関節炎の病態に重要であると報告され20),Th17細胞のエフェクター機能を阻害する効果も期待できる.2010年に国内承認を受けたCTLA4-Ig(abatacept)に関しても,TNFα阻害療法には劣るものの,骨破壊の抑制効果は臨床レベルにおいて報告されており,その安全性の高さも評価されている.さらに,抗IL-17抗体(LY2439821,secukinumab),抗インターロイキン12/23 p40抗体(ustekinumab,briakinumab),抗インターロイキン23 p19抗体といったTh17細胞をターゲットとしうる生物学的な製剤の開発も活発である15).抗IL-17抗体の関節リウマチに対する第II相試験の結果では,TNFα阻害療法やインターロイキン6阻害療法まではいたらぬものの,とくにLY2439821について有意な効果が示され,また,抗IL-インターロイキン12/23 p40抗体ustekinumabは乾癬に対しすでに承認されているが関節リウマチに対しては治験中であり,今後の解析が待たれる21).一方,サイトカイン受容体の下流にあるチロシンキナーゼJAKを標的とした阻害薬も多く開発されており,なかでも,tofacitinibは生物学的な製剤に比肩するという臨床報告がなされ注目があつまっている22).
Th17細胞の分化にはオーファン核内受容体であるRORγt(retinoid-related orphan receptor γt)が必須であることが知られている17).最近,このRORγtに対する特異的な阻害剤が見い出され,マウスの多発性硬化症モデルに高い治癒効果を示すことが報告された23,24).また筆者らは,転写因子IκBζがTh17細胞の分化における新規の制御タンパク質であることを見い出し,Th17細胞の分化に転写因子IκBζとRORγtとの協調作用が必要であることを明らかにしている25).Th17細胞の分化にかかわる転写制御の研究は新規の治療法の開発につながる可能性を秘めており,世界中で精力的に行われている.カテプシンKは破骨細胞による骨吸収に重要なプロテアーゼであり,骨量減少性の疾患に対する有望な治療標的である.筆者らは,新規のカテプシンK阻害剤を開発し,この低分子の阻害剤が破骨細胞の骨吸収を強く抑制し骨粗鬆症モデルや関節炎モデルに高い治癒効果を示すことを明らかにした26).興味深いことに,カテプシンKは樹状細胞においてToll様受容体のひとつTLR9からのシグナルの制御にはたらき,Th17細胞の分化誘導にかかわることがわかった.したがって,カテプシンK阻害剤は関節リウマチにおいて侵される免疫系と骨とを同時に治療できるといった相乗効果が期待できる(図3).ヒトとマウスではTh17細胞の分化に必須のサイトカインがやや異なっているという報告もあり17),今後,罹病期間や治療歴を考慮したうえで,関節リウマチにおけるTh17細胞の性質や動態に関する詳細な解析が必要であろう.
近年,骨芽細胞や破骨細胞といった骨代謝細胞が骨髄の微小環境において造血幹細胞の維持や動員にかかわるという興味深い報告が増えつつある.2003年,骨芽細胞の増減と造血幹細胞の細胞数との相関性が報告され,いわゆる“骨芽細胞性ニッチ”が示唆された27,28).そののち,骨芽細胞の数や機能の抑えられた遺伝子改変マウスの解析について複数の報告があるものの,統一した結果は得られていない29).また,さきの報告ではN-カドヘリン陽性骨芽細胞の重要性が指摘されているが,N-カドヘリンを欠損させたマウスでも造血幹細胞の数は正常であるという報告もなされており,骨芽細胞性ニッチの重要性に関しては議論が分かれている.造血幹細胞ニッチに関しては,CAR細胞(CXCL12を発現する特殊な細網細胞)や血管内皮細胞,ネスチン陽性間葉系幹細胞といった複数の骨髄構成細胞の重要性が提唱されている29).また,骨髄におけるB細胞の初期分化においてもCAR細胞や骨芽細胞,骨細胞の関与が示唆されており30-32),骨髄微小環境の複雑性が垣間みえる.とくに,CAR細胞およびネスチン陽性間葉系幹細胞は骨芽細胞への分化能をもつことが報告されており,今後は,これらの細胞における関係性を明確にすることが課題であろう.また,破骨細胞がカテプシンKやマトリックスメタロプロテアーゼのひとつMMP-9の分泌を介してCXCL12を分解し,造血幹細胞の末梢循環への動員の誘導にかかわるという報告もある33).しかし最近,c-Fosノックアウトマウスやop/opマウスといった破骨細胞を欠損したマウスの解析により,この動員の制御能に関して否定的な見解もなされている34).
セマフォリン6Dやセマフォリン3Aのほかにも,破骨細胞により産生されるセマフォリン4Dが骨芽細胞の分化を制御するという,破骨細胞と骨芽細胞との新たな相互作用も見い出されている35).免疫系の制御だけでなく神経回路の形成にも重要なセマフォリンファミリータンパク質がさまざまな局面において骨代謝を制御しているというこれらの発見により,免疫学とは別の分野との融合も期待される.また,ここでは,骨と免疫系とがかかわる代表的な病態として関節リウマチを紹介したが,ほかにも閉経後骨粗鬆症や炎症性骨折などさまざまな疾患が存在する.今後,関節リウマチでなしえた臨床への貢献にならい,ほかの疾患の制御においても骨免疫学が重要な知見を提供し,臨床応用へ橋渡しできることが望まれる.
略歴:2006年 京都大学大学院生命科学研究科 修了.同年 東京医科歯科大学医歯学総合研究科 博士研究員,2010年 同 助教を経て,2012年より東京大学大学院医学系研究科 助教.
研究テーマ:骨免疫学的な視点から,関節リウマチにとどまらず,さまざまな骨疾患や免疫疾患の病態の理解をめざしたい.
高柳 広(Hiroshi Takayanagi)
東京大学大学院医学系研究科 教授.科学技術振興機構ERATO高柳オステオネットワークプロジェクト 研究総括 兼任.
研究室URL:http://www.immunol.m.u-tokyo.ac.jp/
© 2012 岡本一男・高柳 広 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 免疫学教室)
email:岡本一男,高柳 広
領域融合レビュー, 1, e003 (2012) DOI: 10.7875/leading.author.1.e003
Kazuo Okamoto & Hiroshi Takayanagi: The history of osteoimmunology and its recent progress.
要 約
骨の恒常性は骨代謝細胞だけでなく,ほかの組織や細胞種との相互作用をつうじ複雑に制御されている.とくに,骨と免疫系はサイトカインなど多くの制御タンパク質を共有し不可分な関係を築いている.関節リウマチにおける炎症性骨破壊の研究はこうした骨と免疫系との相互作用に光をあて,両者の融合領域である“骨免疫学”発展の契機をもたらした.また,自己免疫炎症において重要なヘルパーT細胞のサブセットであるTh17細胞は,関節リウマチにおいて骨破壊を誘導する破骨細胞誘導性T細胞として機能することが明らかになり,骨免疫学の視点は臨床においても重要性を増してきている.さらに近年,骨髄を構成する細胞と造血幹細胞との関係性が指摘され,骨免疫学は多方面に発展しつつある.
はじめに
骨組織の恒常性は骨の古い組織が分解されて新しい組織に置き替えられること(骨リモデリング)により維持され,それは骨芽細胞による骨形成と破骨細胞による骨吸収とのバランスにより制御されている.このバランスの破綻は,関節リウマチ,閉経後骨粗鬆症,がん骨転移などの骨量減少性の疾患や,骨硬化症,大理石骨病などをひき起こすことになり,高齢化社会をむかえた現代において,こうしたロコモティブシンドローム(運動器症候群)の克服は医療における大きな課題である.このように骨代謝細胞の連携により生涯をつうじ骨組織が再構築されるわけだが,骨組織はほかの組織や細胞によっても複雑に制御をうけている.
なかでも,骨と免疫系は骨髄の微小環境,また,サイトカインやシグナル伝達分子など多くの制御タンパク質を共有し密接に関係している.“骨免疫学”(osteoimmunology)はこうした骨と免疫系との相互作用にフォーカスした融合領域として発展してきた1).そもそも“osteoimmunology”という呼称は,2000年,T細胞による破骨細胞の制御に関する筆者らの報告の際にNature誌の論説記事において使用されたことにはじまる2).いまでは多くの免疫系サイトカインが骨代謝にかかわることがわかっているが,なかでもRANKL(receptor activation of nuclear factor-κB ligand)は骨と免疫系とをつなぐもっとも重要なタンパク質である3).RANKLはT細胞に発現する樹状細胞の活性化タンパク質として免疫学においてすでに同定されていたサイトカインであった.のちに,破骨細胞の分化において必須のタンパク質であることが解明され,その発見は免疫系と骨代謝とをつなぐ大きな契機になった.また,破骨細胞の分化機序が解明されていくにつれ,意外にも,免疫系の細胞で機能する多くのシグナル伝達分子や転写因子が破骨細胞にとっても重要であることが判明し,骨と免疫系における共有性がよりいっそう明るみになった.
ここでは,これまでの骨免疫学の発展の経緯を概説しつつ,関節リウマチの病態の理解へむけた骨免疫学の研究,さらには,骨髄の微小環境における骨と造血幹細胞ニッチについての最新の知見を紹介し,この学際領域の新展開について述べる.
1.骨と免疫系とを結ぶサイトカインRANKL
破骨細胞は単球/マクロファージ系前駆細胞に由来する多核巨細胞であり,骨基質に接着すると極性化し酸やタンパク質分解酵素を分泌することで骨を吸収する.破骨細胞の分化には,破骨細胞前駆細胞が骨芽細胞や滑膜線維芽細胞など間葉系の支持細胞と接触し分化誘導シグナルを受け取ることが必要であり,1990年代後半に,その分化に必須のサイトカインとしてRANKLが同定された.RANKLは破骨細胞前駆細胞において受容体であるRANKと結合し分化誘導シグナルを伝達する.最近,骨リモデリングにかかわるRANKLの発現細胞として,骨組織に埋没した骨細胞の重要性が明らかにされた4).これまで,その単離の困難さのため骨細胞の生理機能の研究は不十分であったが,骨細胞において特異的にGFPを発現する遺伝子改変マウスの作製により,骨細胞がRANKLを高く発現していることが判明し,さらに,骨細胞において特異的にRANKLを欠損させたマウスでは破骨細胞の分化障害により大理石骨病を呈することが示された4).
RANKLノックアウトマウスおよびRANKノックアウトマウスは重篤な大理石骨病と歯の萌出不全を呈する3).さきに述べたように,当初,RANKLは樹状細胞を制御する機能をもつサイトカインとして報告されたが,RANKLノックアウトマウスおよびRANKノックアウトマウスでは樹状細胞の機能に差は認められない.一方,RANKLノックアウトマウスおよびRANKノックアウトマウスではリンパ節の形成不全や胸腺の髄質上皮細胞の分化障害といった免疫組織の異常が認められる.胸腺の髄質上皮細胞の分化には胸腺細胞やリンパ組織誘導細胞,γδT細胞からのRANKLシグナル伝達の必要性が論じられており5,6),中枢性免疫寛容の成立にもRANKL-RANK経路がかかわっている.また,表皮細胞に由来するRANKLが制御性T細胞の増殖を誘導し,アレルギー性接触皮膚炎や自己免疫性皮膚疾患の抑制にはたらくという報告もある7).さらに最近,制御性T細胞が産生するRANKLは乳がんの転移にかかわるという報告もなされており8),RANKLは骨に限定されず免疫系においても実に多彩な機能をもつ.
2.破骨細胞の分化の分子機構
1990年代末まで,大理石骨病マウスを呈するNF-κB p50とNF-κB p52のダブルノックアウトマウス,c-Fosノックアウトマウス,TRAF6ノックアウトマウスの解析により,破骨細胞の分化におけるこれらのタンパク質の重要性が明らかにされていた1).しかし,これらはインターロイキン1やToll様受容体など破骨細胞の分化が誘導されないような刺激でさえも活性化されるタンパク質であり,RANKL刺激に対し特異的なシグナル伝達分子とはいえなかった.筆者らは,破骨細胞を用いた網羅的なトランスクリプトーム解析により,RANKL刺激により特異的に誘導される転写因子としてNFATc1(nuclear factor of activated T cell c1)を見い出し,このNFATc1が破骨細胞の分化におけるマスター転写因子であることを明らかにした9,10).NFATc1は分化の過程で起こる一連のダイナミックな形態変化や骨吸収の機能にかかわる遺伝子の発現を誘導することができ,破骨細胞の分化における中枢的な機能を担う.最初,NFATファミリーはT細胞の活性化にかかわるとして同定された転写因子であり,この発見によっても,骨と免疫系との共通項目が見い出された.
そののち,ITAM(immuno-receptor tyrosine-based activation moitif)配列をもつITAMアダプタータンパク質であるDAP12(DNAX-activating protein 12)およびFc受容体共通γサブユニットと会合する免疫グロブリン様受容体が,NFATc1の誘導と活性化に必須のCa2+シグナルを惹起する共刺激受容体であること11),さらに,TecおよびBtkがRANKとITAMアダプタータンパク質会合性免疫受容体からのシグナルの統合に必須であることを明らかにした12)(図1).実際,DAP12とFc受容体共通γサブユニットとのダブルノックアウトマウスや,BtkとTecとのダブルノックアウトマウスでは破骨細胞の分化の障害が原因で重篤な大理石骨病を呈する.特筆すべき点は,これら一連の破骨細胞の制御タンパク質が免疫系と共有されていることである.ほかにも,SHP-1やSHIPなどの脱リン酸化酵素,Blimp1,IRF8,Bcl6といった免疫系において重要な役割を担うタンパク質が破骨細胞の分化にかかわることが見い出されている1).
3.共刺激シグナルを介した破骨細胞の分化制御
Fc受容体共通γサブユニットと会合する免疫グロブリン様受容体としてPIR-A(paired immunoglobulin-like receptor-A)とOSCAR(osteoclast-associated receptor)が,DAP12と会合する免疫グロブリン様受容体としてTREM-2(triggering receptor expressed in myeloid cells-2)とSIRPβ1(signal-regulatory protein β1)が同定されている11).また,DAP12遺伝子とTREM-2遺伝子の機能喪失変異は,多発性骨嚢胞による病的な骨折と白質脳症による若年性認知症を主徴とするNasu-Hakola病の成因として同定されている.マウスにおける骨の表現型とNasu-Hakola病患者でみられる骨の症状は完全に一致しないが,患者に由来する末梢血単核球では破骨細胞の分化に障害が認められる点からも,破骨細胞の分化における共刺激シグナルの重要性が理解できる.
近年,神経軸索の反発や初期胚の発生にかかわるプレキシンA1が,破骨細胞においてTREM-2とDAP12に会合しセマフォリン6Dシグナルを伝達することで破骨細胞の機能制御に関与していることが報告された13)(図1).実際,プレキシンA1ノックアウトマウスは破骨細胞の分化障害により大理石骨病を呈し,プレキシンA1-TREM-2-DAP12複合体を介した制御機構が破骨細胞の分化において重要であることがわかる.さらに最近,このプレキシンA1-TREM-2-DAP12複合体による分化制御に関して新たな制御機構が明らかとなった.破骨細胞前駆細胞では骨芽細胞の産生するセマフォリン3Aによりニューロピリン1とプレキシンA1からなるセマフォリン3A受容体複合体が形成され,プレキシンA1-TREM-2-DAP12複合体の形成が阻害されて破骨細胞の分化が抑制される.しかしながら,ニューロピリン1の発現はRANKL刺激により著明に低減するため,RANKL刺激ののちにはプレキシンA1-TREM-2-DAP12複合体が形成されセマフォリン6Dシグナルが伝達できるようになる14)(図1).興味深いことに,セマフォリン3Aは古典的Wnt経路をつうじて骨芽細胞の分化を促進し,脂肪細胞の分化を抑制する機能をもつことも判明した.すなわち,骨吸収の抑制と骨形成の促進という二重の作用をもつことから,セマフォリン3Aが骨関連疾患の新規の治療薬となることが期待される.
4.関節リウマチにおける骨破壊とTh17細胞
関節リウマチにおける骨破壊は骨と免疫系の密接な関係がもっともうきぼりとなる病態である.関節リウマチの発症初期の滑膜においてはT細胞などの炎症性細胞の浸潤が認められ,活動期では腫瘍様に増殖した滑膜組織(パンヌス)が骨の内部に侵入する像が認められる.滑膜組織にはT細胞,滑膜線維芽細胞,滑膜マクロファージなどが存在し,インターロイキン6,インターロイキン1,TNFαなどの炎症性サイトカインやタンパク質分解酵素が大量に産生されている.さらに,関節破壊病巣には多数の破骨細胞が観察され,破骨細胞の欠損マウスならびに破骨細胞の機能が障害されたマウスに実験的に関節炎を誘導しても骨破壊が認められないことから,破骨細胞は炎症性骨破壊において重要であることが実証されている15).
自己免疫応答の中枢となるT細胞に関して,骨破壊との関係は長年にわたり不明であった.活性化T細胞それ自体がRANKLを発現し直接的に破骨細胞の分化を促進するという報告があったが16),のちの筆者らの解析により,正常な活性化T細胞は大量に産生するインターフェロンγの作用により破骨細胞の分化を阻害することがわかった2)(この報告をうけて,さきにも述べたように,Nature誌の論説記事にて“osteoimmunology”という言葉が生まれた).CD4陽性T細胞は抗原刺激により活性化すると,周囲のサイトカインの環境により異なるヘルパーT細胞サブセットへと分化する.Th1細胞はおもにインターフェロンγを産生し,マクロファージの活性化などを介して炎症応答を誘導し細胞に侵入した細菌の排除にかかわる.また,Th2細胞はインターロイキン4やインターロイキン13などを産生し,寄生虫に対する感染防御やアレルギーにかかわる.そして近年,新規のサブセットとして同定されたTh17細胞はインターロイキン17やインターロイキン22を産生し,自己免疫性の炎症や細胞外の細菌あるいは真菌の感染に対する防御に必要とされている17).
現在ではそれぞれのヘルパーT細胞サブセットの性質に関し理解が深まったものの,筆者らが破骨細胞誘導性T細胞の同定に取り組みはじめた当時は,まだTh1/Th2パラダイムにより免疫病態が説明されていた時分であり関節リウマチはTh1型の疾患であると考えられていた.そこで実際に,それぞれのヘルパーT細胞サブセットが破骨細胞の分化へ及ぼす効果を個別に検討したところ,Th1細胞およびTh2細胞はともに破骨細胞の分化を強く抑制し,それぞれインターフェロンγおよびインターロイキン4がおもな抑制因子であることが判明した.一方,当時,同定されたばかりのTh17細胞について検討したところ,Th17細胞は骨芽細胞と骨髄細胞との共存培養系において破骨細胞の分化を顕著に誘導できることが確認された.また,インターロイキン17ノックアウトマウスに由来するTh17細胞ではその破骨細胞の分化誘導能は著しく低かった.インターロイキン17は滑膜細胞においてRANKLの発現を誘導する活性をもっており,Th17細胞はインターロイキン17の産生を介して骨芽細胞におけるRANKLの発現を誘導することが明らかになった18).Th17細胞は,1)局所の炎症を惹起する,2)インターロイキン17や局所の炎症の惹起により滑膜線維芽細胞においてRANKLを誘導する,3)Th17細胞それ自体がRANKLを発現する,といった特性をもち,破骨細胞誘導性T細胞サブセットとして骨破壊にかかわることが明らかになった(図2).
5.関節リウマチにおける炎症性骨破壊の治療戦略
遅効性抗リウマチ薬は炎症の抑制効果を指標に開発されてきたが,筆者らは,メトトレキサート,レフルノミド,サラゾスルファピリジン,ブシラミン,タクロリムスなどがRANKLシグナルの抑制やRANKL発現の抑制効果をもつことを示した19)(図3).TNFαに対する中和抗体や可溶性受容体は臨床においてもっとも長い実績をもつ生物学的な製剤であり,すでに炎症に対する顕著な抑制能だけでなく,骨破壊にも効果を示すことが実証されている15).また,日本発の製剤である抗IL-6受容体抗体tocilizumabも一連の臨床試験から関節破壊に対する強い抑制効果が認められている.抗IL-6受容体抗体はTNFα阻害療法と同様に破骨前駆細胞や分化支持細胞への作用が期待され,また,Th17細胞の阻害といった自己免疫炎症の上流に作用をもつ可能性がある.最近,Th17細胞の産生するインターロイキン17が炎症の局所においてインターロイキン6の産生増幅をひき起こすことが関節炎の病態に重要であると報告され20),Th17細胞のエフェクター機能を阻害する効果も期待できる.2010年に国内承認を受けたCTLA4-Ig(abatacept)に関しても,TNFα阻害療法には劣るものの,骨破壊の抑制効果は臨床レベルにおいて報告されており,その安全性の高さも評価されている.さらに,抗IL-17抗体(LY2439821,secukinumab),抗インターロイキン12/23 p40抗体(ustekinumab,briakinumab),抗インターロイキン23 p19抗体といったTh17細胞をターゲットとしうる生物学的な製剤の開発も活発である15).抗IL-17抗体の関節リウマチに対する第II相試験の結果では,TNFα阻害療法やインターロイキン6阻害療法まではいたらぬものの,とくにLY2439821について有意な効果が示され,また,抗IL-インターロイキン12/23 p40抗体ustekinumabは乾癬に対しすでに承認されているが関節リウマチに対しては治験中であり,今後の解析が待たれる21).一方,サイトカイン受容体の下流にあるチロシンキナーゼJAKを標的とした阻害薬も多く開発されており,なかでも,tofacitinibは生物学的な製剤に比肩するという臨床報告がなされ注目があつまっている22).
Th17細胞の分化にはオーファン核内受容体であるRORγt(retinoid-related orphan receptor γt)が必須であることが知られている17).最近,このRORγtに対する特異的な阻害剤が見い出され,マウスの多発性硬化症モデルに高い治癒効果を示すことが報告された23,24).また筆者らは,転写因子IκBζがTh17細胞の分化における新規の制御タンパク質であることを見い出し,Th17細胞の分化に転写因子IκBζとRORγtとの協調作用が必要であることを明らかにしている25).Th17細胞の分化にかかわる転写制御の研究は新規の治療法の開発につながる可能性を秘めており,世界中で精力的に行われている.カテプシンKは破骨細胞による骨吸収に重要なプロテアーゼであり,骨量減少性の疾患に対する有望な治療標的である.筆者らは,新規のカテプシンK阻害剤を開発し,この低分子の阻害剤が破骨細胞の骨吸収を強く抑制し骨粗鬆症モデルや関節炎モデルに高い治癒効果を示すことを明らかにした26).興味深いことに,カテプシンKは樹状細胞においてToll様受容体のひとつTLR9からのシグナルの制御にはたらき,Th17細胞の分化誘導にかかわることがわかった.したがって,カテプシンK阻害剤は関節リウマチにおいて侵される免疫系と骨とを同時に治療できるといった相乗効果が期待できる(図3).ヒトとマウスではTh17細胞の分化に必須のサイトカインがやや異なっているという報告もあり17),今後,罹病期間や治療歴を考慮したうえで,関節リウマチにおけるTh17細胞の性質や動態に関する詳細な解析が必要であろう.
6.骨髄における骨代謝細胞と造血幹細胞
近年,骨芽細胞や破骨細胞といった骨代謝細胞が骨髄の微小環境において造血幹細胞の維持や動員にかかわるという興味深い報告が増えつつある.2003年,骨芽細胞の増減と造血幹細胞の細胞数との相関性が報告され,いわゆる“骨芽細胞性ニッチ”が示唆された27,28).そののち,骨芽細胞の数や機能の抑えられた遺伝子改変マウスの解析について複数の報告があるものの,統一した結果は得られていない29).また,さきの報告ではN-カドヘリン陽性骨芽細胞の重要性が指摘されているが,N-カドヘリンを欠損させたマウスでも造血幹細胞の数は正常であるという報告もなされており,骨芽細胞性ニッチの重要性に関しては議論が分かれている.造血幹細胞ニッチに関しては,CAR細胞(CXCL12を発現する特殊な細網細胞)や血管内皮細胞,ネスチン陽性間葉系幹細胞といった複数の骨髄構成細胞の重要性が提唱されている29).また,骨髄におけるB細胞の初期分化においてもCAR細胞や骨芽細胞,骨細胞の関与が示唆されており30-32),骨髄微小環境の複雑性が垣間みえる.とくに,CAR細胞およびネスチン陽性間葉系幹細胞は骨芽細胞への分化能をもつことが報告されており,今後は,これらの細胞における関係性を明確にすることが課題であろう.また,破骨細胞がカテプシンKやマトリックスメタロプロテアーゼのひとつMMP-9の分泌を介してCXCL12を分解し,造血幹細胞の末梢循環への動員の誘導にかかわるという報告もある33).しかし最近,c-Fosノックアウトマウスやop/opマウスといった破骨細胞を欠損したマウスの解析により,この動員の制御能に関して否定的な見解もなされている34).
おわりに
セマフォリン6Dやセマフォリン3Aのほかにも,破骨細胞により産生されるセマフォリン4Dが骨芽細胞の分化を制御するという,破骨細胞と骨芽細胞との新たな相互作用も見い出されている35).免疫系の制御だけでなく神経回路の形成にも重要なセマフォリンファミリータンパク質がさまざまな局面において骨代謝を制御しているというこれらの発見により,免疫学とは別の分野との融合も期待される.また,ここでは,骨と免疫系とがかかわる代表的な病態として関節リウマチを紹介したが,ほかにも閉経後骨粗鬆症や炎症性骨折などさまざまな疾患が存在する.今後,関節リウマチでなしえた臨床への貢献にならい,ほかの疾患の制御においても骨免疫学が重要な知見を提供し,臨床応用へ橋渡しできることが望まれる.
文 献
- Takayanagi, H.: Osteoimmunology: shared mechanisms and crosstalk between the immune and bone systems. Nat. Rev. Immunol., 7, 292-304 (2007)[PubMed]
- Takayanagi, H., Ogasawara, K., Hida, S. et al.: T-cell-mediated regulation of osteoclastogenesis by signalling cross-talk between RANKL and IFN-γ. Nature, 408, 600-605 (2000)[PubMed]
- Theill, L. E., Boyle, W. J. & Penninger, J. M.: RANK-L and RANK: T cells, bone loss, and mammalian evolution. Annu. Rev. Immunol., 20, 795-823 (2002)[PubMed]
- Nakashima, T., Hayashi, M., Fukunaga, T. et al.: Evidence for osteocyte regulation of bone homeostasis through RANKL expression. Nat. Med., 17, 1231-1234 (2011)[PubMed]
- Nitta, T., Ohigashi, I., Nakagawa, Y. et al.: Cytokine crosstalk for thymic medulla formation. Curr. Opin. Immunol., 23, 190-197 (2011)[PubMed]
- Roberts, N. A., White, A. J., Jenkinson, W. E. et al.: Rank signaling links the development of invariant γδT cell progenitors and Aire+ medullary epithelium. Immunity, 36, 427-437 (2012)[PubMed]
- Loser, K., Mehling, A., Loeser, S. et al.: Epidermal RANKL controls regulatory T-cell numbers via activation of dendritic cells. Nat. Med., 12, 1372-1379 (2006)[PubMed]
- Tan, W., Zhang, W., Strasner, A. et al.: Tumour-infiltrating regulatory T cells stimulate mammary cancer metastasis through RANKL-RANK signalling. Nature, 470, 548-553 (2011)[PubMed]
- Takayanagi, H., Kim, S., Koga, T. et al.: Induction and activation of the transcription factor NFATc1 (NFAT2) integrate RANKL signaling in terminal differentiation of osteoclasts. Dev. Cell, 3, 889-901 (2002)[PubMed]
- Asagiri, M., Sato, K., Usami, T. et al.: Autoamplification of NFATc1 expression determines its essential role in bone homeostasis. J. Exp. Med., 202, 1261-1269 (2005)[PubMed]
- Koga, T., Inui, M., Inoue, K. et al.: Costimulatory signals mediated by the ITAM motif cooperate with RANKL for bone homeostasis. Nature, 428, 758-763 (2004)[PubMed]
- Shinohara, M., Koga, T., Okamoto, K. et al.: Tyrosine kinases Btk and Tec regulate osteoclast differentiation by linking RANK and ITAM signals. Cell, 132, 794-806 (2008)[PubMed]
- Takegahara, N., Takamatsu, H., Toyofuku, T. et al.: Plexin-A1 and its interaction with DAP12 in immune responses and bone homeostasis. Nat. Cell Biol., 8, 615-622 (2006)[PubMed]
- Hayashi, M., Nakashima, T., Taniguchi, M. et al.: Osteoprotection by semaphorin 3A. Nature, 485, 69-74 (2012)[PubMed] [新着論文レビュー]
- Okamoto, K. & Takayanagi, H.: Regulation of bone by the adaptive immune system in arthritis. Arthritis Res. Ther., 13, 219 (2011)[PubMed]
- Kong, Y. Y., Feige, U., Sarosi, I. et al.: Activated T cells regulate bone loss and joint destruction in adjuvant arthritis through osteoprotegerin ligand. Nature, 402, 304-309 (1999)[PubMed]
- Korn, T., Bettelli, E., Oukka, M. et al.: IL-17 and Th17 cells. Annu. Rev. Immunol., 27, 485-517 (2009)[PubMed]
- Sato, K., Suematsu, A., Okamoto, K. et al.: Th17 functions as an osteoclastogenic helper T cell subset that links T cell activation and bone destruction. J. Exp. Med., 203, 2673-2682 (2006)[PubMed]
- Takayanagi, H.: Osteoimmunology and the effects of the immune system on bone. Nat. Rev. Rheumatol., 5, 667-676 (2009)[PubMed]
- Ogura, H., Murakami, M., Okuyama, Y. et al.: Interleukin-17 promotes autoimmunity by triggering a positive-feedback loop via interleukin-6 induction. Immunity, 29, 628-636 (2008)[PubMed]
- Iwakura, Y., Ishigame, H., Saijo, S. et al.: Functional specialization of interleukin-17 family members. Immunity, 34, 149-162 (2011)[PubMed]
- Tanaka, Y., Maeshima, Y. & Yamaoka, K.: In vitro and in vivo analysis of a JAK inhibitor in rheumatoid arthritis. Ann. Rheum. Dis., 71(Suppl.2), i70-i74 (2012)[PubMed]
- Huh, J. R., Leung, M. W., Huang, P. et al.: Digoxin and its derivatives suppress TH17 cell differentiation by antagonizing RORγt activity. Nature, 472, 486-490 (2011)[PubMed]
- Solt, L. A., Kumar, N., Nuhant, P. et al.: Suppression of TH17 differentiation and autoimmunity by a synthetic ROR ligand. Nature, 472, 491-494 (2011)[PubMed]
- Okamoto, K., Iwai, Y., Oh-Hora, M. et al.: IκBζ regulates TH17 development by cooperating with ROR nuclear receptors. Nature, 464, 1381-1385 (2010)[PubMed]
- Asagiri, M., Hirai, T., Kunigami, T. et al.: Cathepsin K-dependent toll-like receptor 9 signaling revealed in experimental arthritis. Science, 319, 624-627 (2008)[PubMed]
- Calvi, L. M. Adams, G. B., Weibrecht, K. W. et al.: Osteoblastic cells regulate the haematopoietic stem cell niche. Nature, 425, 841-846 (2003)[PubMed]
- Zhang, J., Niu, C., Ye, L. et al.: Identification of the haematopoietic stem cell niche and control of the niche size. Nature, 425, 836-841 (2003)[PubMed]
- Mercier, F. E., Ragu, C. & Scadden, D. T.: The bone marrow at the crossroads of blood and immunity. Nat. Rev. Immunol., 12, 49-60 (2012)[PubMed]
- Nagasawa, T.: Microenvironmental niches in the bone marrow required for B-cell development. Nat. Rev. Immunol., 6, 107-116 (2006)[PubMed]
- Wu, J. Y., Purton, L. E., Rodda, S. J. et al.: Osteoblastic regulation of B lymphopoiesis is mediated by Gsα-dependent signaling pathways. Proc. Natl. Acad. Sci. USA, 105, 16976-16981 (2008)[PubMed]
- Cain, C. J., Rueda, R., McLelland, B. et al.: Absence of sclerostin adversely affects B-cell survival. J. Bone Miner. Res., 27, 1451-1461 (2012)[PubMed]
- Kollet, O., Dar, A., Shivtiel, S. et al.: Osteoclasts degrade endosteal components and promote mobilization of hematopoietic progenitor cells. Nat, Med., 12, 657-664 (2006)[PubMed]
- Miyamoto, K., Yoshida, S., Kawasumi, M. et al.: Osteoclasts are dispensable for hematopoietic stem cell maintenance and mobilization. J. Exp. Med., 208, 2175-2181 (2011)[PubMed]
- Negishi-Koga, T., Shinohara, M., Komatsu, N. et al.: Suppression of bone formation by osteoclastic expression of semaphorin 4D. Nat. Med., 17, 1473-1480 (2011)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:2006年 京都大学大学院生命科学研究科 修了.同年 東京医科歯科大学医歯学総合研究科 博士研究員,2010年 同 助教を経て,2012年より東京大学大学院医学系研究科 助教.
研究テーマ:骨免疫学的な視点から,関節リウマチにとどまらず,さまざまな骨疾患や免疫疾患の病態の理解をめざしたい.
高柳 広(Hiroshi Takayanagi)
東京大学大学院医学系研究科 教授.科学技術振興機構ERATO高柳オステオネットワークプロジェクト 研究総括 兼任.
研究室URL:http://www.immunol.m.u-tokyo.ac.jp/
© 2012 岡本一男・高柳 広 Licensed under CC 表示 2.1 日本