インターロイキン6による神経系と免疫系の融合
2012/10/11
有馬康伸・村上正晃
(大阪大学大学院生命機能研究科 免疫発生学研究室)
email:有馬康伸,村上正晃
領域融合レビュー, 1, e006 (2012) DOI: 10.7875/leading.author.1.e006
Yasunobu Arima & Masaaki Murakami: Establishment of integrated field between neurology and immunology via IL-6 amplifier.

病は気から,鍼灸による疾患の治療など,古来より神経系と免疫系との関与は知られてきている.これまで,求心性の神経の活性化が脳のホルモン中枢や視床下部などを刺激し,ホルモンの分泌を介し全身の免疫系を制御する,いわゆる“内分泌-免疫系”についてはくわしく解析されてきた.しかし,遠心性の神経の活性化あるいは不活性化が直接的に免疫臓器や疾患の標的臓器にはたらきかける“神経シグナル系”の現象に関しては,その役割および分子機構はほとんど判明していなかった.最近,筆者らを含め,いくつかのグループにより,神経シグナル系の具体的な事象が判明してその分子機構の解析が進み,遠心性の神経の刺激と免疫系とが融合した学問分野の形成がはじまった.ここでは,はじめに免疫系と神経系の基礎を紹介し,つづいて,神経の活性化による免疫病あるいは免疫反応の制御についてその現状と課題を記述して,最後に,筆者らによる,インターロイキン6を中心とした自己免疫疾患の研究がどのように神経系の研究と融合したのかを解説する.
免疫系の細胞は骨髄の造血幹細胞から生まれさまざまな細胞に分化する.T細胞のほかの細胞は骨髄において成熟し,一方,T細胞は胸腺において自己反応性の除去および非自己への最適な反応性を獲得する.免疫系細胞が生まれ分化する骨髄や胸腺を一次免疫臓器,非自己を待ち受け活性化する脾臓,リンパ節,扁桃,虫垂,パイエル板などを二次免疫臓器という.免疫系は大きく2つに分類される.進化学的に古い“自然免疫系”と,比較的新しい“獲得免疫系”である.自然免疫系に属する細胞は,樹状細胞,マクロファージ,顆粒球(好中球,好酸球,好塩基球,肥満細胞),ナチュラルキラー細胞などで,獲得免疫系の細胞はB細胞とT細胞である.進化の過程において免疫系は体内から外来の細菌やウイルスを除去するために発達したので,自己と非自己を見分ける,あるいは,認識することができる.自然免疫系の細胞は,細菌の表面のリポ多糖,リポタンパク質,鞭毛,さらに,ウイルスに由来するRNA,細菌やウイルスのDNAなど,非自己のもつ一定のパターン化された構造を,Toll様受容体(Toll-like receptor:TLR),RIG様受容体(RIG-like receptor:RLR),NOD様受容体(NOD-like receptor:NLR)など,パターン認識受容体(pattern recognition receptor:PRR)により認識し貪食する.一方,獲得免疫系の細胞は,アミノ酸残基ひとつの違い,糖鎖の付加ひとつの違い,あるいは,タンパク質の立体構造の違いをも認識でき,B細胞受容体とT細胞受容体により担われている.ナチュラルキラー細胞による抗原の認識機構は少し特殊で,活性化受容体と抑制性受容体からのシグナルのバランスにより活性化する.
獲得免疫系の細胞としてわれわれの体内には,染色体遺伝子の組換えにより形成される無数の多様性をもつB細胞受容体とT細胞受容体をそれぞれ発現したB細胞とT細胞が存在する.ウイルスや細菌が体内に侵入すると,B細胞およびT細胞において非自己を認識できる受容体をもつクローンが増殖し活性化する.B細胞受容体は非自己抗原を直接に認識でき,また,抗原の立体構造をも認識する.しかし,細胞の内部に侵入した抗原,あるいは,タンパク質の内部の構造は認識できない.T細胞受容体はMHC(major histocompatibility complex,主要組織適合遺伝子複合体)分子のうえに提示された10~20アミノ酸残基からなる非自己ペプチドをMHC分子とともに認識する.MHC分子において非自己ペプチドの結合するクレバスの周囲には個人間で多様性があり,これらの部位が臓器移植のときに移植患者のT細胞により認識されることにより移植片拒絶反応が生じる.MHC分子には2種類あり,ひとつはキラーT細胞に抗原ペプチドを提示するMHCクラスI分子,もうひとつはヘルパーT細胞に抗原ペプチドを提示するMHCクラスII分子である.MHCクラスI分子はヒトでは4種類あり,すべての有核細胞がもつ.MHCクラス分子による抗原ペプチドの提示は細胞に存在するすべてのタンパク質が対象となる.つまり,細胞において古くなったりフォールディングに失敗したりしたタンパク質は,ユビキチン化されプロテオソームにおいて分解されることによりペプチドとなり,MHCクラスI分子により提示される.細菌やウイルスは増殖が速いので,これらに感染した細胞では非自己に由来するペプチドはおもにMHCクラスI分子により提示される.一方,ヒトでは3種類あるMHCクラスII分子により,樹状細胞を中心とする抗原提示細胞が貪食した非自己に由来するペプチドが提示される.樹状細胞はからだの隅々にまでくまなく存在し非自己抗原の侵入に備える免疫監視の最初の関所である.最近では,貪食された抗原がMHCクラスI分子により提示されるクロスプレゼンテーションも見い出された.これは,ファゴソームから非自己のタンパク質あるいはペプチドが細胞質にもれでてユビキチン化され,プロテオソームに依存性に抗原ペプチドがつくられMHCクラスI分子により提示されるものである.
ウイルスや細菌にはMHCクラスI分子による抗原提示を阻害するタンパク質をもつものがしばしば存在すること,また,多くのがん細胞ではMHCクラスI分子をもたないものが増殖することから,MHCクラスI分子によるキラーT細胞への抗原の提示機構は感染細胞やがん細胞にとり非常な脅威であることがわかる.一方,MHCクラスII分子により抗原の提示をうけるヘルパーT細胞も免疫系においては重要であり,免疫疾患の鍵を握る細胞である.実際に,この細胞がないと,正常なキラーT細胞の反応も,B細胞から抗体を大量に産生する形質細胞への分化も起こらない.活性化したヘルパーT細胞がほかの細胞を“ヘルプ”するときに重要なタンパク質としてサイトカインがある.サイトカインとは,細胞のあいだのシグナル伝達に重要な可溶性のタンパク質で,分子量は約20,000と比較的小さく,インターロイキン(interleukin:IL),インターフェロン(interferon:IFN),ケモカイン,増殖因子,TNF(tumor necrosis factor,腫瘍壊死因子),TGF(transforming growth factor,トランスフォーミング増殖因子)など,100種類以上が含まれる.これまでの研究から,多くのサイトカインは免疫系ばかりでなく,神経系においても機能することがわかってきた.このレビューの主役のひとつであるインターロイキン6(IL-6)は,自然免疫系と獲得免疫系の両方に作用するサイトカインである.
活性化したヘルパーT細胞では抗原を提示したときに周囲に存在するサイトカインにより,それ自体の発現するサイトカインが決定されている.つまり,IL-12が多いとIFNγを放出するTh1細胞に,IL-4が多いとIL-4を放出するTh2細胞に,IL-6とTGFβが多いとIL-17を放出するTh17細胞に,TGFβが多いとほかのT細胞の活性化を抑制する制御性T細胞(Treg細胞)に分化する.これらのヘルパーT細胞のサブセットのなかで,とくに自己免疫疾患や炎症に対し正に関連するのはTh1細胞とTh17細胞であり,アレルギーなどに関連するのはTh2細胞である.筆者らが研究対象としている自己免疫疾患のなかには,T細胞が自己の抗原を認識して炎症が生じることにより臓器の機能が障害されて発症するものがある.筆者らが,神経系と免疫系との相互作用を証明した多発性硬化症のモデルである実験的自己免疫性脳脊髄炎は,ミエリンオリゴデンドロサイト糖タンパク質に由来するペプチドをマウスに免疫することにより,中枢神経系にTh1細胞およびTh17細胞に依存した炎症を誘導するものである.
このレビューのもうひとつの主役である神経系は,われわれが生存するための反応や行動に必要な情報をからだの隅々にまで伝達し処理を行う一連の器官である.神経系と免疫系では機能タンパク質を共有していることが多々知られている.たとえば,マウスのT細胞の表面に存在するThy1抗原は神経のマーカーとしても有名である.さらに,神経系の発生の際に機能するガイダンスタンパク質であるセマフォリンはさまざまな免疫細胞に発現しており,免疫反応が正常に生じるためにも非常に重要である.また,筆者らが研究対象としているIL-6ファミリーサイトカインには,神経細胞の栄養因子であるCNTF(ciliary neurotrophic factor,繊毛様神経栄養因子)も属している.
中枢神経系は脳(大脳,間脳,中脳,橋,小脳,延髄)と脊髄からなり,中枢神経系から末梢にむかい延びるのが末梢神経系である.脳のなかでも,とくに生命の維持に重要な間脳,中脳,橋,延髄をあわせて脳幹という.一方,末梢神経系は神経細胞体が集まって神経節を形成し,神経線維(軸索)にて中枢神経系と各種の臓器とを結んでいる.脳からでる末梢神経は脳神経といわれ,嗅神経,視神経,動眼神経,滑車神経,三叉神経,外転神経,顔面神経,内耳神経,舌咽神経,迷走神経,副神経,舌下神経の左右12対が存在する.一方,脊椎神経は脊椎の椎間口ごとに1対ずつ存在する.頸椎は8対(C1~C8,マウスでは7対),胸椎は12対(T1~T12,マウスでは13対),腰椎は5対(L1~L5,マウスでは6対),仙椎は5対(S1~S5)ある.神経には末梢の臓器から中枢神経系にシグナルを伝達する求心性神経と,中枢神経系のシグナルを末梢の臓器に伝達する遠心性神経の2種類が存在し,活性化したヘルパーT細胞と同様に,抑制性の神経と興奮性の神経が存在する.
機能的には神経系は体性神経と自律神経とに大別される.体性神経は,外来からの刺激を伝達する求心性の感覚神経と,末梢において反応を起こす遠心性の運動神経からなる.一方,自律神経は心拍,血圧,呼吸,分泌などからだの恒常性に関与するもので,闘争や逃避のときに機能する交感神経と,休息のときに機能する副交感神経がある.おのおのの臓器に分布する求心性の感覚神経は後根神経節を経由して脊椎の背側部の後根に入り中枢神経系につながる.中枢神経系からの遠心性神経は脊椎の腹側部の前根からは運動神経として末梢の臓器につながる.感覚神経と運動神経の神経線維は後根神経節をすぎると交感神経とともにひとつにまとまり末梢の臓器に分布する.副交感性の神経として重要なのは内臓の感覚神経および運動神経でもある迷走神経で,脳神経の12対のなかで唯一,腹部にまで達している.
神経系におけるさまざまな疾患の病態の形成において,神経系に存在するマクロファージ様の細胞であるミクログリアはもとより,循環する血液から侵入する免疫系の細胞の関与を示唆する報告は多い.中枢神経系における自己免疫疾患である多発性硬化症のほかにも,神経変性疾患に分類されるアルツハイマー病,パーキンソン病,脊索硬化症などの病巣部において,活性化したT細胞の集積やIL-17Aの血中濃度の上昇が報告されている1-3).さらに,脊椎を損傷した際,その病巣に浸潤する活性化したT細胞,とくにTh1細胞が治癒を誘導することも示された4).統合失調症などの精神疾患においても,炎症がその病態に関与していることが示唆されている.
さきに述べたように,神経への刺激には求心性と遠心性の2つが存在し,神経系と免疫系との相互作用はそれぞれの神経への刺激による制御をうけている.古くから認められ研究の進んでいる神経-免疫相互作用は,求心性の神経の活性化が視床下部や下垂体-副腎系に作用し,ステロイドを代表とするコルチコイドやアドレナリンなどカテコールアミンを血中に放出させ,内分泌系を介し免疫系に間接的に影響をあたえる“求心性神経-内分泌-免疫系の相互作用”である5-7).実際に,神経への刺激によるグルココルチコイドを介した免疫の抑制機構の論文は多々ある.とくに,胸腺に存在する幼弱なT細胞はグルココルチコイドに対し非常に感受性が高く,さまざまな神経の活性化により影響をうける.また,さまざまな炎症性疾患に随伴する慢性の疼痛においては,求心性の感覚神経の刺激が絶え間なく入力することにより,その刺激を投影する脳の灰白質の形態が炎症に依存的に変化することもわかっている.
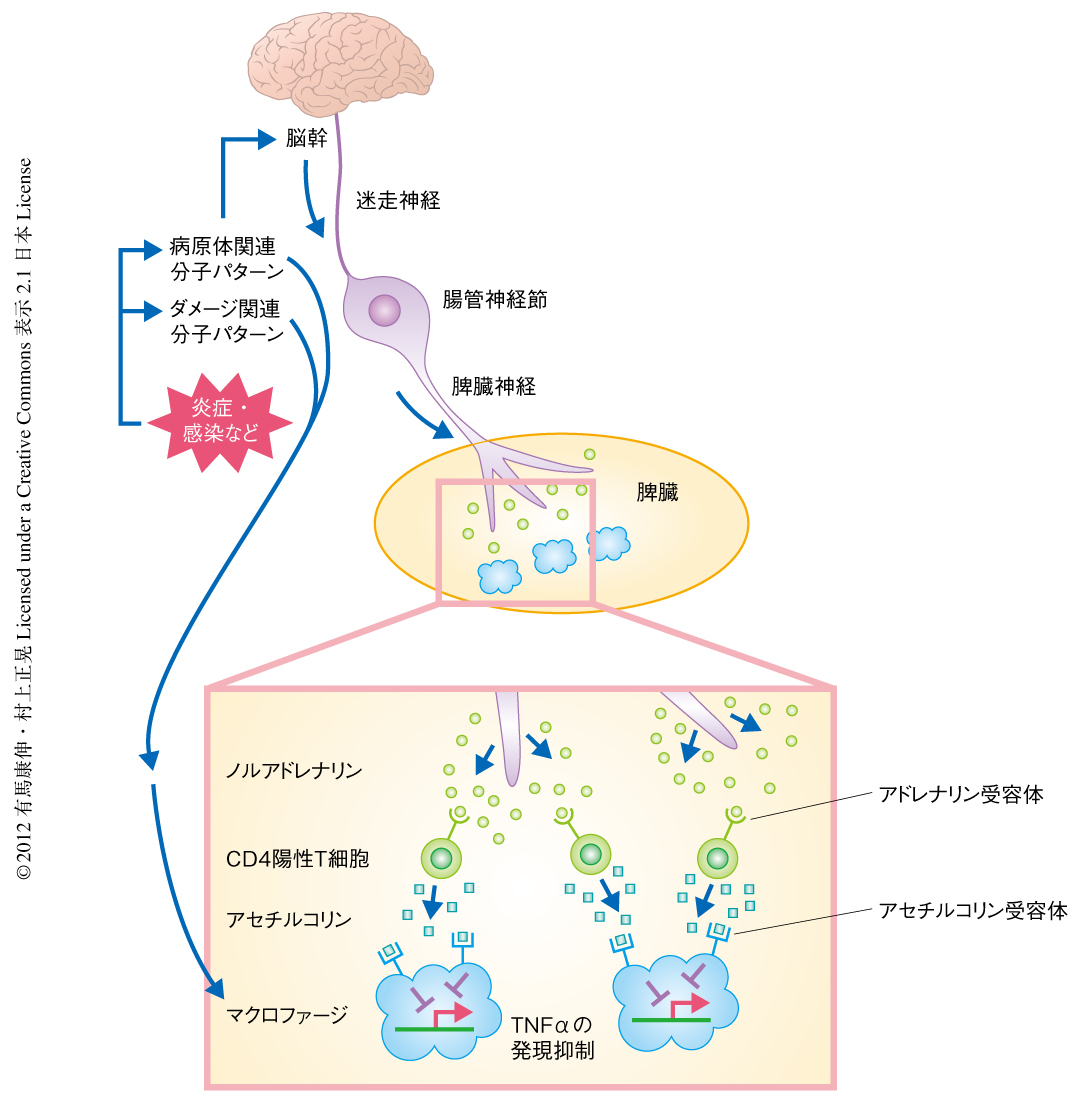
一方,遠心性の神経の活性化が胸腺,骨髄,脾臓やリンパ節などの免疫臓器に直接に作用し,神経伝達タンパク質の分泌を介し直接的に免疫細胞や近傍の細胞に影響をあたえる“遠心性神経-免疫系の相互作用”の研究においては,断定的な結論をもたらすような論文はほとんどなかった.この分野のパイオニアのひとりは,米国のTracey博士である.彼のグループは,すでに1990年代の後半からこの分野の研究を行っていた.当時,求心性の迷走神経への刺激が発熱反応やグルココルチコイドの分泌を誘導すること,遠心性の迷走神経への刺激がニコチン受容体を介し胸腺のリンパ球を減少させることがわかっていた.さらに,臨床的な知見から,喫煙者におけるニコチンの摂取が腸疾患を有意に改善することが見い出された.これらの背景から,彼のグループは,アセチルコリン作動性の副交感神経が炎症反応を抑制するとの仮説をたて実験した結果,迷走神経の遠心性の活性化による刺激がアセチルコリンを介しマクロファージの活性化を抑制していることを見い出した8).具体的には,in vitroにおける実験にて,エンドトキシンの刺激ののちマクロファージから発現される炎症性サイトカイン,TNFα,IL-1β,IL-6,IL-18の発現はアセチルコリンにより抑制されたが,炎症抑制性サイトカインであるIL-10の発現は影響をうけなかった.逆に,迷走神経の電気刺激による活性化はIL-10とグルココルチコイドの血中濃度の上昇を誘導した.彼らは,この遠心性神経-免疫系の相互作用をアセチルコリン作動性の抗炎症経路と考え,さらなる検討をくわえた.その結果,迷走神経の遠心性の刺激により,腸管神経節をへて脾臓神経の末端から脾臓にてノルアドレナリンの発現が誘導されること,そのノルアドレナリンはメモリー表現型を示すCD4陽性T細胞においてアドレナリンβ1受容体とアドレナリンβ2受容体に作用してアセチルコリンの発現を誘導すること,さらにそののち,アセチルコリンは近傍のマクロファージにおいてα7ニコチン性アセチルコリン受容体に作用してリポ多糖による刺激ののちのTNFαの発現を抑制すること,を見い出した9).彼らは現在,免疫臓器への神経伝達物質の放出による免疫細胞の抑制経路を“Inflammatory Reflex”とよび,研究を続けている(図1).
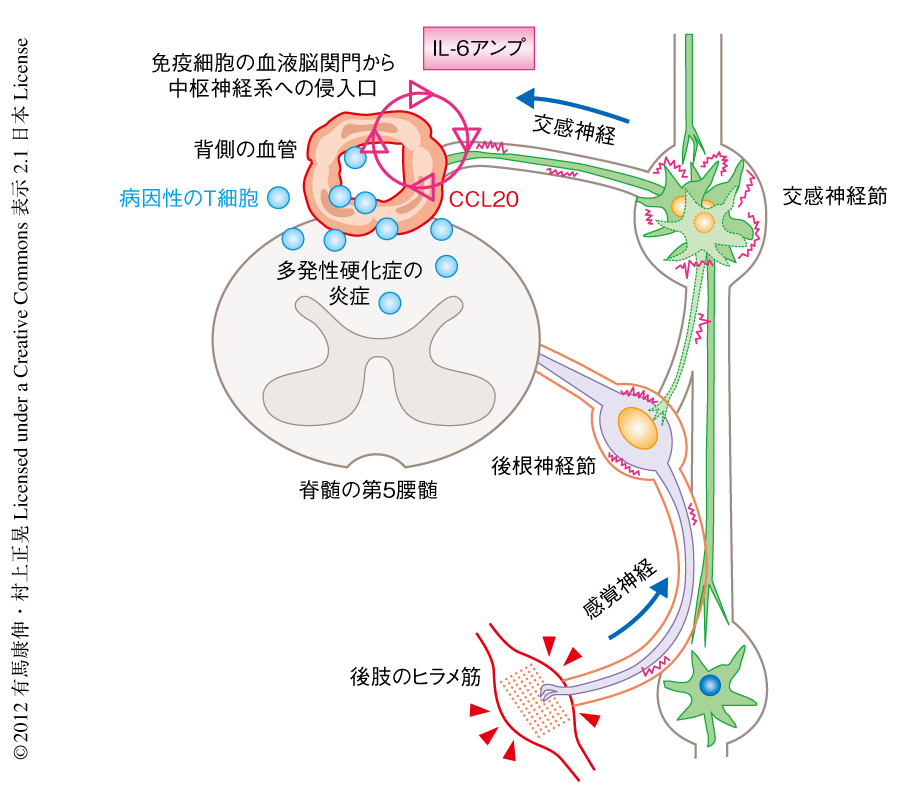
一方,筆者らが新たに発見した神経-免疫系の相互作用は,求心性の感覚神経の活性化が遠心性の交感神経の活性化をひき起こし,第5腰椎の背側の血管の内皮細胞にケモカインの過剰発現の機構である“IL-6アンプ”をノルアドレナリンに依存的に活性化し,ケモカインCCL20を誘導することにより血中の自己免疫性Th17細胞をその部位に集積させ自己免疫疾患を誘導するものである10)(新着論文レビュー でも掲載).最近になり,この血管内皮細胞への局所的な神経への刺激による免疫反応の促進経路は“Gateway Reflex”と名づけられたので,筆者らもこの名称を用いる(図2).
さらに,交感神経の活性化が組織への細胞の浸潤を促進していることについては筆者らのほかにも報告があり,サーカディアンリズムによる交感神経の活性化は非免疫系組織においてβアドレナリン受容体を介しケモカインや接着分子の発現を上昇させ,組織への免疫細胞の移行を促進することにより敗血症性ショックにも寄与していた11).また,免疫疾患だけでなくがんの研究においても,神経への刺激がその治癒に関連したという報告がなされており,マウスの飼育環境につき,より広い空間にてさまざまな形状の物体を配置して飼育することにより,がん細胞の増大を抑制できたという.この抑制機構の機序として,さまざまな視覚刺激により交感神経の活性化が起こり,その下流でレプチンの発現が抑制され腫瘍の抑制につながったとのことが証明された12).
このように,交感神経あるいは副交感神経系が免疫細胞に直接に作用したり,非免疫系細胞を介し間接的に作用したりすることにより,最終的に免疫反応を制御することが徐々に明らかになりつつある.以下,筆者らのIL-6アンプの発見を含む自己免疫疾患の研究の概要を紹介し,そののち,Gateway Reflexについて具体的に紹介する.
1981年,平野俊夫らは,結核患者の肺胞から浸出した細胞の培養上清に存在するB細胞に,抗体の産生を誘導する可溶性の分子があることを発見した13).このインターロイキン6(IL-6)は,1986年には,遺伝子の構造が決定された14).そののちの遺伝子組換えタンパク質を用いた実験から,IL-6には多彩な機能のあることがわかった.たとえば,肝臓においてはたらき炎症の指標となる急性期のタンパク質を産生させる,形質細胞種の増殖因子となる,カポジ肉腫の増殖因子となる,メサンギウム細胞の増殖因子となる,血小板を産生させる,ある種の神経において軸索を延長する,視床下部にはたらき各種のホルモンを分泌させる,破骨細胞を活性化させる,ケラチノサイトを増殖させる,T細胞の生存を誘導する,などである15).一方,IL-6を産生する細胞は非常に多くあり,多くの細胞は活性化するとIL-6を産生した.
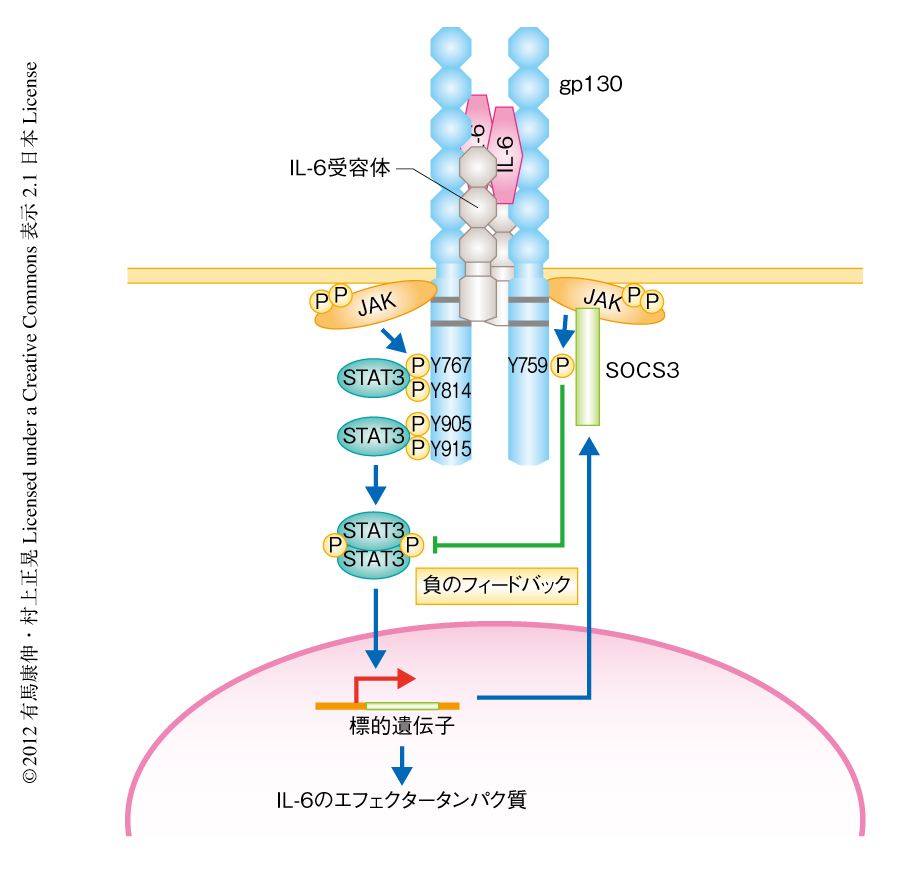
1988年に同定されたIL-6受容体は,細胞外領域にサイトカイン受容体ファミリーに特徴的な4つのシステイン残基をもつドメイン,さらに,Trp-Ser-任意のアミノ酸残基-Trp-Ser(WSxWS)というモチーフをもっていた.しかし,細胞内領域は極端に短かったため,IL-6受容体に会合するシグナル伝達タンパク質の存在が示唆された.実際に,IL-6を結合したIL-6受容体には分子量130,000の糖タンパク質gp130が会合した16).ヒトの胎盤からgp130を精製して抗gp130抗体を作製することにより,gp130をコードするcDNAがクローニングされた17).gp130はIL-6を結合したIL-6受容体の刺激により二量体を形成し,細胞膜の近傍にあるチロシンキナーゼJAKと結合しこれを活性化することで細胞にシグナルを伝達する18,19).そののち,STAT3がJAKの活性化に依存的に活性化して二量体を形成し,核に移動して炎症性タンパク質をコードする遺伝子の転写を亢進する.このとき,IL-6シグナルの負のフィードバックに機能するSOCS3も発現し,SOCS3がgp130に結合してJAKの活性化を抑制することによりIL-6シグナルは収束する15)(図3).
抗IL-6受容体抗体により慢性関節リウマチへの大きな治療効果が示された20).しかしながら,その効果の分子機構は長年にわたり不明であった.その理由のひとつは,IL-6依存性のよい疾患モデルが存在しなかったためであった.筆者らは,gp130において,SOCS3との結合に重要なTyr759をPheに置換したノックインマウス,F759マウスを作製した21).この遺伝子改変マウスではSOCS3に依存性の負のフィードバック機構が抑制されIL-6シグナルが持続的に導入されることにより,生後1年ほどでリウマチ様の関節炎が発症した22).F759マウスをMHCクラスII分子あるいはCD4を欠損したマウスと掛け合わせると疾患の発症は抑制され,また,F759マウスでは活性化したCD4陽性T細胞が加齢とともに増加した.さらに,F759マウスを用いた骨髄移植の実験から,非免疫系細胞に過剰なIL-6シグナルが存在すると,活性化したCD4陽性T細胞が増加し疾患の発症することがわかった23).さらに実験を進めると,過剰なIL-6シグナルは線維芽細胞や血管内皮細胞など非免疫系のI型コラーゲン陽性細胞に作用してT細胞の生存を誘導するサイトカインIL-7の発現を誘導し,活性化したCD4陽性T細胞,とくにTh17細胞が増加し関節炎の誘導されることが明らかになった23,24).つまり,F759マウスの関節炎は,非免疫系細胞に過剰なIL-6シグナルが伝達されIL-7が発現されることで,間接的にTh17細胞が誘導されることによりひき起こされていた.
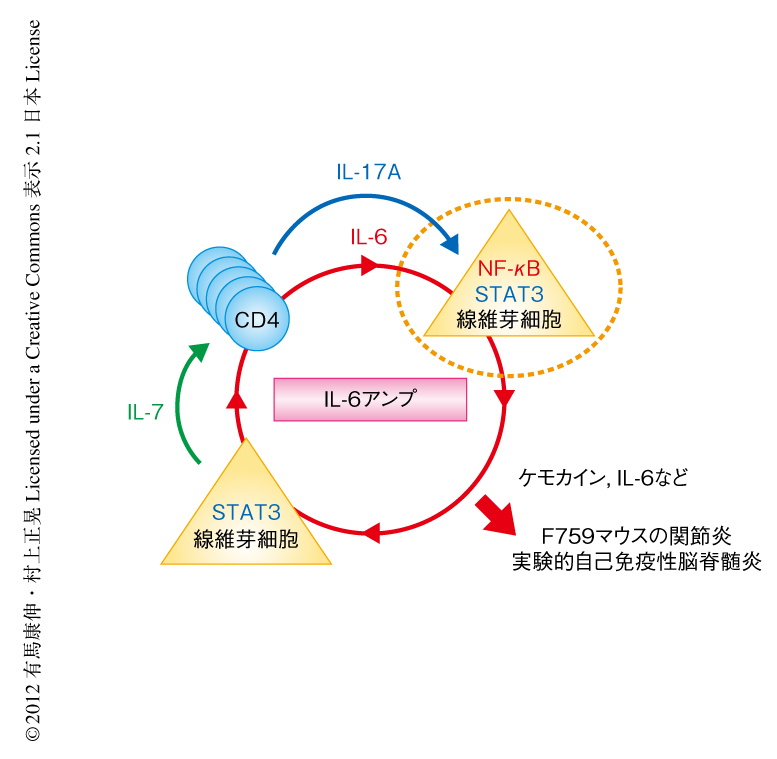
つぎの疑問は,過剰なIL-17はどのようにリウマチ様関節炎を誘導するかであった.IL-17を強制発現させたのち,血中において上昇するサイトカインを調べた.30個以上のサイトカインおよびケモカインについて調べたが,IL-6とケモカインのみが血中に大量に誘導された.この実験を契機として,IL-6の存在のもとIL-17がI型コラーゲン陽性細胞に作用してIL-6を再び大量に発現するIL-6の正のフィードバック機構,“IL-6アンプ”が発見された24)(図4).のちの研究から,IL-6アンプは機能的にはケモカインの大量発現を介し局所における炎症を誘導する機構であり,分子生物学的にはNF-κBとSTAT3の同時活性化であること,さらに,病理的には自己免疫疾患を含む炎症の誘導に重要であることが証明された24-26).
中枢神経系は血液脳関門とよばれる特殊な機構により一般の臓器とは隔絶されている.その存在は1913年に実証されて以来,特殊な血管の構造が実体であることが示唆されてきた.のちに,電子顕微鏡による観察により,中枢神経系の血管内皮細胞のあいだには密着結合(タイトジャンクション)の存在することがわかった.さらに,それら血管をとりまく細胞も周皮細胞,アストロサイト,マクロファージなど複数にわたるため,血中に存在する細胞の血管の外部への浸潤も制限されている.当初は,血中に存在する細胞や分子量の大きな物質は血液脳関門を通過できないと考えられていたが,最近では,さまざまなトランスポーターがその血管内皮細胞に存在しており,分子の選択的な出入りのあることも証明された.しかしながら,中枢神経系においても脳腫瘍などは発症し,さらに,ウイルスの感染や自己免疫疾患も生じる.実際に,正常な中枢神経系にも貪食作用をもつミクログリアが存在し,さまざまな免疫系細胞も少量ではあるが存在している.免疫系がどのような機構により血液脳関門をすりぬけ,中枢神経系において非自己を監視しこれを排除するのかは長年の疑問であった.視床下部などには血液脳関門は存在しないことから免疫細胞はそのような部位から中枢神経系へと移行する可能性,あるいは,髄液を分泌する脳の脈絡叢から病因性のT細胞の侵入する可能性が示されていた.
筆者らがリウマチとともに研究対象としている多発性硬化症は,中枢神経系の脱髄性疾患であり,脳,脊髄,視神経などに多様な神経症状が生じ,多くの患者では再発と寛解をくり返す.特定疾患に認定されている指定難病であり,わが国では10万人あたり10人ほど,欧米では10万人あたり50人ほどの罹患率である.女性に多く発症のピークは30歳ほどである.原因は完全には特定されていないが,自己反応性のCD4陽性T細胞,とくにTh17細胞とTh1細胞の関与が示唆されている.このような多発性硬化症の動物モデルとして,筆者らは,実験的自己免疫性脳脊髄炎を用いている.自己抗原であるミエリンオリゴデンドロサイト糖タンパク質ペプチドを正常なC57BL/6マウスに免疫すると,2週間ほどで脊髄および脳に自己反応性のCD4陽性T細胞(Th17細胞とTh1細胞)が浸潤し麻痺を主徴とした病態を呈する.病態を発症したマウスから自己反応性CD4陽性T細胞を単離して正常なマウスの静脈に移入すると1週間ほどで弱い症状が認められ,2週間をピークに実験的自己免疫性脳脊髄炎の病態を生じる.血管内皮細胞や非免疫系細胞においてgp130やSTAT3を欠損したマウスを宿主にするとその病態は抑制され,また,IL-17Aノックアウトマウスから自己反応性CD4陽性T細胞を作製したときにも病態は抑制されたことから,実験的自己免疫性脳脊髄炎の発症はIL-6アンプの活性化に依存していることがわかった24).
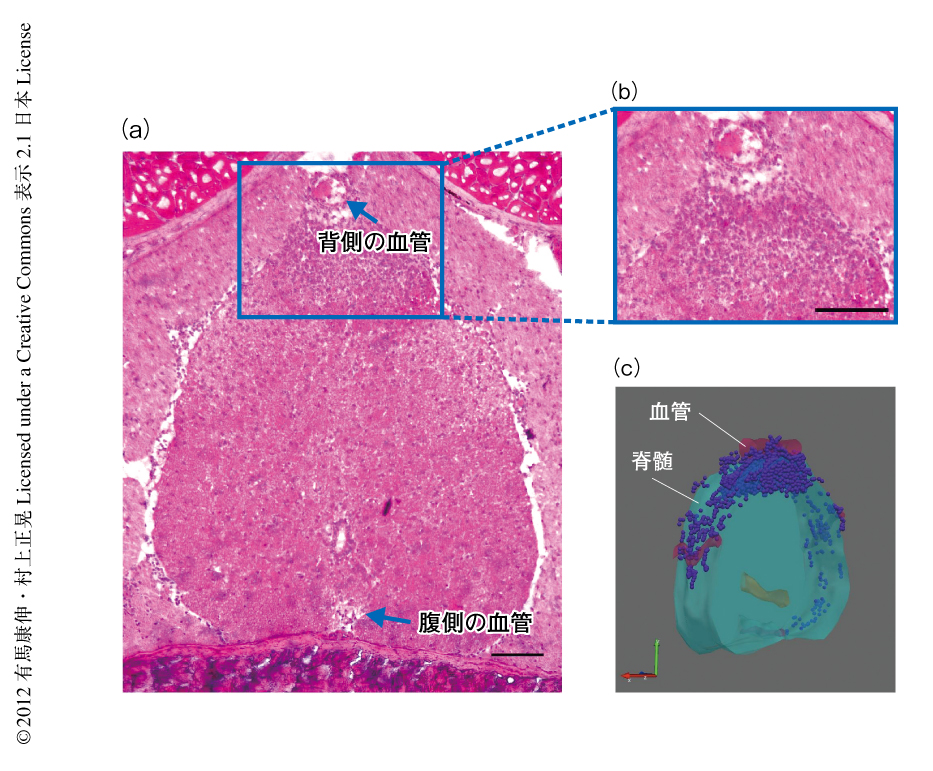
筆者らの作製した実験的自己免疫性脳脊髄炎の病態の発症は,教科書的には非常に不思議なものであった.血液脳関門の存在にもかかわらず,血中に存在する自己反応性ヘルパーT細胞が中枢神経系に侵入し病態を形成するのである.病態の明確な発症よりもまえ,自己反応性ヘルパーT細胞の静脈への移入ののち5日目において脊髄を観察すると,自己反応性ヘルパーT細胞は第5腰椎の背側の血管の周囲にのみに集積していた(図5).この集積はI型コラーゲン陽性の非免疫系細胞や血管内皮細胞においてgp130あるいはSTAT3を欠損させると認められず,さらに,自己反応性ヘルパーT細胞からIL-17Aを欠損させたときにも認められないこと,この部位の血管内皮細胞においてSTAT3やNF-κBが活性化されていたことから,血管内皮細胞におけるIL-6アンプの活性化が自己反応性ヘルパーT細胞の第5腰椎背側の血管の周囲への集積に重要であることが証明された.IL-6アンプはさまざまなケモカインの誘導機構である.この系において重要なケモカインの同定を試みたところ,第5腰椎背側の血管ではTh17細胞の集積に重要なケモカインであるCCL20の発現が上昇しており,また,CCL20受容体であるCCR6を欠損する自己反応性ヘルパーT細胞ではその浸潤は抑制された.
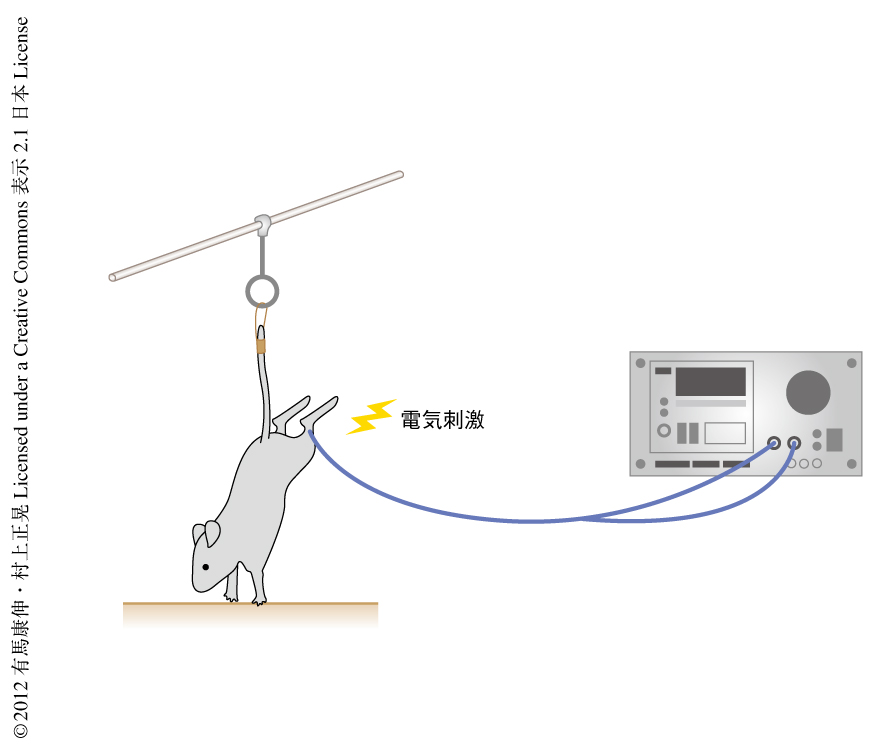
なぜ,第5腰椎背側の血管においてIL-6アンプが過剰に活性化しCCL20が発現しているのだろうか? 第5腰椎には最大の抗重力筋であるヒラメ筋からの感覚神経の後根神経節が存在するので,重力の刺激にともなうヒラメ筋の感覚神経の活性化が関与していると仮定した.そこで,米国航空宇宙局研究局(NASA)にて開発された地上で無重力を再現できる実験系“後肢懸垂”を用いた(図6).後肢を無重力状態にすると第5腰椎背側の血管におけるCCL20の発現は低下し,自己反応性ヘルパーT細胞の集積は認められなくなった.このとき,後根神経節では感覚神経の活性化も認められなかった.さらに,この状態でヒラメ筋を電気刺激すると(図6),刺激の時間に比例して第5腰椎背側の血管におけるCCL20の発現と後根神経節におけるc-fos遺伝子の発現が回復した.さらに,上腕三頭筋や大腿四頭筋を電気刺激すると,それぞれの感覚神経の後根神経節の存在する頸椎や第3腰椎背側の血管においてCCL20の発現と後根神経節におけるc-fos遺伝子の発現が上昇したことから,感覚神経の過剰な活性化によりその後根神経節の存在する部位の近傍,脊椎の背側の血管においてケモカインが発現し,自己反応性ヘルパーT細胞の中枢神経系への侵入口を形成していることがわかった.
つぎの疑問は,感覚神経の過剰な活性化がどのように第5腰椎背側の血管の状態を変化させるかであった.血管の状態は一般的に,自律神経である交感神経と副交感神経により制御されている.第5腰椎背側の血管における血流の速度を測定したところ,後肢懸垂によりその速度が有意に減少し,さらに,ヒラメ筋の電気刺激によりその速度は回復した.第5腰椎の近傍の交感神経節ではc-fos遺伝子の発現が過剰であり,活性化の状態は第1腰椎に比較し有意に高かった.実際に交感神経の末端から分泌されるノルアドレナリンにより血管内皮細胞を処理すると,IL-6アンプの活性化は亢進した.さらに,ノルアドレナリン受容体の阻害薬で処理すると,第5腰椎の背側の血管におけるCCL20の発現,NF-κBの活性化,自己反応性ヘルパーT細胞の浸潤,さらに,病態の発症が有意に抑制された.以上の実験事実より,感覚神経の過剰な活性化は近傍の交感神経節の活性化をひき起こすことが明らかになった.このとき,交感神経による支配領域の血管内皮細胞は過剰なノルアドレナリンにより曝露され,IL-6アンプの過剰な活性化を介しCCL20が発現して自己反応性ヘルパーT細胞の侵入口が形成され,この部位から中枢神経系の炎症性疾患が誘導される10)(図2).
これらの結果から得られた,神経系と免疫系との相互作用に関与する新しいコンセプトは,過剰な神経への刺激は近傍の血管の状態を変化させ免疫細胞の浸潤に関与する,というものである.今回,調べられた神経への刺激は重力や視覚を起点としたものであったが,精神的な刺激を含むほかの刺激でも,同様の事象が中枢神経系を含めさまざまな臓器の血管に生じる可能性がある.そのため,血中に運悪く特定臓器に対する自己反応性T細胞が存在し,その臓器の近傍に神経への過剰な刺激が存在すると,血管の状態が変化して標的臓器への自己反応性T細胞の浸潤が生じ炎症をひき起こす可能性があり,このコンセプトは,臓器に特異的な自己免疫疾患の発症機構に新たな視点を投じたものといえる.
リウマチモデルを用いたIL-6アンプの研究から,IL-6が炎症を誘導するには非免疫系のI型コラーゲン陽性細胞からのケモカインの過剰な発現が重要であることがわかった.さらに,IL-6アンプは多発性硬化症モデルにおいて重力による神経への刺激とあいまって,血液脳関門における免疫細胞の侵入口の形成に役立っていた.IL-6アンプというコンセプトは,活性化したCD4陽性T細胞などから発現するサイトカインが非免疫系細胞にはたらくとNF-κBとSTAT3が同時に活性化され,過剰なケモカインの産生を介して局所における炎症が誘導されるというもので,筆者らは,この機構が炎症,とくに慢性炎症の根本となる原理だと考えている.実際に,IL-6アンプの制御遺伝子や標的遺伝子に関し,遺伝学的な疾患関連遺伝子との比較を行ってみると,それらには疾患および病態の関連遺伝子が多々含まれ,また,その疾患および病態も自己免疫疾患ばかりでなく,メタボリック症候群,神経変性疾患,そのほかの炎症性疾患にまでおよんでいた.今後,IL-6アンプのさらなる解析により,炎症を起点とする疾患および病態の発症機構を解き明かすことにより,炎症の関与するさまざまな疾患により苦しむ人に少しでも貢献できればと考えている.
略歴:2012年 大阪大学大学院生命機能研究科 修了,同年より同 博士研究員.
抱負:神経への刺激による免疫反応の制御の研究を精力的に進めることで,さまざまな疾患に苦しむ患者さんに貢献したい.
村上 正晃(Masaaki Murakami)
大阪大学大学院生命機能研究科 准教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/molonc/www/index.html
© 2012 有馬康伸・村上正晃 Licensed under CC 表示 2.1 日本
(大阪大学大学院生命機能研究科 免疫発生学研究室)
email:有馬康伸,村上正晃
領域融合レビュー, 1, e006 (2012) DOI: 10.7875/leading.author.1.e006
Yasunobu Arima & Masaaki Murakami: Establishment of integrated field between neurology and immunology via IL-6 amplifier.
要 約
病は気から,鍼灸による疾患の治療など,古来より神経系と免疫系との関与は知られてきている.これまで,求心性の神経の活性化が脳のホルモン中枢や視床下部などを刺激し,ホルモンの分泌を介し全身の免疫系を制御する,いわゆる“内分泌-免疫系”についてはくわしく解析されてきた.しかし,遠心性の神経の活性化あるいは不活性化が直接的に免疫臓器や疾患の標的臓器にはたらきかける“神経シグナル系”の現象に関しては,その役割および分子機構はほとんど判明していなかった.最近,筆者らを含め,いくつかのグループにより,神経シグナル系の具体的な事象が判明してその分子機構の解析が進み,遠心性の神経の刺激と免疫系とが融合した学問分野の形成がはじまった.ここでは,はじめに免疫系と神経系の基礎を紹介し,つづいて,神経の活性化による免疫病あるいは免疫反応の制御についてその現状と課題を記述して,最後に,筆者らによる,インターロイキン6を中心とした自己免疫疾患の研究がどのように神経系の研究と融合したのかを解説する.
はじめに:免疫系と神経系の基礎
免疫系の細胞は骨髄の造血幹細胞から生まれさまざまな細胞に分化する.T細胞のほかの細胞は骨髄において成熟し,一方,T細胞は胸腺において自己反応性の除去および非自己への最適な反応性を獲得する.免疫系細胞が生まれ分化する骨髄や胸腺を一次免疫臓器,非自己を待ち受け活性化する脾臓,リンパ節,扁桃,虫垂,パイエル板などを二次免疫臓器という.免疫系は大きく2つに分類される.進化学的に古い“自然免疫系”と,比較的新しい“獲得免疫系”である.自然免疫系に属する細胞は,樹状細胞,マクロファージ,顆粒球(好中球,好酸球,好塩基球,肥満細胞),ナチュラルキラー細胞などで,獲得免疫系の細胞はB細胞とT細胞である.進化の過程において免疫系は体内から外来の細菌やウイルスを除去するために発達したので,自己と非自己を見分ける,あるいは,認識することができる.自然免疫系の細胞は,細菌の表面のリポ多糖,リポタンパク質,鞭毛,さらに,ウイルスに由来するRNA,細菌やウイルスのDNAなど,非自己のもつ一定のパターン化された構造を,Toll様受容体(Toll-like receptor:TLR),RIG様受容体(RIG-like receptor:RLR),NOD様受容体(NOD-like receptor:NLR)など,パターン認識受容体(pattern recognition receptor:PRR)により認識し貪食する.一方,獲得免疫系の細胞は,アミノ酸残基ひとつの違い,糖鎖の付加ひとつの違い,あるいは,タンパク質の立体構造の違いをも認識でき,B細胞受容体とT細胞受容体により担われている.ナチュラルキラー細胞による抗原の認識機構は少し特殊で,活性化受容体と抑制性受容体からのシグナルのバランスにより活性化する.
獲得免疫系の細胞としてわれわれの体内には,染色体遺伝子の組換えにより形成される無数の多様性をもつB細胞受容体とT細胞受容体をそれぞれ発現したB細胞とT細胞が存在する.ウイルスや細菌が体内に侵入すると,B細胞およびT細胞において非自己を認識できる受容体をもつクローンが増殖し活性化する.B細胞受容体は非自己抗原を直接に認識でき,また,抗原の立体構造をも認識する.しかし,細胞の内部に侵入した抗原,あるいは,タンパク質の内部の構造は認識できない.T細胞受容体はMHC(major histocompatibility complex,主要組織適合遺伝子複合体)分子のうえに提示された10~20アミノ酸残基からなる非自己ペプチドをMHC分子とともに認識する.MHC分子において非自己ペプチドの結合するクレバスの周囲には個人間で多様性があり,これらの部位が臓器移植のときに移植患者のT細胞により認識されることにより移植片拒絶反応が生じる.MHC分子には2種類あり,ひとつはキラーT細胞に抗原ペプチドを提示するMHCクラスI分子,もうひとつはヘルパーT細胞に抗原ペプチドを提示するMHCクラスII分子である.MHCクラスI分子はヒトでは4種類あり,すべての有核細胞がもつ.MHCクラス分子による抗原ペプチドの提示は細胞に存在するすべてのタンパク質が対象となる.つまり,細胞において古くなったりフォールディングに失敗したりしたタンパク質は,ユビキチン化されプロテオソームにおいて分解されることによりペプチドとなり,MHCクラスI分子により提示される.細菌やウイルスは増殖が速いので,これらに感染した細胞では非自己に由来するペプチドはおもにMHCクラスI分子により提示される.一方,ヒトでは3種類あるMHCクラスII分子により,樹状細胞を中心とする抗原提示細胞が貪食した非自己に由来するペプチドが提示される.樹状細胞はからだの隅々にまでくまなく存在し非自己抗原の侵入に備える免疫監視の最初の関所である.最近では,貪食された抗原がMHCクラスI分子により提示されるクロスプレゼンテーションも見い出された.これは,ファゴソームから非自己のタンパク質あるいはペプチドが細胞質にもれでてユビキチン化され,プロテオソームに依存性に抗原ペプチドがつくられMHCクラスI分子により提示されるものである.
ウイルスや細菌にはMHCクラスI分子による抗原提示を阻害するタンパク質をもつものがしばしば存在すること,また,多くのがん細胞ではMHCクラスI分子をもたないものが増殖することから,MHCクラスI分子によるキラーT細胞への抗原の提示機構は感染細胞やがん細胞にとり非常な脅威であることがわかる.一方,MHCクラスII分子により抗原の提示をうけるヘルパーT細胞も免疫系においては重要であり,免疫疾患の鍵を握る細胞である.実際に,この細胞がないと,正常なキラーT細胞の反応も,B細胞から抗体を大量に産生する形質細胞への分化も起こらない.活性化したヘルパーT細胞がほかの細胞を“ヘルプ”するときに重要なタンパク質としてサイトカインがある.サイトカインとは,細胞のあいだのシグナル伝達に重要な可溶性のタンパク質で,分子量は約20,000と比較的小さく,インターロイキン(interleukin:IL),インターフェロン(interferon:IFN),ケモカイン,増殖因子,TNF(tumor necrosis factor,腫瘍壊死因子),TGF(transforming growth factor,トランスフォーミング増殖因子)など,100種類以上が含まれる.これまでの研究から,多くのサイトカインは免疫系ばかりでなく,神経系においても機能することがわかってきた.このレビューの主役のひとつであるインターロイキン6(IL-6)は,自然免疫系と獲得免疫系の両方に作用するサイトカインである.
活性化したヘルパーT細胞では抗原を提示したときに周囲に存在するサイトカインにより,それ自体の発現するサイトカインが決定されている.つまり,IL-12が多いとIFNγを放出するTh1細胞に,IL-4が多いとIL-4を放出するTh2細胞に,IL-6とTGFβが多いとIL-17を放出するTh17細胞に,TGFβが多いとほかのT細胞の活性化を抑制する制御性T細胞(Treg細胞)に分化する.これらのヘルパーT細胞のサブセットのなかで,とくに自己免疫疾患や炎症に対し正に関連するのはTh1細胞とTh17細胞であり,アレルギーなどに関連するのはTh2細胞である.筆者らが研究対象としている自己免疫疾患のなかには,T細胞が自己の抗原を認識して炎症が生じることにより臓器の機能が障害されて発症するものがある.筆者らが,神経系と免疫系との相互作用を証明した多発性硬化症のモデルである実験的自己免疫性脳脊髄炎は,ミエリンオリゴデンドロサイト糖タンパク質に由来するペプチドをマウスに免疫することにより,中枢神経系にTh1細胞およびTh17細胞に依存した炎症を誘導するものである.
このレビューのもうひとつの主役である神経系は,われわれが生存するための反応や行動に必要な情報をからだの隅々にまで伝達し処理を行う一連の器官である.神経系と免疫系では機能タンパク質を共有していることが多々知られている.たとえば,マウスのT細胞の表面に存在するThy1抗原は神経のマーカーとしても有名である.さらに,神経系の発生の際に機能するガイダンスタンパク質であるセマフォリンはさまざまな免疫細胞に発現しており,免疫反応が正常に生じるためにも非常に重要である.また,筆者らが研究対象としているIL-6ファミリーサイトカインには,神経細胞の栄養因子であるCNTF(ciliary neurotrophic factor,繊毛様神経栄養因子)も属している.
中枢神経系は脳(大脳,間脳,中脳,橋,小脳,延髄)と脊髄からなり,中枢神経系から末梢にむかい延びるのが末梢神経系である.脳のなかでも,とくに生命の維持に重要な間脳,中脳,橋,延髄をあわせて脳幹という.一方,末梢神経系は神経細胞体が集まって神経節を形成し,神経線維(軸索)にて中枢神経系と各種の臓器とを結んでいる.脳からでる末梢神経は脳神経といわれ,嗅神経,視神経,動眼神経,滑車神経,三叉神経,外転神経,顔面神経,内耳神経,舌咽神経,迷走神経,副神経,舌下神経の左右12対が存在する.一方,脊椎神経は脊椎の椎間口ごとに1対ずつ存在する.頸椎は8対(C1~C8,マウスでは7対),胸椎は12対(T1~T12,マウスでは13対),腰椎は5対(L1~L5,マウスでは6対),仙椎は5対(S1~S5)ある.神経には末梢の臓器から中枢神経系にシグナルを伝達する求心性神経と,中枢神経系のシグナルを末梢の臓器に伝達する遠心性神経の2種類が存在し,活性化したヘルパーT細胞と同様に,抑制性の神経と興奮性の神経が存在する.
機能的には神経系は体性神経と自律神経とに大別される.体性神経は,外来からの刺激を伝達する求心性の感覚神経と,末梢において反応を起こす遠心性の運動神経からなる.一方,自律神経は心拍,血圧,呼吸,分泌などからだの恒常性に関与するもので,闘争や逃避のときに機能する交感神経と,休息のときに機能する副交感神経がある.おのおのの臓器に分布する求心性の感覚神経は後根神経節を経由して脊椎の背側部の後根に入り中枢神経系につながる.中枢神経系からの遠心性神経は脊椎の腹側部の前根からは運動神経として末梢の臓器につながる.感覚神経と運動神経の神経線維は後根神経節をすぎると交感神経とともにひとつにまとまり末梢の臓器に分布する.副交感性の神経として重要なのは内臓の感覚神経および運動神経でもある迷走神経で,脳神経の12対のなかで唯一,腹部にまで達している.
1.神経系の活性化による免疫病および免疫反応の制御
神経系におけるさまざまな疾患の病態の形成において,神経系に存在するマクロファージ様の細胞であるミクログリアはもとより,循環する血液から侵入する免疫系の細胞の関与を示唆する報告は多い.中枢神経系における自己免疫疾患である多発性硬化症のほかにも,神経変性疾患に分類されるアルツハイマー病,パーキンソン病,脊索硬化症などの病巣部において,活性化したT細胞の集積やIL-17Aの血中濃度の上昇が報告されている1-3).さらに,脊椎を損傷した際,その病巣に浸潤する活性化したT細胞,とくにTh1細胞が治癒を誘導することも示された4).統合失調症などの精神疾患においても,炎症がその病態に関与していることが示唆されている.
さきに述べたように,神経への刺激には求心性と遠心性の2つが存在し,神経系と免疫系との相互作用はそれぞれの神経への刺激による制御をうけている.古くから認められ研究の進んでいる神経-免疫相互作用は,求心性の神経の活性化が視床下部や下垂体-副腎系に作用し,ステロイドを代表とするコルチコイドやアドレナリンなどカテコールアミンを血中に放出させ,内分泌系を介し免疫系に間接的に影響をあたえる“求心性神経-内分泌-免疫系の相互作用”である5-7).実際に,神経への刺激によるグルココルチコイドを介した免疫の抑制機構の論文は多々ある.とくに,胸腺に存在する幼弱なT細胞はグルココルチコイドに対し非常に感受性が高く,さまざまな神経の活性化により影響をうける.また,さまざまな炎症性疾患に随伴する慢性の疼痛においては,求心性の感覚神経の刺激が絶え間なく入力することにより,その刺激を投影する脳の灰白質の形態が炎症に依存的に変化することもわかっている.
一方,遠心性の神経の活性化が胸腺,骨髄,脾臓やリンパ節などの免疫臓器に直接に作用し,神経伝達タンパク質の分泌を介し直接的に免疫細胞や近傍の細胞に影響をあたえる“遠心性神経-免疫系の相互作用”の研究においては,断定的な結論をもたらすような論文はほとんどなかった.この分野のパイオニアのひとりは,米国のTracey博士である.彼のグループは,すでに1990年代の後半からこの分野の研究を行っていた.当時,求心性の迷走神経への刺激が発熱反応やグルココルチコイドの分泌を誘導すること,遠心性の迷走神経への刺激がニコチン受容体を介し胸腺のリンパ球を減少させることがわかっていた.さらに,臨床的な知見から,喫煙者におけるニコチンの摂取が腸疾患を有意に改善することが見い出された.これらの背景から,彼のグループは,アセチルコリン作動性の副交感神経が炎症反応を抑制するとの仮説をたて実験した結果,迷走神経の遠心性の活性化による刺激がアセチルコリンを介しマクロファージの活性化を抑制していることを見い出した8).具体的には,in vitroにおける実験にて,エンドトキシンの刺激ののちマクロファージから発現される炎症性サイトカイン,TNFα,IL-1β,IL-6,IL-18の発現はアセチルコリンにより抑制されたが,炎症抑制性サイトカインであるIL-10の発現は影響をうけなかった.逆に,迷走神経の電気刺激による活性化はIL-10とグルココルチコイドの血中濃度の上昇を誘導した.彼らは,この遠心性神経-免疫系の相互作用をアセチルコリン作動性の抗炎症経路と考え,さらなる検討をくわえた.その結果,迷走神経の遠心性の刺激により,腸管神経節をへて脾臓神経の末端から脾臓にてノルアドレナリンの発現が誘導されること,そのノルアドレナリンはメモリー表現型を示すCD4陽性T細胞においてアドレナリンβ1受容体とアドレナリンβ2受容体に作用してアセチルコリンの発現を誘導すること,さらにそののち,アセチルコリンは近傍のマクロファージにおいてα7ニコチン性アセチルコリン受容体に作用してリポ多糖による刺激ののちのTNFαの発現を抑制すること,を見い出した9).彼らは現在,免疫臓器への神経伝達物質の放出による免疫細胞の抑制経路を“Inflammatory Reflex”とよび,研究を続けている(図1).
一方,筆者らが新たに発見した神経-免疫系の相互作用は,求心性の感覚神経の活性化が遠心性の交感神経の活性化をひき起こし,第5腰椎の背側の血管の内皮細胞にケモカインの過剰発現の機構である“IL-6アンプ”をノルアドレナリンに依存的に活性化し,ケモカインCCL20を誘導することにより血中の自己免疫性Th17細胞をその部位に集積させ自己免疫疾患を誘導するものである10)(新着論文レビュー でも掲載).最近になり,この血管内皮細胞への局所的な神経への刺激による免疫反応の促進経路は“Gateway Reflex”と名づけられたので,筆者らもこの名称を用いる(図2).
さらに,交感神経の活性化が組織への細胞の浸潤を促進していることについては筆者らのほかにも報告があり,サーカディアンリズムによる交感神経の活性化は非免疫系組織においてβアドレナリン受容体を介しケモカインや接着分子の発現を上昇させ,組織への免疫細胞の移行を促進することにより敗血症性ショックにも寄与していた11).また,免疫疾患だけでなくがんの研究においても,神経への刺激がその治癒に関連したという報告がなされており,マウスの飼育環境につき,より広い空間にてさまざまな形状の物体を配置して飼育することにより,がん細胞の増大を抑制できたという.この抑制機構の機序として,さまざまな視覚刺激により交感神経の活性化が起こり,その下流でレプチンの発現が抑制され腫瘍の抑制につながったとのことが証明された12).
このように,交感神経あるいは副交感神経系が免疫細胞に直接に作用したり,非免疫系細胞を介し間接的に作用したりすることにより,最終的に免疫反応を制御することが徐々に明らかになりつつある.以下,筆者らのIL-6アンプの発見を含む自己免疫疾患の研究の概要を紹介し,そののち,Gateway Reflexについて具体的に紹介する.
2.多機能サイトカインIL-6の発見とその受容体の構造
1981年,平野俊夫らは,結核患者の肺胞から浸出した細胞の培養上清に存在するB細胞に,抗体の産生を誘導する可溶性の分子があることを発見した13).このインターロイキン6(IL-6)は,1986年には,遺伝子の構造が決定された14).そののちの遺伝子組換えタンパク質を用いた実験から,IL-6には多彩な機能のあることがわかった.たとえば,肝臓においてはたらき炎症の指標となる急性期のタンパク質を産生させる,形質細胞種の増殖因子となる,カポジ肉腫の増殖因子となる,メサンギウム細胞の増殖因子となる,血小板を産生させる,ある種の神経において軸索を延長する,視床下部にはたらき各種のホルモンを分泌させる,破骨細胞を活性化させる,ケラチノサイトを増殖させる,T細胞の生存を誘導する,などである15).一方,IL-6を産生する細胞は非常に多くあり,多くの細胞は活性化するとIL-6を産生した.
1988年に同定されたIL-6受容体は,細胞外領域にサイトカイン受容体ファミリーに特徴的な4つのシステイン残基をもつドメイン,さらに,Trp-Ser-任意のアミノ酸残基-Trp-Ser(WSxWS)というモチーフをもっていた.しかし,細胞内領域は極端に短かったため,IL-6受容体に会合するシグナル伝達タンパク質の存在が示唆された.実際に,IL-6を結合したIL-6受容体には分子量130,000の糖タンパク質gp130が会合した16).ヒトの胎盤からgp130を精製して抗gp130抗体を作製することにより,gp130をコードするcDNAがクローニングされた17).gp130はIL-6を結合したIL-6受容体の刺激により二量体を形成し,細胞膜の近傍にあるチロシンキナーゼJAKと結合しこれを活性化することで細胞にシグナルを伝達する18,19).そののち,STAT3がJAKの活性化に依存的に活性化して二量体を形成し,核に移動して炎症性タンパク質をコードする遺伝子の転写を亢進する.このとき,IL-6シグナルの負のフィードバックに機能するSOCS3も発現し,SOCS3がgp130に結合してJAKの活性化を抑制することによりIL-6シグナルは収束する15)(図3).
3.IL-6に依存性のリウマチモデルマウスとIL-6アンプの発見
抗IL-6受容体抗体により慢性関節リウマチへの大きな治療効果が示された20).しかしながら,その効果の分子機構は長年にわたり不明であった.その理由のひとつは,IL-6依存性のよい疾患モデルが存在しなかったためであった.筆者らは,gp130において,SOCS3との結合に重要なTyr759をPheに置換したノックインマウス,F759マウスを作製した21).この遺伝子改変マウスではSOCS3に依存性の負のフィードバック機構が抑制されIL-6シグナルが持続的に導入されることにより,生後1年ほどでリウマチ様の関節炎が発症した22).F759マウスをMHCクラスII分子あるいはCD4を欠損したマウスと掛け合わせると疾患の発症は抑制され,また,F759マウスでは活性化したCD4陽性T細胞が加齢とともに増加した.さらに,F759マウスを用いた骨髄移植の実験から,非免疫系細胞に過剰なIL-6シグナルが存在すると,活性化したCD4陽性T細胞が増加し疾患の発症することがわかった23).さらに実験を進めると,過剰なIL-6シグナルは線維芽細胞や血管内皮細胞など非免疫系のI型コラーゲン陽性細胞に作用してT細胞の生存を誘導するサイトカインIL-7の発現を誘導し,活性化したCD4陽性T細胞,とくにTh17細胞が増加し関節炎の誘導されることが明らかになった23,24).つまり,F759マウスの関節炎は,非免疫系細胞に過剰なIL-6シグナルが伝達されIL-7が発現されることで,間接的にTh17細胞が誘導されることによりひき起こされていた.
つぎの疑問は,過剰なIL-17はどのようにリウマチ様関節炎を誘導するかであった.IL-17を強制発現させたのち,血中において上昇するサイトカインを調べた.30個以上のサイトカインおよびケモカインについて調べたが,IL-6とケモカインのみが血中に大量に誘導された.この実験を契機として,IL-6の存在のもとIL-17がI型コラーゲン陽性細胞に作用してIL-6を再び大量に発現するIL-6の正のフィードバック機構,“IL-6アンプ”が発見された24)(図4).のちの研究から,IL-6アンプは機能的にはケモカインの大量発現を介し局所における炎症を誘導する機構であり,分子生物学的にはNF-κBとSTAT3の同時活性化であること,さらに,病理的には自己免疫疾患を含む炎症の誘導に重要であることが証明された24-26).
4.血液脳関門と多発性硬化症
中枢神経系は血液脳関門とよばれる特殊な機構により一般の臓器とは隔絶されている.その存在は1913年に実証されて以来,特殊な血管の構造が実体であることが示唆されてきた.のちに,電子顕微鏡による観察により,中枢神経系の血管内皮細胞のあいだには密着結合(タイトジャンクション)の存在することがわかった.さらに,それら血管をとりまく細胞も周皮細胞,アストロサイト,マクロファージなど複数にわたるため,血中に存在する細胞の血管の外部への浸潤も制限されている.当初は,血中に存在する細胞や分子量の大きな物質は血液脳関門を通過できないと考えられていたが,最近では,さまざまなトランスポーターがその血管内皮細胞に存在しており,分子の選択的な出入りのあることも証明された.しかしながら,中枢神経系においても脳腫瘍などは発症し,さらに,ウイルスの感染や自己免疫疾患も生じる.実際に,正常な中枢神経系にも貪食作用をもつミクログリアが存在し,さまざまな免疫系細胞も少量ではあるが存在している.免疫系がどのような機構により血液脳関門をすりぬけ,中枢神経系において非自己を監視しこれを排除するのかは長年の疑問であった.視床下部などには血液脳関門は存在しないことから免疫細胞はそのような部位から中枢神経系へと移行する可能性,あるいは,髄液を分泌する脳の脈絡叢から病因性のT細胞の侵入する可能性が示されていた.
筆者らがリウマチとともに研究対象としている多発性硬化症は,中枢神経系の脱髄性疾患であり,脳,脊髄,視神経などに多様な神経症状が生じ,多くの患者では再発と寛解をくり返す.特定疾患に認定されている指定難病であり,わが国では10万人あたり10人ほど,欧米では10万人あたり50人ほどの罹患率である.女性に多く発症のピークは30歳ほどである.原因は完全には特定されていないが,自己反応性のCD4陽性T細胞,とくにTh17細胞とTh1細胞の関与が示唆されている.このような多発性硬化症の動物モデルとして,筆者らは,実験的自己免疫性脳脊髄炎を用いている.自己抗原であるミエリンオリゴデンドロサイト糖タンパク質ペプチドを正常なC57BL/6マウスに免疫すると,2週間ほどで脊髄および脳に自己反応性のCD4陽性T細胞(Th17細胞とTh1細胞)が浸潤し麻痺を主徴とした病態を呈する.病態を発症したマウスから自己反応性CD4陽性T細胞を単離して正常なマウスの静脈に移入すると1週間ほどで弱い症状が認められ,2週間をピークに実験的自己免疫性脳脊髄炎の病態を生じる.血管内皮細胞や非免疫系細胞においてgp130やSTAT3を欠損したマウスを宿主にするとその病態は抑制され,また,IL-17Aノックアウトマウスから自己反応性CD4陽性T細胞を作製したときにも病態は抑制されたことから,実験的自己免疫性脳脊髄炎の発症はIL-6アンプの活性化に依存していることがわかった24).
5.自己反応性CD4陽性T細胞の血液脳関門における侵入口
筆者らの作製した実験的自己免疫性脳脊髄炎の病態の発症は,教科書的には非常に不思議なものであった.血液脳関門の存在にもかかわらず,血中に存在する自己反応性ヘルパーT細胞が中枢神経系に侵入し病態を形成するのである.病態の明確な発症よりもまえ,自己反応性ヘルパーT細胞の静脈への移入ののち5日目において脊髄を観察すると,自己反応性ヘルパーT細胞は第5腰椎の背側の血管の周囲にのみに集積していた(図5).この集積はI型コラーゲン陽性の非免疫系細胞や血管内皮細胞においてgp130あるいはSTAT3を欠損させると認められず,さらに,自己反応性ヘルパーT細胞からIL-17Aを欠損させたときにも認められないこと,この部位の血管内皮細胞においてSTAT3やNF-κBが活性化されていたことから,血管内皮細胞におけるIL-6アンプの活性化が自己反応性ヘルパーT細胞の第5腰椎背側の血管の周囲への集積に重要であることが証明された.IL-6アンプはさまざまなケモカインの誘導機構である.この系において重要なケモカインの同定を試みたところ,第5腰椎背側の血管ではTh17細胞の集積に重要なケモカインであるCCL20の発現が上昇しており,また,CCL20受容体であるCCR6を欠損する自己反応性ヘルパーT細胞ではその浸潤は抑制された.
なぜ,第5腰椎背側の血管においてIL-6アンプが過剰に活性化しCCL20が発現しているのだろうか? 第5腰椎には最大の抗重力筋であるヒラメ筋からの感覚神経の後根神経節が存在するので,重力の刺激にともなうヒラメ筋の感覚神経の活性化が関与していると仮定した.そこで,米国航空宇宙局研究局(NASA)にて開発された地上で無重力を再現できる実験系“後肢懸垂”を用いた(図6).後肢を無重力状態にすると第5腰椎背側の血管におけるCCL20の発現は低下し,自己反応性ヘルパーT細胞の集積は認められなくなった.このとき,後根神経節では感覚神経の活性化も認められなかった.さらに,この状態でヒラメ筋を電気刺激すると(図6),刺激の時間に比例して第5腰椎背側の血管におけるCCL20の発現と後根神経節におけるc-fos遺伝子の発現が回復した.さらに,上腕三頭筋や大腿四頭筋を電気刺激すると,それぞれの感覚神経の後根神経節の存在する頸椎や第3腰椎背側の血管においてCCL20の発現と後根神経節におけるc-fos遺伝子の発現が上昇したことから,感覚神経の過剰な活性化によりその後根神経節の存在する部位の近傍,脊椎の背側の血管においてケモカインが発現し,自己反応性ヘルパーT細胞の中枢神経系への侵入口を形成していることがわかった.
つぎの疑問は,感覚神経の過剰な活性化がどのように第5腰椎背側の血管の状態を変化させるかであった.血管の状態は一般的に,自律神経である交感神経と副交感神経により制御されている.第5腰椎背側の血管における血流の速度を測定したところ,後肢懸垂によりその速度が有意に減少し,さらに,ヒラメ筋の電気刺激によりその速度は回復した.第5腰椎の近傍の交感神経節ではc-fos遺伝子の発現が過剰であり,活性化の状態は第1腰椎に比較し有意に高かった.実際に交感神経の末端から分泌されるノルアドレナリンにより血管内皮細胞を処理すると,IL-6アンプの活性化は亢進した.さらに,ノルアドレナリン受容体の阻害薬で処理すると,第5腰椎の背側の血管におけるCCL20の発現,NF-κBの活性化,自己反応性ヘルパーT細胞の浸潤,さらに,病態の発症が有意に抑制された.以上の実験事実より,感覚神経の過剰な活性化は近傍の交感神経節の活性化をひき起こすことが明らかになった.このとき,交感神経による支配領域の血管内皮細胞は過剰なノルアドレナリンにより曝露され,IL-6アンプの過剰な活性化を介しCCL20が発現して自己反応性ヘルパーT細胞の侵入口が形成され,この部位から中枢神経系の炎症性疾患が誘導される10)(図2).
これらの結果から得られた,神経系と免疫系との相互作用に関与する新しいコンセプトは,過剰な神経への刺激は近傍の血管の状態を変化させ免疫細胞の浸潤に関与する,というものである.今回,調べられた神経への刺激は重力や視覚を起点としたものであったが,精神的な刺激を含むほかの刺激でも,同様の事象が中枢神経系を含めさまざまな臓器の血管に生じる可能性がある.そのため,血中に運悪く特定臓器に対する自己反応性T細胞が存在し,その臓器の近傍に神経への過剰な刺激が存在すると,血管の状態が変化して標的臓器への自己反応性T細胞の浸潤が生じ炎症をひき起こす可能性があり,このコンセプトは,臓器に特異的な自己免疫疾患の発症機構に新たな視点を投じたものといえる.
おわりに
リウマチモデルを用いたIL-6アンプの研究から,IL-6が炎症を誘導するには非免疫系のI型コラーゲン陽性細胞からのケモカインの過剰な発現が重要であることがわかった.さらに,IL-6アンプは多発性硬化症モデルにおいて重力による神経への刺激とあいまって,血液脳関門における免疫細胞の侵入口の形成に役立っていた.IL-6アンプというコンセプトは,活性化したCD4陽性T細胞などから発現するサイトカインが非免疫系細胞にはたらくとNF-κBとSTAT3が同時に活性化され,過剰なケモカインの産生を介して局所における炎症が誘導されるというもので,筆者らは,この機構が炎症,とくに慢性炎症の根本となる原理だと考えている.実際に,IL-6アンプの制御遺伝子や標的遺伝子に関し,遺伝学的な疾患関連遺伝子との比較を行ってみると,それらには疾患および病態の関連遺伝子が多々含まれ,また,その疾患および病態も自己免疫疾患ばかりでなく,メタボリック症候群,神経変性疾患,そのほかの炎症性疾患にまでおよんでいた.今後,IL-6アンプのさらなる解析により,炎症を起点とする疾患および病態の発症機構を解き明かすことにより,炎症の関与するさまざまな疾患により苦しむ人に少しでも貢献できればと考えている.
文 献
- Sardi, F., Fassina, L., Venturini, L. et al.: Alzheimer's disease, autoimmunity and inflammation. The good, the bad and the ugly. Autoimmun. Rev., 11, 149-153 (2011)[PubMed]
- Appel, S. H., Beers, D. R. & Henkel, J. S.: T cell-microglial dialogue in Parkinson's disease and amyotrophic lateral sclerosis: are we listening? Trends Immunol., 31, 7-17 (2010)[PubMed]
- Brucklacher-Waldert, V., Stuerner, K., Kolster, M. et al.: Phenotypical and functional characterization of T helper 17 cells in multiple sclerosis. Brain, 132, 3329-3341 (2009)[PubMed]
- Ishii, H., Jin, X., Ueno, M. et al.: Adoptive transfer of Th1-conditioned lymphocytes promotes axonal remodeling and functional recovery after spinal cord injury. Cell Death Dis., 3, e363 (2012)[PubMed]
- Felten, D. L.: Neural influence on immune responses: underlying suppositions and basic principles of neural-immune signaling. Prog. Brain Res., 122, 381-389 (2000)[PubMed]
- Thayer, J. F. & Sternberg, E. M.: Neural aspects of immunomodulation: focus on the vagus nerve. Brain Behav. Immun., 24, 1223-1228 (2010)[PubMed]
- Nance, D. M. & Sanders, V. M.: Autonomic innervation and regulation of the immune system (1987-2007). Brain Behav. Immun., 21, 736-745 (2007)[PubMed]
- Borovikova, L. V., Ivanova, S., Zhang, M. et al.: Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin. Nature, 405, 458-462 (2000)[PubMed]
- Rosas-Ballina, M., Olofsson, P. S., Ochani, M. et al.: Acetylcholine-synthesizing T cells relay neural signals in a vagus nerve circuit. Science, 334, 98-101 (2011)[PubMed]
- Arima, Y., Harada, M., Kamimura, D. et al.: Regional neural activation defines a gateway for autoreactive T cells to cross the blood-brain barrier. Cell, 148, 447-457 (2012)[PubMed] [新着論文レビュー]
- Scheiermann, C., Kunisaki, Y., Lucas, D. et al.: Adrenergic nerves govern circadian leukocyte recruitment to tissues. Immunity, 37, 290-301 (2012)[PubMed]
- Cao, L., Liu, X., Lin, E. J. et al.: Environmental and genetic activation of a brain-adipocyte BDNF/leptin axis causes cancer remission and inhibition. Cell, 142, 52-64 (2010)[PubMed]
- Hirano, T., Teranishi, T., Toba, T. et al.: Human helper T cell factor(s) (THF). I. Partial purification and characterization. J. Immunol., 126, 517-522 (1981)[PubMed]
- Hirano, T., Yasukawa, K., Harada, H. et al.: Complementary DNA for a novel human interleukin (BSF-2) that induces B lymphocytes to produce immunoglobulin. Nature, 324, 73-76 (1986)[PubMed]
- Kamimura, D., Ishihara, K. & Hirano, T.: IL-6 signal transduction and its physiological roles: the signal orchestration model. Rev. Physiol. Biochem. Pharmacol., 149, 1-38 (2003)[PubMed]
- Taga, T., Hibi, M., Hirata, Y. et al.: Interleukin-6 triggers the association of its receptor with a possible signal transducer, gp130. Cell, 58, 573-581 (1989)[PubMed]
- Hibi, M., Murakami, M., Saito, M. et al.: Molecular cloning and expression of an IL-6 signal transducer, gp130. Cell, 63, 1149-1157 (1990)[PubMed]
- Murakami, M., Narazaki, M., Hibi, M. et al.: Critical cytoplasmic region of the interleukin 6 signal transducer gp130 is conserved in the cytokine receptor family. Proc. Natl. Acad. Sci. USA, 88, 11349-11353 (1991)[PubMed]
- Murakami, M., Hibi, M., Nakagawa, N. et al.: IL-6-induced homodimerization of gp130 and associated activation of a tyrosine kinase. Science, 260, 1808-1810 (1993)[PubMed]
- Nishimoto, N., Kishimoto, T. & Yoshizaki, K.: Anti-interleukin 6 receptor antibody treatment in rheumatic disease. Ann. Rheum. Dis., 59, i21-i27 (2000)[PubMed]
- Ohtani, T., Ishihara, K., Atsumi, T. et al.: Dissection of signaling cascades through gp130 in vivo: Reciprocal roles for STAT3- and SHP2-mediated signals in immune responses. Immunity, 12, 95-105 (2000)[PubMed]
- Atsumi, T., Ishihara, K., Kamimura, D. et al.: A point mutation of Tyr-759 in interleukin 6 family cytokine receptor subunit gp130 causes autoimmune arthritis. J. Exp. Med., 196, 979-990 (2002)[PubMed]
- Sawa, S., Kamimura, D., Jin, G. H. et al.: Autoimmune arthritis associated with mutated interleukin (IL)-6 receptor gp130 is driven by STAT3/IL-7-dependent homeostatic proliferation of CD4+ T cells. J. Exp. Med., 12, 1459-1470 (2006)[PubMed]
- Ogura, H., Murakami, M., Okuyama, Y. et al.: Interleukin-17 promotes autoimmunity by triggering a positive-feedback loop via interleukin-6 induction. Immunity, 29, 628-636 (2008)[PubMed]
- Murakami, M., Okuyama, Y., Ogura, H. et al.: Local microbleeding facilitates IL-6- and IL-17-dependent arthritis in the absence of tissue antigen recognition by activated T cells. J. Exp. Med., 208, 103-114 (2011)[PubMed]
- Lee, J., Nakagiri, T., Oto, T. et al.: IL-6 amplifier, NF-κB-triggered positive feedback for IL-6 signaling, in grafts is involved in allogeneic rejection responses. J. Immunol., 189, 1928-1936 (2012)[PubMed]
著者プロフィール
略歴:2012年 大阪大学大学院生命機能研究科 修了,同年より同 博士研究員.
抱負:神経への刺激による免疫反応の制御の研究を精力的に進めることで,さまざまな疾患に苦しむ患者さんに貢献したい.
村上 正晃(Masaaki Murakami)
大阪大学大学院生命機能研究科 准教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/molonc/www/index.html
© 2012 有馬康伸・村上正晃 Licensed under CC 表示 2.1 日本