植物の生殖細胞と受精戦略
2012/11/02
東山 哲也
(名古屋大学大学院理学研究科 生命理学専攻生殖分子情報学)
email:東山哲也
領域融合レビュー, 1, e007 (2012) DOI: 10.7875/leading.author.1.e007
Tetsuya Higashiyama: Plant germ cells and fertilization strategies.

毎日のように口にしている穀物は,どのような受精のしくみにより実っているのか,じつはまだ多くの謎に包まれている.しかし最近,複雑な花器官において特定の細胞をねらって解析するさまざまな技術の発展により,受精のしくみが急速に明らかになりつつある.解明された分子や細胞の動態から,生殖細胞の形成,花粉管ガイダンス,重複受精といった興味深い現象について植物の戦略が明らかになってきた.とくに,さまざまなペプチドを介した多様な細胞間コミュニケーションは主要なトピックスのひとつである.被子植物では,一般に,減数分裂ののちに生じる細胞のうち7つが協同して有性生殖を達成している.この7つの細胞には,雌雄で2つずつ,合計で4つの生殖細胞が含まれている.1対の卵と精子とで受精を行う動物に比べ,植物では複雑なシステムがはたらいていることが想像できる.ここでは,身近な存在である“花”においていかにして生殖細胞が形成され受精が達成されるのか,植物を研究対象とはしていない読者にむけ最新のエッセンスを紹介したい.
花は人類にとりさまざまな力をもつ存在である.見た目にも美しく,香りを漂わせ,やがては結実し食糧をもたらす.ここでは,このような花を咲かせる植物である被子植物について話を進める.
われわれ人類が主食としている穀物は,被子植物の受精によりつくられる種子である.植物の受精戦略は,ひとことでいってしまえば,限られた水と時間のなか効率よく繁殖を行うためのものである.砂漠に降った雨により植物が一斉に芽吹き,花を咲かせ,水が干上がるまえに種子をつくり次の世代へと命を繋げるようすは,まさに被子植物のもつ繁殖能力の象徴である.現生種として約760種が知られているイチョウやスギなどの裸子植物においては,生殖の方法は多様である1).それはまるで,種子をつくる植物におけるさまざまな進化の試行錯誤が,生きた化石として残っているかのようである.ところが,約25万種もある被子植物には,ここで説明する重複受精とよばれるしくみが普遍的にみられる.このことからも,重複受精のしくみを獲得した被子植物は爆発的な繁栄を誇っていると考えられる.
植物の生殖を理解するには,“配偶体”を理解することが重要である.動物では減数分裂により生じた細胞は,配偶子(受精にあずかる細胞)である卵と精子とにそのまま分化する.これに対し,植物では減数分裂により生じた細胞(1n細胞)は体細胞分裂をして多細胞の組織(配偶体)をつくり,そのなかで配偶子が分化する.
動物:減数分裂→配偶子(卵および精子)の分化→受精
植物:減数分裂→多細胞からなる配偶体の形成→配偶子の分化→受精
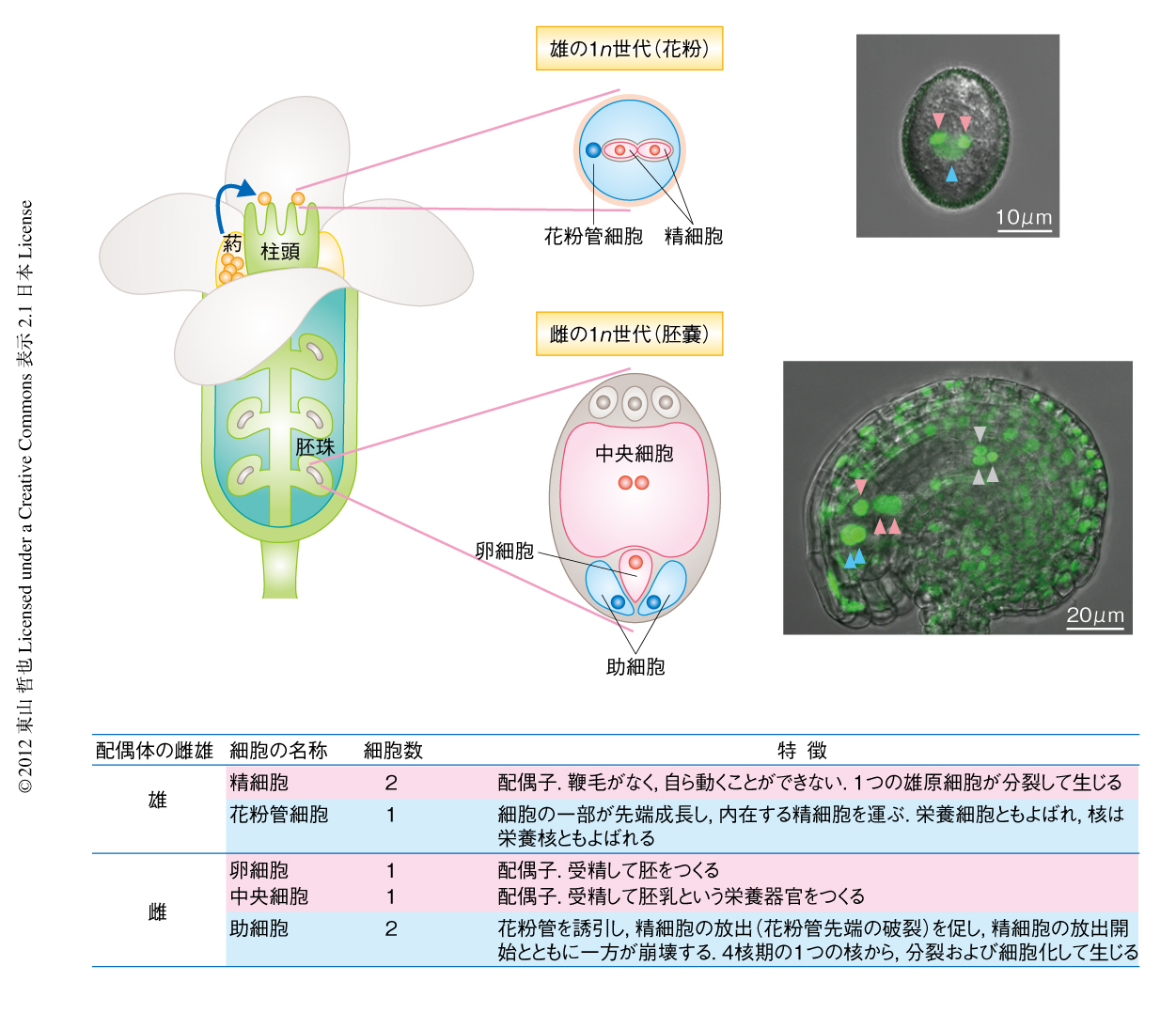
ここでは,ほとんどの読者にはなじみがないと思われる,この配偶体にスポットライトをあてる.多くの被子植物の配偶体には,受精に深くかかわる,雌の4細胞,雄の3細胞,あわせて7つの細胞がある(図1).この個性あふれる7つの細胞を主人公とすることで,これまで理解のむずかしかった植物の生殖を,わかりやすく,興味深いものとして説明してみたい.
これら主人公を簡単に紹介すると,雌の配偶子として“卵細胞”と“中央細胞”の2つ,雄の配偶子として“精細胞”が2つ存在している.卵細胞は片方の精細胞と受精し胚を形成する.中央細胞は独立した受精により“胚乳”という胚の栄養器官(白米の部分)をつくるユニークな細胞である.卵細胞のように次世代に遺伝情報を伝えることはできないが,受精する細胞であることから配偶子のひとつとみなされている2).卵細胞と中央細胞の受精をあわせ重複受精とよぶ.一方,生殖細胞のほかには,精細胞を運ぶ雄の細胞として花粉管細胞が1つ,その花粉管とのやりとりを担う雌の細胞として助細胞が2つ存在する.助細胞は最後には死をもって受精を助けるなど,名のとおり献身的な細胞である.これら7つの主人公がそれぞれ重要な役割をはたし,母親(雌しべの2n組織)の力も借りながら組織的に受精を達成している.それでは,くわしくみていこう.
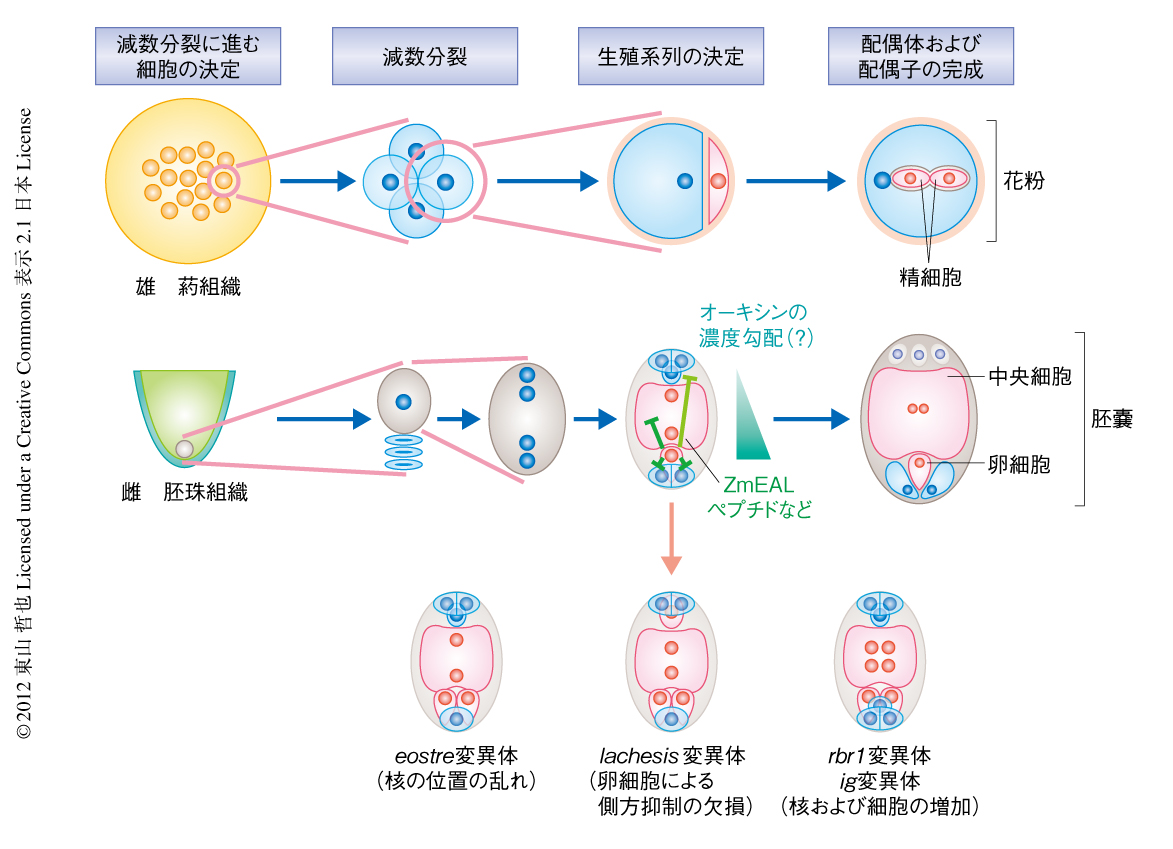
植物において生殖細胞や配偶体はどのように形成されるのか,必要最小限のポイントをまとめておこう2,3).動物では,胚発生の過程で体細胞系列と生殖系列とが分かれ,この生殖系列の細胞が広い意味で生殖細胞とされる.一方,植物では,胚発生の過程で生殖細胞が隔離されることはない.そこで,植物では,生殖系列に対し別の定義が用いられている2).すなわち,ある細胞が配偶子をつくることが約束された段階で生殖系列が決まるとされる.このため,植物の生殖系列は2段階で決まるものと理解されている2)(図2).第1段階は,植物の成長が生殖成長に切り替わり,花芽において配偶体の形成へとむかう細胞(胞原細胞)が決定される段階,そして,第2段階は,配偶体において配偶子の形成へと進む細胞が決定される段階である.雄では胞原細胞が細胞分裂を行うなか,減数分裂へと進む細胞が多数生じる.生殖系列の決定には細胞の系譜よりもその位置が重要であり,この位置情報の重要性は植物の発生において一般にみられる基本戦略である.
雌の配偶体である“胚嚢”(はいのう)の形成はつぎのように進む.種により多少の違いはあるが,シロイヌナズナなど多くの植物にみられる一般的なパターンで説明する(図2).
1)将来,種子になる胚珠(はいしゅ)という組織において,1つの2n細胞が減数分裂を開始する.small RNAや受容体様キナーゼなどを介した細胞間シグナル伝達系により,減数分裂の起こるのは1つの細胞だけに限定されている(雄の胞原細胞も同様に制御されている).
2)減数分裂の結果,縦に並んだ4つの細胞が生じる.このうち,決まった位置にある1つの細胞だけが残り,ほかの3つの細胞はプログラム細胞死により消失する.
3)この1つの細胞が細胞質分裂をともなわない同調的な核分裂により,2核期,4核期,8核期になる.つまり,ショウジョウバエの初期発生のように多核体(シンシチウム)として発生する.
4)8核期になると細胞化が起こるが,核の位置に応じてそれぞれの細胞がつくられる.中央細胞には2つの核が含まれており,核相は2nになる.
一方,雄の配偶体である“花粉”はつぎのように形成される(図2).
1)葯という組織の中心部にある多数の2n細胞が減数分裂を開始する.減数分裂で生じる4つの細胞(四分子)はすべて花粉へと発生する.
2)減数分裂ののちの第1分裂は著しい不等分裂であり,大型の花粉管細胞と,小型の生殖系列の細胞(雄原細胞)とに分かれる.
3)雄原細胞はエンドサイトーシスにより花粉管細胞に取り込まれる.
4)花粉の内部において雄原細胞が分裂し,2つの精細胞を形成する(伸長する花粉管の内部において雄原細胞が分裂する種も多い).
5)雄原細胞をつつむエンドサイトーシス膜が花粉管細胞の核と物理的に連結し,その核を先頭に,雄原細胞もしくは前後に並ぶ2つの精細胞が列車のように花粉管の内部を移動する(後述).
さて,三次元的に整然と細胞の配置される雌性配偶体のパターン形成は,どのような分子機構により進むのであろうか.これまでは,解析のむずかしかった組織の内部における雌性配偶体のパターン形成だが,それぞれの細胞の分化の状態を示すマーカー系列などが整備されてきたことにより解析が進みはじめた3).明らかになってきたこととしては第一に,やはり,核の位置どりが重要であるという点である.シロイヌナズナのRBR1(細胞周期の制御にかかわるがん抑制遺伝子産物Rbのホモログ)やトウモロコシのIG(植物に特有なAS2/LOBファミリータンパク質)をコードする遺伝子の変異体では,胚嚢において核および細胞の数が増加する4,5)(図2).このとき,増加した核は位置に応じて,卵細胞,助細胞,中央細胞の核になる.さらに,シロイヌナズナのeostre変異体においては4核期の段階から核の位置どりが異常となり,助細胞の1つが卵細胞になる6)(図2).eostre変異体ではホメオドメインタンパク質BLH1が胚嚢において異所的に発現している.また,多くの生物において核の位置に対する微小管の関与が報告されているが,雌性配偶体のパターン形成においてもモータータンパク質や微小管重合中心の異常がパターン形成の異常をひき起こす3).
それでは,核の位置どりと細胞分化とはどのように関係しているのだろうか.想定されているのが,モルフォゲンの存在である.近年,報告された説として,植物ホルモンであるオーキシンがモルフォゲンとしてシロイヌナズナの雌性配偶体において濃度勾配を形成しており,その勾配に応じ細胞が分化しているというものがある7)(図2).オーキシンは植物において,細胞分裂,形態形成,屈性現象など,さまざまな生理現象の制御にかかわる低分子ホルモンである.もっとも有名な植物ホルモンといってもいいだろう.近年では,オーキシンの細胞外への排出輸送体であるPINの研究が進み,オーキシンが細胞から細胞へと輸送されるなか組織において極性をつくりだすしくみも明らかになってきている.オーキシンが形成途中の胚嚢の卵細胞の側の極において合成され胚嚢の内部に濃度勾配を形成していること,また,オーキシン合成あるいはオーキシン応答にかかわる遺伝子発現を胚嚢において増減させると卵細胞のマーカーが反足細胞や助細胞の位置において発現するようになることが,この説のおもな根拠である.オーキシンの可視化の方法など,解析における問題点もいくつか指摘されており,広く受け入れられるためにはさらなる解析を待たなければならない.また,胚嚢はショウジョウバエの卵に比べずっと小さく,助細胞になる核と卵細胞になる核の距離はほんの20~30μmであることも注意すべき点であろう.発生運命の決定のために十分な濃度差が得られるのか解析が必要である.
また,細胞化のあとの細胞の運命決定において,2つの重要な知見が明らかになっている.第1に,卵細胞に特異的な転写プログラムを制御する転写因子RKD1およびRKD2がコムギとシロイヌナズナにおいて見い出された8).RKDファミリーに属する転写因子は植物に広く存在する.RKD1およびRKD2は卵細胞において特異的に発現しているが,興味深いことに,カルスとよばれる未分化な培養細胞塊にこれらを発現させると卵細胞に近い遺伝子発現プロファイルを示すようになる.また,興味深いことに,パラログであるRKD4については,その遺伝子発現を一過的に誘導することにより体細胞の遺伝子発現プロファイルを受精卵のものに変え胚に似た組織を形成させることができる9).RKD4の発現により初期化された体細胞は,植物におけるiPS細胞にたとえられることもある.このような転写因子のはたらきにより,卵細胞の発生運命は決定されているものと予想される.第2に,細胞間での側方抑制(lateral inhibition)が重要な役割をはたしており,卵細胞がその制御の中心であるという説が提唱されている.この説の発端となったのが,シロイヌナズナのlachesis変異体である10).lachesis変異体はスプライソソームの構成タンパク質PRP4の機能欠損変異体であり,助細胞の卵細胞化や反足細胞の中央細胞化がみられる(図2).clotho変異体やatropos変異体などほかのスプライソソーム構成タンパク質の変異体においても同様の表現型がみられ,RNA前駆体のプロセシングが配偶体における細胞分化に関与していることがわかる.LACHESIS遺伝子は卵細胞および中央細胞において発現しているが,卵細胞における発現が助細胞や反足細胞の生殖細胞化を抑制し,また,中央細胞の分化を制御していると示唆された11).さらに最近,トウモロコシの卵細胞から分泌されるZmEAL1というペプチドが,反足細胞の中央細胞化を抑制していることが報告された12)(図2).このことも,卵細胞による側方抑制の説を支持している.
雌性配偶体にみられる,こうした核の位置どりや細胞間コミュニケーションによるパターン形成は,植物を理解するうえで興味深いモデル系である.生細胞イメージングや自在な顕微操作技術の開発により,たとえば,ねらった核を動かすことにより形成された細胞の分化状態を生細胞イメージングにより解析するなど,生殖細胞の形成の本質にさらにせまることができると考えられる.
これまで述べてきたとおり,助細胞は卵細胞へ,反足細胞は中央細胞へといったように,発生運命は容易に転換する.しかも,たとえばrbr1変異体において,第2の卵細胞様の細胞は実際に精細胞と受精して胚発生を開始する13).このように,雌性配偶体の細胞は柔軟な可塑性(plasticity)をもつとともに,容易に生殖細胞へと分化できる能力(competency)をもつことがわかる.有名なニンジンの細胞からの個体再生(不定胚の形成)からも知られるように,植物といえば体細胞であっても分化全能性をもつことが有名である.そのような植物の特性をも考えあわせると,そもそも植物にとって,生殖細胞はどれだけ特別なのか? という疑問がわいてくるかもしれない.しかし,たとえ細胞の系譜には依存せず周囲の細胞との細胞間コミュニケーションにより規定されるような生殖細胞であっても,やはり植物において生殖細胞は特別である.
まず,その高い発生の効率があげられる.たとえば,植物では緑色をした葉肉細胞ひとつからでも個体の再生は可能であるが,培養系においてすべての葉肉細胞が再生するわけではない.これに対し,植物では単離した受精卵や,単離した未受精卵を精細胞と電気融合させた受精卵は,高い効率をもって個体に発生する14).単一の細胞を顕微操作し個体にまで発生させようとしても,生殖細胞を用いないと現実的にはむずかしいと考えられる.植物においては生殖細胞工学といった分野はまだ発展途上であるが,こうした観点から,生殖細胞は大きなポテンシャルをもつのではないかと考えられる.
そのほか,生殖細胞ならではの特殊性を多くあげることができる.ヒトを含め動物においては,ミトコンドリアDNAは母親(卵)からのみ遺伝するという母性遺伝が有名である.植物においては母性遺伝が多いものの,両性遺伝や父性遺伝もみられる15).さらに,植物にはミトコンドリアのほか共生オルガネラとして葉緑体(色素体)も存在し,細胞質遺伝の様式はミトコンドリアと葉緑体とで別々に制御されているためその制御は複雑になっている.細胞質遺伝の様式にともない,オルガネラのもつDNAは生殖系列において増幅(遺伝する)あるいは分解(遺伝しない)といった制御をうける15).また,植物においては動物のような生殖系列や受精卵におけるゲノムワイドな再プログラミングは見い出されていないものの,次世代に遺伝情報を伝える真の配偶子(卵細胞と精細胞)のとなりの細胞(花粉管細胞と中央細胞)において,ゲノムワイドなDNA脱メチル化が起こると報告されている.これにより,花粉管細胞と中央細胞においてつくられたsmall RNAがそれぞれ精細胞と卵細胞に輸送され,これら真の配偶子においてトランスポゾンの転移が抑制されているのではないかと考えられている16).さらに,胚乳においてはゲノムインプリンティングがみられる16).これは,動物における胎盤の形成と類似しているが,胚乳の形成を促進する雄のゲノムと抑制する雌のゲノムとがバランスをとることにより,胚乳は正常に発生することができる.このように,生殖細胞ならではの際立った特徴が多くみられることから,植物においてもやはり生殖細胞は特殊な細胞であるといえる.
ここからは,こうして形成された配偶子がいかにして出会い,受精を達成するかについてみていこう.まず,花粉管ガイダンスとよばれる現象の基本的なプロセスについて説明する.植物の受精は,花粉が雌しべの先端の柱頭に付着する受粉からはじまる.しかしながら,標的となる卵細胞は柱頭よりもずっとさきにある(図3).雌しべの先端から卵細胞までの距離は種により異なるが数mmから数十cmである.そこで,花粉は花粉管とよばれる単細胞によりつくられる管を伸長させ,エンドサイトーシスにより取り込んだ精細胞を輸送する.イチョウやソテツなどの裸子植物と違い,このプロセスは精子を形成するための長い時間も,精子が泳ぐための水も必要としない.しかも,被子植物の花粉管は裸子植物の花粉管より伸長速度が速い.裸子植物では受粉から受精まで数か月や1年以上もかかる場合が多いが,多くの被子植物では受粉からわずか数時間で受精にいたる.
それでは,花粉管の先端はどのように卵細胞の位置にまで到達できるのだろうか.そのための分子機構が花粉管ガイダンスである.花粉管ガイダンスとは,雌しべからうける伸長方向の制御であり,これにより花粉管は道に迷うことなく卵細胞まで到達する.花粉管ガイダンスのおもな特徴について,雌しべの母体組織(2n組織)による制御を中心に説明しよう17)(図3).
・花粉管ガイダンスは多段階であり,花粉管の通り道にある組織がつぎつぎに花粉管をガイドする.
・雌しべの母体組織によるガイダンスには,化学屈性だけでなく,組織の形状による物理的な方向の制御など,さまざまなガイドが提唱されている.
・雌しべの母体組織においてはたらく誘引物質は同定されていないが,ユリの柱頭から見い出されたペプチドであるケモシアニンなどの候補がある.
・雌しべの母体組織によるガイダンスには,方向性の制御,伸長の促進,花粉管との接着,そして,最近になり見い出された,受精能の制御などが含まれる.
まとめると,花粉管は雌しべの母体組織の力を借りて,奥にある雌性配偶体(胚嚢)によるガイダンスが有効な範囲へと,方向性をもって進入している.
花粉管が雌しべの基部のふくらんでいる部分(子房)に進入すると,胚嚢によるガイダンスの範囲に入る(図3).胚嚢は胚珠組織につつまれている.培地に取り出した胚珠に花粉管のむかうことが観察された140年ほどまえから,花粉管を胚珠に導く誘引物質が存在するのではないかと考えられ探索されてきたが,その実体は長らく不明のままであった.シロイヌナズナを用いた分子遺伝学的な研究が進められる一方で,胚嚢の半分ほどが胚珠から突出し卵細胞がむき出しとなっている,アゼトウガラシ科のトレニア(Torenia fournieri)というユニークな植物を用いた研究により花粉管の誘引物質の研究が進展した.
筆者らは,トレニアにおいて卵細胞のとなりにある2つの助細胞が拡散性のシグナルにより花粉管を誘引することをin vitroにおいて示し18),さらに,顕微操作により取り出した助細胞において発現している遺伝子を解析した19).興味深いことに,助細胞においてはシステイン残基に富み分泌性と考えられる多くの種類のペプチドが発現していることが明らかになった.そして,助細胞において特異的に強く発現する2つのペプチドが花粉管の誘引物質であることが示された19).これらは,花粉管を引き寄せる性質からLURE(LURE1およびLURE2)と名づけられた.その高い発現量は十分に長い誘引距離につながると考えられた.
LUREは真核生物に普遍的な抗菌ペプチドである“ディフェンシン” 20) に類似したペプチドであり,ともにシステイン残基の数は6つ,シグナルペプチドを除いた予想される全長は約60アミノ酸残基であった.立体構造の形成に重要とされるシステイン残基のあいだの分子内ジスルフィド結合が誘引活性に重要であることが示唆された.植物において,細胞間シグナル伝達を担うペプチド性のリガンドの研究が進展をみせている21).それらの多くは翻訳ののちプロセシングをうけるタイプだが,雌しべから単離されたLUREは,その遺伝子から予想されるシグナルペプチドを除いた全長のペプチドと分子量において差がみられなかったことから,プロセシングや大きな修飾はうけていないと考えられている.ほかにもLUREに類似したペプチドが助細胞において特異的に発現しており,誘引シグナルは多種類のLURE様ぺプチドのカクテルであると予想されている.そして,多種類の誘引物質の存在することが,誘引における機能の分担や分子進化における自由度を生み出しているのではないかと予想されている.LUREは培地にわずか1000分子を置くだけで誘引活性がみられる19).そのため,1分子解析による化学屈性の解明も可能であると考えられ,現在,マイクロデバイスを用いた新たなアプローチが進められている.同じく化学屈性については,ニューロンの軸索ガイダンスにおいてネトリンというタンパク質が誘引物質としてはたらいており,分子機構を対比しながら調べていくのも興味深い.
ほかの植物ではどうかというと,最近,トウモロコシにおいてZmEA1というペプチドがおもに助細胞から分泌される花粉管の誘引物質であると報告されている22).ZmEA1はシステイン残基に富むペプチドではなく,さきに述べた卵細胞による側方抑制にかかわるZmEAL1 11) と類似のペプチドである.トウモロコシは培地において花粉管が伸長しにくいことから明確な誘引活性を示すことは容易でないが,統計的に有意な誘引活性が示されている.一方,シロイヌナズナにおいて,筆者らは,LUREに類似したペプチド性の誘引物質が存在するのではないかと考え解析を進めている16).したがって,被子植物の全体において誘引物質がどのように進化しているかについては,今後の解析を待つ必要がある.LURE遺伝子は分子進化が速く,トレニアの近縁種のLURE遺伝子とのあいだには正の自然選択がはたらき,アミノ酸配列が変化していると示唆されている23).種間におけるLUREペプチドの分子構造の相違が生殖における隔離障壁としてはたらいている可能性もあり,今後は,LUREを用いて生殖における隔離障壁を打破する試みも期待される.
LUREはディフェンシンに類似したペプチドである.細菌や菌類など微生物に対する抗菌ペプチドを誘引物質として利用していることは,雌性配偶体を守りながら目的の相手を引き寄せる戦略として興味深く,LUREの抗菌活性について解析が進められている.ディフェンシンはおもに微生物の細胞膜に突き刺さることにより抗菌活性をもつことが知られているが,LUREの誘引活性には強い種特異性がみられることから,花粉管の側にパートナータンパク質としてLUREの受容体が存在すると考えられる.また,植物の受粉あるいは受精におけるほかの過程においても,抗菌ペプチドに由来すると考えられるペプチドの関与が報告されている24).ディフェンシンに類似したものとしては,アブラナの受粉の際に自家受精を避けるための自他認識にかかわるリガンドとしてSP11/SCRが有名である24).また,トウモロコシでは助細胞から分泌されるディフェンシンに類似のペプチドZmES4が,胚嚢の内部に進入した花粉管の先端を破裂させ精細胞を放出させる役割をもつことが報告されている25).助細胞だけでなく,花器官の全体において多数の抗菌ペプチドの発現していることが知られているが,そうしたペプチドを生殖のため雌雄細胞のあいだのさまざまな認識に利用するようになったのではないかと考えられる.ペプチドのほかにも,たとえば,助細胞で発現し花粉管の認識にかかわるFERONIA受容体様キナーゼなど,生殖と病原菌に対する応答の両方にかかわるタンパク質が同定されている26).
LUREの発見により,花粉管ガイダンスの研究は今後もさまざまな展開が期待される.花粉管の側に存在するであろうLURE受容体の同定や,LUREが花粉管の伸長方向を精密に制御するしくみの解明などが重要な課題として考えられる.とりわけ,雌しべ組織における花粉管ガイダンスにはin vitro系だけでは再現できない精巧で興味深い現象がひそんでいる.最近,筆者らが新たに発見した現象のひとつとして,受精回復システムがある27)(図3).植物において,通常は胚珠に対し1本の花粉管が誘引されることで受精は達成される.この点において,ひとつの卵に多数の精子が群がり受精する動物とは大きく異なっている.植物の卵はたった1本の花粉管にすべてを託していると考えられてきた.
具体的に説明しよう.シロイヌナズナではひとつの雌しべに約50個の胚珠が存在する.柱頭に受粉した多数の花粉から一斉に伸長した花粉管は,伝達組織とよばれる雌しべの中央の通路を進んでいく.その通路の両側に50個の胚珠が整然と並んでいる.野生型ではこれら胚珠のひとつひとつに1本の花粉管がむかう.誘引物質や反発物質をたくみに使いながら交通整理されていると想定されるが,その実体は明らかではない.とくに,反発物質については存在するかどうかすら明らかではない.
このガイドされる花粉管の本数は胚珠の受精の状態に応じて精密に制御されていることが明らかになった27,28).筆者らは,精細胞の形成に異常が生じ精細胞が受精できないg21(duo3-2)変異体(ヘテロ接合体であり,半数の花粉において精細胞が異常)を解析するなかで,種子の形成率が予想の50%よりも高まり65%前後になっていることを見い出した27).雌しべのなかで何が起こっているのか,すべての胚珠において花粉管の挙動をとらえる高度な解剖技術により観察を行った.その結果,まれにしか起こらないと考えられていたひとつの胚珠に2本の花粉管がガイドされる現象が,受精に失敗した胚珠の80%と,高頻度で起こっていることが明らかになった.野生型と変異体の花粉管をマーカーにより識別したところ,変異体の花粉管を受け取った胚珠においてのみ,2本目の花粉管がガイドされていることが示された.
通常の受精の過程では,花粉管が胚嚢に進入し内容物を放出すると,助細胞が1つ崩壊して細胞死を起こし,花粉の内容物を胚嚢の内部に受け入れる場を提供する.そこで,生細胞イメージングにより2本の花粉管が誘導される場合を調べた27).その結果,1本目の花粉管が受精に失敗しても,2つ目の花粉管と助細胞のセットにより正常に受精の行われることが明らかになった.2本の花粉管が到達すると2つ目の助細胞も失われる.助細胞は花粉管を誘引する細胞であり,胚珠がそれ以上の花粉管を受け入れることはなかった.植物は2つの助細胞をもつことにより,受精に失敗したときのバックアップ機能をもつことがわかった.ひとつの種子をつくるため1本の花粉管にすべてを託していると思われていた植物は,じつは,受精に失敗するともう1本の花粉管をよび寄せ受精を回復するというしたたかな面をもつことが示されたのである.そもそも,2つの助細胞は卵細胞により卵細胞化が抑制されていることを考えると,これは卵細胞のしたたかさともいえるだろう.
重複受精について習ったことはあるだろうか? 教科書的に説明すると,“1本の花粉管により輸送される2つの精細胞のうち,一方は卵細胞と受精して胚を,もう一方はとなりの中央細胞と受精して胚乳を形成する現象”と定義される29)(図4).これでは,無味乾燥なうえ,よくわからない現象と嫌われてしまいかねない.しかし,重複受精こそが被子植物の獲得した本質的に重要な現象であり,われわれ人類は穀物生産などその恩恵にあずかっている.近年の大きな発見として,精細胞に存在する細胞膜タンパク質として,受精に必須なGCS1(HAP2)が同定されたことがある30).これは,哺乳動物でいうと受精に必須な精子の側の細胞膜タンパク質であるIzumoのような機能をもつタンパク質と考えられる31).驚いたことに,被子植物において同定されたGCS1は藻類を含むすべての植物系統のほか,原生生物や下等な動物などでも保存されていた.真核生物が初期に受精に用いていたタンパク質であることが示唆される.
しかし,重複受精は,じつはまだ多くの謎に包まれた現象である.たとえば,1)鞭毛もなくアメーバ運動もしない,自分ではまったく移動することのできない精細胞が,いかにして標的の細胞と融合するのか,2)卵細胞と中央細胞に対し,2つの精細胞の受精の相手はどのように決定されているのか,3)胚と胚乳という異なる受精産物のもつ発生プログラムに対し,2つの精細胞はどのように準備されているのか,などの点があげられる.重複受精の解析がむずかしいのは,受精の過程が組織の深部においてすばやく進行するため,そのようすをとらえにくいためにほかならない.
しかし最近,シロイヌナズナにおいて重複受精の解析が進展している29).これには,雌雄の配偶体のそれぞれの細胞を明るく標識する蛍光マーカー系列が整備されてきたこと,それにともない,重複受精に異常のある変異体が取得されてきたこと,トレニアにおける体外受精系の技術が応用されシロイヌナズナでも胚珠と花粉管の培養による体外受精系が確立されたこと,これらにより重複受精の生細胞イメージングが可能になったこと,などの理由があげられる.
ここで,シロイヌナズナの変異体の解析により明らかになったことをまとめておこう29).
・卵細胞の増加するrbr1変異体やeostre変異体において示されたように,2つの精細胞はどちらも卵細胞と受精することが可能である.つまり,中央細胞としか受精できない精細胞はない.
・精細胞が1つになる変異体がいくつか存在するが,その精細胞は卵細胞と中央細胞のいずれとも受精する場合が多く,卵細胞または中央細胞の一方としか選択的に受精できないケースは少ない.
・1本の花粉管に2つより多く精細胞の形成される変異体において,多精は中央細胞の側だけで起こる.
さて,重複受精における最大の謎のひとつは,いかにして2つの精細胞がそれぞれ異なる相手と確実に受精するのかという点である.これは単純なようで解明のむずかしい問題であり,長年にわたり2つの説が提唱されている.第1の説は,2つの精細胞の機能は同じではなく受精の相手はあらかじめ決まっている,とする説である.第2の説は,2つの精細胞の機能は同じであり受精の相手は多精の拒否などの機構により決まる,とする説である.以前は,ルリマツリの仲間のPlumbago zeylanicaという2つの精細胞のうち片方しか色素体をもたないユニークな植物における知見から,受精の相手は花粉管の内部における精細胞の前後の並び順に応じてほぼ決まっているのではないかという,前者にあてはまる説が優勢であった29).しかし最近,シロイヌナズナにおいて中央細胞としか受精できない精細胞はないことや12),2つの精細胞のあいだで発現の異なる遺伝子がみつからないことなどから,むしろ,2つの精細胞に差はないとする,後者の説を支持する結果が得られはじめた29).
こうした背景のもと,重複受精の際に2つの精細胞はどのようにふるまうのか,筆者らは,シロイヌナズナを用いてはじめて重複受精の生細胞イメージングに成功した32).その結果,2つの精細胞は3段階の動きを示しながら重複受精することが明らかになった(図4,関連する映像は,文献32) や参考図書にもあげた http://www.brh.co.jp/seimeishi/journal/071/research_2.html において閲覧が可能).2つの精細胞は花粉管の先端の付近に2つセットで並んでいる.まず,花粉管の先端が破裂し内容物の放出がはじまると,2つの精細胞がセットのまま9秒ほどですばやく卵細胞の上部と中央細胞とが接する位置まで流れ込むように届けられる.自分では動くことのできない精細胞であるが,花粉管から勢いよく放出されるとそのまま受精が起こる部位にまで届き,正確に受け取られるしくみのあることが明らかになった.つぎに,2つの精細胞はそれぞれが卵細胞と中央細胞に接する状態で平均7分ほど動きを止める.そして,第3段階として,それぞれ卵細胞および中央細胞と受精する.実験ではさらに,前後の精細胞の受精の相手を調べるため,光蛍光変換タンパク質mKikGRにより前後の精細胞を異なる色に標識した.その結果,前後の精細胞はどちらも卵細胞および中央細胞と同じ頻度で受精することが明らかになった.これにより,受精の相手は花粉管の内部の前後の位置では決まっていないことが示された.
それでは,2つの精細胞の受精の相手はいったいどのように決まっているのか.筆者らは,これまでの知見から,卵細胞と中央細胞の両方に多精拒否の機構が存在し,重複受精を確実なものにしているという説を提唱した29).中央細胞において多精拒否が弱いのは,障壁が存在しないためではなく,体積が大きいため局所的な多精拒否では十分に防ぎきれていない可能性が考えられる.しかし,生細胞イメージングでは卵細胞と中央細胞の受精がほぼ同時に起こる例も観察されたことから,細胞膜が融合するまえから受精の相手の選別が行われている可能性もある.今後,受精にかかわるタンパク質の同定や,受精を自在に操作できるような実験系の確立が進むことにより,この重複受精の最大の謎が解かれるものと期待される.
また,2つの精細胞の受精の相手は精細胞の発生段階では決まっていないとすると,精細胞がいかにして胚発生と胚乳の形成というまったく異なる発生プログラムに寄与できているのか興味深い.植物の雄ゲノムにコードされる遺伝子は,胚と胚乳の両方の発生において初期段階から重要な役割を担うと考えられている.最近になり,動物の胚発生で知られる胚発生の途中での母性-胚性転移(maternal to zygotic transition)は植物の胚発生では起こらず,受精卵の段階からすでに雄ゲノムは活性化されていることが報告された33).また,植物においては受精卵にて起こる転写が受精卵における発生軸の確立に重要であることが示されており,このための転写因子をコードする遺伝子は,雄の側だけからのもち込みだけでも十分であることが示されている34).さらに,すでに述べたとおり,胚乳の形成においては雄のゲノムはそれを促進するようゲノムインプリンティングされており,これにより受精に依存的にすばやく胚乳を形成することができる16).それでは,精細胞のゲノムは受精の相手の発生にどのように対応しているのか.生細胞イメージングにより,精細胞の核に特異的なヒストンH3のバリアントが,卵細胞と受精したほうの精細胞においてのみ急速に観察されなくなるようすがとらえられた35).精細胞の核においては,受精の相手に応じてすばやくクロマチンリモデリングの進行することにより,異なる発生プログラムに対応しているのかもしれない.
ここでは,“植物の生殖”をキーワードに,その基本的な過程と最近のトピックスについて概説した.身近でありながら,ふだん気にかけることのない植物の生殖について,最新の研究状況やおもしろさなどが,植物を研究対象とはしていない読者に少しでも伝わったようであれば幸いである.卵細胞が2つの助細胞の発生を制御し,それによりしたたかに受精を回復するしくみなど,細胞間コミュニケーションをベースに生きる“植物らしさ”を感じてもらえたのではないだろうか.この分野の発展には,標的とする微量の細胞の解析技術の進歩が貢献している.今後も,さまざまな解析技術,とくに,顕微鏡下における生細胞の解析の技術の発展することが期待される.また,今回は紹介できなかったものの,植物の生殖に関連して進展の著しい分野はほかにも多く存在する.たとえば,自家不和合性(自他認識)の問題や,胚乳の形成のためのゲノムインプリンティングの詳細,栄養生殖から生殖成長への転換機構,初期胚の発生機構,食糧の増産にむけたゲノム育種などがあげられる.今後も,この「領域融合レビュー」において興味深いトピックスがとりあげられ,植物を対象とした研究が多くの読者に興味をもってもらえることを期待したい.
追記:本稿の校正の時点で,筆者らによる,シロイヌナズナのLUREペプチドの同定と生殖隔離障壁の打破に関する論文が受理された36).
略歴:1999年 東京大学大学院理学系研究科博士課程 修了,同年 同 助手を経て,2007年より名古屋大学大学院理学研究科 教授.この間,2004年 フランスLouis Pasteur大学にて海外研修.科学技術振興機構ERATO東山ライブホロニクスプロジェクト 研究総括 兼任.
研究テーマ:顕微鏡下において自由自在に生細胞の解析を展開することにより,個々の細胞の関係性が生み出す生命システムの解明と,鍵となる分子の同定をめざす.
研究室URL:http://www.higashiyama-lab.com/,http://www.liveholonics.com/
© 2012 東山 哲也 Licensed under CC 表示 2.1 日本
(名古屋大学大学院理学研究科 生命理学専攻生殖分子情報学)
email:東山哲也
領域融合レビュー, 1, e007 (2012) DOI: 10.7875/leading.author.1.e007
Tetsuya Higashiyama: Plant germ cells and fertilization strategies.
要 約
毎日のように口にしている穀物は,どのような受精のしくみにより実っているのか,じつはまだ多くの謎に包まれている.しかし最近,複雑な花器官において特定の細胞をねらって解析するさまざまな技術の発展により,受精のしくみが急速に明らかになりつつある.解明された分子や細胞の動態から,生殖細胞の形成,花粉管ガイダンス,重複受精といった興味深い現象について植物の戦略が明らかになってきた.とくに,さまざまなペプチドを介した多様な細胞間コミュニケーションは主要なトピックスのひとつである.被子植物では,一般に,減数分裂ののちに生じる細胞のうち7つが協同して有性生殖を達成している.この7つの細胞には,雌雄で2つずつ,合計で4つの生殖細胞が含まれている.1対の卵と精子とで受精を行う動物に比べ,植物では複雑なシステムがはたらいていることが想像できる.ここでは,身近な存在である“花”においていかにして生殖細胞が形成され受精が達成されるのか,植物を研究対象とはしていない読者にむけ最新のエッセンスを紹介したい.
はじめに
花は人類にとりさまざまな力をもつ存在である.見た目にも美しく,香りを漂わせ,やがては結実し食糧をもたらす.ここでは,このような花を咲かせる植物である被子植物について話を進める.
われわれ人類が主食としている穀物は,被子植物の受精によりつくられる種子である.植物の受精戦略は,ひとことでいってしまえば,限られた水と時間のなか効率よく繁殖を行うためのものである.砂漠に降った雨により植物が一斉に芽吹き,花を咲かせ,水が干上がるまえに種子をつくり次の世代へと命を繋げるようすは,まさに被子植物のもつ繁殖能力の象徴である.現生種として約760種が知られているイチョウやスギなどの裸子植物においては,生殖の方法は多様である1).それはまるで,種子をつくる植物におけるさまざまな進化の試行錯誤が,生きた化石として残っているかのようである.ところが,約25万種もある被子植物には,ここで説明する重複受精とよばれるしくみが普遍的にみられる.このことからも,重複受精のしくみを獲得した被子植物は爆発的な繁栄を誇っていると考えられる.
植物の生殖を理解するには,“配偶体”を理解することが重要である.動物では減数分裂により生じた細胞は,配偶子(受精にあずかる細胞)である卵と精子とにそのまま分化する.これに対し,植物では減数分裂により生じた細胞(1n細胞)は体細胞分裂をして多細胞の組織(配偶体)をつくり,そのなかで配偶子が分化する.
動物:減数分裂→配偶子(卵および精子)の分化→受精
植物:減数分裂→多細胞からなる配偶体の形成→配偶子の分化→受精
ここでは,ほとんどの読者にはなじみがないと思われる,この配偶体にスポットライトをあてる.多くの被子植物の配偶体には,受精に深くかかわる,雌の4細胞,雄の3細胞,あわせて7つの細胞がある(図1).この個性あふれる7つの細胞を主人公とすることで,これまで理解のむずかしかった植物の生殖を,わかりやすく,興味深いものとして説明してみたい.
これら主人公を簡単に紹介すると,雌の配偶子として“卵細胞”と“中央細胞”の2つ,雄の配偶子として“精細胞”が2つ存在している.卵細胞は片方の精細胞と受精し胚を形成する.中央細胞は独立した受精により“胚乳”という胚の栄養器官(白米の部分)をつくるユニークな細胞である.卵細胞のように次世代に遺伝情報を伝えることはできないが,受精する細胞であることから配偶子のひとつとみなされている2).卵細胞と中央細胞の受精をあわせ重複受精とよぶ.一方,生殖細胞のほかには,精細胞を運ぶ雄の細胞として花粉管細胞が1つ,その花粉管とのやりとりを担う雌の細胞として助細胞が2つ存在する.助細胞は最後には死をもって受精を助けるなど,名のとおり献身的な細胞である.これら7つの主人公がそれぞれ重要な役割をはたし,母親(雌しべの2n組織)の力も借りながら組織的に受精を達成している.それでは,くわしくみていこう.
1.植物における生殖細胞の形成
植物において生殖細胞や配偶体はどのように形成されるのか,必要最小限のポイントをまとめておこう2,3).動物では,胚発生の過程で体細胞系列と生殖系列とが分かれ,この生殖系列の細胞が広い意味で生殖細胞とされる.一方,植物では,胚発生の過程で生殖細胞が隔離されることはない.そこで,植物では,生殖系列に対し別の定義が用いられている2).すなわち,ある細胞が配偶子をつくることが約束された段階で生殖系列が決まるとされる.このため,植物の生殖系列は2段階で決まるものと理解されている2)(図2).第1段階は,植物の成長が生殖成長に切り替わり,花芽において配偶体の形成へとむかう細胞(胞原細胞)が決定される段階,そして,第2段階は,配偶体において配偶子の形成へと進む細胞が決定される段階である.雄では胞原細胞が細胞分裂を行うなか,減数分裂へと進む細胞が多数生じる.生殖系列の決定には細胞の系譜よりもその位置が重要であり,この位置情報の重要性は植物の発生において一般にみられる基本戦略である.
雌の配偶体である“胚嚢”(はいのう)の形成はつぎのように進む.種により多少の違いはあるが,シロイヌナズナなど多くの植物にみられる一般的なパターンで説明する(図2).
1)将来,種子になる胚珠(はいしゅ)という組織において,1つの2n細胞が減数分裂を開始する.small RNAや受容体様キナーゼなどを介した細胞間シグナル伝達系により,減数分裂の起こるのは1つの細胞だけに限定されている(雄の胞原細胞も同様に制御されている).
2)減数分裂の結果,縦に並んだ4つの細胞が生じる.このうち,決まった位置にある1つの細胞だけが残り,ほかの3つの細胞はプログラム細胞死により消失する.
3)この1つの細胞が細胞質分裂をともなわない同調的な核分裂により,2核期,4核期,8核期になる.つまり,ショウジョウバエの初期発生のように多核体(シンシチウム)として発生する.
4)8核期になると細胞化が起こるが,核の位置に応じてそれぞれの細胞がつくられる.中央細胞には2つの核が含まれており,核相は2nになる.
一方,雄の配偶体である“花粉”はつぎのように形成される(図2).
1)葯という組織の中心部にある多数の2n細胞が減数分裂を開始する.減数分裂で生じる4つの細胞(四分子)はすべて花粉へと発生する.
2)減数分裂ののちの第1分裂は著しい不等分裂であり,大型の花粉管細胞と,小型の生殖系列の細胞(雄原細胞)とに分かれる.
3)雄原細胞はエンドサイトーシスにより花粉管細胞に取り込まれる.
4)花粉の内部において雄原細胞が分裂し,2つの精細胞を形成する(伸長する花粉管の内部において雄原細胞が分裂する種も多い).
5)雄原細胞をつつむエンドサイトーシス膜が花粉管細胞の核と物理的に連結し,その核を先頭に,雄原細胞もしくは前後に並ぶ2つの精細胞が列車のように花粉管の内部を移動する(後述).
2.生殖細胞の決定の分子機構
さて,三次元的に整然と細胞の配置される雌性配偶体のパターン形成は,どのような分子機構により進むのであろうか.これまでは,解析のむずかしかった組織の内部における雌性配偶体のパターン形成だが,それぞれの細胞の分化の状態を示すマーカー系列などが整備されてきたことにより解析が進みはじめた3).明らかになってきたこととしては第一に,やはり,核の位置どりが重要であるという点である.シロイヌナズナのRBR1(細胞周期の制御にかかわるがん抑制遺伝子産物Rbのホモログ)やトウモロコシのIG(植物に特有なAS2/LOBファミリータンパク質)をコードする遺伝子の変異体では,胚嚢において核および細胞の数が増加する4,5)(図2).このとき,増加した核は位置に応じて,卵細胞,助細胞,中央細胞の核になる.さらに,シロイヌナズナのeostre変異体においては4核期の段階から核の位置どりが異常となり,助細胞の1つが卵細胞になる6)(図2).eostre変異体ではホメオドメインタンパク質BLH1が胚嚢において異所的に発現している.また,多くの生物において核の位置に対する微小管の関与が報告されているが,雌性配偶体のパターン形成においてもモータータンパク質や微小管重合中心の異常がパターン形成の異常をひき起こす3).
それでは,核の位置どりと細胞分化とはどのように関係しているのだろうか.想定されているのが,モルフォゲンの存在である.近年,報告された説として,植物ホルモンであるオーキシンがモルフォゲンとしてシロイヌナズナの雌性配偶体において濃度勾配を形成しており,その勾配に応じ細胞が分化しているというものがある7)(図2).オーキシンは植物において,細胞分裂,形態形成,屈性現象など,さまざまな生理現象の制御にかかわる低分子ホルモンである.もっとも有名な植物ホルモンといってもいいだろう.近年では,オーキシンの細胞外への排出輸送体であるPINの研究が進み,オーキシンが細胞から細胞へと輸送されるなか組織において極性をつくりだすしくみも明らかになってきている.オーキシンが形成途中の胚嚢の卵細胞の側の極において合成され胚嚢の内部に濃度勾配を形成していること,また,オーキシン合成あるいはオーキシン応答にかかわる遺伝子発現を胚嚢において増減させると卵細胞のマーカーが反足細胞や助細胞の位置において発現するようになることが,この説のおもな根拠である.オーキシンの可視化の方法など,解析における問題点もいくつか指摘されており,広く受け入れられるためにはさらなる解析を待たなければならない.また,胚嚢はショウジョウバエの卵に比べずっと小さく,助細胞になる核と卵細胞になる核の距離はほんの20~30μmであることも注意すべき点であろう.発生運命の決定のために十分な濃度差が得られるのか解析が必要である.
また,細胞化のあとの細胞の運命決定において,2つの重要な知見が明らかになっている.第1に,卵細胞に特異的な転写プログラムを制御する転写因子RKD1およびRKD2がコムギとシロイヌナズナにおいて見い出された8).RKDファミリーに属する転写因子は植物に広く存在する.RKD1およびRKD2は卵細胞において特異的に発現しているが,興味深いことに,カルスとよばれる未分化な培養細胞塊にこれらを発現させると卵細胞に近い遺伝子発現プロファイルを示すようになる.また,興味深いことに,パラログであるRKD4については,その遺伝子発現を一過的に誘導することにより体細胞の遺伝子発現プロファイルを受精卵のものに変え胚に似た組織を形成させることができる9).RKD4の発現により初期化された体細胞は,植物におけるiPS細胞にたとえられることもある.このような転写因子のはたらきにより,卵細胞の発生運命は決定されているものと予想される.第2に,細胞間での側方抑制(lateral inhibition)が重要な役割をはたしており,卵細胞がその制御の中心であるという説が提唱されている.この説の発端となったのが,シロイヌナズナのlachesis変異体である10).lachesis変異体はスプライソソームの構成タンパク質PRP4の機能欠損変異体であり,助細胞の卵細胞化や反足細胞の中央細胞化がみられる(図2).clotho変異体やatropos変異体などほかのスプライソソーム構成タンパク質の変異体においても同様の表現型がみられ,RNA前駆体のプロセシングが配偶体における細胞分化に関与していることがわかる.LACHESIS遺伝子は卵細胞および中央細胞において発現しているが,卵細胞における発現が助細胞や反足細胞の生殖細胞化を抑制し,また,中央細胞の分化を制御していると示唆された11).さらに最近,トウモロコシの卵細胞から分泌されるZmEAL1というペプチドが,反足細胞の中央細胞化を抑制していることが報告された12)(図2).このことも,卵細胞による側方抑制の説を支持している.
雌性配偶体にみられる,こうした核の位置どりや細胞間コミュニケーションによるパターン形成は,植物を理解するうえで興味深いモデル系である.生細胞イメージングや自在な顕微操作技術の開発により,たとえば,ねらった核を動かすことにより形成された細胞の分化状態を生細胞イメージングにより解析するなど,生殖細胞の形成の本質にさらにせまることができると考えられる.
3.植物にとっての生殖細胞とは?
これまで述べてきたとおり,助細胞は卵細胞へ,反足細胞は中央細胞へといったように,発生運命は容易に転換する.しかも,たとえばrbr1変異体において,第2の卵細胞様の細胞は実際に精細胞と受精して胚発生を開始する13).このように,雌性配偶体の細胞は柔軟な可塑性(plasticity)をもつとともに,容易に生殖細胞へと分化できる能力(competency)をもつことがわかる.有名なニンジンの細胞からの個体再生(不定胚の形成)からも知られるように,植物といえば体細胞であっても分化全能性をもつことが有名である.そのような植物の特性をも考えあわせると,そもそも植物にとって,生殖細胞はどれだけ特別なのか? という疑問がわいてくるかもしれない.しかし,たとえ細胞の系譜には依存せず周囲の細胞との細胞間コミュニケーションにより規定されるような生殖細胞であっても,やはり植物において生殖細胞は特別である.
まず,その高い発生の効率があげられる.たとえば,植物では緑色をした葉肉細胞ひとつからでも個体の再生は可能であるが,培養系においてすべての葉肉細胞が再生するわけではない.これに対し,植物では単離した受精卵や,単離した未受精卵を精細胞と電気融合させた受精卵は,高い効率をもって個体に発生する14).単一の細胞を顕微操作し個体にまで発生させようとしても,生殖細胞を用いないと現実的にはむずかしいと考えられる.植物においては生殖細胞工学といった分野はまだ発展途上であるが,こうした観点から,生殖細胞は大きなポテンシャルをもつのではないかと考えられる.
そのほか,生殖細胞ならではの特殊性を多くあげることができる.ヒトを含め動物においては,ミトコンドリアDNAは母親(卵)からのみ遺伝するという母性遺伝が有名である.植物においては母性遺伝が多いものの,両性遺伝や父性遺伝もみられる15).さらに,植物にはミトコンドリアのほか共生オルガネラとして葉緑体(色素体)も存在し,細胞質遺伝の様式はミトコンドリアと葉緑体とで別々に制御されているためその制御は複雑になっている.細胞質遺伝の様式にともない,オルガネラのもつDNAは生殖系列において増幅(遺伝する)あるいは分解(遺伝しない)といった制御をうける15).また,植物においては動物のような生殖系列や受精卵におけるゲノムワイドな再プログラミングは見い出されていないものの,次世代に遺伝情報を伝える真の配偶子(卵細胞と精細胞)のとなりの細胞(花粉管細胞と中央細胞)において,ゲノムワイドなDNA脱メチル化が起こると報告されている.これにより,花粉管細胞と中央細胞においてつくられたsmall RNAがそれぞれ精細胞と卵細胞に輸送され,これら真の配偶子においてトランスポゾンの転移が抑制されているのではないかと考えられている16).さらに,胚乳においてはゲノムインプリンティングがみられる16).これは,動物における胎盤の形成と類似しているが,胚乳の形成を促進する雄のゲノムと抑制する雌のゲノムとがバランスをとることにより,胚乳は正常に発生することができる.このように,生殖細胞ならではの際立った特徴が多くみられることから,植物においてもやはり生殖細胞は特殊な細胞であるといえる.
4.雄と雌の生殖細胞が出会うための花粉管ガイダンス
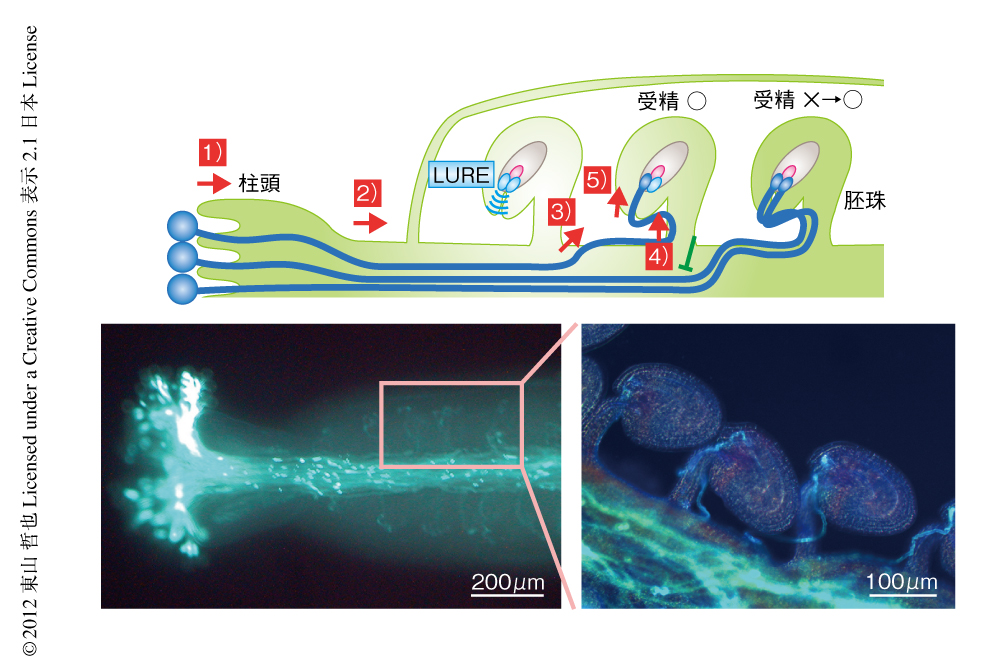
ここからは,こうして形成された配偶子がいかにして出会い,受精を達成するかについてみていこう.まず,花粉管ガイダンスとよばれる現象の基本的なプロセスについて説明する.植物の受精は,花粉が雌しべの先端の柱頭に付着する受粉からはじまる.しかしながら,標的となる卵細胞は柱頭よりもずっとさきにある(図3).雌しべの先端から卵細胞までの距離は種により異なるが数mmから数十cmである.そこで,花粉は花粉管とよばれる単細胞によりつくられる管を伸長させ,エンドサイトーシスにより取り込んだ精細胞を輸送する.イチョウやソテツなどの裸子植物と違い,このプロセスは精子を形成するための長い時間も,精子が泳ぐための水も必要としない.しかも,被子植物の花粉管は裸子植物の花粉管より伸長速度が速い.裸子植物では受粉から受精まで数か月や1年以上もかかる場合が多いが,多くの被子植物では受粉からわずか数時間で受精にいたる.
それでは,花粉管の先端はどのように卵細胞の位置にまで到達できるのだろうか.そのための分子機構が花粉管ガイダンスである.花粉管ガイダンスとは,雌しべからうける伸長方向の制御であり,これにより花粉管は道に迷うことなく卵細胞まで到達する.花粉管ガイダンスのおもな特徴について,雌しべの母体組織(2n組織)による制御を中心に説明しよう17)(図3).
・花粉管ガイダンスは多段階であり,花粉管の通り道にある組織がつぎつぎに花粉管をガイドする.
・雌しべの母体組織によるガイダンスには,化学屈性だけでなく,組織の形状による物理的な方向の制御など,さまざまなガイドが提唱されている.
・雌しべの母体組織においてはたらく誘引物質は同定されていないが,ユリの柱頭から見い出されたペプチドであるケモシアニンなどの候補がある.
・雌しべの母体組織によるガイダンスには,方向性の制御,伸長の促進,花粉管との接着,そして,最近になり見い出された,受精能の制御などが含まれる.
まとめると,花粉管は雌しべの母体組織の力を借りて,奥にある雌性配偶体(胚嚢)によるガイダンスが有効な範囲へと,方向性をもって進入している.
5.花粉管ガイダンスにおける位置情報と種特異性を担うLUREペプチド
花粉管が雌しべの基部のふくらんでいる部分(子房)に進入すると,胚嚢によるガイダンスの範囲に入る(図3).胚嚢は胚珠組織につつまれている.培地に取り出した胚珠に花粉管のむかうことが観察された140年ほどまえから,花粉管を胚珠に導く誘引物質が存在するのではないかと考えられ探索されてきたが,その実体は長らく不明のままであった.シロイヌナズナを用いた分子遺伝学的な研究が進められる一方で,胚嚢の半分ほどが胚珠から突出し卵細胞がむき出しとなっている,アゼトウガラシ科のトレニア(Torenia fournieri)というユニークな植物を用いた研究により花粉管の誘引物質の研究が進展した.
筆者らは,トレニアにおいて卵細胞のとなりにある2つの助細胞が拡散性のシグナルにより花粉管を誘引することをin vitroにおいて示し18),さらに,顕微操作により取り出した助細胞において発現している遺伝子を解析した19).興味深いことに,助細胞においてはシステイン残基に富み分泌性と考えられる多くの種類のペプチドが発現していることが明らかになった.そして,助細胞において特異的に強く発現する2つのペプチドが花粉管の誘引物質であることが示された19).これらは,花粉管を引き寄せる性質からLURE(LURE1およびLURE2)と名づけられた.その高い発現量は十分に長い誘引距離につながると考えられた.
LUREは真核生物に普遍的な抗菌ペプチドである“ディフェンシン” 20) に類似したペプチドであり,ともにシステイン残基の数は6つ,シグナルペプチドを除いた予想される全長は約60アミノ酸残基であった.立体構造の形成に重要とされるシステイン残基のあいだの分子内ジスルフィド結合が誘引活性に重要であることが示唆された.植物において,細胞間シグナル伝達を担うペプチド性のリガンドの研究が進展をみせている21).それらの多くは翻訳ののちプロセシングをうけるタイプだが,雌しべから単離されたLUREは,その遺伝子から予想されるシグナルペプチドを除いた全長のペプチドと分子量において差がみられなかったことから,プロセシングや大きな修飾はうけていないと考えられている.ほかにもLUREに類似したペプチドが助細胞において特異的に発現しており,誘引シグナルは多種類のLURE様ぺプチドのカクテルであると予想されている.そして,多種類の誘引物質の存在することが,誘引における機能の分担や分子進化における自由度を生み出しているのではないかと予想されている.LUREは培地にわずか1000分子を置くだけで誘引活性がみられる19).そのため,1分子解析による化学屈性の解明も可能であると考えられ,現在,マイクロデバイスを用いた新たなアプローチが進められている.同じく化学屈性については,ニューロンの軸索ガイダンスにおいてネトリンというタンパク質が誘引物質としてはたらいており,分子機構を対比しながら調べていくのも興味深い.
ほかの植物ではどうかというと,最近,トウモロコシにおいてZmEA1というペプチドがおもに助細胞から分泌される花粉管の誘引物質であると報告されている22).ZmEA1はシステイン残基に富むペプチドではなく,さきに述べた卵細胞による側方抑制にかかわるZmEAL1 11) と類似のペプチドである.トウモロコシは培地において花粉管が伸長しにくいことから明確な誘引活性を示すことは容易でないが,統計的に有意な誘引活性が示されている.一方,シロイヌナズナにおいて,筆者らは,LUREに類似したペプチド性の誘引物質が存在するのではないかと考え解析を進めている16).したがって,被子植物の全体において誘引物質がどのように進化しているかについては,今後の解析を待つ必要がある.LURE遺伝子は分子進化が速く,トレニアの近縁種のLURE遺伝子とのあいだには正の自然選択がはたらき,アミノ酸配列が変化していると示唆されている23).種間におけるLUREペプチドの分子構造の相違が生殖における隔離障壁としてはたらいている可能性もあり,今後は,LUREを用いて生殖における隔離障壁を打破する試みも期待される.
LUREはディフェンシンに類似したペプチドである.細菌や菌類など微生物に対する抗菌ペプチドを誘引物質として利用していることは,雌性配偶体を守りながら目的の相手を引き寄せる戦略として興味深く,LUREの抗菌活性について解析が進められている.ディフェンシンはおもに微生物の細胞膜に突き刺さることにより抗菌活性をもつことが知られているが,LUREの誘引活性には強い種特異性がみられることから,花粉管の側にパートナータンパク質としてLUREの受容体が存在すると考えられる.また,植物の受粉あるいは受精におけるほかの過程においても,抗菌ペプチドに由来すると考えられるペプチドの関与が報告されている24).ディフェンシンに類似したものとしては,アブラナの受粉の際に自家受精を避けるための自他認識にかかわるリガンドとしてSP11/SCRが有名である24).また,トウモロコシでは助細胞から分泌されるディフェンシンに類似のペプチドZmES4が,胚嚢の内部に進入した花粉管の先端を破裂させ精細胞を放出させる役割をもつことが報告されている25).助細胞だけでなく,花器官の全体において多数の抗菌ペプチドの発現していることが知られているが,そうしたペプチドを生殖のため雌雄細胞のあいだのさまざまな認識に利用するようになったのではないかと考えられる.ペプチドのほかにも,たとえば,助細胞で発現し花粉管の認識にかかわるFERONIA受容体様キナーゼなど,生殖と病原菌に対する応答の両方にかかわるタンパク質が同定されている26).
6.花粉管ガイダンスと受精のリンク:受精回復システム
LUREの発見により,花粉管ガイダンスの研究は今後もさまざまな展開が期待される.花粉管の側に存在するであろうLURE受容体の同定や,LUREが花粉管の伸長方向を精密に制御するしくみの解明などが重要な課題として考えられる.とりわけ,雌しべ組織における花粉管ガイダンスにはin vitro系だけでは再現できない精巧で興味深い現象がひそんでいる.最近,筆者らが新たに発見した現象のひとつとして,受精回復システムがある27)(図3).植物において,通常は胚珠に対し1本の花粉管が誘引されることで受精は達成される.この点において,ひとつの卵に多数の精子が群がり受精する動物とは大きく異なっている.植物の卵はたった1本の花粉管にすべてを託していると考えられてきた.
具体的に説明しよう.シロイヌナズナではひとつの雌しべに約50個の胚珠が存在する.柱頭に受粉した多数の花粉から一斉に伸長した花粉管は,伝達組織とよばれる雌しべの中央の通路を進んでいく.その通路の両側に50個の胚珠が整然と並んでいる.野生型ではこれら胚珠のひとつひとつに1本の花粉管がむかう.誘引物質や反発物質をたくみに使いながら交通整理されていると想定されるが,その実体は明らかではない.とくに,反発物質については存在するかどうかすら明らかではない.
このガイドされる花粉管の本数は胚珠の受精の状態に応じて精密に制御されていることが明らかになった27,28).筆者らは,精細胞の形成に異常が生じ精細胞が受精できないg21(duo3-2)変異体(ヘテロ接合体であり,半数の花粉において精細胞が異常)を解析するなかで,種子の形成率が予想の50%よりも高まり65%前後になっていることを見い出した27).雌しべのなかで何が起こっているのか,すべての胚珠において花粉管の挙動をとらえる高度な解剖技術により観察を行った.その結果,まれにしか起こらないと考えられていたひとつの胚珠に2本の花粉管がガイドされる現象が,受精に失敗した胚珠の80%と,高頻度で起こっていることが明らかになった.野生型と変異体の花粉管をマーカーにより識別したところ,変異体の花粉管を受け取った胚珠においてのみ,2本目の花粉管がガイドされていることが示された.
通常の受精の過程では,花粉管が胚嚢に進入し内容物を放出すると,助細胞が1つ崩壊して細胞死を起こし,花粉の内容物を胚嚢の内部に受け入れる場を提供する.そこで,生細胞イメージングにより2本の花粉管が誘導される場合を調べた27).その結果,1本目の花粉管が受精に失敗しても,2つ目の花粉管と助細胞のセットにより正常に受精の行われることが明らかになった.2本の花粉管が到達すると2つ目の助細胞も失われる.助細胞は花粉管を誘引する細胞であり,胚珠がそれ以上の花粉管を受け入れることはなかった.植物は2つの助細胞をもつことにより,受精に失敗したときのバックアップ機能をもつことがわかった.ひとつの種子をつくるため1本の花粉管にすべてを託していると思われていた植物は,じつは,受精に失敗するともう1本の花粉管をよび寄せ受精を回復するというしたたかな面をもつことが示されたのである.そもそも,2つの助細胞は卵細胞により卵細胞化が抑制されていることを考えると,これは卵細胞のしたたかさともいえるだろう.
7.重複受精:単純でもっともむずかしい問題
重複受精について習ったことはあるだろうか? 教科書的に説明すると,“1本の花粉管により輸送される2つの精細胞のうち,一方は卵細胞と受精して胚を,もう一方はとなりの中央細胞と受精して胚乳を形成する現象”と定義される29)(図4).これでは,無味乾燥なうえ,よくわからない現象と嫌われてしまいかねない.しかし,重複受精こそが被子植物の獲得した本質的に重要な現象であり,われわれ人類は穀物生産などその恩恵にあずかっている.近年の大きな発見として,精細胞に存在する細胞膜タンパク質として,受精に必須なGCS1(HAP2)が同定されたことがある30).これは,哺乳動物でいうと受精に必須な精子の側の細胞膜タンパク質であるIzumoのような機能をもつタンパク質と考えられる31).驚いたことに,被子植物において同定されたGCS1は藻類を含むすべての植物系統のほか,原生生物や下等な動物などでも保存されていた.真核生物が初期に受精に用いていたタンパク質であることが示唆される.
しかし,重複受精は,じつはまだ多くの謎に包まれた現象である.たとえば,1)鞭毛もなくアメーバ運動もしない,自分ではまったく移動することのできない精細胞が,いかにして標的の細胞と融合するのか,2)卵細胞と中央細胞に対し,2つの精細胞の受精の相手はどのように決定されているのか,3)胚と胚乳という異なる受精産物のもつ発生プログラムに対し,2つの精細胞はどのように準備されているのか,などの点があげられる.重複受精の解析がむずかしいのは,受精の過程が組織の深部においてすばやく進行するため,そのようすをとらえにくいためにほかならない.
しかし最近,シロイヌナズナにおいて重複受精の解析が進展している29).これには,雌雄の配偶体のそれぞれの細胞を明るく標識する蛍光マーカー系列が整備されてきたこと,それにともない,重複受精に異常のある変異体が取得されてきたこと,トレニアにおける体外受精系の技術が応用されシロイヌナズナでも胚珠と花粉管の培養による体外受精系が確立されたこと,これらにより重複受精の生細胞イメージングが可能になったこと,などの理由があげられる.
ここで,シロイヌナズナの変異体の解析により明らかになったことをまとめておこう29).
・卵細胞の増加するrbr1変異体やeostre変異体において示されたように,2つの精細胞はどちらも卵細胞と受精することが可能である.つまり,中央細胞としか受精できない精細胞はない.
・精細胞が1つになる変異体がいくつか存在するが,その精細胞は卵細胞と中央細胞のいずれとも受精する場合が多く,卵細胞または中央細胞の一方としか選択的に受精できないケースは少ない.
・1本の花粉管に2つより多く精細胞の形成される変異体において,多精は中央細胞の側だけで起こる.
さて,重複受精における最大の謎のひとつは,いかにして2つの精細胞がそれぞれ異なる相手と確実に受精するのかという点である.これは単純なようで解明のむずかしい問題であり,長年にわたり2つの説が提唱されている.第1の説は,2つの精細胞の機能は同じではなく受精の相手はあらかじめ決まっている,とする説である.第2の説は,2つの精細胞の機能は同じであり受精の相手は多精の拒否などの機構により決まる,とする説である.以前は,ルリマツリの仲間のPlumbago zeylanicaという2つの精細胞のうち片方しか色素体をもたないユニークな植物における知見から,受精の相手は花粉管の内部における精細胞の前後の並び順に応じてほぼ決まっているのではないかという,前者にあてはまる説が優勢であった29).しかし最近,シロイヌナズナにおいて中央細胞としか受精できない精細胞はないことや12),2つの精細胞のあいだで発現の異なる遺伝子がみつからないことなどから,むしろ,2つの精細胞に差はないとする,後者の説を支持する結果が得られはじめた29).
こうした背景のもと,重複受精の際に2つの精細胞はどのようにふるまうのか,筆者らは,シロイヌナズナを用いてはじめて重複受精の生細胞イメージングに成功した32).その結果,2つの精細胞は3段階の動きを示しながら重複受精することが明らかになった(図4,関連する映像は,文献32) や参考図書にもあげた http://www.brh.co.jp/seimeishi/journal/071/research_2.html において閲覧が可能).2つの精細胞は花粉管の先端の付近に2つセットで並んでいる.まず,花粉管の先端が破裂し内容物の放出がはじまると,2つの精細胞がセットのまま9秒ほどですばやく卵細胞の上部と中央細胞とが接する位置まで流れ込むように届けられる.自分では動くことのできない精細胞であるが,花粉管から勢いよく放出されるとそのまま受精が起こる部位にまで届き,正確に受け取られるしくみのあることが明らかになった.つぎに,2つの精細胞はそれぞれが卵細胞と中央細胞に接する状態で平均7分ほど動きを止める.そして,第3段階として,それぞれ卵細胞および中央細胞と受精する.実験ではさらに,前後の精細胞の受精の相手を調べるため,光蛍光変換タンパク質mKikGRにより前後の精細胞を異なる色に標識した.その結果,前後の精細胞はどちらも卵細胞および中央細胞と同じ頻度で受精することが明らかになった.これにより,受精の相手は花粉管の内部の前後の位置では決まっていないことが示された.
それでは,2つの精細胞の受精の相手はいったいどのように決まっているのか.筆者らは,これまでの知見から,卵細胞と中央細胞の両方に多精拒否の機構が存在し,重複受精を確実なものにしているという説を提唱した29).中央細胞において多精拒否が弱いのは,障壁が存在しないためではなく,体積が大きいため局所的な多精拒否では十分に防ぎきれていない可能性が考えられる.しかし,生細胞イメージングでは卵細胞と中央細胞の受精がほぼ同時に起こる例も観察されたことから,細胞膜が融合するまえから受精の相手の選別が行われている可能性もある.今後,受精にかかわるタンパク質の同定や,受精を自在に操作できるような実験系の確立が進むことにより,この重複受精の最大の謎が解かれるものと期待される.
また,2つの精細胞の受精の相手は精細胞の発生段階では決まっていないとすると,精細胞がいかにして胚発生と胚乳の形成というまったく異なる発生プログラムに寄与できているのか興味深い.植物の雄ゲノムにコードされる遺伝子は,胚と胚乳の両方の発生において初期段階から重要な役割を担うと考えられている.最近になり,動物の胚発生で知られる胚発生の途中での母性-胚性転移(maternal to zygotic transition)は植物の胚発生では起こらず,受精卵の段階からすでに雄ゲノムは活性化されていることが報告された33).また,植物においては受精卵にて起こる転写が受精卵における発生軸の確立に重要であることが示されており,このための転写因子をコードする遺伝子は,雄の側だけからのもち込みだけでも十分であることが示されている34).さらに,すでに述べたとおり,胚乳の形成においては雄のゲノムはそれを促進するようゲノムインプリンティングされており,これにより受精に依存的にすばやく胚乳を形成することができる16).それでは,精細胞のゲノムは受精の相手の発生にどのように対応しているのか.生細胞イメージングにより,精細胞の核に特異的なヒストンH3のバリアントが,卵細胞と受精したほうの精細胞においてのみ急速に観察されなくなるようすがとらえられた35).精細胞の核においては,受精の相手に応じてすばやくクロマチンリモデリングの進行することにより,異なる発生プログラムに対応しているのかもしれない.
おわりに
ここでは,“植物の生殖”をキーワードに,その基本的な過程と最近のトピックスについて概説した.身近でありながら,ふだん気にかけることのない植物の生殖について,最新の研究状況やおもしろさなどが,植物を研究対象とはしていない読者に少しでも伝わったようであれば幸いである.卵細胞が2つの助細胞の発生を制御し,それによりしたたかに受精を回復するしくみなど,細胞間コミュニケーションをベースに生きる“植物らしさ”を感じてもらえたのではないだろうか.この分野の発展には,標的とする微量の細胞の解析技術の進歩が貢献している.今後も,さまざまな解析技術,とくに,顕微鏡下における生細胞の解析の技術の発展することが期待される.また,今回は紹介できなかったものの,植物の生殖に関連して進展の著しい分野はほかにも多く存在する.たとえば,自家不和合性(自他認識)の問題や,胚乳の形成のためのゲノムインプリンティングの詳細,栄養生殖から生殖成長への転換機構,初期胚の発生機構,食糧の増産にむけたゲノム育種などがあげられる.今後も,この「領域融合レビュー」において興味深いトピックスがとりあげられ,植物を対象とした研究が多くの読者に興味をもってもらえることを期待したい.
追記:本稿の校正の時点で,筆者らによる,シロイヌナズナのLUREペプチドの同定と生殖隔離障壁の打破に関する論文が受理された36).
文 献
- Fernando, D. D., Quinn, C. R., Brenner, E. D. et al.: Male gametophyte development and evolution in extant gymnosperms. Int. J. Plant Dev. Biol., 4, 47-63 (2010)
- Grossniklaus, U.: Plant germline development: a tale of cross-talk, signaling, and cellular interactions. Sex. Plant Reprod., 24, 91-95 (2011)[PubMed]
- Sprunck, S. & Gross-Hardt, R.: Nuclear behavior, cell polarity, and cell specification in the female gametophyte. Sex. Plant Reprod., 24, 123-136 (2011)[PubMed]
- Ebel, C., Mariconti, L. & Gruissem, W.: Plant retinoblastoma homologues control nuclear proliferation in the female gametophyte. Nature, 429, 776-780 (2004)[PubMed]
- Evans, M. M. S.: The indeterminate gametophyte1 gene of maize encodes a LOB domain protein required for embryo sac and leaf development. Plant Cell, 19, 46-62 (2007)[PubMed]
- Pagnussat, G. C., Yu, H. J. & Sundaresan, V.: Cell-fate switch of synergid to egg cell in Arabidopsis eostre mutant embryo sacs arises from misexpression of the BEL1-like homeodomain gene BLH1. Plant Cell, 19, 3578-3592 (2007)[PubMed]
- Pagnussat, G. C., Alandete-Saez, M., Bowman, J. L. et al.: Auxin-dependent patterning and gamete specification in the Arabidopsis female gametophyte. Science, 324, 1684-1689 (2009)[PubMed]
- Koszegi, D., Johnston, A. J., Rutten, T. et al.: Members of the RKD transcription factor family induce an egg cell-like gene expression program. Plant J., 67, 280-291 (2011)[PubMed]
- Waki, T., Hiki, T., Watanabe, R. et al.: The Arabidopsis RWP-RK protein RKD4 triggers gene expression and pattern formation in early embryogenesis. Curr. Biol., 21, 1277-1281 (2011)[PubMed]
- Gross-Hardt, R., Kagi, C., Baumann, N. et al.: LACHESIS restricts gametic cell fate in the female gametophyte of Arabidopsis. PLoS Biol., 5, e47 (2007)[PubMed]
- Volz, R., von Lyncker, L., Baumann, N. et al.: LACHESIS-dependent egg-cell signaling regulates the development of female gametophytic cells. Development, 139, 498-502 (2012)[PubMed]
- Krohn, N. G., Lausser, A., Jurani, M. et al.: Egg cell signaling by the secreted peptide ZmEAL1 controls antipodal cell fate. Dev. Cell, 23, 219-225 (2012)[PubMed]
- Ingouff, M., Sakata, T., Li, J. et al.: The two male gametes share equal ability to fertilize the egg cell in Arabidopsis thaliana. Curr. Biol., 19, R19-R20 (2009)[PubMed]
- Okamoto, T.: In vitro fertilization with rice gametes: production of zygotes and zygote and embryo culture. Methods Mol. Biol., 710, 17-27 (2011)[PubMed]
- Nagata, N.: Mechanisms for independent cytoplasmic inheritance of mitochondria and plastids in angiosperms. J. Plant Res., 123, 193-199 (2010)[PubMed]
- Wollmann, H. & Berger, F.: Epigenetic reprogramming during plant reproduction and seed development. Curr. Opin. Plant Biol., 15, 63-69 (2012)[PubMed]
- Takeuchi, H. & Higashiyama, T.: Attraction of tip-growing pollen tubes by the female gametophyte. Curr. Opin. Plant Biol., 14, 614-621 (2011)[PubMed]
- Higashiyama, T., Yabe, S., Sasaki, N. et al.: Pollen tube attraction by the synergid cell. Science, 293, 1480-1483 (2001)[PubMed]
- Okuda, S., Tsutsui, H., Shiina, K. et al.: Defensin-like polypeptide LUREs are pollen tube attractants secreted from synergid cells. Nature, 458, 357-361 (2009)[PubMed]
- Yeaman, M. R. & Yount, N. Y.: Unifying themes in host defence effector polypeptides. Nat. Rev. Microbiol., 5, 727-740 (2007)[PubMed]
- Matsubayashi, Y.: Post-translational modifications in secreted peptide hormones in plants. Plant Cell Physiol., 52, 5-13 (2011)[PubMed]
- Marton, M. L., Fastner, A., Uebler, S. et al.: Overcoming hybridization barriers by the secretion of the maize pollen tube attractant ZmEA1 from Arabidopsis ovules. Curr. Biol., 22, 1194-1198 (2012)[PubMed]
- Kanaoka, M. M., Kawano, N., Matsubara, Y. et al.: Identification and characterization of TcCRP1, a pollen tube attractant from Torenia concolor. Ann. Bot., 108, 739-747 (2011)[PubMed]
- Higashiyama, T.: Peptide signaling in pollen-pistil interactions. Plant Cell Physiol., 51, 177-189 (2010)[PubMed]
- Amien, S., Kliwer, I., Marton, M. L. et al.: Defensin-like ZmES4 mediates pollen tube burst in maize via opening of the potassium channel KZM1. PLoS Biol., 8, e1000388 (2010)[PubMed]
- Kessler, S. A., Shimosato-Asano, H., Keinath, N. F. et al.: Conserved molecular components for pollen tube reception and fungal invasion. Science, 330, 968-971 (2010)[PubMed]
- Kasahara, R. D., Maruyama, D., Hamamura, Y. et al.: Fertilization recovery after defective sperm cell release in Arabidopsis. Curr. Biol., 22, 1084-1089 (2012)[PubMed]
- Beale, K. M., Leydon, A. R., Johnson, M. A.: Gamete fusion is required to block multiple pollen tubes from entering an Arabidopsis ovule. Curr Biol., 22, 1090-1094 (2012)[PubMed]
- Hamamura, Y., Nagahara, S. & Higashiyama, T.: Double fertilization on the move. Curr. Opin. Plant Biol., 15, 70-77 (2012)[PubMed]
- Mori, T., Kuroiwa, H., Higashiyama, T. et al.: GENERATIVE CELL SPECIFIC 1 is essential for angiosperm fertilization. Nat. Cell Biol., 8, 64-71 (2006)[PubMed]
- Inoue, N., Ikawa, M., Isotani, A. et al.: The immunoglobulin superfamily protein Izumo is required for sperm to fuse with eggs. Nature, 434, 234-238 (2005)[PubMed]
- Hamamura, Y., Saito, C., Awai, C. et al.: Live-cell imaging reveals the dynamics of two sperm cells during double fertilization in Arabidopsis thaliana. Curr. Biol., 21, 497-502 (2011)[PubMed]
- Nodine, M. D. & Bartel, D. P.: Maternal and paternal genomes contribute equally to the transcriptome of early plant embryos. Nature, 482, 94-97 (2012)[PubMed]
- Ueda, M., Zhang, Z. & Laux, T.: Transcriptional activation of Arabidopsis axis patterning genes WOX8/9 links zygote polarity to embryo development. Dev. Cell, 20, 264-270 (2011)[PubMed]
- Ingouff, M., Hamamura, Y., Gourgues, M. et al.: Distinct dynamics of HISTONE3 variants between the two fertilization products in plants. Curr. Biol., 17, 1032-1037 (2007)[PubMed]
- Takeuchi, H. & Higashiyama, T.: A species-specific cluster of defensin-like genes encodes diffusible pollen tube attractants in Arabidopsis. PLoS Biol., 10, e1001449 (2012)[PubMed]
参考図書
東山哲也: 被子植物の繁栄を支える重複受精の瞬間を見る. 生命誌ジャーナル, 71 (2011) URL:http://www.brh.co.jp/seimeishi/journal/071/research_2.html
「植物の軸と情報」特定領域研究班 編: 植物の生存戦略:「じっとしているという知恵に」に学ぶ. 朝日新聞社 (2007)
野々村賢一: イネ生殖細胞形成過程を制御する遺伝子群の単離と機能解析. 遺伝学研究, 9, 147-152 (2007)
Kinoshita, T. & Jacobsen, S. E.: Opening the door to epigenetics in PCP. Plant Cell Physiol., 53, 763-765 (2012)[PubMed]
著者プロフィール
略歴:1999年 東京大学大学院理学系研究科博士課程 修了,同年 同 助手を経て,2007年より名古屋大学大学院理学研究科 教授.この間,2004年 フランスLouis Pasteur大学にて海外研修.科学技術振興機構ERATO東山ライブホロニクスプロジェクト 研究総括 兼任.
研究テーマ:顕微鏡下において自由自在に生細胞の解析を展開することにより,個々の細胞の関係性が生み出す生命システムの解明と,鍵となる分子の同定をめざす.
研究室URL:http://www.higashiyama-lab.com/,http://www.liveholonics.com/
© 2012 東山 哲也 Licensed under CC 表示 2.1 日本