幹細胞の多能性を規定する分子機構
2012/12/11
丹羽 仁史
(理化学研究所発生・再生科学総合研究センター 多能性幹細胞研究プロジェクト)
email:丹羽仁史
領域融合レビュー, 1, e008 (2012) DOI: 10.7875/leading.author.1.e008
Hitoshi Niwa: Molecular mechanism governing pluripotency of stem cells.

マウスの着床前の胚から樹立されたマウスES細胞は,サイトカインのひとつLIFに依存的に多能性を維持している.このLIFシグナルは複数の転写因子の制御を介し多能性に関連する転写因子ネットワークに入力している.これとは並列に,液性タンパク質であるWntも多能性の維持に寄与するが,このWntシグナルはTcf3によるEsrrb遺伝子の発現抑制を解除するというひとつの点において多能性に関連する転写因子ネットワークに入力している.一方,マウスの着床後の胚から樹立されたマウスEpiSC(エピブラスト幹細胞)はアクチビンとFgf2に依存して多能性を維持しているが,その転写因子ネットワークへの入力様式は明らかでない.ただし,EpiSCではLIFシグナルおよびWntシグナルへの入力にかかわる転写因子の発現は抑制されており,これがこれら異なる多能性幹細胞の性質を規定している可能性がある.今日では,これら細胞の異なる多能性の状態をナイーブ型およびプライム型として区別するのが一般的であり,ヒトES細胞はこの分類ではプライム型に属する.ただし,これまで提唱されていたこの2つの状態の差異のうちキメラ胚の形成能は絶対的なものとはいえず,マウスEpiSCはEカドヘリンを一過性に発現させるだけで,その胚盤胞の注入はキメラ胚の形成に寄与した.今後,ナイーブ型およびプライム型の状態において表現型とシグナルの入力,および,転写因子ネットワークの状態を注意深く対応させることにより,ナイーブ型の状態を規定する種をこえた原理の解明が待たれる.
幹細胞は,自己以外の種類の細胞に分化する能力(分化能)と,細胞分裂をへて自己と同一の分化能をもつ娘細胞を生み出す能力(自己複製能)とをあわせもつ細胞として定義される.このうち,分化能として多能性をもつ細胞を多能性幹細胞とよぶ.多能性は,もっとも普遍的には三胚葉すべてに分化できる能力として規定される.胚性がん細胞(embryonal carcinoma cell,EC細胞)は歴史的にはじめて体外で培養された多能性幹細胞である.このEC細胞は奇形がん種(teratocarcinoma)とよばれる三胚葉の成分が混在する腫瘍に由来し,マウスに移植することによりふたたび奇形がん種を形成したことから多能性をもつことが確認された.さらに,実験的に形成した一部の奇形がん種に由来するEC細胞では,初期胚への移植により正常な発生過程に寄与して三胚葉に分化し,いわゆるキメラマウスの形成も可能であることが確認された1).そして,EC細胞の知見にもとづき,1981年,マウスの胚盤胞の内部細胞塊から胚性幹細胞(embryonic stem cell,ES細胞)が樹立された2,3).このES細胞は胚盤胞への移植により高率にキメラマウスを形成し,そこで生殖細胞系列にも寄与した.これにより,シャーレにおいて培養したES細胞にくわえた遺伝子操作を次世代の個体へと伝達する道が拓かれ,特定の遺伝子機能を喪失した,いわゆるノックアウトマウスの作製が可能になった.この技術の発生研究および医学研究への功績は大きく,開発者は2007年のノーベル医学生理学賞を受賞している.一方で,ES細胞は多能性を規定する分子機構の解明の基盤ともなり,そこから得られた知見にもとづき,2006年,Oct3/4遺伝子,Sox2遺伝子,Klf4遺伝子,Myc遺伝子の4つの遺伝子を導入することで体細胞を初期化することにより,誘導型多能性幹細胞(induced pluripotent stem cell,iPS細胞)が作製された4).この研究を成し遂げた山中伸弥が2012年のノーベル医学生理学賞を受賞したことは記憶に新しい.このレビューでは,これら研究の基盤となった多能性幹細胞が自己複製と分化を遂行するための分子機構について最近の知見を概説する.
マウスES細胞は,1981年の最初の樹立の報告においては,通常の血清含有培地を用い,マウス胎仔から採取した線維芽細胞の上で重層培養されていた.1988年,LIF(leukemia inhibitory factor,白血病抑制因子)がマウスES細胞の分化を抑制し多能性を維持する液性タンパク質として作用することが報告された5).LIFはそれ以前にM1白血病細胞の分化を誘導するタンパク質として同定されていたインターロイキン6ファミリーに属するサイトカインであったが,マウスES細胞に対してはそれとは逆に分化抑制の効果を示し,培地へのLIFの添加により,線維芽細胞との重層培養なしにゼラチン基質の上でマウスES細胞の多能性を維持することができた.LIFはGp130とLIF受容体βからなるLIF受容体に結合し,細胞において3つのシグナル伝達経路を作動させる(図1).これらのうち,Jak-Stat3経路が機能的に重要であることが,その機能の喪失によりLIFの存在下でマウスES細胞の分化が誘導されること6),および,その人為的な活性化によりLIFの非存在下で自己複製が維持されること7) により証明された.一方,LIFはPI3キナーゼ-Akt経路も活性化するが,Aktの人為的な活性化によってもLIFの非存在下で自己複製は維持されることが報告されている8).
では,これらのシグナル伝達経路はどのような遺伝子の発現を活性化することで多能性の維持に寄与しているのだろうか? その同定のため,マウスES細胞において未分化状態にて特異的に発現する転写因子を強制発現させて,LIFの非存在下で自己複製が維持されるかどうか検討された.その結果,2003年にホメオボックス転写因子Nanogが9,10),2009年にはKruppelファミリーに属するジンクフィンガー転写因子Klf4およびTボックス転写因子Tbx3が11),そのような能力をもつと報告された.そして,これらのうちKlf4はJak-Stat3経路において,Tbx3とNanogはPI3キナーゼ-Akt経路において,その発現の活性化されることが示された(図1).
一方で,1990年,EC細胞を用いた解析から,2つのホメオボックス関連DNA結合領域をもつ転写因子Oct3/4が未分化状態において特異的に発現していると報告された12-14).2000年には,Oct3/4の発現が一定量に維持されることがマウスES細胞における多能性の維持に必須であり,その発現量の増加はLIFの除去と同様に分化を誘導し,その減少は栄養外胚葉への分化を誘導することが報告された15).Oct3/4はSryファミリーに属するHMGボックス転写因子Sox2と複合体を形成し標的遺伝子の転写を活性化する16).Sox2もまたマウスES細胞における多能性の維持に必須であり,その機能の欠失は栄養外胚葉への分化を誘導する17).Oct3/4の機能抑制が栄養外胚葉への分化を特異的に誘導する機構として,Oct3/4は栄養外胚葉への分化を指令するホメオボックス転写因子Cdx2と相互抑制回路を形成し,Oct3/4の発現減少はCdx2の発現増加を誘導して栄養外胚葉への分化を誘導するものと考えられている18).また,Sox2はOct3/4と相互活性化回路を形成し,Sox2の発現減少はOct3/4の発現減少をへて,結果的に栄養外胚葉への分化を誘導すると考えられている.
では,LIFからのシグナル伝達経路はどのようにOct3/4あるいはSox2に連結しているのだろうか? Oct3/4の発現を制御する転写因子として,Oct3/4,Sox2,Nr5a2,Nanog,Esrrbなどが報告されている.したがって,Nanogはその連結タンパク質として重要と考えられるが,一方で,Nanogを欠損した細胞は不安定ながらも多能性を維持できるので,これだけでは説明できない19).Klf4はOct3/4およびSox2と協調して標的遺伝子の転写活性化にはたらくことが報告されており,機能的な連結に重要と考えられる20).また,Oct3/4により直接に制御される標的遺伝子の候補としてKlf4遺伝子,Tbx3遺伝子,Nanog遺伝子,Nr5a2遺伝子,Esrrb遺伝子がすべてあげられていることから,これらにコードされる転写因子はネットワークを形成し自己安定化を行っていると考えられるが,その構造の詳細は解明されていない.
Mycもまた,LIFシグナル伝達経路に関与する転写因子と考えられている.安定変異型Mycの強制発現によりLIFの非存在下で自己複製が維持されることが報告されている21).一方,Mycを単独で欠損したマウスES細胞は正常に自己複製するが,MycとMycnとの二重欠損マウスES細胞は胚体外内胚葉へと分化することから,Mycファミリーの機能的な重複が示された22).しかし,Mycの二量体形成のパートナーであるMaxを欠損したマウスES細胞は通常の血清含有培地では維持できないが,GSK3阻害剤とMAPK阻害剤を含む無血清培地(後述)では維持できたことから,Mycファミリーの機能はマウスES細胞における多能性の維持に無条件に必要ではないといえる23).
LIFにより活性化される第3の細胞内シグナル伝達経路としてMAPキナーゼ経路がある(図1).この経路は,マウスES細胞自体が発現するFGF4により刺激されるFGF受容体の細胞内シグナル伝達経路でもある.このMAPキナーゼ経路は多能性の維持に拮抗して分化を誘導する方向にはたらき,Fgf4あるいはErk2の欠損によりこの経路の活性化を阻害すると,マウスES細胞の自己複製は安定化し自発的な分化が抑制される24).また,MAPキナーゼはNanogおよびTbx3の核への移行に抑制的にはたらくことが報告されている11,25).しかし,これまでにMAPキナーゼ経路における機能的な標的タンパク質は報告されていない.
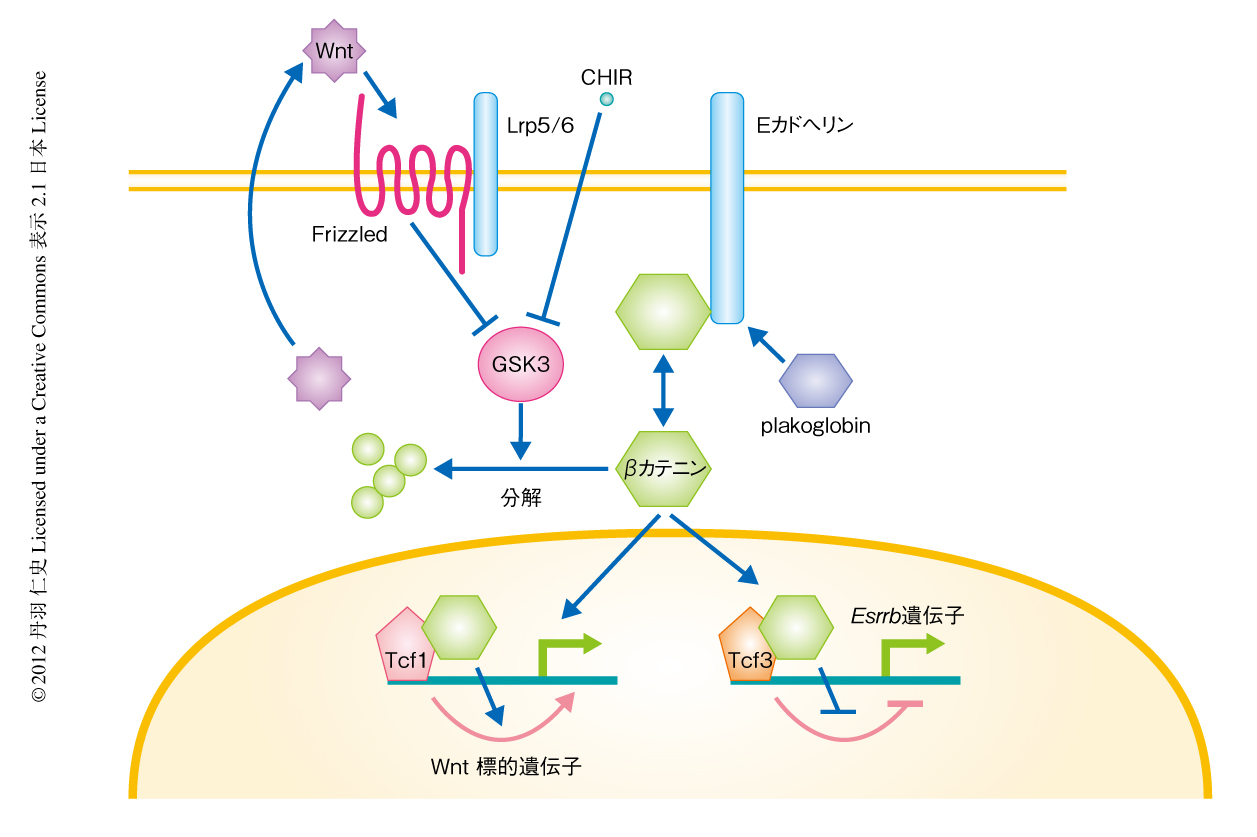
Wntは発生過程のさまざまな場面ではたらく液性タンパク質である.Wntシグナルは古典的経路においてはFrizzledとLrp5あるいはLrp6とからなる受容体をへてGSK3の抑制にはたらく(図2).GSK3はβカテニンをリン酸化しその分解を亢進させるので,Wntシグナルの刺激によるGSK3の抑制はβカテニンを安定化させる.安定化し蓄積したβカテニンは核へと移行し,Tcfファミリーに属する転写因子と協調して標的遺伝子の発現を制御する.2004年,マウスES細胞に対するWnt3a阻害剤あるいはGSK3阻害剤の添加は多能性の維持に寄与することが示唆された26).さらに2008年には,GSK3阻害剤とMAPキナーゼ阻害剤を同時に添加することにより,無血清培地においてマウスES細胞の多能性を維持できることが報告された27).このGSK3阻害剤とMAPキナーゼ阻害剤を組み合わせた無血清培地(2i無血清培地)はLIFなしに多能性を維持できるが,そこにLIFをくわえると多能性維持の効果が増強することから,これらの細胞内シグナル制御は協調的にはたらきうるようである.
では,Wntシグナル伝達経路はどのような遺伝子の発現を制御することで多能性の維持に寄与しているのだろうか? Tcfファミリーに属する転写因子のひとつTcf3はマウスES細胞においてその機能を欠失させると多能性の維持を安定化させることから,マウスES細胞におけるWntシグナル伝達経路の機能的な構成タンパク質であることが示唆された.ついで,Tcf3はおもに転写抑制因子としてはたらくこと,そして,その機能はWntシグナルの刺激により核に蓄積したβカテニンとの結合により抑制されることが報告された28).すなわち,Wnt3a阻害剤あるいはGSK3阻害剤の投与はβカテニンの活性化をへてTcf3による標的遺伝子の転写抑制を解除することにより,多能性の維持に寄与していたのである.一方,WntシグナルはマウスES細胞においてもβカテニンとTcf1との複合体の形成を介しAxin2遺伝子などの標的遺伝子の転写活性化を起こすが,こちらの多能性の維持への寄与はこれまでのところ検証されていない.最近,Tcf3により転写抑制される標的遺伝子としてEsrrb遺伝子が同定された.Esrrbの人為的な発現の維持はGSK3阻害剤の効果を代替でき,Esrrbを欠損したマウスES細胞はGSK3阻害剤への応答性を喪失した.一方で,Esrrbの人為的な発現の維持はNanogやKlf4,Tbx3と同様にLIFの効果をも代替できたが,Esrrbを欠損したマウスES細胞はLIFの存在下では多能性を維持することができた.これより,Esrrbの機能はGSK3-Tcf3経路の標的としては必要だがLIFシグナル伝達経路の活性化により代償が可能であり,LIFシグナルとWntシグナルの転写因子ネットワークへの入力は分離が可能で,かつ,協調性を示すことを説明することが可能になった29)(図2).
ここまで,シグナルの入力との関連において,おもに転写因子による遺伝子の発現制御にもとづく(ジェネティックな)制御機構について述べた.一方で最近,エピジェネティックな制御機構も多能性の維持に寄与していることが報告されている.
ATP依存的クロマチン再構成複合体のひとつであるNuRD(nucleosome remodelling and histone deacetylase)複合体は,その多能性の維持への寄与が機能的に証明された最初のエピジェネティック因子である.NuRD複合体の構成タンパク質のひとつであるMbd3を欠損させたマウスES細胞は分化に対する抵抗性を示し,LIFの非存在下でも自己複製を続ける30).NuRD複合体はおもに転写を抑制する機能をもつことが知られていたが,最近,マウスES細胞においてNuRD複合体はKlf4,Klf5,Tbx3,Rex1などの発現を抑制しており,その欠損はこれらの転写因子の発現を増加させることにより分化に対する抵抗性を誘導することが示された31).一方,ヒストン脱メチル化酵素LSD1はNuRD複合体の構成タンパク質であるが,その機能は多能性の維持には関与せず,分化誘導ののちの遺伝子の発現制御に寄与しているようである32).
BAF複合体もATP依存的クロマチン再構成複合体のひとつであるが,おもに転写活性化に寄与する点でNuRD複合体とは異なる.マウスES細胞にはES細胞に特異的な構成タンパク質を含むesBAF複合体が存在し,Oct3/4やNanogと結合してこれら転写因子による標的遺伝子の転写活性化に寄与することが知られている33).また,ゲノムワイドな解析ではesBAF複合体はStat3ともっとも強く共局在し,その標的遺伝子の発現制御への寄与が示唆されている34,35).
マウスES細胞では遺伝子コード領域のクロマチンが全般にユークロマチン状態にあり,ヒストンの交換が高頻度に起こっていることが知られている36).このような状態の維持には転写活性化にかかわるヒストン修飾パターンの積極的な形成が関与していると考えられる.ヒストンアセチル化は転写活性化にかかわるヒストン修飾の代表であるが,この修飾を導入するヒストンアセチルトランスフェラーゼ(histone acetyltransferase:HAT)のひとつTip60は,ノックダウンによる機能的なスクリーニングから多能性の維持への寄与が示唆されている37).また最近,別のヒストンアセチルトランスフェラーゼであるMOF/Myst1/Kat8がマウスES細胞における自己複製の維持に必須であることが報告された38).ヒストンH3の4番目のリジン残基のメチル化(H3K4me)も転写活性化にかかわるヒストン修飾のひとつであり,Trithoraxグループ(trxG)複合体がその導入に関与している.マウスES細胞におけるTrithoraxグループ複合体の構成タンパク質のひとつWdr5は,ゲノムにおいてOct3/4と共局在し多能性の維持に寄与していると考えられている39).
これらとは対照的に,多くのエピジェネティックな制御機構はヘテロクロマチンを形成し遺伝子発現を抑制する方向にはたらくが,マウスES細胞の多能性の維持には必要ない40).Polycomb抑制複合体2(PRC2)はヒストンH3の27番目のリジン残基のメチル化(H3K27me3)を導入して転写を抑制するが,マウスES細胞においてその構成タンパク質であるEed,Suz12,Ezh2を欠損させH3K27me3をほぼ消滅させても多能性は維持される.また,H3K4me3とH3K27me3の混在する二価のドメイン(bivalent domain)はマウスES細胞において自己複製と分化の制御にかかわるエピジェネティックな状態として注目をあつめたが,最近の報告では,GSK3阻害剤とMAPキナーゼ阻害剤をくわえた2i無血清培地で培養されたマウスES細胞においては,ゲノムにおいてH3K4me3とH3K27me3の混在するドメインが激減しているにもかかわらず,その多能性の状態はむしろ亢進していること,そして,その分化誘導の過程でもH3K4me3とH3K27me3の混在するドメインの出現は明確ではないことが示された41).したがって,H3K27me3の導入によるH3K4me3と混在するドメインの形成には強い機能的な意義は存在しないと考えたほうがよいと思われる.
マウスES細胞は子宮に着床する前の胚盤胞から樹立された多能性幹細胞であるが,2007年,少し発生の進んだ着床の後の胚からも多能性幹細胞が樹立された42,43).この細胞はエピブラスト幹細胞(epiblast stem cell,EpiSC)と命名され,マウスES細胞とはさまざまな点で違いを示した(表1).マウスEpiSCの増殖はLIFには依存せず,マウスES細胞においてLIFシグナルの入力にかかわる転写因子であるKlf4やTbx3も発現していない.一方,Nanogは発現しているが,その発現はEpiSCの自己複製に必要な液性タンパク質であるアクチビンのシグナルにより制御されていることが示されている.しかし最近,Nanogを欠損したEpiSCが樹立されたので,マウスES細胞と同様に,Nanogの機能はEpiSCにおける多能性の維持にも必須ではないといえる44).
マウスES細胞をEpiSCの培養条件において培養を続けると,その一部がEpiSC様の多能性幹細胞へと移行することが報告されている.逆に,EpiSCはSK3阻害剤とMAPキナーゼ阻害剤をくわえた2i無血清培地では分化してしまい,LIFと血清を含む培地でわずかにES細胞様の多能性幹細胞への移行が認められるにすぎない.しかし,このとき,マウスES細胞において特異的に発現している転写因子Klf2,Klf4,Nanog,Tbx3,Esrrb,Nr5a1,Nr5a2のうちどれかひとつを過剰発現させるか,あるいは,LIFシグナルを強制的に活性化させると,数%の細胞がES細胞様の多能性幹細胞へと“リプログラミング”される45,46).したがって,ES細胞からEpiSCへの移行は発生過程の順方向の変化であって基本的には不可逆的であり,その逆行には分化した細胞の場合と同様に遺伝子操作を必要とする.
では,EpiSCは発生過程においてどの時期の多能性幹細胞の状態に近いのだろうか? マウスES細胞からの始原生殖細胞の分化誘導の条件の検討により,マウスES細胞から分化し形成された着床後胚の多能性幹細胞に相当する状態からは始原生殖細胞が分化誘導できるのに対し,EpiSCからは同様の培養条件では誘導できないことが報告された47).さらに,これらの細胞および始原生殖細胞が形成されるまえの着床後胚(5.5日胚)における多能性幹細胞の遺伝子発現プロファイルの比較から,EpiSCはこの時期の多能性幹細胞とは異なっていることが示された.これらの結果から,EpiSCは生殖細胞が分化したのち,発生6日以降の時期の多能性幹細胞に近いと推測される.
では,ES細胞とEpiSCとの違いはどのような分子機構により規定されているのだろうか? さきに述べたEpiSCをリプログラミングする活性をもつ転写因子は,マウスES細胞においてはおもにLIFシグナル伝達経路に関与しており,それぞれの機能はES細胞の多能性の維持において必須ではないという点で共通している.したがって,マウスES細胞に特徴的な多能性はLIFシグナルへの応答性に依存していると考えられる.一方,マウスES細胞と比較してEpiSCにおいて強く発現する遺伝子から,EpiSCに特徴的な多能性を規定する機能的なタンパク質はこれまで同定されていない.
EpiSCはエピジェネティックな制御の点でもマウスES細胞とは大きく異なっている.雌では着床の直後の胚においてエピジェネティックな制御により2本あるX染色体の一方の不活性化が起こるが,雌のマウスES細胞は着床前の2本のX染色体がともに活性な状態を維持しているのに対し,雌のEpiSCでは1本のX染色体に不活性化が起こっている.また,発生の過程で制御される遺伝子のヒストン修飾状態にも明らかな違いが報告されている.さらに,Dnmt3a遺伝子やDnmt3l遺伝子といったDNAメチル化に関与する遺伝子の発現がEpiSCにおいて高いことも観察されている.ただし,このような違いがどのようにしてEpiSCの表現型に機能的に関与しているのかは明らかでない.
ES細胞とEpiSCとを区別する表現型として,胚盤胞に注入されたときのキメラ胚への寄与能がある.2007年の報告では,EpiSCを胚盤胞に注入してもほとんどは内部細胞塊と融合せず,わずかなキメラ胚が回収されたにすぎなかったとされている42,43).しかし,EpiSCは着床後胚に由来する多能性幹細胞であり,着床前の胚盤胞への移植は異所性の移植であるから,これがキメラ胚に寄与できない理由とも考えられる.また,そもそもEpiSCのもととなる着床後胚の多能性幹細胞もまた,胚発生の過程において三胚葉への分化能を示すことから,EpiSCが絶対的な意味でキメラ胚への寄与能を喪失しているとは考えにくい.EpiSCのキメラ胚への寄与能を正当に評価するためには着床後胚への同所性の移植を行うことが理想的だが,これには技術的に高い困難がある.
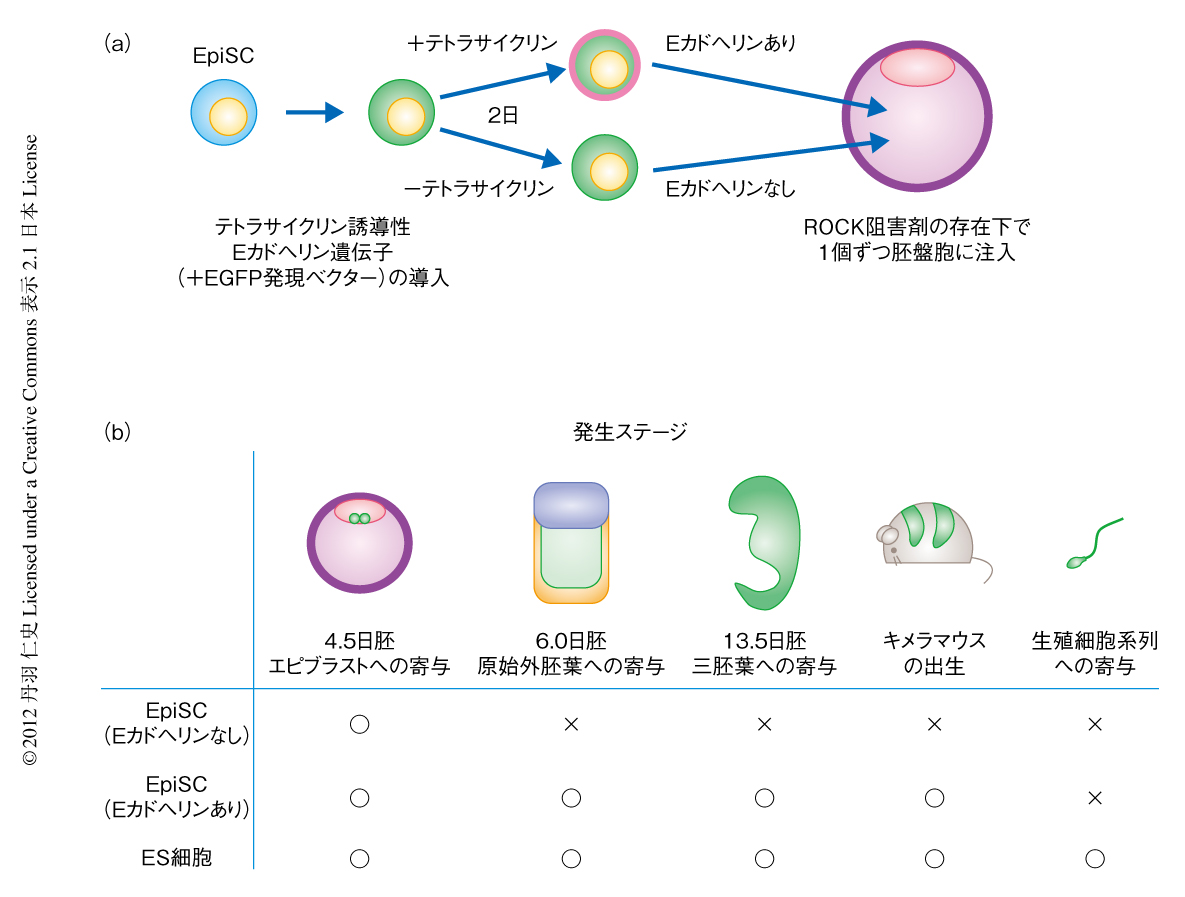
そこで最近,筆者らは,Eカドヘリンを一過性に強制発現させたEpiSCを胚盤胞に注入し,そのキメラ胚への寄与能を検討した48)(図3).Eカドヘリンを強制発現させた理由は,EカドヘリンはマウスES細胞において細胞間接着をつかさどる主たる接着因子であること,そして,過去の報告ではEpiSCではその発現が低下しているとされていたことによる.Eカドヘリンを2日間にわたり発現させたEpiSCにおいては,マウスES細胞に特異的な遺伝子の発現は誘導されず,また,X染色体の再活性化も認められなかったことから,マウスES細胞に特異的な転写因子を強制発現させたときのようなリプログラミングは誘導されていないと考えられた.しかし,これらの細胞を胚盤胞に1個だけ注入すると,その5%が良好なキメラ胚を形成した.したがって,EpiSCがキメラ胚への寄与能を喪失しているようにみえるのはその絶対的な能力の欠損を示すものではなく,かつ,マウスES細胞に特異的な転写因子の機能はキメラ胚への寄与能を規定するものではないといえた.また,この方法で作製されたキメラマウスではEpiSCに由来する細胞の生殖細胞系列への寄与は観察できなかった.これは,さきに述べたように,EpiSCが生殖細胞系列の分離ののちの,発生後期の多能性幹細胞の状態に近いことを反映しているのかもしれない.
1981年のマウスES細胞株の樹立の報告ののち,さまざまな動物種からのES細胞株の樹立が試みられたが,キメラ胚への寄与能の証明を含む成功例の報告は皆無であった.1995年,胚盤胞からのサルES細胞の樹立が報告されたが,その培養条件はマウスのものとは異なり,LIFの代わりにアクチビンとFgf2を含むものであった49).1998年には,同じ培養条件でヒトES細胞の樹立が報告され50),そののち,ほかの動物種からも同じ条件での胚盤胞からのES細胞株の樹立があいついでなされた.
当初,このようなマウスとそれ以外の動物種のES細胞の培養条件における依存性の違いは,マウスにおいて種特異的にLIFシグナルが多能性の維持にはたらくためであると解釈された.しかし,さきに述べたマウスにおけるEpiSCの樹立は,このような状況を一変させた.マウスEpiSCは,マウス以外の動物種のES細胞と同じく,アクチビンおよびFgf2に依存的に多能性を維持しているのみならず,それ以外の性質においても,マウスES細胞よりこれらのES細胞に似ている.これは,マウスES細胞とそれ以外の動物種のES細胞の違いは,種に依存的な違いというより,これら多能性幹細胞がシャーレにおいてとどまった発生段階の違いであることを示唆している.
しかし,マウスEpiSCとほかの動物種のES細胞(たとえば,ヒトES細胞)とには決定的な違いがある.前者が着床後胚に由来するのに対し,後者は着床前の胚盤胞に由来する,という点である.それで,ヒトES細胞がマウスEpiSCに似ているならば,ヒトES細胞は樹立の過程において着床後胚に相当するまで発生した多能性幹細胞の集団に由来する,ということなのだろうか? 最近,この点を示唆する興味深い研究成果が報告された.マウス胚盤胞の内部細胞塊をLIFを含有する培地で培養するとES細胞を樹立できるが,これをアクチビンおよびFgf2を含有する培地で培養するとEpiSCを樹立できたのだ51).これは,さきに述べたヒトES細胞の樹立に関する仮説を強く支持するものである.
ヒトES細胞がマウスES細胞と相同ではなく,むしろ,マウスEpiSCと相同であるなら,“ES細胞”という単語は単にその細胞が着床前の初期胚に由来するという出自の相同性を示すだけで,細胞の状態の相同性を表わせていないことになる.2009年,マウスES細胞型の多能性の状態をナイーブ型多能性(naïve pluripotency),マウスEpiSC型の多能性の状態をプライム型多能性(primed pluripotency)とする分類が提唱された52).これによれば,ヒトES細胞はプライム型多能性幹細胞に分類されることになる.現在,この分類は多能性幹細胞の性質による分類として普及しつつある.
では,胚の多能性幹細胞から樹立された細胞がナイーブ型になるかプライム型になるかはどのように決定されるのだろうか? さきに述べた結果からも明らかなように,ここには2つのパラメーターが存在する.ひとつは由来する細胞の発生段階で,ナイーブ型多能性幹細胞からプライム型多能性幹細胞が得られることはあっても,その逆はありえない.もうひとつは培養条件で,ナイーブ型の状態を維持できる培養条件が存在しないかぎり,ナイーブ型多能性幹細胞に由来していたとしても培養された細胞はナイーブ型ではありえない.現時点で,ナイーブ型の状態を維持できる培養条件はマウスおよびラットというげっ歯類においてしか確立されていない.GSK3阻害剤とMAPキナーゼ阻害剤をくわえた2i無血清培地における培養も,げっ歯類以外ではナイーブ型多能性の維持には十分ではないようである.ここには,動物種による明らかな違いが存在する.しかしながら,ナイーブ型多能性幹細胞にはプライム型多能性幹細胞に実用的にまさる特性が多い.たとえば,相同遺伝子組換えの効率はナイーブ型多能性幹細胞のほうがはるかに高く,プライム型多能性幹細胞における遺伝子ターゲティングは通常の方法では困難である.また,2i無血清培地における培養にみられるよう,ナイーブ型多能性幹細胞のほうがより均一な性質で維持することが可能であり品質管理の点で有利である.今後,マウスES細胞におけるナイーブ型多能性の維持機構をシグナルの入力との関連において明らかにし,さらにそのプライム型多能性への移行の過程における変化を解析することにより,動物種の壁をこえた,普遍的なナイーブ型多能性幹細胞の培養条件の確立が待たれる.
略歴:1993年 熊本大学大学院医学系研究科 修了,同年 熊本大学医学部 助手,1994年 英国Edinburgh大学 ポスドク,1996年 大阪大学医学部 助手,2001年 理化学研究所発生・再生科学総合研究センター チームリーダーを経て,2009年より同 プロジェクトリーダー.
研究テーマ:マウス多能性幹細胞において機能する転写因子ネットワーク.
研究室URL:http://www.cdb.riken.jp/pcs/
© 2012 丹羽 仁史 Licensed under CC 表示 2.1 日本
(理化学研究所発生・再生科学総合研究センター 多能性幹細胞研究プロジェクト)
email:丹羽仁史
領域融合レビュー, 1, e008 (2012) DOI: 10.7875/leading.author.1.e008
Hitoshi Niwa: Molecular mechanism governing pluripotency of stem cells.
要 約
マウスの着床前の胚から樹立されたマウスES細胞は,サイトカインのひとつLIFに依存的に多能性を維持している.このLIFシグナルは複数の転写因子の制御を介し多能性に関連する転写因子ネットワークに入力している.これとは並列に,液性タンパク質であるWntも多能性の維持に寄与するが,このWntシグナルはTcf3によるEsrrb遺伝子の発現抑制を解除するというひとつの点において多能性に関連する転写因子ネットワークに入力している.一方,マウスの着床後の胚から樹立されたマウスEpiSC(エピブラスト幹細胞)はアクチビンとFgf2に依存して多能性を維持しているが,その転写因子ネットワークへの入力様式は明らかでない.ただし,EpiSCではLIFシグナルおよびWntシグナルへの入力にかかわる転写因子の発現は抑制されており,これがこれら異なる多能性幹細胞の性質を規定している可能性がある.今日では,これら細胞の異なる多能性の状態をナイーブ型およびプライム型として区別するのが一般的であり,ヒトES細胞はこの分類ではプライム型に属する.ただし,これまで提唱されていたこの2つの状態の差異のうちキメラ胚の形成能は絶対的なものとはいえず,マウスEpiSCはEカドヘリンを一過性に発現させるだけで,その胚盤胞の注入はキメラ胚の形成に寄与した.今後,ナイーブ型およびプライム型の状態において表現型とシグナルの入力,および,転写因子ネットワークの状態を注意深く対応させることにより,ナイーブ型の状態を規定する種をこえた原理の解明が待たれる.
はじめに
幹細胞は,自己以外の種類の細胞に分化する能力(分化能)と,細胞分裂をへて自己と同一の分化能をもつ娘細胞を生み出す能力(自己複製能)とをあわせもつ細胞として定義される.このうち,分化能として多能性をもつ細胞を多能性幹細胞とよぶ.多能性は,もっとも普遍的には三胚葉すべてに分化できる能力として規定される.胚性がん細胞(embryonal carcinoma cell,EC細胞)は歴史的にはじめて体外で培養された多能性幹細胞である.このEC細胞は奇形がん種(teratocarcinoma)とよばれる三胚葉の成分が混在する腫瘍に由来し,マウスに移植することによりふたたび奇形がん種を形成したことから多能性をもつことが確認された.さらに,実験的に形成した一部の奇形がん種に由来するEC細胞では,初期胚への移植により正常な発生過程に寄与して三胚葉に分化し,いわゆるキメラマウスの形成も可能であることが確認された1).そして,EC細胞の知見にもとづき,1981年,マウスの胚盤胞の内部細胞塊から胚性幹細胞(embryonic stem cell,ES細胞)が樹立された2,3).このES細胞は胚盤胞への移植により高率にキメラマウスを形成し,そこで生殖細胞系列にも寄与した.これにより,シャーレにおいて培養したES細胞にくわえた遺伝子操作を次世代の個体へと伝達する道が拓かれ,特定の遺伝子機能を喪失した,いわゆるノックアウトマウスの作製が可能になった.この技術の発生研究および医学研究への功績は大きく,開発者は2007年のノーベル医学生理学賞を受賞している.一方で,ES細胞は多能性を規定する分子機構の解明の基盤ともなり,そこから得られた知見にもとづき,2006年,Oct3/4遺伝子,Sox2遺伝子,Klf4遺伝子,Myc遺伝子の4つの遺伝子を導入することで体細胞を初期化することにより,誘導型多能性幹細胞(induced pluripotent stem cell,iPS細胞)が作製された4).この研究を成し遂げた山中伸弥が2012年のノーベル医学生理学賞を受賞したことは記憶に新しい.このレビューでは,これら研究の基盤となった多能性幹細胞が自己複製と分化を遂行するための分子機構について最近の知見を概説する.
1.マウスES細胞の多能性を規定する分子機構
1.1.LIFシグナル伝達経路による多能性維持の機構
マウスES細胞は,1981年の最初の樹立の報告においては,通常の血清含有培地を用い,マウス胎仔から採取した線維芽細胞の上で重層培養されていた.1988年,LIF(leukemia inhibitory factor,白血病抑制因子)がマウスES細胞の分化を抑制し多能性を維持する液性タンパク質として作用することが報告された5).LIFはそれ以前にM1白血病細胞の分化を誘導するタンパク質として同定されていたインターロイキン6ファミリーに属するサイトカインであったが,マウスES細胞に対してはそれとは逆に分化抑制の効果を示し,培地へのLIFの添加により,線維芽細胞との重層培養なしにゼラチン基質の上でマウスES細胞の多能性を維持することができた.LIFはGp130とLIF受容体βからなるLIF受容体に結合し,細胞において3つのシグナル伝達経路を作動させる(図1).これらのうち,Jak-Stat3経路が機能的に重要であることが,その機能の喪失によりLIFの存在下でマウスES細胞の分化が誘導されること6),および,その人為的な活性化によりLIFの非存在下で自己複製が維持されること7) により証明された.一方,LIFはPI3キナーゼ-Akt経路も活性化するが,Aktの人為的な活性化によってもLIFの非存在下で自己複製は維持されることが報告されている8).
では,これらのシグナル伝達経路はどのような遺伝子の発現を活性化することで多能性の維持に寄与しているのだろうか? その同定のため,マウスES細胞において未分化状態にて特異的に発現する転写因子を強制発現させて,LIFの非存在下で自己複製が維持されるかどうか検討された.その結果,2003年にホメオボックス転写因子Nanogが9,10),2009年にはKruppelファミリーに属するジンクフィンガー転写因子Klf4およびTボックス転写因子Tbx3が11),そのような能力をもつと報告された.そして,これらのうちKlf4はJak-Stat3経路において,Tbx3とNanogはPI3キナーゼ-Akt経路において,その発現の活性化されることが示された(図1).
一方で,1990年,EC細胞を用いた解析から,2つのホメオボックス関連DNA結合領域をもつ転写因子Oct3/4が未分化状態において特異的に発現していると報告された12-14).2000年には,Oct3/4の発現が一定量に維持されることがマウスES細胞における多能性の維持に必須であり,その発現量の増加はLIFの除去と同様に分化を誘導し,その減少は栄養外胚葉への分化を誘導することが報告された15).Oct3/4はSryファミリーに属するHMGボックス転写因子Sox2と複合体を形成し標的遺伝子の転写を活性化する16).Sox2もまたマウスES細胞における多能性の維持に必須であり,その機能の欠失は栄養外胚葉への分化を誘導する17).Oct3/4の機能抑制が栄養外胚葉への分化を特異的に誘導する機構として,Oct3/4は栄養外胚葉への分化を指令するホメオボックス転写因子Cdx2と相互抑制回路を形成し,Oct3/4の発現減少はCdx2の発現増加を誘導して栄養外胚葉への分化を誘導するものと考えられている18).また,Sox2はOct3/4と相互活性化回路を形成し,Sox2の発現減少はOct3/4の発現減少をへて,結果的に栄養外胚葉への分化を誘導すると考えられている.
では,LIFからのシグナル伝達経路はどのようにOct3/4あるいはSox2に連結しているのだろうか? Oct3/4の発現を制御する転写因子として,Oct3/4,Sox2,Nr5a2,Nanog,Esrrbなどが報告されている.したがって,Nanogはその連結タンパク質として重要と考えられるが,一方で,Nanogを欠損した細胞は不安定ながらも多能性を維持できるので,これだけでは説明できない19).Klf4はOct3/4およびSox2と協調して標的遺伝子の転写活性化にはたらくことが報告されており,機能的な連結に重要と考えられる20).また,Oct3/4により直接に制御される標的遺伝子の候補としてKlf4遺伝子,Tbx3遺伝子,Nanog遺伝子,Nr5a2遺伝子,Esrrb遺伝子がすべてあげられていることから,これらにコードされる転写因子はネットワークを形成し自己安定化を行っていると考えられるが,その構造の詳細は解明されていない.
Mycもまた,LIFシグナル伝達経路に関与する転写因子と考えられている.安定変異型Mycの強制発現によりLIFの非存在下で自己複製が維持されることが報告されている21).一方,Mycを単独で欠損したマウスES細胞は正常に自己複製するが,MycとMycnとの二重欠損マウスES細胞は胚体外内胚葉へと分化することから,Mycファミリーの機能的な重複が示された22).しかし,Mycの二量体形成のパートナーであるMaxを欠損したマウスES細胞は通常の血清含有培地では維持できないが,GSK3阻害剤とMAPK阻害剤を含む無血清培地(後述)では維持できたことから,Mycファミリーの機能はマウスES細胞における多能性の維持に無条件に必要ではないといえる23).
1.2.FGFシグナル伝達経路による分化誘導の機構
LIFにより活性化される第3の細胞内シグナル伝達経路としてMAPキナーゼ経路がある(図1).この経路は,マウスES細胞自体が発現するFGF4により刺激されるFGF受容体の細胞内シグナル伝達経路でもある.このMAPキナーゼ経路は多能性の維持に拮抗して分化を誘導する方向にはたらき,Fgf4あるいはErk2の欠損によりこの経路の活性化を阻害すると,マウスES細胞の自己複製は安定化し自発的な分化が抑制される24).また,MAPキナーゼはNanogおよびTbx3の核への移行に抑制的にはたらくことが報告されている11,25).しかし,これまでにMAPキナーゼ経路における機能的な標的タンパク質は報告されていない.
1.3.Wntシグナル伝達経路による多能性維持の機構
Wntは発生過程のさまざまな場面ではたらく液性タンパク質である.Wntシグナルは古典的経路においてはFrizzledとLrp5あるいはLrp6とからなる受容体をへてGSK3の抑制にはたらく(図2).GSK3はβカテニンをリン酸化しその分解を亢進させるので,Wntシグナルの刺激によるGSK3の抑制はβカテニンを安定化させる.安定化し蓄積したβカテニンは核へと移行し,Tcfファミリーに属する転写因子と協調して標的遺伝子の発現を制御する.2004年,マウスES細胞に対するWnt3a阻害剤あるいはGSK3阻害剤の添加は多能性の維持に寄与することが示唆された26).さらに2008年には,GSK3阻害剤とMAPキナーゼ阻害剤を同時に添加することにより,無血清培地においてマウスES細胞の多能性を維持できることが報告された27).このGSK3阻害剤とMAPキナーゼ阻害剤を組み合わせた無血清培地(2i無血清培地)はLIFなしに多能性を維持できるが,そこにLIFをくわえると多能性維持の効果が増強することから,これらの細胞内シグナル制御は協調的にはたらきうるようである.
では,Wntシグナル伝達経路はどのような遺伝子の発現を制御することで多能性の維持に寄与しているのだろうか? Tcfファミリーに属する転写因子のひとつTcf3はマウスES細胞においてその機能を欠失させると多能性の維持を安定化させることから,マウスES細胞におけるWntシグナル伝達経路の機能的な構成タンパク質であることが示唆された.ついで,Tcf3はおもに転写抑制因子としてはたらくこと,そして,その機能はWntシグナルの刺激により核に蓄積したβカテニンとの結合により抑制されることが報告された28).すなわち,Wnt3a阻害剤あるいはGSK3阻害剤の投与はβカテニンの活性化をへてTcf3による標的遺伝子の転写抑制を解除することにより,多能性の維持に寄与していたのである.一方,WntシグナルはマウスES細胞においてもβカテニンとTcf1との複合体の形成を介しAxin2遺伝子などの標的遺伝子の転写活性化を起こすが,こちらの多能性の維持への寄与はこれまでのところ検証されていない.最近,Tcf3により転写抑制される標的遺伝子としてEsrrb遺伝子が同定された.Esrrbの人為的な発現の維持はGSK3阻害剤の効果を代替でき,Esrrbを欠損したマウスES細胞はGSK3阻害剤への応答性を喪失した.一方で,Esrrbの人為的な発現の維持はNanogやKlf4,Tbx3と同様にLIFの効果をも代替できたが,Esrrbを欠損したマウスES細胞はLIFの存在下では多能性を維持することができた.これより,Esrrbの機能はGSK3-Tcf3経路の標的としては必要だがLIFシグナル伝達経路の活性化により代償が可能であり,LIFシグナルとWntシグナルの転写因子ネットワークへの入力は分離が可能で,かつ,協調性を示すことを説明することが可能になった29)(図2).
1.4.多能性とエピジェネティクス
ここまで,シグナルの入力との関連において,おもに転写因子による遺伝子の発現制御にもとづく(ジェネティックな)制御機構について述べた.一方で最近,エピジェネティックな制御機構も多能性の維持に寄与していることが報告されている.
ATP依存的クロマチン再構成複合体のひとつであるNuRD(nucleosome remodelling and histone deacetylase)複合体は,その多能性の維持への寄与が機能的に証明された最初のエピジェネティック因子である.NuRD複合体の構成タンパク質のひとつであるMbd3を欠損させたマウスES細胞は分化に対する抵抗性を示し,LIFの非存在下でも自己複製を続ける30).NuRD複合体はおもに転写を抑制する機能をもつことが知られていたが,最近,マウスES細胞においてNuRD複合体はKlf4,Klf5,Tbx3,Rex1などの発現を抑制しており,その欠損はこれらの転写因子の発現を増加させることにより分化に対する抵抗性を誘導することが示された31).一方,ヒストン脱メチル化酵素LSD1はNuRD複合体の構成タンパク質であるが,その機能は多能性の維持には関与せず,分化誘導ののちの遺伝子の発現制御に寄与しているようである32).
BAF複合体もATP依存的クロマチン再構成複合体のひとつであるが,おもに転写活性化に寄与する点でNuRD複合体とは異なる.マウスES細胞にはES細胞に特異的な構成タンパク質を含むesBAF複合体が存在し,Oct3/4やNanogと結合してこれら転写因子による標的遺伝子の転写活性化に寄与することが知られている33).また,ゲノムワイドな解析ではesBAF複合体はStat3ともっとも強く共局在し,その標的遺伝子の発現制御への寄与が示唆されている34,35).
マウスES細胞では遺伝子コード領域のクロマチンが全般にユークロマチン状態にあり,ヒストンの交換が高頻度に起こっていることが知られている36).このような状態の維持には転写活性化にかかわるヒストン修飾パターンの積極的な形成が関与していると考えられる.ヒストンアセチル化は転写活性化にかかわるヒストン修飾の代表であるが,この修飾を導入するヒストンアセチルトランスフェラーゼ(histone acetyltransferase:HAT)のひとつTip60は,ノックダウンによる機能的なスクリーニングから多能性の維持への寄与が示唆されている37).また最近,別のヒストンアセチルトランスフェラーゼであるMOF/Myst1/Kat8がマウスES細胞における自己複製の維持に必須であることが報告された38).ヒストンH3の4番目のリジン残基のメチル化(H3K4me)も転写活性化にかかわるヒストン修飾のひとつであり,Trithoraxグループ(trxG)複合体がその導入に関与している.マウスES細胞におけるTrithoraxグループ複合体の構成タンパク質のひとつWdr5は,ゲノムにおいてOct3/4と共局在し多能性の維持に寄与していると考えられている39).
これらとは対照的に,多くのエピジェネティックな制御機構はヘテロクロマチンを形成し遺伝子発現を抑制する方向にはたらくが,マウスES細胞の多能性の維持には必要ない40).Polycomb抑制複合体2(PRC2)はヒストンH3の27番目のリジン残基のメチル化(H3K27me3)を導入して転写を抑制するが,マウスES細胞においてその構成タンパク質であるEed,Suz12,Ezh2を欠損させH3K27me3をほぼ消滅させても多能性は維持される.また,H3K4me3とH3K27me3の混在する二価のドメイン(bivalent domain)はマウスES細胞において自己複製と分化の制御にかかわるエピジェネティックな状態として注目をあつめたが,最近の報告では,GSK3阻害剤とMAPキナーゼ阻害剤をくわえた2i無血清培地で培養されたマウスES細胞においては,ゲノムにおいてH3K4me3とH3K27me3の混在するドメインが激減しているにもかかわらず,その多能性の状態はむしろ亢進していること,そして,その分化誘導の過程でもH3K4me3とH3K27me3の混在するドメインの出現は明確ではないことが示された41).したがって,H3K27me3の導入によるH3K4me3と混在するドメインの形成には強い機能的な意義は存在しないと考えたほうがよいと思われる.
2.マウスEpiSCの多能性を規定する分子機構
2.1.マウスEpiSCとは?
マウスES細胞は子宮に着床する前の胚盤胞から樹立された多能性幹細胞であるが,2007年,少し発生の進んだ着床の後の胚からも多能性幹細胞が樹立された42,43).この細胞はエピブラスト幹細胞(epiblast stem cell,EpiSC)と命名され,マウスES細胞とはさまざまな点で違いを示した(表1).マウスEpiSCの増殖はLIFには依存せず,マウスES細胞においてLIFシグナルの入力にかかわる転写因子であるKlf4やTbx3も発現していない.一方,Nanogは発現しているが,その発現はEpiSCの自己複製に必要な液性タンパク質であるアクチビンのシグナルにより制御されていることが示されている.しかし最近,Nanogを欠損したEpiSCが樹立されたので,マウスES細胞と同様に,Nanogの機能はEpiSCにおける多能性の維持にも必須ではないといえる44).
マウスES細胞をEpiSCの培養条件において培養を続けると,その一部がEpiSC様の多能性幹細胞へと移行することが報告されている.逆に,EpiSCはSK3阻害剤とMAPキナーゼ阻害剤をくわえた2i無血清培地では分化してしまい,LIFと血清を含む培地でわずかにES細胞様の多能性幹細胞への移行が認められるにすぎない.しかし,このとき,マウスES細胞において特異的に発現している転写因子Klf2,Klf4,Nanog,Tbx3,Esrrb,Nr5a1,Nr5a2のうちどれかひとつを過剰発現させるか,あるいは,LIFシグナルを強制的に活性化させると,数%の細胞がES細胞様の多能性幹細胞へと“リプログラミング”される45,46).したがって,ES細胞からEpiSCへの移行は発生過程の順方向の変化であって基本的には不可逆的であり,その逆行には分化した細胞の場合と同様に遺伝子操作を必要とする.
では,EpiSCは発生過程においてどの時期の多能性幹細胞の状態に近いのだろうか? マウスES細胞からの始原生殖細胞の分化誘導の条件の検討により,マウスES細胞から分化し形成された着床後胚の多能性幹細胞に相当する状態からは始原生殖細胞が分化誘導できるのに対し,EpiSCからは同様の培養条件では誘導できないことが報告された47).さらに,これらの細胞および始原生殖細胞が形成されるまえの着床後胚(5.5日胚)における多能性幹細胞の遺伝子発現プロファイルの比較から,EpiSCはこの時期の多能性幹細胞とは異なっていることが示された.これらの結果から,EpiSCは生殖細胞が分化したのち,発生6日以降の時期の多能性幹細胞に近いと推測される.
2.2.EpiSCの特性を規定する分子機構
では,ES細胞とEpiSCとの違いはどのような分子機構により規定されているのだろうか? さきに述べたEpiSCをリプログラミングする活性をもつ転写因子は,マウスES細胞においてはおもにLIFシグナル伝達経路に関与しており,それぞれの機能はES細胞の多能性の維持において必須ではないという点で共通している.したがって,マウスES細胞に特徴的な多能性はLIFシグナルへの応答性に依存していると考えられる.一方,マウスES細胞と比較してEpiSCにおいて強く発現する遺伝子から,EpiSCに特徴的な多能性を規定する機能的なタンパク質はこれまで同定されていない.
EpiSCはエピジェネティックな制御の点でもマウスES細胞とは大きく異なっている.雌では着床の直後の胚においてエピジェネティックな制御により2本あるX染色体の一方の不活性化が起こるが,雌のマウスES細胞は着床前の2本のX染色体がともに活性な状態を維持しているのに対し,雌のEpiSCでは1本のX染色体に不活性化が起こっている.また,発生の過程で制御される遺伝子のヒストン修飾状態にも明らかな違いが報告されている.さらに,Dnmt3a遺伝子やDnmt3l遺伝子といったDNAメチル化に関与する遺伝子の発現がEpiSCにおいて高いことも観察されている.ただし,このような違いがどのようにしてEpiSCの表現型に機能的に関与しているのかは明らかでない.
2.3.EpiSCのキメラ胚への寄与能
ES細胞とEpiSCとを区別する表現型として,胚盤胞に注入されたときのキメラ胚への寄与能がある.2007年の報告では,EpiSCを胚盤胞に注入してもほとんどは内部細胞塊と融合せず,わずかなキメラ胚が回収されたにすぎなかったとされている42,43).しかし,EpiSCは着床後胚に由来する多能性幹細胞であり,着床前の胚盤胞への移植は異所性の移植であるから,これがキメラ胚に寄与できない理由とも考えられる.また,そもそもEpiSCのもととなる着床後胚の多能性幹細胞もまた,胚発生の過程において三胚葉への分化能を示すことから,EpiSCが絶対的な意味でキメラ胚への寄与能を喪失しているとは考えにくい.EpiSCのキメラ胚への寄与能を正当に評価するためには着床後胚への同所性の移植を行うことが理想的だが,これには技術的に高い困難がある.
そこで最近,筆者らは,Eカドヘリンを一過性に強制発現させたEpiSCを胚盤胞に注入し,そのキメラ胚への寄与能を検討した48)(図3).Eカドヘリンを強制発現させた理由は,EカドヘリンはマウスES細胞において細胞間接着をつかさどる主たる接着因子であること,そして,過去の報告ではEpiSCではその発現が低下しているとされていたことによる.Eカドヘリンを2日間にわたり発現させたEpiSCにおいては,マウスES細胞に特異的な遺伝子の発現は誘導されず,また,X染色体の再活性化も認められなかったことから,マウスES細胞に特異的な転写因子を強制発現させたときのようなリプログラミングは誘導されていないと考えられた.しかし,これらの細胞を胚盤胞に1個だけ注入すると,その5%が良好なキメラ胚を形成した.したがって,EpiSCがキメラ胚への寄与能を喪失しているようにみえるのはその絶対的な能力の欠損を示すものではなく,かつ,マウスES細胞に特異的な転写因子の機能はキメラ胚への寄与能を規定するものではないといえた.また,この方法で作製されたキメラマウスではEpiSCに由来する細胞の生殖細胞系列への寄与は観察できなかった.これは,さきに述べたように,EpiSCが生殖細胞系列の分離ののちの,発生後期の多能性幹細胞の状態に近いことを反映しているのかもしれない.
3.多能性幹細胞の一般的な分類
1981年のマウスES細胞株の樹立の報告ののち,さまざまな動物種からのES細胞株の樹立が試みられたが,キメラ胚への寄与能の証明を含む成功例の報告は皆無であった.1995年,胚盤胞からのサルES細胞の樹立が報告されたが,その培養条件はマウスのものとは異なり,LIFの代わりにアクチビンとFgf2を含むものであった49).1998年には,同じ培養条件でヒトES細胞の樹立が報告され50),そののち,ほかの動物種からも同じ条件での胚盤胞からのES細胞株の樹立があいついでなされた.
当初,このようなマウスとそれ以外の動物種のES細胞の培養条件における依存性の違いは,マウスにおいて種特異的にLIFシグナルが多能性の維持にはたらくためであると解釈された.しかし,さきに述べたマウスにおけるEpiSCの樹立は,このような状況を一変させた.マウスEpiSCは,マウス以外の動物種のES細胞と同じく,アクチビンおよびFgf2に依存的に多能性を維持しているのみならず,それ以外の性質においても,マウスES細胞よりこれらのES細胞に似ている.これは,マウスES細胞とそれ以外の動物種のES細胞の違いは,種に依存的な違いというより,これら多能性幹細胞がシャーレにおいてとどまった発生段階の違いであることを示唆している.
しかし,マウスEpiSCとほかの動物種のES細胞(たとえば,ヒトES細胞)とには決定的な違いがある.前者が着床後胚に由来するのに対し,後者は着床前の胚盤胞に由来する,という点である.それで,ヒトES細胞がマウスEpiSCに似ているならば,ヒトES細胞は樹立の過程において着床後胚に相当するまで発生した多能性幹細胞の集団に由来する,ということなのだろうか? 最近,この点を示唆する興味深い研究成果が報告された.マウス胚盤胞の内部細胞塊をLIFを含有する培地で培養するとES細胞を樹立できるが,これをアクチビンおよびFgf2を含有する培地で培養するとEpiSCを樹立できたのだ51).これは,さきに述べたヒトES細胞の樹立に関する仮説を強く支持するものである.
ヒトES細胞がマウスES細胞と相同ではなく,むしろ,マウスEpiSCと相同であるなら,“ES細胞”という単語は単にその細胞が着床前の初期胚に由来するという出自の相同性を示すだけで,細胞の状態の相同性を表わせていないことになる.2009年,マウスES細胞型の多能性の状態をナイーブ型多能性(naïve pluripotency),マウスEpiSC型の多能性の状態をプライム型多能性(primed pluripotency)とする分類が提唱された52).これによれば,ヒトES細胞はプライム型多能性幹細胞に分類されることになる.現在,この分類は多能性幹細胞の性質による分類として普及しつつある.
おわりに
では,胚の多能性幹細胞から樹立された細胞がナイーブ型になるかプライム型になるかはどのように決定されるのだろうか? さきに述べた結果からも明らかなように,ここには2つのパラメーターが存在する.ひとつは由来する細胞の発生段階で,ナイーブ型多能性幹細胞からプライム型多能性幹細胞が得られることはあっても,その逆はありえない.もうひとつは培養条件で,ナイーブ型の状態を維持できる培養条件が存在しないかぎり,ナイーブ型多能性幹細胞に由来していたとしても培養された細胞はナイーブ型ではありえない.現時点で,ナイーブ型の状態を維持できる培養条件はマウスおよびラットというげっ歯類においてしか確立されていない.GSK3阻害剤とMAPキナーゼ阻害剤をくわえた2i無血清培地における培養も,げっ歯類以外ではナイーブ型多能性の維持には十分ではないようである.ここには,動物種による明らかな違いが存在する.しかしながら,ナイーブ型多能性幹細胞にはプライム型多能性幹細胞に実用的にまさる特性が多い.たとえば,相同遺伝子組換えの効率はナイーブ型多能性幹細胞のほうがはるかに高く,プライム型多能性幹細胞における遺伝子ターゲティングは通常の方法では困難である.また,2i無血清培地における培養にみられるよう,ナイーブ型多能性幹細胞のほうがより均一な性質で維持することが可能であり品質管理の点で有利である.今後,マウスES細胞におけるナイーブ型多能性の維持機構をシグナルの入力との関連において明らかにし,さらにそのプライム型多能性への移行の過程における変化を解析することにより,動物種の壁をこえた,普遍的なナイーブ型多能性幹細胞の培養条件の確立が待たれる.
文 献
- Papaioannou, V. E., Gardner, R. L., McBurney, M. W. et al.: Participation of cultured teratocarcinoma cells in mouse embryogenesis. J. Embryol. Exp. Morphol., 44, 93-104 (1978)[PubMed]
- Evans, M. J. & Kaufman, M. H.: Establishment in culture of pluripotential cells from mouse embryos. Nature, 292, 154-156 (1981)[PubMed]
- Martin, G. R.: Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc. Natl. Acad. Sci. USA, 78, 7634-7638 (1981)[PubMed]
- Takahashi, K. & Yamanaka, S.: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126, 663-676 (2006)[PubMed]
- Smith, A. G., Heath, J. K., Donaldson, D. D. et al.: Inhibition of pluripotential embryonic stem cell differentiation by purified polypeptides. Nature, 336, 688-690 (1988)[PubMed]
- Niwa, H., Burdon, T., Chambers, I. et al.: Self-renewal of pluripotent embryonic stem cells is mediated via activation of STAT3. Genes Dev., 12, 2048-2060 (1998)[PubMed]
- Matsuda, T., Nakamura, T., Nakao, K. et al.: STAT3 activation is sufficient to maintain an undifferentiated state of mouse embryonic stem cells. EMBO J., 18, 4261-4269 (1999)[PubMed]
- Watanabe, S., Umehara, H., Murayama, K. et al.: Activation of Akt signaling is sufficient to maintain pluripotency in mouse and primate embryonic stem cells. Oncogene, 25, 2697-2707 (2006)[PubMed]
- Chambers, I., Colby, D., Robertson, M. et al.: Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells. Cell, 113, 643-655 (2003)[PubMed]
- Mitsui, K., Tokuzawa, Y., Itoh, H. et al.: The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells. Cell, 113, 631-642 (2003)[PubMed]
- Niwa, H., Ogawa, K., Shimosato, D. et al.: A parallel circuit of LIF signalling pathways maintains pluripotency of mouse ES cells. Nature, 460, 118-122 (2009)[PubMed]
- Okamoto, K., Okazawa, H., Okuda, A. et al.: A novel octamer binding transcription factor is differentially expressed in mouse embryonic cells. Cell, 60, 461-472 (1990)[PubMed]
- Rosner, M. H., Vigano, M. A., Ozato, K. et al.: A POU-domain transcription factor in early stem cells and germ cells of the mammalian embryo. Nature, 345, 686-692 (1990)[PubMed]
- Scholer, H. R., Ruppert, S., Suzuki, N. et al.: New type of POU domain in germ line-specific protein Oct-4. Nature, 344, 435-439 (1990)[PubMed]
- Niwa, H., Miyazaki, J. & Smith, A. G.: Quantitative expression of Oct-3/4 defines differentiation, dedifferentiation or self-renewal of ES cells. Nat. Genet., 24, 372-376 (2000)[PubMed]
- Yuan, H., Corbi, N., Basilico, C. et al.: Developmental-specific activity of the FGF-4 enhancer requires the synergistic action of Sox2 and Oct-3. Genes Dev., 9, 2635-2645 (1995)[PubMed]
- Masui, S., Nakatake, Y., Toyooka, Y. et al.: Pluripotency governed by Sox2 via regulation of Oct3/4 expression in mouse embryonic stem cells. Nat. Cell Biol., 9, 625-635 (2007)[PubMed]
- Niwa, H., Toyooka, Y., Shimosato, D. et al.: Interaction between Oct3/4 and Cdx2 determines trophectoderm differentiation. Cell, 123, 917-929 (2005)[PubMed]
- Chambers, I., Silva, J., Colby, D. et al.: Nanog safeguards pluripotency and mediates germline development. Nature, 450, 1230-1234 (2007)[PubMed]
- Nakatake, Y., Fukui, N., Iwamatsu, Y. et al.: Klf4 cooperates with Oct3/4 and Sox2 to activate the Lefty1 core promoter in embryonic stem cells. Mol. Cell. Biol., 26, 7772-7782 (2006)[PubMed]
- Cartwright, P., McLean, C., Sheppard, A. et al.: LIF/STAT3 controls ES cell self-renewal and pluripotency by a Myc-dependent mechanism. Development, 132, 885-896 (2005)[PubMed]
- Smith, K. N., Singh, A. M. & Dalton, S.: Myc represses primitive endoderm differentiation in pluripotent stem cells. Cell Stem Cell, 7, 343-354 (2010)[PubMed]
- Hishida, T., Nozaki, Y., Nakachi, Y. et al.: Indefinite self-renewal of ESCs through Myc/Max transcriptional complex-independent mechanisms. Cell Stem Cell, 9, 37-49 (2011)[PubMed] [新着論文レビュー]
- Kunath, T., Saba-El-Leil, M. K., Almousailleakh, M. et al.: FGF stimulation of the Erk1/2 signalling cascade triggers transition of pluripotent embryonic stem cells from self-renewal to lineage commitment. Development, 134, 2895-2902 (2007)[PubMed]
- Hamazaki, T., Kehoe, S. M., Nakano, T. et al.: The Grb2/Mek pathway represses Nanog in murine embryonic stem cells. Mol. Cell. Biol., 26, 7539-7549 (2006)[PubMed]
- Sato, N., Meijer, L., Skaltsounis, L. et al.: Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signaling by a pharmacological GSK-3-specific inhibitor. Nat. Med., 10, 55-63 (2004)[PubMed]
- Ying, Q. L., Wray, J., Nichols, J. et al.: The ground state of embryonic stem cell self-renewal. Nature, 453, 519-523 (2008)[PubMed]
- Wray, J., Kalkan, T., Gomez-Lopez, S. et al.: Inhibition of glycogen synthase kinase-3 alleviates Tcf3 repression of the pluripotency network and increases embryonic stem cell resistance to differentiation. Nat. Cell Biol., 13, 838-845 (2011)[PubMed]
- Martello, G., Sugimoto, T., Diamanti, E. et al.: Esrrb is a pivotal target of the gsk3/tcf3 axis regulating embryonic stem cell self-renewal. Cell Stem Cell, 11, 491-504 (2012)[PubMed] [新着論文レビュー]
- Kaji, K., Caballero, I. M., MacLeod, R. et al.: The NuRD component Mbd3 is required for pluripotency of embryonic stem cells. Nat. Cell Biol., 8, 285-292 (2006)[PubMed]
- Reynolds, N., Latos, P., Hynes-Allen, A. et al.: NuRD suppresses pluripotency gene expression to promote transcriptional heterogeneity and lineage commitment. Cell Stem Cell. 10, 583-594 (2012)[PubMed]
- Whyte, W. A., Bilodeau, S., Orlando, D. A. et al.: Enhancer decommissioning by LSD1 during embryonic stem cell differentiation. Nature, 482, 221-225 (2012)[PubMed]
- Ho, L., Ronan, J. L., Wu, J. et al.: An embryonic stem cell chromatin remodeling complex, esBAF, is essential for embryonic stem cell self-renewal and pluripotency. Proc. Natl. Acad. Sci. USA, 106, 5181-5186 (2009)[PubMed]
- Ho, L., Miller, E. L., Ronan, J. L. et al.: esBAF facilitates pluripotency by conditioning the genome for LIF/STAT3 signalling and by regulating polycomb function. Nat. Cell Biol., 13, 903-913 (2011)[PubMed]
- Novershtern, N. & Hanna, J. H.: esBAF safeguards Stat3 binding to maintain pluripotency. Nat. Cell Biol., 13, 886-888 (2011)[PubMed]
- Meshorer, E., Yellajoshula, D., George, E. et al.: Hyperdynamic plasticity of chromatin proteins in pluripotent embryonic stem cells. Dev. Cell, 10, 105-116 (2006)[PubMed]
- Fazzio, T. G., Huff, J. T. & Panning, B.: An RNAi screen of chromatin proteins identifies Tip60-p400 as a regulator of embryonic stem cell identity. Cell, 134, 162-174 (2008)[PubMed]
- Li, X., Li, L., Pandey, R. et al.: The histone acetyltransferase MOF is a key regulator of the embryonic stem cell core transcriptional network. Cell Stem Cell, 11, 163-178 (2012)[PubMed]
- Ang, Y. S., Tsai, S. Y., Lee, D. F. et al.: Wdr5 mediates self-renewal and reprogramming via the embryonic stem cell core transcriptional network. Cell, 145, 183-197 (2011)[PubMed]
- Niwa, H.: How is pluripotency determined and maintained? Development, 134, 635-646 (2007)[PubMed]
- Marks, H., Kalkan, T., Menafra, R. et al.: The transcriptional and epigenomic foundations of ground state pluripotency. Cell, 149, 590-604 (2012)[PubMed]
- Brons, I. G., Smithers, L. E., Trotter, M. W. et al.: Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature, 448, 191-195 (2007)[PubMed]
- Tesar, P. J., Chenoweth, J. G., Brook, F. A. et al.: New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature, 448, 196-199 (2007)[PubMed]
- Festuccia, N., Osorno, R., Halbritter, F. et al.: Esrrb is a direct Nanog target gene that can substitute for Nanog function in pluripotent cells. Cell Stem Cell, 11, 477-490 (2012)[PubMed]
- Guo, G., Yang, J., Nichols, J. et al.: Klf4 reverts developmentally programmed restriction of ground state pluripotency. Development, 136, 1063-1069 (2009)[PubMed]
- Guo, G. & Smith, A.: A genome-wide screen in EpiSCs identifies Nr5a nuclear receptors as potent inducers of ground state pluripotency. Development, 137, 3185-3192 (2010)[PubMed]
- Hayashi, K., Ohta, H. & Kurimoto, K. et al.: Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell, 146, 519-532 (2011)[PubMed]
- Ohtsuka, S., Nishikawa-Torikai, S. & Niwa, H.: E-cadherin promotes incorporation of mouse epiblast stem cells into normal development. PLoS One, 7, e45220 (2012)[PubMed]
- Thomson, J. A., Kalishman, J., Golos, T. G. et al.: Isolation of a primate embryonic stem cell line. Proc. Natl. Acad. Sci. USA, 92, 7844-7848 (1995)[PubMed]
- Thomson, J. A., Itskovitz-Eldor, J., Shapiro, S. S. et al.: Embryonic stem cell lines derived from human blastocysts. Science, 282, 1145-1147 (1998)[PubMed]
- Najm, F. J., Chenoweth, J. G., Anderson, P. D. et al.: Isolation of epiblast stem cells from preimplantation mouse embryos. Cell Stem Cell, 8, 318-325 (2011)[PubMed]
- Nichols, J. & Smith, A.: Naive and primed pluripotent states. Cell Stem Cell, 4, 487-492 (2009)[PubMed]
著者プロフィール
略歴:1993年 熊本大学大学院医学系研究科 修了,同年 熊本大学医学部 助手,1994年 英国Edinburgh大学 ポスドク,1996年 大阪大学医学部 助手,2001年 理化学研究所発生・再生科学総合研究センター チームリーダーを経て,2009年より同 プロジェクトリーダー.
研究テーマ:マウス多能性幹細胞において機能する転写因子ネットワーク.
研究室URL:http://www.cdb.riken.jp/pcs/
© 2012 丹羽 仁史 Licensed under CC 表示 2.1 日本