立体構造が明らかにしたGタンパク質共役受容体の刺激受容のしくみ
2013/03/11
天野剛志・廣明秀一
(名古屋大学大学院創薬科学研究科 構造分子薬理学分野)
email:廣明秀一
領域融合レビュー, 2, e003 (2013) DOI: 10.7875/leading.author.2.e003
Takeshi Tenno & Hidekazu Hiroaki: A common mechanism of signal transduction of G-protein-coupled receptors revealed by their three-dimensional structures.

2012年のノーベル化学賞は,Gタンパク質共役受容体(GPCR)に関する研究について,米国Duke大学のLefkowitz教授と米国Stanford大学のKobilka教授に授与された.GPCRは細胞の外の刺激を内部に伝える刺激受容とシグナル伝達の鍵となるタンパク質であり,創薬の標的としてもきわめて重要である.しかし,細胞外のシグナルを立体構造の変化を介し細胞内に伝達するという機能的な必然性のため,膜貫通へリックスの配向ならびに細胞内ループの周辺において,複数の立体構造のあいだでの構造のゆらぎが存在しており,その構造解析は容易ではなかった.細胞内ループにT4リゾチームのような可溶性のタンパク質を融合することにより,高分解能でのβ2アドレナリン受容体の構造解析はなされたが,この構造解析にいたるまでに,さまざまな研究者により多くのGPCRに普遍的に応用の可能な方法論が確立された.たとえば,脂質キュービックフェーズ法,あるいは,熱安定性をもつ点変異体を徹底活用してGPCRのコア構造の平衡状態を不活性型または活性型のいずれかにかたよらせ固定するといった手法である.これらの方法は単なる構造生物学における技術開発にとどまらず,GPCRのシグナル伝達機構の本質の理解にせまるものであった.ここでは,GPCRによるシグナル伝達の分子機構について,GPCRの立体構造解析の技術開発の進展と関連づけて解説する.
古来,毒と薬は表裏一体であった.あるいは,医薬品の発見と開発の歴史は,その初期において,毒物の発見とその利用の歴史であるといい換えても過言ではない.人類はその存続をかけて,これまでに多くの毒と出会い,その一部の有効利用に成功してきた.そうした歴史的な経緯のなかで実用化されてきた医薬品の多くは,人体のホメオスタシスや神経伝達を制御するGタンパク質共役受容体(G-protein coupled receptor:GPCR)を標的とするものである.2012年のノーベル化学賞は,米国Duke大学のRobert J. Lefkowitz教授と米国Stanford大学のBrian K. Kobilka教授の,GPCRの構造と機能に関する長年の研究成果に対し授与された.ところで,不思議な話ではあるが,GPCRは分子生物学あるいは細胞生物学の観点から注目度の高いタンパク質ではない.たとえば,生命科学系の大学院において広く使用されている教科書『Essential細胞生物学 第3版1)』においても,わずか十数ページが割かれているにすぎない.一方で,その薬理学的な重要性から,医学や生理学あるいは薬学の関係者からは,知る人ぞ知る重要な標的タンパク質と目されていた.また,構造生物学者からは構造解析の困難なタンパク質の代表格とされていた.今回のノーベル化学賞につながった業績は,その機能解析をつうじホメオスタシスや神経伝達などきわめて重要な生理現象に共通な機構の解明において,その端緒を開いたという点で非常に意義深い.
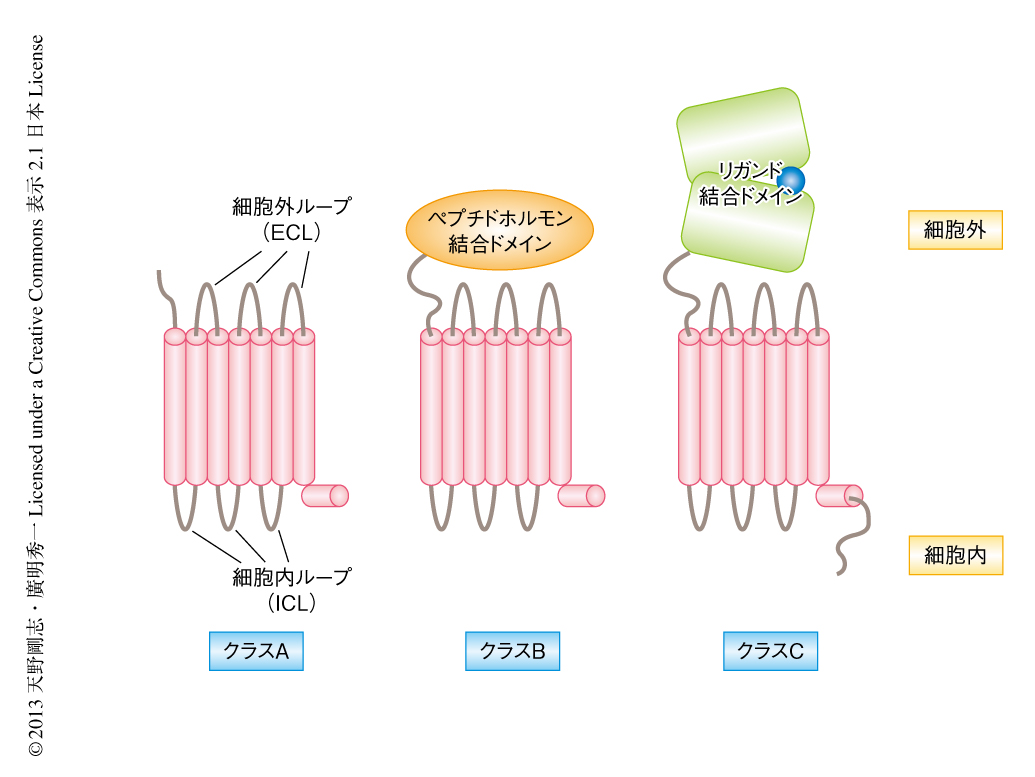
まず,アミノ酸一次配列にもとづいたGPCRの分類と,それぞれの基本的な生理機能について復習しておこう.GPCRはペプチドホルモンや低分子リガンド,あるいは,光などの細胞外のシグナルを受容し,それを細胞内に伝えるのが主たる機能である.GPCRの主要な3つのクラスについてあげた(図1).この分類は,オランダCMBI(Centre for Molecular and Biomolecular Informatics)の公開しているデータベースGPCRDB 2,3)(URL:http://www.GPCR.org/7tm/)を参考にしている.現時点で,ヒトのゲノムにはおよそ1400種のGPCRの遺伝子が存在しており,この数は全遺伝子のおよそ5%にも及ぶ.このうち,もっとも多いのは嗅覚受容体である.これらのGPCRは,全長のアミノ酸配列の相同性にもとづき5つのクラスに分類されている.
ここでおもにとりあげるクラスA(ロドプシンファミリーともよばれる)は,N末端ならびにC末端にあるループが短い,または,そこにほかの構造ドメインをもたないタイプである.カテコールアミンや脂溶性の低分子リガンド(多くの神経伝達物質を含む),ペプチドホルモン(エンドセリンなど)を受容してシグナル伝達を行う.最初期に構造解析されたロドプシンは,それらのリガンドの代わりに光受容分子であるレチナールが共有結合により結合している.クラスAには,視覚や嗅覚などの感覚,神経伝達,ホメオスタシスの維持など,きわめて重要な生理機能にかかわるGPCRが数多く含まれている.
ここでは割愛するが,創薬の標的として注目されているカテゴリーとして,クラスB(セクレチン受容体ファミリーともよばれる)と,クラスC(代謝型グルタミン酸受容体ファミリーともよばれる)がある.クラスBは,N末端に100~300アミノ酸残基とやや長い領域をもち,そこに約100アミノ酸残基のペプチドホルモン結合ドメイン(または,単に細胞外ドメインとよばれる)が存在し,セクレチンなどジスルフィド結合を含まないペプチドホルモンの刺激伝達を行う.クラスCは,N末端に約300アミノ酸残基とさらに長い領域をもち,そこにアミノ酸などに対するリガンド結合ドメインが存在する.クラスCの代表例は神経伝達に欠かせないグルタミン酸受容体である.おもしろいことに,クラスCのもつリガンド結合ドメインは真正細菌においても遺伝的に保存されており,ペリプラズムにおいてアミノ酸選択輸送などに機能するタンパク質のもつドメインと立体構造がきわめて類似している.
このほかに,Wntシグナル伝達系においてシグナルを受容する7回膜貫通型受容体Frizzledや,酵母のもつ接合因子受容体などを,それぞれ,さきに述べたものとは別のGPCRのファミリーとして分類することもあるが,現行のデータベースGPCRDBには収載されていない.
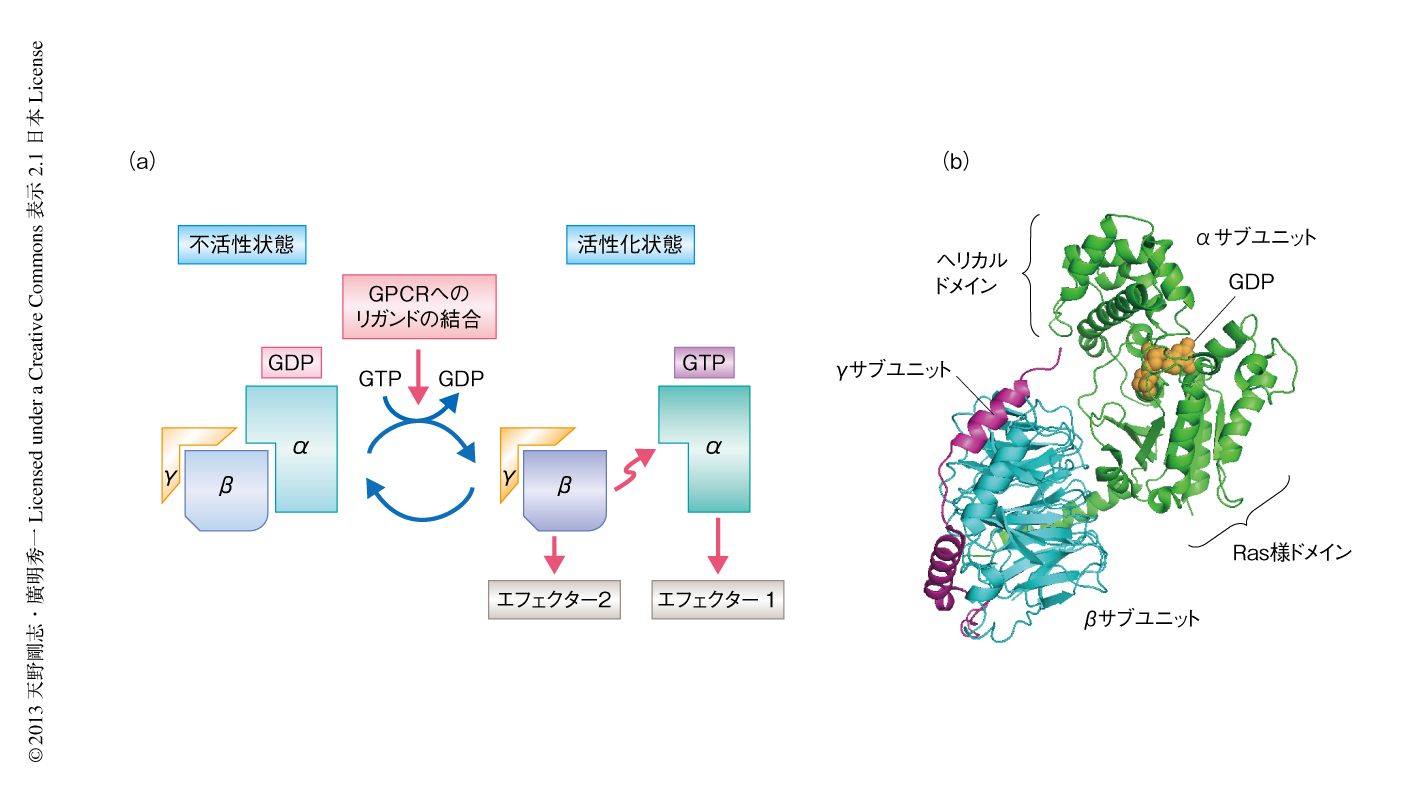
GPCRにリガンドが結合するとGPCRの膜貫通へリックスの立体構造に変化が起こり,その変化が細胞内ループに伝わって,結果的に,細胞内ループに結合したヘテロ三量体型GTP結合タンパク質に伝達される4).このヘテロ三量体型GTP結合タンパク質(以下,単にGタンパク質とよぶ)は,その名のとおり,α,β,γの3つのサブユニットからなるタンパク質であり,このうちGTPと結合するのはαサブユニットである.Gタンパク質には複数の種類があり,その種類により細胞内に伝わるシグナルは大きく異なる.たとえば哺乳類において,αサブユニット,βサブユニット,γサブユニットの分子種は,それぞれ,約20種類,約6種類,約12種類が存在している.GPCRが同じでもそれに共役するGタンパク質の種類が異なれば生理的に活性化と抑制の正反対の反応をひき起こすこともあり,そのことがGPCRに関係する生理現象の複雑さの原因のひとつとなっている.Gタンパク質においても,細胞増殖におけるシグナル伝達などで知られる低分子量Gタンパク質などと同様に,GDP結合型が不活性型,GTP結合型が活性型である.リガンドがGPCRに結合することによりシグナルはGタンパク質のαサブユニットに伝達される.すると,これまで不活性型であったGタンパク質のGDPがGTPに交換され,αサブユニットとβγサブユニットの2つに解離する.αサブユニットとβγサブユニットはそれぞれGPCRから解離し,別個のエフェクター分子に作用してシグナルを伝達していく(図2).
GPCRの種類ならびにそれが発現している細胞により,GPCRと共役しているGタンパク質の種類も異なっている.それらはαサブユニットの配列により,Gs,Gi/o,Gq,G12/13の4つのタイプに大別される.Gsのsは活性化(stimulation)の頭文字を意味し,膜酵素であるアデニル酸シクラーゼを活性化することにより後続するシグナル伝達カスケードの初発を行う.また,ホスホリパーゼA2あるいはホスホリパーゼCなどを活性化して細胞内にシグナルを伝達する.活性化されたアデニル酸シクラーゼにより生成されたcAMPは,プロテインキナーゼAを活性化して広範な細胞刺激をつかさどるセカンドメッセンジャーである.一方,Gi/oのi/oは阻害(inhibitory)/その他(other)の頭文字を意味し,しばしばアデニル酸シクラーゼの活性を阻害するため,さきのGsに由来するシグナルの抑制を担う.そのほか,βγサブユニットを介してホスファチジルイノシトール特異的ホスホリパーゼCβやホスホジエステラーゼを活性化するなど,広範なシグナル伝達系に関与している.これら2つの主要なタイプのほか,ホスホリパーゼCβを活性化するGq,低分子量Gタンパク質であるRasやRhoを介したシグナル伝達系とクロストークするG12/13がある.
GPCRにはホルモン受容体や神経伝達物質受容体などが多く含まれる.そのため,通常の酵素阻害剤やチャネルブロッカーとは異なり,GPCRに作用する薬物は薬理学的につぎの2種類に大別される.すなわち,アゴニスト(作動薬)とアンタゴニスト(拮抗薬)である.アゴニストはその受容体の生理的なリガンドと同様の生理作用をひき起こす薬物であり,アンタゴニストは生理的なリガンドの作用に拮抗してこれを阻害する薬物である.通常,薬物の作用強度は薬物と標的となる受容体との解離定数(Kd)により一意的に定められるべきものであるが,GPCRのアゴニストには大過剰を投与しても本来の生理的なリガンドが起こしうる生理反応の部分的な活性化しか示さないものがある.そこで,解離定数とは別に,飽和したときに100%の生理活性をひき起こしうるものを完全アゴニスト,部分活性化しかなしとげないものを部分アゴニストとよんで区別している.また,少なくない数のGPCRはリガンドの結合していない状態でもある程度のシグナル伝達を行っている.これは,いわば,自動車のエンジンのアイドリング回転に相当する活性で,基礎活性(または,基底状態活性)とよぶ.通常のアンタゴニストは受容体によるシグナル伝達の活性化は阻害するものの,この基礎活性には影響をあたえない.一方,インバースアゴニスト(逆作動薬)とよばれる薬物は,この基礎活性をさらに抑制する薬物である.GPCRの関与する系ではこれら複雑な現象が古くから知られており,その分子機構の解明が待たれていた.
Kobilka研究室の業績にくわえ,これまでGPCRの高分解能での立体構造解析に成功し技術確立に貢献した,Stevens研究室(米国Scripps Research Institute),Tate研究室(英国MRC Laboratory of Molecular Biology),および,わが国の岩田 想研究室(京都大学大学院医学研究科)による成果について紹介する.なお,GPCRの結晶化法の進展について,執筆時に収集した54個のPDBエントリーにある結晶化の条件などをまとめたものをSupplementary Tableとして添付する(表1).これが読者の一助になればと願っている.
表1 GPCR結晶化法の進展
2013年1月10日 現在
[Download]
GPCRは重要な創薬ターゲットであったこともあり,その構造決定にむけて多くの努力がなされてきた.構造決定においてたちはだかった壁は,1)組換え体のGPCRが大量に得られないこと,2)結晶が得られない,たとえ得られたとしても,分解能の悪いこと,であった.これらの壁はタンパク質の結晶化においてつねにたちはだかるものであるが,GPCRにおいてはとくに高い壁であった.
組換えGPCRを得る手法として,大腸菌から真核細胞まで,さまざまな方法が検討されてきた.筆者らが調べたかぎり,これまでに立体構造が報告されたGPCRのほとんどは昆虫細胞から調製されており,ほかには,メタノール資化性酵母(Pichia pastris)が3例,大腸菌(固体NMRによる解析が行われた)が1例であった.そして,結晶化に適した試料を得るため,膜貫通へリックスへの変異の導入による安定化5,6),N末端やC末端,あるいは,細胞内ループなどの切除7),糖鎖により修飾されるアスパラギン残基からほかの残基への変異,などが行われた.これらの改変はリガンドに対する親和性や活性化能に影響する可能性があるため,野生型と比較したうえで結晶化に適した発現コンストラクトが選択された.
発現させたGPCRは細胞膜に埋め込まれているので,細胞を破砕して超遠心分離すると不溶性画分に存在する.この不溶性画分からGPCRを得るには界面活性剤によりGPCRを可溶化する必要があるが,その一方で,界面活性剤の使用はGPCRを変性させてしまう可能性がある.したがって,界面活性剤の種類や量の条件検討はGPCRの構造解析において重要である.構造の報告されているGPCRでは,可溶化にn-ドデシル-β-D-マルトシド(DDM)がもっとも多く使われており,30例あった.DDMは親水性の部分がマルトースとなっている非イオン性界面活性剤であり,GPCRにかぎらずほかの膜タンパク質の構造解析にもよく使われている.また,22例においては,精製の途中に界面活性剤を交換し,結晶化において別の界面活性剤を使用していた.さらに,新しい界面活性剤の導入も進められており,7例において,2本のマルトース基と2本の炭化水素鎖をもつマルトースネオペンチルグリコール(MNG)が用いられていた8).MNGはミセルの形成される臨界ミセル濃度がDDMより1桁小さく,このことがGPCRの安定化に寄与したのかもしれない.
GPCRはリガンドとの結合によりそのコンホメーションを変化させることで細胞内のGタンパク質の活性化をひき起こす.膨大な生化学的および薬理学的な研究から,GPCRのなかにはリガンドと結合していなくても一定の活性化能をもつものや,複数のリガンドとの結合能をもちリガンドごとに活性化能の異なるものが存在する.前者は,リガンドと結合していない状態において活性型と不活性型との動的平衡が存在すること,後者は,結合するリガンドによりコンホメーション変化の度合いが異なることを示唆しており,いずれも,GPCRのシグナル伝達機構に動的なコンホメーション変化の過程が内在されていることを示唆している.しかし,こうしたGPCRの動的な性質は結晶化するうえでは不都合となるため,GPCRの精製のときからリガンドをくわえ,均一なコンホメーションをもつ試料となるよう調製していることが多い.用いられているリガンドには,完全な活性化状態に誘導する完全アゴニスト,弱い活性化状態で固定する部分アゴニスト,不活性状態に固定するアンタゴニストもしくはインバースアゴニストがある.インバースアゴニストはリガンドと結合していない状態でも活性化能をもつβ2アドレナリン受容体の構造解析において用いられ,これを積極的に不活性状態に固定することにより構造解析を成功に導いた9,10).
試料の調製においては,ほかにもGPCRを安定に保つための修飾など,さまざまなくふうがなされており,それらの実験条件はほとんどの論文において本文ではなくオンラインにあるSupplementary Informationに細かく記述されている.これらSupplementary Informationは構造解析にいたった研究チームの粘り強い努力の結晶であり,ぜひ一読を勧めたい.
試料の調製におけるくふうにより均一なコンホメーションをとりうる試料を得ることが可能となったとしても,残念ながら,まだ構造解析に足る分解能をもつ結晶は得られない.なぜなら,GPCRには運動性の高い細胞内ループが存在するほか,ミセルにおおわれたGPCRは格子状には整列しにくいからである.
2007年,2種類のβ2アドレナリン受容体の立体構造が報告された.一方は,細胞内ループと特異的に相互作用する抗体(Fabフラグメント)を作製して共結晶化により得られた構造,もう一方は,細胞内ループの一部をファージに由来するT4リゾチームと置換して作製したキメラタンパク質の結晶化により得られた構造であった9,10).さまざまな生化学的な研究により,7本の膜貫通ヘリックスのうち,5番目(TM5)と6番目(TM6)をつなぐ3番目の細胞内ループ(ICL3)は非常に高い運動性をもつことが示唆されていた.この運動性を抑えるため,インバースアゴニストとの結合により不活性状態のコンホメーションをとるβ2アドレナリン受容体の試料をもとに,そのICL3を認識するモノクローナル抗体が作製された11).結果的には,抗体と結合させたβ2アドレナリン受容体のリガンドとの結合能は抗体を結合させなかったときとほとんど変わらなかったためICL3の運動性は抑えられていなかったが,結合させた抗体により親水性の領域の拡大したことが結晶化に寄与したものと思われた.一方,ICL3をT4リゾチームにより置換したキメラタンパク質の構造解析では,すでに構造の報告されていたロドプシンのTM5とTM6との距離と,T4リゾチームのN末端とC末端との距離に着目し,ICL3へのT4リゾチームの挿入箇所の異なる複数の発現コンストラクトが作製された.そして,リガンドとの結合アッセイをもとに結晶化に用いる試料を選別し,さらに,のちに述べる脂質キュービックフェーズ法を導入することにより結晶化に成功した12).
さらに2011年,β2アドレナリン受容体とT4リゾチームとのキメラタンパク質について,細胞内領域に結合するナノボディを用いた結晶構造が報告された13).ナノボディはラクダに由来する抗体であり,重鎖のみから構成され約15 kDaと比較的小さい.この抗体はその小ささだけでなく,単一ドメインからなるため大腸菌や酵母でも発現が可能であるというメリットもある14).このナノボディの結合は,アゴニストと結合した状態のβ2アドレナリン受容体の安定化に寄与し,その結晶化を成功に導いた.一方,T4リゾチームとのキメラタンパク質とする方法は,ICL3だけでなく,N末端に融合させた場合にも結晶化に成功した.また,キメラ化するタンパク質パートナーとして熱安定化アポシトクロムb562RILがくわわり15),2012年,これをN末端に融合させたN/QFQオピオイド受容体,および,ICL3に挿入したA2Aアデノシン受容体の構造解析が報告された.
GPCRの結晶化においては,さきに述べたように,脂質キュービックフェーズ法(脂質メソフェーズ法ともよばれる)がβ2アドレナリン受容体とT4リゾチームとのキメラタンパク質の構造解析においてはじめて用いられ,そののち,GPCRの構造解析の約半数において利用されている.この方法は,水溶液におけるモノオレイン(グリセロールに1分子のオレイン酸がエステル結合した脂質)の比率と温度の変化により起こる相転移を利用する.GPCRの試料とモノオレイン,コレステロールの混合物に沈殿剤をくわえると,相転移により層状の格子構造となる.このとき,脂質二重膜にそった水平方向ではくわえたコレステロールをあいだにはさんでGPCRが整列していく.一方,脂質二重膜と直行する垂直方向では,脂質二重膜の両側に突き出たGPCRの細胞外領域と細胞内領域にある親水性の部分とが相互作用して層を重ねていく.GPCRにT4リゾチームや抗体などが結合しているときには,その部分が足がかりとなって重層していくものと考えられている16).β2アドレナリン受容体の構造解析の結果から,TM2とTM4に保存されたコレステロール結合モチーフの存在が示唆された17).このように脂質キュービックフェーズ法によりGPCRが規則正しく整列することで,より高分解能の構造解析が達成できたのだろう.一方,シチメンチョウのβ1アドレナリン受容体の構造解析においては,N末端およびC末端の切除,さらに,変異の導入により活性をもつ安定なβ1アドレナリン受容体が調製され6),蒸気拡散法による結晶化に成功した.
クラスAのGPCRはロドプシンファミリーともいわれ,ロドプシンに対するアミノ酸配列の保存性が比較的高い.このことは,さきに述べたように,2007年に報告されたβ2アドレナリン受容体とT4リゾチームとのキメラタンパク質の構造は,T4リゾチームとロドプシンのデータをもとに分子置換法により決定されたことからも明らかであろう.
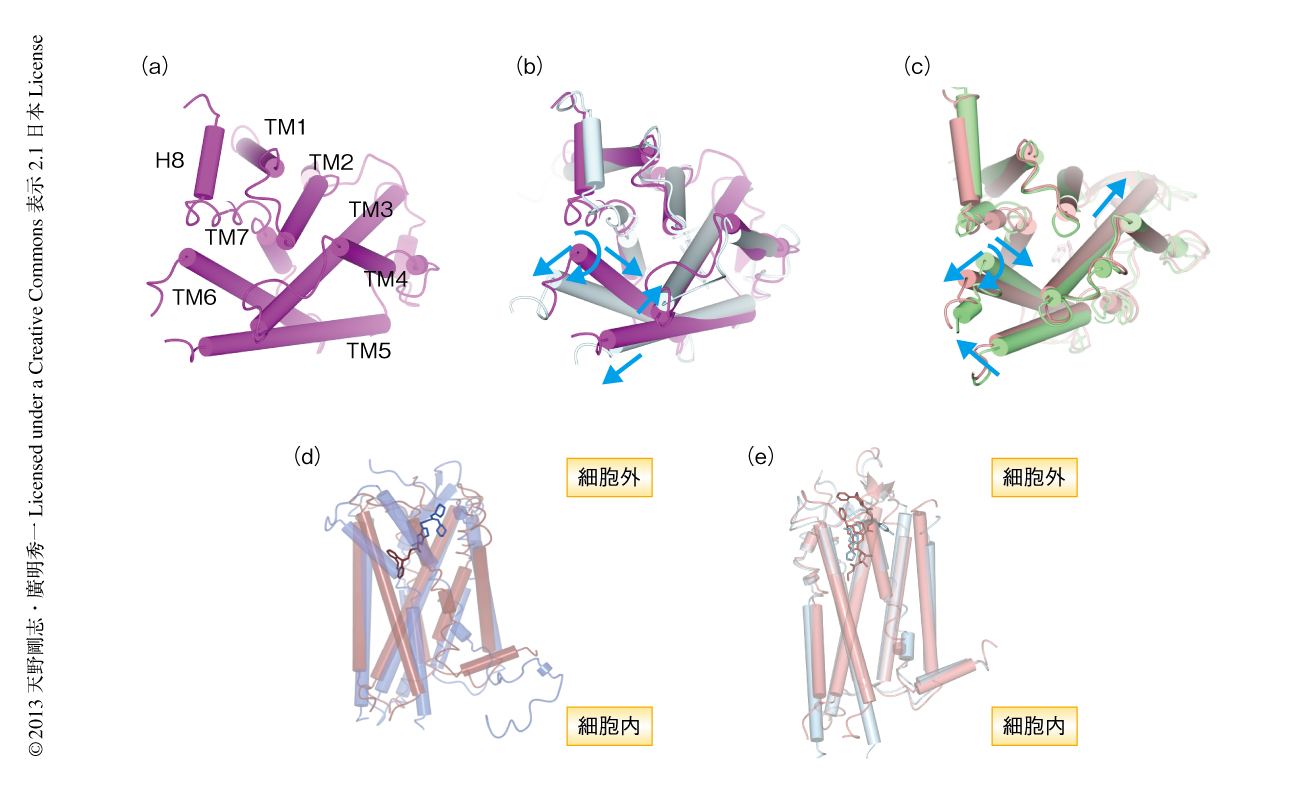
7本の膜貫通ヘリックス(TM1~TM7)の配置はどのGPCRでも同じであり,細胞内からGPCRの細胞質側をみたとき,膜貫通ヘリックスは時計回りに配置されている.しかし,膜貫通ヘリックスの相対的な位置や角度,長さについてはGPCRにより違いがある(図3a).たとえば,ウシのロドプシンの構造(PDB ID:1U39)を基準とすると,スフィンゴリン脂質をリガンドとするS1P1受容体(PDB ID:3V2W)はTM1とTM2がTM3へむかって近づいている.これら膜貫通ヘリックスの位置の違いからS1P1受容体のTM1とTM7とのあいだには隙間が生じ,スフィンゴリン脂質がその隙間を通過しS1P1受容体の内部のポケットにアクセスしている可能性が示された.
また,同じGPCRでも結合しているリガンドが変わると膜貫通ヘリックスの位置と角度も変化しており,この変化こそが細胞外からのシグナルを細胞内へ伝える分子機構の鍵である.これまでに,アゴニストの結合した活性型と,アンタゴニストもしくはインバースアゴニストの結合した不活性型の両方の構造が決定されているのは,β2アドレナリン受容体,β1アドレナリン受容体,A2Aアデノシン受容体である.活性型と不活性型のGPCRの違いを細胞内からみると,β2アドレナリン受容体では,TM5は中心から外側への移動,TM6は時計回りの回転と外側への移動,TM3とTM7は内側への移動が生じていた(図3b).一方,A2Aアデノシン受容体では,TM3は細胞外へむかっての移動,TM5はTM6へむかっての移動,TM6は時計回りの回転と外側への移動,TM7は内側への移動が生じていた(図3c).これらのコンホメーションの変化には結晶化の条件などによる影響の含まれている可能性があるが,アゴニストの結合による結合ポケットの周辺の小さな変化が膜貫通ヘリックスの移動や回転を誘起し,GPCRの細胞質側に大きな変化を生じさせている.
細胞外の領域はN末端領域と3つの細胞外ループ(ECL1~ECL3)から構成されているが,そのアミノ酸配列はGPCRのあいだであまり保存されておらず,長さも異なる.細胞外ループは単に膜貫通ヘリックスをつないでいるだけではなく,遊離のリガンドを迎え入れる入口となり,GPCRによってはリガンドとの結合に寄与している場合もある.β1アドレナリン受容体,β2アドレナリン受容体,S1P1スフィンゴリン脂質受容体においては,ECL2にαヘリックスが存在する.一方,CXCR4ケモカイン受容体,ニューロテンシン受容体,PAR1プロテアーゼ活性化受容体,δオピオイド受容体,κオピオイド受容体,μオピオイド受容体,ノシセプチン受容体においては,ECL2にβシートが形成されており,A2Aアデノシン受容体においては,ECL1とECL2とのあいだにβシートが形成されている.ECL2とTM3の細胞外側のあいだにはジスルフィド結合が形成されており,ECL2のゆらぎが抑えられている.このジスルフィド結合はクラスAのGPCRのあいだで保存されているが,S1P1スフィンゴリン脂質受容体においてはTM3の細胞外側にシステイン残基がないのでこれは存在しない.ロドプシンにおいて,細胞質側にあるC末端には8本目のαヘリックスが存在するが,これはほかのクラスAのGPCRにおいても存在することが多い.
リガンドの結合する位置はGPCRのあいだで少しずつ異なっている.膜貫通領域の深い位置で結合しているのは,ロドプシン(11-cis-レチナール),ムスカリンM2受容体(3-キヌクリジニルベンジレート),ムスカリンM3受容体(チオトロピウム),ヒスタミンH1受容体(ドキセピン)である.逆に,比較的浅い位置で結合しているのは,ドーパミンD3受容体(エチクロプリド),CXCR4ケモカイン受容体(It1t),S1P1スフィンゴリン脂質受容体(スフィンゴリン脂質模倣化合物),ニューロテンシン受容体である(図3d).また,同じGPCRでもリガンドにより結合する部位は異なっており,たとえばA2Aアデノシン受容体の場合,アゴニストのUK-432097は膜貫通領域の深い位置まで入り込んで結合していたが,インバースアゴニストのZM241385は浅い位置で結合していた(図3e).
実際の構造解析の例を参考にしながらGPCRによるリガンドの認識機構とシグナル伝達機構を解説する.とりあげるのは,これまで紹介していなかったGPCRの解析に成功したもうひとつの研究室であるGrisshammer研究室(米国NIH)による成果で,2012年に報告された,ニューロテンシン受容体とニューロテンシン(の部分ペプチド)との複合体の構造である17).ニューロテンシンはウシの視床下部で発見された13アミノ酸残基からなるペプチドホルモンであり,末梢血管の拡張と血圧の降下作用,腸管の収縮作用,鎮静作用などが知られる.これまでに多くのアゴニストあるいはアンタゴニストとGPCRとの複合体の構造が報告されているが,ペプチドホルモンと結合しているものとしては,この構造がはじめてであるので例として選んだ.結晶化には,ニューロテンシン受容体の3番目の細胞内ループをT4リゾチームにより置換したキメラタンパク質が用いられた.試料はバキュロウイルス-昆虫細胞発現系を用いて発現させたのち精製され,界面活性剤としてはMNGが使用された.最終的に,脂質キュービックフェーズ法により結晶化され,2.8Å分解能で解析された18).
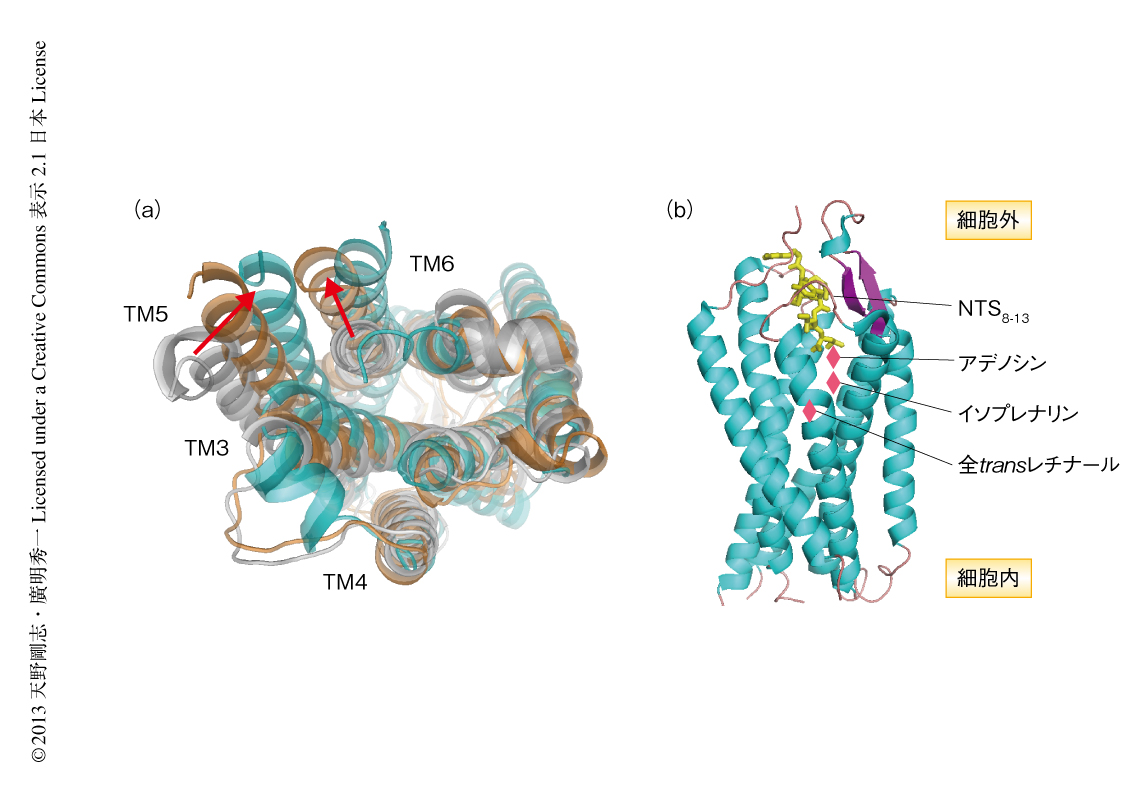
得られた立体構造の特徴をまとめると,以下の点に集約される.1)得られたニューロテンシン受容体の立体構造をロドプシン,および,β2アドレナリン受容体の活性型および不活性型の構造と比較すると,活性型のβ2アドレナリン受容体の構造に類似していた.2)得られた立体構造を細胞質側からみると,膜貫通へリックス(TM)の相対配置について,TM5がTM6のある方向に寄っており,同時に,TM6も隣接しているTM3から離れてTM5のほうに寄る配置となっていた(図4a).ニューロテンシン受容体におけるリガンド結合部位は,1番目を除く6本の膜貫通ヘリックスTM2~TM7の細胞外側の残基と,N末端ループおよび3本の細胞外ループECL1~ECL3により構成された深く広いポケットであり,とくにECL2およびECL3,TM6およびTM7に由来する残基と多くの相互作用がみられた.リガンドとニューロテンシン受容体のアミノ酸残基側鎖とのあいだのおもな相互作用は,水素結合および静電的相互作用であった.
この構造解析ではリガンドと結合していない状態のニューロテンシン受容体の立体構造は明らかにされていないため,リガンドとの結合の前後でどのような構造変化が起こるのか,その詳細は未知である.しかし,アゴニストとの結合により誘起されるコンホメーションの変化,すなわち,TM5やTM6が相対配置を変え,最終的にICL2およびICL3の立体構造の変化をひき起こす点は共通であった.しかし,リガンド結合部位の“深さ”の点では大きく異なっていた.ロドプシンにおける内在性リガンドである全transレチノールや,β1アドレナリン受容体のリガンドであるイソプレナリン,A2Aアデノシン受容体のリガンドであるアデノシンなどは,膜貫通ヘリックスのより膜の中心部に近い深部に結合することで構造変化を起こす.それに対し,ニューロテンシンの結合部位はそれらリガンドの結合部位よりも5Å近くも膜外(細胞の外側)に近い(浅い)ところであった(図4b).したがって,リガンドとの結合部位は異なるのに生じるコンホメーション変化は共通であることは,活性型のβ2アドレナリン受容体やA2Aアデノシン受容体の構造から示されているものとは異なる分子機構により,ニューロテンシン受容体は活性型のコンホメーションをとることを示唆した.
GPCRによるシグナルの受容が最終的にどのようにGタンパク質に伝達されるかについて簡単に紹介する.この分子機構の解明に大きく貢献したのは,2011年の,アゴニスト結合型のβ2アドレナリン受容体とヌクレオチド非結合型Gタンパク質との複合体の構造解析の報告である19)(図5a).さきに述べたように,アゴニストとの結合によりGPCRにひき起こされる立体構造の変化は,細胞の内側におけるTM6の時計回りの回転として現われる.その結果,TM5とTM6とのあいだに溝が形成され,このGPCRとGタンパク質との複合体においては,そこにGタンパク質のαサブユニットのもつα5ヘリックスが結合していた.しかし,TM6とα5へリックスとの位置関係はこれまでロドプシンとトランスジューシンに由来するペプチドとの複合体の構造から予測されていたものとは異なっていた.すなわち,GPCRとの相互作用により細胞質側においてαサブユニットのRas様ドメインのコンホメーションが変化し,つづいて,この変化にともないαサブユニットに劇的な構造変化が誘導されると予測された.GPCRとの複合体から取り出したGタンパク質の立体構造(図5b)を,GDP結合型Gタンパク質の立体構造(図2b)と比較するとわかるように,GPCRとの複合体からはαサブユニットのヘリカルドメインとよばれる領域が消えている(実際は,なくなったわけではなく,ドメインの位置関係が角度にして130度近い回転運動を起こし,この図の背面にまわりこんでいる).そしてその結果,これまでGDPがはさまれるようにして結合していた部位が,大きく溶媒に露出してGDPの解離が促されるような構造となっていた.そののち,低分子量Gタンパク質におけるシグナル伝達のスキームと同じく,GTPが結合することでαサブユニットの構造は活性型へと変化し,下流の分子へとシグナル伝達カスケードを開始するのであろう.
これまで解明されていなかった受容体の立体構造とシグナル伝達の分子機構が明らかにされることにより,生命科学の多くの分野(たとえば,分子生物学,タンパク質科学,創薬,バイオインフォマティクスにくわえ,ときには,神経科学や薬理学なども含まれる)に影響が生じ,それ以後の研究の潮流すら決定してしまうことがときおりある.LefkowitzとKobilka“以前”の薬理学の研究がまさにそれであった.同じリガンドが細胞や組織あるいはその投与量によりまったく逆の薬理活性を示し,さらに,同じ受容体を介して異なる生理現象をひき起こすという混沌とした状況は,ことGPCRに関するかぎり,薬理学という学問を複雑怪奇な暗記学問とし,多くの医学生および薬学生の不評を買ってきた.筆者らの推測ではあるが,そのおもな理由は,GPCRに作用する生体内リガンドや薬物のもたらす生理現象が複雑かつ予測不可能で,容易に理解あるいは説明しがたかったせいではなかろうか? しかし,ロドプシンの高分解能の結晶化により端緒が切られ20),そののち,急速に発展した構造決定法の確立と普及により,わずかな期間に多くのGPCRにおいて構造解明がなされ,明快な分子薬理学の時代の到来がつげられた.GPCRの構造解析がもたらした情報をもとに,今後は,アゴニスト,部分アゴニスト,アンタゴニスト,部分アンタゴニスト,インバースアゴニストなど,これまで以上に豊富な種類の薬物の開発が合理的かつ論理的に進められていくことになろう.非常に興味深いことは,GPCRのシグナル伝達機構そのものに内在される動的な構造特性の理解が,結果的にさまざまな手法を生み出す契機となり,構造決定の成功をもたらしたことである.溶液NMR法や小角散乱法と異なり,本来は静的な構造しかあたえないはずのX線結晶解析が導き出したGPCRの構造動態も,多くの研究者による技術の積み重ねの歴史があればこそ,よりリアルなものとしてせまってくるのではなかろうか.複数の立体構造のあいだの動的平衡やタンパク質の構造ゆらぎといった“動的構造”のもたらす生理的な現象の重要性は,GPCRのほかにも,低分子量Gタンパク質や核内受容体の関与するシグナル伝達において認知されはじめており,構造生物学分野における新たな鍵概念となりつつある.こうした新しい概念の確立が創薬の分野にパラダイムシフトをもたらす日も近いと考えられる.
略歴:2004年 愛媛大学大学院理工学研究科 修了,同年 横浜市立大学大学院総合理学研究科 研究員,2005年 京都大学大学院工学研究科 研究員,2007年 神戸大学大学院医学系研究科 特命助教,2011年 名古屋大学理学部 特任助教を経て,2012年より名古屋大学大学院創薬科学研究科 助教.
研究テーマ:構造生物学的なアプローチによる膜タンパク質のシグナル受容機構の解明,および,マルチドメインタンパク質のシグナル伝達機構の解明.
関心事:とくに,タンパク質の構造変化をともなうシグナル伝達機構およびシグナル受容機構に興味があります.調製の困難な組換えタンパク質の新規の調製法の開発にも励んでいます.
廣明 秀一(Hidekazu Hiroaki)
略歴:1992年 大阪大学院薬学研究科博士課程 修了,同年 日本ロシュ 研究所,1996年 生物分子工学研究所,2001年 横浜市立大学大学院総合理学研究科 助教授,2007年 神戸大学大学院医学系研究科 特命教授,2011年 名古屋大学理学部 教授を経て,2012年より名古屋大学大学院創薬科学研究科 教授.
研究テーマ:創薬を志向したタンパク質ドメインのNMR構造生物学.
関心事:マルチドメインタンパク質および天然変性タンパク質の構造動態と機能発現の機構に興味があります.研究オタクな大学院生を常時募集中.
研究室URL:http://presat-vector.org/hiroaki-lab/
© 2013 天野剛志・廣明秀一 Licensed under CC 表示 2.1 日本
(名古屋大学大学院創薬科学研究科 構造分子薬理学分野)
email:廣明秀一
領域融合レビュー, 2, e003 (2013) DOI: 10.7875/leading.author.2.e003
Takeshi Tenno & Hidekazu Hiroaki: A common mechanism of signal transduction of G-protein-coupled receptors revealed by their three-dimensional structures.
要 約
2012年のノーベル化学賞は,Gタンパク質共役受容体(GPCR)に関する研究について,米国Duke大学のLefkowitz教授と米国Stanford大学のKobilka教授に授与された.GPCRは細胞の外の刺激を内部に伝える刺激受容とシグナル伝達の鍵となるタンパク質であり,創薬の標的としてもきわめて重要である.しかし,細胞外のシグナルを立体構造の変化を介し細胞内に伝達するという機能的な必然性のため,膜貫通へリックスの配向ならびに細胞内ループの周辺において,複数の立体構造のあいだでの構造のゆらぎが存在しており,その構造解析は容易ではなかった.細胞内ループにT4リゾチームのような可溶性のタンパク質を融合することにより,高分解能でのβ2アドレナリン受容体の構造解析はなされたが,この構造解析にいたるまでに,さまざまな研究者により多くのGPCRに普遍的に応用の可能な方法論が確立された.たとえば,脂質キュービックフェーズ法,あるいは,熱安定性をもつ点変異体を徹底活用してGPCRのコア構造の平衡状態を不活性型または活性型のいずれかにかたよらせ固定するといった手法である.これらの方法は単なる構造生物学における技術開発にとどまらず,GPCRのシグナル伝達機構の本質の理解にせまるものであった.ここでは,GPCRによるシグナル伝達の分子機構について,GPCRの立体構造解析の技術開発の進展と関連づけて解説する.
はじめに
古来,毒と薬は表裏一体であった.あるいは,医薬品の発見と開発の歴史は,その初期において,毒物の発見とその利用の歴史であるといい換えても過言ではない.人類はその存続をかけて,これまでに多くの毒と出会い,その一部の有効利用に成功してきた.そうした歴史的な経緯のなかで実用化されてきた医薬品の多くは,人体のホメオスタシスや神経伝達を制御するGタンパク質共役受容体(G-protein coupled receptor:GPCR)を標的とするものである.2012年のノーベル化学賞は,米国Duke大学のRobert J. Lefkowitz教授と米国Stanford大学のBrian K. Kobilka教授の,GPCRの構造と機能に関する長年の研究成果に対し授与された.ところで,不思議な話ではあるが,GPCRは分子生物学あるいは細胞生物学の観点から注目度の高いタンパク質ではない.たとえば,生命科学系の大学院において広く使用されている教科書『Essential細胞生物学 第3版1)』においても,わずか十数ページが割かれているにすぎない.一方で,その薬理学的な重要性から,医学や生理学あるいは薬学の関係者からは,知る人ぞ知る重要な標的タンパク質と目されていた.また,構造生物学者からは構造解析の困難なタンパク質の代表格とされていた.今回のノーベル化学賞につながった業績は,その機能解析をつうじホメオスタシスや神経伝達などきわめて重要な生理現象に共通な機構の解明において,その端緒を開いたという点で非常に意義深い.
1.GPCRの分類
まず,アミノ酸一次配列にもとづいたGPCRの分類と,それぞれの基本的な生理機能について復習しておこう.GPCRはペプチドホルモンや低分子リガンド,あるいは,光などの細胞外のシグナルを受容し,それを細胞内に伝えるのが主たる機能である.GPCRの主要な3つのクラスについてあげた(図1).この分類は,オランダCMBI(Centre for Molecular and Biomolecular Informatics)の公開しているデータベースGPCRDB 2,3)(URL:http://www.GPCR.org/7tm/)を参考にしている.現時点で,ヒトのゲノムにはおよそ1400種のGPCRの遺伝子が存在しており,この数は全遺伝子のおよそ5%にも及ぶ.このうち,もっとも多いのは嗅覚受容体である.これらのGPCRは,全長のアミノ酸配列の相同性にもとづき5つのクラスに分類されている.
ここでおもにとりあげるクラスA(ロドプシンファミリーともよばれる)は,N末端ならびにC末端にあるループが短い,または,そこにほかの構造ドメインをもたないタイプである.カテコールアミンや脂溶性の低分子リガンド(多くの神経伝達物質を含む),ペプチドホルモン(エンドセリンなど)を受容してシグナル伝達を行う.最初期に構造解析されたロドプシンは,それらのリガンドの代わりに光受容分子であるレチナールが共有結合により結合している.クラスAには,視覚や嗅覚などの感覚,神経伝達,ホメオスタシスの維持など,きわめて重要な生理機能にかかわるGPCRが数多く含まれている.
ここでは割愛するが,創薬の標的として注目されているカテゴリーとして,クラスB(セクレチン受容体ファミリーともよばれる)と,クラスC(代謝型グルタミン酸受容体ファミリーともよばれる)がある.クラスBは,N末端に100~300アミノ酸残基とやや長い領域をもち,そこに約100アミノ酸残基のペプチドホルモン結合ドメイン(または,単に細胞外ドメインとよばれる)が存在し,セクレチンなどジスルフィド結合を含まないペプチドホルモンの刺激伝達を行う.クラスCは,N末端に約300アミノ酸残基とさらに長い領域をもち,そこにアミノ酸などに対するリガンド結合ドメインが存在する.クラスCの代表例は神経伝達に欠かせないグルタミン酸受容体である.おもしろいことに,クラスCのもつリガンド結合ドメインは真正細菌においても遺伝的に保存されており,ペリプラズムにおいてアミノ酸選択輸送などに機能するタンパク質のもつドメインと立体構造がきわめて類似している.
このほかに,Wntシグナル伝達系においてシグナルを受容する7回膜貫通型受容体Frizzledや,酵母のもつ接合因子受容体などを,それぞれ,さきに述べたものとは別のGPCRのファミリーとして分類することもあるが,現行のデータベースGPCRDBには収載されていない.
2.GPCRによるシグナル伝達のしくみ
GPCRにリガンドが結合するとGPCRの膜貫通へリックスの立体構造に変化が起こり,その変化が細胞内ループに伝わって,結果的に,細胞内ループに結合したヘテロ三量体型GTP結合タンパク質に伝達される4).このヘテロ三量体型GTP結合タンパク質(以下,単にGタンパク質とよぶ)は,その名のとおり,α,β,γの3つのサブユニットからなるタンパク質であり,このうちGTPと結合するのはαサブユニットである.Gタンパク質には複数の種類があり,その種類により細胞内に伝わるシグナルは大きく異なる.たとえば哺乳類において,αサブユニット,βサブユニット,γサブユニットの分子種は,それぞれ,約20種類,約6種類,約12種類が存在している.GPCRが同じでもそれに共役するGタンパク質の種類が異なれば生理的に活性化と抑制の正反対の反応をひき起こすこともあり,そのことがGPCRに関係する生理現象の複雑さの原因のひとつとなっている.Gタンパク質においても,細胞増殖におけるシグナル伝達などで知られる低分子量Gタンパク質などと同様に,GDP結合型が不活性型,GTP結合型が活性型である.リガンドがGPCRに結合することによりシグナルはGタンパク質のαサブユニットに伝達される.すると,これまで不活性型であったGタンパク質のGDPがGTPに交換され,αサブユニットとβγサブユニットの2つに解離する.αサブユニットとβγサブユニットはそれぞれGPCRから解離し,別個のエフェクター分子に作用してシグナルを伝達していく(図2).
GPCRの種類ならびにそれが発現している細胞により,GPCRと共役しているGタンパク質の種類も異なっている.それらはαサブユニットの配列により,Gs,Gi/o,Gq,G12/13の4つのタイプに大別される.Gsのsは活性化(stimulation)の頭文字を意味し,膜酵素であるアデニル酸シクラーゼを活性化することにより後続するシグナル伝達カスケードの初発を行う.また,ホスホリパーゼA2あるいはホスホリパーゼCなどを活性化して細胞内にシグナルを伝達する.活性化されたアデニル酸シクラーゼにより生成されたcAMPは,プロテインキナーゼAを活性化して広範な細胞刺激をつかさどるセカンドメッセンジャーである.一方,Gi/oのi/oは阻害(inhibitory)/その他(other)の頭文字を意味し,しばしばアデニル酸シクラーゼの活性を阻害するため,さきのGsに由来するシグナルの抑制を担う.そのほか,βγサブユニットを介してホスファチジルイノシトール特異的ホスホリパーゼCβやホスホジエステラーゼを活性化するなど,広範なシグナル伝達系に関与している.これら2つの主要なタイプのほか,ホスホリパーゼCβを活性化するGq,低分子量Gタンパク質であるRasやRhoを介したシグナル伝達系とクロストークするG12/13がある.
3.GPCRに特徴的な薬理作用
GPCRにはホルモン受容体や神経伝達物質受容体などが多く含まれる.そのため,通常の酵素阻害剤やチャネルブロッカーとは異なり,GPCRに作用する薬物は薬理学的につぎの2種類に大別される.すなわち,アゴニスト(作動薬)とアンタゴニスト(拮抗薬)である.アゴニストはその受容体の生理的なリガンドと同様の生理作用をひき起こす薬物であり,アンタゴニストは生理的なリガンドの作用に拮抗してこれを阻害する薬物である.通常,薬物の作用強度は薬物と標的となる受容体との解離定数(Kd)により一意的に定められるべきものであるが,GPCRのアゴニストには大過剰を投与しても本来の生理的なリガンドが起こしうる生理反応の部分的な活性化しか示さないものがある.そこで,解離定数とは別に,飽和したときに100%の生理活性をひき起こしうるものを完全アゴニスト,部分活性化しかなしとげないものを部分アゴニストとよんで区別している.また,少なくない数のGPCRはリガンドの結合していない状態でもある程度のシグナル伝達を行っている.これは,いわば,自動車のエンジンのアイドリング回転に相当する活性で,基礎活性(または,基底状態活性)とよぶ.通常のアンタゴニストは受容体によるシグナル伝達の活性化は阻害するものの,この基礎活性には影響をあたえない.一方,インバースアゴニスト(逆作動薬)とよばれる薬物は,この基礎活性をさらに抑制する薬物である.GPCRの関与する系ではこれら複雑な現象が古くから知られており,その分子機構の解明が待たれていた.
4.GPCRの結晶化のくふう:受容体とリガンド
Kobilka研究室の業績にくわえ,これまでGPCRの高分解能での立体構造解析に成功し技術確立に貢献した,Stevens研究室(米国Scripps Research Institute),Tate研究室(英国MRC Laboratory of Molecular Biology),および,わが国の岩田 想研究室(京都大学大学院医学研究科)による成果について紹介する.なお,GPCRの結晶化法の進展について,執筆時に収集した54個のPDBエントリーにある結晶化の条件などをまとめたものをSupplementary Tableとして添付する(表1).これが読者の一助になればと願っている.
表1 GPCR結晶化法の進展
2013年1月10日 現在
[Download]
GPCRは重要な創薬ターゲットであったこともあり,その構造決定にむけて多くの努力がなされてきた.構造決定においてたちはだかった壁は,1)組換え体のGPCRが大量に得られないこと,2)結晶が得られない,たとえ得られたとしても,分解能の悪いこと,であった.これらの壁はタンパク質の結晶化においてつねにたちはだかるものであるが,GPCRにおいてはとくに高い壁であった.
組換えGPCRを得る手法として,大腸菌から真核細胞まで,さまざまな方法が検討されてきた.筆者らが調べたかぎり,これまでに立体構造が報告されたGPCRのほとんどは昆虫細胞から調製されており,ほかには,メタノール資化性酵母(Pichia pastris)が3例,大腸菌(固体NMRによる解析が行われた)が1例であった.そして,結晶化に適した試料を得るため,膜貫通へリックスへの変異の導入による安定化5,6),N末端やC末端,あるいは,細胞内ループなどの切除7),糖鎖により修飾されるアスパラギン残基からほかの残基への変異,などが行われた.これらの改変はリガンドに対する親和性や活性化能に影響する可能性があるため,野生型と比較したうえで結晶化に適した発現コンストラクトが選択された.
発現させたGPCRは細胞膜に埋め込まれているので,細胞を破砕して超遠心分離すると不溶性画分に存在する.この不溶性画分からGPCRを得るには界面活性剤によりGPCRを可溶化する必要があるが,その一方で,界面活性剤の使用はGPCRを変性させてしまう可能性がある.したがって,界面活性剤の種類や量の条件検討はGPCRの構造解析において重要である.構造の報告されているGPCRでは,可溶化にn-ドデシル-β-D-マルトシド(DDM)がもっとも多く使われており,30例あった.DDMは親水性の部分がマルトースとなっている非イオン性界面活性剤であり,GPCRにかぎらずほかの膜タンパク質の構造解析にもよく使われている.また,22例においては,精製の途中に界面活性剤を交換し,結晶化において別の界面活性剤を使用していた.さらに,新しい界面活性剤の導入も進められており,7例において,2本のマルトース基と2本の炭化水素鎖をもつマルトースネオペンチルグリコール(MNG)が用いられていた8).MNGはミセルの形成される臨界ミセル濃度がDDMより1桁小さく,このことがGPCRの安定化に寄与したのかもしれない.
GPCRはリガンドとの結合によりそのコンホメーションを変化させることで細胞内のGタンパク質の活性化をひき起こす.膨大な生化学的および薬理学的な研究から,GPCRのなかにはリガンドと結合していなくても一定の活性化能をもつものや,複数のリガンドとの結合能をもちリガンドごとに活性化能の異なるものが存在する.前者は,リガンドと結合していない状態において活性型と不活性型との動的平衡が存在すること,後者は,結合するリガンドによりコンホメーション変化の度合いが異なることを示唆しており,いずれも,GPCRのシグナル伝達機構に動的なコンホメーション変化の過程が内在されていることを示唆している.しかし,こうしたGPCRの動的な性質は結晶化するうえでは不都合となるため,GPCRの精製のときからリガンドをくわえ,均一なコンホメーションをもつ試料となるよう調製していることが多い.用いられているリガンドには,完全な活性化状態に誘導する完全アゴニスト,弱い活性化状態で固定する部分アゴニスト,不活性状態に固定するアンタゴニストもしくはインバースアゴニストがある.インバースアゴニストはリガンドと結合していない状態でも活性化能をもつβ2アドレナリン受容体の構造解析において用いられ,これを積極的に不活性状態に固定することにより構造解析を成功に導いた9,10).
試料の調製においては,ほかにもGPCRを安定に保つための修飾など,さまざまなくふうがなされており,それらの実験条件はほとんどの論文において本文ではなくオンラインにあるSupplementary Informationに細かく記述されている.これらSupplementary Informationは構造解析にいたった研究チームの粘り強い努力の結晶であり,ぜひ一読を勧めたい.
5.GPCRの結晶化のくふう:結晶の作製
試料の調製におけるくふうにより均一なコンホメーションをとりうる試料を得ることが可能となったとしても,残念ながら,まだ構造解析に足る分解能をもつ結晶は得られない.なぜなら,GPCRには運動性の高い細胞内ループが存在するほか,ミセルにおおわれたGPCRは格子状には整列しにくいからである.
2007年,2種類のβ2アドレナリン受容体の立体構造が報告された.一方は,細胞内ループと特異的に相互作用する抗体(Fabフラグメント)を作製して共結晶化により得られた構造,もう一方は,細胞内ループの一部をファージに由来するT4リゾチームと置換して作製したキメラタンパク質の結晶化により得られた構造であった9,10).さまざまな生化学的な研究により,7本の膜貫通ヘリックスのうち,5番目(TM5)と6番目(TM6)をつなぐ3番目の細胞内ループ(ICL3)は非常に高い運動性をもつことが示唆されていた.この運動性を抑えるため,インバースアゴニストとの結合により不活性状態のコンホメーションをとるβ2アドレナリン受容体の試料をもとに,そのICL3を認識するモノクローナル抗体が作製された11).結果的には,抗体と結合させたβ2アドレナリン受容体のリガンドとの結合能は抗体を結合させなかったときとほとんど変わらなかったためICL3の運動性は抑えられていなかったが,結合させた抗体により親水性の領域の拡大したことが結晶化に寄与したものと思われた.一方,ICL3をT4リゾチームにより置換したキメラタンパク質の構造解析では,すでに構造の報告されていたロドプシンのTM5とTM6との距離と,T4リゾチームのN末端とC末端との距離に着目し,ICL3へのT4リゾチームの挿入箇所の異なる複数の発現コンストラクトが作製された.そして,リガンドとの結合アッセイをもとに結晶化に用いる試料を選別し,さらに,のちに述べる脂質キュービックフェーズ法を導入することにより結晶化に成功した12).
さらに2011年,β2アドレナリン受容体とT4リゾチームとのキメラタンパク質について,細胞内領域に結合するナノボディを用いた結晶構造が報告された13).ナノボディはラクダに由来する抗体であり,重鎖のみから構成され約15 kDaと比較的小さい.この抗体はその小ささだけでなく,単一ドメインからなるため大腸菌や酵母でも発現が可能であるというメリットもある14).このナノボディの結合は,アゴニストと結合した状態のβ2アドレナリン受容体の安定化に寄与し,その結晶化を成功に導いた.一方,T4リゾチームとのキメラタンパク質とする方法は,ICL3だけでなく,N末端に融合させた場合にも結晶化に成功した.また,キメラ化するタンパク質パートナーとして熱安定化アポシトクロムb562RILがくわわり15),2012年,これをN末端に融合させたN/QFQオピオイド受容体,および,ICL3に挿入したA2Aアデノシン受容体の構造解析が報告された.
GPCRの結晶化においては,さきに述べたように,脂質キュービックフェーズ法(脂質メソフェーズ法ともよばれる)がβ2アドレナリン受容体とT4リゾチームとのキメラタンパク質の構造解析においてはじめて用いられ,そののち,GPCRの構造解析の約半数において利用されている.この方法は,水溶液におけるモノオレイン(グリセロールに1分子のオレイン酸がエステル結合した脂質)の比率と温度の変化により起こる相転移を利用する.GPCRの試料とモノオレイン,コレステロールの混合物に沈殿剤をくわえると,相転移により層状の格子構造となる.このとき,脂質二重膜にそった水平方向ではくわえたコレステロールをあいだにはさんでGPCRが整列していく.一方,脂質二重膜と直行する垂直方向では,脂質二重膜の両側に突き出たGPCRの細胞外領域と細胞内領域にある親水性の部分とが相互作用して層を重ねていく.GPCRにT4リゾチームや抗体などが結合しているときには,その部分が足がかりとなって重層していくものと考えられている16).β2アドレナリン受容体の構造解析の結果から,TM2とTM4に保存されたコレステロール結合モチーフの存在が示唆された17).このように脂質キュービックフェーズ法によりGPCRが規則正しく整列することで,より高分解能の構造解析が達成できたのだろう.一方,シチメンチョウのβ1アドレナリン受容体の構造解析においては,N末端およびC末端の切除,さらに,変異の導入により活性をもつ安定なβ1アドレナリン受容体が調製され6),蒸気拡散法による結晶化に成功した.
6.クラスAのGPCRの比較
クラスAのGPCRはロドプシンファミリーともいわれ,ロドプシンに対するアミノ酸配列の保存性が比較的高い.このことは,さきに述べたように,2007年に報告されたβ2アドレナリン受容体とT4リゾチームとのキメラタンパク質の構造は,T4リゾチームとロドプシンのデータをもとに分子置換法により決定されたことからも明らかであろう.
7本の膜貫通ヘリックス(TM1~TM7)の配置はどのGPCRでも同じであり,細胞内からGPCRの細胞質側をみたとき,膜貫通ヘリックスは時計回りに配置されている.しかし,膜貫通ヘリックスの相対的な位置や角度,長さについてはGPCRにより違いがある(図3a).たとえば,ウシのロドプシンの構造(PDB ID:1U39)を基準とすると,スフィンゴリン脂質をリガンドとするS1P1受容体(PDB ID:3V2W)はTM1とTM2がTM3へむかって近づいている.これら膜貫通ヘリックスの位置の違いからS1P1受容体のTM1とTM7とのあいだには隙間が生じ,スフィンゴリン脂質がその隙間を通過しS1P1受容体の内部のポケットにアクセスしている可能性が示された.
また,同じGPCRでも結合しているリガンドが変わると膜貫通ヘリックスの位置と角度も変化しており,この変化こそが細胞外からのシグナルを細胞内へ伝える分子機構の鍵である.これまでに,アゴニストの結合した活性型と,アンタゴニストもしくはインバースアゴニストの結合した不活性型の両方の構造が決定されているのは,β2アドレナリン受容体,β1アドレナリン受容体,A2Aアデノシン受容体である.活性型と不活性型のGPCRの違いを細胞内からみると,β2アドレナリン受容体では,TM5は中心から外側への移動,TM6は時計回りの回転と外側への移動,TM3とTM7は内側への移動が生じていた(図3b).一方,A2Aアデノシン受容体では,TM3は細胞外へむかっての移動,TM5はTM6へむかっての移動,TM6は時計回りの回転と外側への移動,TM7は内側への移動が生じていた(図3c).これらのコンホメーションの変化には結晶化の条件などによる影響の含まれている可能性があるが,アゴニストの結合による結合ポケットの周辺の小さな変化が膜貫通ヘリックスの移動や回転を誘起し,GPCRの細胞質側に大きな変化を生じさせている.
細胞外の領域はN末端領域と3つの細胞外ループ(ECL1~ECL3)から構成されているが,そのアミノ酸配列はGPCRのあいだであまり保存されておらず,長さも異なる.細胞外ループは単に膜貫通ヘリックスをつないでいるだけではなく,遊離のリガンドを迎え入れる入口となり,GPCRによってはリガンドとの結合に寄与している場合もある.β1アドレナリン受容体,β2アドレナリン受容体,S1P1スフィンゴリン脂質受容体においては,ECL2にαヘリックスが存在する.一方,CXCR4ケモカイン受容体,ニューロテンシン受容体,PAR1プロテアーゼ活性化受容体,δオピオイド受容体,κオピオイド受容体,μオピオイド受容体,ノシセプチン受容体においては,ECL2にβシートが形成されており,A2Aアデノシン受容体においては,ECL1とECL2とのあいだにβシートが形成されている.ECL2とTM3の細胞外側のあいだにはジスルフィド結合が形成されており,ECL2のゆらぎが抑えられている.このジスルフィド結合はクラスAのGPCRのあいだで保存されているが,S1P1スフィンゴリン脂質受容体においてはTM3の細胞外側にシステイン残基がないのでこれは存在しない.ロドプシンにおいて,細胞質側にあるC末端には8本目のαヘリックスが存在するが,これはほかのクラスAのGPCRにおいても存在することが多い.
リガンドの結合する位置はGPCRのあいだで少しずつ異なっている.膜貫通領域の深い位置で結合しているのは,ロドプシン(11-cis-レチナール),ムスカリンM2受容体(3-キヌクリジニルベンジレート),ムスカリンM3受容体(チオトロピウム),ヒスタミンH1受容体(ドキセピン)である.逆に,比較的浅い位置で結合しているのは,ドーパミンD3受容体(エチクロプリド),CXCR4ケモカイン受容体(It1t),S1P1スフィンゴリン脂質受容体(スフィンゴリン脂質模倣化合物),ニューロテンシン受容体である(図3d).また,同じGPCRでもリガンドにより結合する部位は異なっており,たとえばA2Aアデノシン受容体の場合,アゴニストのUK-432097は膜貫通領域の深い位置まで入り込んで結合していたが,インバースアゴニストのZM241385は浅い位置で結合していた(図3e).
7.GPCRによるリガンドの認識機構:ニューロテンシン受容体を例として
実際の構造解析の例を参考にしながらGPCRによるリガンドの認識機構とシグナル伝達機構を解説する.とりあげるのは,これまで紹介していなかったGPCRの解析に成功したもうひとつの研究室であるGrisshammer研究室(米国NIH)による成果で,2012年に報告された,ニューロテンシン受容体とニューロテンシン(の部分ペプチド)との複合体の構造である17).ニューロテンシンはウシの視床下部で発見された13アミノ酸残基からなるペプチドホルモンであり,末梢血管の拡張と血圧の降下作用,腸管の収縮作用,鎮静作用などが知られる.これまでに多くのアゴニストあるいはアンタゴニストとGPCRとの複合体の構造が報告されているが,ペプチドホルモンと結合しているものとしては,この構造がはじめてであるので例として選んだ.結晶化には,ニューロテンシン受容体の3番目の細胞内ループをT4リゾチームにより置換したキメラタンパク質が用いられた.試料はバキュロウイルス-昆虫細胞発現系を用いて発現させたのち精製され,界面活性剤としてはMNGが使用された.最終的に,脂質キュービックフェーズ法により結晶化され,2.8Å分解能で解析された18).
得られた立体構造の特徴をまとめると,以下の点に集約される.1)得られたニューロテンシン受容体の立体構造をロドプシン,および,β2アドレナリン受容体の活性型および不活性型の構造と比較すると,活性型のβ2アドレナリン受容体の構造に類似していた.2)得られた立体構造を細胞質側からみると,膜貫通へリックス(TM)の相対配置について,TM5がTM6のある方向に寄っており,同時に,TM6も隣接しているTM3から離れてTM5のほうに寄る配置となっていた(図4a).ニューロテンシン受容体におけるリガンド結合部位は,1番目を除く6本の膜貫通ヘリックスTM2~TM7の細胞外側の残基と,N末端ループおよび3本の細胞外ループECL1~ECL3により構成された深く広いポケットであり,とくにECL2およびECL3,TM6およびTM7に由来する残基と多くの相互作用がみられた.リガンドとニューロテンシン受容体のアミノ酸残基側鎖とのあいだのおもな相互作用は,水素結合および静電的相互作用であった.
この構造解析ではリガンドと結合していない状態のニューロテンシン受容体の立体構造は明らかにされていないため,リガンドとの結合の前後でどのような構造変化が起こるのか,その詳細は未知である.しかし,アゴニストとの結合により誘起されるコンホメーションの変化,すなわち,TM5やTM6が相対配置を変え,最終的にICL2およびICL3の立体構造の変化をひき起こす点は共通であった.しかし,リガンド結合部位の“深さ”の点では大きく異なっていた.ロドプシンにおける内在性リガンドである全transレチノールや,β1アドレナリン受容体のリガンドであるイソプレナリン,A2Aアデノシン受容体のリガンドであるアデノシンなどは,膜貫通ヘリックスのより膜の中心部に近い深部に結合することで構造変化を起こす.それに対し,ニューロテンシンの結合部位はそれらリガンドの結合部位よりも5Å近くも膜外(細胞の外側)に近い(浅い)ところであった(図4b).したがって,リガンドとの結合部位は異なるのに生じるコンホメーション変化は共通であることは,活性型のβ2アドレナリン受容体やA2Aアデノシン受容体の構造から示されているものとは異なる分子機構により,ニューロテンシン受容体は活性型のコンホメーションをとることを示唆した.
8.GPCRによるシグナル伝達機構:Gタンパク質におよぼされる構造変化
GPCRによるシグナルの受容が最終的にどのようにGタンパク質に伝達されるかについて簡単に紹介する.この分子機構の解明に大きく貢献したのは,2011年の,アゴニスト結合型のβ2アドレナリン受容体とヌクレオチド非結合型Gタンパク質との複合体の構造解析の報告である19)(図5a).さきに述べたように,アゴニストとの結合によりGPCRにひき起こされる立体構造の変化は,細胞の内側におけるTM6の時計回りの回転として現われる.その結果,TM5とTM6とのあいだに溝が形成され,このGPCRとGタンパク質との複合体においては,そこにGタンパク質のαサブユニットのもつα5ヘリックスが結合していた.しかし,TM6とα5へリックスとの位置関係はこれまでロドプシンとトランスジューシンに由来するペプチドとの複合体の構造から予測されていたものとは異なっていた.すなわち,GPCRとの相互作用により細胞質側においてαサブユニットのRas様ドメインのコンホメーションが変化し,つづいて,この変化にともないαサブユニットに劇的な構造変化が誘導されると予測された.GPCRとの複合体から取り出したGタンパク質の立体構造(図5b)を,GDP結合型Gタンパク質の立体構造(図2b)と比較するとわかるように,GPCRとの複合体からはαサブユニットのヘリカルドメインとよばれる領域が消えている(実際は,なくなったわけではなく,ドメインの位置関係が角度にして130度近い回転運動を起こし,この図の背面にまわりこんでいる).そしてその結果,これまでGDPがはさまれるようにして結合していた部位が,大きく溶媒に露出してGDPの解離が促されるような構造となっていた.そののち,低分子量Gタンパク質におけるシグナル伝達のスキームと同じく,GTPが結合することでαサブユニットの構造は活性型へと変化し,下流の分子へとシグナル伝達カスケードを開始するのであろう.
おわりに
これまで解明されていなかった受容体の立体構造とシグナル伝達の分子機構が明らかにされることにより,生命科学の多くの分野(たとえば,分子生物学,タンパク質科学,創薬,バイオインフォマティクスにくわえ,ときには,神経科学や薬理学なども含まれる)に影響が生じ,それ以後の研究の潮流すら決定してしまうことがときおりある.LefkowitzとKobilka“以前”の薬理学の研究がまさにそれであった.同じリガンドが細胞や組織あるいはその投与量によりまったく逆の薬理活性を示し,さらに,同じ受容体を介して異なる生理現象をひき起こすという混沌とした状況は,ことGPCRに関するかぎり,薬理学という学問を複雑怪奇な暗記学問とし,多くの医学生および薬学生の不評を買ってきた.筆者らの推測ではあるが,そのおもな理由は,GPCRに作用する生体内リガンドや薬物のもたらす生理現象が複雑かつ予測不可能で,容易に理解あるいは説明しがたかったせいではなかろうか? しかし,ロドプシンの高分解能の結晶化により端緒が切られ20),そののち,急速に発展した構造決定法の確立と普及により,わずかな期間に多くのGPCRにおいて構造解明がなされ,明快な分子薬理学の時代の到来がつげられた.GPCRの構造解析がもたらした情報をもとに,今後は,アゴニスト,部分アゴニスト,アンタゴニスト,部分アンタゴニスト,インバースアゴニストなど,これまで以上に豊富な種類の薬物の開発が合理的かつ論理的に進められていくことになろう.非常に興味深いことは,GPCRのシグナル伝達機構そのものに内在される動的な構造特性の理解が,結果的にさまざまな手法を生み出す契機となり,構造決定の成功をもたらしたことである.溶液NMR法や小角散乱法と異なり,本来は静的な構造しかあたえないはずのX線結晶解析が導き出したGPCRの構造動態も,多くの研究者による技術の積み重ねの歴史があればこそ,よりリアルなものとしてせまってくるのではなかろうか.複数の立体構造のあいだの動的平衡やタンパク質の構造ゆらぎといった“動的構造”のもたらす生理的な現象の重要性は,GPCRのほかにも,低分子量Gタンパク質や核内受容体の関与するシグナル伝達において認知されはじめており,構造生物学分野における新たな鍵概念となりつつある.こうした新しい概念の確立が創薬の分野にパラダイムシフトをもたらす日も近いと考えられる.
文 献
- Alberts, B. 他著, 中村桂子, 松原謙一 監訳: Essential細胞生物学 原書第3版. 南江堂 (2011)
- Horn, F., Weare, J., Beukers, M. W. et al.: GPCRDB: an information system for G protein-coupled receptors. Nucleic Acids Res., 26, 275-259 (1998)[PubMed]
- Vroling, B., Sanders, M., Baakman, C. et al.: GPCRDB: information system for G protein-coupled receptors. Nucleic Acids Res., 39, D309-D319 (2011)[PubMed]
- Nishimura, A., Kitano, K., Takasaki, J. T. et al.: Structural basis for the specific inhibition of heterotrimeric Gq protein by a small molecule. Proc. Natl. Acad. Sci. USA, 107, 13666-13671 (2010)[PubMed]
- Robertson, N., Jazayeri, A., Errey, J. et al.: The properties of thermostabilised G protein-coupled receptors (StaRs) and their use in drug discovery. Neuropharmacology, 60, 26-44 (2011)[PubMed]
- Serrano-Vega, M. J., Magnani, F., Shibata, Y. et al.: Conformational thermostabilization of the β1-adrenergic receptor in a detergent-resistant form. Proc. Natl. Acad. Sci. USA, 105, 877-882 (2008)[PubMed]
- Kobilka, B. K.: Amino and carboxyl terminal modifications to facilitate the production and purification of a G protein-coupled receptor. Anal. Biochem., 231, 269-271 (1995)[PubMed]
- Chae, P. S., Rasmussen, S. G. F., Rana, R. R. et al.: Maltose-neopentyl glycol (MNG) amphiphiles for solubilization, stabilization and crystallization of membrane proteins. Nat. Methods, 7, 1003-1008 (2010)[PubMed]
- Rasmussen, S. G. F., Choi, H. -J., Rosenbaum, D. M. et al.: Crystal structure of the human β2 adrenergic G-protein-coupled receptor. Nature, 450, 383-387 (2007)[PubMed]
- Cherezov, V., Rosenbaum, D. M., Hanson, M. A. et al.: High-resolution crystal structure of an engineered human β2-adrenergic G protein-coupled receptor. Science, 318, 1258-1265 (2007)[PubMed]
- Day, P. W., Rasmussen, S. G. F., Parnot, C. et al.: A monoclonal antibody for G protein-coupled receptor crystallography. Nat Methods, 4, 927-929 (2007)[PubMed]
- Rosenbaum, D. M., Cherezov, V., Hanson, M. A. et al.: GPCR engineering yields high-resolution structural insights into β2-adrenergic receptor function. Science, 318, 1266-1273 (2007)[PubMed]
- Rasmussen, S. G. F., Choi, H. -J., Fung, J. J. et al.: Structure of a nanobody-stabilized active state of the β2-adrenoceptor. Nature, 469, 175-180 (2011)[PubMed]
- Steyaert, J. & Kobilka, B. K.: Nanobody stabilization of G protein-coupled receptor conformational states. Curr. Opin. Struct. Biol., 21, 567-572 (2011)[PubMed]
- Chun, E., Thompson, A. A., Liu, W. et al.: Fusion partner toolchest for the stabilization and crystallization of G protein-coupled receptors. Structure, 20, 967-976 (2012)[PubMed]
- Caffrey, M.: Crystallizing membrane proteins for structure determination: use of lipidic mesophases. Annu. Rev. Biophys., 38, 29-51 (2009)[PubMed]
- Hanson, M. A., Cherezov, V., Griffith, M. T. et al.: A specific cholesterol binding site is established by the 2.8Å structure of the human β2-adrenergic receptor. Structure, 16, 897-905 (2008)[PubMed]
- White, J. F., Noinaj, N., Shibata, Y. et al.: Structure of the agonist-bound neurotensin receptor. Nature, 490, 508-513 (2012)[PubMed]
- Rasmussen, S. G., DeVree, B. T., Zou, Y. et al.: Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature, 477, 549-555 (2011)[PubMed]
- Palczewski, K., Kumasaka, T., Hori, T. et al.: Crystal structure of rhodopsin: A G protein-coupled receptor. Science, 289, 739-745 (2000)[PubMed]
著者プロフィール
略歴:2004年 愛媛大学大学院理工学研究科 修了,同年 横浜市立大学大学院総合理学研究科 研究員,2005年 京都大学大学院工学研究科 研究員,2007年 神戸大学大学院医学系研究科 特命助教,2011年 名古屋大学理学部 特任助教を経て,2012年より名古屋大学大学院創薬科学研究科 助教.
研究テーマ:構造生物学的なアプローチによる膜タンパク質のシグナル受容機構の解明,および,マルチドメインタンパク質のシグナル伝達機構の解明.
関心事:とくに,タンパク質の構造変化をともなうシグナル伝達機構およびシグナル受容機構に興味があります.調製の困難な組換えタンパク質の新規の調製法の開発にも励んでいます.
廣明 秀一(Hidekazu Hiroaki)
略歴:1992年 大阪大学院薬学研究科博士課程 修了,同年 日本ロシュ 研究所,1996年 生物分子工学研究所,2001年 横浜市立大学大学院総合理学研究科 助教授,2007年 神戸大学大学院医学系研究科 特命教授,2011年 名古屋大学理学部 教授を経て,2012年より名古屋大学大学院創薬科学研究科 教授.
研究テーマ:創薬を志向したタンパク質ドメインのNMR構造生物学.
関心事:マルチドメインタンパク質および天然変性タンパク質の構造動態と機能発現の機構に興味があります.研究オタクな大学院生を常時募集中.
研究室URL:http://presat-vector.org/hiroaki-lab/
© 2013 天野剛志・廣明秀一 Licensed under CC 表示 2.1 日本