花成ホルモン“フロリゲン”の構造と機能
2013/03/21
辻 寛之・田岡健一郎・島本 功
(奈良先端科学技術大学院大学バイオサイエンス研究科 植物分子遺伝学研究室)
email:辻 寛之
領域融合レビュー, 2, e004 (2013) DOI: 10.7875/leading.author.2.e004
Hiroyuki Tsuji, Ken-ichiro Taoka & Ko Shimamoto: Structure and function of flowering hormone "florigen".

フロリゲンは植物の花芽分化を決定づける因子であり,その正体を明らかにすることは長いあいだ植物科学における重要な問題のひとつであった.近年の分子遺伝学的な解析の進展により,フロリゲンの正体はFT/Hd3aとよばれる球状タンパク質であることが明らかになり,さらに最近になり,フロリゲン受容体の同定や,機能の本体であるフロリゲン活性化複合体の結晶構造の解明など,分子レベルでの理解も深まってきている.また,フロリゲンは花だけでなくジャガイモの形成を決定づけるなど,驚くべき多機能性をもつことが明らかになってきた.ここでは,わが国が世界をリードしてきたフロリゲン研究の歴史を概観するとともに,フロリゲンの構造と機能に関する最新の知見を解説する.
フロリゲンは,植物に花芽を形成させる決定的な効果をもつ物質として,1936年にその存在が予言された1).フロリゲンは美しい花とそののちの実りをもたらすばかりでなく,“組織間の長距離コミュニケーション”や“栄養成長と生殖成長との転換”といった重要な問題をも内包する魅力的な研究対象となり,その存在が提唱されて以来,フロリゲンの正体を明らかにするため数多くの研究がなされてきた2).しかし,こうした努力にもかかわらずフロリゲンの正体は長く謎のままであり,いつしか“幻の植物ホルモン”とまでよばれるようになった3).近年のモデル植物を用いた分子遺伝学的な研究はこうした状況を突破し,2007年,フロリゲンの分子実体はHd3a/FTとよばれるタンパク質であることが明らかにされ4,5),さらに2011年,フロリゲンの受容体の同定,および,活性の本体となるタンパク質複合体の結晶構造が解明された6)(新着論文レビュー でも掲載).ここでは,フロリゲンの構造と機能に関する最新の知見をまとめ,そこから提示されるフロリゲン研究の展望について議論する.
はじめに,フロリゲンの概念が提出されるまでの歴史的な経緯について概説する.植物は発芽したのち,通常は葉をつくりつづけるが,春や秋など特定の季節が到来すると葉の発生を停止して花芽の形成(花成)を開始する3).そこで最初の重要な問題は,植物が環境要因のうち何を認識して季節を判断し花成を開始しているかである.1920年,タバコやダイズにおいて花成のタイミングを調査した実験結果を総合することにより,花成の開始の最大の鍵となるのは1日の日の長さ(日長)であることが明らかにされた7).生命現象が日長により制御される性質は,一般的に光周性とよばれる.植物の花成が日長により制御される光周性花成が発見されて以来,光周性は動物の季節性の繁殖行動などへ一般化された8).現在では,光周性の分子機構も明らかにされつつあり,光周性は概日時計と光情報入力系の複雑な相互作用により成立していることが知られている8).
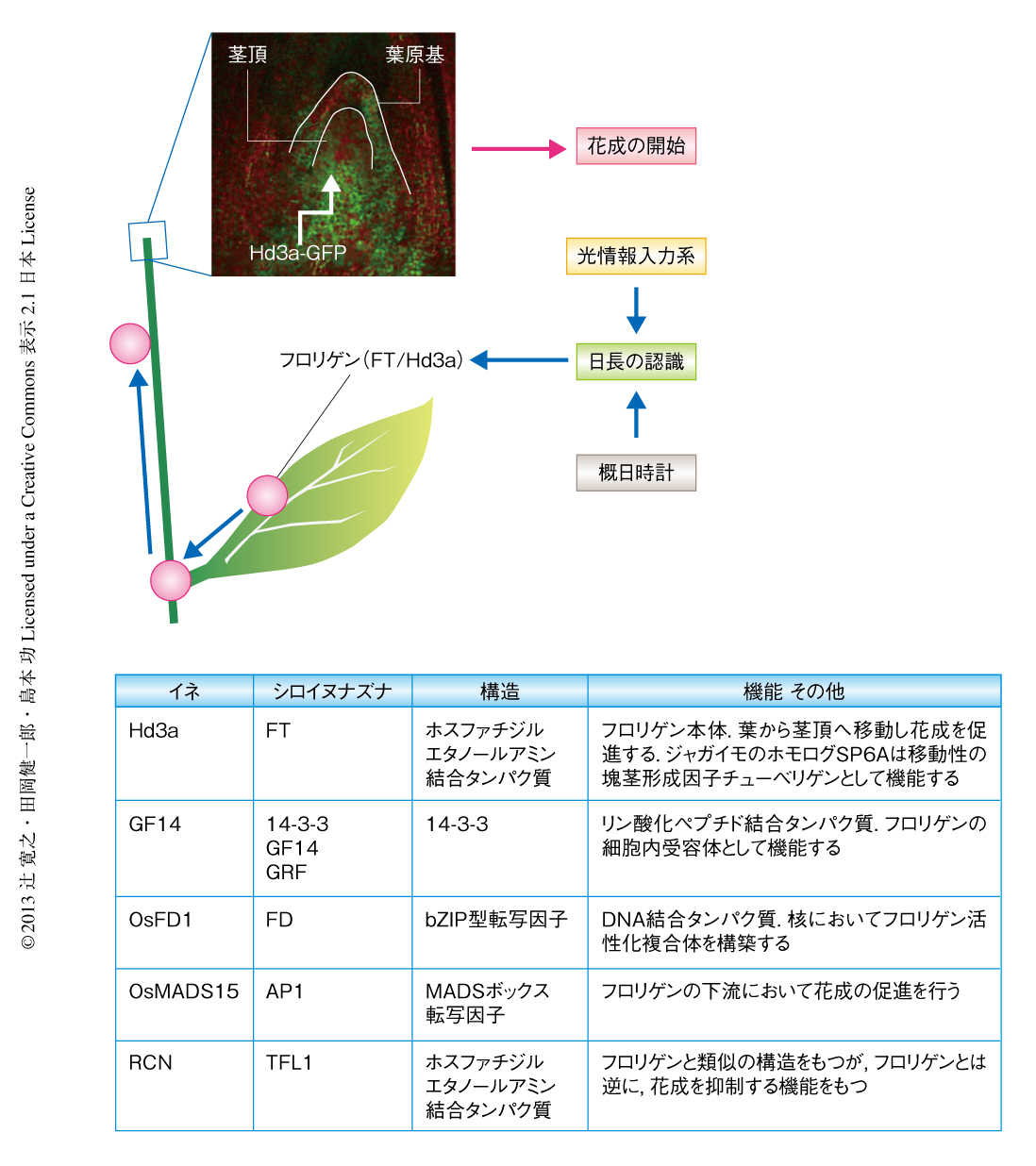
つぎの重要な問題は,植物がどの器官において日長を認識しているかである.さまざまな器官をおおいかくすことにより器官ごとに日長を変えた場合に,花成のタイミングはどう変化するかを評価する実験などから,日長の計測を行う器官は葉であることが明らかになった3).しかし,実際に花のつく器官は,葉ではなく茎の先端である.葉で認識された日長は,どのように花芽のできる茎の先端へと伝達されるのか.1936年,ロシアの植物生理学者Chailakhyan(チャイラヒャン)は,“葉で合成されて茎頂へ移動し花芽を分化させる物質”の存在を予言し,これをフロリゲンと名づけた1)(図1).そののち,“花芽を分化する条件で栽培した植物”を“花芽を分化しない条件で栽培した植物”へと接木すると,後者にも花芽が形成されるといった実験結果などから,フロリゲンの存在は強く支持されるようになった3).それ以来,フロリゲンを物質として単離しようという研究が精力的に行われたが,長くその単離にはいたらなかった2).
フロリゲンを同定しその特徴を生理学的に明らかにしようとする研究において,わが国の植物生理学研究は世界を牽引してきた.とくに1940年代より,鋭敏な光周性花成を示すアサガオを用いた独自の研究が開始され,その理解に貢献してきた.アサガオの品種ムラサキでは子葉に対し1回の短日条件をあたえるだけで花成の誘導に十分なフロリゲンが合成されるとされ,さらに,花芽の分化した腋芽の数を計測することでフロリゲンの活性を定量的に評価できるなど,当時のフロリゲン研究の推進にきわめて有利な材料であった.当時,進められてきたアサガオの光周性花成の研究はフロリゲンの移動速度の推定をはじめとする重要な発見をもたらし3),こうした蓄積が,後述するように,フロリゲンの分子実体の解明においてわが国の研究者が貢献したことの背景になったのかもしれない.
近年のイネおよびシロイヌナズナを用いた分子遺伝学的な解析から,フロリゲンの分子実体がHd3a/FTとよばれるタンパク質であることが明らかにされた4,5)(図1).ここでは,その実態解明の経緯について概説する.
1999年,京都大学の荒木 崇らのグループは,ドイツのグループとともに,のちにフロリゲンをコードしていることが明らかにされるFLOWERING LOCUS T(FT)遺伝子を同定した9,10).シロイヌナズナの花成は長日条件において促進されるが,ft変異体において完全な花成の促進は起こらなかった.したがって,FT遺伝子は葉におけるフロリゲンの合成から茎頂における受容まで,いずれかのステップに必須であることが期待された.FT遺伝子の発現する部位は葉の維管束篩部(葉脈などにある栄養分の通り道)であったことから11),FTタンパク質は一見すると葉で機能していると考えられよう.しかし2005年になり,この2つのグループは,FTタンパク質の機能する部位について重要な示唆をあたえる結果を報告した.FTが完全に機能するには,茎頂だけで発現するbZIP型の転写因子FDとの相互作用が必要であるという報告である12,13).FT遺伝子はその発現部位が葉であるにもかかわらず,作用部位が茎頂である可能性が示されたといえよう.
2007年になり,筆者らのグループとドイツの別のグループは,それぞれ,FTのイネにおけるホモログであるHd3aタンパク質,および,シロイヌナズナFTタンパク質がフロリゲンの分子実体であることを強く示唆する研究結果を報告した4,5).本稿では,筆者らのイネにおける報告5) を中心に概説するが,シロイヌナズナに関する報告についても興味をもたれた読者は原著論文4) を参照してほしい.まず,Hd3a遺伝子のプロモーター活性が詳細に調査され,このプロモーターはイネの花成が促進される短日条件において特異的に葉の維管束篩部において活性をもち,茎頂ではこのプロモーターの活性はみられないことが示された.Hd3a遺伝子プロモーターから転写され生じるmRNAも葉でのみ強い蓄積がみられ,茎頂にはほとんど蓄積していなかった.最後に,Hd3aタンパク質の局在を調べるため,Hd3a遺伝子プロモーターの制御下においてHd3a-GFP融合タンパク質を発現するイネが作出され,Hd3aの局在がGFPの蛍光を指標に追跡された.その結果,転写もmRNAもほとんどない茎頂において,Hd3a-GFP融合タンパク質の蛍光が明瞭に検出された(図1).このことは,Hd3aが葉の維管束篩部から茎頂へと長距離移動したことを強く示唆した5).さらに,Hd3a-GFP融合タンパク質を発現させたイネは早咲きとなり,また,Hd3a遺伝子とそのホモログであるRFT1遺伝子の発現をRNAi法によりノックダウンすると花成が完全に抑制されたことから,Hd3aにはイネの花成を促進する機能があると結論された5,14).これらの結果を総合すると,Hd3aタンパク質が移動性の花成促進シグナル“フロリゲン”の分子実体であることが強く示唆された.同様の結論は,荒木らのグループによるシロイヌナズナの接木実験や15),米国のグループによるカボチャの接木実験16) などからも得られており,現在では,フロリゲンの実体がHd3a/FTであるという結論は広く受け入れられている17,18).
フロリゲンの分子実体は長距離の移動性をもつタンパク質FT/Hd3aであった.歴史的にはこのことが,フロリゲンの同定を遅らせた原因であったのかもしれない.たとえば,フロリゲンの抽出の試みにおいて,対象はほかの植物ホルモンと同様の低分子化合物が想定されていた.そのため,FT/Hd3aは精製の過程で失われたり不活性化されたりしていたと推測される.また,抽出したフロリゲンの活性を確認する方法として,抽出物に植物体の腋芽などを浸漬もしくは塗布したり根から吸わせたりして花成を観察する方法がとられてきた.この場合,仮にFT/Hd3aが精製画分に存在していたとしても分子量20,000という高分子であるため細胞膜を透過できず,したがって,活性を確認することは困難であったろう.
ここからさきは,最新の研究結果から明らかになった,フロリゲンの活性本体であるタンパク質複合体,および,フロリゲンの細胞内における受容体,さらに,これらの発見から展開するフロリゲンの新しい機能について概説する.登場するおもな因子についてまとめたので,参照のうえ読み進んでほしい(図1).
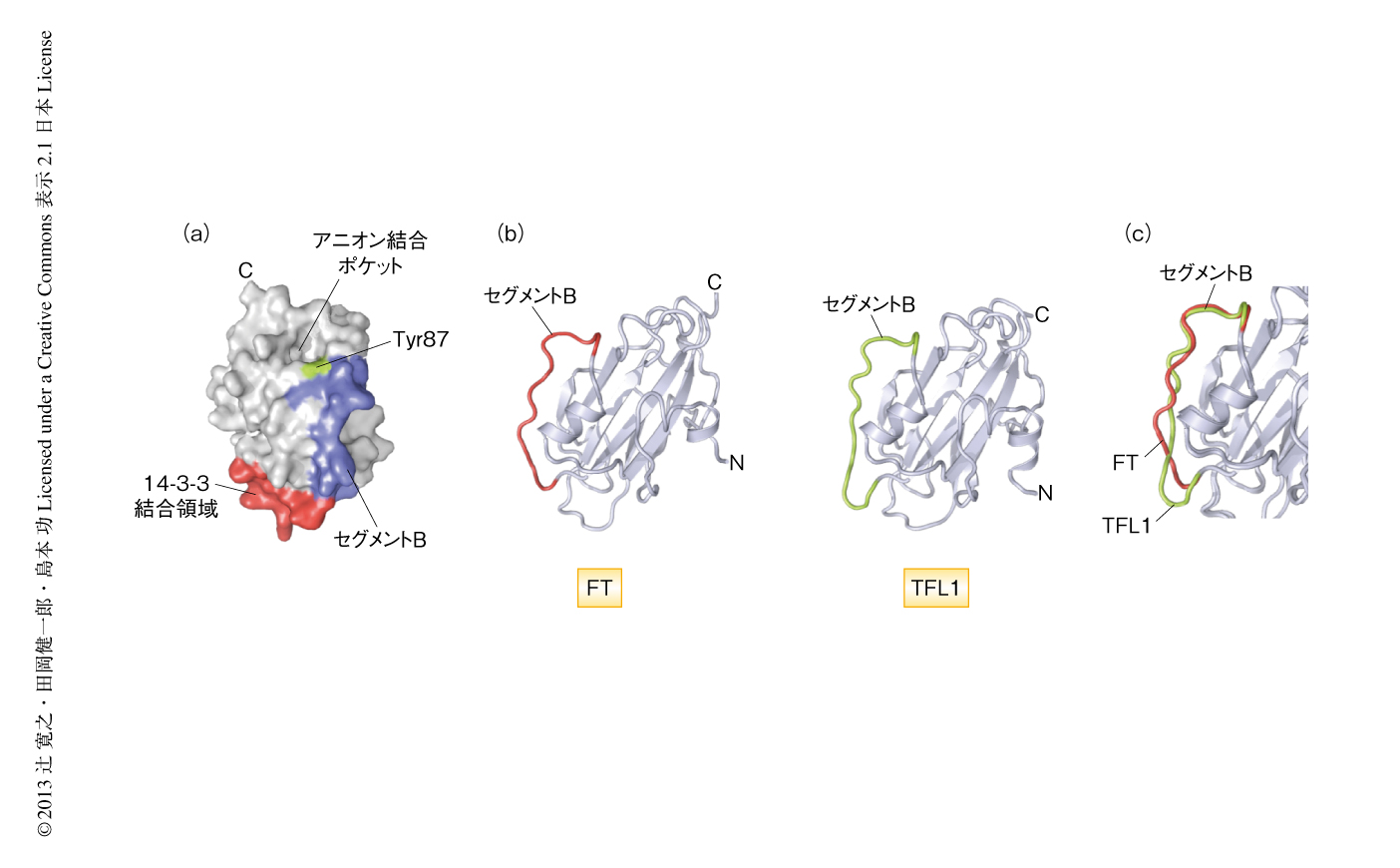
FT/Hd3aはホスファチジルエタノールアミン結合タンパク質(phosphatidylethanolamine binding protein:PEBP)とよく似た1次構造を示すタンパク質である.ホスファチジルエタノールアミン結合タンパク質はリン脂質の一種であるホスファチジルエタノールアミンと結合する可溶性かつ塩基性のタンパク質としてウシの脳からみつかったが,そののち,多くの生物種に普遍的に存在することが明らかになった.分子量20,000の小さな球状タンパク質で,ホスファチジルエタノールアミンのリン酸基の部分が結合するアニオン結合ポケット領域とよばれる小さなくぼみをもつ.フロリゲンの3次元構造については,ドイツのグループがFT 19),筆者らのグループがHd3a 6) について結晶構造を報告している(図2).この2つは互いに非常に似た構造を示し,アニオン結合ポケット領域の構造も保存されているが,ホスファチジルエタノールアミン結合タンパク質によるリン酸基の認識に重要なチロシン残基は保存されていなかった.現在のところ,フロリゲンの花成促進機能とホスファチジルエタノールアミンとの関連は不明である.
これまでに知られているホスファチジルエタノールアミン結合タンパク質の生化学的な機能からは,フロリゲンによる花成の促進の分子機構を推測することは困難であった.このような場合,対象である機能不明のタンパク質がどのようなタンパク質と相互作用しているかを知ることで機能の推測において重要な手がかりが得られることが多い.さきに述べたFD遺伝子は,花成が遅延する変異体としてすでに報告されていたfd変異体の原因遺伝子であった.FD遺伝子はbZIP型の転写因子をコードしており,FTとFDの両者の過剰発現により花芽分裂組織決定遺伝子のひとつであるAP1遺伝子の発現を異所的に誘導できる13).そして,酵母ツーハイブリッド法によりFTとFDとの相互作用が検出された12,13).この相互作用には,FDのC末端側に存在し,Ca2+依存性プロテインキナーゼ(calcium-dependent protein kinase:CDPK)によりリン酸化されると予想されるアミノ酸配列モチーフThr-Ala-Proの存在が必須であった12).そして,このモチーフを欠損させたFDは花成における機能を喪失した.以上から,FTとFDとが相互作用することがFTによる花成の促進に重要であると考えられた12).これらの結果から,転写因子FDは,それ自体に転写活性化能はないが,FTと結合することにより転写活性化能を獲得し標的遺伝子の転写を活性化する,というモデルが提出された19).
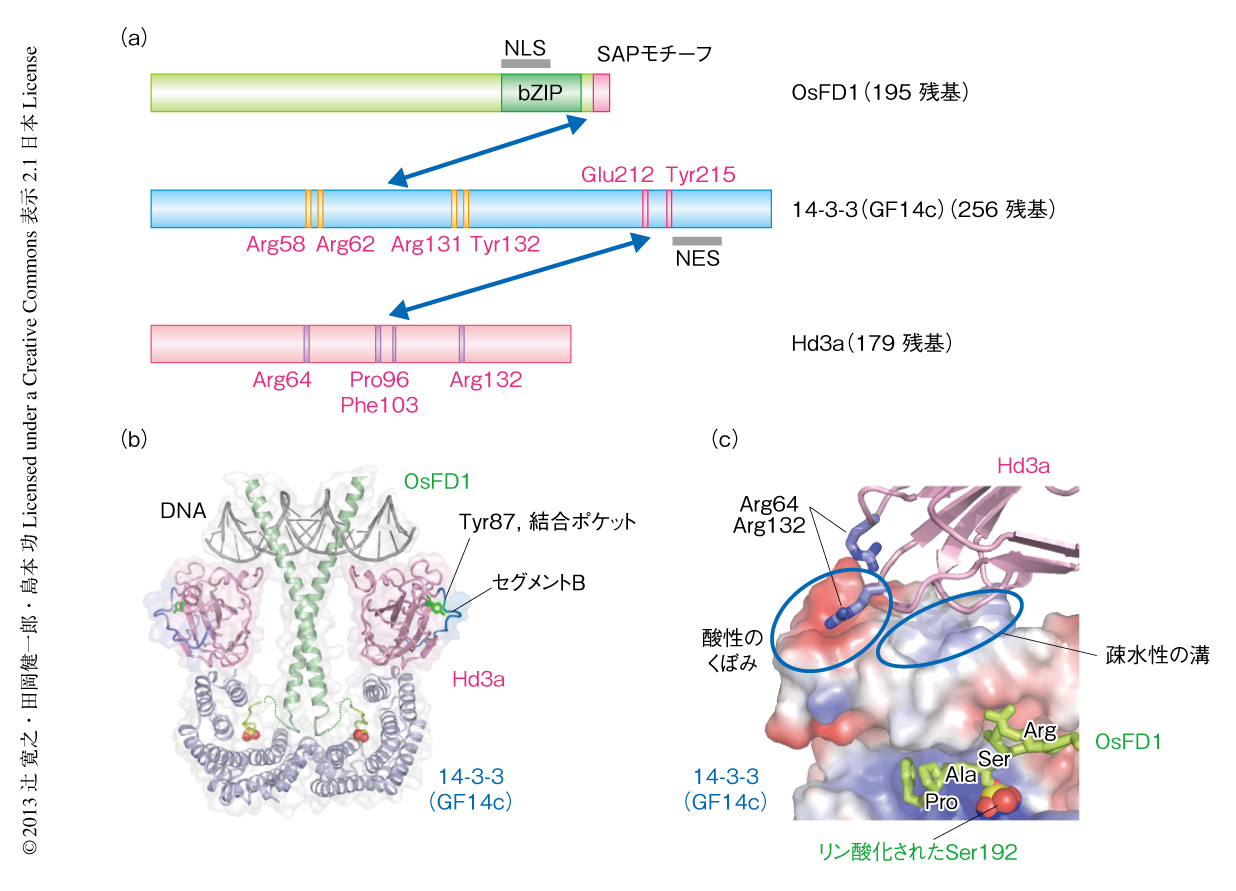
筆者らのグループも,フロリゲンの機能の理解のため酵母ツーハイブリッド法によるHd3a相互作用タンパク質の探索を行った6).その結果,14-3-3タンパク質のひとつであるGF14c,シロイヌナズナFDのイネにおけるホモログであるOsFD1などがHd3aと相互作用するタンパク質として得られた(図3a).14-3-3をコードする遺伝子はイネのゲノムにおいて8つ存在しており,それぞれの産物はGF14aからGF14hの名称がつけられているが,Hd3aと結合の可能なのはこのうち4つ,GF14b,GF14c,GF14e,GF14fであった.これら4つの機能はフロリゲンの機能に関して本質的に同等であると考えられたので,ここではまとめて14-3-3とよぶ.これらのアミノ酸配列を比較したところ,14-3-3を除くHd3a相互作用タンパク質のC末端側には,さきに述べたFD-FT相互作用モチーフ12) に類似したSAPモチーフSer-Ala-Proが共通して見い出され,それは酵母ツーハイブリッド法におけるHd3aとの相互作用に必須であった.しかし,高度に精製した組換えタンパク質を用いたin vitroにおける相互作用実験では,Hd3aと14-3-3とのあいだの相互作用は検出されたが,Hd3aとOsFD1とのあいだの相互作用は検出できなかった.これらの実験結果と,14-3-3の結合モチーフであるモード1とSAPモチーフが似ていること,さらに,14-3-3にSAPモチーフはないことから,Hd3aとその相互作用タンパク質は,14-3-3を介し間接的に相互作用していると考えた(図3a).酵母ツーハイブリッド法において観察されたHd3aとその相互作用タンパク質との結合は,出芽酵母に内在する14-3-3を介した間接的なものであると説明できる.実際,OsFD1と14-3-3とはin vitroの実験系においても相互作用し,さらに,変異解析によりSAPモチーフのSerのリン酸化がOsFD1と14-3-3との相互作用に重要であることがわかった.酵母ツーハイブリッド法はタンパク質の相互作用を簡便に試験できるすぐれた実験系であるが,出芽酵母に内在するタンパク質による間接的な相互作用を検出する可能性がひそんでいる.また,プルダウンアッセイなどin vitroにおける相互作用解析においても,用いるタンパク質の精製度が十分に高くなければタンパク質の産生に用いた細胞からのもち込みが相互作用に影響する場合があるため,結果の解釈には注意が必要である.FTとFDとの相互作用の解析の結果は,そのよい教訓といえるかもしれない.
筆者らのグループは,Hd3a,14-3-3,OsFD1の相互作用の詳細を調べるため,これら3つのタンパク質からなるタンパク質複合体の立体構造解析を行い,結晶構造を2.4Å分解能で決定することに成功した6)(PDB ID:3AXY).結晶化にあたり,OsFD1としては14-3-3との結合に必要十分なリン酸化Ser192を含むC末端側の9アミノ酸残基からなる断片を用いた.得られた複合体の構造は,Hd3a,14-3-3,OsFD1それぞれ2分子ずつからなるW字型のヘテロ六量体を形成していた(図3b).そして,二量体を形成した14-3-3のW字の底にあるくぼみに,リン酸化されたOsFD1がはまり込み,その上側にHd3aが1分子ずつ左右対称に離れて結合していた.Hd3aとOsFD1とのあいだに直接的な相互作用はみられなかった(図3c).この複合体をフロリゲン活性化複合体(florigen activation complex:FAC)と名づけた.
14-3-3は真核生物に広く保存されている分子量約30,000の酸性タンパク質である.14-3-3という名前は,ウシの脳に存在するタンパク質を網羅的に分類する際に,クロマトグラフィーによる画分番号14と電気泳動での移動位置3.3に存在するタンパク質を14-3-3と命名したことに由来する.14-3-3には複数の異なる分子種が存在し,それらのあいだでホモ二量体あるいはヘテロ二量体を形成する.14-3-3二量体はリン酸化セリン残基あるいはリン酸化スレオニン残基を認識してさまざまなタンパク質と結合し,その機能を制御する.14-3-3と結合するタンパク質の多くには,14-3-3により認識されるリン酸化セリン残基あるいはスレオニン残基の周囲に,共通するアミノ酸配列モチーフであるモード1(Arg-X-X-pSer-X-Pro)あるいはモード2(R-X-X-X-pSer-X-Pro)が見い出される.
フロリゲン活性化複合体の場合,14-3-3とOsFD1との結合はSAPモチーフ中のリン酸化セリン残基の認識による,14-3-3に典型的にみられる結合であった.それに対して,14-3-3とHd3aとの結合はリン酸化に非依存的な新規な結合であった.そして,この結合様式が,14-3-3がOsFD1とHd3aの両方に同時に結合することを可能にしていた.フロリゲン活性化複合体を構成する3つのタンパク質の相互作用面を詳細にみたところ,OsFD1と14-3-3との相互作用においては,OsFD1のリン酸化されたSer192が14-3-3の塩基性のリン酸化ペプチド結合ポケットにはまり込み,さらに,SAPモチーフの全体も認識されていた(図3c).一方,14-3-3とHd3aとの相互作用は,Hd3aの中央ループ領域に存在する2つの突き出たアルギニン残基Arg64とArg132が14-3-3の上部にある酸性のくぼみにはまり込み,さらに,Hd3aの本体は14-3-3のC末端側のへリックスのあいだにある疎水性の溝と広く相互作用していた(図3c).イネのフロリゲン活性化複合体において観察されたHd3aと14-3-3,14-3-3とOsFD1の相互作用部位は,ともにイネ以外の高等植物のFT,14-3-3,FDにおいても高度に保存されていた6).シロイヌナズナにおいて,FTと14-3-3との相互作用もすでに報告されている20).以上から,フロリゲン,14-3-3,転写因子FDによる複合体の形成は高等植物の花成の制御において共通して存在し,フロリゲンがすべての植物に共通にはたらく分子基盤になっていると考えられた.
植物の細胞において,フロリゲン活性化複合体はイネOsMADS15遺伝子やシロイヌナズナAP1遺伝子など花芽形成遺伝子のプロモーター領域に結合し転写を活性化していると考えられる6,13).シロイヌナズナAP1遺伝子プロモーターの解析からは,Cボックス配列を含む特定の領域を欠損させるとFTとFDに対する応答能が失われることが報告されている6,13).また,in vitroにおいてイネのフロリゲン活性化複合体とCボックス配列とが結合しうることがゲルシフトアッセイにより明らかにされている13).完全長のFDと標的となるDNAを含むフロリゲン活性化複合体の結晶構造解析の例はまだないが,既知である動物のbZIP型の転写因子CREBとDNAとの複合体の構造をもとに作製されたフロリゲン活性化複合体とDNAとの複合体のモデル構造(図3b)では,Hd3aとOsFD1とは直接に結合することなく,Hd3aは14-3-3とOsFD1をDNAに安定に保持するよう位置していた.したがって,Hd3aはフロリゲン活性化複合体の安定化にも寄与している可能性が考えられた.
イネのプロトプラストを用いてフロリゲン活性化複合体が細胞において構築される機構が詳細に調べられた6).GFPなどの蛍光タンパク質との融合によりフロリゲン活性化複合体の個々の構成タンパク質の細胞内での局在を観察した場合,Hd3aは核と細胞質に,14-3-3はほとんどが細胞質に,OsFD1は核のみに局在しており,フロリゲン活性化複合体モデルにおいて複合体を形成するはずの3つのタンパク質の局在はそれぞれ異なっていた(図4a).つぎに,複合体の細胞内における局在が二分子蛍光補間(bimolecular fluorescence complementation:BiFC)法により調べられた.BiFC法は,相互作用能を調べようとする2つのタンパク質のそれぞれに2分割した蛍光タンパク質を融合させ,2つのタンパク質が相互作用すると蛍光タンパク質の立体構造が再構成されて蛍光が観察される,という原理による手法である.BiFC法によりHd3a-14-3-3複合体の形成は細胞質において検出された(図4a).ところが,そこにさらにCFP-OsFD1融合タンパク質を共発現させると,Hd3a-14-3-3複合体はOsFD1に依存的に細胞質から核へと局在を変え,3つのタンパク質が核に集まることが観察された(図4a).そして,BiFC法においても,Hd3a-OsFD1複合体は核において検出された.また,シロイヌナズナにおいてもFT-FD複合体のBiFCシグナルは核において検出される.これらを考えあわせると,14-3-3は細胞質においてHd3aと最初に結合するフロリゲン受容体として機能し,Hd3a-14-3-3複合体は核へと移行してOsFD1と相互作用すると考えられた(図4b).
ここまで紹介したどの実験方法も,フロリゲン活性化複合体を構成するタンパク質の2因子間の相互作用を明らかにするものであり,3因子が“同時に”ひとつの複合体に存在することを示すものではない.筆者らのグループは,BiFC法と蛍光共鳴エネルギー転移/蛍光寿命測定(fluorescence resonance energy transfer/fluorescent lifetime imaging:FRET/FLIM)法とを組み合わせた手法により,この点を明らかにすることを試みた.FRET/FLIM法は,2分子のあいだの蛍光共鳴エネルギー移動(FRET)による蛍光寿命の変化を観測することにより,その2分子が近接しているかどうかを定量的に評価する手法である.具体的には,Hd3aと14-3-3との相互作用をBiFC法により検出し,さらに,BiFC法において再構成された蛍光タンパク質VenusとCFP-OsFD1融合タンパク質との相互作用をFRET/FLIM法により検出することで,3つのタンパク質からなる複合体の検出を試みた.解析の結果は,生細胞においても3つのタンパク質からなるフロリゲン活性化複合体は核において形成されていることを強く示唆した6).
モデル(図3b)では,細胞質において形成されたHd3a-14-3-3複合体がいかにして核に存在するOsFD1と相互作用するのか,まだ説明できていない.これについては今後の解析課題であるが,現在のところ,つぎのような仮説が有力である.すなわち,細胞質において翻訳されたOsFD1が細胞質のHd3a-14-3-3複合体と相互作用し,形成されたフロリゲン活性化複合体はOsFD1のもつ核局在シグナルのはたらきにより核へと移行する,というものである21).この仮説をサポートする知見として,14-3-3のもつHd3a結合領域は14-3-3の核外移行シグナルと重なっており,Hd3aとの結合によりその機能は阻害されると予想されることがあげられる.もうひとつ,ごく最近になり得られたOsFD2についての知見がある21).OsFD2は葉の発生制御に関与するbZIP型の転写因子で,そのSAPモチーフ類似配列を介して14-3-3と結合し,Hd3aとフロリゲン活性化複合体を形成することができる21).OsFD1と比較すると核局在シグナルの配列に大きな違いがみられ,おそらくそのために,核への局在の効率はOsFD1に比べ著しく低い21).しかし,そのSAPモチーフ類似配列に変異を導入して14-3-3との結合能を喪失させたり,Hd3aを共発現させてフロリゲン活性化複合体を形成させたりすると,OsFD2の核への局在の効率は著しく上昇した21).この観察結果は,さきに述べた仮説によりうまく説明できるものである.
Hd3aの下流の標的遺伝子としてOsMADS15遺伝子が報告されている14).OsMADS15遺伝子はMADSボックス遺伝子ファミリーのうちAP1遺伝子サブファミリーに属する.シロイヌナズナにおいて,AP1遺伝子は花器官の形成のABCモデルにおいてクラスA遺伝子として機能するだけでなく,花成において花芽分裂組織決定遺伝子としても機能し,FTとFDにより正に制御されることが明らかにされている12,13).最近になり,イネのAP1遺伝子サブファミリーの3つのメンバー,OsMADS14遺伝子,OsMADS15遺伝子,OsMADS18遺伝子と,SEP遺伝子サブファミリーのメンバーであるPAP2遺伝子(OsMADS34遺伝子)の四重変異体では,生殖成長への相転換が起こらないことが示された22).そこで,OsMADS15遺伝子の活性化を花成のマーカーとして,花成におけるHd3a,14-3-3,OsFD1の3者の相互作用の重要性が詳細に調べられた6).一過的発現実験において,OsMADS15 mRNAの量はHd3a遺伝子およびOsFD1遺伝子をともに発現させた場合にのみ増加した.しかし,14-3-3との相互作用を欠損する変異を導入したHd3a遺伝子,あるいは,14-3-3との相互作用を欠損する変異を導入したOsFD1を発現させた場合には,OsMADS15 mRNAの発現の上昇はほとんど観察されなかった.ここで注意すべき点は,プロトプラストには内在性の14-3-3が大量に発現していることである.そのため,14-3-3の一過的な発現の有無はOsMADS15 mRNAの発現上昇にほとんど影響しなかった.そこで,イネのゲノムにHd3aと結合の可能な14-3-3をコードする遺伝子は4つ存在するが,それらに対しRNAiベクターを導入することによりHd3aと結合の可能な14-3-3の発現をすべてノックダウンしたところ,Hd3a遺伝子およびOsFD1の発現に依存したOsMADS15遺伝子の活性化は抑制された.以上の実験結果は,フロリゲン活性化複合体の形成は下流の標的遺伝子の活性化に必須であることを示唆した.
さらに,多数の形質転換イネを用いた実験から,フロリゲン活性化複合体の形成は実際に花芽の形成において必要であることが明らかになった6).Hd3a遺伝子を過剰発現する形質転換イネでは,その出穂は顕著に促進されたが5,6),14-3-3との相互作用を欠損した変異Hd3a遺伝子の過剰発現ではその花成の促進機能は失われた6).また,OsFD1の発現をRNAi法によりノックダウンすると,シロイヌナズナfd変異体12,13) やトウモロコシdlf1変異体23) と同様に,花成は遅延した.そして,OsFD1を過剰発現させると花成は促進された.ただし,このOsFD1の過剰発現による花成の促進効果は,14-3-3と恒常的に結合の可能なリン酸化模倣変異を導入したOsFD1にのみ顕著であった.このことは,OsFD1の花成の制御への関与とともに,OsFD1のリン酸化の制御も重要な制御要因のひとつであることを示唆した.
花芽形成遺伝子の活性化におけるフロリゲン活性化複合体の重要性は明らかになったが,フロリゲン活性化複合体がどのような分子機構により下流の標的遺伝子の転写を活性化しているのかはまだ明らかにされていない.OsFD1/FDはbZIP型の転写因子であるが,単独では下流の標的遺伝子を活性化しない.また,OsFD1やHd3a/FTには転写因子に典型的にみられる酸性領域のようなドメインはみあたらない.FTの詳細なドメイン解析からは,セグメントBとよばれるループ領域とアニオン結合ポケット領域が花成の促進機能に重要であることが明らかにされている19,24).これらの領域は,フロリゲン活性化複合体の構造モデルではその表面に露出していることから(図3b),これらの領域に未同定の転写活性化因子がリクルートされることにより下流の標的遺伝子の転写活性化がひき起こされるのではないかと予想されている6).
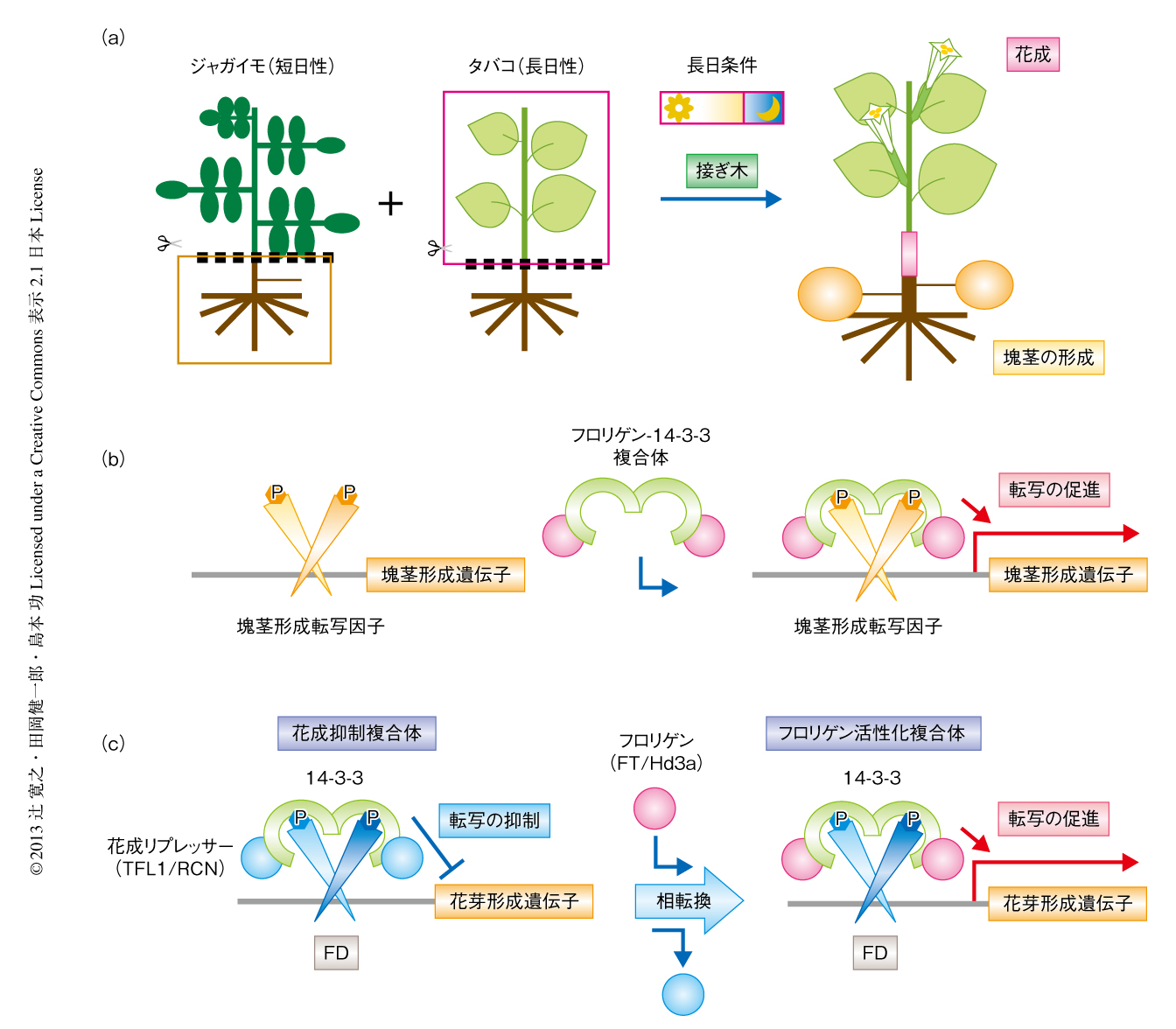
光周性反応は植物のさまざまな生理現象にかかわっていることが古くから知られている.ジャガイモの塊茎(イモ)の形成が短日条件で誘導される現象はその代表的な例である.塊茎の形成においても,葉において合成される仮想の塊茎形成ホルモン(チューベリゲン)が形成を誘導するという説が提唱された25).ここでは,つぎのような実験から,チューベリゲンがフロリゲンと同一の物質である可能性について報告された(図5a).花成における日長条件の異なるタバコ品種(短日性,長日性,中日性)とジャガイモとを接ぎ木し,台木であるジャガイモにおける塊茎の形成を調べたところ,形成が観察されたのはいずれの接ぎ木実験の場合においても穂木であるタバコの花成が誘導されているときのみであった25).このことは,異なる植物種でつくられた花成を誘導する物質が接ぎ木により伝達され,ジャガイモにおいて塊茎の形成を誘導できることを示唆した.
筆者らは最近になり,イネのフロリゲンをコードするHd3a遺伝子をジャガイモにおいて過剰発現させると,本来は塊茎の形成が誘導されない長日条件においても塊茎が形成されることを見い出した26).この過剰発現の効果は接ぎ木の伝達性を示すことから,フロリゲンがチューベリゲンとしても機能していることが強く示唆された.最近の研究から,このような花成の制御のほかのフロリゲンの機能が明らかにされはじめている.例をあげると,ポプラの短日条件における成長の停止と休眠芽の形成27),テンサイ(サトウダイコン)における花成の抑制28),トマトやトウモロコシにおける形態形成29,30),シロイヌナズナにおける気孔開閉の制御31),トマトにおける果実収量32) において,FT遺伝子のホモログのかかわっていることが報告されている.ポプラの場合,2つの異なるFT遺伝子ホモログ,PtFT1遺伝子とPtFT2遺伝子が役割を分担して栄養成長および生殖成長を制御している27).PtFT1遺伝子は冬のおわりに発現し生殖成長の開始の決定にかかわるのに対し,PtFT2遺伝子は栄養成長期に発現し栄養成長や休眠芽の休眠の阻害を促進すると考えられている.テンサイの場合,2つの異なるFT遺伝子ホモログのうち,BvFT2遺伝子は花成の促進に必須であるのに対し,BvFT1遺伝子は花成の抑制にはたらき,その発現の減少が春化による花成に重要である28).トマトの場合,FT遺伝子のホモログであるSFT遺伝子は,花成のみならず葉の形態を含めた,より一般的な形態形成制御遺伝子として機能している29).さらに,その遺伝子量が果実収量にも重要であることが報告されている32).ここで重要な点は,Hd3aにおいて14-3-3との結合にかかわるアミノ酸残基は,ここにあげたどのFTホモログにおいても高度に保存されていたことである.したがって,これらのFTホモログも14-3-3と結合できると考えられる.ひとつの魅力的な仮説は,イネのフロリゲン活性化複合体における転写因子OsFD1が,14-3-3と相互作用できる別の転写因子に置き換わったかたちでフロリゲン活性化複合体様の複合体が形成され,花芽形成関連遺伝子とは異なる標的遺伝子の発現制御がなされている,というものである(図5b).このような転写因子の候補として,フロリゲン活性化複合体の形成能をもつが花成ではなく葉の形成制御にかかわると考えられるOsFD2があげられよう21).
興味深いのは,機能的に拮抗するFT遺伝子のホモログにおいては構造にも違いがみられることである.一般に,花成の促進にはたらくFTホモログのアミノ酸配列は非常に高度に保存されているが,PtFT2やBvFT1のもつセグメントB領域には一般的なコンセンサス配列と比較してアミノ酸配列の置換がみられる.セグメントB領域は,さきに述べたように,フロリゲンによる下流遺伝子の転写活性化に重要な領域である.BvFT1のセグメントB領域にみられるアミノ酸に置換の導入された変異BvFT2は,花成促進から花成抑制へと機能転換した27).これについては,セグメントBの違いにより異なる転写活性化因子が結合することで機能の変換が起こった可能性が考えられよう.
花成リプレッサー遺伝子TERMINAL FLOWER1(TFL1)は,早咲きと花序の有限成長の表現型を示すシロイヌナズナ変異体から同定された33).tfl1変異体は早咲きとなり,花序分裂組織が花に変換されるため頂端に花が形成され有限花序となるが,TFL1遺伝子を過剰発現させると逆に遅咲きとなり無限成長性が強調されるようになる.筆者らのグループも,TFL1遺伝子のイネにおけるホモログであるRCN遺伝子の過剰発現が花成の抑制にはたらくことを報告している34).また最近になって,多年生植物の花成の抑制35) やバラやイチゴにみられる四季咲き36) の原因遺伝子としてTFL1遺伝子のホモログが報告されており,開花の季節性におけるTFL1遺伝子ホモログの重要性が明らかにされてきている.これらの知見は,TFL1/RCN遺伝子が花成に関してFT/Hd3a遺伝子とは正反対にはたらくことを示している.ところが,TFL1/RCNはFT/Hd3aと同様にホスファチジルエタノールアミン結合タンパク質ファミリーに属することから,FT/Hd3aとTFL1/RCNは花成の制御の共通した経路において拮抗的にはたらくと考えられてきた9,10,19,24).
FT遺伝子とTFL1遺伝子との拮抗的な機能の分化については,それらの産物であるタンパク質の構造情報をもとにした先駆的な解析がなされている.アニオン結合ポケット領域の周辺に位置するFTのTyr85(Hd3aではTyr87)がFTサブファミリーにおいて,TFL1のHis88がTFL1サブファミリーにおいて,完全に保存されていることから,これらのアミノ酸残基の置換実験が行われた24).その結果,FTのTyr85をHisに置換するとFT過剰発現体と比べ遅咲きになった.一方,FT遺伝子とTFL1遺伝子のキメラ遺伝子の花成に対する効果が網羅的に調べられ,セグメントB領域がFT遺伝子とTFL1遺伝子のと特異性をもたらすことが明らかにされた19).セグメントB領域はFTとTFL1の結晶構造を比較したとき大きく異なっているループ領域に相当する.これらの結果は,アニオン結合ポケット領域やセグメントB領域の違いがFTとTFL1との機能の分化に重要であることを示唆した19,24).
ここで重要な点は,Hd3aにおいて14-3-3との結合にかかわるアミノ酸残基はTFL1/RCNサブファミリーにおいても高度に保存されている点である6).実際,シロイヌナズナやトマトのTFL1ホモログが14-3-3と相互作用することがすでに報告されている20).TFL1/RCNによる花成の抑制の分子機構について,花成の促進におけるフロリゲン活性化複合体モデルをもとにしたつぎのような仮説が考えられる.すなわち,栄養成長期にはフロリゲン活性化複合体のフロリゲンの位置にTFL1/RCNが入り込んだ花成抑制複合体(flowering repression complex:FRC)が形成され花芽形成遺伝子の転写を抑制しているが,フロリゲンが茎頂に到達すると,花成抑制複合体のTFL1/RCNがフロリゲンと置換されてフロリゲン活性化複合体へと転換し,花芽形成遺伝子の転写が促進され花成が誘導される(図5c).また,茎頂分裂組織においてTFL1/RCNが転写因子と14-3-3との複合体をフロリゲンと競合することによりフロリゲンの活性のバランスを制御し,無限成長性を維持するのにかかわっている可能性も考えられる(図5c).このモデルにおいて,フロリゲンの機能の抑制にはTFL1/RCNが14-3-3と結合することによりフロリゲンがフロリゲン活性化複合体を形成するのを阻害するだけでも十分であると考えられるが,花成抑制複合体においてTFL1/RCNのアニオン結合ポケット領域やセグメントB領域に転写制御コリプレッサーが結合して花成遺伝子の転写をより積極的に抑制している可能性もある37).
これまでに得られた知見を総合すると,フロリゲンであるHd3a/FTは葉で合成されたのち,維管束をとおって茎頂まで長距離移動し,茎頂細胞の細胞質において14-3-3に受容されHd3a/FT-14-3-3複合体を形成する.そののち,Hd3a/FT-14-3-3複合体は核へと移行し,FDとさらに高次の複合体であるフロリゲン活性化複合体を形成して花芽形成遺伝子の転写を活性化させ,花成を開始させると考えられる.FTは単なる“花成”ホルモンにとどまらず,ジャガイモにおける塊茎の形成を含むさまざまな形態形成を制御する,移動性の多機能ホルモンであると認識されるようになってきた.この多機能性を担う分子基盤として,フロリゲン活性化複合体の構成タンパク質の交換モデルが考えられる.
フロリゲンの理解を進めるうえでは,つぎのような重要な課題が残されている.ひとつは,フロリゲン活性化複合体に結合する転写活性化因子の同定や,DNAを含めた完全なフロリゲン活性化複合体の立体構造の決定である.これにより,フロリゲンの生化学的な役割やフロリゲン活性化複合体の形成を規定する構造的な要因が明らかになるだろう.そのつぎの課題は,フロリゲンの多機能性の分子機構を明らかにすることである.まずはフロリゲン活性化複合体モデルから予想されるような転写因子の探索が急務であろう.フロリゲンの長距離移動における分子機構の理解も重要である.最近になり,FTの篩管伴細胞から篩部要素への移行にかかわるタンパク質としてFTIP1というC2ドメインタンパク質が報告された38).しかし,FTIP1によるFT輸送の分子機構は明らかにされていない.さらに,篩部要素から茎頂分裂組織の細胞への輸送機構は不明のままである.また,フロリゲンによる花成の制御の際に茎頂分裂組織においてどのような変化がひき起こされているのか,すなわち,茎頂分裂組織における幹細胞の成長相の転換過程の全体像を理解する必要がある.これには,エピゲノムや小分子RNA,トランスクリプトーム変化の網羅的な解析が有力な切り口となるだろう.また,フロリゲンの生細胞イメージングと発現解析とを組み合わせることにより,フロリゲンによる茎頂分裂組織の空間的な制御の理解が進むだろう.
フロリゲンの研究は基礎科学だけにとどまらない.植物の花成を人為的に制御する技術は農業において非常に有用である.ただし,“花咲か爺さん”の話にあるように,フロリゲンをただ植物にふりかけただけでは何も起こらないだろう.なぜなら,フロリゲンの受容体は細胞内にあるが,フロリゲン自体は細胞膜を通過できないタンパク質だからである.フロリゲンの投与による花成の制御には植物の細胞内にフロリゲンを取り込ませる手法の開発が必要となるだろう.別のアプローチとして,フロリゲン活性化複合体の構造情報を活用し,その活性を制御できるような低分子化合物を開発することも可能だろう.
このように,フロリゲン活性化複合体モデルを基盤としたフロリゲンの制御機構の解明は,基礎研究としての重要性にとどまらず,作物の生産において重要な形質の改良にもつながるものと期待される.
略歴:奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:フロリゲンが花を咲かせる分子機構の解明,植物の成長相転換の全体像を理解する.
抱負:いろいろな切り口から植物科学,さらには,生命科学の基本的な問題を解明したい.理想的な作物の開発に直結する基礎研究を展開したい.
田岡 健一郎(Ken-ichiro Taoka)
略歴:奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:フロリゲンによる花成の分子機構の解明.
抱負:フロリゲンの基礎研究を発展させて“フロリゲン農業”へと展開させたい.
島本 功(Ko Shimamoto)
奈良先端科学技術大学院大学バイオサイエンス研究科 教授.
研究室URL:http://bsw3.naist.jp/simamoto/simamoto.html
© 2013 辻 寛之・田岡健一郎・島本 功 Licensed under CC 表示 2.1 日本
(奈良先端科学技術大学院大学バイオサイエンス研究科 植物分子遺伝学研究室)
email:辻 寛之
領域融合レビュー, 2, e004 (2013) DOI: 10.7875/leading.author.2.e004
Hiroyuki Tsuji, Ken-ichiro Taoka & Ko Shimamoto: Structure and function of flowering hormone "florigen".
要 約
フロリゲンは植物の花芽分化を決定づける因子であり,その正体を明らかにすることは長いあいだ植物科学における重要な問題のひとつであった.近年の分子遺伝学的な解析の進展により,フロリゲンの正体はFT/Hd3aとよばれる球状タンパク質であることが明らかになり,さらに最近になり,フロリゲン受容体の同定や,機能の本体であるフロリゲン活性化複合体の結晶構造の解明など,分子レベルでの理解も深まってきている.また,フロリゲンは花だけでなくジャガイモの形成を決定づけるなど,驚くべき多機能性をもつことが明らかになってきた.ここでは,わが国が世界をリードしてきたフロリゲン研究の歴史を概観するとともに,フロリゲンの構造と機能に関する最新の知見を解説する.
はじめに
フロリゲンは,植物に花芽を形成させる決定的な効果をもつ物質として,1936年にその存在が予言された1).フロリゲンは美しい花とそののちの実りをもたらすばかりでなく,“組織間の長距離コミュニケーション”や“栄養成長と生殖成長との転換”といった重要な問題をも内包する魅力的な研究対象となり,その存在が提唱されて以来,フロリゲンの正体を明らかにするため数多くの研究がなされてきた2).しかし,こうした努力にもかかわらずフロリゲンの正体は長く謎のままであり,いつしか“幻の植物ホルモン”とまでよばれるようになった3).近年のモデル植物を用いた分子遺伝学的な研究はこうした状況を突破し,2007年,フロリゲンの分子実体はHd3a/FTとよばれるタンパク質であることが明らかにされ4,5),さらに2011年,フロリゲンの受容体の同定,および,活性の本体となるタンパク質複合体の結晶構造が解明された6)(新着論文レビュー でも掲載).ここでは,フロリゲンの構造と機能に関する最新の知見をまとめ,そこから提示されるフロリゲン研究の展望について議論する.
はじめに,フロリゲンの概念が提出されるまでの歴史的な経緯について概説する.植物は発芽したのち,通常は葉をつくりつづけるが,春や秋など特定の季節が到来すると葉の発生を停止して花芽の形成(花成)を開始する3).そこで最初の重要な問題は,植物が環境要因のうち何を認識して季節を判断し花成を開始しているかである.1920年,タバコやダイズにおいて花成のタイミングを調査した実験結果を総合することにより,花成の開始の最大の鍵となるのは1日の日の長さ(日長)であることが明らかにされた7).生命現象が日長により制御される性質は,一般的に光周性とよばれる.植物の花成が日長により制御される光周性花成が発見されて以来,光周性は動物の季節性の繁殖行動などへ一般化された8).現在では,光周性の分子機構も明らかにされつつあり,光周性は概日時計と光情報入力系の複雑な相互作用により成立していることが知られている8).
つぎの重要な問題は,植物がどの器官において日長を認識しているかである.さまざまな器官をおおいかくすことにより器官ごとに日長を変えた場合に,花成のタイミングはどう変化するかを評価する実験などから,日長の計測を行う器官は葉であることが明らかになった3).しかし,実際に花のつく器官は,葉ではなく茎の先端である.葉で認識された日長は,どのように花芽のできる茎の先端へと伝達されるのか.1936年,ロシアの植物生理学者Chailakhyan(チャイラヒャン)は,“葉で合成されて茎頂へ移動し花芽を分化させる物質”の存在を予言し,これをフロリゲンと名づけた1)(図1).そののち,“花芽を分化する条件で栽培した植物”を“花芽を分化しない条件で栽培した植物”へと接木すると,後者にも花芽が形成されるといった実験結果などから,フロリゲンの存在は強く支持されるようになった3).それ以来,フロリゲンを物質として単離しようという研究が精力的に行われたが,長くその単離にはいたらなかった2).
フロリゲンを同定しその特徴を生理学的に明らかにしようとする研究において,わが国の植物生理学研究は世界を牽引してきた.とくに1940年代より,鋭敏な光周性花成を示すアサガオを用いた独自の研究が開始され,その理解に貢献してきた.アサガオの品種ムラサキでは子葉に対し1回の短日条件をあたえるだけで花成の誘導に十分なフロリゲンが合成されるとされ,さらに,花芽の分化した腋芽の数を計測することでフロリゲンの活性を定量的に評価できるなど,当時のフロリゲン研究の推進にきわめて有利な材料であった.当時,進められてきたアサガオの光周性花成の研究はフロリゲンの移動速度の推定をはじめとする重要な発見をもたらし3),こうした蓄積が,後述するように,フロリゲンの分子実体の解明においてわが国の研究者が貢献したことの背景になったのかもしれない.
1.フロリゲンの正体
近年のイネおよびシロイヌナズナを用いた分子遺伝学的な解析から,フロリゲンの分子実体がHd3a/FTとよばれるタンパク質であることが明らかにされた4,5)(図1).ここでは,その実態解明の経緯について概説する.
1999年,京都大学の荒木 崇らのグループは,ドイツのグループとともに,のちにフロリゲンをコードしていることが明らかにされるFLOWERING LOCUS T(FT)遺伝子を同定した9,10).シロイヌナズナの花成は長日条件において促進されるが,ft変異体において完全な花成の促進は起こらなかった.したがって,FT遺伝子は葉におけるフロリゲンの合成から茎頂における受容まで,いずれかのステップに必須であることが期待された.FT遺伝子の発現する部位は葉の維管束篩部(葉脈などにある栄養分の通り道)であったことから11),FTタンパク質は一見すると葉で機能していると考えられよう.しかし2005年になり,この2つのグループは,FTタンパク質の機能する部位について重要な示唆をあたえる結果を報告した.FTが完全に機能するには,茎頂だけで発現するbZIP型の転写因子FDとの相互作用が必要であるという報告である12,13).FT遺伝子はその発現部位が葉であるにもかかわらず,作用部位が茎頂である可能性が示されたといえよう.
2007年になり,筆者らのグループとドイツの別のグループは,それぞれ,FTのイネにおけるホモログであるHd3aタンパク質,および,シロイヌナズナFTタンパク質がフロリゲンの分子実体であることを強く示唆する研究結果を報告した4,5).本稿では,筆者らのイネにおける報告5) を中心に概説するが,シロイヌナズナに関する報告についても興味をもたれた読者は原著論文4) を参照してほしい.まず,Hd3a遺伝子のプロモーター活性が詳細に調査され,このプロモーターはイネの花成が促進される短日条件において特異的に葉の維管束篩部において活性をもち,茎頂ではこのプロモーターの活性はみられないことが示された.Hd3a遺伝子プロモーターから転写され生じるmRNAも葉でのみ強い蓄積がみられ,茎頂にはほとんど蓄積していなかった.最後に,Hd3aタンパク質の局在を調べるため,Hd3a遺伝子プロモーターの制御下においてHd3a-GFP融合タンパク質を発現するイネが作出され,Hd3aの局在がGFPの蛍光を指標に追跡された.その結果,転写もmRNAもほとんどない茎頂において,Hd3a-GFP融合タンパク質の蛍光が明瞭に検出された(図1).このことは,Hd3aが葉の維管束篩部から茎頂へと長距離移動したことを強く示唆した5).さらに,Hd3a-GFP融合タンパク質を発現させたイネは早咲きとなり,また,Hd3a遺伝子とそのホモログであるRFT1遺伝子の発現をRNAi法によりノックダウンすると花成が完全に抑制されたことから,Hd3aにはイネの花成を促進する機能があると結論された5,14).これらの結果を総合すると,Hd3aタンパク質が移動性の花成促進シグナル“フロリゲン”の分子実体であることが強く示唆された.同様の結論は,荒木らのグループによるシロイヌナズナの接木実験や15),米国のグループによるカボチャの接木実験16) などからも得られており,現在では,フロリゲンの実体がHd3a/FTであるという結論は広く受け入れられている17,18).
フロリゲンの分子実体は長距離の移動性をもつタンパク質FT/Hd3aであった.歴史的にはこのことが,フロリゲンの同定を遅らせた原因であったのかもしれない.たとえば,フロリゲンの抽出の試みにおいて,対象はほかの植物ホルモンと同様の低分子化合物が想定されていた.そのため,FT/Hd3aは精製の過程で失われたり不活性化されたりしていたと推測される.また,抽出したフロリゲンの活性を確認する方法として,抽出物に植物体の腋芽などを浸漬もしくは塗布したり根から吸わせたりして花成を観察する方法がとられてきた.この場合,仮にFT/Hd3aが精製画分に存在していたとしても分子量20,000という高分子であるため細胞膜を透過できず,したがって,活性を確認することは困難であったろう.
2.フロリゲンの生化学的な特徴
ここからさきは,最新の研究結果から明らかになった,フロリゲンの活性本体であるタンパク質複合体,および,フロリゲンの細胞内における受容体,さらに,これらの発見から展開するフロリゲンの新しい機能について概説する.登場するおもな因子についてまとめたので,参照のうえ読み進んでほしい(図1).
FT/Hd3aはホスファチジルエタノールアミン結合タンパク質(phosphatidylethanolamine binding protein:PEBP)とよく似た1次構造を示すタンパク質である.ホスファチジルエタノールアミン結合タンパク質はリン脂質の一種であるホスファチジルエタノールアミンと結合する可溶性かつ塩基性のタンパク質としてウシの脳からみつかったが,そののち,多くの生物種に普遍的に存在することが明らかになった.分子量20,000の小さな球状タンパク質で,ホスファチジルエタノールアミンのリン酸基の部分が結合するアニオン結合ポケット領域とよばれる小さなくぼみをもつ.フロリゲンの3次元構造については,ドイツのグループがFT 19),筆者らのグループがHd3a 6) について結晶構造を報告している(図2).この2つは互いに非常に似た構造を示し,アニオン結合ポケット領域の構造も保存されているが,ホスファチジルエタノールアミン結合タンパク質によるリン酸基の認識に重要なチロシン残基は保存されていなかった.現在のところ,フロリゲンの花成促進機能とホスファチジルエタノールアミンとの関連は不明である.
3.フロリゲンと相互作用するタンパク質の発見
これまでに知られているホスファチジルエタノールアミン結合タンパク質の生化学的な機能からは,フロリゲンによる花成の促進の分子機構を推測することは困難であった.このような場合,対象である機能不明のタンパク質がどのようなタンパク質と相互作用しているかを知ることで機能の推測において重要な手がかりが得られることが多い.さきに述べたFD遺伝子は,花成が遅延する変異体としてすでに報告されていたfd変異体の原因遺伝子であった.FD遺伝子はbZIP型の転写因子をコードしており,FTとFDの両者の過剰発現により花芽分裂組織決定遺伝子のひとつであるAP1遺伝子の発現を異所的に誘導できる13).そして,酵母ツーハイブリッド法によりFTとFDとの相互作用が検出された12,13).この相互作用には,FDのC末端側に存在し,Ca2+依存性プロテインキナーゼ(calcium-dependent protein kinase:CDPK)によりリン酸化されると予想されるアミノ酸配列モチーフThr-Ala-Proの存在が必須であった12).そして,このモチーフを欠損させたFDは花成における機能を喪失した.以上から,FTとFDとが相互作用することがFTによる花成の促進に重要であると考えられた12).これらの結果から,転写因子FDは,それ自体に転写活性化能はないが,FTと結合することにより転写活性化能を獲得し標的遺伝子の転写を活性化する,というモデルが提出された19).
筆者らのグループも,フロリゲンの機能の理解のため酵母ツーハイブリッド法によるHd3a相互作用タンパク質の探索を行った6).その結果,14-3-3タンパク質のひとつであるGF14c,シロイヌナズナFDのイネにおけるホモログであるOsFD1などがHd3aと相互作用するタンパク質として得られた(図3a).14-3-3をコードする遺伝子はイネのゲノムにおいて8つ存在しており,それぞれの産物はGF14aからGF14hの名称がつけられているが,Hd3aと結合の可能なのはこのうち4つ,GF14b,GF14c,GF14e,GF14fであった.これら4つの機能はフロリゲンの機能に関して本質的に同等であると考えられたので,ここではまとめて14-3-3とよぶ.これらのアミノ酸配列を比較したところ,14-3-3を除くHd3a相互作用タンパク質のC末端側には,さきに述べたFD-FT相互作用モチーフ12) に類似したSAPモチーフSer-Ala-Proが共通して見い出され,それは酵母ツーハイブリッド法におけるHd3aとの相互作用に必須であった.しかし,高度に精製した組換えタンパク質を用いたin vitroにおける相互作用実験では,Hd3aと14-3-3とのあいだの相互作用は検出されたが,Hd3aとOsFD1とのあいだの相互作用は検出できなかった.これらの実験結果と,14-3-3の結合モチーフであるモード1とSAPモチーフが似ていること,さらに,14-3-3にSAPモチーフはないことから,Hd3aとその相互作用タンパク質は,14-3-3を介し間接的に相互作用していると考えた(図3a).酵母ツーハイブリッド法において観察されたHd3aとその相互作用タンパク質との結合は,出芽酵母に内在する14-3-3を介した間接的なものであると説明できる.実際,OsFD1と14-3-3とはin vitroの実験系においても相互作用し,さらに,変異解析によりSAPモチーフのSerのリン酸化がOsFD1と14-3-3との相互作用に重要であることがわかった.酵母ツーハイブリッド法はタンパク質の相互作用を簡便に試験できるすぐれた実験系であるが,出芽酵母に内在するタンパク質による間接的な相互作用を検出する可能性がひそんでいる.また,プルダウンアッセイなどin vitroにおける相互作用解析においても,用いるタンパク質の精製度が十分に高くなければタンパク質の産生に用いた細胞からのもち込みが相互作用に影響する場合があるため,結果の解釈には注意が必要である.FTとFDとの相互作用の解析の結果は,そのよい教訓といえるかもしれない.
4.フロリゲン活性化複合体の構造
筆者らのグループは,Hd3a,14-3-3,OsFD1の相互作用の詳細を調べるため,これら3つのタンパク質からなるタンパク質複合体の立体構造解析を行い,結晶構造を2.4Å分解能で決定することに成功した6)(PDB ID:3AXY).結晶化にあたり,OsFD1としては14-3-3との結合に必要十分なリン酸化Ser192を含むC末端側の9アミノ酸残基からなる断片を用いた.得られた複合体の構造は,Hd3a,14-3-3,OsFD1それぞれ2分子ずつからなるW字型のヘテロ六量体を形成していた(図3b).そして,二量体を形成した14-3-3のW字の底にあるくぼみに,リン酸化されたOsFD1がはまり込み,その上側にHd3aが1分子ずつ左右対称に離れて結合していた.Hd3aとOsFD1とのあいだに直接的な相互作用はみられなかった(図3c).この複合体をフロリゲン活性化複合体(florigen activation complex:FAC)と名づけた.
14-3-3は真核生物に広く保存されている分子量約30,000の酸性タンパク質である.14-3-3という名前は,ウシの脳に存在するタンパク質を網羅的に分類する際に,クロマトグラフィーによる画分番号14と電気泳動での移動位置3.3に存在するタンパク質を14-3-3と命名したことに由来する.14-3-3には複数の異なる分子種が存在し,それらのあいだでホモ二量体あるいはヘテロ二量体を形成する.14-3-3二量体はリン酸化セリン残基あるいはリン酸化スレオニン残基を認識してさまざまなタンパク質と結合し,その機能を制御する.14-3-3と結合するタンパク質の多くには,14-3-3により認識されるリン酸化セリン残基あるいはスレオニン残基の周囲に,共通するアミノ酸配列モチーフであるモード1(Arg-X-X-pSer-X-Pro)あるいはモード2(R-X-X-X-pSer-X-Pro)が見い出される.
フロリゲン活性化複合体の場合,14-3-3とOsFD1との結合はSAPモチーフ中のリン酸化セリン残基の認識による,14-3-3に典型的にみられる結合であった.それに対して,14-3-3とHd3aとの結合はリン酸化に非依存的な新規な結合であった.そして,この結合様式が,14-3-3がOsFD1とHd3aの両方に同時に結合することを可能にしていた.フロリゲン活性化複合体を構成する3つのタンパク質の相互作用面を詳細にみたところ,OsFD1と14-3-3との相互作用においては,OsFD1のリン酸化されたSer192が14-3-3の塩基性のリン酸化ペプチド結合ポケットにはまり込み,さらに,SAPモチーフの全体も認識されていた(図3c).一方,14-3-3とHd3aとの相互作用は,Hd3aの中央ループ領域に存在する2つの突き出たアルギニン残基Arg64とArg132が14-3-3の上部にある酸性のくぼみにはまり込み,さらに,Hd3aの本体は14-3-3のC末端側のへリックスのあいだにある疎水性の溝と広く相互作用していた(図3c).イネのフロリゲン活性化複合体において観察されたHd3aと14-3-3,14-3-3とOsFD1の相互作用部位は,ともにイネ以外の高等植物のFT,14-3-3,FDにおいても高度に保存されていた6).シロイヌナズナにおいて,FTと14-3-3との相互作用もすでに報告されている20).以上から,フロリゲン,14-3-3,転写因子FDによる複合体の形成は高等植物の花成の制御において共通して存在し,フロリゲンがすべての植物に共通にはたらく分子基盤になっていると考えられた.
植物の細胞において,フロリゲン活性化複合体はイネOsMADS15遺伝子やシロイヌナズナAP1遺伝子など花芽形成遺伝子のプロモーター領域に結合し転写を活性化していると考えられる6,13).シロイヌナズナAP1遺伝子プロモーターの解析からは,Cボックス配列を含む特定の領域を欠損させるとFTとFDに対する応答能が失われることが報告されている6,13).また,in vitroにおいてイネのフロリゲン活性化複合体とCボックス配列とが結合しうることがゲルシフトアッセイにより明らかにされている13).完全長のFDと標的となるDNAを含むフロリゲン活性化複合体の結晶構造解析の例はまだないが,既知である動物のbZIP型の転写因子CREBとDNAとの複合体の構造をもとに作製されたフロリゲン活性化複合体とDNAとの複合体のモデル構造(図3b)では,Hd3aとOsFD1とは直接に結合することなく,Hd3aは14-3-3とOsFD1をDNAに安定に保持するよう位置していた.したがって,Hd3aはフロリゲン活性化複合体の安定化にも寄与している可能性が考えられた.
5.フロリゲン活性化複合体の形成機構:フロリゲン受容体としての14-3-3
イネのプロトプラストを用いてフロリゲン活性化複合体が細胞において構築される機構が詳細に調べられた6).GFPなどの蛍光タンパク質との融合によりフロリゲン活性化複合体の個々の構成タンパク質の細胞内での局在を観察した場合,Hd3aは核と細胞質に,14-3-3はほとんどが細胞質に,OsFD1は核のみに局在しており,フロリゲン活性化複合体モデルにおいて複合体を形成するはずの3つのタンパク質の局在はそれぞれ異なっていた(図4a).つぎに,複合体の細胞内における局在が二分子蛍光補間(bimolecular fluorescence complementation:BiFC)法により調べられた.BiFC法は,相互作用能を調べようとする2つのタンパク質のそれぞれに2分割した蛍光タンパク質を融合させ,2つのタンパク質が相互作用すると蛍光タンパク質の立体構造が再構成されて蛍光が観察される,という原理による手法である.BiFC法によりHd3a-14-3-3複合体の形成は細胞質において検出された(図4a).ところが,そこにさらにCFP-OsFD1融合タンパク質を共発現させると,Hd3a-14-3-3複合体はOsFD1に依存的に細胞質から核へと局在を変え,3つのタンパク質が核に集まることが観察された(図4a).そして,BiFC法においても,Hd3a-OsFD1複合体は核において検出された.また,シロイヌナズナにおいてもFT-FD複合体のBiFCシグナルは核において検出される.これらを考えあわせると,14-3-3は細胞質においてHd3aと最初に結合するフロリゲン受容体として機能し,Hd3a-14-3-3複合体は核へと移行してOsFD1と相互作用すると考えられた(図4b).
ここまで紹介したどの実験方法も,フロリゲン活性化複合体を構成するタンパク質の2因子間の相互作用を明らかにするものであり,3因子が“同時に”ひとつの複合体に存在することを示すものではない.筆者らのグループは,BiFC法と蛍光共鳴エネルギー転移/蛍光寿命測定(fluorescence resonance energy transfer/fluorescent lifetime imaging:FRET/FLIM)法とを組み合わせた手法により,この点を明らかにすることを試みた.FRET/FLIM法は,2分子のあいだの蛍光共鳴エネルギー移動(FRET)による蛍光寿命の変化を観測することにより,その2分子が近接しているかどうかを定量的に評価する手法である.具体的には,Hd3aと14-3-3との相互作用をBiFC法により検出し,さらに,BiFC法において再構成された蛍光タンパク質VenusとCFP-OsFD1融合タンパク質との相互作用をFRET/FLIM法により検出することで,3つのタンパク質からなる複合体の検出を試みた.解析の結果は,生細胞においても3つのタンパク質からなるフロリゲン活性化複合体は核において形成されていることを強く示唆した6).
モデル(図3b)では,細胞質において形成されたHd3a-14-3-3複合体がいかにして核に存在するOsFD1と相互作用するのか,まだ説明できていない.これについては今後の解析課題であるが,現在のところ,つぎのような仮説が有力である.すなわち,細胞質において翻訳されたOsFD1が細胞質のHd3a-14-3-3複合体と相互作用し,形成されたフロリゲン活性化複合体はOsFD1のもつ核局在シグナルのはたらきにより核へと移行する,というものである21).この仮説をサポートする知見として,14-3-3のもつHd3a結合領域は14-3-3の核外移行シグナルと重なっており,Hd3aとの結合によりその機能は阻害されると予想されることがあげられる.もうひとつ,ごく最近になり得られたOsFD2についての知見がある21).OsFD2は葉の発生制御に関与するbZIP型の転写因子で,そのSAPモチーフ類似配列を介して14-3-3と結合し,Hd3aとフロリゲン活性化複合体を形成することができる21).OsFD1と比較すると核局在シグナルの配列に大きな違いがみられ,おそらくそのために,核への局在の効率はOsFD1に比べ著しく低い21).しかし,そのSAPモチーフ類似配列に変異を導入して14-3-3との結合能を喪失させたり,Hd3aを共発現させてフロリゲン活性化複合体を形成させたりすると,OsFD2の核への局在の効率は著しく上昇した21).この観察結果は,さきに述べた仮説によりうまく説明できるものである.
6.フロリゲン活性化複合体の機能
Hd3aの下流の標的遺伝子としてOsMADS15遺伝子が報告されている14).OsMADS15遺伝子はMADSボックス遺伝子ファミリーのうちAP1遺伝子サブファミリーに属する.シロイヌナズナにおいて,AP1遺伝子は花器官の形成のABCモデルにおいてクラスA遺伝子として機能するだけでなく,花成において花芽分裂組織決定遺伝子としても機能し,FTとFDにより正に制御されることが明らかにされている12,13).最近になり,イネのAP1遺伝子サブファミリーの3つのメンバー,OsMADS14遺伝子,OsMADS15遺伝子,OsMADS18遺伝子と,SEP遺伝子サブファミリーのメンバーであるPAP2遺伝子(OsMADS34遺伝子)の四重変異体では,生殖成長への相転換が起こらないことが示された22).そこで,OsMADS15遺伝子の活性化を花成のマーカーとして,花成におけるHd3a,14-3-3,OsFD1の3者の相互作用の重要性が詳細に調べられた6).一過的発現実験において,OsMADS15 mRNAの量はHd3a遺伝子およびOsFD1遺伝子をともに発現させた場合にのみ増加した.しかし,14-3-3との相互作用を欠損する変異を導入したHd3a遺伝子,あるいは,14-3-3との相互作用を欠損する変異を導入したOsFD1を発現させた場合には,OsMADS15 mRNAの発現の上昇はほとんど観察されなかった.ここで注意すべき点は,プロトプラストには内在性の14-3-3が大量に発現していることである.そのため,14-3-3の一過的な発現の有無はOsMADS15 mRNAの発現上昇にほとんど影響しなかった.そこで,イネのゲノムにHd3aと結合の可能な14-3-3をコードする遺伝子は4つ存在するが,それらに対しRNAiベクターを導入することによりHd3aと結合の可能な14-3-3の発現をすべてノックダウンしたところ,Hd3a遺伝子およびOsFD1の発現に依存したOsMADS15遺伝子の活性化は抑制された.以上の実験結果は,フロリゲン活性化複合体の形成は下流の標的遺伝子の活性化に必須であることを示唆した.
さらに,多数の形質転換イネを用いた実験から,フロリゲン活性化複合体の形成は実際に花芽の形成において必要であることが明らかになった6).Hd3a遺伝子を過剰発現する形質転換イネでは,その出穂は顕著に促進されたが5,6),14-3-3との相互作用を欠損した変異Hd3a遺伝子の過剰発現ではその花成の促進機能は失われた6).また,OsFD1の発現をRNAi法によりノックダウンすると,シロイヌナズナfd変異体12,13) やトウモロコシdlf1変異体23) と同様に,花成は遅延した.そして,OsFD1を過剰発現させると花成は促進された.ただし,このOsFD1の過剰発現による花成の促進効果は,14-3-3と恒常的に結合の可能なリン酸化模倣変異を導入したOsFD1にのみ顕著であった.このことは,OsFD1の花成の制御への関与とともに,OsFD1のリン酸化の制御も重要な制御要因のひとつであることを示唆した.
花芽形成遺伝子の活性化におけるフロリゲン活性化複合体の重要性は明らかになったが,フロリゲン活性化複合体がどのような分子機構により下流の標的遺伝子の転写を活性化しているのかはまだ明らかにされていない.OsFD1/FDはbZIP型の転写因子であるが,単独では下流の標的遺伝子を活性化しない.また,OsFD1やHd3a/FTには転写因子に典型的にみられる酸性領域のようなドメインはみあたらない.FTの詳細なドメイン解析からは,セグメントBとよばれるループ領域とアニオン結合ポケット領域が花成の促進機能に重要であることが明らかにされている19,24).これらの領域は,フロリゲン活性化複合体の構造モデルではその表面に露出していることから(図3b),これらの領域に未同定の転写活性化因子がリクルートされることにより下流の標的遺伝子の転写活性化がひき起こされるのではないかと予想されている6).
7.フロリゲンの多様な機能とフロリゲン活性化複合体
光周性反応は植物のさまざまな生理現象にかかわっていることが古くから知られている.ジャガイモの塊茎(イモ)の形成が短日条件で誘導される現象はその代表的な例である.塊茎の形成においても,葉において合成される仮想の塊茎形成ホルモン(チューベリゲン)が形成を誘導するという説が提唱された25).ここでは,つぎのような実験から,チューベリゲンがフロリゲンと同一の物質である可能性について報告された(図5a).花成における日長条件の異なるタバコ品種(短日性,長日性,中日性)とジャガイモとを接ぎ木し,台木であるジャガイモにおける塊茎の形成を調べたところ,形成が観察されたのはいずれの接ぎ木実験の場合においても穂木であるタバコの花成が誘導されているときのみであった25).このことは,異なる植物種でつくられた花成を誘導する物質が接ぎ木により伝達され,ジャガイモにおいて塊茎の形成を誘導できることを示唆した.
筆者らは最近になり,イネのフロリゲンをコードするHd3a遺伝子をジャガイモにおいて過剰発現させると,本来は塊茎の形成が誘導されない長日条件においても塊茎が形成されることを見い出した26).この過剰発現の効果は接ぎ木の伝達性を示すことから,フロリゲンがチューベリゲンとしても機能していることが強く示唆された.最近の研究から,このような花成の制御のほかのフロリゲンの機能が明らかにされはじめている.例をあげると,ポプラの短日条件における成長の停止と休眠芽の形成27),テンサイ(サトウダイコン)における花成の抑制28),トマトやトウモロコシにおける形態形成29,30),シロイヌナズナにおける気孔開閉の制御31),トマトにおける果実収量32) において,FT遺伝子のホモログのかかわっていることが報告されている.ポプラの場合,2つの異なるFT遺伝子ホモログ,PtFT1遺伝子とPtFT2遺伝子が役割を分担して栄養成長および生殖成長を制御している27).PtFT1遺伝子は冬のおわりに発現し生殖成長の開始の決定にかかわるのに対し,PtFT2遺伝子は栄養成長期に発現し栄養成長や休眠芽の休眠の阻害を促進すると考えられている.テンサイの場合,2つの異なるFT遺伝子ホモログのうち,BvFT2遺伝子は花成の促進に必須であるのに対し,BvFT1遺伝子は花成の抑制にはたらき,その発現の減少が春化による花成に重要である28).トマトの場合,FT遺伝子のホモログであるSFT遺伝子は,花成のみならず葉の形態を含めた,より一般的な形態形成制御遺伝子として機能している29).さらに,その遺伝子量が果実収量にも重要であることが報告されている32).ここで重要な点は,Hd3aにおいて14-3-3との結合にかかわるアミノ酸残基は,ここにあげたどのFTホモログにおいても高度に保存されていたことである.したがって,これらのFTホモログも14-3-3と結合できると考えられる.ひとつの魅力的な仮説は,イネのフロリゲン活性化複合体における転写因子OsFD1が,14-3-3と相互作用できる別の転写因子に置き換わったかたちでフロリゲン活性化複合体様の複合体が形成され,花芽形成関連遺伝子とは異なる標的遺伝子の発現制御がなされている,というものである(図5b).このような転写因子の候補として,フロリゲン活性化複合体の形成能をもつが花成ではなく葉の形成制御にかかわると考えられるOsFD2があげられよう21).
興味深いのは,機能的に拮抗するFT遺伝子のホモログにおいては構造にも違いがみられることである.一般に,花成の促進にはたらくFTホモログのアミノ酸配列は非常に高度に保存されているが,PtFT2やBvFT1のもつセグメントB領域には一般的なコンセンサス配列と比較してアミノ酸配列の置換がみられる.セグメントB領域は,さきに述べたように,フロリゲンによる下流遺伝子の転写活性化に重要な領域である.BvFT1のセグメントB領域にみられるアミノ酸に置換の導入された変異BvFT2は,花成促進から花成抑制へと機能転換した27).これについては,セグメントBの違いにより異なる転写活性化因子が結合することで機能の変換が起こった可能性が考えられよう.
8.花成リプレッサーTFL1とフロリゲン活性化複合体
花成リプレッサー遺伝子TERMINAL FLOWER1(TFL1)は,早咲きと花序の有限成長の表現型を示すシロイヌナズナ変異体から同定された33).tfl1変異体は早咲きとなり,花序分裂組織が花に変換されるため頂端に花が形成され有限花序となるが,TFL1遺伝子を過剰発現させると逆に遅咲きとなり無限成長性が強調されるようになる.筆者らのグループも,TFL1遺伝子のイネにおけるホモログであるRCN遺伝子の過剰発現が花成の抑制にはたらくことを報告している34).また最近になって,多年生植物の花成の抑制35) やバラやイチゴにみられる四季咲き36) の原因遺伝子としてTFL1遺伝子のホモログが報告されており,開花の季節性におけるTFL1遺伝子ホモログの重要性が明らかにされてきている.これらの知見は,TFL1/RCN遺伝子が花成に関してFT/Hd3a遺伝子とは正反対にはたらくことを示している.ところが,TFL1/RCNはFT/Hd3aと同様にホスファチジルエタノールアミン結合タンパク質ファミリーに属することから,FT/Hd3aとTFL1/RCNは花成の制御の共通した経路において拮抗的にはたらくと考えられてきた9,10,19,24).
FT遺伝子とTFL1遺伝子との拮抗的な機能の分化については,それらの産物であるタンパク質の構造情報をもとにした先駆的な解析がなされている.アニオン結合ポケット領域の周辺に位置するFTのTyr85(Hd3aではTyr87)がFTサブファミリーにおいて,TFL1のHis88がTFL1サブファミリーにおいて,完全に保存されていることから,これらのアミノ酸残基の置換実験が行われた24).その結果,FTのTyr85をHisに置換するとFT過剰発現体と比べ遅咲きになった.一方,FT遺伝子とTFL1遺伝子のキメラ遺伝子の花成に対する効果が網羅的に調べられ,セグメントB領域がFT遺伝子とTFL1遺伝子のと特異性をもたらすことが明らかにされた19).セグメントB領域はFTとTFL1の結晶構造を比較したとき大きく異なっているループ領域に相当する.これらの結果は,アニオン結合ポケット領域やセグメントB領域の違いがFTとTFL1との機能の分化に重要であることを示唆した19,24).
ここで重要な点は,Hd3aにおいて14-3-3との結合にかかわるアミノ酸残基はTFL1/RCNサブファミリーにおいても高度に保存されている点である6).実際,シロイヌナズナやトマトのTFL1ホモログが14-3-3と相互作用することがすでに報告されている20).TFL1/RCNによる花成の抑制の分子機構について,花成の促進におけるフロリゲン活性化複合体モデルをもとにしたつぎのような仮説が考えられる.すなわち,栄養成長期にはフロリゲン活性化複合体のフロリゲンの位置にTFL1/RCNが入り込んだ花成抑制複合体(flowering repression complex:FRC)が形成され花芽形成遺伝子の転写を抑制しているが,フロリゲンが茎頂に到達すると,花成抑制複合体のTFL1/RCNがフロリゲンと置換されてフロリゲン活性化複合体へと転換し,花芽形成遺伝子の転写が促進され花成が誘導される(図5c).また,茎頂分裂組織においてTFL1/RCNが転写因子と14-3-3との複合体をフロリゲンと競合することによりフロリゲンの活性のバランスを制御し,無限成長性を維持するのにかかわっている可能性も考えられる(図5c).このモデルにおいて,フロリゲンの機能の抑制にはTFL1/RCNが14-3-3と結合することによりフロリゲンがフロリゲン活性化複合体を形成するのを阻害するだけでも十分であると考えられるが,花成抑制複合体においてTFL1/RCNのアニオン結合ポケット領域やセグメントB領域に転写制御コリプレッサーが結合して花成遺伝子の転写をより積極的に抑制している可能性もある37).
おわりに
これまでに得られた知見を総合すると,フロリゲンであるHd3a/FTは葉で合成されたのち,維管束をとおって茎頂まで長距離移動し,茎頂細胞の細胞質において14-3-3に受容されHd3a/FT-14-3-3複合体を形成する.そののち,Hd3a/FT-14-3-3複合体は核へと移行し,FDとさらに高次の複合体であるフロリゲン活性化複合体を形成して花芽形成遺伝子の転写を活性化させ,花成を開始させると考えられる.FTは単なる“花成”ホルモンにとどまらず,ジャガイモにおける塊茎の形成を含むさまざまな形態形成を制御する,移動性の多機能ホルモンであると認識されるようになってきた.この多機能性を担う分子基盤として,フロリゲン活性化複合体の構成タンパク質の交換モデルが考えられる.
フロリゲンの理解を進めるうえでは,つぎのような重要な課題が残されている.ひとつは,フロリゲン活性化複合体に結合する転写活性化因子の同定や,DNAを含めた完全なフロリゲン活性化複合体の立体構造の決定である.これにより,フロリゲンの生化学的な役割やフロリゲン活性化複合体の形成を規定する構造的な要因が明らかになるだろう.そのつぎの課題は,フロリゲンの多機能性の分子機構を明らかにすることである.まずはフロリゲン活性化複合体モデルから予想されるような転写因子の探索が急務であろう.フロリゲンの長距離移動における分子機構の理解も重要である.最近になり,FTの篩管伴細胞から篩部要素への移行にかかわるタンパク質としてFTIP1というC2ドメインタンパク質が報告された38).しかし,FTIP1によるFT輸送の分子機構は明らかにされていない.さらに,篩部要素から茎頂分裂組織の細胞への輸送機構は不明のままである.また,フロリゲンによる花成の制御の際に茎頂分裂組織においてどのような変化がひき起こされているのか,すなわち,茎頂分裂組織における幹細胞の成長相の転換過程の全体像を理解する必要がある.これには,エピゲノムや小分子RNA,トランスクリプトーム変化の網羅的な解析が有力な切り口となるだろう.また,フロリゲンの生細胞イメージングと発現解析とを組み合わせることにより,フロリゲンによる茎頂分裂組織の空間的な制御の理解が進むだろう.
フロリゲンの研究は基礎科学だけにとどまらない.植物の花成を人為的に制御する技術は農業において非常に有用である.ただし,“花咲か爺さん”の話にあるように,フロリゲンをただ植物にふりかけただけでは何も起こらないだろう.なぜなら,フロリゲンの受容体は細胞内にあるが,フロリゲン自体は細胞膜を通過できないタンパク質だからである.フロリゲンの投与による花成の制御には植物の細胞内にフロリゲンを取り込ませる手法の開発が必要となるだろう.別のアプローチとして,フロリゲン活性化複合体の構造情報を活用し,その活性を制御できるような低分子化合物を開発することも可能だろう.
このように,フロリゲン活性化複合体モデルを基盤としたフロリゲンの制御機構の解明は,基礎研究としての重要性にとどまらず,作物の生産において重要な形質の改良にもつながるものと期待される.
文 献
- Chailakhyan, M. K.: New facts in support of the hormonal theory of plant development. C. R. Acad. Sci. URSS, 13, 79-83 (1936)
- Zeevaart, J. A.: Leaf-produced floral signals. Curr. Opin. Plant Biol., 11, 541-547 (2008)[PubMed]
- 瀧本 敦: 花を咲かせるものは何か:花成ホルモンを求めて. 中央公論社 (1998)
- Corbesier, L., Vincent, C., Jang, S. et al.: FT protein movement contributes to long-distance signaling in floral induction of Arabidopsis. Science, 316, 1030-1033 (2007)[PubMed]
- Tamaki, S., Matsuo, S., Wong, H. L. et al.: Hd3a protein is a mobile flowering signal in rice. Science, 316, 1033-1036 (2007)[PubMed]
- Taoka, K., Ohki, I., Tsuji, H. et al.: 14-3-3 proteins act as intracellular receptors for rice Hd3a florigen. Nature, 476, 332-397 (2011)[PubMed] [新着論文レビュー]
- Garner, W. W. & Allard, H. A.: Effect of the relative length of day and night and other factors of the environment on growth and reproduction in plants. J. Agric. Res., 18, 553-606 (1920)
- 海老原史樹文, 井毅 毅 (編): 光周性の分子生物学. シュプリンガー・ジャパン (2009)
- Kobayashi, Y., Kaya, H., Goto, K. et al.: A pair of related genes with antagonistic roles in mediating flowering signals. Science, 286, 1960-1962 (1999)[PubMed]
- Kardailsky, I., Shukla, V. K., Ahn, J. H. et al.: Activation tagging of the floral inducer FT. Science, 286, 1962-1965 (1999)[PubMed]
- Takada, S. & Goto, K.: TERMINAL FLOWER2, an Arabidopsis homolog of HETEROCHROMATIN PROTEIN1, counteracts the activation of FLOWERING LOCUS T by CONSTANS in the vascular tissues of leaves to regulate flowering time. Plant Cell, 15, 2856-2865 (2003)[PubMed]
- Abe, M., Kobayashi, Y., Yamamoto, S. et al.: FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex. Science, 309, 1052-1056 (2005)[PubMed]
- Wigge, P. A., Kim, M. C., Jaeger, K. E. et al.: Integration of spatial and temporal information during floral induction in Arabidopsis. Science, 309, 1056-1059 (2005)[PubMed]
- Komiya, R., Ikegami, A., Tamaki, S. et al.: Hd3a and RFT1 are essential for flowering in rice. Development, 135, 767-774 (2008)[PubMed]
- Notaguchi, M., Abe, M., Kimura, T. et al.: Long-distance, graft-transmissible action of Arabidopsis FLOWERING LOCUS T protein to promote flowering. Plant Cell Physiol., 49, 1645-1658 (2008)[PubMed]
- Lin, M. K., Belanger, H., Lee, Y. J. et al.: FLOWERING LOCUS T protein may act as the long-distance florigenic signal in the cucurbits. Plant Cell, 19, 1488-1506 (2007)[PubMed]
- Andres, F. & Coupland, G.: The genetic basis of flowering responses to seasonal cues. Nat. Rev. Genet., 13, 627-639 (2012)[PubMed]
- Tsuji, H., Taoka, K. & Shimamoto, K.: Regulation of flowering in rice, two florigen genes, a complex gene network, and natural variation. Curr. Opin. Plant Biol., 14, 45-52 (2011)[PubMed]
- Ahn, J. H., Miller, D., Winter, V. J. et al.: A divergent external loop confers antagonistic activity on floral regulators FT and TFL1. EMBO J., 25, 605-614 (2006)[PubMed]
- Pnueli, L., Gutfinger, T., Hareven, D. et al.: Tomato SP-interacting proteins define a conserved signaling system that regulates shoot architecture and flowering. Plant Cell, 13, 2687-2702 (2001)[PubMed]
- Tsuji, H., Nakamura, H., Taoka, K. I. et al.: Functional diversification of FD transcription factors in rice, components of florigen activation complexes. Plant Cell Physiol., 54, 385-397 (2013)[PubMed]
- Kobayashi, K., Yasuno, N., Sato, Y.: et al.: Inflorescence meristem identity in rice is specified by overlapping functions of three AP1/FUL-like MADS box genes and PAP2, a SEPALLATA MADS box gene. Plant Cell, 24, 1848-1859 (2012)[PubMed]
- Muszynski, M. G., Dam, T., Li, B. et al.: delayed flowering1 Encodes a basic leucine zipper protein that mediates floral inductive signals at the shoot apex in maize. Plant Physiol., 142, 1523-1536 (2006)[PubMed]
- Hanzawa, Y., Money, T., Bradley, D.: A single amino acid converts a repressor to an activator of flowering. Proc. Natl. Acad. Sci. USA, 102, 7748-7753 (2005)[PubMed]
- Chailakhyan, M. K., Yanina, L. I., Devedzhyan, A. G. et al.: Photoperiodism and tuber formation in grafting of tobacco onto potato. Dokl. Akad. Nauk SSSR, 257, 1276-1280 (1981)
- Navarro, C., Abelenda, J. A., Cruz-Oro, E. et al.: Control of flowering and storage organ formation in potato by FLOWERING LOCUS T. Nature, 478, 119-132 (2011)[PubMed]
- Hsu, C. Y., Adams, J. P., Kim. H. et al.: FLOWERING LOCUS T duplication coordinates reproductive and vegetative growth in perennial poplar. Proc. Natl. Acad. Sci. USA, 108, 10756-10761 (2011)[PubMed]
- Pin, P. A., Benlloch, R., Bonnet, D. et al.: An antagonistic pair of FT homologs mediates the control of flowering time in sugar beet. Science, 330, 1397-1400 (2010)[PubMed]
- Shalit, A., Rozman, A., Goldshmidt, A. et al.: The flowering hormone florigen functions as a general systemic regulator of growth and termination. Proc. Natl. Acad. Sci. USA, 106, 8392-8397 (2009)[PubMed]
- Danilevskaya, O. N., Meng, X., McGonigle, B. et al.: Beyond flowering time, pleiotropic function of the maize flowering hormone florigen. Plant Signal. Behav., 6, 1267-1270 (2011)[PubMed]
- Kinoshita, T., Ono, N., Hayashi, Y. et al.: Flowering Locus T regulates stomatal opening. Curr. Biol., 21, 1232-1238 (2011)[PubMed]
- Krieger, U., Lippman, Z. B. & Zamir, D.: The flowering gene SINGLE FLOWER TRUSS drives heterosis for yield in tomato. Nat. Genet., 42, 459-463 (2010)[PubMed]
- Bradley, D., Ratcliffe, O., Vincent, C. et al.: Inflorescence commitment and architecture in Arabidopsis. Science, 275, 80-83 (1997)[PubMed]
- Nakagawa, M., Shimamoto, K., Kyozuka, J.: Overexpression of RCN1 and RCN2, rice TERMINAL FLOWER 1/CENTRORADIALIS homologs, confers delay of phase transition and altered panicle morphology in rice. Plant J., 29, 743-750 (2002)[PubMed]
- Wang, R. H., Albani, M. C., Vincent, C. et al.: Aa TFL1 confers an age-dependent response to vernalization in perennial Arabis alpina. Plant Cell, 23, 1307-1321 (2011)[PubMed]
- Iwata, H., Gaston, A., Remay, A. et al.: The TFL1 homologue KSN is a regulator of continuous flowering in rose and strawberry. Plant J., 69, 116-125 (2012)[PubMed]
- Hanano, S. & Goto, K.: Arabidopsis TERMINAL FLOWER1 is involved in the regulation of flowering time and inflorescence development through transcriptional repression. Plant Cell, 23, 3172-3184 (2011)[PubMed]
- Liu, L., Liu, C., Hou, X. L. et al.: FTIP1 is an essential regulator required for florigen transport. PLoS Biol., 10, e1001313 (2012)[PubMed]
参考図書
田岡健一郎, 大木 出, 辻 寛之 他: 花成ホルモンフロリゲンとその受容体の構造解析からみえてきたフロリゲン機能の分子基盤. 化学と生物, 50, 654-659 (2012)
著者プロフィール
略歴:奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:フロリゲンが花を咲かせる分子機構の解明,植物の成長相転換の全体像を理解する.
抱負:いろいろな切り口から植物科学,さらには,生命科学の基本的な問題を解明したい.理想的な作物の開発に直結する基礎研究を展開したい.
田岡 健一郎(Ken-ichiro Taoka)
略歴:奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:フロリゲンによる花成の分子機構の解明.
抱負:フロリゲンの基礎研究を発展させて“フロリゲン農業”へと展開させたい.
島本 功(Ko Shimamoto)
奈良先端科学技術大学院大学バイオサイエンス研究科 教授.
研究室URL:http://bsw3.naist.jp/simamoto/simamoto.html
© 2013 辻 寛之・田岡健一郎・島本 功 Licensed under CC 表示 2.1 日本