免疫系における恒常性の維持と制御性T細胞
2013/05/15
濱口真英・坂口志文
(大阪大学免疫学フロンティア研究センター 実験免疫学)
email:濱口真英
領域融合レビュー, 2, e005 (2013) DOI: 10.7875/leading.author.2.e005
Masahide Hamaguchi & Shimon Sakaguchi: Mechanisms of regulatory T cell mediated immune suppression.

免疫系における恒常性の維持においては,免疫抑制機能に特化した細胞系譜である制御性T細胞が重要である.制御性T細胞による免疫抑制の中心的な機序として,インターロイキン2の産生抑制,CD25の発現によるインターロイキン2の枯渇,CTLA-4の発現による抗原提示細胞の機能抑制がある.これらにくわえ,インターロイキン10の産生など副次的な抑制機能がはたらくと考えられている.最近の研究から,制御性T細胞は腫瘍免疫や移植免疫などにおけるさまざまな生理的あるいは病的な免疫応答の制御,また,免疫恒常性の維持に必須であることが明らかになってきた.今後,制御性T細胞を標的とした免疫疾患の治療法および予防法,また,免疫応答を亢進あるいは減弱させる手法の開発について迅速な進展が期待される.
正常な免疫系は病原微生物などの病原体に応答しこれを効果的に排除するが,個体を構成する生体分子,腸内細菌などの共生微生物,あるいは,環境物質に対しては応答しない.一方,自己を構成する分子に対する免疫不応答が破れ自己免疫応答が惹起されると,自己免疫疾患の発症にいたる.また,病原体に対する免疫応答であっても,それが過剰であれば組織の傷害をともない免疫病理学的な疾患の原因となる.たとえば,腸内細菌などの共生微生物や食餌抗原に対する過剰な免疫応答は炎症性腸疾患の原因のひとつである.また,花粉など免疫学的に無害な環境物質に対する過剰な免疫応答はアレルギー性疾患を惹起する.ここでは,このような免疫自己寛容あるいは免疫恒常性を維持する制御機構について,制御性T細胞の役割を中心に最近の考え方を解説する.
免疫系は“自己”と“非自己”の免疫学的な識別の機構と,それにもとづく免疫自己寛容の導入および免疫恒常性の維持の機構をもつ.免疫自己寛容とは自己抗原に対する免疫不応答をいう.このような免疫応答の代表的な機構として,自己反応性リンパ球の負の選択がある.胸腺においては,胸腺ストローマ細胞により提示される自己抗原ペプチドとNHC分子との複合体を未熟な自己反応性のT細胞が強く認識すると,このT細胞はアポトーシスにおちいる.すなわち,胸腺や骨髄といった中心性リンパ球産生器官では自己反応性リンパ球が負の選択により排除されている.しかしながら,すべての自己反応性リンパ球が排除されるわけではない.実際,自己抗原を強力なアジュバントとともに免疫すれば自己抗体あるいは自己反応性T細胞を容易に誘導できる.すなわち,潜在的に自己免疫疾患を起こしうる自己反応性リンパ球は,正常な個体の末梢免疫系に生理的な状態で存在する.このような自己反応性リンパ球の活性化および増殖を抑制する生理的な制御機構のひとつは,特定のT細胞による抑制的な制御である.
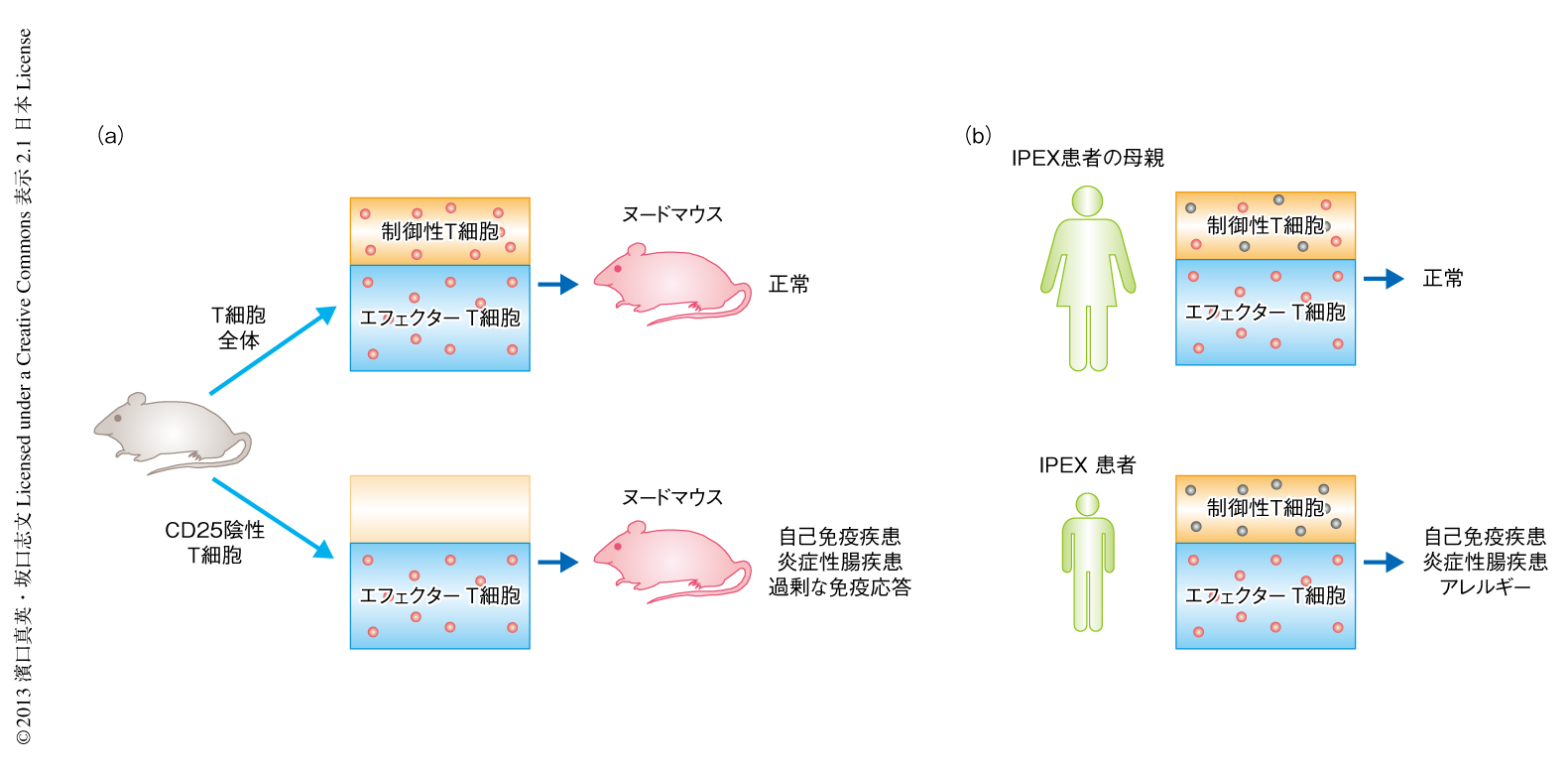
免疫応答の抑制的な制御機能に特化したT細胞が存在するか否か,存在するとしてもその異常がなんらかの免疫疾患の原因であるか否かに関しては,長く議論があった1).この仮説を直接的に証明する実験のひとつは,正常な動物から特定のT細胞の亜群を除去することにより自己免疫疾患などの免疫疾患を誘導できるか,除去したT細胞の亜群をおぎなうことでその免疫疾患の発症を抑制できるか,を検討することである.そのような試みとして,正常なマウスの脾臓から調製したT細胞からCD25(インターロイキン2受容体α鎖)を発現するCD4陽性T細胞を除去し,T細胞の欠損する同系のマウス(たとえば,先天的に胸腺を欠損するヌードマウス)に残りのT細胞を移入すると,移入から2~3カ月で自己免疫性甲状腺炎,自己免疫性胃炎,I型糖尿病などさまざまな自己免疫疾患が高率に自然発症することが示された(図1a).この自己免疫疾患の発症は,少数のCD25陽性CD4陽性T細胞の同時移入により完全に阻止された.このような自己免疫疾患の発症阻止能をもつCD25陽性CD4陽性T細胞は,正常な個体において末梢のCD4陽性T細胞の約10%をしめており,制御性T細胞と名づけられた2).また,CD25陽性CD4陽性制御性T細胞は正常な胸腺において機能的に成熟した状態で産生される.すなわち,正常な胸腺は,自己免疫疾患を惹起しうる自己反応性T細胞のみならず,その活性化および増殖を抑制する制御性T細胞をも産生する.免疫自己寛容は,自己反応性T細胞に対する負の選択にくわえ,制御性T細胞による能動的な抑制により維持されている3).
免疫系に内在するCD25陽性CD4陽性制御性T細胞の重要な特徴として,転写因子Foxp3を特異的に発現しており,Foxp3の欠損あるいは突然変異により制御性T細胞の発生および分化,また,抑制機能が障害されることがある.Foxp3遺伝子は致死性の自己免疫および炎症性疾患を自然発症するScurfyマウスの原因遺伝子としてポジショナルクローニング法によりX染色体において同定され,つづいて,あとでのべるヒトIPEX症候群の原因遺伝子であることが示されたものである4).また,正常なT細胞でもFoxp3を異所性に発現させることにより免疫抑制機能が発揮されるという実験結果から,Foxp3遺伝子は制御性T細胞の発生および機能におけるマスター遺伝子であると考えられている5-7).
制御性T細胞の存在は動物実験により証明されたが,制御性T細胞が免疫自己寛容あるいは免疫恒常性の維持に不可欠な役割をはたしていることの直接的な証拠は,X染色体伴性劣性の遺伝疾患であるIPEX(immune dysregulation, polyendocrinopathy, enteropathy, X-linked,X染色体連鎖免疫制御異常多発性内分泌障害消化器病)症候群の存在である.この単一の遺伝子変異による稀少性の遺伝疾患では,I型糖尿病が80%,自己免疫性甲状腺炎が70%,そのほか,溶血性貧血,血小板減少性紫斑病などさまざまな自己免疫疾患が生後3年以内に発症する.ほとんど全例において炎症性腸炎が発症し,また,高免疫グロブリンE血症,アレルギー性皮膚炎,食物アレルギーがみられる.IPEX症候群の原因遺伝子はさきに述べたFOXP3遺伝子である.FOXP3遺伝子に突然変異が生じるとその大半において制御性T細胞の発生が阻害され,その結果,自己抗原および非自己抗原に対する免疫応答の制御が異常をきたす8)(図1b).
転写因子Foxp3による遺伝子発現の制御機構の解明は,胸腺で産生される制御性T細胞の発生および機能の理解のみならず,人工的にFoxp3陽性制御性T細胞を作製するうえでも重要である.実際,マウスのナイーブCD4陽性T細胞をTGFβの存在下において抗原により刺激するとFoxp3を発現し,機能および表現型において内在性の制御性T細胞に類似した誘導性制御性T細胞を実験的に作製できる.しかし,内在性の制御性T細胞と誘導性制御性T細胞とは機能的に完全には同一ではないことも示されている8,9).内在性の制御性T細胞と誘導性制御性T細胞との最大の差異は,T細胞受容体の抗原特異性とFoxp3発現の安定性である.すなわち,誘導性制御性T細胞は自己抗原に対する親和性の低いナイーブCD4陽性T細胞から分化させるため,おのずと自己認識能も低くなる.このことは,自己免疫疾患の細胞療法として誘導性制御性T細胞を用いることにおいては不利にはたらくが,一方,移植片に対する免疫寛容を目標とした細胞療法では有利にはたらくかもしれない.しかし,誘導性制御性T細胞におけるFoxp3の発現は不安定であり,このことが臨床への応用をはばんでいる9).
近年の研究により,誘導性制御性T細胞におけるFoxp3発現の不安定性は,おもにFoxp3遺伝子のエピジェネティックな制御の違いに由来すると理解されている9-12).エピジェネティクスとは,DNA塩基配列の変化をともなわず細胞分裂ののちも継承される遺伝子発現あるいは表現型の変化と定義され,遺伝子発現のエピジェネティックな制御とは,DNAの配列は変化することなくDNAやクロマチンの修飾により遺伝子発現が制御されることである.近年,細胞系譜に特異的な遺伝子発現制御は,転写因子による制御とエピジェネティックな制御に依存することが明らかになってきている.制御性T細胞におけるエピジェネティックな制御として,Foxp3をはじめとする制御性T細胞に特異的なさまざまな機能タンパク質をコードする遺伝子の発現制御領域において,制御性T細胞に特異的な脱メチル化領域の存在することがある.誘導性制御性T細胞ではFoxp3遺伝子をはじめとする制御性T細胞に特異的な遺伝子において,制御性T細胞に特異的な脱メチル化領域がメチル化されたままであり,このため,Foxp3遺伝子を含む制御性T細胞に特異的な遺伝子の発現は不安定である.現在では,制御性T細胞を人工的に誘導するには単にFoxp3を発現させればよいという段階は終了し,いかにFoxp3を安定的に発現させるかという段階に入っている.
また,ヒトのCD4陽性T細胞はT細胞受容体に強い刺激をうけると比較的容易にFOXP3を発現することが知られているが,このようなFOXP3陽性CD4陽性T細胞は制御性T細胞に特異的な脱メチル化領域が脱メチル化されておらず,FOXP3の発現は不安定であり,さらに,免疫抑制機能をもたない13).制御性T細胞に特異的なエピジェネティックな修飾を導入することにより,FOXP3の発現のみならず,機能的に安定な制御性T細胞を作製する手法の開発が望まれる.
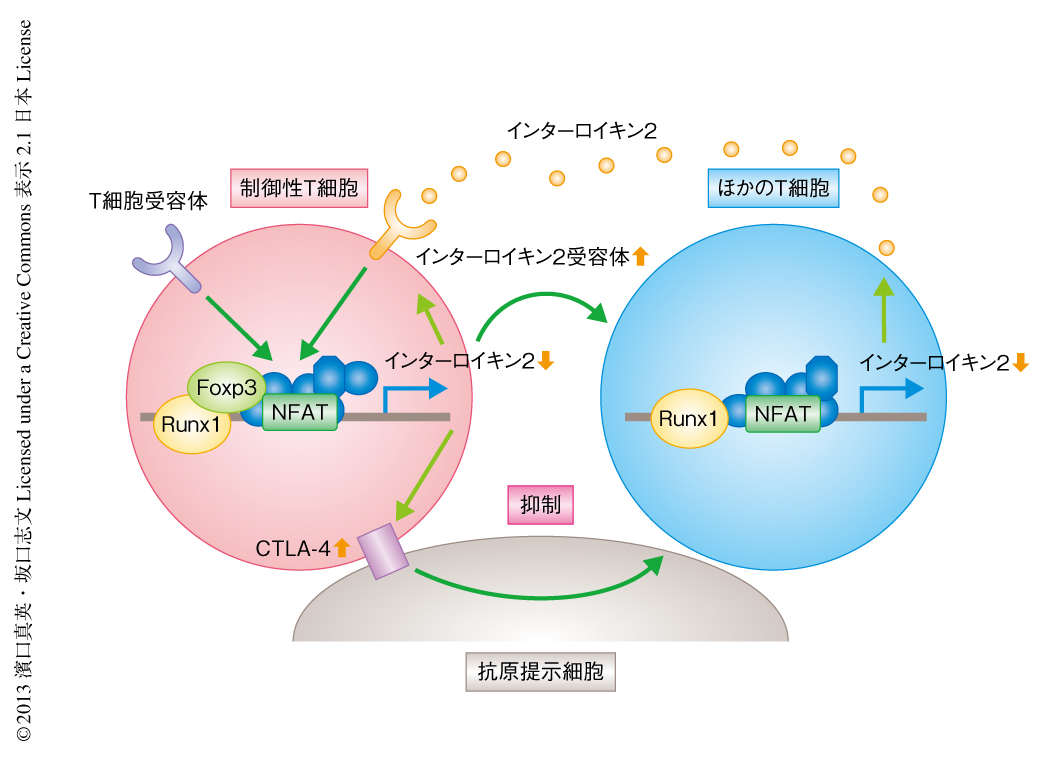
さきに述べたように,制御性T細胞はCD25(インターロイキン2受容体α鎖)を高発現している2).CD25は,インターロイキン2受容体β鎖であるCD122およびインターロイキン2受容体γ鎖であるCD132とともに,インターロイキン2受容体を構成する.制御性T細胞は,胸腺における産生のときからすでに高親和性のインターロイキン2受容体を発現する特異なT細胞である.一方,制御性T細胞では転写因子Foxp3がインターロイキン2遺伝子の発現を抑制している.その結果,制御性T細胞の生存の維持には,ほかの細胞により産生されるインターロイキン2が不可欠である.実際に,インターロイキン2ノックアウトマウスは制御性T細胞の異常により致死性の自己免疫性炎症を発症する14).また,正常な個体にインターロイキン2の中和抗体を投与すると,制御性T細胞が減少し自己免疫疾患が自然発症する15).したがって,CD25は制御性T細胞のよいマーカーであると同時に,制御性T細胞の機能に必須のタンパク質でもある.さらに,ほかのT細胞によりインターロイキン2が大量に産生されると,制御性T細胞が増殖し免疫抑制が亢進することにより,さらなる免疫反応が抑制される.すなわち,インターロイキン2は負のフィードバックによる免疫制御を媒介している(図2).
制御性T細胞は複数の機序により免疫抑制能を発揮するが,制御性T細胞の免疫抑制機能の根幹は抗原提示細胞によるT細胞活性化の抑制である.ナイーブT細胞は抗原提示細胞,とくに樹状細胞の提示する抗原によるT細胞受容体への刺激(シグナル1)と,抗原提示細胞に発現するCD80/CD86によるCD28への副刺激(シグナル2)により活性化され,インターロイキン2を産生し増殖する.制御性T細胞の重要な特徴として,CD28の分子ホモログであるCTLA-4をつねに高発現していることがある16).CTLA-4はCD28と同じくCD80/CD86と結合する.結合の親和性はCTLA-4のほうがCD28より20倍も高い.制御性T細胞に発現するCTLA-4は抗原提示細胞においてCD80/CD86の発現を抑制する.その結果,抗原提示細胞は抗原を提示しても副刺激を提供できないため,ほかのT細胞を活性化できない17)(図2).さらに,さきに述べたように,制御性T細胞は高親和性のインターロイキン2受容体を高発現し,周囲からインターロイキン2を受け取ることによりほかのT細胞の活性化および増殖に必要なインターロイキン2を奪い,抗原反応性のT細胞にアポトーシスを誘導する.さらに,制御性T細胞は特定の条件(たとえば,腸管粘膜)において免疫抑制性のサイトカインであるインターロイキン10を産生する.インターロイキン10はおもに抗原提示細胞の成熟を抑えることにより免疫抑制に関与する18).また,制御性T細胞は炎症のタイプに応じて免疫応答を制御することができる.たとえば,基本的な抑制活性を維持しつつ,Th1型の炎症(たとえば,インターフェロンγの産生)に応じて特定のケモカイン受容体(たとえば,CXCR3)を発現し,Th1反応の場に動員されてそこで免疫抑制能を発揮する.
制御性T細胞は免疫自己寛容の維持に必要なT細胞として発見された.のちの研究により,制御性T細胞がさまざまな生理的あるいは病的な免疫応答の制御,また,免疫恒常性の維持において必須であることが明らかになってきた4,19).たとえば,腫瘍免疫において腫瘍細胞に特異的なリンパ球の認識する腫瘍抗原の多くは正常な自己抗原である.したがって,制御性T細胞は免疫自己寛容を維持すると同時に,腫瘍に対する免疫監視機構を減弱あるいは阻害する.また,腫瘍組織では制御性T細胞が増加し,ときに腫瘍に浸潤したT細胞の大部分が制御性T細胞でしめられることもある.実際に,実験的に制御性T細胞を除去あるいは減少させることにより腫瘍に対する免疫応答を亢進させることができる.現在,制御性T細胞を標的とするがん免疫療法が開発されつつある.一方で,臓器移植の理想は,移植臓器に対し自己の臓器に対するのと同じく安定な免疫寛容を誘導することである.実際に,実験的に制御性T細胞を移植アロ抗原に特異的に増殖させることにより移植免疫寛容を誘導できる.さらに,ウイルス,細菌,寄生虫などによるさまざまな感染症において,制御性T細胞を除去あるいは減少させることにより免疫応答を実験的に亢進させることが可能である.また,さきのIPEX症候群にみられるように,制御性T細胞の機能異常により腸内常在細菌に対する過剰な免疫応答が惹起されることから,常在微生物との生理的な共生においても制御性T細胞は必須のはたらきをしているものと考えられる.一方,妊娠した母体がどのようにして胎仔に対する免疫寛容を維持しているのかの理解はいまだに免疫学の重要な課題であるが,妊娠した動物では胎盤に多くの制御性T細胞の集積がみられる.また,妊娠した動物から制御性T細胞を除去するととたんに流産が惹起される.したがって,胎児と母胎における免疫寛容において制御性T細胞が重要な役割をはたしているものと考えられる20).
ここでは,制御性T細胞の発見の歴史的な意義からはじめ,制御性T細胞を特徴づける転写因子Foxp3とエピジェネティックな制御,ならびに,免疫抑制の分子機構について,主要な項目にしぼり解説した.このような知見をもとに,今後,制御性T細胞を標的とした免疫疾患の治療法や予防法,また,免疫応答を亢進あるいは減弱する手法の開発について迅速な進展が期待される.
略歴:2009年 京都府立医科大学大学院医学研究科 修了,2013年より大阪大学免疫学フロンティア研究センター 助教.
研究テーマ:制御性T細胞の発生と機能発現の分子機構.
坂口 志文(Shimon Sakaguchi)
大阪大学免疫学フロンティア研究センター 教授.
© 2013 濱口真英・坂口志文 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 実験免疫学)
email:濱口真英
領域融合レビュー, 2, e005 (2013) DOI: 10.7875/leading.author.2.e005
Masahide Hamaguchi & Shimon Sakaguchi: Mechanisms of regulatory T cell mediated immune suppression.
要 約
免疫系における恒常性の維持においては,免疫抑制機能に特化した細胞系譜である制御性T細胞が重要である.制御性T細胞による免疫抑制の中心的な機序として,インターロイキン2の産生抑制,CD25の発現によるインターロイキン2の枯渇,CTLA-4の発現による抗原提示細胞の機能抑制がある.これらにくわえ,インターロイキン10の産生など副次的な抑制機能がはたらくと考えられている.最近の研究から,制御性T細胞は腫瘍免疫や移植免疫などにおけるさまざまな生理的あるいは病的な免疫応答の制御,また,免疫恒常性の維持に必須であることが明らかになってきた.今後,制御性T細胞を標的とした免疫疾患の治療法および予防法,また,免疫応答を亢進あるいは減弱させる手法の開発について迅速な進展が期待される.
はじめに
正常な免疫系は病原微生物などの病原体に応答しこれを効果的に排除するが,個体を構成する生体分子,腸内細菌などの共生微生物,あるいは,環境物質に対しては応答しない.一方,自己を構成する分子に対する免疫不応答が破れ自己免疫応答が惹起されると,自己免疫疾患の発症にいたる.また,病原体に対する免疫応答であっても,それが過剰であれば組織の傷害をともない免疫病理学的な疾患の原因となる.たとえば,腸内細菌などの共生微生物や食餌抗原に対する過剰な免疫応答は炎症性腸疾患の原因のひとつである.また,花粉など免疫学的に無害な環境物質に対する過剰な免疫応答はアレルギー性疾患を惹起する.ここでは,このような免疫自己寛容あるいは免疫恒常性を維持する制御機構について,制御性T細胞の役割を中心に最近の考え方を解説する.
1.免疫自己寛容および免疫恒常性の維持と制御性T細胞
免疫系は“自己”と“非自己”の免疫学的な識別の機構と,それにもとづく免疫自己寛容の導入および免疫恒常性の維持の機構をもつ.免疫自己寛容とは自己抗原に対する免疫不応答をいう.このような免疫応答の代表的な機構として,自己反応性リンパ球の負の選択がある.胸腺においては,胸腺ストローマ細胞により提示される自己抗原ペプチドとNHC分子との複合体を未熟な自己反応性のT細胞が強く認識すると,このT細胞はアポトーシスにおちいる.すなわち,胸腺や骨髄といった中心性リンパ球産生器官では自己反応性リンパ球が負の選択により排除されている.しかしながら,すべての自己反応性リンパ球が排除されるわけではない.実際,自己抗原を強力なアジュバントとともに免疫すれば自己抗体あるいは自己反応性T細胞を容易に誘導できる.すなわち,潜在的に自己免疫疾患を起こしうる自己反応性リンパ球は,正常な個体の末梢免疫系に生理的な状態で存在する.このような自己反応性リンパ球の活性化および増殖を抑制する生理的な制御機構のひとつは,特定のT細胞による抑制的な制御である.
免疫応答の抑制的な制御機能に特化したT細胞が存在するか否か,存在するとしてもその異常がなんらかの免疫疾患の原因であるか否かに関しては,長く議論があった1).この仮説を直接的に証明する実験のひとつは,正常な動物から特定のT細胞の亜群を除去することにより自己免疫疾患などの免疫疾患を誘導できるか,除去したT細胞の亜群をおぎなうことでその免疫疾患の発症を抑制できるか,を検討することである.そのような試みとして,正常なマウスの脾臓から調製したT細胞からCD25(インターロイキン2受容体α鎖)を発現するCD4陽性T細胞を除去し,T細胞の欠損する同系のマウス(たとえば,先天的に胸腺を欠損するヌードマウス)に残りのT細胞を移入すると,移入から2~3カ月で自己免疫性甲状腺炎,自己免疫性胃炎,I型糖尿病などさまざまな自己免疫疾患が高率に自然発症することが示された(図1a).この自己免疫疾患の発症は,少数のCD25陽性CD4陽性T細胞の同時移入により完全に阻止された.このような自己免疫疾患の発症阻止能をもつCD25陽性CD4陽性T細胞は,正常な個体において末梢のCD4陽性T細胞の約10%をしめており,制御性T細胞と名づけられた2).また,CD25陽性CD4陽性制御性T細胞は正常な胸腺において機能的に成熟した状態で産生される.すなわち,正常な胸腺は,自己免疫疾患を惹起しうる自己反応性T細胞のみならず,その活性化および増殖を抑制する制御性T細胞をも産生する.免疫自己寛容は,自己反応性T細胞に対する負の選択にくわえ,制御性T細胞による能動的な抑制により維持されている3).
2.CD25陽性CD4陽性制御性T細胞と転写因子Foxp3
免疫系に内在するCD25陽性CD4陽性制御性T細胞の重要な特徴として,転写因子Foxp3を特異的に発現しており,Foxp3の欠損あるいは突然変異により制御性T細胞の発生および分化,また,抑制機能が障害されることがある.Foxp3遺伝子は致死性の自己免疫および炎症性疾患を自然発症するScurfyマウスの原因遺伝子としてポジショナルクローニング法によりX染色体において同定され,つづいて,あとでのべるヒトIPEX症候群の原因遺伝子であることが示されたものである4).また,正常なT細胞でもFoxp3を異所性に発現させることにより免疫抑制機能が発揮されるという実験結果から,Foxp3遺伝子は制御性T細胞の発生および機能におけるマスター遺伝子であると考えられている5-7).
制御性T細胞の存在は動物実験により証明されたが,制御性T細胞が免疫自己寛容あるいは免疫恒常性の維持に不可欠な役割をはたしていることの直接的な証拠は,X染色体伴性劣性の遺伝疾患であるIPEX(immune dysregulation, polyendocrinopathy, enteropathy, X-linked,X染色体連鎖免疫制御異常多発性内分泌障害消化器病)症候群の存在である.この単一の遺伝子変異による稀少性の遺伝疾患では,I型糖尿病が80%,自己免疫性甲状腺炎が70%,そのほか,溶血性貧血,血小板減少性紫斑病などさまざまな自己免疫疾患が生後3年以内に発症する.ほとんど全例において炎症性腸炎が発症し,また,高免疫グロブリンE血症,アレルギー性皮膚炎,食物アレルギーがみられる.IPEX症候群の原因遺伝子はさきに述べたFOXP3遺伝子である.FOXP3遺伝子に突然変異が生じるとその大半において制御性T細胞の発生が阻害され,その結果,自己抗原および非自己抗原に対する免疫応答の制御が異常をきたす8)(図1b).
転写因子Foxp3による遺伝子発現の制御機構の解明は,胸腺で産生される制御性T細胞の発生および機能の理解のみならず,人工的にFoxp3陽性制御性T細胞を作製するうえでも重要である.実際,マウスのナイーブCD4陽性T細胞をTGFβの存在下において抗原により刺激するとFoxp3を発現し,機能および表現型において内在性の制御性T細胞に類似した誘導性制御性T細胞を実験的に作製できる.しかし,内在性の制御性T細胞と誘導性制御性T細胞とは機能的に完全には同一ではないことも示されている8,9).内在性の制御性T細胞と誘導性制御性T細胞との最大の差異は,T細胞受容体の抗原特異性とFoxp3発現の安定性である.すなわち,誘導性制御性T細胞は自己抗原に対する親和性の低いナイーブCD4陽性T細胞から分化させるため,おのずと自己認識能も低くなる.このことは,自己免疫疾患の細胞療法として誘導性制御性T細胞を用いることにおいては不利にはたらくが,一方,移植片に対する免疫寛容を目標とした細胞療法では有利にはたらくかもしれない.しかし,誘導性制御性T細胞におけるFoxp3の発現は不安定であり,このことが臨床への応用をはばんでいる9).
近年の研究により,誘導性制御性T細胞におけるFoxp3発現の不安定性は,おもにFoxp3遺伝子のエピジェネティックな制御の違いに由来すると理解されている9-12).エピジェネティクスとは,DNA塩基配列の変化をともなわず細胞分裂ののちも継承される遺伝子発現あるいは表現型の変化と定義され,遺伝子発現のエピジェネティックな制御とは,DNAの配列は変化することなくDNAやクロマチンの修飾により遺伝子発現が制御されることである.近年,細胞系譜に特異的な遺伝子発現制御は,転写因子による制御とエピジェネティックな制御に依存することが明らかになってきている.制御性T細胞におけるエピジェネティックな制御として,Foxp3をはじめとする制御性T細胞に特異的なさまざまな機能タンパク質をコードする遺伝子の発現制御領域において,制御性T細胞に特異的な脱メチル化領域の存在することがある.誘導性制御性T細胞ではFoxp3遺伝子をはじめとする制御性T細胞に特異的な遺伝子において,制御性T細胞に特異的な脱メチル化領域がメチル化されたままであり,このため,Foxp3遺伝子を含む制御性T細胞に特異的な遺伝子の発現は不安定である.現在では,制御性T細胞を人工的に誘導するには単にFoxp3を発現させればよいという段階は終了し,いかにFoxp3を安定的に発現させるかという段階に入っている.
また,ヒトのCD4陽性T細胞はT細胞受容体に強い刺激をうけると比較的容易にFOXP3を発現することが知られているが,このようなFOXP3陽性CD4陽性T細胞は制御性T細胞に特異的な脱メチル化領域が脱メチル化されておらず,FOXP3の発現は不安定であり,さらに,免疫抑制機能をもたない13).制御性T細胞に特異的なエピジェネティックな修飾を導入することにより,FOXP3の発現のみならず,機能的に安定な制御性T細胞を作製する手法の開発が望まれる.
3.制御性T細胞による免疫恒常性の維持の分子機構とその異常
さきに述べたように,制御性T細胞はCD25(インターロイキン2受容体α鎖)を高発現している2).CD25は,インターロイキン2受容体β鎖であるCD122およびインターロイキン2受容体γ鎖であるCD132とともに,インターロイキン2受容体を構成する.制御性T細胞は,胸腺における産生のときからすでに高親和性のインターロイキン2受容体を発現する特異なT細胞である.一方,制御性T細胞では転写因子Foxp3がインターロイキン2遺伝子の発現を抑制している.その結果,制御性T細胞の生存の維持には,ほかの細胞により産生されるインターロイキン2が不可欠である.実際に,インターロイキン2ノックアウトマウスは制御性T細胞の異常により致死性の自己免疫性炎症を発症する14).また,正常な個体にインターロイキン2の中和抗体を投与すると,制御性T細胞が減少し自己免疫疾患が自然発症する15).したがって,CD25は制御性T細胞のよいマーカーであると同時に,制御性T細胞の機能に必須のタンパク質でもある.さらに,ほかのT細胞によりインターロイキン2が大量に産生されると,制御性T細胞が増殖し免疫抑制が亢進することにより,さらなる免疫反応が抑制される.すなわち,インターロイキン2は負のフィードバックによる免疫制御を媒介している(図2).
制御性T細胞は複数の機序により免疫抑制能を発揮するが,制御性T細胞の免疫抑制機能の根幹は抗原提示細胞によるT細胞活性化の抑制である.ナイーブT細胞は抗原提示細胞,とくに樹状細胞の提示する抗原によるT細胞受容体への刺激(シグナル1)と,抗原提示細胞に発現するCD80/CD86によるCD28への副刺激(シグナル2)により活性化され,インターロイキン2を産生し増殖する.制御性T細胞の重要な特徴として,CD28の分子ホモログであるCTLA-4をつねに高発現していることがある16).CTLA-4はCD28と同じくCD80/CD86と結合する.結合の親和性はCTLA-4のほうがCD28より20倍も高い.制御性T細胞に発現するCTLA-4は抗原提示細胞においてCD80/CD86の発現を抑制する.その結果,抗原提示細胞は抗原を提示しても副刺激を提供できないため,ほかのT細胞を活性化できない17)(図2).さらに,さきに述べたように,制御性T細胞は高親和性のインターロイキン2受容体を高発現し,周囲からインターロイキン2を受け取ることによりほかのT細胞の活性化および増殖に必要なインターロイキン2を奪い,抗原反応性のT細胞にアポトーシスを誘導する.さらに,制御性T細胞は特定の条件(たとえば,腸管粘膜)において免疫抑制性のサイトカインであるインターロイキン10を産生する.インターロイキン10はおもに抗原提示細胞の成熟を抑えることにより免疫抑制に関与する18).また,制御性T細胞は炎症のタイプに応じて免疫応答を制御することができる.たとえば,基本的な抑制活性を維持しつつ,Th1型の炎症(たとえば,インターフェロンγの産生)に応じて特定のケモカイン受容体(たとえば,CXCR3)を発現し,Th1反応の場に動員されてそこで免疫抑制能を発揮する.
4.さまざまな生理的および病的な状態と制御性T細胞
制御性T細胞は免疫自己寛容の維持に必要なT細胞として発見された.のちの研究により,制御性T細胞がさまざまな生理的あるいは病的な免疫応答の制御,また,免疫恒常性の維持において必須であることが明らかになってきた4,19).たとえば,腫瘍免疫において腫瘍細胞に特異的なリンパ球の認識する腫瘍抗原の多くは正常な自己抗原である.したがって,制御性T細胞は免疫自己寛容を維持すると同時に,腫瘍に対する免疫監視機構を減弱あるいは阻害する.また,腫瘍組織では制御性T細胞が増加し,ときに腫瘍に浸潤したT細胞の大部分が制御性T細胞でしめられることもある.実際に,実験的に制御性T細胞を除去あるいは減少させることにより腫瘍に対する免疫応答を亢進させることができる.現在,制御性T細胞を標的とするがん免疫療法が開発されつつある.一方で,臓器移植の理想は,移植臓器に対し自己の臓器に対するのと同じく安定な免疫寛容を誘導することである.実際に,実験的に制御性T細胞を移植アロ抗原に特異的に増殖させることにより移植免疫寛容を誘導できる.さらに,ウイルス,細菌,寄生虫などによるさまざまな感染症において,制御性T細胞を除去あるいは減少させることにより免疫応答を実験的に亢進させることが可能である.また,さきのIPEX症候群にみられるように,制御性T細胞の機能異常により腸内常在細菌に対する過剰な免疫応答が惹起されることから,常在微生物との生理的な共生においても制御性T細胞は必須のはたらきをしているものと考えられる.一方,妊娠した母体がどのようにして胎仔に対する免疫寛容を維持しているのかの理解はいまだに免疫学の重要な課題であるが,妊娠した動物では胎盤に多くの制御性T細胞の集積がみられる.また,妊娠した動物から制御性T細胞を除去するととたんに流産が惹起される.したがって,胎児と母胎における免疫寛容において制御性T細胞が重要な役割をはたしているものと考えられる20).
おわりに
ここでは,制御性T細胞の発見の歴史的な意義からはじめ,制御性T細胞を特徴づける転写因子Foxp3とエピジェネティックな制御,ならびに,免疫抑制の分子機構について,主要な項目にしぼり解説した.このような知見をもとに,今後,制御性T細胞を標的とした免疫疾患の治療法や予防法,また,免疫応答を亢進あるいは減弱する手法の開発について迅速な進展が期待される.
文 献
- Sakaguchi, S.: Regulatory T cells: key controllers of immunologic self-tolerance. Cell, 101, 455-458 (2000)[PubMed]
- Sakaguchi, S., Sakaguchi, N., Asano, M. et al.: Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor α-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J. Immunol., 155, 1151-1164 (1995)[PubMed]
- Itoh., M., Takahashi, T., Sakaguchi, N. et al.: Thymus and autoimmunity: production of CD25+CD4+ naturally anergic and suppressive T cells as a key function of the thymus in maintaining immunologic self-tolerance. J. Immunol., 162, 5317-5326 (1999)[PubMed]
- Bennett, C. L., Christie, J., Ramsdell, F. et al.: The immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome (IPEX) is caused by mutations of FOXP3. Nat. Genet., 27, 20-21 (2001)[PubMed]
- Hori, S., Nomura, T. & Sakaguchi, S.: Control of regulatory T cell development by the transcription factor Foxp3. Science, 299, 1057-1061 (2003)[PubMed]
- Fontenot, J. D., Gavin, M. A. & Rudensky, A. Y.: Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat. Immunol., 4, 330-336 (2003)[PubMed]
- Khattri, R., Cox, T., Yasayko, S. A. et al.: An essential role for Scurfin in CD4+CD25+ T regulatory cells. Nat. Immunol., 4, 337-342 (2003)[PubMed]
- Sakaguchi, S., Yamaguchi, T., Nomura, T. et al.: Regulatory T cells and immune tolerance. Cell, 133, 775-787 (2008)[PubMed]
- Floess, S., Freyer, J., Siewert, C. et al.: Epigenetic control of the foxp3 locus in regulatory T cells. PLoS Biol., 5, e38 (2007)[PubMed]
- Polansky, J. K., Kretschmer, K., Freyer, J. et al.: DNA methylation controls Foxp3 gene expression. Eur. J. Immunol., 38, 1654-1663 (2008)[PubMed]
- Huehn, J., Polansky, J. K. & Hamann, A.: Epigenetic control of FOXP3 expression: the key to a stable regulatory T-cell lineage? Nat. Rev. Immunol., 9, 83-89 (2009)[PubMed]
- Ohkura, N., Hamaguchi, M., Morikawa, H. et al.: T cell receptor stimulation-induced epigenetic changes and Foxp3 expression are independent and complementary events required for Treg cell development. Immunity, 37, 785-799 (2012)[PubMed]
- Miyara, M., Yoshioka, Y., Kitoh, A. et al.: Functional delineation and differentiation dynamics of human CD4+ T cells expressing the FoxP3 transcription factor. Immunity, 30, 899-911 (2009)[PubMed]
- Schorle, H., Holtschke, T., Hunig, T. et al.: Development and function of T cells in mice rendered interleukin-2 deficient by gene targeting. Nature, 352, 621-624 (1991)[PubMed]
- Setoguchi, R., Hori, S., Takahashi, T. et al.: Homeostatic maintenance of natural Foxp3+ CD25+ CD4+ regulatory T cells by interleukin (IL)-2 and induction of autoimmune disease by IL-2 neutralization. J. Exp. Med., 201, 723-735 (2005)[PubMed]
- Takahashi, T., Tagami, T., Yamazaki, S. et al.: Immunologic self-tolerance maintained by CD25+CD4+ regulatory T cells constitutively expressing cytotoxic T lymphocyte-associated antigen 4. J. Exp. Med., 192, 303-309 (2000)[PubMed]
- Wing, K., Onishi, Y., Prieto-Martin, P. et al.: CTLA-4 control over Foxp3+ regulatory T cell function. Science, 322, 271-275 (2008)[PubMed]
- Izcue, A., Coombes, J. L. & Powrie, F.: Regulatory lymphocytes and intestinal inflammation. Annu. Rev. Immunol., 27, 313-338 (2009)[PubMed]
- Sakaguchi, S. & Powrie, F.: Emerging challenges in regulatory T cell function and biology. Science, 317, 627-629 (2007)[PubMed]
- Rowe, J. H., Ertelt, J. M., Xin, L. et al.: Pregnancy imprints regulatory memory that sustains anergy to fetal antigen. Nature, 490, 102-106 (2012)[PubMed]
著者プロフィール
略歴:2009年 京都府立医科大学大学院医学研究科 修了,2013年より大阪大学免疫学フロンティア研究センター 助教.
研究テーマ:制御性T細胞の発生と機能発現の分子機構.
坂口 志文(Shimon Sakaguchi)
大阪大学免疫学フロンティア研究センター 教授.
© 2013 濱口真英・坂口志文 Licensed under CC 表示 2.1 日本