メンブレントラフィックにおける普遍的な制御因子Rabタンパク質
2013/05/29
大林典彦・福田光則
(東北大学大学院生命科学研究科 膜輸送機構解析分野)
email:大林典彦,福田光則
領域融合レビュー, 2, e006 (2013) DOI: 10.7875/leading.author.2.e006
Norihiko Ohbayashi & Mitsunori Fukuda: Rab GTPases and their roles in membrane traffic.

真核生物の細胞に存在するエンドソームやリソソームなどのオルガネラや細胞膜は,それぞれが独立しているわけではなく,メンブレントラフィックにより密接にかかわりあっている.Rasスーパーファミリーに属するRabタンパク質は,このメンブレントラフィックにおいてきわめて重要な制御因子である.Rabタンパク質の機能の異常は神経疾患や免疫疾患をはじめ,じつに多岐にわたる病態にかかわっていることから,Rabタンパク質は個々の細胞の生存だけでなく,さまざまな高次機能にも不可欠であると考えられている.ここでは,Rabタンパク質による制御機構やその生理機能,そして,Rabタンパク質の機能異常とそれにともなう病態に関する最近の知見を概説する.
小胞体において合成され正しくフォールディングされた膜タンパク質や分泌タンパク質は,ゴルジ体およびトランスゴルジネットワークをへてさまざまな目的地へと運ばれる.たとえば,分泌経路により細胞の外や細胞膜へと輸送されるタンパク質や,エンドソームなどのオルガネラに輸送されるタンパク質がある.後者の輸送は,細胞膜からエンドサイトーシスによりオルガネラに到達するものとあいまって複雑なネットワークを構築しており,それぞれのオルガネラが膜やその内容物を交換しあっている.これらのネットワークは基本的に脂質二重膜に包まれた小胞の行き来により制御されており,供与側のオルガネラにおける積み荷タンパク質の選別と小胞の出芽,モータータンパク質による輸送,標的となる膜への繋留および融合といったダイナミックな膜動態をともなう.これらの膜動態を総称してメンブレントラフィック(膜輸送あるいは小胞輸送)とよんでいる(図1).また最近では,経済用語を借用して細胞内ロジスティクスともよばれる.
近年,このメンブレントラフィックにおける普遍的な制御因子として注目をあつめているのがRabタンパク質である.RabファミリーはRasスーパーファミリーに属する低分子量Gタンパク質のなかで最大のファミリーを形成する.ヒトでは66種類のRabタンパク質(GTPaseドメイン以外のドメインをもつ,ほかとはやや異なるRab44やRab45も含む)が報告されており1),それぞれが特異的なメンブレントラフィックを制御するものと考えられている.Rabタンパク質は,ほかの低分子量Gタンパク質と同じく,2つのヌクレオチド結合状態をサイクルする分子スイッチとして機能する.すなわち,GTP結合型の活性化状態とGDP結合型の不活性化状態とのあいだでそのコンフォメーションを変換する.Rabタンパク質は膜に可逆的に結合するが,これはRabタンパク質の活性化の状態に依存しており,一般的に,GTP結合型である活性化型のRabタンパク質は,C末端に存在する1つまたは2つのシステイン残基を介してゲラニルゲラニル(疎水性プレニル基)化されることにより膜に結合している.膜に結合した活性化型Rabタンパク質は,おのおののRabタンパク質に特異的なエフェクタータンパク質と結合し,オルガネラにおける小胞の出芽,小胞の細胞骨格にそった輸送,あるいは,特異的なオルガネラへの繋留や融合を制御している2).
ここでは,これら多彩な役割を担うRabタンパク質の制御機構や生理機能,そして,Rabタンパク質の機能破綻による病態の発症機構について概説する.
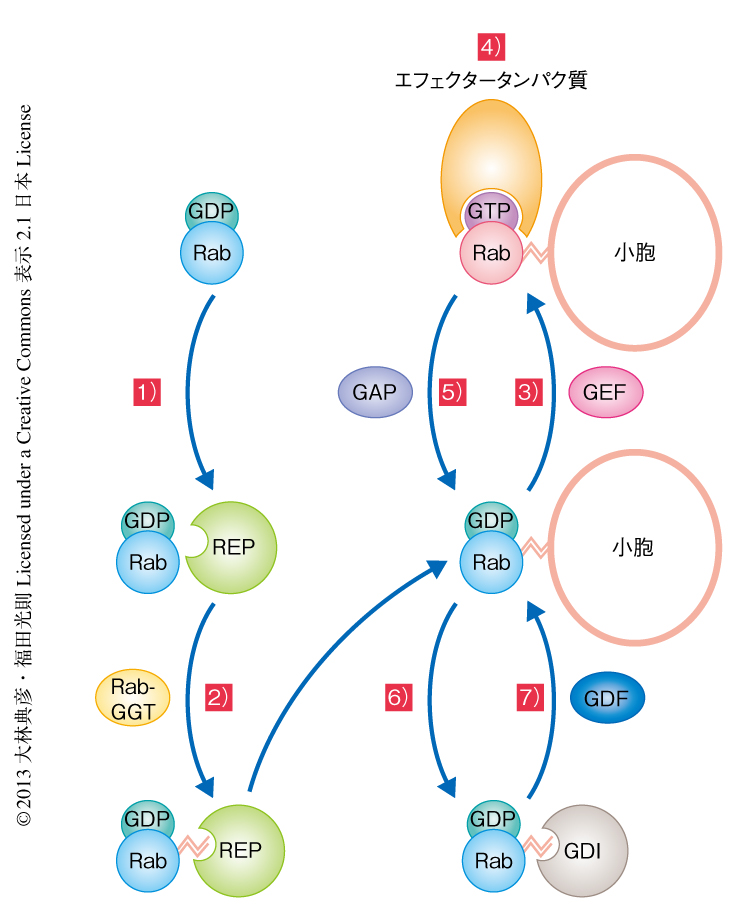
細胞質において合成されたRabタンパク質は,そのままでは膜に結合することはできない.新規に合成されたRabタンパク質は,まず,Rabエスコートタンパク質(REP:Rab escort protein)の作用により,Rabゲラニルゲラニル転移酵素(Rab-GGT:Rab geranylgeranyl transferase)に受け渡される3).つぎに,Rab-GGTはRabタンパク質のC末端に存在するシステイン残基をゲラニルゲラニル化する4).この脂質化修飾により,Rabタンパク質は細胞膜やオルガネラ膜と相互作用することが可能になる.つづいて,Rabタンパク質に特異的なグアニンヌクレオチド交換因子(GEF:guanine-nucleotide exchange factor)の作用によりGDPからGTPへの交換反応(活性化)が行われる5).Rabタンパク質にGTPが結合するとRabタンパク質のスイッチIおよびスイッチIIとよばれる領域において構造変化が起こり,スイッチ領域やスイッチ間領域にエフェクタータンパク質が結合することのできる活性化状態になる6).活性化型のRabタンパク質と結合したエフェクタータンパク質は,その機能に応じてメンブレントラフィックにおけるさまざまなステップを制御する.これまでに報告されたエフェクタータンパク質は多種多様であり,のちに,いくつかの例を述べる.
さて,膜に結合した活性化型のRabタンパク質は,メンブレントラフィックにおける役割をおえると不活性化される必要がある.Rabタンパク質それ自体にもGTPをGDPに加水分解するGTPase活性が備わっているが,この作用だけでは不十分で,Rabタンパク質に特異的なGTPase活性化タンパク質(GAP:GTPase-activating protein)の助けを得ることでRabタンパク質は不活性化される7).不活性化されたGDP結合型のRabタンパク質は,サイトゾルに存在するGDP解離抑制因子(GDI:GDP dissociation inhibitor)の作用により,C末端のゲラニルゲラニル基を保持したまま膜から引き抜かれる.ゲラニルゲラニル基は親水性であるサイトゾルでは不安定であるが,GDIがゲラニルゲラニル基に対しシャペロンとして機能することにより不活性化型Rabタンパク質をサイトゾルにおいて安定に保持し,再活性化されるまで待機させることができる8).興味深いことに,REPとGDIはどちらも不活性化型Rabタンパク質のシャペロンとしての機能をもつが,脂質化修飾されたRabタンパク質に対する親和性という点において両者は大きく異なる.REPはゲラニルゲラニル化Rabタンパク質と未修飾Rabタンパク質とに対する親和性において大きな差はないが,GDIはゲラニルゲラニル化Rabタンパク質に対して圧倒的に高い親和性をもち,Rabタンパク質の再利用におけるGDIの重要性の根拠となっている9).不活性化型のRabタンパク質は最終的にGDIから解離することによりふたたび膜と相互作用することが可能になり,GEFの作用によりGTP結合型の活性化状態へと変換する.なお,このGDIからの解離については,GDI置換因子(GDF:GDI displacement factor)により行われるとの報告もあるが10),その機能は一部のRabタンパク質に対してのみでありコンセンサスは得られていない.
このように,Rabタンパク質の活性化のスイッチ,および,それにともなうオルガネラ膜への局在のオンオフのサイクルは,GEF,GAP,GGT,REP,GDIといったタンパク質の協調作用による制御をうけている(図2).
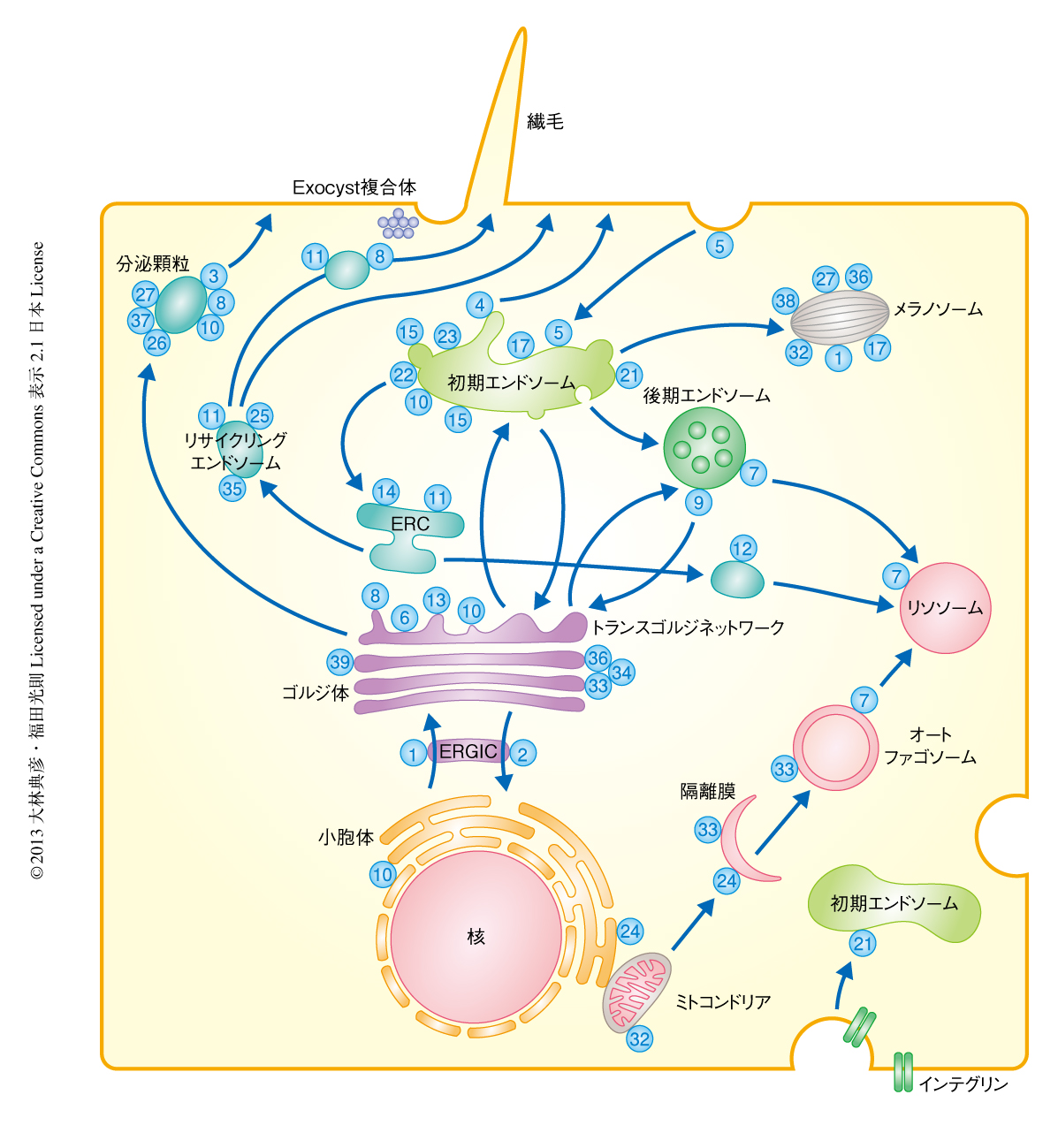
小胞体において新規に合成されたタンパク質は,ゴルジ体を経由してトランスゴルジネットワークに到達するとそこで選別をうけ,さまざまな輸送の過程をへることになる.たとえば,ホルモン顆粒の産生やグルコース輸送体の輸送などには細胞膜への分泌経路が利用されており,この輸送経路ではRab3,Rab27,Rab10などが活躍する11,12).細胞膜や初期エンドソームにはRab5が存在し,エンドサイトーシスにより細胞に取り込まれた小胞と初期エンドソームとの融合を促す13).また,初期エンドソームはソーティングエンドソームともよばれ,細胞膜や細胞の外から取り込まれた物質をさまざまなオルガネラへと振り分ける機能をもち,Rab5だけでなく,Rab4やRab21をはじめ14,15),多くのRabタンパク質が存在する.細胞に取り込まれた物質のうち不要なものは,初期エンドソームから分化した後期エンドソームをへてリソソームと融合することにより分解される.後期エンドソームからリソソームにかけてはRab7が重要な機能を担う16).一方,再利用すべき物質は,初期エンドソームから即座に細胞膜へともどる過程(rapid recycling)と,いちど中心体の近傍に存在するエンドサイトーシスリサイクルコンパートメント(ERC:endocytic recycling compartment)へと運ばれそこから出芽したリサイクリングエンドソームにより細胞膜へともどる過程(slow recycling)の,いずれかを経由する.前者の過程にはRab4が14),後者の過程にはRab11が主要なはたらきをしており,細胞接着因子であるインテグリンやカドヘリンのリサイクリングにはRab11が積極的にかかわっている17,18).また,トランスフェリン受容体や一部のアミノ酸輸送体などリサイクリングエンドソームに移行したものは分解をうけないと考えられていたが,最近,Rab12に依存的にリソソームにリクルートされるという新規の輸送過程も見い出されている19,20).さらに,初期エンドソーム,後期エンドソーム,リサイクリングエンドソームからは,トランスゴルジネットワークにも小胞を逆行輸送させており,その詳細はのちに述べる.
Rabファミリーを構成するそれぞれのメンバーは特異的な膜への局在を示し,固有のメンブレントラフィックを制御していると考えられている(図3).たとえば,Rab1やRab2は小胞体およびゴルジ体に局在して小胞体とゴルジ体とのあいだのメンブレントラフィックを制御し21),Rab3は分泌小胞に特異的に局在してシナプス小胞などのエキソサイトーシスを制御している11).では,これらRabタンパク質の膜への局在はどのように制御されているのだろうか.これまで,以下に述べるような複数のモデルが提示されており,おそらく,それぞれのモデルを複合的に用いることによりRabタンパク質の局在は規定されているものと思われる.Rabタンパク質の1次構造を比べてみると,Rabファミリーのあいだでは保存されているが,RasやRhoなどほかの低分子量Gタンパク質には存在しない特異的な約5アミノ酸残基からなる配列が5か所に存在しF1~F5とよばれている.さらに,SF1~SF4とよばれるRabサブファミリーのあいだでよく保存された比較的長いアミノ酸配列も4か所に存在している.これらF1~F5およびSF1~SF4のアミノ酸配列がRabタンパク質の局在性を規定するとのモデルが提示されている22).
そのほかにも,GEFが局所的にRabタンパク質をGTP型に変換して活性化し,GDIとの親和性を低下させることによりその解離を促して,Rabタンパク質を特異的な膜と結合させるとのモデルが提唱されている.たとえば,Rab27AのGEFとして知られるDENN/MADDはRab27Aのメラノソームへの局在を制御しているとの報告や23),Rab5のGEFであるRabex-5をミトコンドリアに異所的に発現させると本来は初期エンドソームに局在すべきRab5がミトコンドリアに局在するようになるとの報告は24),このモデルの裏づけになっている.このように,GEFはRabタンパク質の局在制御における主要なタンパク質のひとつと考えられるが,そのためには,Rabタンパク質よりも対応するGEFがさきに特異的な膜に局在する必要性があり,それには,オルガネラ膜に存在するイノシトールリン脂質に対するGEFの親和性や,のちに述べるRabカスケードのような分子機構が必要になる.
さらに,活性化型のRabタンパク質が特異的なオルガネラ膜に局在すると,ひきつづきそのエフェクタータンパク質が結合することにより,Rabタンパク質を膜において安定化させているとの報告もある.たとえば,後期エンドソームに局在するRab9はエフェクタータンパク質であるTIP47との結合がその局在に重要である25).また,初期エンドソームに局在するRab5はそのエフェクタータンパク質Rabaptin-5との結合を介し間接的にRabex-5をRab5自体にリクルートする.Rabex-5はRab5のGEFとして機能するためさらにRab5が活性化されることになり,Rab5の局在がより安定化される26).すなわち,エフェクタータンパク質との結合はRabタンパク質の局在にとり正のフィードバック的な要素を含むと考えることができる.
オルガネラのあいだを行き来する小胞は,その表面がCOPIやCOPII,あるいは,クラスリンなどのコートタンパク質によりおおわれている.これらのコートタンパク質はおもにArf/Sarファミリーに属する低分子量Gタンパク質により制御されながら供与側のオルガネラ膜に集積するが,輸送されるべき積み荷タンパク質の選別の過程にはRabタンパク質も重要な役割をはたしている.リソソームに含まれる酸性加水分解酵素は膜タンパク質であるマンノース6-リン酸受容体に結合してトランスゴルジネットワークから後期エンドソームへと輸送されるが,後期エンドソームに到達した酸性加水分解酵素はマンノース6-リン酸受容体から解離し,役目をはたしたマンノース6-リン酸受容体はふたたびトランスゴルジネットワークへともどり再利用される.Rab9のエフェクタータンパク質であるTIP47はマンノース6-リン酸受容体の細胞質領域との結合能ももち,後期エンドソームに存在するRab9にTIP47が結合するとTIP47とマンノース6-リン酸受容体との結合が強まり,後期エンドソームにおけるマンノース6-リン酸受容体の輸送小胞への選別と出芽が促進される27).また,別の例として,レトロマーとよばれるタンパク質複合体があげられる.レトロマーはエンドソーム膜においてコートタンパク質として機能するが,Rab7のエフェクタータンパク質としても機能しており,Rab7はレトロマーとの相互作用を介してトランスゴルジネットワークに輸送される積み荷タンパク質の選別と小胞の出芽にかかわっている28).
ほとんどの輸送小胞はコートタンパク質によりおおわれているため,標的となる膜に融合するまえにコートタンパク質を小胞膜から脱離(脱コート)する必要がある.ここでは,クラスリン依存性エンドサイトーシスののちの脱コートを例に,その分子機構を説明する.細胞膜に存在するリン脂質であるホスファチジルイノシトール4,5-ビスリン酸を認識してクラスリンアダプター複合体であるAP-2が弱く結合すると,特定のキナーゼAAKがAP-2のμサブユニットをリン酸化することによりAP-2の細胞膜への結合は安定化する.つぎに,AP-2がトランスフェリン受容体などの積み荷タンパク質を認識してクラスリンを集合させることにより,被覆小胞が形成される29).このクラスリン被覆小胞にはRab5が存在しており,Rab5とそのGEFであるGAPVD1(hRME-6)が協調してクラスリン被覆小胞を脱コートさせる30).すなわち,GAPVD1は被覆小胞からAAKを解離させたり,あるいは,Rab5のエフェクタータンパク質であるホスファチジルイノシトール3-キナーゼやホスファチジルイノシトールホスファターゼをリクルートすることで細胞膜からもち込まれたホスファチジルイノシトール4,5-ビスリン酸のレベルを低下させたりすることにより,クラスリン被覆小胞の脱コートをひき起こすものと考えられている.
供与側のオルガネラ膜から出芽した輸送小胞は微小管やアクチンフィラメントといった細胞骨格にそって運ばれ目的地のオルガネラに到達する.微小管は核の近傍に存在する微小管形成中心から細胞の辺縁にむかって延びており,辺縁部にむかう順行輸送にはキネシンモータータンパク質が,反対の方向にむかう逆行輸送にはダイニンモータータンパク質が機能する.これらのモータータンパク質と輸送小胞とをつなげるリンカーとして,Rabタンパク質は重要な役割を担っている31,32).たとえば,エンドソームに存在するRab14を認識してキネシン-3が直接に結合することにより,FGF受容体のゴルジ体からエンドソームへの順行輸送が制御されている33).また,ゴルジ体に存在するRab6のエフェクタータンパク質としてRabkinesin-6が報告されているが,これはキネシン-6のサブユニットとして知られ,細胞質分裂に重要な役割をはたしている34).以上は,Rabタンパク質とキネシンモータータンパク質との直接的な相互作用によるものだが,小胞膜にあるRabタンパク質がエフェクタータンパク質を介しキネシンモータータンパク質と間接的に相互作用するケースも報告されている.たとえば,Rab3はDENN/MADDを介してキネシンモータータンパク質に相互作用し,Rab3陽性小胞をニューロンの軸索にそって順行方向に輸送する35).また,小胞体やゴルジ体に存在するRab1Aはメラノサイト(色素細胞)にあるメラノソームにも存在しその順行輸送を制御しているが,ここにも,Rab1Aとキネシンモータータンパク質とをつなぐエフェクタータンパク質の存在が想定されている36).
微小管を逆行方向に輸送するダイニンモータータンパク質とRabタンパク質との関係についても多くの報告がある.たとえば,後期エンドソームに局在するRab7はエフェクタータンパク質であるRILPを介してダイニンとダイナクチンからなる複合体と相互作用し,後期エンドソームの逆行輸送を制御している16).また,メラノソームに局在するRab36は,同じくRab36のエフェクタータンパク質でもあるRILPを介してダイニンとダイナクチンからなる複合体と相互作用し,メラノソームの逆行輸送を制御している37).
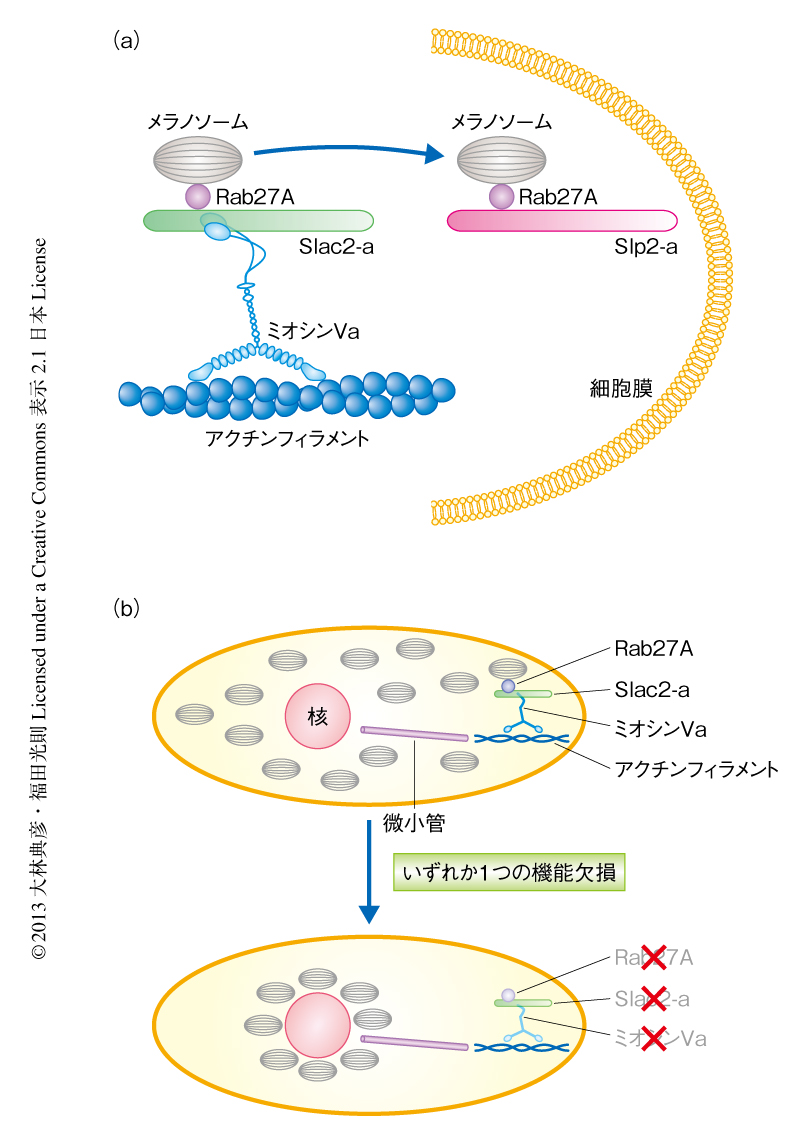
輸送小胞は微小管を長距離にわたりダイナミックに動くのに対し,アクチンフィラメントではミオシンモータータンパク質のはたらきにより短距離の局所的な動きをし,そののち,細胞膜へと輸送される.Rabタンパク質とミオシンモータータンパク質との関連性でよく研究されているものとして,Rab27Aの例があげられる(図4a).メラノソームに局在するRab27Aはエフェクタータンパク質であるSlac2-a(melanophilinともよばれる)を介してミオシンVaと相互作用することにより,メラノソームの微小管からアクチンフィラメントへの受け渡し,そして,アクチンフィラメントにおける局所的な動きを制御している38).さらに,Rab27AはSlac2-aとは異なるエフェクタータンパク質であるSlp2-aに結合の相手を変えてメラノソームを細胞膜に繋留する38).ほかの例としては,シナプス後部における神経伝達物質受容体のエンドサイトーシスとリサイクリングによる発現制御機構に対するRab11とミオシンVbの関与があげられる.長期増強(LTP:long-term potentiation)の過程において,AMPA型グルタミン酸受容体を含むRab11陽性小胞はRab11のエフェクタータンパク質であるFIP2を介してミオシンVbと相互作用することにより,シナプス後膜に輸送される39).このように,小胞膜あるいはオルガネラ膜にあるRabタンパク質とモータータンパク質とをつなぐ例は枚挙にいとまがなく31),オルガネラに特異的な小胞輸送における特異性を示唆するものと考えられる.
一般的に,輸送小胞は最初に繋留タンパク質による相互作用(繋留あるいはドッキングとよばれる)を介して目的地となるオルガネラと結合する.そののち,SNARE(soluble NSF attachment protein receptor)タンパク質の作用により輸送小胞と標的となる膜との融合が起こる.この過程においてもRabタンパク質は繋留タンパク質およびSNAREタンパク質と相互作用し,繋留から融合のステップに深く関与している.繋留タンパク質は,ひとつの比較的大きなタンパク質によるものと,多くのサブユニットから構成されるタンパク質複合体によるものの,大きく2つのグループに分けることができる.ひとつのタンパク質によるものとしては,コイルドコイルタンパク質(p115,GM130,GCC185などのゴルジ体に局在するゴルジンファミリータンパク質や,EEA1などのRab5エフェクタータンパク質)やシナプトタグミン様タンパク質などの報告がある.また,タンパク質複合体によるものとしては,HOPS/Vps-C複合体,Exocyst複合体,COG複合体,GARP/VFT複合体,TRAPP複合体などの報告がある40).
小胞体や小胞体-ゴルジ体中間区画(ERGIC:ER-Golgi intermediate compartment)からシスゴルジに輸送されるCOPII小胞にはRab1が存在しており,ひとつの説として,以下のモデルが提唱されている.Rab1が繋留タンパク質であるp115をCOPII小胞にリクルートし,シスゴルジ側にはRab1のエフェクタータンパク質であるGM130が待機している.そして,GM130とp115とが複合体を形成し繋留タンパク質として機能することにより,シスゴルジへ小胞が繋留される41).さらに,GM130はSyntaxin-5などのSNAREタンパク質と相互作用することにより,小胞のシスゴルジへの融合が促進される42).
シナプトタグミン様タンパク質はそのN末端側に存在するSHDドメインを介してRab27と特異的に結合し,分泌小胞の細胞膜への繋留にかかわる.内分泌細胞株のPC12細胞においては,ホルモン顆粒(有芯顆粒ともよばれる)にRab27Aが局在し,エフェクタータンパク質であるrabphilinとの結合を介して細胞膜に存在するSNAP25と結合することにより,ホルモン顆粒を細胞膜に繋留する43).
初期エンドソームに存在するRab5は,その常時活性化型の変異体を発現させると巨大なエンドソームが誘導されるなど,エンドソームの融合に深くかかわっている.Rab5はEEA1やRabenosyn-5といったエフェクタータンパク質をRab5陽性エンドソームにリクルートし,リクルートされたEEA1はそのコイルドコイルドメインを介して二量体化することによりRab5陽性エンドソームどうしを繋留する44).また,EEA1はSyntaxin-6などのエンドソームのSNAREタンパク質とも会合し,Rab5陽性エンドソームの融合を促進する44).さらに,Rab5のエフェクタータンパク質にはホスファチジルイノシトール3-キナーゼやホスファチジルイノシトール4-ホスファターゼあるいはホスファチジルイノシトール5-ホスファターゼなどがあり,Rab5陽性エンドソームにホスファチジルイノシトール3-リン酸を濃縮させる.このため,ホスファチジルイノシトール3-リン酸を特異的に認識するFYVEドメインをもつEEA1やRabenosyn-5は,Rab5陽性エンドソームにさらに保持されやすくなる.したがって,小胞の繋留や融合には低分子量Gタンパク質だけでなく,ホスファチジルイノシトールの機能も重要と考えられる45).
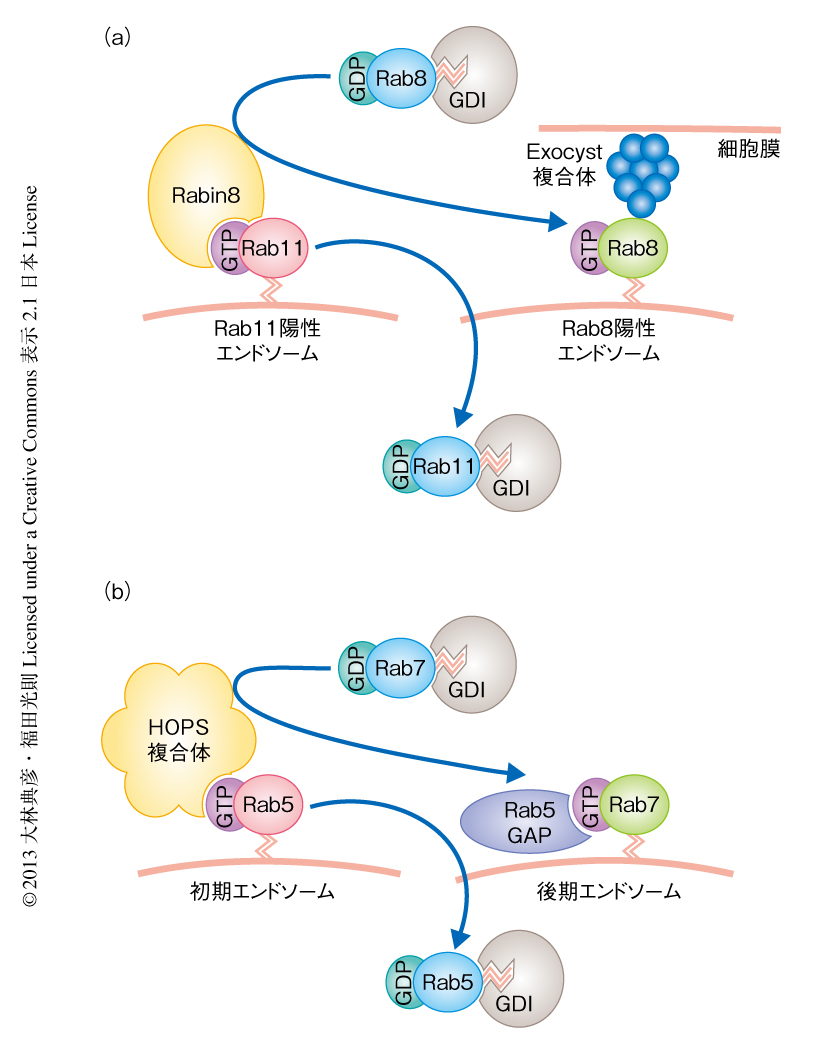
細胞膜はすべてが均一ではなく,特殊な膜ドメイン構造をもつことにより細胞機能の維持に重要な役割をはたしている.この細胞膜の特異的なドメインへの物質輸送を極性輸送とよぶ.たとえば,多くの細胞には1次繊毛(規則的な配置をとる微小管からなる軸糸により,細胞膜の一部が外側に突き出た構造)という小さな突起構造がある.ここにはロドプシンやソマトスタチン受容体などのGタンパク質共役受容体が豊富に含まれており,細胞外の環境を感知するためのセンサー構造として注目されている.1次繊毛に極性輸送されるリサイクリングエンドソームにはRab11が存在し,エフェクタータンパク質であるRabin8を小胞にリクルートする.Rabin8はRab8のGEF活性をもつため,Rab8もこの小胞にリクルートされる.つぎに,Rab8はSec15との結合を起点として小胞にExocyst複合体をリクルートし細胞膜に繋留する46)(図5a).なお,Exocyst複合体は8つのサブユニットからなる巨大なタンパク質複合体であり,トランスゴルジネットワークやリサイクリングエンドソームからの輸送小胞を細胞膜へ繋留する役割を担っている47).また,極性輸送は上皮細胞の頂端-基部極性の形成にも重要な役割をはたしており,Rab8Aノックアウトマウスでは頂端部の細胞膜への極性輸送の異常による小腸微絨毛萎縮の症状を示す48).
あるひとつのオルガネラが成熟段階を変化させると,それにともないRabタンパク質の変換が生じる.たとえば,エンドソームの成熟の過程をみてみると,初期エンドソーム膜に局在するRab5は後期エンドソーム膜には存在せず,代わりにRab7が存在している.この過程では,まず,Rab5はHOPS複合体をエンドソーム膜にリクルートする.HOPS複合体はRab7のGEFとして機能するVps39をサブユニットとしてもつことから,つぎに,エンドソーム膜にRab7がリクルートされる49)(図5b).一方,線虫の後期エンドソームではRab5のGAPが機能することによりRab5が取り除かれるという報告があるものの50),脊椎動物においてはRab5のGAPの関与は明らかではない.このように,Rabタンパク質の変換はRabのエフェクタータンパク質,および,GEFあるいはGAPによる連続的で調和のとれたはたらきにより実行されるため,“Rabカスケード”とよばれている.このRabカスケードはメンブレントラフィックのさまざまな局面において認められる.さきに述べた1次繊毛の形成の過程におけるRab11からRab8のカスケード(図5a)もこの一例であり46),Rabin8のように,1分子内に上流となるRabタンパク質(ここでは,Rab11)の活性化型との結合ドメイン(Rab結合ドメイン)と,下流となるRabタンパク質(ここでは,Rab8)の活性化ドメイン(GEFドメイン)とをあわせもつタンパク質が機能する局面では,Rabカスケードが機能している場合が多い.しかし,1分子内に存在するRab結合ドメインとGEFドメインとが別々の生理機能を担っている場合もあるので注意が必要である51).
これまで述べてきたように,Rabタンパク質はさまざまなメンブレントラフィックにおけるキーファクターであるため,Rabタンパク質それ自体の異常だけでなく,その活性化を制御するタンパク質やエフェクタータンパク質の異常はさまざまな疾患をひき起こす52).また最近では,病原性微生物が宿主側のRabタンパク質を巧妙に用いることにより感染を成立させていることなども明らかになってきている53).ここでは,それらの代表例をいくつか紹介する.
Rabタンパク質とがんとの関連性を示す報告は数多くあるが,よく理解されている例としてはRab25があげられる.Rab25はRab11と類似しており(Rab11Cとよばれることもある),卵巣がんや乳がんにおいて高発現している.とくに,Rab25はCLIC3と協調的に機能し,エンドサイトーシスされたα5β1インテグリンをリサイクリングさせて仮足(pseudopodia)へと輸送する.これにより細胞の移動を促進させ,がん細胞の転移に関与するものと考えられている54).
先天性疾患の代表例としては,メラノソームのアクチンフィラメントにそった輸送(アクチン輸送)を制御するRab27A,Slac2-a,ミオシンVaからなる三者複合体のいずれかの異常により色素異常の症状を示すGriscelli症候群があげられる.ミオシンVaの異常は1型Griscelli症候群,Rab27Aの異常は2型Griscelli症候群,Slac2-aの異常は3型Griscelli症候群の原因となる38).メラノソームのアクチン輸送に異常が生じると,メラノソームは微小管からアクチンフィラメントへと受け渡されず,微小管を逆行性にもどってしまい核の近傍に凝集する(図4b).このため,メラノソームはメラノサイトから隣接する毛母細胞や皮膚角化細胞へと受け渡されずに色素異常の症状を示す.また,2型Griscelli症候群は色素異常にくわえ免疫疾患をともなうが,これはRab27Aがメラノソームだけでなく,細胞傷害性T細胞や好中球からの顆粒の放出にも関与しているためである38).ほかにも,Rab3A,Rab7,Rab18,Rab23,Rab33B,Rab38,Rab39Bなどの変異によりヒトやマウスにおいて疾患が発症することが知られており,詳細は文献を参照されたい52).
新規に合成されたRabタンパク質のシャペロンとして機能するREP1に異常が生じると,先天性脈絡膜欠如(choroideremia)を発症する.おそらく,ほかの組織にREP2が存在し相補的に機能しているため,このように限定された組織において疾患が発症するものと思われる.また,同じくRabタンパク質のシャペロンであるGDIαに異常があるとX連鎖精神遅滞(X-linked mental retardation)の症状を示す.Rab3はシナプス小胞に存在しその分泌に深くかかわることからGDIαのターゲットの候補としてRab3が考えられており,実際に,Rab3のGAPに異常が生じるとWarburg Micro症候群やMartsolf症候群といった神経疾患がひき起こされる.
病原性微生物の例としては,リステリア菌,ピロリ菌,レジオネラ菌,サルモネラ菌,クラミジア菌などの真正細菌の感染におけるRabタンパク質の報告があるが53),基本的には,宿主の細胞に取り込まれたこれらの真正細菌が宿主のRabタンパク質にはたらきかけ,リソソームをはじめとする異物認識機構からうまくまぬがれる手段を獲得するものである.たとえば,食中毒をひき起こすサルモネラ菌(Salmonella enterica serovar Typhimurium)がエンドサイトーシスによりマクロファージなどに侵入すると,エンドソームの内部において増殖するが,そのままだと,この小胞はリソソームと融合しサルモネラ菌は宿主から排除される運命にある.しかし興味深いことに,この小胞ではリソソームにリクルートされるべき酸性加水分解酵素が排除されている.これは,サルモネラ自体がコードするタンパク質SifAにより,Rab9依存性のマンノース6-リン酸受容体のトランスゴルジネットワークへの逆行輸送が阻害され,マンノース6-リン酸受容体のリサイクリングが抑制されることによりリソソームに輸送されるべき酸性加水分解酵素が減少する,といった巧妙な戦略によるものである55).
現在のところ,Rabタンパク質は哺乳動物において60種類以上ものアイソフォームが存在する.ここで述べたように,Rab1やRab5をはじめその機能のよく理解されているものもあるが,多くのRabタンパク質はまだその機能はよく理解されていない.また,いまだ多くのRabタンパク質において,対応するエフェクタータンパク質やGEFあるいはGAPは同定されていない7,56).したがって,機能未知のRabタンパク質に着目し,新しいエフェクタータンパク質やGEFあるいはGAPを探索しその機能の解明に取り組むことは,メンブレントラフィックの新たな局面を解き明かす可能性をひめている.さきに述べたRab12の機能の発見,すなわち,リサイクリングエンドソームからリソソームにつながる経路の発見などは,その好例ではないかと考えられる19,20).その一方で,Rab5やRab27などのように,ひとつのRabタンパク質に複数のエフェクタータンパク質の存在するケースもある.たとえば,メラノソームのアクチン輸送を制御するRab27A,Slac2-a,ミオシンVaの相互作用は,細胞膜に繋留される際には,Rab27AとSlp2-aとの相互作用に変化する.このエフェクタータンパク質の交換はSlac2-aとSlp2-aのRab27Aに対する親和性の違いによりある程度は説明できるものの38),本当のところはよくわかっていない.したがって,ひとつのRabタンパク質に対する複数のエフェクタータンパク質の使い分けがどのように制御されているのかを明らかにできれば,メンブレントラフィックの連続した流れの理解が飛躍的に向上するものと考えられる.そのためには,活性化型のRabタンパク質を生細胞イメージング法により高解像度に検出する技術が,ますます有用になってくるものと予想される57).
略歴:2002年 京都大学大学院薬学研究科 修了,同年 岡崎統合バイオサイエンスセンター 博士研究員,2005年 北海道大学大学院薬学研究科 助手を経て,2008年より東北大学大学院生命科学研究科 助手(現 助教).
研究テーマ:メラノソームの形成や細胞骨格における輸送にかかわる分子機構の探求とその普遍性の追究.
福田 光則(Mitsunori Fukuda)
東北大学大学院生命科学研究科 教授.
研究室URL:http://www.biology.tohoku.ac.jp/lab-www/fukuda_lab/home-ja.html
© 2013 大林典彦・福田光則 Licensed under CC 表示 2.1 日本
(東北大学大学院生命科学研究科 膜輸送機構解析分野)
email:大林典彦,福田光則
領域融合レビュー, 2, e006 (2013) DOI: 10.7875/leading.author.2.e006
Norihiko Ohbayashi & Mitsunori Fukuda: Rab GTPases and their roles in membrane traffic.
要 約
真核生物の細胞に存在するエンドソームやリソソームなどのオルガネラや細胞膜は,それぞれが独立しているわけではなく,メンブレントラフィックにより密接にかかわりあっている.Rasスーパーファミリーに属するRabタンパク質は,このメンブレントラフィックにおいてきわめて重要な制御因子である.Rabタンパク質の機能の異常は神経疾患や免疫疾患をはじめ,じつに多岐にわたる病態にかかわっていることから,Rabタンパク質は個々の細胞の生存だけでなく,さまざまな高次機能にも不可欠であると考えられている.ここでは,Rabタンパク質による制御機構やその生理機能,そして,Rabタンパク質の機能異常とそれにともなう病態に関する最近の知見を概説する.
はじめに
小胞体において合成され正しくフォールディングされた膜タンパク質や分泌タンパク質は,ゴルジ体およびトランスゴルジネットワークをへてさまざまな目的地へと運ばれる.たとえば,分泌経路により細胞の外や細胞膜へと輸送されるタンパク質や,エンドソームなどのオルガネラに輸送されるタンパク質がある.後者の輸送は,細胞膜からエンドサイトーシスによりオルガネラに到達するものとあいまって複雑なネットワークを構築しており,それぞれのオルガネラが膜やその内容物を交換しあっている.これらのネットワークは基本的に脂質二重膜に包まれた小胞の行き来により制御されており,供与側のオルガネラにおける積み荷タンパク質の選別と小胞の出芽,モータータンパク質による輸送,標的となる膜への繋留および融合といったダイナミックな膜動態をともなう.これらの膜動態を総称してメンブレントラフィック(膜輸送あるいは小胞輸送)とよんでいる(図1).また最近では,経済用語を借用して細胞内ロジスティクスともよばれる.
近年,このメンブレントラフィックにおける普遍的な制御因子として注目をあつめているのがRabタンパク質である.RabファミリーはRasスーパーファミリーに属する低分子量Gタンパク質のなかで最大のファミリーを形成する.ヒトでは66種類のRabタンパク質(GTPaseドメイン以外のドメインをもつ,ほかとはやや異なるRab44やRab45も含む)が報告されており1),それぞれが特異的なメンブレントラフィックを制御するものと考えられている.Rabタンパク質は,ほかの低分子量Gタンパク質と同じく,2つのヌクレオチド結合状態をサイクルする分子スイッチとして機能する.すなわち,GTP結合型の活性化状態とGDP結合型の不活性化状態とのあいだでそのコンフォメーションを変換する.Rabタンパク質は膜に可逆的に結合するが,これはRabタンパク質の活性化の状態に依存しており,一般的に,GTP結合型である活性化型のRabタンパク質は,C末端に存在する1つまたは2つのシステイン残基を介してゲラニルゲラニル(疎水性プレニル基)化されることにより膜に結合している.膜に結合した活性化型Rabタンパク質は,おのおののRabタンパク質に特異的なエフェクタータンパク質と結合し,オルガネラにおける小胞の出芽,小胞の細胞骨格にそった輸送,あるいは,特異的なオルガネラへの繋留や融合を制御している2).
ここでは,これら多彩な役割を担うRabタンパク質の制御機構や生理機能,そして,Rabタンパク質の機能破綻による病態の発症機構について概説する.
1.分子スイッチとしてのRabタンパク質によるオンオフの制御
細胞質において合成されたRabタンパク質は,そのままでは膜に結合することはできない.新規に合成されたRabタンパク質は,まず,Rabエスコートタンパク質(REP:Rab escort protein)の作用により,Rabゲラニルゲラニル転移酵素(Rab-GGT:Rab geranylgeranyl transferase)に受け渡される3).つぎに,Rab-GGTはRabタンパク質のC末端に存在するシステイン残基をゲラニルゲラニル化する4).この脂質化修飾により,Rabタンパク質は細胞膜やオルガネラ膜と相互作用することが可能になる.つづいて,Rabタンパク質に特異的なグアニンヌクレオチド交換因子(GEF:guanine-nucleotide exchange factor)の作用によりGDPからGTPへの交換反応(活性化)が行われる5).Rabタンパク質にGTPが結合するとRabタンパク質のスイッチIおよびスイッチIIとよばれる領域において構造変化が起こり,スイッチ領域やスイッチ間領域にエフェクタータンパク質が結合することのできる活性化状態になる6).活性化型のRabタンパク質と結合したエフェクタータンパク質は,その機能に応じてメンブレントラフィックにおけるさまざまなステップを制御する.これまでに報告されたエフェクタータンパク質は多種多様であり,のちに,いくつかの例を述べる.
さて,膜に結合した活性化型のRabタンパク質は,メンブレントラフィックにおける役割をおえると不活性化される必要がある.Rabタンパク質それ自体にもGTPをGDPに加水分解するGTPase活性が備わっているが,この作用だけでは不十分で,Rabタンパク質に特異的なGTPase活性化タンパク質(GAP:GTPase-activating protein)の助けを得ることでRabタンパク質は不活性化される7).不活性化されたGDP結合型のRabタンパク質は,サイトゾルに存在するGDP解離抑制因子(GDI:GDP dissociation inhibitor)の作用により,C末端のゲラニルゲラニル基を保持したまま膜から引き抜かれる.ゲラニルゲラニル基は親水性であるサイトゾルでは不安定であるが,GDIがゲラニルゲラニル基に対しシャペロンとして機能することにより不活性化型Rabタンパク質をサイトゾルにおいて安定に保持し,再活性化されるまで待機させることができる8).興味深いことに,REPとGDIはどちらも不活性化型Rabタンパク質のシャペロンとしての機能をもつが,脂質化修飾されたRabタンパク質に対する親和性という点において両者は大きく異なる.REPはゲラニルゲラニル化Rabタンパク質と未修飾Rabタンパク質とに対する親和性において大きな差はないが,GDIはゲラニルゲラニル化Rabタンパク質に対して圧倒的に高い親和性をもち,Rabタンパク質の再利用におけるGDIの重要性の根拠となっている9).不活性化型のRabタンパク質は最終的にGDIから解離することによりふたたび膜と相互作用することが可能になり,GEFの作用によりGTP結合型の活性化状態へと変換する.なお,このGDIからの解離については,GDI置換因子(GDF:GDI displacement factor)により行われるとの報告もあるが10),その機能は一部のRabタンパク質に対してのみでありコンセンサスは得られていない.
このように,Rabタンパク質の活性化のスイッチ,および,それにともなうオルガネラ膜への局在のオンオフのサイクルは,GEF,GAP,GGT,REP,GDIといったタンパク質の協調作用による制御をうけている(図2).
2.Rabタンパク質の細胞内局在とメンブレントラフィック
小胞体において新規に合成されたタンパク質は,ゴルジ体を経由してトランスゴルジネットワークに到達するとそこで選別をうけ,さまざまな輸送の過程をへることになる.たとえば,ホルモン顆粒の産生やグルコース輸送体の輸送などには細胞膜への分泌経路が利用されており,この輸送経路ではRab3,Rab27,Rab10などが活躍する11,12).細胞膜や初期エンドソームにはRab5が存在し,エンドサイトーシスにより細胞に取り込まれた小胞と初期エンドソームとの融合を促す13).また,初期エンドソームはソーティングエンドソームともよばれ,細胞膜や細胞の外から取り込まれた物質をさまざまなオルガネラへと振り分ける機能をもち,Rab5だけでなく,Rab4やRab21をはじめ14,15),多くのRabタンパク質が存在する.細胞に取り込まれた物質のうち不要なものは,初期エンドソームから分化した後期エンドソームをへてリソソームと融合することにより分解される.後期エンドソームからリソソームにかけてはRab7が重要な機能を担う16).一方,再利用すべき物質は,初期エンドソームから即座に細胞膜へともどる過程(rapid recycling)と,いちど中心体の近傍に存在するエンドサイトーシスリサイクルコンパートメント(ERC:endocytic recycling compartment)へと運ばれそこから出芽したリサイクリングエンドソームにより細胞膜へともどる過程(slow recycling)の,いずれかを経由する.前者の過程にはRab4が14),後者の過程にはRab11が主要なはたらきをしており,細胞接着因子であるインテグリンやカドヘリンのリサイクリングにはRab11が積極的にかかわっている17,18).また,トランスフェリン受容体や一部のアミノ酸輸送体などリサイクリングエンドソームに移行したものは分解をうけないと考えられていたが,最近,Rab12に依存的にリソソームにリクルートされるという新規の輸送過程も見い出されている19,20).さらに,初期エンドソーム,後期エンドソーム,リサイクリングエンドソームからは,トランスゴルジネットワークにも小胞を逆行輸送させており,その詳細はのちに述べる.
3.Rabタンパク質のオルガネラ膜への局在の特異性
Rabファミリーを構成するそれぞれのメンバーは特異的な膜への局在を示し,固有のメンブレントラフィックを制御していると考えられている(図3).たとえば,Rab1やRab2は小胞体およびゴルジ体に局在して小胞体とゴルジ体とのあいだのメンブレントラフィックを制御し21),Rab3は分泌小胞に特異的に局在してシナプス小胞などのエキソサイトーシスを制御している11).では,これらRabタンパク質の膜への局在はどのように制御されているのだろうか.これまで,以下に述べるような複数のモデルが提示されており,おそらく,それぞれのモデルを複合的に用いることによりRabタンパク質の局在は規定されているものと思われる.Rabタンパク質の1次構造を比べてみると,Rabファミリーのあいだでは保存されているが,RasやRhoなどほかの低分子量Gタンパク質には存在しない特異的な約5アミノ酸残基からなる配列が5か所に存在しF1~F5とよばれている.さらに,SF1~SF4とよばれるRabサブファミリーのあいだでよく保存された比較的長いアミノ酸配列も4か所に存在している.これらF1~F5およびSF1~SF4のアミノ酸配列がRabタンパク質の局在性を規定するとのモデルが提示されている22).
そのほかにも,GEFが局所的にRabタンパク質をGTP型に変換して活性化し,GDIとの親和性を低下させることによりその解離を促して,Rabタンパク質を特異的な膜と結合させるとのモデルが提唱されている.たとえば,Rab27AのGEFとして知られるDENN/MADDはRab27Aのメラノソームへの局在を制御しているとの報告や23),Rab5のGEFであるRabex-5をミトコンドリアに異所的に発現させると本来は初期エンドソームに局在すべきRab5がミトコンドリアに局在するようになるとの報告は24),このモデルの裏づけになっている.このように,GEFはRabタンパク質の局在制御における主要なタンパク質のひとつと考えられるが,そのためには,Rabタンパク質よりも対応するGEFがさきに特異的な膜に局在する必要性があり,それには,オルガネラ膜に存在するイノシトールリン脂質に対するGEFの親和性や,のちに述べるRabカスケードのような分子機構が必要になる.
さらに,活性化型のRabタンパク質が特異的なオルガネラ膜に局在すると,ひきつづきそのエフェクタータンパク質が結合することにより,Rabタンパク質を膜において安定化させているとの報告もある.たとえば,後期エンドソームに局在するRab9はエフェクタータンパク質であるTIP47との結合がその局在に重要である25).また,初期エンドソームに局在するRab5はそのエフェクタータンパク質Rabaptin-5との結合を介し間接的にRabex-5をRab5自体にリクルートする.Rabex-5はRab5のGEFとして機能するためさらにRab5が活性化されることになり,Rab5の局在がより安定化される26).すなわち,エフェクタータンパク質との結合はRabタンパク質の局在にとり正のフィードバック的な要素を含むと考えることができる.
4.Rabタンパク質により輸送される積み荷タンパク質の選別と小胞の出芽
オルガネラのあいだを行き来する小胞は,その表面がCOPIやCOPII,あるいは,クラスリンなどのコートタンパク質によりおおわれている.これらのコートタンパク質はおもにArf/Sarファミリーに属する低分子量Gタンパク質により制御されながら供与側のオルガネラ膜に集積するが,輸送されるべき積み荷タンパク質の選別の過程にはRabタンパク質も重要な役割をはたしている.リソソームに含まれる酸性加水分解酵素は膜タンパク質であるマンノース6-リン酸受容体に結合してトランスゴルジネットワークから後期エンドソームへと輸送されるが,後期エンドソームに到達した酸性加水分解酵素はマンノース6-リン酸受容体から解離し,役目をはたしたマンノース6-リン酸受容体はふたたびトランスゴルジネットワークへともどり再利用される.Rab9のエフェクタータンパク質であるTIP47はマンノース6-リン酸受容体の細胞質領域との結合能ももち,後期エンドソームに存在するRab9にTIP47が結合するとTIP47とマンノース6-リン酸受容体との結合が強まり,後期エンドソームにおけるマンノース6-リン酸受容体の輸送小胞への選別と出芽が促進される27).また,別の例として,レトロマーとよばれるタンパク質複合体があげられる.レトロマーはエンドソーム膜においてコートタンパク質として機能するが,Rab7のエフェクタータンパク質としても機能しており,Rab7はレトロマーとの相互作用を介してトランスゴルジネットワークに輸送される積み荷タンパク質の選別と小胞の出芽にかかわっている28).
5.Rabタンパク質による被覆小胞の脱コート
ほとんどの輸送小胞はコートタンパク質によりおおわれているため,標的となる膜に融合するまえにコートタンパク質を小胞膜から脱離(脱コート)する必要がある.ここでは,クラスリン依存性エンドサイトーシスののちの脱コートを例に,その分子機構を説明する.細胞膜に存在するリン脂質であるホスファチジルイノシトール4,5-ビスリン酸を認識してクラスリンアダプター複合体であるAP-2が弱く結合すると,特定のキナーゼAAKがAP-2のμサブユニットをリン酸化することによりAP-2の細胞膜への結合は安定化する.つぎに,AP-2がトランスフェリン受容体などの積み荷タンパク質を認識してクラスリンを集合させることにより,被覆小胞が形成される29).このクラスリン被覆小胞にはRab5が存在しており,Rab5とそのGEFであるGAPVD1(hRME-6)が協調してクラスリン被覆小胞を脱コートさせる30).すなわち,GAPVD1は被覆小胞からAAKを解離させたり,あるいは,Rab5のエフェクタータンパク質であるホスファチジルイノシトール3-キナーゼやホスファチジルイノシトールホスファターゼをリクルートすることで細胞膜からもち込まれたホスファチジルイノシトール4,5-ビスリン酸のレベルを低下させたりすることにより,クラスリン被覆小胞の脱コートをひき起こすものと考えられている.
6.Rabタンパク質による輸送小胞の移動
供与側のオルガネラ膜から出芽した輸送小胞は微小管やアクチンフィラメントといった細胞骨格にそって運ばれ目的地のオルガネラに到達する.微小管は核の近傍に存在する微小管形成中心から細胞の辺縁にむかって延びており,辺縁部にむかう順行輸送にはキネシンモータータンパク質が,反対の方向にむかう逆行輸送にはダイニンモータータンパク質が機能する.これらのモータータンパク質と輸送小胞とをつなげるリンカーとして,Rabタンパク質は重要な役割を担っている31,32).たとえば,エンドソームに存在するRab14を認識してキネシン-3が直接に結合することにより,FGF受容体のゴルジ体からエンドソームへの順行輸送が制御されている33).また,ゴルジ体に存在するRab6のエフェクタータンパク質としてRabkinesin-6が報告されているが,これはキネシン-6のサブユニットとして知られ,細胞質分裂に重要な役割をはたしている34).以上は,Rabタンパク質とキネシンモータータンパク質との直接的な相互作用によるものだが,小胞膜にあるRabタンパク質がエフェクタータンパク質を介しキネシンモータータンパク質と間接的に相互作用するケースも報告されている.たとえば,Rab3はDENN/MADDを介してキネシンモータータンパク質に相互作用し,Rab3陽性小胞をニューロンの軸索にそって順行方向に輸送する35).また,小胞体やゴルジ体に存在するRab1Aはメラノサイト(色素細胞)にあるメラノソームにも存在しその順行輸送を制御しているが,ここにも,Rab1Aとキネシンモータータンパク質とをつなぐエフェクタータンパク質の存在が想定されている36).
微小管を逆行方向に輸送するダイニンモータータンパク質とRabタンパク質との関係についても多くの報告がある.たとえば,後期エンドソームに局在するRab7はエフェクタータンパク質であるRILPを介してダイニンとダイナクチンからなる複合体と相互作用し,後期エンドソームの逆行輸送を制御している16).また,メラノソームに局在するRab36は,同じくRab36のエフェクタータンパク質でもあるRILPを介してダイニンとダイナクチンからなる複合体と相互作用し,メラノソームの逆行輸送を制御している37).
輸送小胞は微小管を長距離にわたりダイナミックに動くのに対し,アクチンフィラメントではミオシンモータータンパク質のはたらきにより短距離の局所的な動きをし,そののち,細胞膜へと輸送される.Rabタンパク質とミオシンモータータンパク質との関連性でよく研究されているものとして,Rab27Aの例があげられる(図4a).メラノソームに局在するRab27Aはエフェクタータンパク質であるSlac2-a(melanophilinともよばれる)を介してミオシンVaと相互作用することにより,メラノソームの微小管からアクチンフィラメントへの受け渡し,そして,アクチンフィラメントにおける局所的な動きを制御している38).さらに,Rab27AはSlac2-aとは異なるエフェクタータンパク質であるSlp2-aに結合の相手を変えてメラノソームを細胞膜に繋留する38).ほかの例としては,シナプス後部における神経伝達物質受容体のエンドサイトーシスとリサイクリングによる発現制御機構に対するRab11とミオシンVbの関与があげられる.長期増強(LTP:long-term potentiation)の過程において,AMPA型グルタミン酸受容体を含むRab11陽性小胞はRab11のエフェクタータンパク質であるFIP2を介してミオシンVbと相互作用することにより,シナプス後膜に輸送される39).このように,小胞膜あるいはオルガネラ膜にあるRabタンパク質とモータータンパク質とをつなぐ例は枚挙にいとまがなく31),オルガネラに特異的な小胞輸送における特異性を示唆するものと考えられる.
7.Rabタンパク質による繋留および膜融合
一般的に,輸送小胞は最初に繋留タンパク質による相互作用(繋留あるいはドッキングとよばれる)を介して目的地となるオルガネラと結合する.そののち,SNARE(soluble NSF attachment protein receptor)タンパク質の作用により輸送小胞と標的となる膜との融合が起こる.この過程においてもRabタンパク質は繋留タンパク質およびSNAREタンパク質と相互作用し,繋留から融合のステップに深く関与している.繋留タンパク質は,ひとつの比較的大きなタンパク質によるものと,多くのサブユニットから構成されるタンパク質複合体によるものの,大きく2つのグループに分けることができる.ひとつのタンパク質によるものとしては,コイルドコイルタンパク質(p115,GM130,GCC185などのゴルジ体に局在するゴルジンファミリータンパク質や,EEA1などのRab5エフェクタータンパク質)やシナプトタグミン様タンパク質などの報告がある.また,タンパク質複合体によるものとしては,HOPS/Vps-C複合体,Exocyst複合体,COG複合体,GARP/VFT複合体,TRAPP複合体などの報告がある40).
小胞体や小胞体-ゴルジ体中間区画(ERGIC:ER-Golgi intermediate compartment)からシスゴルジに輸送されるCOPII小胞にはRab1が存在しており,ひとつの説として,以下のモデルが提唱されている.Rab1が繋留タンパク質であるp115をCOPII小胞にリクルートし,シスゴルジ側にはRab1のエフェクタータンパク質であるGM130が待機している.そして,GM130とp115とが複合体を形成し繋留タンパク質として機能することにより,シスゴルジへ小胞が繋留される41).さらに,GM130はSyntaxin-5などのSNAREタンパク質と相互作用することにより,小胞のシスゴルジへの融合が促進される42).
シナプトタグミン様タンパク質はそのN末端側に存在するSHDドメインを介してRab27と特異的に結合し,分泌小胞の細胞膜への繋留にかかわる.内分泌細胞株のPC12細胞においては,ホルモン顆粒(有芯顆粒ともよばれる)にRab27Aが局在し,エフェクタータンパク質であるrabphilinとの結合を介して細胞膜に存在するSNAP25と結合することにより,ホルモン顆粒を細胞膜に繋留する43).
初期エンドソームに存在するRab5は,その常時活性化型の変異体を発現させると巨大なエンドソームが誘導されるなど,エンドソームの融合に深くかかわっている.Rab5はEEA1やRabenosyn-5といったエフェクタータンパク質をRab5陽性エンドソームにリクルートし,リクルートされたEEA1はそのコイルドコイルドメインを介して二量体化することによりRab5陽性エンドソームどうしを繋留する44).また,EEA1はSyntaxin-6などのエンドソームのSNAREタンパク質とも会合し,Rab5陽性エンドソームの融合を促進する44).さらに,Rab5のエフェクタータンパク質にはホスファチジルイノシトール3-キナーゼやホスファチジルイノシトール4-ホスファターゼあるいはホスファチジルイノシトール5-ホスファターゼなどがあり,Rab5陽性エンドソームにホスファチジルイノシトール3-リン酸を濃縮させる.このため,ホスファチジルイノシトール3-リン酸を特異的に認識するFYVEドメインをもつEEA1やRabenosyn-5は,Rab5陽性エンドソームにさらに保持されやすくなる.したがって,小胞の繋留や融合には低分子量Gタンパク質だけでなく,ホスファチジルイノシトールの機能も重要と考えられる45).
細胞膜はすべてが均一ではなく,特殊な膜ドメイン構造をもつことにより細胞機能の維持に重要な役割をはたしている.この細胞膜の特異的なドメインへの物質輸送を極性輸送とよぶ.たとえば,多くの細胞には1次繊毛(規則的な配置をとる微小管からなる軸糸により,細胞膜の一部が外側に突き出た構造)という小さな突起構造がある.ここにはロドプシンやソマトスタチン受容体などのGタンパク質共役受容体が豊富に含まれており,細胞外の環境を感知するためのセンサー構造として注目されている.1次繊毛に極性輸送されるリサイクリングエンドソームにはRab11が存在し,エフェクタータンパク質であるRabin8を小胞にリクルートする.Rabin8はRab8のGEF活性をもつため,Rab8もこの小胞にリクルートされる.つぎに,Rab8はSec15との結合を起点として小胞にExocyst複合体をリクルートし細胞膜に繋留する46)(図5a).なお,Exocyst複合体は8つのサブユニットからなる巨大なタンパク質複合体であり,トランスゴルジネットワークやリサイクリングエンドソームからの輸送小胞を細胞膜へ繋留する役割を担っている47).また,極性輸送は上皮細胞の頂端-基部極性の形成にも重要な役割をはたしており,Rab8Aノックアウトマウスでは頂端部の細胞膜への極性輸送の異常による小腸微絨毛萎縮の症状を示す48).
8.Rabカスケード
あるひとつのオルガネラが成熟段階を変化させると,それにともないRabタンパク質の変換が生じる.たとえば,エンドソームの成熟の過程をみてみると,初期エンドソーム膜に局在するRab5は後期エンドソーム膜には存在せず,代わりにRab7が存在している.この過程では,まず,Rab5はHOPS複合体をエンドソーム膜にリクルートする.HOPS複合体はRab7のGEFとして機能するVps39をサブユニットとしてもつことから,つぎに,エンドソーム膜にRab7がリクルートされる49)(図5b).一方,線虫の後期エンドソームではRab5のGAPが機能することによりRab5が取り除かれるという報告があるものの50),脊椎動物においてはRab5のGAPの関与は明らかではない.このように,Rabタンパク質の変換はRabのエフェクタータンパク質,および,GEFあるいはGAPによる連続的で調和のとれたはたらきにより実行されるため,“Rabカスケード”とよばれている.このRabカスケードはメンブレントラフィックのさまざまな局面において認められる.さきに述べた1次繊毛の形成の過程におけるRab11からRab8のカスケード(図5a)もこの一例であり46),Rabin8のように,1分子内に上流となるRabタンパク質(ここでは,Rab11)の活性化型との結合ドメイン(Rab結合ドメイン)と,下流となるRabタンパク質(ここでは,Rab8)の活性化ドメイン(GEFドメイン)とをあわせもつタンパク質が機能する局面では,Rabカスケードが機能している場合が多い.しかし,1分子内に存在するRab結合ドメインとGEFドメインとが別々の生理機能を担っている場合もあるので注意が必要である51).
9.Rabタンパク質の機能不全と疾患
これまで述べてきたように,Rabタンパク質はさまざまなメンブレントラフィックにおけるキーファクターであるため,Rabタンパク質それ自体の異常だけでなく,その活性化を制御するタンパク質やエフェクタータンパク質の異常はさまざまな疾患をひき起こす52).また最近では,病原性微生物が宿主側のRabタンパク質を巧妙に用いることにより感染を成立させていることなども明らかになってきている53).ここでは,それらの代表例をいくつか紹介する.
Rabタンパク質とがんとの関連性を示す報告は数多くあるが,よく理解されている例としてはRab25があげられる.Rab25はRab11と類似しており(Rab11Cとよばれることもある),卵巣がんや乳がんにおいて高発現している.とくに,Rab25はCLIC3と協調的に機能し,エンドサイトーシスされたα5β1インテグリンをリサイクリングさせて仮足(pseudopodia)へと輸送する.これにより細胞の移動を促進させ,がん細胞の転移に関与するものと考えられている54).
先天性疾患の代表例としては,メラノソームのアクチンフィラメントにそった輸送(アクチン輸送)を制御するRab27A,Slac2-a,ミオシンVaからなる三者複合体のいずれかの異常により色素異常の症状を示すGriscelli症候群があげられる.ミオシンVaの異常は1型Griscelli症候群,Rab27Aの異常は2型Griscelli症候群,Slac2-aの異常は3型Griscelli症候群の原因となる38).メラノソームのアクチン輸送に異常が生じると,メラノソームは微小管からアクチンフィラメントへと受け渡されず,微小管を逆行性にもどってしまい核の近傍に凝集する(図4b).このため,メラノソームはメラノサイトから隣接する毛母細胞や皮膚角化細胞へと受け渡されずに色素異常の症状を示す.また,2型Griscelli症候群は色素異常にくわえ免疫疾患をともなうが,これはRab27Aがメラノソームだけでなく,細胞傷害性T細胞や好中球からの顆粒の放出にも関与しているためである38).ほかにも,Rab3A,Rab7,Rab18,Rab23,Rab33B,Rab38,Rab39Bなどの変異によりヒトやマウスにおいて疾患が発症することが知られており,詳細は文献を参照されたい52).
新規に合成されたRabタンパク質のシャペロンとして機能するREP1に異常が生じると,先天性脈絡膜欠如(choroideremia)を発症する.おそらく,ほかの組織にREP2が存在し相補的に機能しているため,このように限定された組織において疾患が発症するものと思われる.また,同じくRabタンパク質のシャペロンであるGDIαに異常があるとX連鎖精神遅滞(X-linked mental retardation)の症状を示す.Rab3はシナプス小胞に存在しその分泌に深くかかわることからGDIαのターゲットの候補としてRab3が考えられており,実際に,Rab3のGAPに異常が生じるとWarburg Micro症候群やMartsolf症候群といった神経疾患がひき起こされる.
病原性微生物の例としては,リステリア菌,ピロリ菌,レジオネラ菌,サルモネラ菌,クラミジア菌などの真正細菌の感染におけるRabタンパク質の報告があるが53),基本的には,宿主の細胞に取り込まれたこれらの真正細菌が宿主のRabタンパク質にはたらきかけ,リソソームをはじめとする異物認識機構からうまくまぬがれる手段を獲得するものである.たとえば,食中毒をひき起こすサルモネラ菌(Salmonella enterica serovar Typhimurium)がエンドサイトーシスによりマクロファージなどに侵入すると,エンドソームの内部において増殖するが,そのままだと,この小胞はリソソームと融合しサルモネラ菌は宿主から排除される運命にある.しかし興味深いことに,この小胞ではリソソームにリクルートされるべき酸性加水分解酵素が排除されている.これは,サルモネラ自体がコードするタンパク質SifAにより,Rab9依存性のマンノース6-リン酸受容体のトランスゴルジネットワークへの逆行輸送が阻害され,マンノース6-リン酸受容体のリサイクリングが抑制されることによりリソソームに輸送されるべき酸性加水分解酵素が減少する,といった巧妙な戦略によるものである55).
おわりに
現在のところ,Rabタンパク質は哺乳動物において60種類以上ものアイソフォームが存在する.ここで述べたように,Rab1やRab5をはじめその機能のよく理解されているものもあるが,多くのRabタンパク質はまだその機能はよく理解されていない.また,いまだ多くのRabタンパク質において,対応するエフェクタータンパク質やGEFあるいはGAPは同定されていない7,56).したがって,機能未知のRabタンパク質に着目し,新しいエフェクタータンパク質やGEFあるいはGAPを探索しその機能の解明に取り組むことは,メンブレントラフィックの新たな局面を解き明かす可能性をひめている.さきに述べたRab12の機能の発見,すなわち,リサイクリングエンドソームからリソソームにつながる経路の発見などは,その好例ではないかと考えられる19,20).その一方で,Rab5やRab27などのように,ひとつのRabタンパク質に複数のエフェクタータンパク質の存在するケースもある.たとえば,メラノソームのアクチン輸送を制御するRab27A,Slac2-a,ミオシンVaの相互作用は,細胞膜に繋留される際には,Rab27AとSlp2-aとの相互作用に変化する.このエフェクタータンパク質の交換はSlac2-aとSlp2-aのRab27Aに対する親和性の違いによりある程度は説明できるものの38),本当のところはよくわかっていない.したがって,ひとつのRabタンパク質に対する複数のエフェクタータンパク質の使い分けがどのように制御されているのかを明らかにできれば,メンブレントラフィックの連続した流れの理解が飛躍的に向上するものと考えられる.そのためには,活性化型のRabタンパク質を生細胞イメージング法により高解像度に検出する技術が,ますます有用になってくるものと予想される57).
文 献
- Klopper, T. H., Kienle, N., Fasshauer, D. et al.: Untangling the evolution of Rab G proteins: implications of a comprehensive genomic analysis. BMC Biol., 10, 71 (2012)[PubMed]
- Hutagalung, A. H. & Novick, P. J.: Role of Rab GTPases in membrane traffic and cell physiology. Physiol. Rev., 91, 119-149 (2011)[PubMed]
- Alexandrov, K., Horiuchi, H., Steele-Mortimer, O. et al.: Rab escort protein-1 is a multifunctional protein that accompanies newly prenylated rab proteins to their target membranes. EMBO J., 13, 5262-5273 (1994)[PubMed]
- Andres, D. A., Seabra, M. C., Brown, M. S. et al.: cDNA cloning of component A of Rab geranylgeranyl transferase and demonstration of its role as a Rab escort protein. Cell, 73, 1091-1099 (1993)[PubMed]
- Pfeffer, S. R.: Rab GTPases: specifying and deciphering organelle identity and function. Trends Cell Biol., 11, 487-491 (2001)[PubMed]
- Pfeffer, S. R.: Structural clues to Rab GTPase functional diversity. J. Biol. Chem., 280, 15485-15488 (2005)[PubMed]
- Fukuda, M.: TBC proteins: GAPs for mammalian small GTPase Rab? Biosci. Rep., 31, 159-168 (2011)[PubMed]
- Collins, R. N.: "Getting it on": GDI displacement and small GTPase membrane recruitment. Mol. Cell, 12, 1064-1066 (2003)[PubMed]
- Pylypenko, O., Rak, A., Durek, T. et al.: Structure of doubly prenylated Ypt1:GDI complex and the mechanism of GDI-mediated Rab recycling. EMBO J., 25, 13-23 (2006)[PubMed]
- Sivars, U., Aivazian, D. & Pfeffer, S. R.: Yip3 catalyses the dissociation of endosomal Rab-GDI complexes. Nature, 425, 856-859 (2003)[PubMed]
- Fukuda, M.: Regulation of secretory vesicle traffic by Rab small GTPases. Cell. Mol. Life Sci., 65, 2801-2813 (2008)[PubMed]
- Sano, H., Roach, W. G., Peck, G. R. et al.: Rab10 in insulin-stimulated GLUT4 translocation. Biochem. J., 411, 89-95 (2008)[PubMed]
- Gorvel, J. P., Chavrier, P., Zerial, M. et al.: rab5 controls early endosome fusion in vitro. Cell, 64, 915-925 (1991)[PubMed]
- van der Sluijs, P., Hull, M., Webster, P. et al.: The small GTP-binding protein rab4 controls an early sorting event on the endocytic pathway. Cell, 70, 729-740 (1992)[PubMed]
- Simpson, J. C., Griffiths, G., Wessling-Resnick, M. et al.: A role for the small GTPase Rab21 in the early endocytic pathway. J. Cell Sci., 117, 6297-6311 (2004)[PubMed]
- Johansson, M., Rocha, N., Zwart, W. et al.: Activation of endosomal dynein motors by stepwise assembly of Rab7-RILP-p150Glued, ORP1L, and the receptor βIII spectrin. J. Cell Biol., 176, 459-471 (2007)[PubMed]
- Weigert, R., Yeung, A. C., Li, J. et al.: Rab22a regulates the recycling of membrane proteins internalized independently of clathrin. Mol. Biol. Cell, 15, 3758-3770 (2004)[PubMed]
- Kawauchi, T., Sekine, K., Shikanai, M. et al.: Rab GTPases-dependent endocytic pathways regulate neuronal migration and maturation through N-cadherin trafficking. Neuron, 67, 588-602 (2010)[PubMed]
- Matsui, T., Itoh, T. & Fukuda, M.: Small GTPase Rab12 regulates constitutive degradation of transferrin receptor. Traffic, 12, 1432-1443 (2011)[PubMed]
- Matsui, T. & Fukuda, M.: Rab12 regulates mTORC1 activity and autophagy through controlling the degradation of amino-acid transporter PAT4. EMBO Rep., 14, 450-457 (2013)[PubMed]
- Allan, B. B., Moyer, B. D. & Balch, W. E.: Rab1 recruitment of p115 into a cis-SNARE complex: programming budding COPII vesicles for fusion. Science, 289, 444-448 (2000)[PubMed]
- Ali, B. R., Wasmeier, C., Lamoreux, L. et al.: Multiple regions contribute to membrane targeting of Rab GTPases. J. Cell Sci., 117, 6401-6412 (2004)[PubMed]
- Figueiredo, A. C., Wasmeier, C., Tarafder, A. K. et al.: Rab3GEP is the non-redundant guanine nucleotide exchange factor for Rab27a in melanocytes. J. Biol. Chem., 283, 23209-23216 (2008)[PubMed]
- Blumer, J., Rey, J., Dehmelt, L. et al.: RabGEFs are a major determinant for specific Rab membrane targeting. J. Cell Biol., 200, 287-300 (2013)[PubMed]
- Carroll, K. S., Hanna, J., Simon, I. et al.: Role of Rab9 GTPase in facilitating receptor recruitment by TIP47. Science, 292, 1373-1376 (2001)[PubMed]
- Horiuchi, H., Lippe, R., McBride, H. M. et al.: A novel Rab5 GDP/GTP exchange factor complexed to Rabaptin-5 links nucleotide exchange to effector recruitment and function. Cell, 90, 1149-1159 (1997)[PubMed]
- Aivazian, D., Serrano, R. L. & Pfeffer, S.: TIP47 is a key effector for Rab9 localization. J. Cell Biol., 173, 917-926 (2006)[PubMed]
- Rojas, R., van Vlijmen, T., Mardones, G. A. et al.: Regulation of retromer recruitment to endosomes by sequential action of Rab5 and Rab7. J. Cell Biol., 183, 513-526 (2008)[PubMed]
- Jackson, A. P., Flett, A., Smythe, C. et al.: Clathrin promotes incorporation of cargo into coated pits by activation of the AP2 adaptor μ2 kinase. J. Cell Biol., 163, 231-236 (2003)[PubMed]
- Semerdjieva, S., Shortt, B., Maxwell, E. et al.: Coordinated regulation of AP2 uncoating from clathrin-coated vesicles by rab5 and hRME-6. J. Cell Biol., 183, 499-511 (2008)[PubMed]
- Akhmanova, A. & Hammer, J. A. III.: Linking molecular motors to membrane cargo. Curr. Opin. Cell Biol., 22, 479-487 (2010)[PubMed]
- Ohbayashi, N. & Fukuda, M.: Role of Rab family GTPases and their effectors in melanosomal logistics. J. Biochem., 151, 343-351 (2012)[PubMed]
- Ueno, H., Huang, X., Tanaka, Y. et al.: KIF16B/Rab14 molecular motor complex is critical for early embryonic development by transporting FGF receptor. Dev. Cell, 20, 60-71 (2011)[PubMed]
- Echard, A., Jollivet, F., Martinez, O. et al.: Interaction of a Golgi-associated kinesin-like protein with Rab6. Science, 279, 580-585 (1998)[PubMed]
- Niwa, S., Tanaka, Y. & Hirokawa, N.: KIF1Bβ- and KIF1A-mediated axonal transport of presynaptic regulator Rab3 occurs in a GTP-dependent manner through DENN/MADD. Nat. Cell Biol., 10, 1269-1279 (2008)[PubMed]
- Ishida, M., Ohbayashi, N., Maruta, Y. et al.: Functional involvement of Rab1A in microtubule-dependent anterograde melanosome transport in melanocytes. J. Cell Sci., 125, 5177-5187 (2012)[PubMed]
- Matsui, T., Ohbayashi, N. & Fukuda, M.: The Rab interacting lysosomal protein (RILP) homology domain functions as a novel effector domain for small GTPase Rab36: Rab36 regulates retrograde melanosome transport in melanocytes. J. Biol. Chem., 287, 28619-28631 (2012)[PubMed]
- Fukuda, M.: Versatile role of Rab27 in membrane trafficking: focus on the Rab27 effector families. J. Biochem., 137, 9-16 (2005)[PubMed]
- Wang, Z., Edwards, J. G., Riley, N. et al.: Myosin Vb mobilizes recycling endosomes and AMPA receptors for postsynaptic plasticity. Cell, 135, 535-548 (2008)[PubMed]
- Bonifacino, J. S. & Hierro, A.: Transport according to GARP: receiving retrograde cargo at the trans-Golgi network. Trends Cell Biol., 21, 159-167 (2011)[PubMed]
- Short, B., Haas, A. & Barr, F. A.: Golgins and GTPases, giving identity and structure to the Golgi apparatus. Biochim. Biophys. Acta, 1744, 383-395 (2005)[PubMed]
- Diao, A., Frost, L., Morohashi, Y. et al.: Coordination of golgin tethering and SNARE assembly: GM130 binds syntaxin 5 in a p115-regulated manner. J. Biol. Chem., 283, 6957-6967 (2008)[PubMed]
- Fukuda, M.: Rab27 and its effectors in secretory granule exocytosis: a novel docking machinery composed of a Rab27-effector complex. Biochem. Soc. Trans., 34, 691-695 (2006)[PubMed]
- Simonsen, A., Lippe, R., Christoforidis, S. et al.: EEA1 links PI(3)K function to Rab5 regulation of endosome fusion. Nature, 394, 494-498 (1998)[PubMed]
- Shin, H. W., Hayashi, M., Christoforidis, S. et al.: An enzymatic cascade of Rab5 effectors regulates phosphoinositide turnover in the endocytic pathway. J. Cell Biol., 170, 607-618 (2005)[PubMed]
- Knodler, A., Feng, S., Zhang, J. et al.: Coordination of Rab8 and Rab11 in primary ciliogenesis. Proc. Natl. Acad. Sci. USA, 107, 6346-6351 (2010)[PubMed]
- Das, A. & Guo, W.: Rabs and the exocyst in ciliogenesis, tubulogenesis and beyond. Trends Cell Biol., 21, 383-386 (2011)[PubMed]
- Sato, T., Mushiake, S., Kato, Y. et al.: The Rab8 GTPase regulates apical protein localization in intestinal cells. Nature, 448, 366-369 (2007)[PubMed]
- Rink, J., Ghigo, E., Kalaidzidis, Y. et al.: Rab conversion as a mechanism of progression from early to late endosomes. Cell, 122, 735-749 (2005)[PubMed]
- Chotard, L., Mishra, A. K., Sylvain, M. A. et al.: TBC-2 regulates RAB-5/RAB-7-mediated endosomal trafficking in Caenorhabditis elegans. Mol. Biol. Cell, 21, 2285-2296 (2010)[PubMed]
- Ohbayashi, N., Yatsu, A., Tamura, K. et al.: The Rab21-GEF activity of Varp, but not its Rab32/38 effector function, is required for dendrite formation in melanocytes. Mol. Biol. Cell, 23, 669-678 (2012)[PubMed]
- Seixas, E., Barros, M., Seabra, M. C. et al.: Rab and Arf proteins in genetic diseases. Traffic, 14, 871-885 (2013)[PubMed]
- Stein, M. P., Muller, M. P. & Wandinger-Ness, A.: Bacterial pathogens commandeer Rab GTPases to establish intracellular niches. Traffic, 13, 1565-1588 (2012)[PubMed]
- Dozynkiewicz, M. A., Jamieson, N. B., Macpherson, I. et al.: Rab25 and CLIC3 collaborate to promote integrin recycling from late endosomes/lysosomes and drive cancer progression. Dev. Cell, 22, 131-145 (2012)[PubMed]
- McGourty, K., Thurston, T. L., Matthews, S. A. et al.: Salmonella inhibits retrograde trafficking of mannose-6-phosphate receptors and lysosome function. Science, 338, 963-967 (2012)[PubMed]
- Kanno, E., Ishibashi, K., Kobayashi, H. et al.: Comprehensive screening for novel Rab-binding proteins by GST pull-down assay using 60 different mammalian Rabs. Traffic, 11, 491-507 (2010)[PubMed]
- Aoki, K. & Matsuda, M.: Visualization of small GTPase activity with fluorescence resonance energy transfer-based biosensors. Nat. Protoc., 4, 1623-1631 (2009)[PubMed]
著者プロフィール
略歴:2002年 京都大学大学院薬学研究科 修了,同年 岡崎統合バイオサイエンスセンター 博士研究員,2005年 北海道大学大学院薬学研究科 助手を経て,2008年より東北大学大学院生命科学研究科 助手(現 助教).
研究テーマ:メラノソームの形成や細胞骨格における輸送にかかわる分子機構の探求とその普遍性の追究.
福田 光則(Mitsunori Fukuda)
東北大学大学院生命科学研究科 教授.
研究室URL:http://www.biology.tohoku.ac.jp/lab-www/fukuda_lab/home-ja.html
© 2013 大林典彦・福田光則 Licensed under CC 表示 2.1 日本