肝臓の再生を担う肝前駆細胞とその制御機構
2013/06/10
伊藤 暢・宮島 篤
(東京大学分子細胞生物学研究所 発生・再生研究分野)
email:伊藤 暢
領域融合レビュー, 2, e007 (2013) DOI: 10.7875/leading.author.2.e007
Tohru Itoh & Atsushi Miyajima: Regulatory mechanisms for adult liver progenitor cells that support liver regeneration.

肝臓はきわめて高い再生能力をもち,臓器再生のモデルとして多くの研究が行われてきた.長きにわたり,その解析の中心にあったのは部分肝切除ののちの再生の過程であり,これは成熟した肝細胞の肥大や増殖により担われる代償性の再生である.一方で,薬物や毒物などにより重篤あるいは慢性的な障害をうけ肝細胞自体の増殖が阻害された場合には,正常な肝臓では存在の認められない特殊な肝前駆細胞が活性化されて増幅し,これが肝細胞や胆管上皮細胞へと分化することにより肝臓の機能を回復させるものと考えられている.近年,このような肝前駆細胞に依存性の再生がヒトの病態をより反映するものとして注目をあつめるようになった.肝前駆細胞の実体,とりわけ,その由来についてはいまだ議論がつづく一方で,その制御機構についての理解は急速に進みつつある.ここでは,それらの現状と今後の課題について,肝前駆細胞の活性化に重要なニッチシグナルに関する筆者らの最近の研究成果をまじえ解説する.
再生医療が大きな注目をあつめている.iPS細胞を中心とした昨今のブームのなかにあって,もっぱら人々の思い浮かべる“再生”のイメージとは,機能不全におちいったり古くなったりした臓器を試験管内で人為的につくりだした臓器と置き換えるというような類のものかもしれない.一方で,生体にはもともと,障害や損傷により失われた組織や器官を機能的に修復する自律的な再生能力がある程度まで備わっている.イモリやプラナリアのような比較的下等な生物はきわめて高い再生能力を示すのに対し,残念ながら,ヒトを含む哺乳動物における再生能力は限定的である.
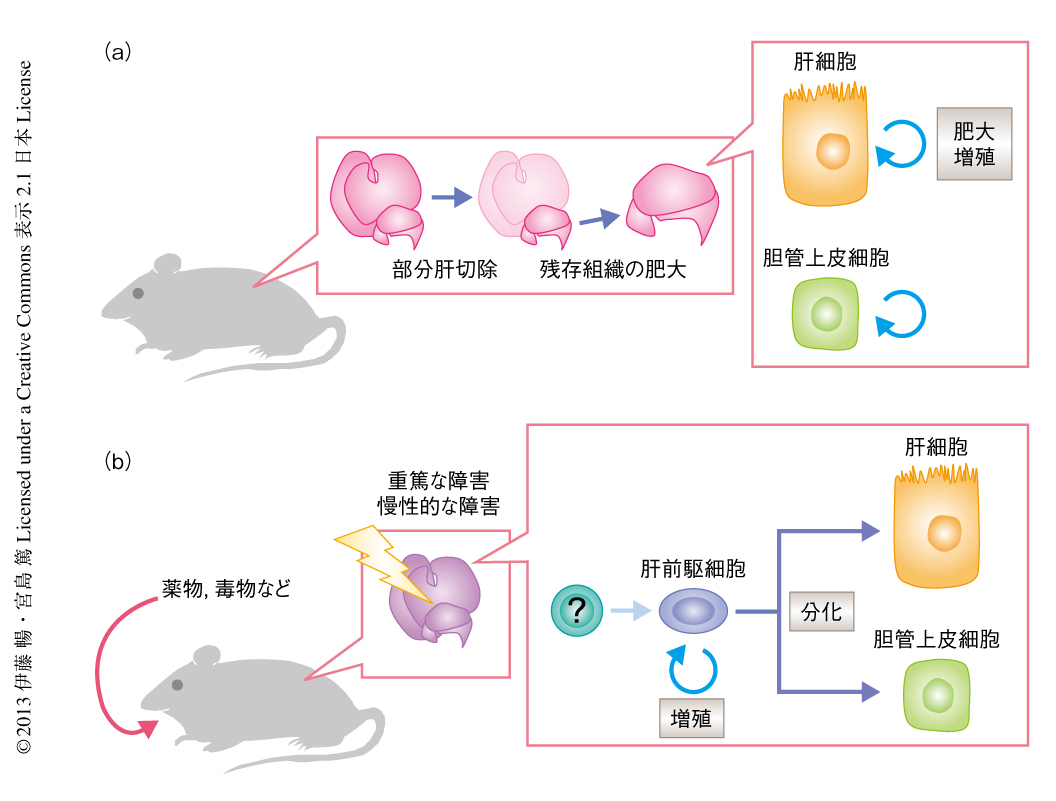
哺乳動物の臓器のなかで例外的に高い再生能力をもつことの知られるのは肝臓である.たとえば,その2/3を外科的に切除(“部分肝切除”とよばれる)した場合でも,残りの部分から短期間(マウスの場合,1週間程度)のうちにもとの大きさへと再生し機能を回復することが可能である(図1a).このような肝臓の高い再生能力ははるか昔より知られていたようで,ギリシャ神話のなかにもプロメテウスの逸話として登場する.すなわち,天上から火を盗んで人間に与えたプロメテウスはゼウスの怒りを買い,コーカサス山頂に磔にされて大鷲に肝臓を啄まれるのだが,彼の肝臓は毎晩再生するため来る日も来る日も同じ苦しみを味わいつづけることになる,というものである.科学の研究においては,部分肝切除にともなう肝臓の再生の実験モデルは1930年代に確立し,当初は,もっぱらラットが対象とされていたが,今日では,トランスジェニックやノックアウトなど遺伝子改変の可能なマウスの系も多用されるようになっている.臓器再生の分野におけるひとつのパラダイムとして長年にわたり解析され,これまでに多くの知見が集積している.
このような肝臓の再生の分野に,近年,新たな展開が生まれている.これまで中心であった部分肝切除モデルとは異なる様式により担われる肝臓の再生の分子機構に注目があつまり,急速にその理解が進みつつある.そこに主役として登場するのが,“肝前駆細胞”である.
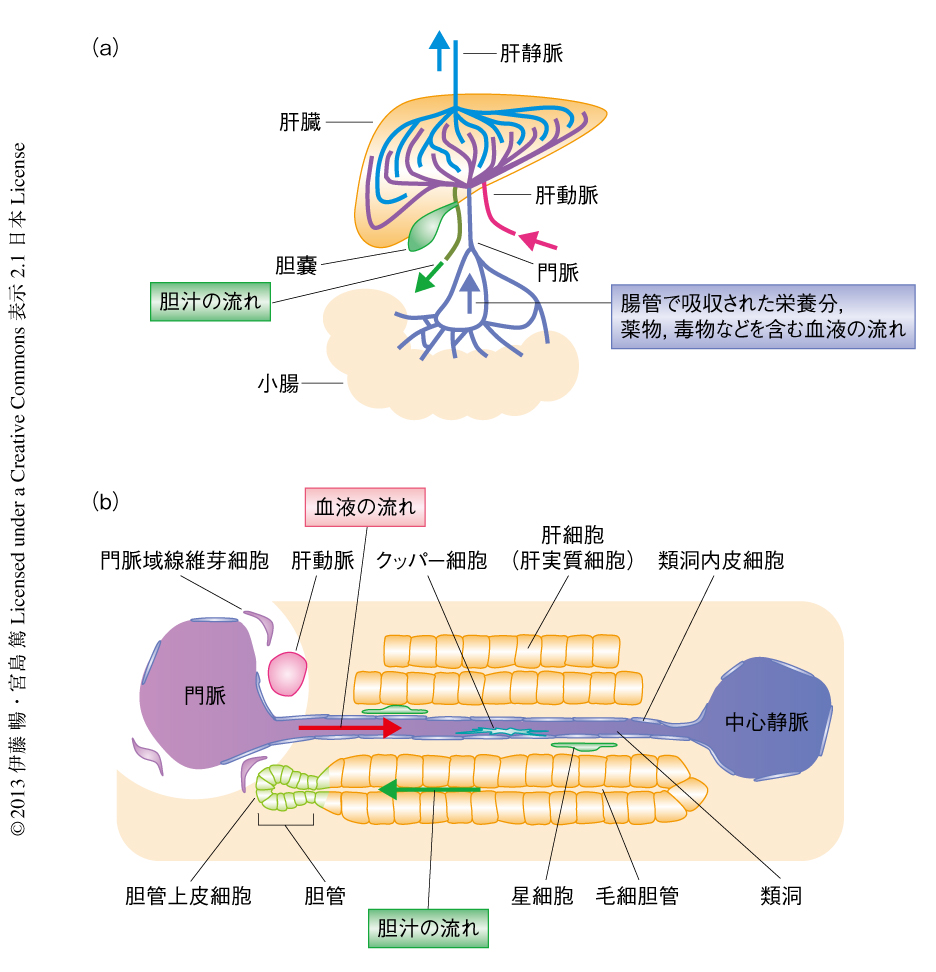
肝臓の外観における大きな特徴のひとつは,分葉構造をとる点である.葉(lobe)の数は,ヒトでは4つ,ラットやマウスでは数え方により4つから7つとされている.葉により機能的な違いがあるとは考えられておらず,分葉構造をとる理由は明らかではない.ただし,特定の葉の付け根を結紮して切断することにより,一定の体積を外科的に切除することが可能であることは,実験を行ううえで大きなメリットである.解剖学的なもうひとつの大きな特徴は,通常の動脈(肝動脈)および静脈(肝静脈)にくわえて,門脈とよばれる血管の流入のある点である(図2a).消化管において吸収された栄養分や薬物あるいは毒物などは,この門脈を介して,まずは肝臓へと流れ込む.したがって,肝臓は生体における化学的なフィルターあるいはバリアと位置づけられている.
代謝や解毒の中心器官である肝臓は,そのほかにもきわめて多くの重要な生理機能をもつ.それら機能の大部分は実質細胞である肝細胞により担われている.肝細胞は機能的な中心であると同時に,肝臓全体の8割ほどをしめていることから,多少乱暴ないい方にはなるが,肝臓の再生とは第一義的には肝細胞の再生のことだといい換えられる.肝臓の組織において,肝細胞は門脈と中心静脈という2種類の血管を両端とする軸にそって配列し,そのような肝細胞のあいだを類洞とよばれる毛細血管が走行する(図2b).肝臓を構成する肝細胞(肝実質細胞)以外の細胞はひとくくりに肝非実質細胞と称され,胆管上皮細胞,星細胞,線維芽細胞,類洞内皮細胞,クッパー細胞のほか,各種の免疫系の細胞などがそれに含まれる.
肝臓の再生を理解するうえでは,これとは別に,上皮系細胞とそれ以外という大別のしかたをするのが有効である.肝臓においては肝細胞および胆管上皮細胞が上皮系の細胞であるが,これらは組織の構造において連続して存在している.肝細胞と胆管上皮細胞との接続部分は解剖学的に“ヘリング管”(canal of Hering)とよばれる構造をとる.肝細胞のもつ重要な機能のひとつが胆汁の産生であり,肝細胞において産生された胆汁は,隣接する肝細胞のあいだに形成される間隙(毛細胆管)へと分泌される.毛細胆管に流れ出た胆汁は,ヘリング管を通じて胆管上皮細胞により構成される管腔構造である胆管へと注ぎ込んで集合し,肝臓の外へ出たのち最終的に十二指腸へと排出される.
肝細胞および胆管上皮細胞は発生の過程において,胎児の肝臓に存在する共通の前駆細胞である“肝芽細胞”(hepatoblast)に由来する.肝臓学の分野では,肝細胞および胆管上皮細胞への二方向性の分化能をもつ細胞を“肝幹細胞”と定義し,肝芽細胞は胎児期における肝幹細胞と位置づけられている1).しかしながら,肝芽細胞と同等あるいは類似した性状をもつ細胞の存在は,成体の肝臓においては明確には認められない.成体の肝臓から取り出して培養系に供した場合に高い増殖能やコロニー形成能,二方向性の分化能を示す細胞の存在は報告されているものの2-4),それらの細胞がもともとの生体の肝臓においてどこに存在し,どのような機能を担うのか,肝臓の組織のメンテナンス(正常な状況のもとでの組織のターンオーバー)や肝臓の再生に寄与しているのかどうかは,まったくもって不明である.血液系や腸管,皮膚などの組織では,成熟し分化した細胞の寿命は比較的短いため,組織幹細胞からのすばやい細胞の供給の行われていることは明確である.これに対し,肝臓の組織(肝細胞)のターンオーバーは数カ月という長いタイムスパンで行われているとされ,細胞の供給の観察および評価は容易ではない.一般には,肝細胞のメンテナンスは成熟した肝細胞の分裂により担われているという考え方が支配的である.一方で,正常な肝臓の組織においても門脈域(胆管側)から新たな肝細胞が生み出され,中心静脈域にむかい徐々に送り出されているとする説も提唱されている5).実際に,胆管上皮細胞のマーカーであるSox9の遺伝子座にタモキシフェンにより活性を誘導することのできるようにしたCreリコンビナーゼ(CreERT2)の遺伝子をノックインしたマウスを用いたCre/loxP系による遺伝的な細胞系譜の解析により,タモキシフェンの投与により標識された細胞が胆管の付近から中心静脈域にむけてしだいに広がっていき,1年程度で肝臓のほとんど全体をしめるという結果が示され,大きな衝撃をあたえた6)(新着論文レビュー でも掲載).しかしながら,ほかのグループによる,Creリコンビナーゼを発現する別のマウス系統を用いたり,肝細胞を標識したりという細胞系譜の解析の結果はおおむねこれに否定的で,定常状態での肝細胞のメンテナンスにおいて,既存の肝細胞以外による関与はほとんど無視できるとされている7,8).これらのいっけん矛盾するような報告をいずれは統一的に解釈することが可能になるのか,個々の実験系で用いられた標識の手法(細胞の種類,標識の効率など)の再評価も含めて,今後の検討が待たれるところである.
肝臓は一部を切り取っても再生してもとどおりになるというのは,じつは正確ないい方ではない.さきに述べたとおり,肝臓は分葉構造をとっており,部分肝切除モデルは通常は葉を単位として行われる.このとき,残存する葉はなんら障害をうけておらず,そこに存在する実質組織も直接的な損傷はうけていない.部分肝切除ののちには,残存する葉が肥大することにより肝臓はもとの大きさと機能を回復する.切り取られた葉が再び生えてくるわけではなく,したがって,肝臓全体のかたちはもとにはもどらない.このような再生は“代償性肥大”あるいは“代償性再生”とよばれる(図1a).この過程では,残存する肝細胞が成熟し分化した状態のまま,肥大したり分裂したりすることにより,組織全体としての大きさを回復し再生する9).すなわち,未分化な組織幹細胞あるいは前駆細胞からの新たな細胞の供給はないとされている.部分肝切除ののち肝臓が再生するさまはきわめて劇的かつ興味深い現象であるため,長年にわたり,このモデルが肝臓の再生の研究におけるゴールデンスタンダードとされてきた.このことから,肝臓の再生には未分化な幹細胞あるいは前駆細胞は関与しないとする考え方が一般に広まった.
しかしながら,肝臓のうける障害とそれに対する再生の応答を考える場合,部分肝切除モデルは,ある意味,きわめて人為的で特殊だともいえる.肝切除手術や生体肝移植を行うわれわれヒトは別にして,ラットやマウスのような動物がその肝臓の一部をきれいに切り取られるという状況はほとんどありえない.むしろ,肝臓が本来うける障害の多くは,血流(門脈流)を介しもたらされる種々の薬物や毒物あるいはウイルスの感染などに起因すると考えられる.このような場合には肝細胞の壊死やアポトーシスが誘導され,炎症反応や免疫反応も惹起されうるという点で,部分肝切除のときに残存するきれいな肝臓の組織とは様相はだいぶ異なる.障害の程度が軽微あるいは限定的であれば,隣接するあるいは残存する肝細胞が分裂することで再生は可能であろう.しかしながら,障害の程度が重篤であったり長期化あるいは慢性化したりした場合や,薬物などの作用により肝細胞自体の増殖が阻害されたような場合には,もはや成熟した肝細胞に依存した再生システムは十分に機能しなくなる.このような状況では,正常な肝臓には存在しない,未分化性をもつ特殊な細胞が出現して増幅しさらに分化することにより,肝臓の再生を行うと考えられている(図1b).
このような特殊な細胞のプロトタイプが,オーバル細胞(oval cell)とよばれるものである.もともとは,ラットにて2-アセチルアミノフルオレンの投与により肝細胞の増殖を抑制した状態において,部分肝切除あるいは四塩化炭素の投与により肝臓に障害をあたえた場合に,門脈域の周辺に出現する細胞として記述され,その卵円形の形態から名づけられた10).肝細胞と胆管上皮細胞との境界に位置するヘリング管の近傍から出現し,その両者の性質をあわせもつこと,さらに,組織学的な観察から肝細胞および胆管上皮細胞への二方向性の分化能をもつと考えられたことから,成体の肝臓(障害をうけた肝臓)における肝幹細胞の代名詞ともなっている.そののち,類似の細胞が肝障害モデルマウスにおいても誘導されることが明らかになり,マウスにおいても障害をあたえたときに出現する特殊な細胞に対し,オーバル細胞の名称を広く適用する傾向がみられる.現在,マウスにおいてオーバル細胞を誘導する肝障害モデルとしてもっとも汎用されているのは,3,5-ジエトキシカルボニル-1,4-ジヒドロコリジン(DDC)を含有する食餌の投与,および,エチオニン添加コリン欠乏食の投与の2つである.これらは,いずれもオーバル細胞誘導モデルとして扱われているものの,異なる病因を背景としており,誘導される細胞の性状や様態には違いが認められる.さらに,ラットとは異なる障害モデルであって,マーカーの発現についても一致しない点がある.種間の違いも含め,さまざまな障害により誘導されるオーバル細胞には不均質性の存在することが明らかになりつつあり,その名称はかえって混乱をまねいている.また,それらの細胞が真に二方向性の分化能を示すことは厳密には示されていないことや,障害のときのみ一過性に出現することから,多分化能と自己複製能をもって定義される幹細胞というよりは,むしろ,一過性に増幅する前駆細胞集団と位置づけるほうが正確だとも考えられている.ここでは,以下,“肝前駆細胞”という呼称を用い,これがかかわる再生の過程を“前駆細胞に依存性の再生”とよぶことにする.
肝前駆細胞に類似した細胞は,ウイルス性慢性肝炎,アルコール性肝疾患,非アルコール性脂肪性肝疾患,劇症肝炎など,ヒトの肝臓における種々の疾患においてもしばしば出現しその増幅が観察される.さらに,それらの度合いと疾患の程度には相関が認められ,病態生理学的に重要な意味をもつものと考えられている.肝臓における障害にひきつづく線維化の発症や進行,発がんへの関与,とりわけ,肝がん幹細胞との関連などが示唆されているものの,その実態は明らかではない.肝前駆細胞の誘導とこれに依存した肝臓の再生の過程は,近年,ヒトの病態をより反映するものとして注目をあつめ,急速に研究が進展しつつある.
オーバル細胞を例として,もともと,肝前駆細胞は形態学的な特徴により定義および同定されていたが,現在では,マーカーの発現にもとづいて議論されるのが一般的である.肝前駆細胞のマーカーとして,古典的にはサイトケラチン19,最近では,EpCAM,CD133(Prominin 1),Sox9,オステオポンチンなどが用いられているが,これらはすべて正常な肝臓の胆管にも発現している2,4,6,8,11,12).じつのところ,胆管上皮細胞と肝前駆細胞とをマーカーの発現により区別することはほとんど不可能だといってよい.さらに,肝前駆細胞は門脈域に出現し,胆管に類似したクラスター状の構造をとりながら実質領域へと広がっていく.障害の種類や程度により異なるが,多くの場合には明瞭な管腔構造は形成されておらず,細胆管反応あるいは偽胆管増生などとよばれる.肝前駆細胞の誘導(出現および増幅)と細胆管反応とは,前者が機能的な側面,後者が形態的な側面に着目しているという違いであって,本質的には同一の現象をとらえていると,筆者らは考えている(ここでも,同義のものとして扱う).肝前駆細胞は孤立した特殊な細胞集団として存在しているのか,既存の胆管系とはどのような関係にあるのかは,興味のもたれるところである.
筆者らの研究室では,正常のとき胆管上皮細胞には発現せず,障害をうけたとき肝前駆細胞に特異的に発現するタンパク質として,EpCAMのパラログであるTrop2を同定している4).しかしながら,Trop2の発現の有無が未分化性や分化能といったなんらかの機能的な差異と相関しているかは不明である.別のグループからは,FoxL1-Cre BACトランスジェニックマウスを用いることで障害をうけたときの肝前駆細胞を標識することが可能であるとの報告がなされている13).すなわち,このCreリコンビナーゼを発現する系統を適当なレポーターマウスと掛け合わせると,正常のとき胆管は標識されず,障害をうけたとき肝前駆細胞を特異的に標識することが可能である.さらに,細胞系譜の解析により,この標識された肝前駆細胞は肝細胞および胆管上皮細胞へと分化することを示している.難点は,内在性のFoxL1は肝前駆細胞のマーカーとなるかどうかは不明であり,現時点では,この特殊なマウス系統を用いてのみ,“肝前駆細胞”を同定することが可能なことである.今後,さらなる遺伝子発現の解析あるいはマーカーの探索などをつうじ,胆管上皮細胞と肝前駆細胞との共通点および相違点がより明確となることが求められる.
また,肝前駆細胞マーカーに陽性の細胞はすべて一様に“前駆細胞”としての活性(未分化性および分化能)をもつのか,という点も未解決の重要な課題である.おそらく,現時点で肝前駆細胞としてとらえられているものは不均一な集団であり,そこには分化の段階に応じた階層性も存在すると考えられる.この点で注目すべきなのは,最近のLgr5に関する報告である14).Lgr5は,小腸の陰窩(クリプト)に存在する幹細胞をはじめ,さまざまな組織の幹細胞において特異的に発現するマーカーとしてよく知られている.この報告では,Lgr5-LacZノックインマウスおよびLgr5-CreERT2ノックインマウスを用いた解析から,標識に陽性の細胞が肝臓が種々の障害をうけたときに特異的に出現する(すなわち,正常な肝臓には存在しない)こと,それらの細胞をin vitroオルガノイド培養系により増幅し肝細胞へと分化を誘導することが可能であり,さらに,肝障害モデルマウスへ移植すると生着も可能であることを示しており,Lgr5が障害をうけた肝臓に特異的な肝幹細胞マーカーだと主張している.あいにく,障害をうけた肝臓の染色像は明瞭ではないが,Lgr5により標識されているのは,胆管系細胞および肝前駆細胞の一部のみであるようにみえる.標識の効率(CreERT2の発現量や組換えの頻度)が影響している可能性もあるが,肝前駆細胞の集団のなかにLgr5の発現の異なる亜集団が存在し,前駆細胞(あるいは,幹細胞)として異なる性状および挙動を示すのであれば,たいへんに興味深い.
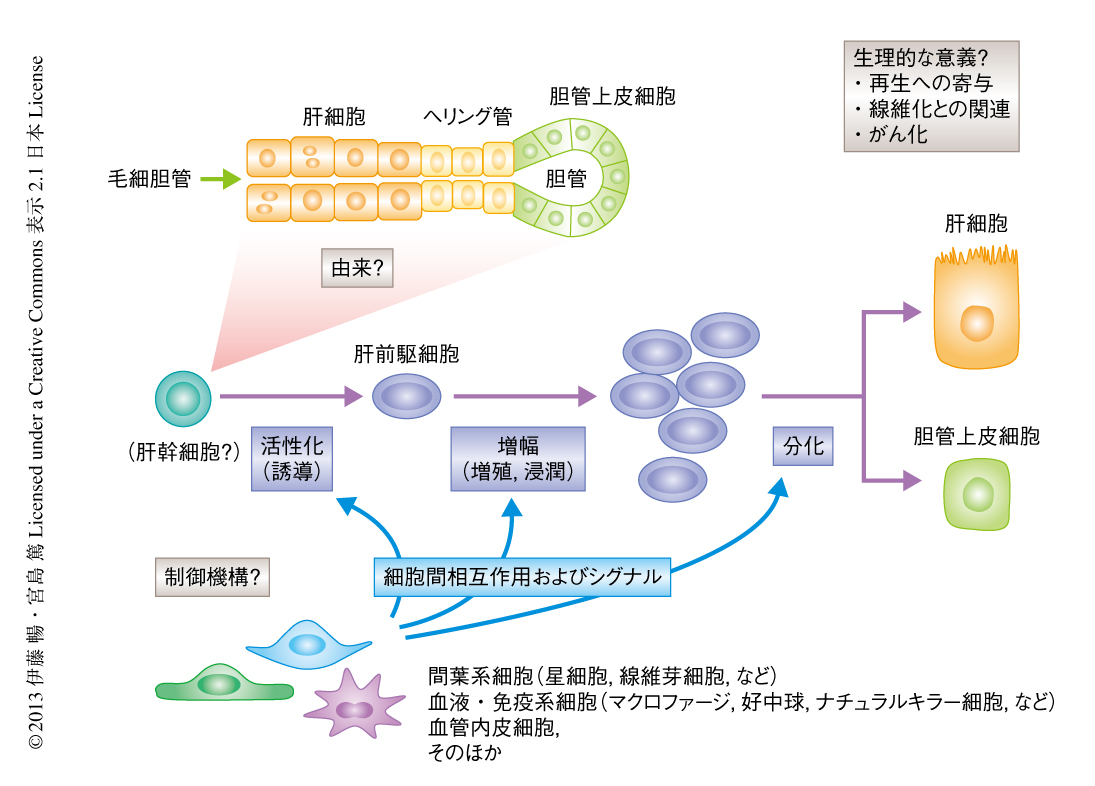
ラットのオーバル細胞はヘリング管に由来するという組織学的な観察にもとづき,マウスあるいはヒトにおいても,肝前駆細胞の由来はヘリング管であるとする考え方が長らく一般的である(図3).肝細胞と胆管上皮細胞との境界に位置する部分に,両者に二方向性に分化することの可能な細胞(の起源)が存在するというのは妥当なモデルに思えるが,実際には,いまだ厳密な証明はなされていない.ヘリング管は解剖学的な観察にもとづいて規定される構造であり,これを特異的に同定し標識することの可能なマーカーと,それを用いて細胞系譜を解析することの可能な系は,現時点では存在しない.肝前駆細胞の起源については,骨髄に由来するという説が主張された時期もあったが,これは現在ではほぼ完全に否定されている.最近では,Cre/loxP系を用いて肝細胞および胆管上皮細胞をそれぞれ特異的に標識して細胞系譜を追跡することにより,肝前駆細胞がいずれに由来するかを議論した論文が多くみられるようになってきた6-8).さきに述べた肝細胞のメンテナンスの場合と同様に,用いられた実験系(標識の手法)や適用された肝障害モデルマウスにより異なる結果が得られており,統一的な見解は得られていないのが実状である.見方を変えると,マーカーの発現においては同じ肝前駆細胞として扱われている細胞でも,その誘導の原因となる肝臓への障害の種類により,異なる起源に由来する可能性が強く示唆される.今後の解析の進展により,将来的にはマーカーの発現のみならず,むしろ,その由来や分化能にもとづいて肝前駆細胞とよばれる集団が新たに定義しなおされ,より細分化されていくのではないかと期待される.
肝前駆細胞の誘導の起こるような障害のときには炎症反応のともなうことが多く,TNFやインターロイキン6,インターフェロンγなどさまざまな炎症性サイトカインの関与が示唆されてきた.なかでも,肝前駆細胞の制御における重要性がもっとも明確に示されているもののひとつが,TNFファミリータンパク質のひとつTWEAKである.肝臓に特異的なトランスジェニックマウスやアデノウイルスによる遺伝子導入系を用いて,マウスの肝臓においてTWEAKを強制発現させることにより肝前駆細胞が誘導される15).逆に,TWEAKの受容体であるFn14のノックアウトマウスでは,オーバル細胞を誘導する肝障害モデルマウスにおいて肝前駆細胞の誘導が抑制されている15,16).ただし,この抑制は部分的もしくは一過性のものであり,肝前駆細胞の誘導にかかわる制御タンパク質はほかにも存在すると考えられる.また,TWEAKあるいはFn14を発現する細胞は必ずしも明確に同定されてはおらず,このシグナルが肝前駆細胞に直接に作用するのか,その作用機序には不明な点も残されている.
肝前駆細胞の制御にかかわるタンパク質として,ほかにはWntファミリーが知られている.ラット,マウス,ヒトにおいて,肝臓が種々の障害をうけたときWntの発現が上昇すること,肝前駆細胞ではβカテニン経路の活性化が誘導されることが,複数のグループによりあいついで報告された17-20).ただし,19種類あるWntファミリーのうち,いずれが発現しているのかは報告により異なっており,重要性も明確には示されていない.また,Wntを産生する細胞や作用機序,肝前駆細胞における機能についても明らかではなかったが,最近になり,新たに興味深い報告がなされた(これについては,のちに述べる).そのほかにも,HGFも肝前駆細胞の誘導に重要であることが,その受容体であるc-Metのノックアウトマウスを用いた解析から示されている21).この場合は,TWEAKや,つぎに述べるFGF7とは異なり,HGFが単独で肝前駆細胞を十分に誘導することが可能であるかどうかについては示されていない.
一般に,組織幹細胞あるいは前駆細胞は,その周囲をとりまく細胞や細胞外基質により未分化性の維持や増殖および分化の制御をうけることが知られている.このような特殊な微小環境のことを“ニッチ”(niche)とよぶ.筆者らは,肝前駆細胞に対してもその活性を制御するなんらかのニッチが存在すると仮定し,これを同定することを試みた22).肝臓に肝前駆細胞の出現が認められるような障害があたえられたときには線維化や炎症反応の誘導をともなうことが多く,肝前駆細胞(オーバル細胞)が線維芽細胞や星細胞などの間葉系細胞や血液系細胞と相互作用することを示唆する報告もいくつかなされていた.そこで,DDCを含有する食餌の投与による肝障害モデルマウスの肝臓の組織切片を用いて,種々の間葉系細胞マーカーおよび血液細胞マーカーと,肝前駆細胞マーカーとの共免疫染色を行った.このとき,マーカーの発現を指標として細胞をセルソーターにより単離することを視野にいれて,とくに細胞表面マーカーに注目した.その結果,Thy1(= CD90)陽性の細胞が肝前駆細胞に隣接して存在することを見い出した.
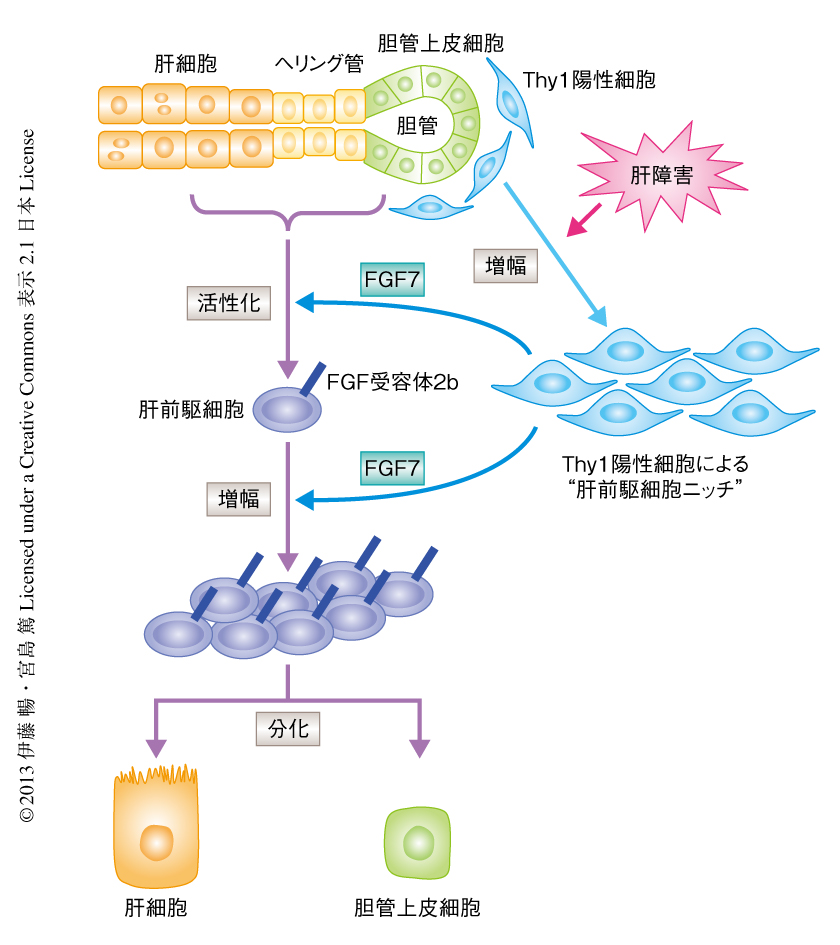
Thy1陽性細胞はたまたま肝前駆細胞のそばに存在するだけなのだろうか? かりに,この細胞が肝前駆細胞に対するニッチとして真に機能するものであるなら,なんらかのシグナルを介して直接的に作用しその活性を制御しているはずである.そこで,そのようなシグナルの存在と実体を明らかにしようと考えた.Thy1陽性細胞は間葉系細胞の性質をもち,一方で,肝細胞と胆管上皮細胞に分化する(と想定される)肝前駆細胞は上皮系細胞だと考えられる.そこで,間葉と上皮との相互作用にかかわることの知られている種々の細胞間シグナル伝達タンパク質について,肝臓に障害のあたえたときの発現パターンを検討した.その結果,有力な候補としてFGFファミリーのひとつであるFGF7(別名KGF)を見い出した.FGF7の発現は正常な肝臓においてはほとんど認められなかったのに対し,DDC含有食餌投与による肝障害モデルマウスをはじめ,胆汁鬱体性の肝障害モデルマウスや慢性肝炎モデルマウスなど,肝前駆細胞の誘導をともなう種々の肝障害モデルマウスにおいて顕著に誘導された.その発現は肝前駆細胞の周囲において観察され,さらに,セルソーターを用いて単離した細胞画分における遺伝子発現解析から,Thy1陽性かつCD45陰性の間葉系細胞がFGF7のおもな産生細胞であることが明らかになった.一方で,FGF7の特異的な受容体であるFGF受容体2bは肝前駆細胞において強く発現していた.これらのことから,FGF7は肝前駆細胞の活性化をともなうさまざまな障害のときに共通して,Thy1陽性の間葉系細胞により産生および分泌され,肝前駆細胞に直接に作用することが強く示唆された.また,ヒトの急性肝炎や劇症肝炎の患者の血清において,FGF7の濃度が増大することも確認された.
そこで,FGF7ノックアウトマウスを用いて解析したところ,DDC含有食餌投与による肝障害モデルマウスや胆汁鬱体性の肝障害モデルマウスにおいて,肝前駆細胞の誘導がほぼ完全に抑制されていることが明らかになった.DDC含有食餌投与による肝障害モデルマウスを用いてさらに詳細に検討したところ,FGF7ノックアウトマウスでは肝臓の障害が顕著に増悪し致死率が有意に上昇していた.一方で,ドキシサイクリンの投与により肝臓において特異的にFGF7を強制発現させることの可能なトランスジェニックマウスを作製し解析したところ,肝臓に障害のない状態でもFGF7の過剰発現により人為的に肝前駆細胞の活性化をひき起こすことが可能であった.さらに,DDC含有食餌投与による肝障害モデルマウスにおいてFGF7を過剰に発現させると,再生が誘導および促進され障害の程度は軽減されることが示された.以上の結果から,肝臓に障害があたえられたとき,FGF7を介したニッチ細胞との相互作用が肝前駆細胞の活性化に重要であることがはじめて明らかになった(図4).さらに,FGF7の機能欠損(ノックアウトマウス)あるいは過剰発現(トランスジェニックマウス)により肝前駆細胞の誘導のレベルをそれぞれ抑制あるいは増加させた場合に,肝臓の障害の程度がこれと相関して増悪あるいは改善したことは,肝前駆細胞が実際に肝臓の再生に積極的に寄与している可能性を強く示唆した.将来的には,FGF7あるいは関連するタンパク質を用いることにより,ヒトの種々の肝疾患に対する新規の治療法の開発への応用も期待される.
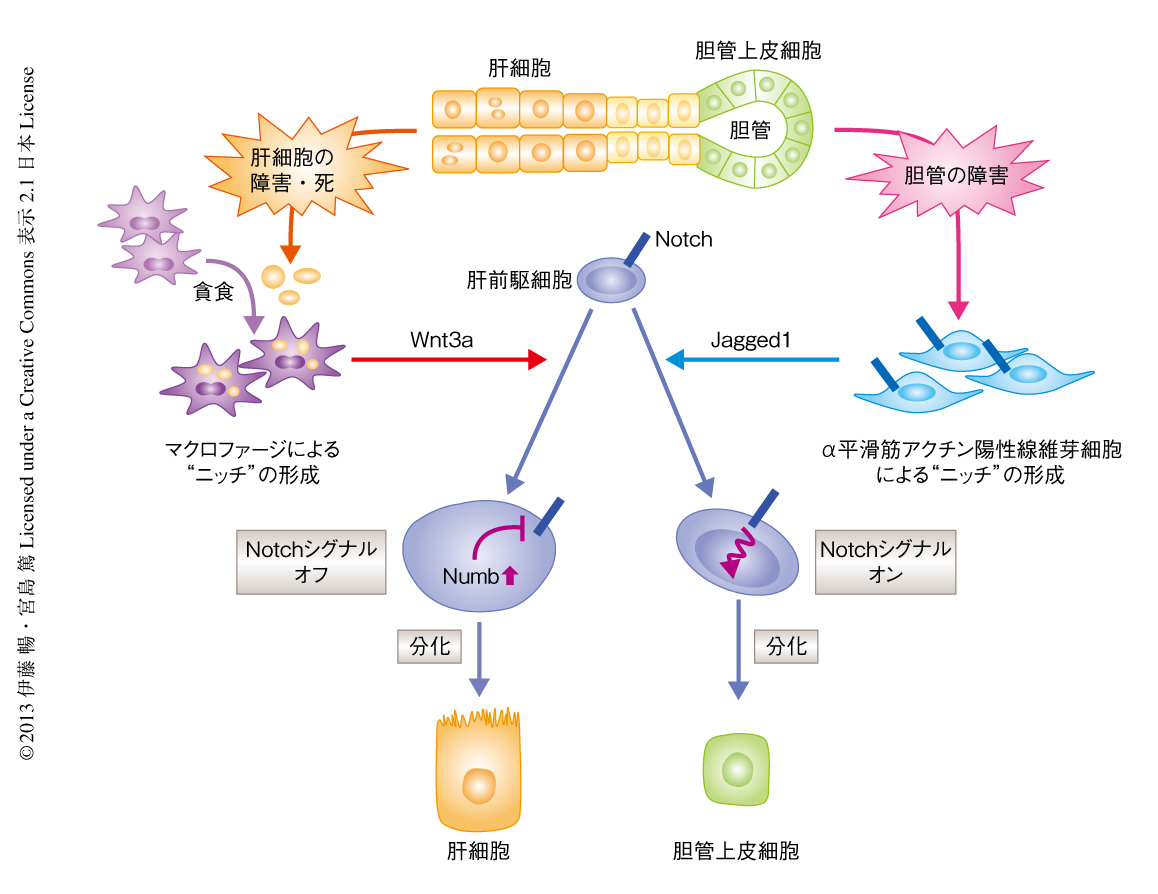
一方で最近,ニッチシグナルによる肝前駆細胞の分化の制御に関しても興味深い報告がなされている23).ここでは,肝前駆細胞の誘導および細胆管反応の観察される障害を,その主要な病態にもとづき“胆管障害性”および“肝細胞障害性”の2つに大別し,両者における肝前駆細胞ニッチの違いに注目している.ヒトにおいては,原発性胆汁性肝硬変や原発性硬化性胆管炎が前者,C型肝炎ウイルス感染による慢性肝炎が後者にあたる.マウスにおいては,DDC含有食餌投与による肝障害モデルを胆管障害性の再生モデル,エチオニン添加コリン欠乏食投与による肝障害モデルを肝細胞障害性の再生モデルと位置づけて検討した.胆管障害性の再生モデルにおいては,肝前駆細胞の周囲にはα平滑筋アクチン陽性の線維芽細胞(ここでは,筋線維芽細胞とよんでいる)が集積し,これがNotchのリガンドであるJagged1を発現することにより肝前駆細胞においてNotchシグナル伝達経路を活性化していた.Notchシグナル伝達経路は発生の過程において肝芽細胞から胆管上皮細胞への分化の誘導に重要であることが知られており,この再生の過程においても肝前駆細胞から胆管上皮細胞の方向への分化を誘導していることが,Notchシグナル伝達経路の阻害剤を用いた実験などから示された.一方で,肝細胞障害性の再生モデルにおいては,肝前駆細胞の周囲にはマクロファージの集積が認められた.マクロファージは障害により死滅した肝細胞の残骸を貪食するとWnt3aを発現した.これが肝前駆細胞に作用すると,βカテニン経路によりNotchの分解にかかわるNumbの発現が誘導され,Notchシグナル伝達経路の活性化が抑制されることにより,結果的に肝細胞の方向への分化が促進された.すなわち,Notchシグナル伝達経路とWntシグナル伝達経路という2つのシグナル伝達経路の活性化のバランスにより,肝前駆細胞の分化の方向性が制御されるというモデルを提唱している(図5).しかしながら,さきに述べたとおり,胆管障害性とされるDDC含有食餌投与による肝障害モデルマウスにおいても肝前駆細胞にてWntシグナル伝達経路の活性化は誘導されており,単に量的な違いにより説明されるのか,あるいは,さらに別のシグナル伝達経路の関与による質的な違いがあるのかなど,今後の研究の進展が望まれる.また,ここでいうα平滑筋アクチン陽性の線維芽細胞は,筆者らの見い出したThy1陽性細胞と同等あるいは類似したものと考えられる.Thy1陽性細胞におけるFGF7シグナルによる肝前駆細胞ニッチが,エチオニン添加コリン欠乏食投与による肝障害モデルマウスにおいても機能しているのかどうかは重要な検討課題である.
これまでに紹介したTWEAK,Wnt,HGF,FGF7,Notchを中心として,さまざまなシグナル伝達経路がどのように関連し相互作用しあっているのか,今後の解析により,肝前駆細胞の出現,増幅,機能を制御する細胞間ネットワークの全容が明らかにされることが期待される.
実験モデルにおいては代償性再生,あるいは,前駆細胞に依存性の再生のそれぞれを区別し特化した解析が行われているが,実際のヒトの肝疾患の病態において両者は共存かつ混在し,障害の部位や程度などに応じて適切な反応が誘導されることにより,肝臓はその頑強な再生能力を実現していると考えられる.今後は,この2つの再生の様式がどのように関連また連携し,それらのバランスが制御されているのかにも焦点をあてる必要があるだろう.肝臓の再生の分子機構を分子および細胞のレベルにおいて明らかにすることは,肝臓のもつ強い再生能力の秘密を解き明かすとともに,臓器あるいは組織の再生をつかさどる基本原理の理解にもつながるだろう.さらに,体外においてiPS細胞などから人工的につくりだした細胞,組織,臓器を移植するという治療法にくわえて,生物にもともと備わっている再生能力をひきだして増強するという,別の視点による治療戦略の創出にもつながるものと期待される.
略歴:1998年 東京大学大学院理学系研究科博士課程 修了,同年 東京大学医科学研究所 博士研究員,2000年 米国Salk Institute for Biological Studies博士研究員,2003年 東京大学分子細胞生物学研究所 特任研究員,2004年 同 助手を経て,2013年より 同 講師.
研究テーマ:肝臓の再生の分子機構.
抱負:障害あるいは再生のときの肝前駆細胞の動態やほかの細胞との相互作用,それらのありのままのすがたをとらえてみたい.Seeing is believing.
宮島 篤(Atsushi Miyajima)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/cytokine/index.html
© 2013 伊藤 暢・宮島 篤 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 発生・再生研究分野)
email:伊藤 暢
領域融合レビュー, 2, e007 (2013) DOI: 10.7875/leading.author.2.e007
Tohru Itoh & Atsushi Miyajima: Regulatory mechanisms for adult liver progenitor cells that support liver regeneration.
要 約
肝臓はきわめて高い再生能力をもち,臓器再生のモデルとして多くの研究が行われてきた.長きにわたり,その解析の中心にあったのは部分肝切除ののちの再生の過程であり,これは成熟した肝細胞の肥大や増殖により担われる代償性の再生である.一方で,薬物や毒物などにより重篤あるいは慢性的な障害をうけ肝細胞自体の増殖が阻害された場合には,正常な肝臓では存在の認められない特殊な肝前駆細胞が活性化されて増幅し,これが肝細胞や胆管上皮細胞へと分化することにより肝臓の機能を回復させるものと考えられている.近年,このような肝前駆細胞に依存性の再生がヒトの病態をより反映するものとして注目をあつめるようになった.肝前駆細胞の実体,とりわけ,その由来についてはいまだ議論がつづく一方で,その制御機構についての理解は急速に進みつつある.ここでは,それらの現状と今後の課題について,肝前駆細胞の活性化に重要なニッチシグナルに関する筆者らの最近の研究成果をまじえ解説する.
はじめに
再生医療が大きな注目をあつめている.iPS細胞を中心とした昨今のブームのなかにあって,もっぱら人々の思い浮かべる“再生”のイメージとは,機能不全におちいったり古くなったりした臓器を試験管内で人為的につくりだした臓器と置き換えるというような類のものかもしれない.一方で,生体にはもともと,障害や損傷により失われた組織や器官を機能的に修復する自律的な再生能力がある程度まで備わっている.イモリやプラナリアのような比較的下等な生物はきわめて高い再生能力を示すのに対し,残念ながら,ヒトを含む哺乳動物における再生能力は限定的である.
哺乳動物の臓器のなかで例外的に高い再生能力をもつことの知られるのは肝臓である.たとえば,その2/3を外科的に切除(“部分肝切除”とよばれる)した場合でも,残りの部分から短期間(マウスの場合,1週間程度)のうちにもとの大きさへと再生し機能を回復することが可能である(図1a).このような肝臓の高い再生能力ははるか昔より知られていたようで,ギリシャ神話のなかにもプロメテウスの逸話として登場する.すなわち,天上から火を盗んで人間に与えたプロメテウスはゼウスの怒りを買い,コーカサス山頂に磔にされて大鷲に肝臓を啄まれるのだが,彼の肝臓は毎晩再生するため来る日も来る日も同じ苦しみを味わいつづけることになる,というものである.科学の研究においては,部分肝切除にともなう肝臓の再生の実験モデルは1930年代に確立し,当初は,もっぱらラットが対象とされていたが,今日では,トランスジェニックやノックアウトなど遺伝子改変の可能なマウスの系も多用されるようになっている.臓器再生の分野におけるひとつのパラダイムとして長年にわたり解析され,これまでに多くの知見が集積している.
このような肝臓の再生の分野に,近年,新たな展開が生まれている.これまで中心であった部分肝切除モデルとは異なる様式により担われる肝臓の再生の分子機構に注目があつまり,急速にその理解が進みつつある.そこに主役として登場するのが,“肝前駆細胞”である.
1.肝臓の構造と機能および組織の維持
肝臓の外観における大きな特徴のひとつは,分葉構造をとる点である.葉(lobe)の数は,ヒトでは4つ,ラットやマウスでは数え方により4つから7つとされている.葉により機能的な違いがあるとは考えられておらず,分葉構造をとる理由は明らかではない.ただし,特定の葉の付け根を結紮して切断することにより,一定の体積を外科的に切除することが可能であることは,実験を行ううえで大きなメリットである.解剖学的なもうひとつの大きな特徴は,通常の動脈(肝動脈)および静脈(肝静脈)にくわえて,門脈とよばれる血管の流入のある点である(図2a).消化管において吸収された栄養分や薬物あるいは毒物などは,この門脈を介して,まずは肝臓へと流れ込む.したがって,肝臓は生体における化学的なフィルターあるいはバリアと位置づけられている.
代謝や解毒の中心器官である肝臓は,そのほかにもきわめて多くの重要な生理機能をもつ.それら機能の大部分は実質細胞である肝細胞により担われている.肝細胞は機能的な中心であると同時に,肝臓全体の8割ほどをしめていることから,多少乱暴ないい方にはなるが,肝臓の再生とは第一義的には肝細胞の再生のことだといい換えられる.肝臓の組織において,肝細胞は門脈と中心静脈という2種類の血管を両端とする軸にそって配列し,そのような肝細胞のあいだを類洞とよばれる毛細血管が走行する(図2b).肝臓を構成する肝細胞(肝実質細胞)以外の細胞はひとくくりに肝非実質細胞と称され,胆管上皮細胞,星細胞,線維芽細胞,類洞内皮細胞,クッパー細胞のほか,各種の免疫系の細胞などがそれに含まれる.
肝臓の再生を理解するうえでは,これとは別に,上皮系細胞とそれ以外という大別のしかたをするのが有効である.肝臓においては肝細胞および胆管上皮細胞が上皮系の細胞であるが,これらは組織の構造において連続して存在している.肝細胞と胆管上皮細胞との接続部分は解剖学的に“ヘリング管”(canal of Hering)とよばれる構造をとる.肝細胞のもつ重要な機能のひとつが胆汁の産生であり,肝細胞において産生された胆汁は,隣接する肝細胞のあいだに形成される間隙(毛細胆管)へと分泌される.毛細胆管に流れ出た胆汁は,ヘリング管を通じて胆管上皮細胞により構成される管腔構造である胆管へと注ぎ込んで集合し,肝臓の外へ出たのち最終的に十二指腸へと排出される.
肝細胞および胆管上皮細胞は発生の過程において,胎児の肝臓に存在する共通の前駆細胞である“肝芽細胞”(hepatoblast)に由来する.肝臓学の分野では,肝細胞および胆管上皮細胞への二方向性の分化能をもつ細胞を“肝幹細胞”と定義し,肝芽細胞は胎児期における肝幹細胞と位置づけられている1).しかしながら,肝芽細胞と同等あるいは類似した性状をもつ細胞の存在は,成体の肝臓においては明確には認められない.成体の肝臓から取り出して培養系に供した場合に高い増殖能やコロニー形成能,二方向性の分化能を示す細胞の存在は報告されているものの2-4),それらの細胞がもともとの生体の肝臓においてどこに存在し,どのような機能を担うのか,肝臓の組織のメンテナンス(正常な状況のもとでの組織のターンオーバー)や肝臓の再生に寄与しているのかどうかは,まったくもって不明である.血液系や腸管,皮膚などの組織では,成熟し分化した細胞の寿命は比較的短いため,組織幹細胞からのすばやい細胞の供給の行われていることは明確である.これに対し,肝臓の組織(肝細胞)のターンオーバーは数カ月という長いタイムスパンで行われているとされ,細胞の供給の観察および評価は容易ではない.一般には,肝細胞のメンテナンスは成熟した肝細胞の分裂により担われているという考え方が支配的である.一方で,正常な肝臓の組織においても門脈域(胆管側)から新たな肝細胞が生み出され,中心静脈域にむかい徐々に送り出されているとする説も提唱されている5).実際に,胆管上皮細胞のマーカーであるSox9の遺伝子座にタモキシフェンにより活性を誘導することのできるようにしたCreリコンビナーゼ(CreERT2)の遺伝子をノックインしたマウスを用いたCre/loxP系による遺伝的な細胞系譜の解析により,タモキシフェンの投与により標識された細胞が胆管の付近から中心静脈域にむけてしだいに広がっていき,1年程度で肝臓のほとんど全体をしめるという結果が示され,大きな衝撃をあたえた6)(新着論文レビュー でも掲載).しかしながら,ほかのグループによる,Creリコンビナーゼを発現する別のマウス系統を用いたり,肝細胞を標識したりという細胞系譜の解析の結果はおおむねこれに否定的で,定常状態での肝細胞のメンテナンスにおいて,既存の肝細胞以外による関与はほとんど無視できるとされている7,8).これらのいっけん矛盾するような報告をいずれは統一的に解釈することが可能になるのか,個々の実験系で用いられた標識の手法(細胞の種類,標識の効率など)の再評価も含めて,今後の検討が待たれるところである.
2.肝臓の再生:2つの様式
肝臓は一部を切り取っても再生してもとどおりになるというのは,じつは正確ないい方ではない.さきに述べたとおり,肝臓は分葉構造をとっており,部分肝切除モデルは通常は葉を単位として行われる.このとき,残存する葉はなんら障害をうけておらず,そこに存在する実質組織も直接的な損傷はうけていない.部分肝切除ののちには,残存する葉が肥大することにより肝臓はもとの大きさと機能を回復する.切り取られた葉が再び生えてくるわけではなく,したがって,肝臓全体のかたちはもとにはもどらない.このような再生は“代償性肥大”あるいは“代償性再生”とよばれる(図1a).この過程では,残存する肝細胞が成熟し分化した状態のまま,肥大したり分裂したりすることにより,組織全体としての大きさを回復し再生する9).すなわち,未分化な組織幹細胞あるいは前駆細胞からの新たな細胞の供給はないとされている.部分肝切除ののち肝臓が再生するさまはきわめて劇的かつ興味深い現象であるため,長年にわたり,このモデルが肝臓の再生の研究におけるゴールデンスタンダードとされてきた.このことから,肝臓の再生には未分化な幹細胞あるいは前駆細胞は関与しないとする考え方が一般に広まった.
しかしながら,肝臓のうける障害とそれに対する再生の応答を考える場合,部分肝切除モデルは,ある意味,きわめて人為的で特殊だともいえる.肝切除手術や生体肝移植を行うわれわれヒトは別にして,ラットやマウスのような動物がその肝臓の一部をきれいに切り取られるという状況はほとんどありえない.むしろ,肝臓が本来うける障害の多くは,血流(門脈流)を介しもたらされる種々の薬物や毒物あるいはウイルスの感染などに起因すると考えられる.このような場合には肝細胞の壊死やアポトーシスが誘導され,炎症反応や免疫反応も惹起されうるという点で,部分肝切除のときに残存するきれいな肝臓の組織とは様相はだいぶ異なる.障害の程度が軽微あるいは限定的であれば,隣接するあるいは残存する肝細胞が分裂することで再生は可能であろう.しかしながら,障害の程度が重篤であったり長期化あるいは慢性化したりした場合や,薬物などの作用により肝細胞自体の増殖が阻害されたような場合には,もはや成熟した肝細胞に依存した再生システムは十分に機能しなくなる.このような状況では,正常な肝臓には存在しない,未分化性をもつ特殊な細胞が出現して増幅しさらに分化することにより,肝臓の再生を行うと考えられている(図1b).
このような特殊な細胞のプロトタイプが,オーバル細胞(oval cell)とよばれるものである.もともとは,ラットにて2-アセチルアミノフルオレンの投与により肝細胞の増殖を抑制した状態において,部分肝切除あるいは四塩化炭素の投与により肝臓に障害をあたえた場合に,門脈域の周辺に出現する細胞として記述され,その卵円形の形態から名づけられた10).肝細胞と胆管上皮細胞との境界に位置するヘリング管の近傍から出現し,その両者の性質をあわせもつこと,さらに,組織学的な観察から肝細胞および胆管上皮細胞への二方向性の分化能をもつと考えられたことから,成体の肝臓(障害をうけた肝臓)における肝幹細胞の代名詞ともなっている.そののち,類似の細胞が肝障害モデルマウスにおいても誘導されることが明らかになり,マウスにおいても障害をあたえたときに出現する特殊な細胞に対し,オーバル細胞の名称を広く適用する傾向がみられる.現在,マウスにおいてオーバル細胞を誘導する肝障害モデルとしてもっとも汎用されているのは,3,5-ジエトキシカルボニル-1,4-ジヒドロコリジン(DDC)を含有する食餌の投与,および,エチオニン添加コリン欠乏食の投与の2つである.これらは,いずれもオーバル細胞誘導モデルとして扱われているものの,異なる病因を背景としており,誘導される細胞の性状や様態には違いが認められる.さらに,ラットとは異なる障害モデルであって,マーカーの発現についても一致しない点がある.種間の違いも含め,さまざまな障害により誘導されるオーバル細胞には不均質性の存在することが明らかになりつつあり,その名称はかえって混乱をまねいている.また,それらの細胞が真に二方向性の分化能を示すことは厳密には示されていないことや,障害のときのみ一過性に出現することから,多分化能と自己複製能をもって定義される幹細胞というよりは,むしろ,一過性に増幅する前駆細胞集団と位置づけるほうが正確だとも考えられている.ここでは,以下,“肝前駆細胞”という呼称を用い,これがかかわる再生の過程を“前駆細胞に依存性の再生”とよぶことにする.
肝前駆細胞に類似した細胞は,ウイルス性慢性肝炎,アルコール性肝疾患,非アルコール性脂肪性肝疾患,劇症肝炎など,ヒトの肝臓における種々の疾患においてもしばしば出現しその増幅が観察される.さらに,それらの度合いと疾患の程度には相関が認められ,病態生理学的に重要な意味をもつものと考えられている.肝臓における障害にひきつづく線維化の発症や進行,発がんへの関与,とりわけ,肝がん幹細胞との関連などが示唆されているものの,その実態は明らかではない.肝前駆細胞の誘導とこれに依存した肝臓の再生の過程は,近年,ヒトの病態をより反映するものとして注目をあつめ,急速に研究が進展しつつある.
3.肝前駆細胞の性状と起源
オーバル細胞を例として,もともと,肝前駆細胞は形態学的な特徴により定義および同定されていたが,現在では,マーカーの発現にもとづいて議論されるのが一般的である.肝前駆細胞のマーカーとして,古典的にはサイトケラチン19,最近では,EpCAM,CD133(Prominin 1),Sox9,オステオポンチンなどが用いられているが,これらはすべて正常な肝臓の胆管にも発現している2,4,6,8,11,12).じつのところ,胆管上皮細胞と肝前駆細胞とをマーカーの発現により区別することはほとんど不可能だといってよい.さらに,肝前駆細胞は門脈域に出現し,胆管に類似したクラスター状の構造をとりながら実質領域へと広がっていく.障害の種類や程度により異なるが,多くの場合には明瞭な管腔構造は形成されておらず,細胆管反応あるいは偽胆管増生などとよばれる.肝前駆細胞の誘導(出現および増幅)と細胆管反応とは,前者が機能的な側面,後者が形態的な側面に着目しているという違いであって,本質的には同一の現象をとらえていると,筆者らは考えている(ここでも,同義のものとして扱う).肝前駆細胞は孤立した特殊な細胞集団として存在しているのか,既存の胆管系とはどのような関係にあるのかは,興味のもたれるところである.
筆者らの研究室では,正常のとき胆管上皮細胞には発現せず,障害をうけたとき肝前駆細胞に特異的に発現するタンパク質として,EpCAMのパラログであるTrop2を同定している4).しかしながら,Trop2の発現の有無が未分化性や分化能といったなんらかの機能的な差異と相関しているかは不明である.別のグループからは,FoxL1-Cre BACトランスジェニックマウスを用いることで障害をうけたときの肝前駆細胞を標識することが可能であるとの報告がなされている13).すなわち,このCreリコンビナーゼを発現する系統を適当なレポーターマウスと掛け合わせると,正常のとき胆管は標識されず,障害をうけたとき肝前駆細胞を特異的に標識することが可能である.さらに,細胞系譜の解析により,この標識された肝前駆細胞は肝細胞および胆管上皮細胞へと分化することを示している.難点は,内在性のFoxL1は肝前駆細胞のマーカーとなるかどうかは不明であり,現時点では,この特殊なマウス系統を用いてのみ,“肝前駆細胞”を同定することが可能なことである.今後,さらなる遺伝子発現の解析あるいはマーカーの探索などをつうじ,胆管上皮細胞と肝前駆細胞との共通点および相違点がより明確となることが求められる.
また,肝前駆細胞マーカーに陽性の細胞はすべて一様に“前駆細胞”としての活性(未分化性および分化能)をもつのか,という点も未解決の重要な課題である.おそらく,現時点で肝前駆細胞としてとらえられているものは不均一な集団であり,そこには分化の段階に応じた階層性も存在すると考えられる.この点で注目すべきなのは,最近のLgr5に関する報告である14).Lgr5は,小腸の陰窩(クリプト)に存在する幹細胞をはじめ,さまざまな組織の幹細胞において特異的に発現するマーカーとしてよく知られている.この報告では,Lgr5-LacZノックインマウスおよびLgr5-CreERT2ノックインマウスを用いた解析から,標識に陽性の細胞が肝臓が種々の障害をうけたときに特異的に出現する(すなわち,正常な肝臓には存在しない)こと,それらの細胞をin vitroオルガノイド培養系により増幅し肝細胞へと分化を誘導することが可能であり,さらに,肝障害モデルマウスへ移植すると生着も可能であることを示しており,Lgr5が障害をうけた肝臓に特異的な肝幹細胞マーカーだと主張している.あいにく,障害をうけた肝臓の染色像は明瞭ではないが,Lgr5により標識されているのは,胆管系細胞および肝前駆細胞の一部のみであるようにみえる.標識の効率(CreERT2の発現量や組換えの頻度)が影響している可能性もあるが,肝前駆細胞の集団のなかにLgr5の発現の異なる亜集団が存在し,前駆細胞(あるいは,幹細胞)として異なる性状および挙動を示すのであれば,たいへんに興味深い.
ラットのオーバル細胞はヘリング管に由来するという組織学的な観察にもとづき,マウスあるいはヒトにおいても,肝前駆細胞の由来はヘリング管であるとする考え方が長らく一般的である(図3).肝細胞と胆管上皮細胞との境界に位置する部分に,両者に二方向性に分化することの可能な細胞(の起源)が存在するというのは妥当なモデルに思えるが,実際には,いまだ厳密な証明はなされていない.ヘリング管は解剖学的な観察にもとづいて規定される構造であり,これを特異的に同定し標識することの可能なマーカーと,それを用いて細胞系譜を解析することの可能な系は,現時点では存在しない.肝前駆細胞の起源については,骨髄に由来するという説が主張された時期もあったが,これは現在ではほぼ完全に否定されている.最近では,Cre/loxP系を用いて肝細胞および胆管上皮細胞をそれぞれ特異的に標識して細胞系譜を追跡することにより,肝前駆細胞がいずれに由来するかを議論した論文が多くみられるようになってきた6-8).さきに述べた肝細胞のメンテナンスの場合と同様に,用いられた実験系(標識の手法)や適用された肝障害モデルマウスにより異なる結果が得られており,統一的な見解は得られていないのが実状である.見方を変えると,マーカーの発現においては同じ肝前駆細胞として扱われている細胞でも,その誘導の原因となる肝臓への障害の種類により,異なる起源に由来する可能性が強く示唆される.今後の解析の進展により,将来的にはマーカーの発現のみならず,むしろ,その由来や分化能にもとづいて肝前駆細胞とよばれる集団が新たに定義しなおされ,より細分化されていくのではないかと期待される.
4.肝前駆細胞の制御機構
肝前駆細胞の誘導の起こるような障害のときには炎症反応のともなうことが多く,TNFやインターロイキン6,インターフェロンγなどさまざまな炎症性サイトカインの関与が示唆されてきた.なかでも,肝前駆細胞の制御における重要性がもっとも明確に示されているもののひとつが,TNFファミリータンパク質のひとつTWEAKである.肝臓に特異的なトランスジェニックマウスやアデノウイルスによる遺伝子導入系を用いて,マウスの肝臓においてTWEAKを強制発現させることにより肝前駆細胞が誘導される15).逆に,TWEAKの受容体であるFn14のノックアウトマウスでは,オーバル細胞を誘導する肝障害モデルマウスにおいて肝前駆細胞の誘導が抑制されている15,16).ただし,この抑制は部分的もしくは一過性のものであり,肝前駆細胞の誘導にかかわる制御タンパク質はほかにも存在すると考えられる.また,TWEAKあるいはFn14を発現する細胞は必ずしも明確に同定されてはおらず,このシグナルが肝前駆細胞に直接に作用するのか,その作用機序には不明な点も残されている.
肝前駆細胞の制御にかかわるタンパク質として,ほかにはWntファミリーが知られている.ラット,マウス,ヒトにおいて,肝臓が種々の障害をうけたときWntの発現が上昇すること,肝前駆細胞ではβカテニン経路の活性化が誘導されることが,複数のグループによりあいついで報告された17-20).ただし,19種類あるWntファミリーのうち,いずれが発現しているのかは報告により異なっており,重要性も明確には示されていない.また,Wntを産生する細胞や作用機序,肝前駆細胞における機能についても明らかではなかったが,最近になり,新たに興味深い報告がなされた(これについては,のちに述べる).そのほかにも,HGFも肝前駆細胞の誘導に重要であることが,その受容体であるc-Metのノックアウトマウスを用いた解析から示されている21).この場合は,TWEAKや,つぎに述べるFGF7とは異なり,HGFが単独で肝前駆細胞を十分に誘導することが可能であるかどうかについては示されていない.
5.肝前駆細胞を支配するニッチとシグナル
一般に,組織幹細胞あるいは前駆細胞は,その周囲をとりまく細胞や細胞外基質により未分化性の維持や増殖および分化の制御をうけることが知られている.このような特殊な微小環境のことを“ニッチ”(niche)とよぶ.筆者らは,肝前駆細胞に対してもその活性を制御するなんらかのニッチが存在すると仮定し,これを同定することを試みた22).肝臓に肝前駆細胞の出現が認められるような障害があたえられたときには線維化や炎症反応の誘導をともなうことが多く,肝前駆細胞(オーバル細胞)が線維芽細胞や星細胞などの間葉系細胞や血液系細胞と相互作用することを示唆する報告もいくつかなされていた.そこで,DDCを含有する食餌の投与による肝障害モデルマウスの肝臓の組織切片を用いて,種々の間葉系細胞マーカーおよび血液細胞マーカーと,肝前駆細胞マーカーとの共免疫染色を行った.このとき,マーカーの発現を指標として細胞をセルソーターにより単離することを視野にいれて,とくに細胞表面マーカーに注目した.その結果,Thy1(= CD90)陽性の細胞が肝前駆細胞に隣接して存在することを見い出した.
Thy1陽性細胞はたまたま肝前駆細胞のそばに存在するだけなのだろうか? かりに,この細胞が肝前駆細胞に対するニッチとして真に機能するものであるなら,なんらかのシグナルを介して直接的に作用しその活性を制御しているはずである.そこで,そのようなシグナルの存在と実体を明らかにしようと考えた.Thy1陽性細胞は間葉系細胞の性質をもち,一方で,肝細胞と胆管上皮細胞に分化する(と想定される)肝前駆細胞は上皮系細胞だと考えられる.そこで,間葉と上皮との相互作用にかかわることの知られている種々の細胞間シグナル伝達タンパク質について,肝臓に障害のあたえたときの発現パターンを検討した.その結果,有力な候補としてFGFファミリーのひとつであるFGF7(別名KGF)を見い出した.FGF7の発現は正常な肝臓においてはほとんど認められなかったのに対し,DDC含有食餌投与による肝障害モデルマウスをはじめ,胆汁鬱体性の肝障害モデルマウスや慢性肝炎モデルマウスなど,肝前駆細胞の誘導をともなう種々の肝障害モデルマウスにおいて顕著に誘導された.その発現は肝前駆細胞の周囲において観察され,さらに,セルソーターを用いて単離した細胞画分における遺伝子発現解析から,Thy1陽性かつCD45陰性の間葉系細胞がFGF7のおもな産生細胞であることが明らかになった.一方で,FGF7の特異的な受容体であるFGF受容体2bは肝前駆細胞において強く発現していた.これらのことから,FGF7は肝前駆細胞の活性化をともなうさまざまな障害のときに共通して,Thy1陽性の間葉系細胞により産生および分泌され,肝前駆細胞に直接に作用することが強く示唆された.また,ヒトの急性肝炎や劇症肝炎の患者の血清において,FGF7の濃度が増大することも確認された.
そこで,FGF7ノックアウトマウスを用いて解析したところ,DDC含有食餌投与による肝障害モデルマウスや胆汁鬱体性の肝障害モデルマウスにおいて,肝前駆細胞の誘導がほぼ完全に抑制されていることが明らかになった.DDC含有食餌投与による肝障害モデルマウスを用いてさらに詳細に検討したところ,FGF7ノックアウトマウスでは肝臓の障害が顕著に増悪し致死率が有意に上昇していた.一方で,ドキシサイクリンの投与により肝臓において特異的にFGF7を強制発現させることの可能なトランスジェニックマウスを作製し解析したところ,肝臓に障害のない状態でもFGF7の過剰発現により人為的に肝前駆細胞の活性化をひき起こすことが可能であった.さらに,DDC含有食餌投与による肝障害モデルマウスにおいてFGF7を過剰に発現させると,再生が誘導および促進され障害の程度は軽減されることが示された.以上の結果から,肝臓に障害があたえられたとき,FGF7を介したニッチ細胞との相互作用が肝前駆細胞の活性化に重要であることがはじめて明らかになった(図4).さらに,FGF7の機能欠損(ノックアウトマウス)あるいは過剰発現(トランスジェニックマウス)により肝前駆細胞の誘導のレベルをそれぞれ抑制あるいは増加させた場合に,肝臓の障害の程度がこれと相関して増悪あるいは改善したことは,肝前駆細胞が実際に肝臓の再生に積極的に寄与している可能性を強く示唆した.将来的には,FGF7あるいは関連するタンパク質を用いることにより,ヒトの種々の肝疾患に対する新規の治療法の開発への応用も期待される.
一方で最近,ニッチシグナルによる肝前駆細胞の分化の制御に関しても興味深い報告がなされている23).ここでは,肝前駆細胞の誘導および細胆管反応の観察される障害を,その主要な病態にもとづき“胆管障害性”および“肝細胞障害性”の2つに大別し,両者における肝前駆細胞ニッチの違いに注目している.ヒトにおいては,原発性胆汁性肝硬変や原発性硬化性胆管炎が前者,C型肝炎ウイルス感染による慢性肝炎が後者にあたる.マウスにおいては,DDC含有食餌投与による肝障害モデルを胆管障害性の再生モデル,エチオニン添加コリン欠乏食投与による肝障害モデルを肝細胞障害性の再生モデルと位置づけて検討した.胆管障害性の再生モデルにおいては,肝前駆細胞の周囲にはα平滑筋アクチン陽性の線維芽細胞(ここでは,筋線維芽細胞とよんでいる)が集積し,これがNotchのリガンドであるJagged1を発現することにより肝前駆細胞においてNotchシグナル伝達経路を活性化していた.Notchシグナル伝達経路は発生の過程において肝芽細胞から胆管上皮細胞への分化の誘導に重要であることが知られており,この再生の過程においても肝前駆細胞から胆管上皮細胞の方向への分化を誘導していることが,Notchシグナル伝達経路の阻害剤を用いた実験などから示された.一方で,肝細胞障害性の再生モデルにおいては,肝前駆細胞の周囲にはマクロファージの集積が認められた.マクロファージは障害により死滅した肝細胞の残骸を貪食するとWnt3aを発現した.これが肝前駆細胞に作用すると,βカテニン経路によりNotchの分解にかかわるNumbの発現が誘導され,Notchシグナル伝達経路の活性化が抑制されることにより,結果的に肝細胞の方向への分化が促進された.すなわち,Notchシグナル伝達経路とWntシグナル伝達経路という2つのシグナル伝達経路の活性化のバランスにより,肝前駆細胞の分化の方向性が制御されるというモデルを提唱している(図5).しかしながら,さきに述べたとおり,胆管障害性とされるDDC含有食餌投与による肝障害モデルマウスにおいても肝前駆細胞にてWntシグナル伝達経路の活性化は誘導されており,単に量的な違いにより説明されるのか,あるいは,さらに別のシグナル伝達経路の関与による質的な違いがあるのかなど,今後の研究の進展が望まれる.また,ここでいうα平滑筋アクチン陽性の線維芽細胞は,筆者らの見い出したThy1陽性細胞と同等あるいは類似したものと考えられる.Thy1陽性細胞におけるFGF7シグナルによる肝前駆細胞ニッチが,エチオニン添加コリン欠乏食投与による肝障害モデルマウスにおいても機能しているのかどうかは重要な検討課題である.
これまでに紹介したTWEAK,Wnt,HGF,FGF7,Notchを中心として,さまざまなシグナル伝達経路がどのように関連し相互作用しあっているのか,今後の解析により,肝前駆細胞の出現,増幅,機能を制御する細胞間ネットワークの全容が明らかにされることが期待される.
おわりに
実験モデルにおいては代償性再生,あるいは,前駆細胞に依存性の再生のそれぞれを区別し特化した解析が行われているが,実際のヒトの肝疾患の病態において両者は共存かつ混在し,障害の部位や程度などに応じて適切な反応が誘導されることにより,肝臓はその頑強な再生能力を実現していると考えられる.今後は,この2つの再生の様式がどのように関連また連携し,それらのバランスが制御されているのかにも焦点をあてる必要があるだろう.肝臓の再生の分子機構を分子および細胞のレベルにおいて明らかにすることは,肝臓のもつ強い再生能力の秘密を解き明かすとともに,臓器あるいは組織の再生をつかさどる基本原理の理解にもつながるだろう.さらに,体外においてiPS細胞などから人工的につくりだした細胞,組織,臓器を移植するという治療法にくわえて,生物にもともと備わっている再生能力をひきだして増強するという,別の視点による治療戦略の創出にもつながるものと期待される.
文 献
- Tanaka, M., Itoh, T., Tanimizu, N. et al.: Liver stem/progenitor cells: their characteristics and regulatory mechanisms. J. Biochem., 149, 231-239 (2011)[PubMed]
- Suzuki, A., Sekiya, S., Onishi, M. et al.: Flow cytometric isolation and clonal identification of self-renewing bipotent hepatic progenitor cells in adult mouse liver. Hepatology, 48, 1964-1978 (2008)[PubMed]
- Kamiya, A., Kakinuma, S., Yamazaki, Y. et al.: Enrichment and clonal culture of progenitor cells during mouse postnatal liver development in mice. Gastroenterology, 137, 1114-1126 (2009)[PubMed]
- Okabe, M., Tsukahara, Y., Tanaka, M. et al.: Potential hepatic stem cells reside in EpCAM+ cells of normal and injured mouse liver. Development, 136, 1951-1960 (2009)[PubMed]
- Zajicek, G., Oren, R., Weinreb, M. Jr.: The streaming liver. Liver, 5, 293-300 (1985)[PubMed]
- Furuyama, K., Kawaguchi, Y., Akiyama, H. et al.: Continuous cell supply from a Sox9-expressing progenitor zone in adult liver, exocrine pancreas and intestine. Nat. Genet., 43, 34-41 (2011)[PubMed] [新着論文レビュー]
- Malato, Y., Naqvi, S., Schurmann, N. et al.: Fate tracing of mature hepatocytes in mouse liver homeostasis and regeneration. J. Clin. Invest., 121, 4850-4860 (2011)[PubMed]
- Espanol-Suner, R., Carpentier, R., Van Hul, N. et al.: Liver progenitor cells yield functional hepatocytes in response to chronic liver injury in mice. Gastroenterology, 143, 1564-1575 (2012)[PubMed]
- Miyaoka, Y., Ebato, K., Kato, H. et al.: Hypertrophy and unconventional cell division of hepatocytes underlie liver regeneration. Curr. Biol., 22, 1166-1175 (2012)[PubMed]
- Farber, E.: Similarities in the sequence of early histological changes induced in the liver of the rat by ethionine, 2-acetylamino-fluorene, and 3'-methyl-4-dimethylaminoazobenzene. Cancer Res., 16, 142-148 (1956)[PubMed]
- Rountree, C. B., Barsky, L., Ge, S. et al.: A CD133-expressing murine liver oval cell population with bilineage potential. Stem Cells, 25, 2419-2429 (2007)[PubMed]
- Dorrell, C., Erker, L., Schug, J. et al.: Prospective isolation of a bipotential clonogenic liver progenitor cell in adult mice. Genes Dev., 25, 1193-1203 (2011)[PubMed]
- Shin, S., Walton, G., Aoki, R. et al.: Foxl1-Cre-marked adult hepatic progenitors have clonogenic and bilineage differentiation potential. Genes Dev., 25, 1185-1192 (2011)[PubMed]
- Huch, M., Dorrell, C., Boj, S. F. et al.: In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration. Nature, 494, 247-250 (2013)[PubMed]
- Jakubowski, A., Ambrose, C., Parr, M. et al.: TWEAK induces liver progenitor cell proliferation. J. Clin. Invest., 115, 2330-2340 (2005)[PubMed]
- Tirnitz-Parker, J. E., Viebahn, C. S., Jakubowski, A. et al.: Tumor necrosis factor-like weak inducer of apoptosis is a mitogen for liver progenitor cells. Hepatology, 52, 291-302 (2010)[PubMed]
- Hu, M., Kurobe, M., Jeong, Y. J. et al.: Wnt/β-catenin signaling in murine hepatic transit amplifying progenitor cells. Gastroenterology, 133, 1579-1591 (2007)[PubMed]
- Apte, U., Thompson, M. D., Cui, S. et al.: Wnt/β-catenin signaling mediates oval cell response in rodents. Hepatology, 47, 288-295 (2008)[PubMed]
- Yang, W., Yan, H. X., Chen, L. et al.: Wnt/β-catenin signaling contributes to activation of normal and tumorigenic liver progenitor cells. Cancer Res., 68, 4287-4295 (2008)[PubMed]
- Itoh, T., Kamiya, Y., Okabe, M. et al.: Inducible expression of Wnt genes during adult hepatic stem/progenitor cell response. FEBS Lett., 583, 777-781 (2009)[PubMed]
- Ishikawa, T., Factor, V. M., Marquardt, J. U. et al.: Hepatocyte growth factor/c-met signaling is required for stem-cell-mediated liver regeneration in mice. Hepatology, 55, 1215-1226 (2012)[PubMed]
- Takase, H. M., Itoh, T., Ino, S. et al.: FGF7 is a functional niche signal required for stimulation of adult liver progenitor cells that support liver regeneration. Genes Dev., 27, 169-181 (2012)[PubMed]
- Boulter, L., Govaere, O., Bird, T. G. et al.: Macrophage-derived Wnt opposes Notch signaling to specify hepatic progenitor cell fate in chronic liver disease. Nat. Med., 18, 572-579 (2012)[PubMed]
参考図書
日本再生医療学会 (監修), 後藤満一, 大橋一夫 (編集): 代謝系臓器 (再生医療叢書5). 朝倉書店 (2012)
著者プロフィール
略歴:1998年 東京大学大学院理学系研究科博士課程 修了,同年 東京大学医科学研究所 博士研究員,2000年 米国Salk Institute for Biological Studies博士研究員,2003年 東京大学分子細胞生物学研究所 特任研究員,2004年 同 助手を経て,2013年より 同 講師.
研究テーマ:肝臓の再生の分子機構.
抱負:障害あるいは再生のときの肝前駆細胞の動態やほかの細胞との相互作用,それらのありのままのすがたをとらえてみたい.Seeing is believing.
宮島 篤(Atsushi Miyajima)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/cytokine/index.html
© 2013 伊藤 暢・宮島 篤 Licensed under CC 表示 2.1 日本