膜輸送タンパク質の分子機構の構造基盤
2013/09/25
濡木 理
(東京大学大学院理学系研究科 生物化学専攻)
email:濡木 理
領域融合レビュー, 2, e009 (2013) DOI: 10.7875/leading.author.2.e009
Osamu Nureki: Structural basis for molecular mechanism of membrane channels and transporters.

細胞は水1分子も通さない脂質二重膜,すなわち,細胞膜によりおおわれており,細胞膜は細胞の内外の環境を隔離することにより細胞の内部を生命活動に適した環境に維持している.膜に埋め込まれたチャネルや膜輸送タンパク質は,細胞の内外のイオン,糖,代謝産物,あるいは,薬物などの異物を正確に輸送することにより,この細胞内の環境を維持するナノマシンである.ヒトの遺伝子の30%以上は膜タンパク質をコードしており,創薬ターゲットの50%以上は膜タンパク質であることから,膜タンパク質の研究は生命原理の探求のみならず,医薬への応用にもきわめて重要である.最近になり,抗体や環状ペプチドといった分子バインダーを用いて動的な膜タンパク質の構造を安定化し結晶化を改善する技術,脂質中にて結晶化を行う脂質キュービック相法の技術,シンクロトロンのマイクロフォーカスX線ビームを用いた高分解能な構造解析の技術など,基盤となる技術が進歩し,チャネルや膜輸送タンパク質がどのように特異的な輸送基質を認識し,どのように輸送を駆動し,どのように輸送を制御しているのか,など,分子機構の解明が飛躍的に進んだ.ここでは,チャネルおよび膜輸送タンパク質の分子機構の構造基盤について,最近の知見もまじえ解説する.
細胞膜は細胞の内外の境界を決め,細胞の内部を外部の環境とは異なる状態で維持し,細胞の生存にとり不可欠な役割をはたす.物質を細胞の内外に輸送することによりこの異なる環境をつくりだしているのが,細胞膜に埋め込まれたチャネルや膜輸送タンパク質である.チャネルは,輸送基質それ自体のもつ化学ポテンシャルエネルギー(電気化学的な勾配)により輸送が駆動されるもので,このような輸送は受動輸送とよばれる.輸送基質に対する親和性は低く,その分,輸送の速度は非常に速い.これに対して,膜輸送タンパク質は,輸送基質との結合にともない構造変化を起こすことにより輸送を行うため,輸送の速度は遅い.これらのチャネルおよび膜輸送タンパク質が機能するにあたり重要な点は,1)その機能の本質である“輸送の駆動機構”,2)輸送基質の識別機構,3)輸送の制御機構,である.しかしながら,膜輸送タンパク質を含む膜タンパク質は試料の調製などの問題から立体構造の決定が困難であり,これらの理解はかぎられた状況にあった.その一方,最近になり,結晶化に適した膜タンパク質を迅速にスクリーニングする蛍光検出ゲルろ過クロマトグラフィー法(fluorescence-detection exclusion size chromatography:FESC)の技術,抗体や環状ペプチドといった“分子バインダー”を用いて動的な膜タンパク質の構造を安定化し結晶化を改善する技術,脂質中にて結晶化を行う脂質キュービック相法(lipidic cubic phase:LCP)の技術など,膜タンパク質の高分解能な構造解析のための技術が飛躍的に進歩し,さきにあげた3つの点は解明されつつある.ここでは,これら3つの点に焦点をあてながら,チャネルおよび膜輸送タンパク質の分子機構を解説する.
K+チャネルは,イオン半径が1.51ÅのK+は透過させるが,1.16Åとこれよりイオン半径の小さいNa+は通さない.チャネルが単なる孔であるなら,大きいものを通すならより小さいものも通すはずである.この謎を解明したのがRoderick Mackinnonで,この功績により2003年にノーベル化学賞を受賞した.
Mackinnonは,K+チャネルKcsAの結晶構造を高分解能で決定した1).その結果,細胞の外側からの入口の付近に,ペプチド主鎖のカルボニル酸素およびThrのβ酸素が5つ縦に並び,これが四量体ごとに4回対称で整列したイオンの通り道を構成していた(図1).驚くべきことに,通常,K+は水分子が8つ配位しているのに対し,この構造ではうち4つが脱水和してさきの酸素原子により置換されていた.K+はイオン半径が十分に大きいので酸素原子による配位結合が安定に形成され,脱水和による安定化エネルギーの減少が相殺される.これに対し,Na+はイオン半径が小さく,酸素原子による安定な配位結合が形成できないため脱水和が起こらず,むしろ,半径が大きくなりこのイオンの通り道を通過できないことが示唆された.このため,このイオンの通り道はイオン選択性フィルター(ion selectivity filter)と命名された.
Mg2+はイオン半径が0.72Åであるのに対し,水分子との親和性が高いため水和半径は5.3Åと非常に大きく,Co2+やNi2+に近い.同じアルカリ土類金属のCa2+はイオン半径が1.12Å,水和半径が2.9Åであり,水和により半径はあまり変わらない.Mg2+は酸素原子との親和性が高いため,リン酸化酵素やポリメラーゼなどのATPaseやGタンパク質などGTPaseの補酵素としてはたらく.細胞内のCa2+濃度は細胞の状態に大きな影響を及ぼすことが知られているが,最近,細胞内Mg2+濃度が異常になると,心臓病,糖尿病,高血圧など生活習慣病が惹起されることが判明し,Mg2+が細胞のホメオスタシスに重要な役割をはたしていことが明らかになってきた.また,ごく最近,Mg2+は脳における記憶の保持にも重要であることが判明した2)(新着論文レビュー でも掲載).
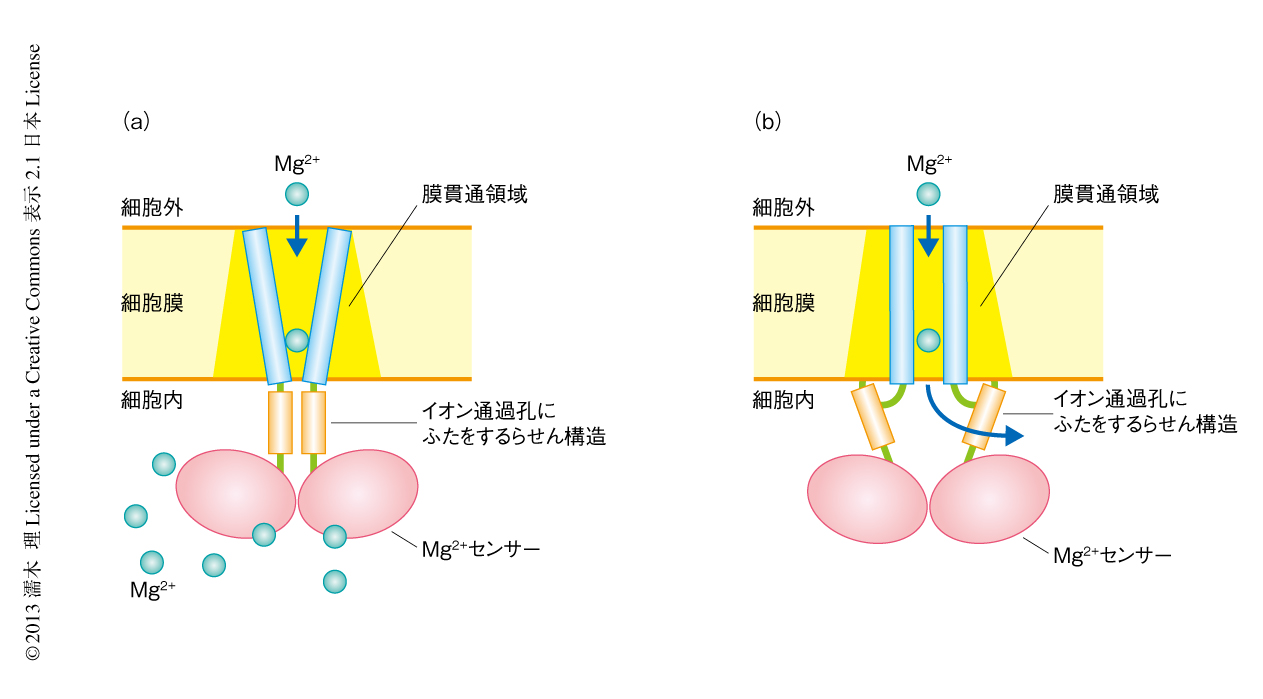
筆者らは,細胞の外側から内側へのMg2+の取り込みを担う新規のMg2+輸送タンパク質MgtEについて,Mg2+存在下における構造をX線結晶構造解析により2.9Å分解能で決定した3,4)(図2).その結果,MgtEの膜貫通ドメインに,生体の内外へとMg2+を透過させるための“イオン透過孔”が細胞膜を横切るかたちで存在することが明らかになった.このイオン透過孔には,輸送の途中にあると考えられるMg2+様の電子密度が観測された.しかし,Mg2+過剰条件におけるMgtEの構造では,5番目の膜貫通ヘリックスによりMg2+の透過孔がふさがれていた(図2).さらに,各ドメインの境界には多くの酸性アミノ酸残基が延びており,多くのMg2+がこれに結合して電荷を中和していることが判明した.さらに,MgtEの構造において“Mg2+センサー”として機能すると考えられる細胞質ドメインについて,Mg2+過剰条件あるいはMg2+欠乏条件それぞれにおける立体構造を決定した.その結果,Mg2+欠乏条件における細胞質ドメインの構造には,各ドメインが互いに反発して開くような大きな構造変化がみられた.細胞内Mg2+濃度に依存したこの構造変化は,コンピューターを用いた分子動力学シミュレーションによっても再現された5).この細胞質ドメインの構造変化が膜貫通ドメインの構造変化を誘起し,イオン透過孔を開閉してMg2+の透過を制御すると推測された.以上をふまえ,MgtEの細胞質ドメインが細胞内のMg2+濃度を感知することにより,Mg2+が過剰なときにはMg2+取り込みを阻害し,欠乏している場合にはMg2+取り込みを促進させるという,Mg2+バランス維持の分子機構を提唱した3)(図3).さらに,電気生理学な解析により,MgtEがMg2+に特異的なチャネルであり,細胞内のMg2+濃度に依存してイオン透過孔が開閉することを実証した4).興味深いことに,細胞質ドメインのMg2+と結合する残基に変異を導入したMgtE変異体では,高いMg2+濃度においてもイオン透過孔は開きっぱなしになっており,細胞質ドメインを欠失するとイオン透過孔の開口率はほぼ100%になったことから,MgtEの細胞質ドメインはMg2+センサーとしてはたらき,イオン透過孔の開閉を制御することにより細胞内のMg2+濃度を制御していることが実証された4).
(2013年9月27日 著者からの依頼により,1パラグラフ削除)
膜輸送タンパク質は輸送基質に対し1つ以上の特異的な結合部位をもち,この結合部位が細胞膜の外側に露出したり内側に露出したりする可逆的な構造変化を起こす結果,輸送基質は細胞膜を通過する.膜輸送タンパク質ではエネルギー源と共役して輸送基質を電気化学的な勾配に逆らい能動輸送するものがほとんどである.膜輸送タンパク質は,能動輸送を駆動するエネルギー源により,以下の3つに分類される.1)共役輸送タンパク質(coupled transporter):勾配に逆らった輸送基質の輸送を,勾配にしたがった別の輸送基質の輸送と共役させる.2)ATP駆動型ポンプ(ATP-driven pump):ATPの加水分解と輸送基質の能動輸送とを共役させる.3)光駆動型ポンプ(light-driven pump):光エネルギーの受容と輸送基質の能動輸送とを共役させるもので,おもに細菌や古細菌のロドプシンファミリータンパク質がある.
共役輸送タンパク質において,2つの輸送基質の輸送の方向が同じものをシンポート,逆方向のものをアンチポートという.無機イオンが電気化学的な勾配にそって移動する際に放出される自由エネルギーを,もうひとつの輸送基質を輸送するための駆動力として用いる場合が多い.とくに,動物の細胞ではNa+の電気化学的な勾配が大きな駆動力となっている.こうして細胞内に流れ込んだNa+は,ついで,細胞膜に存在するATP駆動型ポンプであるNa+ポンプにより細胞外にくみ出される.このATP駆動型ポンプは,Na+の電気化学的な勾配を形成することにより間接的に輸送基質の輸送を駆動していることになる.このため,このとき,ATP駆動型ポンプを1次輸送タンパク質,共役輸送タンパク質を2次輸送タンパク質とよぶ.
たとえば,腸や腎臓の上皮細胞では,電気化学的な勾配にそって流入するNa+と共役して,糖やアミノ酸が細胞内に輸送される(シンポート).この場合,共役輸送タンパク質が構造変化を起こして細胞外開構造から細胞内開構造となるのは,両方の輸送基質(Na+と糖あるいはアミノ酸)と結合したときか,両方とも結合していないときのみである.一方,細菌や酵母では,能動輸送の大半はNa+ではなくH+の勾配に依存しており,動物細胞のオルガネラと似ている.これは,細胞膜にNa+ポンプがほとんどなくH+ポンプが多いからである.H+の電気化学的な勾配により駆動されるシンポートにおいて共役輸送タンパク質として古くから研究されているものに,ラクトース透過酵素LacYがある.
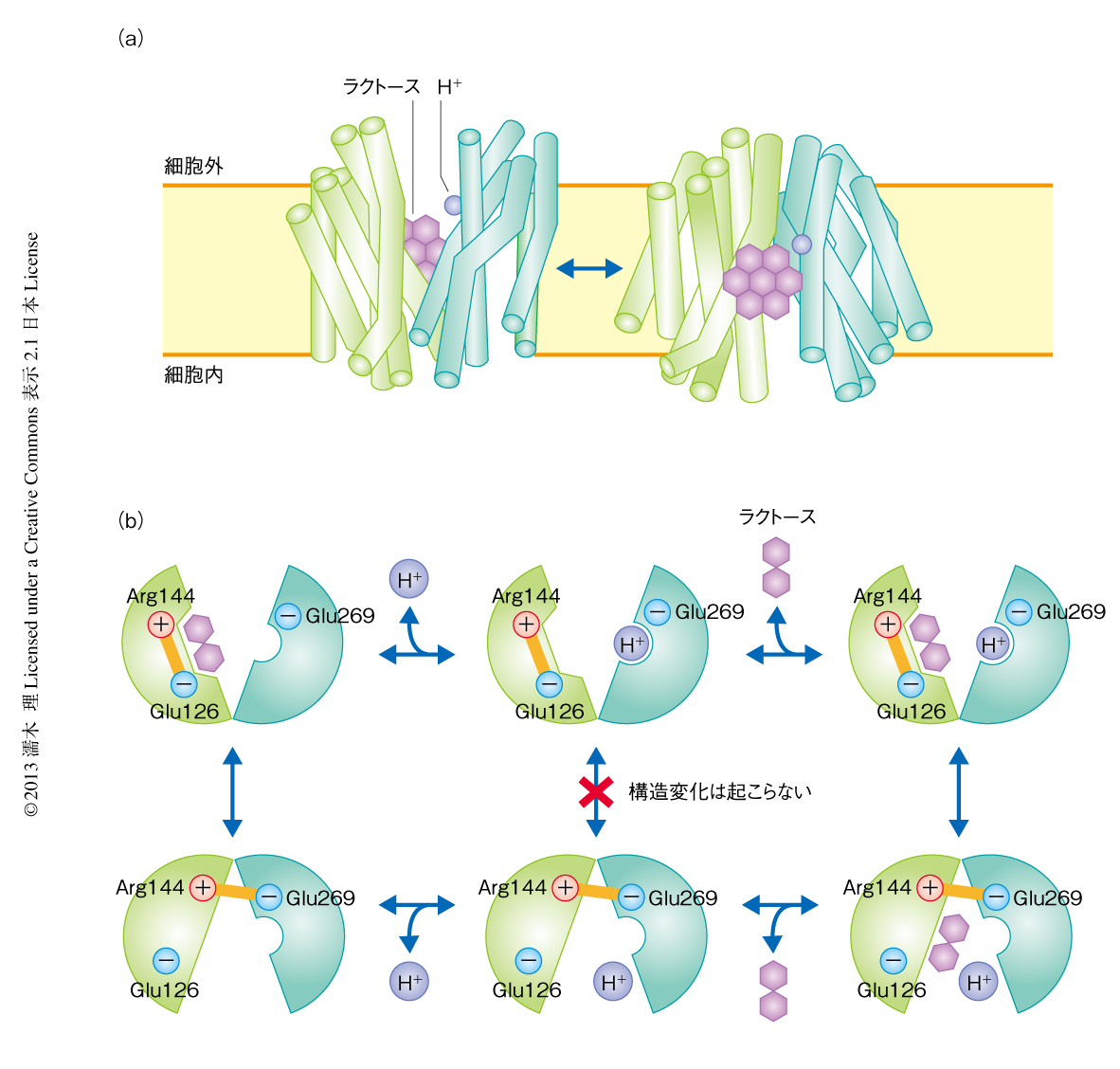
LacYはMFS(major facilitator superfamily)という12回膜貫通タンパク質スーパーファミリーに属する.MFSはH+と輸送基質をシンポートする共役輸送タンパク質であり,1000以上のファミリーからなる膜輸送タンパク質としては最大のスーパーファミリーである.LacYについてはX線結晶構造解析により輸送基質の結合した細胞内開構造の構造が報告されており,そのシンポートの機構が明らかにされている6)(図4).LacYの12本の膜貫通へリックスは6本ずつ2つのローブを形成しており,細胞外開構造では,N末端側のローブに存在するArg144とGlu126とが静電相互作用により結合しているため,C末端側のローブのGlu269が自由になりH+と結合する.そのため,N末端側のローブの電気的に中和された基質結合ポケットに輸送基質であるラクトースが結合できるようになる.LacYが細胞内開構造に変わるとArg144はGlu269と結合するようになり,H+が外れるのと同時に膜貫通へリックスがすべるように構造変化を起こし,ラクトースとの結合部位は壊れてラクトースは細胞内へと放出される.共役輸送タンパク質が構造変化を起こすのは両方の輸送基質が結合したときか両方とも結合していないときのみであり,H+だけと結合した状態のあいだで構造変化は起こらないので,H+はラクトースとともにしか輸送されない.
POTもMFSに属する共役輸送タンパク質で,H+とジペプチドあるいはトリペプチドをシンポートする.ヒトでは小腸の絨毛にPepT1およびPepT2というPOTが大量に発現しており,タンパク質が消化されてできたペプチドの取り込みにはたらいている7).さらに,POTはβラクタム系の抗生物質や抗ウイルス剤などの薬剤の取り込みにもはたらいており,医薬の分野においても重要である8).
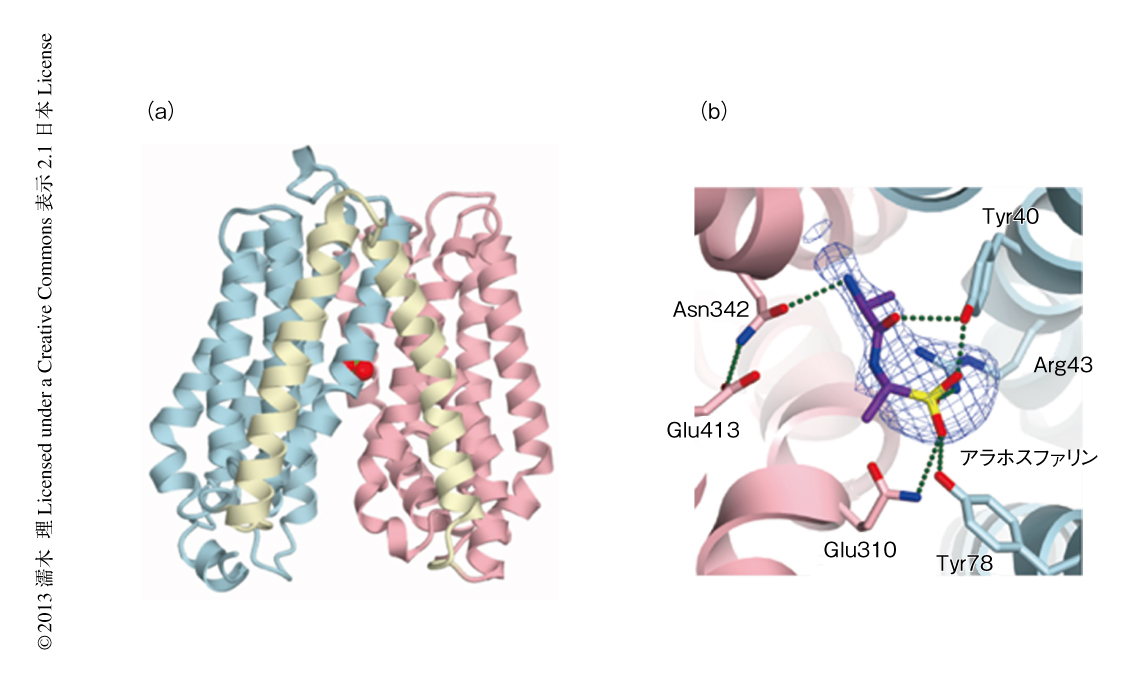
筆者らは,脂質キュービック相法を用いた結晶化により,POT単独,および,POTと輸送基質であるジペプチドアナログとの複合体の結晶構造を1.9~2.5Å分解能という高分解能で明らかにした9)(図5).この構造は細胞内開構造であり,POTのArg43とプロトン化されたGlu310(プロトン化されたときのみ,電気的な反発なく水素結合できる)が輸送基質であるジペプチドのカルボキシル基を水素結合により認識していることがわかった(図5).さらに,コンピューターを用いた分子動力学シミュレーションによる解析から,Glu310が脱プロトン化すると電気的な反発によりジペプチドを結合できなくなり,一方,Arg43とGlu310とが静電相互作用で引き合って細胞内開構造から細胞内閉構造へと変化することが明らかになった.これは,細胞内開構造において輸送基質であるジペプチドを解離し細胞内閉構造へと変化する生理的な過程に相当する.また,コンピューターシミュレーションにより,H+とジペプチドとが結合したとき,あるいは,何も結合していないときのみ構造変化が起こり,H+のみの結合した状態では構造変化は起こらないという,シンポートの主要な分子機構の構造基盤を解明することができた9).すなわち,基質ポケットの表面の電荷状態がGlu310のプロトン化により中和されることにより輸送基質であるジペプチドが結合し,H+の輸送とともにジペプチドも解離してシンポートの起こることが明らかになった.
MATE(multidrug and toxic compound extrusion)は多剤排出輸送タンパク質であり,Na+あるいはH+のインポートと共役することにより,異物やさまざまな薬剤をアンチポートにより細胞の外へと排出する10).ヒトのMATEは腎臓や肝臓において多く発現しており,細胞からの異物の排出に重要な役割をはたしている11).しかし,病原性細菌やがん細胞においてMATEが大量に発現すると,抗生物質や抗がん剤の効かない多剤耐性菌や抗がん剤耐性がん細胞が出現することになるため,MATEの阻害剤の開発は医薬の分野において急務となっていた12).
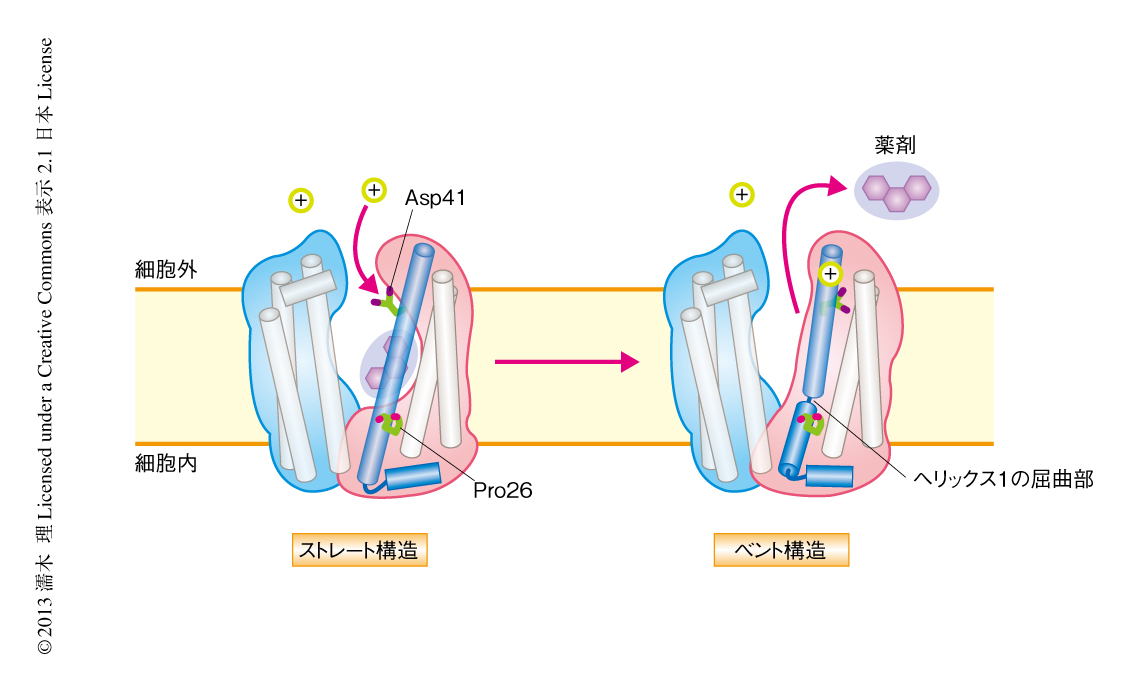
筆者らは,H+により駆動される古細菌のMATEの結晶構造を,単独,および,抗生物質あるいは阻害ペプチドとの複合体のかたちで2.1~3.0Å分解能という高分解能で決定した13)(新着論文レビュー でも掲載).MATEはMFSとよく似ており,12本の膜貫通へリックスが6本ずつ2つのヘリックスバンドルドメインを形成していて,細胞外開構造をとっていた(図6).MATEは単独でも,結晶化されたときのpHにより2つの構造をとることがわかった.中性の付近ではヘリックス1がまっすぐ伸びたかたちをとり,ストレート構造と命名された.しかし,酸性条件ではヘリックス1は真ん中のPro26において折れ曲がり,大きく曲がったベント構造をとった.このベント構造では,ヘリックス1により基質結合ポケットがふさがれ,輸送基質となる薬剤は結合できないことがわかった.さらに,基質結合ポケットのあるN末端ドメインのさきにはAsp41やAsp184などの酸性アミノ酸残基あるいは親水性アミノ酸残基があり,ストレート構造においてこれらはゆるく結合していたが,酸性条件ではAsp41がプロトン化することによりAsp184などと強固な水素結合ネットワークを形成し,ヘリックス1を引っ張り込むことによりベント構造になり輸送基質が排出されることが明らかになった.以上のことから,H+と共役した薬剤の排出機構が明らかになった13)(図7,動画のURLは,http://www.nature.com/nature/journal/v496/n7444/fig_tab/nature12014_SV1.html).さらに,このMATEと強固に結合する環状ペプチドをスクリーニングしたところ,そのひとつは薬剤結合ポケットを占拠し(図6),強い阻害活性をもつことがわかり,これまで薬剤を排出してしまうため阻害剤をデザインすることが不可能であったMATEに対し,阻害剤の開発する道を開くことになった13).
真核生物の細胞は1 mMほどの高いCa2+濃度の環境にさらされながら,細胞質における遊離のCa2+濃度を0.1μM程度にまで下げることにより,Ca2+の流入による細胞内シグナル伝達(たとえば,筋肉の収縮)を達成している.したがって,細胞内のCa2+濃度を低く保つ輸送タンパク質は生命の維持にとりきわめて重要である.Ca2+を細胞外に排出するおもな輸送タンパク質には,後述するP型Ca2+ポンプと,Ca2+/陽イオン交換輸送タンパク質とがある14).Ca2+/陽イオン交換輸送タンパク質の機能不全はヒトにおいて高血圧を惹起することが知られている.
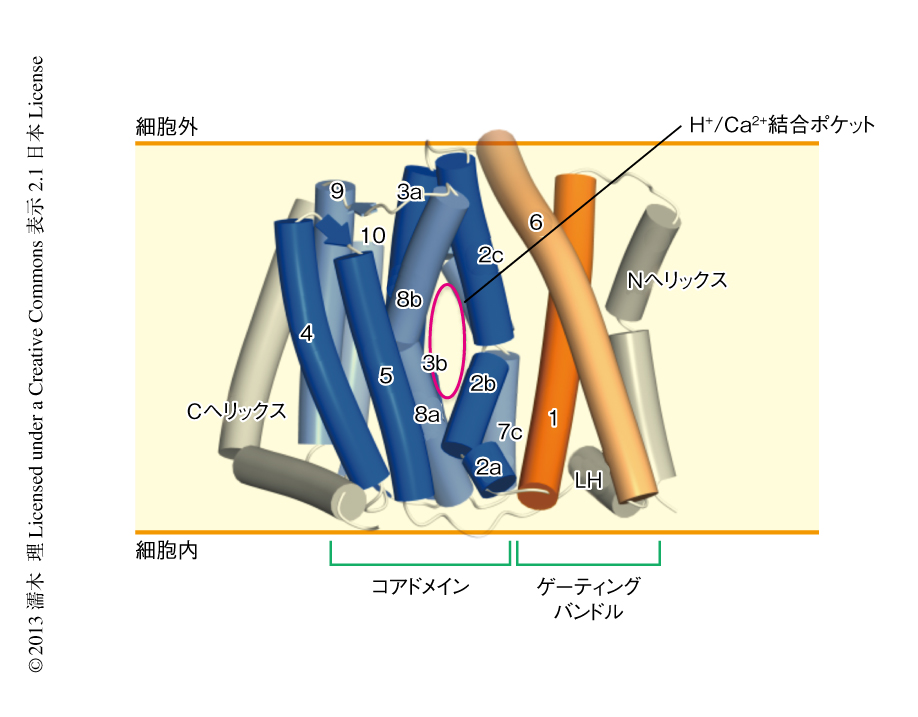
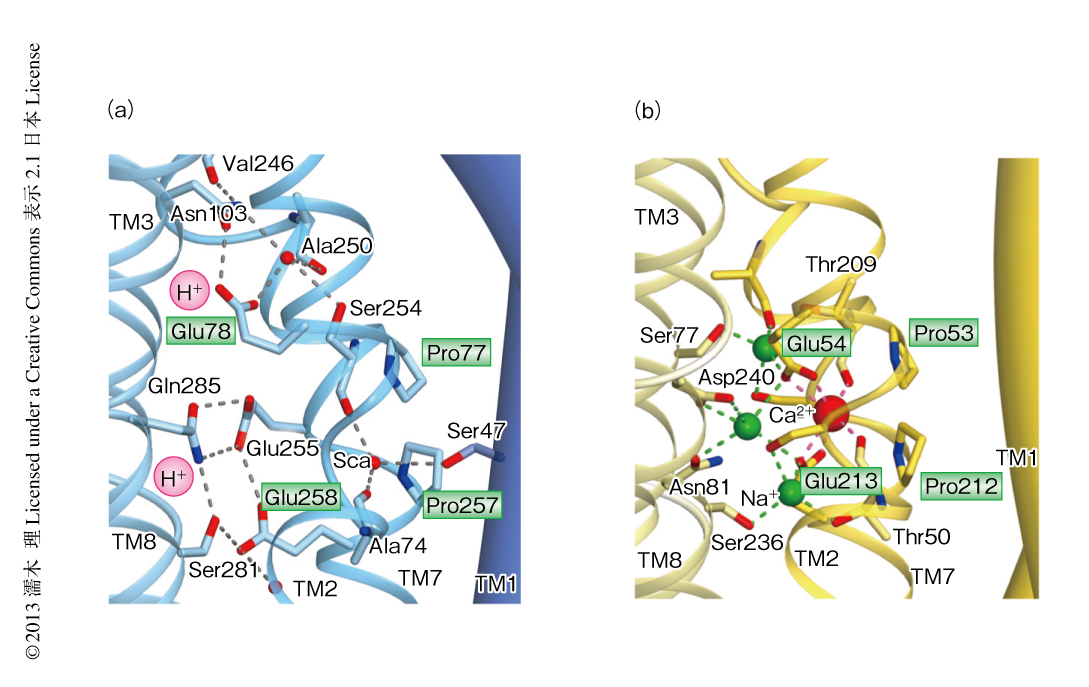
筆者らは,H+/Ca2+交換輸送タンパク質CAXの結晶構造を2.3Å分解能で決定した.その結果,CAXはコアドメインとゲーティングバンドルから構成されることが明らかになった15)(新着論文レビュー でも掲載)(図8).すでに報告されていたNa+/Ca2+交換輸送タンパク質の構造が細胞外開構造であったのに対し16),CAXの構造は細胞内開構造であった.2つの構造の比較から,Ca2+/陽イオン交換輸送タンパク質はゲーティングバンドルがコアドメインの表面にある疎水性パッチのうえを滑ることによりゲーティングへリックスが回転し,そのうえに存在する親水性クラスターが細胞の外側の透過孔を向いたり,細胞内の透過孔を向いたりことをくり返すことにより,細胞外開構造と細胞内開構造とのあいだを切り替わることが明らかになった15)(図8).また,この構造では,3つのグルタミン酸残基Glu78,Glu255,Glu258が互いにあるいはグルタミン残基と水素結合を形成していたことからプロトン化した状態であり,陽イオン結合ポケットに3つのH+が結合したH+結合型であると考えられた(図9).一方,Ca2+結合型のNa+/Ca2+交換輸送タンパク質の構造と比較することにより,さきのプロトン化していた3つのGluのうちGlu78とGlu258が向きを変えてCa2+と結合することが判明し(図9),H+とCa2+は同時には結合できないこともわかった.さらに,陽イオン結合ポケットにH+やCa2+が結合することにより,はじめてコアドメインに疎水性パッチが形成され,ゲーティングバンドルはこのうえを滑ることのできるようになることが明らかになり,陽イオンに依存的な構造変化の機構が解明された15)(動画のURLは,http://www.sciencemag.org/content/suppl/2013/05/23/science.1239002.DC1/1239002s1.mov).
以上,MATEおよびCAXの構造機能解析の結果,2つの輸送基質のうちどちらか一方が結合したときのみ,細胞外開構造と細胞内開構造とのあいだの構造変化が誘起され,輸送基質が輸送されるという,アンチポートの主要な分子機構の構造基盤が明らかになった(図10).
[hs_figure id=10&image=/wordpress/wp-content/uploads/2013/09/Nureki-2.e009-Fig.10.png&caption=fig10-caption-text]
ATP駆動型ポンプはATPのADPとリン酸への加水分解により生じるエネルギーを利用するため,輸送性ATPaseともよばれる.ATP駆動型ポンプにはつぎの3つの型がある.
1)P型ポンプ(P-type ATPase):輸送サイクルのあいだに輸送タンパク質自体がリン酸化されるのでP型とよばれる.細胞膜をはさんでNa+,K+,H+,Ca2+などさまざまな陽イオンの勾配を形成するイオンポンプが含まれる.
2)F型ポンプ(F-type ATPase):多くのサブユニットから構成されるタービンのようなかたちをしたポンプである.F型ポンプにはF型ATPaseとV型ATPaseとがある.細菌の細胞膜,ミトコンドリアの内膜,葉緑体のチラコイド膜にみられる.F型ATPaseの多くは膜をはさんだH+の濃度勾配によりADPとリン酸からATPを合成するが,その逆反応も触媒するためATP合成酵素ともよばれる.このH+の濃度勾配は,好気性細菌やミトコンドリアでは酸化的リン酸化にともなう電子伝達により,葉緑体では光合成により,好塩菌ではバクテリオロドプシンのような光駆動型H+ポンプにより,形成される.一方,リソソーム,シナプス小胞,植物の液胞などのオルガネラには,ATPを合成せずもっぱらH+ポンプとしてオルガネラのpHを低く保つためにはたらくV型ATPaseがある.これまでのところ,F型ATPaseに関しては細胞質ドメインであるαβサブユニットのほかには,膜貫通ドメインであるcサブユニットのリング構造が報告されているのに対し17),V型ATPaseに関してはモータードメインの構造が報告されている18)(新着論文レビュー でも掲載).
3)ABC輸送タンパク質(ABC transporter):イオンだけを輸送するP型ポンプあるいはF型ポンプとは異なり,ATPの加水分解のエネルギーを輸送タンパク質の構造変化と共役させることにより,細胞膜を横切って小分子を輸送する.細胞質側にATPと結合するABC(ATP-binding cassette,ATP結合カセット)ドメインをもつためこの名がある.このABCドメインは二量体を形成してATPと結合しているが,ATPを加水分解すると二量体構造がゆるんでゲートが開くため,輸送が行われる.数多くの結晶構造が報告されているが,最近では,ビタミンB12輸送タンパク質の構造が報告されている19).
さきに述べたように,真核生物の細胞の内外のCa2+濃度勾配はCa2+を細胞の外へと能動輸送するCa2+ポンプと2次輸送タンパク質により維持されていて,そのCa2+ポンプのひとつはP型Ca2+-ATPaseであり,もうひとつはNa+の電気化学的な勾配が駆動するNa+-Ca2+交換輸送タンパク質(Na+-Ca2+ exchanger)である.P型ATPaseのうちもっとも研究が進んでいるのは,骨格筋細胞の筋小胞体膜に存在するCa2+-ATPaseであるSRCA1である.筋小胞体はCa2+の貯蔵庫であり,活動電位により筋細胞膜が脱分極するとCa2+が筋小胞体からCa2+チャネルを通って細胞質へと放出され,筋肉を収縮させる.Ca2+ポンプは筋小胞体の膜タンパク質の約90%をしめ,細胞質から筋小胞体へとCa2+を能動輸送する.
さまざまな輸送の状態におけるSRCA1の構造は,豊島 近およびPoul Nissenらにより解明された20-27).P型ATPaseは10本の膜貫通へリックスをもち,そのうち3本は脂質二重膜を貫く中央のチャネルの壁を形成している(図11).細胞質ドメインはATP結合ドメイン,リン酸化ドメイン,作動性ドメインの3つのドメインからなり,ATPが加水分解されると同時に,リン酸化ドメインのAsp351がリン酸化される.Ca2+ポンプからリン酸基が外れると,2本の膜貫通へリックスの構造がゆるんで筋細胞膜の細胞質側にむかい空洞が生じ,そこに2つのCa2+が結合する.さらに,細胞質側のATP結合ドメインにATPが結合し,これが加水分解して生じたリン酸基がAsp351に結合(リン酸化)すると,このリン酸基と作動性ドメインとが静電的に相互作用するため,これに引っ張られて3本の膜貫通ドメインの配向が変わり,Ca2+結合部位は崩壊して筋小胞体の内腔側にむかい開口し,Ca2+は小胞体の内腔へと放出される.
[hs_figure id=11&image=/wordpress/wp-content/uploads/2013/09/Nureki-2.e009-Fig.11.png&caption=fig11-caption-text]
さきに,能動輸送を行う膜輸送タンパク質の3つ目は光駆動型ポンプであると述べた.これらはおもに原核生物のロドプシンファミリータンパク質である.ところが,真核生物のロドプシンファミリータンパク質は,ポンプではなく,ロドプシンのようなGタンパク質共役受容体であったり,以下に述べるようなチャネルであったりする.近年,脳神経科学の分野において,チャネルロドプシンとよばれる光駆動型の陽イオンチャネルを利用したニューロンの選択的な活性化の技術が脚光をあびている.チャネルロドプシンは青色光を受容するとイオン透過孔が開きNa+やCa2+といった陽イオンを透過するため28),チャネルロドプシンを強制発現させたニューロンに青色光を照射することにより,そのニューロンのみを選択的に活性化させることが可能になる.最近,極細の光ファイバーを脳に挿入することにより,マウスのような高等動物でもin vivoにおいて特定のニューロンを活性化させ,そのニューロンあるいは神経回路が行動にあたえる影響を解析することができるようになった29).
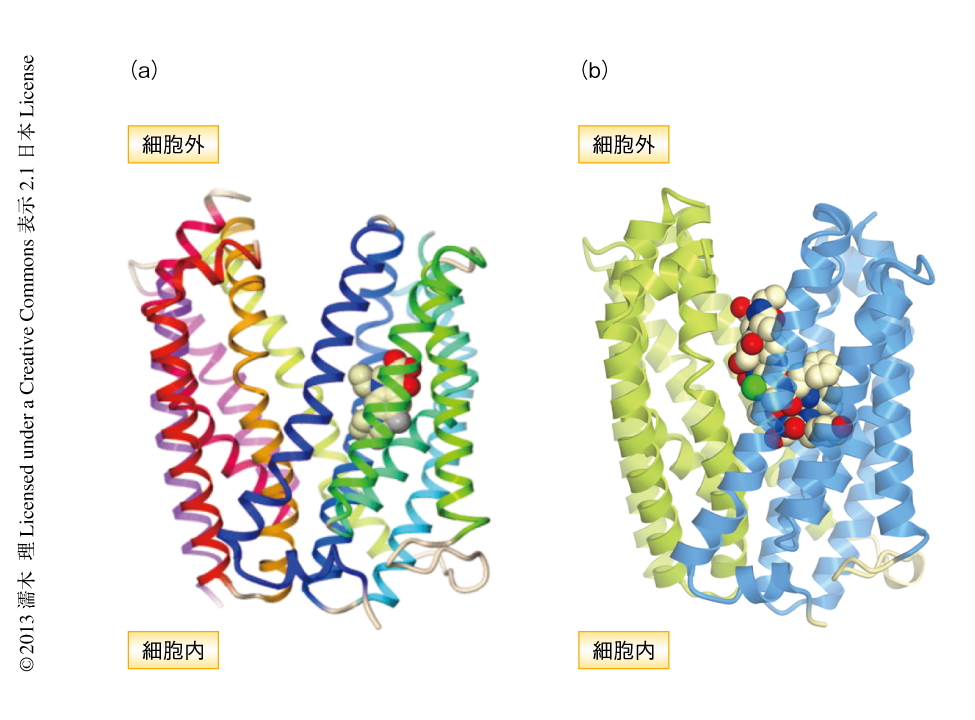
筆者らは,世界にさきがけ,脂質キュービック相法を用いてチャネルロドプシンの結晶化に成功し,その結晶構造を2.3Å分解能で決定した30)(新着論文レビュー でも掲載)(図12).チャネルロドプシンは二量体を形成しており,それぞれのサブユニットあたり負の電荷表面をもつ孔をもっていた.実際に,この孔の内部の親水性アミノ酸残基に変異を導入し,電気生理学な解析により光電流を測定することにより,この孔がイオン透過孔であることが判明した.このイオン透過孔は,光を受容するレチナール(通常は全trans型であるが,光を受容すると13-cis型となる)がシッフ塩基によりLys296に共有結合している近傍に存在した.しかし,このイオン透過光はその細胞質側が2つのゲートによりふさがれていた.すなわち,この構造は閉構造(基底状態)の構造であった.これらのゲートは,Glu122とGlu129がそれぞれHis173,Asn297と水素結合することによりイオン透過孔をふさいでいた.これら2つのGluをAlaに置換しても光電流に変化はなかったのに対し,つねにプロトン化したGluを模倣するGlnに置換すると光電流は大きく減退したことから,これらのGluのプロトン化および脱プロトン化がチャネルの開閉に重要であることが示唆された.さらに,Glu122およびGlu129を脱プロトン化状態にし,レチナールを13-cis型にして分子動力学シミュレーションを行うことにより,光照射によりチャネルが閉構造から開構造に変化する機構を解明することに成功した.今後,この構造にもとづいてより有用なチャネルロドプシン変異体をデザインすることにより,神経生物学や神経病理学の分野に大きく貢献することが期待される.
[hs_figure id=12&image=/wordpress/wp-content/uploads/2013/09/Nureki-2.e009-Fig.12.png&caption=fig12-caption-text]
これまで,イオンや糖,ペプチドといった小分子の膜輸送の分子機構について述べてきた.しかしながら,水1分子も透過することのできない脂質二重膜を,タンパク質のような巨大な分子も透過することができる.これにはたらく輸送タンパク質がSecトランスロコン複合体である.実際に,リボソームで合成されたタンパク質の約30%は,ATPaseモーターであるSecAにより駆動され,Sec膜透過タンパク質を介して,ほどかれた状態で細胞膜を透過し,あるいは,膜タンパク質は細胞膜に埋め込まれる.
筆者らは,タンパク質の膜透過チャネルである10回膜貫通タンパク質SecYE複合体の結晶構造を,特異的な抗体との複合体のかたちで3.2Å分解能で決定した31)(図13).SecYE複合体は真核生物ではSec61複合体として保存されている.これまで報告されていた古細菌のSecYEβ複合体が閉構造であったのに対し32),この構造は膜貫通へリックスが互いに開いて疎水性のへこみを形成した開構造であった.この疎水性のへこみには輸送されるタンパク質のN末端のシグナル配列が結合し,タンパク質の輸送が誘起されることが示唆された.システイン架橋法を用いた生物化学的な解析と結晶構造解析,分子動力学シミュレーションにより,抗体が結合しない状態ではSecYE複合体は閉構造をとっており,SecA(あるいは,これを模倣した抗体)が結合すると閉構造から開構造へと構造変化することが明らかにされた.さらに,SecAとSecYE複合体とをシステイン架橋法を用いて解析した結果,SecAもSecYE複合体と結合すると開構造となり,ATPase活性の亢進することが明らかにされた.すなわち,SecAもSecYE複合体も単独では閉構造をとっているが,互いに複合体を形成することにより開構造へと変化し,タンパク質の膜透過をひき起こすことが明らかになった.SecAとSecYEGの複合体の低分解能結晶構造も33),このことを支持していた.
[hs_figure id=13&image=/wordpress/wp-content/uploads/2013/09/Nureki-2.e009-Fig.13.png&caption=fig13-caption-text]
さらに最近,SecYE複合体と協働する12回膜貫通タンパク質SecDF複合体についても,結晶構造を3.3Å分解能で解明した34)(新着論文レビュー でも掲載)(図14).生化学的な解析によりSecDF複合体は,SecAが変性したタンパク質をSecYE複合体に押し込んだのち,タンパク質の膜透過における後期の過程を,H+の濃度勾配のエネルギーを用いて促進する機能をもつことが明らかにされた34).さらに,システイン架橋法を用いた解析により,SecDFのペリプラズムドメイン1が2つの構造をダイナミックに往復することにより,細胞の外へと輸送されてきたタンパク質をSecYE複合体から引っ張りだし巻きもどすことを明らかにした34).さらに,電気生理学的な解析と蛍光分光解析により,SecDF複合体はH+を輸送する新規のH+チャネルであり,これを駆動力としてペリプラズムドメイン1が構造変化をくり返すことにより,タンパク質の膜輸送を促進する膜シャペロンとしてはたらくことを実証し,さらに,H+の輸送にはたらく荷電アミノ酸残基を同定することにも成功した34).
[hs_figure id=14&image=/wordpress/wp-content/uploads/2013/09/Nureki-2.e009-Fig.14.png&caption=fig14-caption-text]
これまで述べてきた膜輸送タンパク質の構造生物学な研究から,膜輸送タンパク質は独自の基質結合ポケットにより輸送基質を認識し,輸送基質それ自体のもつ化学ポテンシャルエネルギー,あるいは,ほかのイオンの濃度勾配やATPの加水分解のエネルギーを用いて,輸送を駆動していることが明らかになった.とくに,イオンの結合やリン酸化などにより透過孔の内部の電荷状態が変化することで,輸送基質との結合や解離,構造変化が誘起されることにより,輸送が駆動されるという分子機構が解明された.さらに,膜輸送タンパク質の多くは,細胞内ドメインがセンサーとしてはたらき輸送基質と相互作用することでこの情報を膜貫通ドメインへと伝達し透過孔を開閉するゲーティング機構をもちあわせることにより,輸送を制御するという分子機構が解明されつつある.
略歴:東京大学大学院理学系研究科 教授.
研究テーマ:遺伝暗号の翻訳,膜輸送および受容,慢性炎症の分子機構.
抱負:細胞のさまざまな生理機構を原子分解能で解明し,医薬の分野に応用したい.
研究室URL:http://www.nurekilab.net/
© 2013 濡木 理 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物化学専攻)
email:濡木 理
領域融合レビュー, 2, e009 (2013) DOI: 10.7875/leading.author.2.e009
Osamu Nureki: Structural basis for molecular mechanism of membrane channels and transporters.
要 約
細胞は水1分子も通さない脂質二重膜,すなわち,細胞膜によりおおわれており,細胞膜は細胞の内外の環境を隔離することにより細胞の内部を生命活動に適した環境に維持している.膜に埋め込まれたチャネルや膜輸送タンパク質は,細胞の内外のイオン,糖,代謝産物,あるいは,薬物などの異物を正確に輸送することにより,この細胞内の環境を維持するナノマシンである.ヒトの遺伝子の30%以上は膜タンパク質をコードしており,創薬ターゲットの50%以上は膜タンパク質であることから,膜タンパク質の研究は生命原理の探求のみならず,医薬への応用にもきわめて重要である.最近になり,抗体や環状ペプチドといった分子バインダーを用いて動的な膜タンパク質の構造を安定化し結晶化を改善する技術,脂質中にて結晶化を行う脂質キュービック相法の技術,シンクロトロンのマイクロフォーカスX線ビームを用いた高分解能な構造解析の技術など,基盤となる技術が進歩し,チャネルや膜輸送タンパク質がどのように特異的な輸送基質を認識し,どのように輸送を駆動し,どのように輸送を制御しているのか,など,分子機構の解明が飛躍的に進んだ.ここでは,チャネルおよび膜輸送タンパク質の分子機構の構造基盤について,最近の知見もまじえ解説する.
はじめに
細胞膜は細胞の内外の境界を決め,細胞の内部を外部の環境とは異なる状態で維持し,細胞の生存にとり不可欠な役割をはたす.物質を細胞の内外に輸送することによりこの異なる環境をつくりだしているのが,細胞膜に埋め込まれたチャネルや膜輸送タンパク質である.チャネルは,輸送基質それ自体のもつ化学ポテンシャルエネルギー(電気化学的な勾配)により輸送が駆動されるもので,このような輸送は受動輸送とよばれる.輸送基質に対する親和性は低く,その分,輸送の速度は非常に速い.これに対して,膜輸送タンパク質は,輸送基質との結合にともない構造変化を起こすことにより輸送を行うため,輸送の速度は遅い.これらのチャネルおよび膜輸送タンパク質が機能するにあたり重要な点は,1)その機能の本質である“輸送の駆動機構”,2)輸送基質の識別機構,3)輸送の制御機構,である.しかしながら,膜輸送タンパク質を含む膜タンパク質は試料の調製などの問題から立体構造の決定が困難であり,これらの理解はかぎられた状況にあった.その一方,最近になり,結晶化に適した膜タンパク質を迅速にスクリーニングする蛍光検出ゲルろ過クロマトグラフィー法(fluorescence-detection exclusion size chromatography:FESC)の技術,抗体や環状ペプチドといった“分子バインダー”を用いて動的な膜タンパク質の構造を安定化し結晶化を改善する技術,脂質中にて結晶化を行う脂質キュービック相法(lipidic cubic phase:LCP)の技術など,膜タンパク質の高分解能な構造解析のための技術が飛躍的に進歩し,さきにあげた3つの点は解明されつつある.ここでは,これら3つの点に焦点をあてながら,チャネルおよび膜輸送タンパク質の分子機構を解説する.
1.チャネルによる輸送基質の識別機構
K+チャネルは,イオン半径が1.51ÅのK+は透過させるが,1.16Åとこれよりイオン半径の小さいNa+は通さない.チャネルが単なる孔であるなら,大きいものを通すならより小さいものも通すはずである.この謎を解明したのがRoderick Mackinnonで,この功績により2003年にノーベル化学賞を受賞した.
Mackinnonは,K+チャネルKcsAの結晶構造を高分解能で決定した1).その結果,細胞の外側からの入口の付近に,ペプチド主鎖のカルボニル酸素およびThrのβ酸素が5つ縦に並び,これが四量体ごとに4回対称で整列したイオンの通り道を構成していた(図1).驚くべきことに,通常,K+は水分子が8つ配位しているのに対し,この構造ではうち4つが脱水和してさきの酸素原子により置換されていた.K+はイオン半径が十分に大きいので酸素原子による配位結合が安定に形成され,脱水和による安定化エネルギーの減少が相殺される.これに対し,Na+はイオン半径が小さく,酸素原子による安定な配位結合が形成できないため脱水和が起こらず,むしろ,半径が大きくなりこのイオンの通り道を通過できないことが示唆された.このため,このイオンの通り道はイオン選択性フィルター(ion selectivity filter)と命名された.
2.チャネルによる輸送の制御機構
Mg2+はイオン半径が0.72Åであるのに対し,水分子との親和性が高いため水和半径は5.3Åと非常に大きく,Co2+やNi2+に近い.同じアルカリ土類金属のCa2+はイオン半径が1.12Å,水和半径が2.9Åであり,水和により半径はあまり変わらない.Mg2+は酸素原子との親和性が高いため,リン酸化酵素やポリメラーゼなどのATPaseやGタンパク質などGTPaseの補酵素としてはたらく.細胞内のCa2+濃度は細胞の状態に大きな影響を及ぼすことが知られているが,最近,細胞内Mg2+濃度が異常になると,心臓病,糖尿病,高血圧など生活習慣病が惹起されることが判明し,Mg2+が細胞のホメオスタシスに重要な役割をはたしていことが明らかになってきた.また,ごく最近,Mg2+は脳における記憶の保持にも重要であることが判明した2)(新着論文レビュー でも掲載).
筆者らは,細胞の外側から内側へのMg2+の取り込みを担う新規のMg2+輸送タンパク質MgtEについて,Mg2+存在下における構造をX線結晶構造解析により2.9Å分解能で決定した3,4)(図2).その結果,MgtEの膜貫通ドメインに,生体の内外へとMg2+を透過させるための“イオン透過孔”が細胞膜を横切るかたちで存在することが明らかになった.このイオン透過孔には,輸送の途中にあると考えられるMg2+様の電子密度が観測された.しかし,Mg2+過剰条件におけるMgtEの構造では,5番目の膜貫通ヘリックスによりMg2+の透過孔がふさがれていた(図2).さらに,各ドメインの境界には多くの酸性アミノ酸残基が延びており,多くのMg2+がこれに結合して電荷を中和していることが判明した.さらに,MgtEの構造において“Mg2+センサー”として機能すると考えられる細胞質ドメインについて,Mg2+過剰条件あるいはMg2+欠乏条件それぞれにおける立体構造を決定した.その結果,Mg2+欠乏条件における細胞質ドメインの構造には,各ドメインが互いに反発して開くような大きな構造変化がみられた.細胞内Mg2+濃度に依存したこの構造変化は,コンピューターを用いた分子動力学シミュレーションによっても再現された5).この細胞質ドメインの構造変化が膜貫通ドメインの構造変化を誘起し,イオン透過孔を開閉してMg2+の透過を制御すると推測された.以上をふまえ,MgtEの細胞質ドメインが細胞内のMg2+濃度を感知することにより,Mg2+が過剰なときにはMg2+取り込みを阻害し,欠乏している場合にはMg2+取り込みを促進させるという,Mg2+バランス維持の分子機構を提唱した3)(図3).さらに,電気生理学な解析により,MgtEがMg2+に特異的なチャネルであり,細胞内のMg2+濃度に依存してイオン透過孔が開閉することを実証した4).興味深いことに,細胞質ドメインのMg2+と結合する残基に変異を導入したMgtE変異体では,高いMg2+濃度においてもイオン透過孔は開きっぱなしになっており,細胞質ドメインを欠失するとイオン透過孔の開口率はほぼ100%になったことから,MgtEの細胞質ドメインはMg2+センサーとしてはたらき,イオン透過孔の開閉を制御することにより細胞内のMg2+濃度を制御していることが実証された4).
(2013年9月27日 著者からの依頼により,1パラグラフ削除)
3.膜輸送タンパク質による能動輸送
膜輸送タンパク質は輸送基質に対し1つ以上の特異的な結合部位をもち,この結合部位が細胞膜の外側に露出したり内側に露出したりする可逆的な構造変化を起こす結果,輸送基質は細胞膜を通過する.膜輸送タンパク質ではエネルギー源と共役して輸送基質を電気化学的な勾配に逆らい能動輸送するものがほとんどである.膜輸送タンパク質は,能動輸送を駆動するエネルギー源により,以下の3つに分類される.1)共役輸送タンパク質(coupled transporter):勾配に逆らった輸送基質の輸送を,勾配にしたがった別の輸送基質の輸送と共役させる.2)ATP駆動型ポンプ(ATP-driven pump):ATPの加水分解と輸送基質の能動輸送とを共役させる.3)光駆動型ポンプ(light-driven pump):光エネルギーの受容と輸送基質の能動輸送とを共役させるもので,おもに細菌や古細菌のロドプシンファミリータンパク質がある.
共役輸送タンパク質において,2つの輸送基質の輸送の方向が同じものをシンポート,逆方向のものをアンチポートという.無機イオンが電気化学的な勾配にそって移動する際に放出される自由エネルギーを,もうひとつの輸送基質を輸送するための駆動力として用いる場合が多い.とくに,動物の細胞ではNa+の電気化学的な勾配が大きな駆動力となっている.こうして細胞内に流れ込んだNa+は,ついで,細胞膜に存在するATP駆動型ポンプであるNa+ポンプにより細胞外にくみ出される.このATP駆動型ポンプは,Na+の電気化学的な勾配を形成することにより間接的に輸送基質の輸送を駆動していることになる.このため,このとき,ATP駆動型ポンプを1次輸送タンパク質,共役輸送タンパク質を2次輸送タンパク質とよぶ.
たとえば,腸や腎臓の上皮細胞では,電気化学的な勾配にそって流入するNa+と共役して,糖やアミノ酸が細胞内に輸送される(シンポート).この場合,共役輸送タンパク質が構造変化を起こして細胞外開構造から細胞内開構造となるのは,両方の輸送基質(Na+と糖あるいはアミノ酸)と結合したときか,両方とも結合していないときのみである.一方,細菌や酵母では,能動輸送の大半はNa+ではなくH+の勾配に依存しており,動物細胞のオルガネラと似ている.これは,細胞膜にNa+ポンプがほとんどなくH+ポンプが多いからである.H+の電気化学的な勾配により駆動されるシンポートにおいて共役輸送タンパク質として古くから研究されているものに,ラクトース透過酵素LacYがある.
4.LacYによるシンポートの機構
LacYはMFS(major facilitator superfamily)という12回膜貫通タンパク質スーパーファミリーに属する.MFSはH+と輸送基質をシンポートする共役輸送タンパク質であり,1000以上のファミリーからなる膜輸送タンパク質としては最大のスーパーファミリーである.LacYについてはX線結晶構造解析により輸送基質の結合した細胞内開構造の構造が報告されており,そのシンポートの機構が明らかにされている6)(図4).LacYの12本の膜貫通へリックスは6本ずつ2つのローブを形成しており,細胞外開構造では,N末端側のローブに存在するArg144とGlu126とが静電相互作用により結合しているため,C末端側のローブのGlu269が自由になりH+と結合する.そのため,N末端側のローブの電気的に中和された基質結合ポケットに輸送基質であるラクトースが結合できるようになる.LacYが細胞内開構造に変わるとArg144はGlu269と結合するようになり,H+が外れるのと同時に膜貫通へリックスがすべるように構造変化を起こし,ラクトースとの結合部位は壊れてラクトースは細胞内へと放出される.共役輸送タンパク質が構造変化を起こすのは両方の輸送基質が結合したときか両方とも結合していないときのみであり,H+だけと結合した状態のあいだで構造変化は起こらないので,H+はラクトースとともにしか輸送されない.
5.POTによるシンポートの機構
POTもMFSに属する共役輸送タンパク質で,H+とジペプチドあるいはトリペプチドをシンポートする.ヒトでは小腸の絨毛にPepT1およびPepT2というPOTが大量に発現しており,タンパク質が消化されてできたペプチドの取り込みにはたらいている7).さらに,POTはβラクタム系の抗生物質や抗ウイルス剤などの薬剤の取り込みにもはたらいており,医薬の分野においても重要である8).
筆者らは,脂質キュービック相法を用いた結晶化により,POT単独,および,POTと輸送基質であるジペプチドアナログとの複合体の結晶構造を1.9~2.5Å分解能という高分解能で明らかにした9)(図5).この構造は細胞内開構造であり,POTのArg43とプロトン化されたGlu310(プロトン化されたときのみ,電気的な反発なく水素結合できる)が輸送基質であるジペプチドのカルボキシル基を水素結合により認識していることがわかった(図5).さらに,コンピューターを用いた分子動力学シミュレーションによる解析から,Glu310が脱プロトン化すると電気的な反発によりジペプチドを結合できなくなり,一方,Arg43とGlu310とが静電相互作用で引き合って細胞内開構造から細胞内閉構造へと変化することが明らかになった.これは,細胞内開構造において輸送基質であるジペプチドを解離し細胞内閉構造へと変化する生理的な過程に相当する.また,コンピューターシミュレーションにより,H+とジペプチドとが結合したとき,あるいは,何も結合していないときのみ構造変化が起こり,H+のみの結合した状態では構造変化は起こらないという,シンポートの主要な分子機構の構造基盤を解明することができた9).すなわち,基質ポケットの表面の電荷状態がGlu310のプロトン化により中和されることにより輸送基質であるジペプチドが結合し,H+の輸送とともにジペプチドも解離してシンポートの起こることが明らかになった.
6.MATEによるアンチポートの機構
MATE(multidrug and toxic compound extrusion)は多剤排出輸送タンパク質であり,Na+あるいはH+のインポートと共役することにより,異物やさまざまな薬剤をアンチポートにより細胞の外へと排出する10).ヒトのMATEは腎臓や肝臓において多く発現しており,細胞からの異物の排出に重要な役割をはたしている11).しかし,病原性細菌やがん細胞においてMATEが大量に発現すると,抗生物質や抗がん剤の効かない多剤耐性菌や抗がん剤耐性がん細胞が出現することになるため,MATEの阻害剤の開発は医薬の分野において急務となっていた12).
筆者らは,H+により駆動される古細菌のMATEの結晶構造を,単独,および,抗生物質あるいは阻害ペプチドとの複合体のかたちで2.1~3.0Å分解能という高分解能で決定した13)(新着論文レビュー でも掲載).MATEはMFSとよく似ており,12本の膜貫通へリックスが6本ずつ2つのヘリックスバンドルドメインを形成していて,細胞外開構造をとっていた(図6).MATEは単独でも,結晶化されたときのpHにより2つの構造をとることがわかった.中性の付近ではヘリックス1がまっすぐ伸びたかたちをとり,ストレート構造と命名された.しかし,酸性条件ではヘリックス1は真ん中のPro26において折れ曲がり,大きく曲がったベント構造をとった.このベント構造では,ヘリックス1により基質結合ポケットがふさがれ,輸送基質となる薬剤は結合できないことがわかった.さらに,基質結合ポケットのあるN末端ドメインのさきにはAsp41やAsp184などの酸性アミノ酸残基あるいは親水性アミノ酸残基があり,ストレート構造においてこれらはゆるく結合していたが,酸性条件ではAsp41がプロトン化することによりAsp184などと強固な水素結合ネットワークを形成し,ヘリックス1を引っ張り込むことによりベント構造になり輸送基質が排出されることが明らかになった.以上のことから,H+と共役した薬剤の排出機構が明らかになった13)(図7,動画のURLは,http://www.nature.com/nature/journal/v496/n7444/fig_tab/nature12014_SV1.html).さらに,このMATEと強固に結合する環状ペプチドをスクリーニングしたところ,そのひとつは薬剤結合ポケットを占拠し(図6),強い阻害活性をもつことがわかり,これまで薬剤を排出してしまうため阻害剤をデザインすることが不可能であったMATEに対し,阻害剤の開発する道を開くことになった13).
7.CAXによるCa2+とH+のアンチポートの機構
真核生物の細胞は1 mMほどの高いCa2+濃度の環境にさらされながら,細胞質における遊離のCa2+濃度を0.1μM程度にまで下げることにより,Ca2+の流入による細胞内シグナル伝達(たとえば,筋肉の収縮)を達成している.したがって,細胞内のCa2+濃度を低く保つ輸送タンパク質は生命の維持にとりきわめて重要である.Ca2+を細胞外に排出するおもな輸送タンパク質には,後述するP型Ca2+ポンプと,Ca2+/陽イオン交換輸送タンパク質とがある14).Ca2+/陽イオン交換輸送タンパク質の機能不全はヒトにおいて高血圧を惹起することが知られている.
筆者らは,H+/Ca2+交換輸送タンパク質CAXの結晶構造を2.3Å分解能で決定した.その結果,CAXはコアドメインとゲーティングバンドルから構成されることが明らかになった15)(新着論文レビュー でも掲載)(図8).すでに報告されていたNa+/Ca2+交換輸送タンパク質の構造が細胞外開構造であったのに対し16),CAXの構造は細胞内開構造であった.2つの構造の比較から,Ca2+/陽イオン交換輸送タンパク質はゲーティングバンドルがコアドメインの表面にある疎水性パッチのうえを滑ることによりゲーティングへリックスが回転し,そのうえに存在する親水性クラスターが細胞の外側の透過孔を向いたり,細胞内の透過孔を向いたりことをくり返すことにより,細胞外開構造と細胞内開構造とのあいだを切り替わることが明らかになった15)(図8).また,この構造では,3つのグルタミン酸残基Glu78,Glu255,Glu258が互いにあるいはグルタミン残基と水素結合を形成していたことからプロトン化した状態であり,陽イオン結合ポケットに3つのH+が結合したH+結合型であると考えられた(図9).一方,Ca2+結合型のNa+/Ca2+交換輸送タンパク質の構造と比較することにより,さきのプロトン化していた3つのGluのうちGlu78とGlu258が向きを変えてCa2+と結合することが判明し(図9),H+とCa2+は同時には結合できないこともわかった.さらに,陽イオン結合ポケットにH+やCa2+が結合することにより,はじめてコアドメインに疎水性パッチが形成され,ゲーティングバンドルはこのうえを滑ることのできるようになることが明らかになり,陽イオンに依存的な構造変化の機構が解明された15)(動画のURLは,http://www.sciencemag.org/content/suppl/2013/05/23/science.1239002.DC1/1239002s1.mov).
以上,MATEおよびCAXの構造機能解析の結果,2つの輸送基質のうちどちらか一方が結合したときのみ,細胞外開構造と細胞内開構造とのあいだの構造変化が誘起され,輸送基質が輸送されるという,アンチポートの主要な分子機構の構造基盤が明らかになった(図10).
[hs_figure id=10&image=/wordpress/wp-content/uploads/2013/09/Nureki-2.e009-Fig.10.png&caption=fig10-caption-text]
8.ATP駆動型ポンプ
ATP駆動型ポンプはATPのADPとリン酸への加水分解により生じるエネルギーを利用するため,輸送性ATPaseともよばれる.ATP駆動型ポンプにはつぎの3つの型がある.
1)P型ポンプ(P-type ATPase):輸送サイクルのあいだに輸送タンパク質自体がリン酸化されるのでP型とよばれる.細胞膜をはさんでNa+,K+,H+,Ca2+などさまざまな陽イオンの勾配を形成するイオンポンプが含まれる.
2)F型ポンプ(F-type ATPase):多くのサブユニットから構成されるタービンのようなかたちをしたポンプである.F型ポンプにはF型ATPaseとV型ATPaseとがある.細菌の細胞膜,ミトコンドリアの内膜,葉緑体のチラコイド膜にみられる.F型ATPaseの多くは膜をはさんだH+の濃度勾配によりADPとリン酸からATPを合成するが,その逆反応も触媒するためATP合成酵素ともよばれる.このH+の濃度勾配は,好気性細菌やミトコンドリアでは酸化的リン酸化にともなう電子伝達により,葉緑体では光合成により,好塩菌ではバクテリオロドプシンのような光駆動型H+ポンプにより,形成される.一方,リソソーム,シナプス小胞,植物の液胞などのオルガネラには,ATPを合成せずもっぱらH+ポンプとしてオルガネラのpHを低く保つためにはたらくV型ATPaseがある.これまでのところ,F型ATPaseに関しては細胞質ドメインであるαβサブユニットのほかには,膜貫通ドメインであるcサブユニットのリング構造が報告されているのに対し17),V型ATPaseに関してはモータードメインの構造が報告されている18)(新着論文レビュー でも掲載).
3)ABC輸送タンパク質(ABC transporter):イオンだけを輸送するP型ポンプあるいはF型ポンプとは異なり,ATPの加水分解のエネルギーを輸送タンパク質の構造変化と共役させることにより,細胞膜を横切って小分子を輸送する.細胞質側にATPと結合するABC(ATP-binding cassette,ATP結合カセット)ドメインをもつためこの名がある.このABCドメインは二量体を形成してATPと結合しているが,ATPを加水分解すると二量体構造がゆるんでゲートが開くため,輸送が行われる.数多くの結晶構造が報告されているが,最近では,ビタミンB12輸送タンパク質の構造が報告されている19).
9.P型Ca2+ポンプによるCa2+の輸送機構
さきに述べたように,真核生物の細胞の内外のCa2+濃度勾配はCa2+を細胞の外へと能動輸送するCa2+ポンプと2次輸送タンパク質により維持されていて,そのCa2+ポンプのひとつはP型Ca2+-ATPaseであり,もうひとつはNa+の電気化学的な勾配が駆動するNa+-Ca2+交換輸送タンパク質(Na+-Ca2+ exchanger)である.P型ATPaseのうちもっとも研究が進んでいるのは,骨格筋細胞の筋小胞体膜に存在するCa2+-ATPaseであるSRCA1である.筋小胞体はCa2+の貯蔵庫であり,活動電位により筋細胞膜が脱分極するとCa2+が筋小胞体からCa2+チャネルを通って細胞質へと放出され,筋肉を収縮させる.Ca2+ポンプは筋小胞体の膜タンパク質の約90%をしめ,細胞質から筋小胞体へとCa2+を能動輸送する.
さまざまな輸送の状態におけるSRCA1の構造は,豊島 近およびPoul Nissenらにより解明された20-27).P型ATPaseは10本の膜貫通へリックスをもち,そのうち3本は脂質二重膜を貫く中央のチャネルの壁を形成している(図11).細胞質ドメインはATP結合ドメイン,リン酸化ドメイン,作動性ドメインの3つのドメインからなり,ATPが加水分解されると同時に,リン酸化ドメインのAsp351がリン酸化される.Ca2+ポンプからリン酸基が外れると,2本の膜貫通へリックスの構造がゆるんで筋細胞膜の細胞質側にむかい空洞が生じ,そこに2つのCa2+が結合する.さらに,細胞質側のATP結合ドメインにATPが結合し,これが加水分解して生じたリン酸基がAsp351に結合(リン酸化)すると,このリン酸基と作動性ドメインとが静電的に相互作用するため,これに引っ張られて3本の膜貫通ドメインの配向が変わり,Ca2+結合部位は崩壊して筋小胞体の内腔側にむかい開口し,Ca2+は小胞体の内腔へと放出される.
[hs_figure id=11&image=/wordpress/wp-content/uploads/2013/09/Nureki-2.e009-Fig.11.png&caption=fig11-caption-text]
10.光駆動性イオンチャネルの分子機構
さきに,能動輸送を行う膜輸送タンパク質の3つ目は光駆動型ポンプであると述べた.これらはおもに原核生物のロドプシンファミリータンパク質である.ところが,真核生物のロドプシンファミリータンパク質は,ポンプではなく,ロドプシンのようなGタンパク質共役受容体であったり,以下に述べるようなチャネルであったりする.近年,脳神経科学の分野において,チャネルロドプシンとよばれる光駆動型の陽イオンチャネルを利用したニューロンの選択的な活性化の技術が脚光をあびている.チャネルロドプシンは青色光を受容するとイオン透過孔が開きNa+やCa2+といった陽イオンを透過するため28),チャネルロドプシンを強制発現させたニューロンに青色光を照射することにより,そのニューロンのみを選択的に活性化させることが可能になる.最近,極細の光ファイバーを脳に挿入することにより,マウスのような高等動物でもin vivoにおいて特定のニューロンを活性化させ,そのニューロンあるいは神経回路が行動にあたえる影響を解析することができるようになった29).
筆者らは,世界にさきがけ,脂質キュービック相法を用いてチャネルロドプシンの結晶化に成功し,その結晶構造を2.3Å分解能で決定した30)(新着論文レビュー でも掲載)(図12).チャネルロドプシンは二量体を形成しており,それぞれのサブユニットあたり負の電荷表面をもつ孔をもっていた.実際に,この孔の内部の親水性アミノ酸残基に変異を導入し,電気生理学な解析により光電流を測定することにより,この孔がイオン透過孔であることが判明した.このイオン透過孔は,光を受容するレチナール(通常は全trans型であるが,光を受容すると13-cis型となる)がシッフ塩基によりLys296に共有結合している近傍に存在した.しかし,このイオン透過光はその細胞質側が2つのゲートによりふさがれていた.すなわち,この構造は閉構造(基底状態)の構造であった.これらのゲートは,Glu122とGlu129がそれぞれHis173,Asn297と水素結合することによりイオン透過孔をふさいでいた.これら2つのGluをAlaに置換しても光電流に変化はなかったのに対し,つねにプロトン化したGluを模倣するGlnに置換すると光電流は大きく減退したことから,これらのGluのプロトン化および脱プロトン化がチャネルの開閉に重要であることが示唆された.さらに,Glu122およびGlu129を脱プロトン化状態にし,レチナールを13-cis型にして分子動力学シミュレーションを行うことにより,光照射によりチャネルが閉構造から開構造に変化する機構を解明することに成功した.今後,この構造にもとづいてより有用なチャネルロドプシン変異体をデザインすることにより,神経生物学や神経病理学の分野に大きく貢献することが期待される.
[hs_figure id=12&image=/wordpress/wp-content/uploads/2013/09/Nureki-2.e009-Fig.12.png&caption=fig12-caption-text]
11.Secトランスロコン複合体によるタンパク質の膜透過
これまで,イオンや糖,ペプチドといった小分子の膜輸送の分子機構について述べてきた.しかしながら,水1分子も透過することのできない脂質二重膜を,タンパク質のような巨大な分子も透過することができる.これにはたらく輸送タンパク質がSecトランスロコン複合体である.実際に,リボソームで合成されたタンパク質の約30%は,ATPaseモーターであるSecAにより駆動され,Sec膜透過タンパク質を介して,ほどかれた状態で細胞膜を透過し,あるいは,膜タンパク質は細胞膜に埋め込まれる.
筆者らは,タンパク質の膜透過チャネルである10回膜貫通タンパク質SecYE複合体の結晶構造を,特異的な抗体との複合体のかたちで3.2Å分解能で決定した31)(図13).SecYE複合体は真核生物ではSec61複合体として保存されている.これまで報告されていた古細菌のSecYEβ複合体が閉構造であったのに対し32),この構造は膜貫通へリックスが互いに開いて疎水性のへこみを形成した開構造であった.この疎水性のへこみには輸送されるタンパク質のN末端のシグナル配列が結合し,タンパク質の輸送が誘起されることが示唆された.システイン架橋法を用いた生物化学的な解析と結晶構造解析,分子動力学シミュレーションにより,抗体が結合しない状態ではSecYE複合体は閉構造をとっており,SecA(あるいは,これを模倣した抗体)が結合すると閉構造から開構造へと構造変化することが明らかにされた.さらに,SecAとSecYE複合体とをシステイン架橋法を用いて解析した結果,SecAもSecYE複合体と結合すると開構造となり,ATPase活性の亢進することが明らかにされた.すなわち,SecAもSecYE複合体も単独では閉構造をとっているが,互いに複合体を形成することにより開構造へと変化し,タンパク質の膜透過をひき起こすことが明らかになった.SecAとSecYEGの複合体の低分解能結晶構造も33),このことを支持していた.
[hs_figure id=13&image=/wordpress/wp-content/uploads/2013/09/Nureki-2.e009-Fig.13.png&caption=fig13-caption-text]
さらに最近,SecYE複合体と協働する12回膜貫通タンパク質SecDF複合体についても,結晶構造を3.3Å分解能で解明した34)(新着論文レビュー でも掲載)(図14).生化学的な解析によりSecDF複合体は,SecAが変性したタンパク質をSecYE複合体に押し込んだのち,タンパク質の膜透過における後期の過程を,H+の濃度勾配のエネルギーを用いて促進する機能をもつことが明らかにされた34).さらに,システイン架橋法を用いた解析により,SecDFのペリプラズムドメイン1が2つの構造をダイナミックに往復することにより,細胞の外へと輸送されてきたタンパク質をSecYE複合体から引っ張りだし巻きもどすことを明らかにした34).さらに,電気生理学的な解析と蛍光分光解析により,SecDF複合体はH+を輸送する新規のH+チャネルであり,これを駆動力としてペリプラズムドメイン1が構造変化をくり返すことにより,タンパク質の膜輸送を促進する膜シャペロンとしてはたらくことを実証し,さらに,H+の輸送にはたらく荷電アミノ酸残基を同定することにも成功した34).
[hs_figure id=14&image=/wordpress/wp-content/uploads/2013/09/Nureki-2.e009-Fig.14.png&caption=fig14-caption-text]
おわりに
これまで述べてきた膜輸送タンパク質の構造生物学な研究から,膜輸送タンパク質は独自の基質結合ポケットにより輸送基質を認識し,輸送基質それ自体のもつ化学ポテンシャルエネルギー,あるいは,ほかのイオンの濃度勾配やATPの加水分解のエネルギーを用いて,輸送を駆動していることが明らかになった.とくに,イオンの結合やリン酸化などにより透過孔の内部の電荷状態が変化することで,輸送基質との結合や解離,構造変化が誘起されることにより,輸送が駆動されるという分子機構が解明された.さらに,膜輸送タンパク質の多くは,細胞内ドメインがセンサーとしてはたらき輸送基質と相互作用することでこの情報を膜貫通ドメインへと伝達し透過孔を開閉するゲーティング機構をもちあわせることにより,輸送を制御するという分子機構が解明されつつある.
文 献
- Zhou, Y., Morais-Cabral, J. H., Kaufman, A. et al.: Chemistry of ion coordination and hydration revealed by a K+ channel-Fab complex at 2.0Å resolution. Nature, 414, 43-48 (2001)[PubMed]
- Miyashita, T., Oda, Y., Horiuchi, J. et al.: Mg2+ block of Drosophila NMDA receptors is required for long-term memory formation and CREB-dependent gene expression. Neuron, 74, 887-898 (2012)[PubMed] [新着論文レビュー]
- Hattori, M., Tanaka, Y., Fukai, S. et al.: Crystal structure of the MgtE Mg2+ transporter. Nature, 448, 1072-1075 (2007)[PubMed]
- Hattori, M., Iwase, N., Furuya, N. et al.: Mg2+-dependent gating of bacterial MgtE channel underlies Mg2+ homeostasis. EMBO J., 28, 3602-3612 (2009)[PubMed]
- Ishitani, R., Sugita, Y., Dohmae, N. et al.: Mg2+-sensing mechanism of Mg2+ transporter MgtE probed by molecular dynamics study. Proc. Natl. Acad. Sci. USA, 105, 15393-15398 (2008)[PubMed]
- Abramson, J., Smirnova, I., Kasho, V. et al.: Structure and mechanism of the lactose permease of Escherichia coli. Science, 301, 601-605 (2003)[PubMed]
- Fei, Y. J., Kanai, Y., Nussberger, S. et al.: Expression cloning of a mammalian proton-coupled oligopeptide transporter. Nature, 368, 563-566 (1994)[PubMed]
- Smith, D. E., Clemencon, B. & Hediger, M. A.: Proton-coupled oligopeptide transporter family SLC15: physiological, pharmacological and pathological implications. Mol. Aspects Med., 34, 323-336 (2013)[PubMed]
- Doki, S., Kato, H. E., Solcan, N. et al.: Structural basis for dynamic mechanism of proton-coupled symport by the peptide transporter POT. Proc. Natl. Acad. Sci. USA, 110, 11343-11348 (2013)[PubMed]
- Brown, M. H., Paulsen, I. T. & Skurray, R. A.: The multidrug efflux protein NorM is a prototype of a new family of transporters. Mol. Microbiol., 31, 394-395 (1999)[PubMed]
- Damme, K., Nies, A. T., Schaeffeler, E. et al.: Mammalian MATE (SLC47A) transport proteins: impact on efflux of endogenous substrates and xenobiotics. Drug Metab. Rev., 43, 499-523 (2011)[PubMed]
- Kaatz, G. W., McAleese, F. & Seo, S. M.: Multidrug resistance in Staphylococcus aureus due to overexpression of a novel multidrug and toxin extrusion (MATE) transport protein. Antimicrob. Agents Chemother., 49, 1857-1864 (2005)[PubMed]
- Tanaka, Y., Hipolito, C. J., Maturana, A. D. et al.: Structural basis for the drug extrusion mechanism by a MATE multidrug transporter. Nature, 496, 247-251 (2013)[PubMed] [新着論文レビュー]
- Cai, X. & Lytton, J.: The cation/Ca2+ exchanger superfamily: phylogenetic analysis and structural implications. Mol. Biol. Evol., 21, 1692-1703 (2004)[PubMed]
- Nishizawa, T., Kita, S., Maturana, A. D. et al.: Structural basis for the counter-transport mechanism of a H+/Ca2+ exchanger. Science, 341, 168-172 (2013)[PubMed] [新着論文レビュー]
- Liao, J., Li, H., Zeng, W. et al.: Structural insight into the ion-exchange mechanism of the sodium/calcium exchanger. Science, 335, 686-690 (2012)[PubMed]
- Pogoryelov, D., Yildiz, O., Faraldo-Gomez J. D. et al.: High-resolution structure of the rotor ring of a proton-dependent ATP synthase. Nat. Struct. Mol. Biol., 16, 1068-1073 (2009)[PubMed]
- Arai, S., Saijo, S., Suzuki, K. et al.: Rotation mechanism of Enterococcus hirae V1-ATPase based on asymmetric crystal structures. Nature, 493, 703-707 (2013)[PubMed] [新着論文レビュー]
- Korkhov, V. M., Mireku, S. A. & Locher, K. P.: Structure of AMP-PNP-bound vitamin B12 transporter BtuCD-F. Nature, 490, 367-372 (2012)[PubMed]
- Toyoshima, C. & Nomura, H.: Structural changes in the calcium pump accompanying the dissociation of calcium. Nature, 418, 605-611 (2002)[PubMed]
- Toyoshima, C. & Mizutani, T.: Crystal structure of the calcium pump with a bound ATP analogue. Nature, 430, 529-535 (2004)[PubMed]
- Toyoshima, C., Nomura, H. & Tsuda, T.: Lumenal gating mechanism revealed in calcium pump crystal structures with phosphate analogues. Nature, 432, 361-368 (2004)[PubMed]
- Shinoda, T., Ogawa, H., Cornelius, F. et al.: Crystal structure of the sodium-potassium pump at 2.4Å resolution. Nature, 459, 446-450 (2009)[PubMed]
- Toyoshima, C., Iwasawa, S., Ogawa, H. et al.: Crystal structures of the calcium pump and sarcolipin in the Mg2+-bound E1 state. Nature, 495, 260-264 (2013)[PubMed]
- Sorensen, T. L., Moller, J. V. & Nissen, P.: Phosphoryl transfer and calcium ion occlusion in the calcium pump. Science, 304, 1672-1675 (2004)[PubMed]
- Olesen, C., Sorensen, T. L., Nielsen, R. C. et al.: Dephosphorylation of the calcium pump coupled to counterion occlusion. Science, 306, 2251-2255 (2004)[PubMed]
- Olesen, C., Picard, M., Winther, A. M. et al.: The structural basis of calcium transport by the calcium pump. Nature, 450, 1036-1042 (2007)[PubMed]
- Nagel, G., Ollig, D., Fuhrmann, M. et al.: Channelrhodopsin-1: a light-gated proton channel in green algae. Science, 296, 2395-2398 (2002)[PubMed]
- Adamantidis, A. R., Zhang, F., Aravanis, A. M. et al.: Neural substrates of awakening probed with optogenetic control of hypocretin neurons. Nature, 450, 420-424 (2007)[PubMed]
- Kato, H. E., Zhang, F., Yizhar, O. et al.: Crystal structure of the channelrhodopsin light-gated cation channel. Nature, 482, 369-374 (2012)[PubMed] [新着論文レビュー]
- Tsukazaki, T., Mori, H., Fukai, S. et al.: Conformational transition of Sec machinery inferred from bacterial SecYE structures. Nature, 455, 988-991 (2008)[PubMed]
- Van den Berg, B., Clemons, W. M. Jr., Collinson, I. et al.: X-ray structure of a protein-conducting channel. Nature, 427, 36-44 (2004)[PubMed]
- Zimmer, J., Nam, Y. & Rapoport, T. A.: Structure of a complex of the ATPase SecA and the protein-translocation channel. Nature, 455, 936-943 (2008)[PubMed]
- Tsukazaki, T., Mori, H., Echizen, Y. et al.: Structure and function of a membrane component SecDF that enhances protein export. Nature, 474, 235-238 (2011)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:東京大学大学院理学系研究科 教授.
研究テーマ:遺伝暗号の翻訳,膜輸送および受容,慢性炎症の分子機構.
抱負:細胞のさまざまな生理機構を原子分解能で解明し,医薬の分野に応用したい.
研究室URL:http://www.nurekilab.net/
© 2013 濡木 理 Licensed under CC 表示 2.1 日本