代謝プログラムによる幹細胞の機能の制御
2013/11/11
田久保 圭誉
(慶應義塾大学医学部 坂口講座テニュアトラック・プログラム)
email:田久保圭誉
領域融合レビュー, 2, e012 (2013) DOI: 10.7875/leading.author.2.e012
Keiyo Takubo: Regulation of stem cells by metabolic programs.

自己複製能と多分化能をもつ幹細胞は,幹細胞としての性質を保つために固有の転写因子のセットにもとづく転写制御ネットワークを維持している.そして,こうした転写制御ネットワークの下流では,さまざまな幹細胞に固有の細胞生物学的な現象を実行するために代謝プログラムを起動し,必要に応じエネルギー通貨であるATPや代謝産物を産生している.近年,ニッチにある各種の臓器幹細胞や,ES細胞あるいはiPS細胞といった多能性幹細胞では,分化した細胞とは異なる代謝プログラムを保持していることが見い出された.そして,代謝プログラムそれ自体が幹細胞の未分化性の維持や自己複製能,静止状態の維持などに寄与していることが明らかになってきた.幹細胞における代謝プログラムの理解は,幹細胞の増幅や分化した細胞の産生といった再生医療にも役だつ技術の開発,また,がん幹細胞を標的とする治療戦略の策定にも寄与しうることから,代謝の視座から幹細胞システムを理解する重要性は増している.
組織幹細胞は自己複製能と多分化能をもつ細胞の集団であり,組織の発生や恒常性の維持の要として機能する.幹細胞性を規定する転写因子や,幹細胞を維持する微小環境である“ニッチ”からのシグナルは,自己複製,非対称な分裂,静止状態の維持,分化,遊走,ニッチへのホーミングなど,幹細胞に特有の生物現象を実行するためのエネルギーをもたらす代謝プログラムを起動すると考えられている.近年,造血幹細胞をはじめとする各種の幹細胞システムの解析から,これまで不明であった幹細胞に特有の代謝特性とその分子機構が見い出された.その結果,幹細胞における代謝プログラムは恒常性の維持や老化からの防御に不可欠な役割をはたしていることが明らかになりつつある.一方で,幹細胞のなかでも,多能性をもち培養により維持される多能性幹細胞においても,幹細胞性の維持やリプログラミングによる多能性の獲得の過程において,代謝の制御が重要な役割をはたすことが明らかになっている.
ここでは,ES細胞(embryonic stem cell,胚性幹細胞)やiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)といった多能性幹細胞,および,哺乳類の骨髄ニッチに存在する造血幹細胞を中心として,幹細胞性の維持,増殖,分化,そして,リプログラミングの過程における代謝プログラムとその制御機構について解説する.
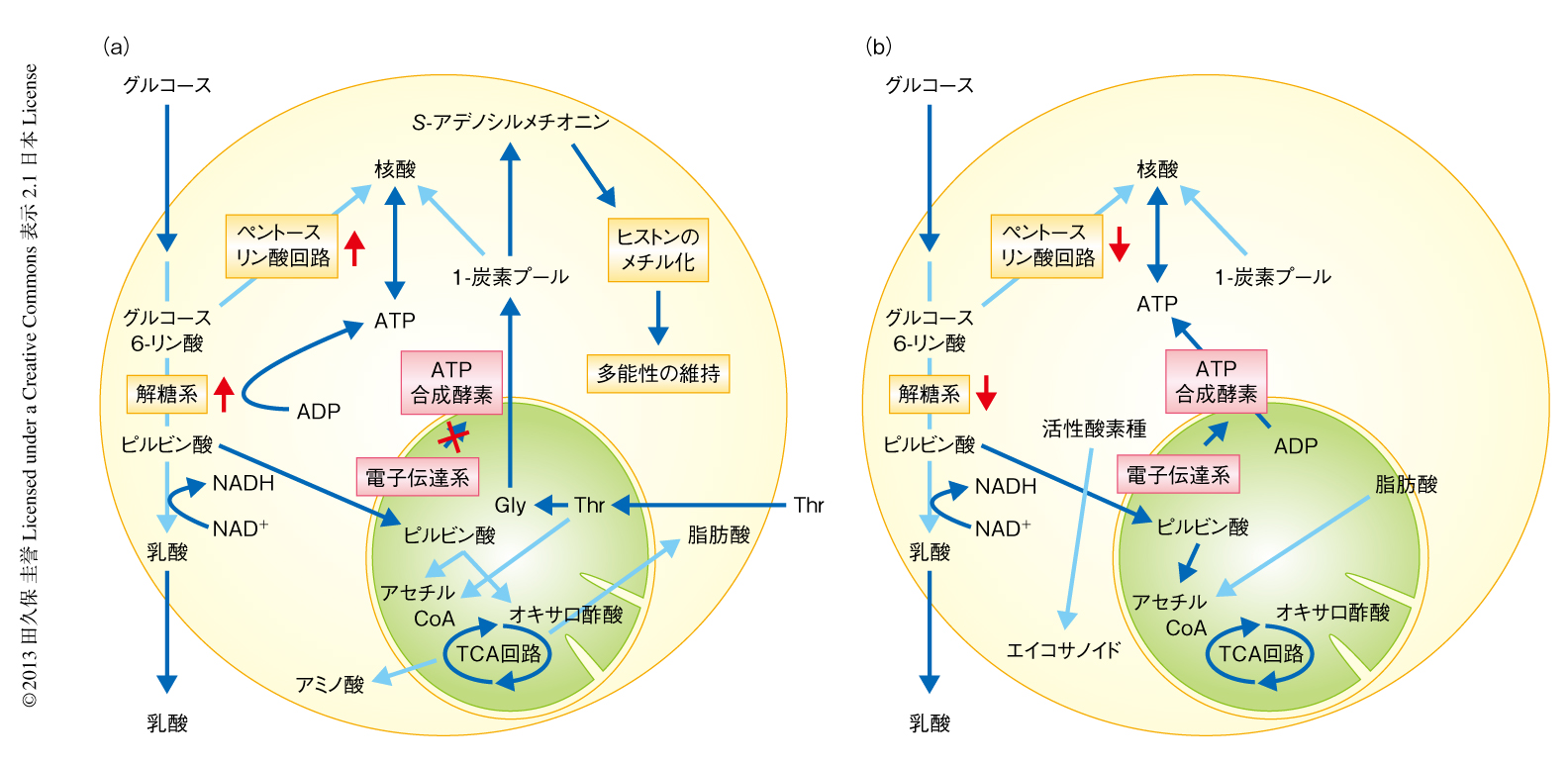
初期胚の胚盤胞にある内部細胞塊では,細胞内へグルコースを輸送するGlut1やGlut3の発現が高くグルコースの取り込み能が高い.その結果,解糖系の代謝流束が高く,乳酸の産生能も高いことが知られている1,2)(図1a).こうした解糖系に依存した代謝特性が胚盤胞において重要であることは,各種の解糖系の酵素を欠損すると着床前致死となることからも支持される3-6).胚盤胞では解糖系だけでなくミトコンドリアにおける酸化的リン酸化の活性も高まり酸素の消費も高くなることが知られているが7),これは,むしろ栄養外胚葉のミトコンドリアが高い膜電位を保つことによるものであり,内部細胞塊のミトコンドリアは膜電位の低い状態を保っている8).
胚盤胞から得られ培養により維持される多能性幹細胞であるES細胞も,同様に解糖系に大きく依存した代謝特性を示す9-14).また,分化した細胞からiPS細胞へのリプログラミングの過程においても,酸化的リン酸化への依存から解糖系を中心とした代謝への再移行が認められ,iPS細胞が樹立されたのちはES細胞と同様に解糖系への依存性を示す.したがって,多能性を獲得するリプログラミングの過程においては,代謝特性についてもリプログラミングが起こっている.このとき,解糖系の再活性化は多能性マーカーの誘導にさきだって起こることが知られており15),リプログラミングの効率を上げることの知られている細胞の増殖亢進が分化した細胞に誘導された結果,代謝は細胞の増殖に適した解糖系にリプログラミングされていると考えられる.このとき,解糖系の阻害や酸化的リン酸化の活性化はiPS細胞へのリプログラミングを抑制することから,代謝動態の変化も多能性の獲得の促進に貢献すると考えられている16,17).また,解糖系の副経路であるペントースリン酸経路はマウスのES細胞において活性化しており,この経路から活発な細胞の増殖のため必要な核酸が供給されていると考えられる12,18,19).
このように,ES細胞では酸化的リン酸化の活性は低く,ATPの産生は解糖系に依存している.すなわち,解糖系はミトコンドリアにおける代謝に比べ相対的に活性化していると考えられる.こうした状況において,ミトコンドリアにおける酸素の消費もまた重要な役割をはたしている.具体的には,電子伝達系においてNADHをNAD+へと酸化してTCA回路の代謝流束を維持することにより,ES細胞は細胞における酸化還元の状態を適切に保ち,クエン酸からの脂質の合成や,オキサロ酢酸やαケトグルタル酸からのアミノ酸の合成を進めていると考えられる20)(図1a).実際に,ES細胞の集団全体としては低いミトコンドリア膜電位を示すが,そのなかで,相対的に高いミトコンドリア膜電位を示す分画と低いミトコンドリア膜電位を示す分画とを取り分けてテラトーマの形成能を比較すると,相対的に高いミトコンドリア膜電位を示す分画のES細胞のほうがより効率的にテラトーマを形成することが知られている21).さらに,ミトコンドリアにおいてピルビン酸からアセチルCoAを産生するピルビン酸脱水素酵素複合体を失った胚盤胞は発生に異常を呈することからも22,23),解糖系と同様に,ミトコンドリアにおいて代謝プログラムが適切に維持されることは多能性幹細胞の維持に不可欠であることがわかる.
一方で,マウスのES細胞は多能性を担保するエピゲノムの状態を維持するため,培地からのスレオニンの取り込みをとくに必要としている.これは,ほかの線維芽細胞や細胞株にはみられない特徴である24).さらに,取り込まれたスレオニンをグリシンとアセチルCoAへ異化するときの律速酵素であるスレオニン水酸化酵素は,初期の胚盤胞,ES細胞,iPS細胞において発現の上昇していることが知られている.このスレオニン水酸化酵素が介する反応により得られたグリシンは,ミトコンドリアにおいてグリシンの開裂にはたらくグリシン脱炭酸酵素により,細胞において葉酸に依存性の1-炭素プールを維持するために用いられる(図1a).グリシン脱炭酸酵素はスレオニン水酸化酵素と同様に多能性幹細胞において高く発現している25).スレオニン水酸化酵素の阻害や発現の抑制によりマウスES細胞の増殖は抑制されることから,スレオニンに由来する代謝産物は多能性幹細胞の維持に必要であると考えられる.スレオニン水酸化酵素とグリシン脱炭酸酵素は5-メチルテトラヒドロ葉酸の産生を誘導し,5-メチルテトラヒドロ葉酸-ホモシステインメチルトランスフェラーゼを介したホモシステインからのメチオニンの再生を促進する.その結果,ヒストンH3の4番目のリジン残基のトリメチル化においてメチル基を供与する,S-アデノシルメチオニンの産生が誘導される25).ヒストンH3の4番目のリジン残基のトリメチル化は,多能性維持と自己複製能を担保するユークロマチンの開いた構造の維持のため必要である.さらに,スレオニン水酸化酵素を介した葉酸に依存性の1-炭素プールは核酸の合成を促進するため24),これも増殖の速い多能性幹細胞を維持するために都合がよいと考えられる.
一方で,ES細胞が分化していくときには解糖系の代謝流束が低下し,スレオニンを好んで取り込みグリシンを産生するという代謝特性も失われる.代わりに,ミトコンドリアにおける酸化的リン酸化がグルコースや脂肪酸に由来する代謝産物により駆動されるようになる9,24,26,27)(図1b).その結果,活性酸素種の産生が増加し細胞の酸化還元の環境はより酸化状態へとかたむく.もともと,ES細胞には酸化されやすい炭素二重結合を含む不飽和脂肪酸が多く存在する.そのため,細胞において活性酸素種が産生されるようになると,これらが酸化されエイコサノイドを供給するようになる.エイコサノイド合成経路の阻害剤をくわえることによりES細胞の多能性の維持は促進されることが知られていることから28),代謝特性の変化により産生されるエイコサノイドはES細胞の未分化性を失わせ,分化へとむかわせると考えられる.このように,分化した細胞と多能性幹細胞とは代謝特性が異なるため,これをうまく利用することにより分化した細胞を効率的に産生することが可能になる.その一例が,代謝特性を利用した多能性幹細胞から心筋細胞の誘導系である.胎生期の心筋前駆細胞は乳酸を取り込んで酸化的リン酸化経路を活性化することが知られている29).ヒトのES細胞やiPS細胞から心筋細胞を分化させるときに培地のグルコースを除き乳酸をくわえておくと,胚葉体から多能性幹細胞を含まない純度の高い機能的な心筋細胞を得ることができる30).つまり,幹細胞と分化した細胞の代謝特性の理解は,幹細胞および分化した細胞それぞれに新しい操作技術をもたらす可能性がある.
つねに増殖しているES細胞とは異なり,生体の多くの幹細胞は静止状態にある.具体的には,骨髄の造血幹細胞や間葉系幹細胞,脳の神経幹細胞,毛包バルジ領域の表皮幹細胞や筋肉の衛星細胞が,こうした静止状態の幹細胞のカテゴリーに含まれる.一般的に,この種の幹細胞は活性酸素種による細胞傷害からのがれ老化することなく生涯にわたる自己複製能を保持するため,細胞周期が静止期にあると考えられている31).
造血系において,胎生期や生後すぐの骨髄では造血幹細胞は活発に増殖している.対照的に,成体では造血幹細胞は骨髄ニッチにより細胞周期が静止期に維持されており,その分裂の頻度はマウスでは145日に1回と計算され生涯に5回程度しか分裂しないと見積もられている32).造血幹細胞は感染や出血など各種の造血ストレスが負荷されたときには活発に増殖するが,ひとたび増殖をはじめた造血幹細胞も,ふたたび静止状態にもどることのできることが知られている32).しかし,造血幹細胞や造血前駆細胞における時期や状況に応じた代謝の制御機構は不明であった.
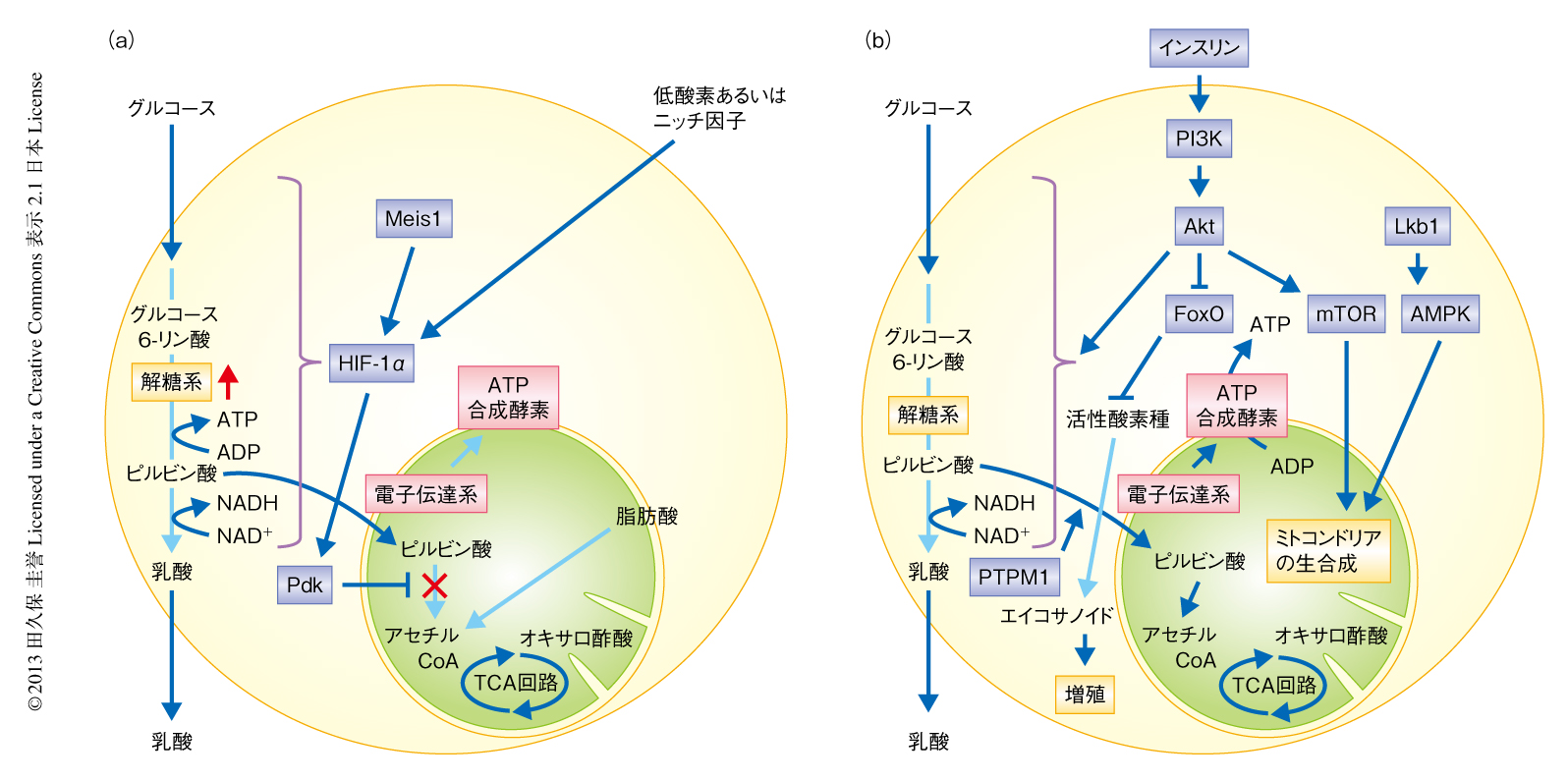
正常の造血幹細胞と造血前駆細胞の代謝プロファイルを検討するため,マウスから大量の造血幹細胞,造血前駆細胞,分化した血球細胞を集めてキャピラリー電気泳動-飛行時間型質量分析計によるメタボローム解析を実施すると33),造血幹細胞において解糖系の活性化を示唆する代謝プロファイルが得られる.実際に,in vitroにおいて,造血幹細胞のミトコンドリアにおける酸化的リン酸化を阻害しても造血幹細胞の特徴のひとつであるSP(side population)形質はよく保たれるが,解糖系を阻害するとこのSP形質は維持されない.したがって,成体の造血幹細胞において解糖系は活性化していると考えられる.こうした代謝特性には,骨髄の低酸素の微小環境により解糖系のマスターレギュレーターであるHIF-1αが活性化することが重要であると考えられている.HIF-1αはbHLH-PAS型の転写因子であり,通常の大気の酸素分圧では酸素に依存性のプロリン水酸化酵素とアスパラギン水酸化酵素により,ODDドメインのプロリン残基とC-TADドメインのアスパラギン残基がそれぞれ水酸化されている.ODDドメインのプロリン残基が水酸化されたHIF-1αは,ユビキチンリガーゼであるVHLにより認識されユビキチン-プロテアソーム系により分解される.また,C-TADドメインのアスパラギン残基が水酸化されたHIF-1αは,転写因子p300/CBPと相互作用できなくなるため,その転写活性をフルに発揮できなくなる.一方で,低酸素の環境ではプロリン水酸化酵素およびアスパラギン水酸化酵素は活性を失うため,HIF-1αは安定して存在できるようになり,酸素に非依存性のサブユニットであるHIF-1βとともに核へと移行して,ヘテロ二量体の転写因子HIF-1として低酸素の環境に適応するために必要な遺伝子の発現を制御する.
HIF-1αを欠損した造血幹細胞では,幹細胞としての活性が障害されると同時に,ミトコンドリアにおける活性酸素種の産生が増加し解糖系の活性が低下する33,34).一方で,VHLをヘテロで欠損した造血幹細胞では活性酸素種の産生が減少する.さらに,VHLをホモで欠損した造血幹細胞ではミトコンドリアの量が非常に減少する.造血幹細胞は活性酸素種に対し脆弱であり,活性酸素種への過剰な曝露は幹細胞にアポトーシスや分化を誘導し幹細胞の枯渇をまねくことが知られていることから35,36),造血幹細胞において,HIF-1αはミトコンドリアへの代謝流束を抑制し活性酸素種の産生を低下させ,その一方で,解糖系を活性化させて幹細胞を維持していることが示唆される33,34)(図2a).同様に,低酸素の環境にある神経幹細胞も活性酸素種への曝露に対し同様の反応を示すことが知られている37).こうした観察は,解糖系の活性化は単なる低酸素の環境への適応機構ではなく,静止期における幹細胞の維持に必要な代謝プログラムであることを示唆している.実際に,HIF-1αの発現それ自体は造血幹細胞に特異的な転写因子であるMeis1により転写の段階で誘導および維持されており38),その結果として,解糖系の酵素の発現が維持されていると考えられる.HIF-1αはファミリータンパク質であるHIF-2αと共通する標的遺伝子をある程度もつとされているが,成体においてHIF-2αを欠損した造血幹細胞の幹細胞としての活性には異常のないことから39),HIF-1αに特異的な標的遺伝子のあることが示唆されている.また,造血幹細胞は骨髄の血管からの距離にかかわりなく細胞における低酸素状態を維持しているという報告もあり40),たんに骨髄の低酸素の部位に造血幹細胞が局在するという“低酸素ニッチ”モデルよりも,なんらかのニッチのシグナルや細胞における酸素の消費を含む代謝特性が,造血幹細胞の低酸素状態の維持に寄与している可能性が示唆されている.また,こうした造血幹細胞の代謝プログラムがその自己複製能の維持に必須であるのか,それとも,低酸素の環境に対するたんなる適応機構であるのかはまだ確定していない.
さて,造血幹細胞はES細胞と同様にミトコンドリアの量が少なく,形態学的にも未熟であり,低いミトコンドリア膜電位と少ないNADHの量を示すことが報告されている38,41).こうした低ミトコンドリア膜電位の形質を説明する分子機構としては,ピルビン酸脱水素酵素に対するリン酸化酵素によるものがあげられる.ピルビン酸脱水素酵素はミトコンドリアにおいて解糖系に由来するピルビン酸をアセチルCoAへと変換する.ピルビン酸脱水素酵素リン酸化酵素は,ピルビン酸脱水素酵素をリン酸化することによりその活性を抑制する.ピルビン酸脱水素酵素のリン酸化の状態を検討したところ,実際に,造血幹細胞では造血前駆細胞に比べピルビン酸脱水素酵素は高くリン酸化されており,ピルビン酸脱水素酵素リン酸化酵素の活性の高いことが示唆された33)(図2a).哺乳類では,ピルビン酸脱水素酵素リン酸化酵素はPdk1遺伝子~Pdk4遺伝子までの4つの遺伝子にコードされたファミリーを形成している.HIF-1αの発現とピルビン酸脱水素酵素リン酸化酵素の発現との相関について検討すると,Pdk2とPdk4がHIF-1αの発現量と正の相関を示す.さらに,HIF-1αを欠損した造血幹細胞の移植における生着能の異常はPdk2あるいはPdk4の過剰発現により回復することから,これらはHIF-1αの機能的な下流タンパク質と考えられる.Pdk2あるいはPdk4を欠損した造血幹細胞は解糖系の活性の低下を認め,ミトコンドリアの量の増加と活性酸素種の産生の増加を認めた.また,細胞周期の亢進による細胞老化の形質を示した.したがって,Pdk2とPdk4は造血幹細胞の代謝特性を維持するため重要な機能をはたしていると考えられる33).残るファミリーメンバーであるPdk1とPdk3についても造血幹細胞において高く発現していることが報告されており42),Pdkファミリーは幹細胞の代謝特性と幹細胞としての活性とを協調的に維持していると思われる.ただし,ミトコンドリアにおけるエネルギー代謝が障害されている変異マウスでも,造血幹細胞の代謝特性と幹細胞としての活性は障害されるため43-46),ミトコンドリアにおけるエネルギー代謝も解糖系と同様に重要であることが示唆されている.
さらに,恒常性の維持だけでなく腫瘍の発生にもミトコンドリアに由来する代謝産物の寄与していることが示されている.TCA回路の中間代謝産物であるαケトグルタル酸は,ヒストンのリジン残基を脱メチル化する酵素であるJmjCドメイン含有型ヒストン脱メチル化酵素が活性を発揮するために必要であることが知られている.TCA回路の酵素であるイソクエン酸脱水素酵素のアイソザイムIDH1およびIDH2の体細胞変異は,脳腫瘍や急性骨髄性白血病などの腫瘍において認められる.変異IDH1や変異IDH2はαケトグルタル酸から2-ヒドロキシグルタル酸を産生する活性を獲得しているため,αケトグルタル酸の量が低下する.すなわち,JmjCドメイン含有型ヒストン脱メチル化酵素の活性が低下し,本来は脱メチル化されるべきヒストンに異常を呈する.組織幹細胞からの分化のときにヒストンの脱メチル化が重要であることは知られており,実際に,変異IDHの発現は造血幹細胞の分化の阻害を誘導することが知られている47,48).一方で,変異IDHはヒストンのメチル化だけでなくDNAのメチル化の状態にも影響を及ぼす.TET2はαケトグルタル酸に依存して5-メチルシトシンを5-ヒドロキシメチルシトシンへと変換する酵素であり,IDH変異によるαケトグルタル酸の減少にともない活性が低下する.5-ヒドロキシメチルシトシンは細胞分裂やDNA塩基除去修復機構により非メチル化シトシンへと置換されて脱メチル化される.すなわち,変異IDHによるTET2の酵素活性の低下は,5-ヒドロキシメチルシトシンの産生を抑制しDNAのメチル化を亢進する.また,2-ヒドロキシグルタル酸の光学異性体である (R)-エナンチオマーはプロリン水酸化酵素の活性を亢進させるため,細胞におけるHIF-αの量が低下することも知られており49),こうした代謝産物の変化にはじまるさまざまな変化の総和として細胞の増殖や分化に異常が生じ,腫瘍が発生すると考えられる.
一方で,骨髄に存在するもうひとつの幹細胞である間葉系幹細胞も低酸素の環境にあることが知られている.間葉系幹細胞から分化して生じる骨芽細胞と比べると,間葉系幹細胞は解糖系の酵素を高く発現し,一方で,ミトコンドリアにおける酸化的リン酸化にはたらく酵素の発現は低いことから,やはり,解糖系に依存していることが示唆されている50).間葉系幹細胞それ自体は,通常の大気の酸素分圧での培養においては酸素の高い消費を示し酸化的リン酸化を利用して増殖することが知られており,コロニーの形成能も高いことが知られている.ただし,その代償として細胞老化の傾向を示し,自己複製能を失い分化しやすくなる51,52).したがって,解糖系に依存しているのはたんなる骨髄の低酸素の環境への適応反応であったとしても,結果として,幹細胞の活性を維持するためには有効な戦略であるといえる.間葉系幹細胞は造血幹細胞のニッチとして機能することが知られており53),近接する細胞どうしの代謝特性がいかに協調的に制御され相互に影響しあっているかは,今後,解明されるべき課題である.
静止状態の幹細胞にくわえ,増殖期にある幹細胞や前駆細胞も組織の恒常性の維持において重要な役割をはたすことが知られている.造血幹細胞と,そこから分化して生じる骨髄球系の造血前駆細胞のプロテオームを比較すると,静止期にある造血幹細胞は解糖系に依存しているのに対し,造血前駆細胞では好気的解糖と酸化的リン酸化を同時に利用していることが示唆される(図2b).実際に,解糖系の最初の反応を触媒するヘキソキナーゼのアイソザイムの発現に注目すると,造血幹細胞ではおもに解糖系を介したATPの産生を促進するHk1の発現が高く,骨髄球系の造血前駆細胞ではペントースリン酸経路の活性化を介し脂肪酸の生合成を促進するとされるHk2とHk3の発現が高い42,54).したがって,造血幹細胞では解糖系をおもにエネルギーの産生に用い,造血前駆細胞では解糖系を異化作用に用いていると考えられる.骨髄球系の分化に必要な転写因子であるPU.1はHk3の発現を誘導することから,細胞の分化のプログラムが直接に代謝を制御していることが示唆される.一方で,ピルビン酸脱水素酵素リン酸化酵素の発現についても,造血前駆細胞において発現が低下することから骨髄球系への分化にともない酸化的リン酸化の抑制が解除されることが示唆される33,42).これにくわえ,ミトコンドリアにおけるカルジオリピンの合成の過程でホスファチジルグリセロールリン酸の脱リン酸化にはたらく脱リン酸化酵素PTPMT1は,造血幹細胞から造血前駆細胞へと分化するときに酸化的リン酸化にスイッチを入れるため必要であると考えられている55)(図2b).このように,造血前駆細胞において酸化的リン酸化のスイッチが入ると活性酸素種の産生が高まることになる.興味深いことに,ショウジョウバエにおける哺乳類の骨髄球系前駆細胞様の細胞(medullary zone progenitor)は分化した血球細胞を産生するときに活性酸素種を必要とすることが知られており56),哺乳類においても,造血前駆細胞における代謝の変動と活性酸素種の産生そのものが,分化能を規定する要素である可能性がある.また,造血幹細胞に比べると活発に増殖をくり返す精子幹細胞は,活性酸素種が多すぎると細胞周期の停止とアポトーシスが誘導される一方,細胞増殖のためには適度な量の活性酸素種を必要とすることが報告されている57,58).したがって,活性酸素種とそれを産生する代謝プログラムは,いつでも分化や老化を誘導するという幹細胞にとり負の効果を発揮するわけではなく,活性酸素の量や細胞種,あるいは,状況に依存して幹細胞と前駆細胞の運命を決定すると考えられる.
体性幹細胞が組織の恒常性を適切に維持することは,個体老化の進行にかかわると考えられている.その一方で,幹細胞の機能や数が低下することは老化関連疾患の一因となることが想定されている.実際に,活性酸素種による細胞傷害の蓄積は幹細胞の自己複製を傷害し,老化を促進することが知られている46,59).個体老化を制御することが知られているインスリン-Aktシグナル伝達系,AMPKシグナル伝達系,mTORシグナル伝達系といった各種の栄養感受性のシグナル伝達系は,幹細胞の自己複製と静止状態とのバランスをとることにより細胞老化を制御していることが知られている.たとえば,インスリン-Aktシグナル伝達系により負に制御される転写因子FOXOを欠損すると,造血幹細胞はストレスへの耐性を失い幹細胞が枯渇する35,36).また,AMPKを活性化するLkb1の欠損により造血幹細胞のミトコンドリアには異常が起こり,静止状態が失われて幹細胞が枯渇する43-45).さらに,mTOR複合体1の活性を負に制御するTsc1の欠損により造血幹細胞においてミトコンドリアが増加し,細胞の増殖が誘発され,結果として,幹細胞が枯渇することが示されている60).これと一致するように,ラパマイシンによりmTOR複合体1の活性を抑制すると,造血幹細胞の細胞老化を抑制して自己複製能や多分化能を維持できるとの報告もなされている61).こうした代謝センサーにくわえ,ピルビン酸脱水素酵素リン酸化酵素によるミトコンドリアへの代謝流束の制御も,幹細胞の活性を操作するあたりその標的となりうる.ピルビン酸脱水素酵素の阻害作用のある1-アミノエチルホスフィン酸を添加して造血幹細胞あるいは造血前駆細胞を培養すると,この添加はいずれも強力な増殖の抑制作用を示し,造血前駆細胞は死滅した.ところが,造血幹細胞は増殖が抑制されたまま1カ月にわたり培養することが可能であり,その時点でも造血幹細胞としての表面マーカーを保ちつつ,骨髄に移植しても生着能と多分化能を保持した.一方で,1-アミノエチルホスフィン酸を添加していない造血幹細胞では骨髄移植ののちの生着能は完全に失われていた.そのとき,1-アミノエチルホスフィン酸を添加した造血幹細胞は,添加していない造血幹細胞に比べ細胞老化の形質の出現が抑制されていた33).こうした観察は,幹細胞の代謝制御により静止状態や自己複製能,多分化能を一括して操作し老化を抑制できる可能性を示唆している.
細胞が環境や状況に応じ代謝プログラムを変動させることは生物の基本的な生存戦略であるが,幹細胞における代謝プログラムと,それが発揮する効果には不明な点が多い.ここでは,多能性幹細胞と造血幹細胞それぞれの代謝制御機構と,その幹細胞システムの維持に対する影響について紹介した.現在,造血幹細胞をはじめとする各種の幹細胞において,代謝制御プログラムがその維持や機能の発揮に重要な役割をはたすことが報告されてきている.細胞において代謝を制御する化合物は数多く存在するため,今後は,こうした代謝プログラムを人為的に制御することが,幹細胞の機能の新しい改変法や,幹細胞の老化の抑制にもとづく抗老化法の開発につながることが期待される.さらに,正常の幹細胞とがん幹細胞との代謝制御の異同の理解は,がん幹細胞に特異的な治療法の開発にもつながることが期待される.このとき問題となるのは,幹細胞の代謝特性を網羅的かつ経時的に把握する技術である.また,とくに体性幹細胞の場合には,数が少ないうえニッチとのかかわりも問題となるため,空間的な情報も加味した高感度の代謝解析が重要となる.こうした技術的な困難をのりこえていくことにより,教科書的な知識の膨大な集積と思われがちな代謝が,幹細胞ヒエラルキーの各段階でいかに精巧かつダイナミックに制御されているか,ひとつひとつ明らかになっていくものと思われる.
略歴:2007年 慶應義塾大学大学院医学研究科 修了,慶應義塾大学医学部 助教を経て,2011年より同 専任講師.
研究テーマ:幹細胞とニッチとの相互作用と,その破綻の分子機構.
抱負:成体における幹細胞の解析を手がかりにして,難解な生命現象からシンプルな法則を見い出したい.
© 2013 田久保 圭誉 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 坂口講座テニュアトラック・プログラム)
email:田久保圭誉
領域融合レビュー, 2, e012 (2013) DOI: 10.7875/leading.author.2.e012
Keiyo Takubo: Regulation of stem cells by metabolic programs.
要 約
自己複製能と多分化能をもつ幹細胞は,幹細胞としての性質を保つために固有の転写因子のセットにもとづく転写制御ネットワークを維持している.そして,こうした転写制御ネットワークの下流では,さまざまな幹細胞に固有の細胞生物学的な現象を実行するために代謝プログラムを起動し,必要に応じエネルギー通貨であるATPや代謝産物を産生している.近年,ニッチにある各種の臓器幹細胞や,ES細胞あるいはiPS細胞といった多能性幹細胞では,分化した細胞とは異なる代謝プログラムを保持していることが見い出された.そして,代謝プログラムそれ自体が幹細胞の未分化性の維持や自己複製能,静止状態の維持などに寄与していることが明らかになってきた.幹細胞における代謝プログラムの理解は,幹細胞の増幅や分化した細胞の産生といった再生医療にも役だつ技術の開発,また,がん幹細胞を標的とする治療戦略の策定にも寄与しうることから,代謝の視座から幹細胞システムを理解する重要性は増している.
はじめに
組織幹細胞は自己複製能と多分化能をもつ細胞の集団であり,組織の発生や恒常性の維持の要として機能する.幹細胞性を規定する転写因子や,幹細胞を維持する微小環境である“ニッチ”からのシグナルは,自己複製,非対称な分裂,静止状態の維持,分化,遊走,ニッチへのホーミングなど,幹細胞に特有の生物現象を実行するためのエネルギーをもたらす代謝プログラムを起動すると考えられている.近年,造血幹細胞をはじめとする各種の幹細胞システムの解析から,これまで不明であった幹細胞に特有の代謝特性とその分子機構が見い出された.その結果,幹細胞における代謝プログラムは恒常性の維持や老化からの防御に不可欠な役割をはたしていることが明らかになりつつある.一方で,幹細胞のなかでも,多能性をもち培養により維持される多能性幹細胞においても,幹細胞性の維持やリプログラミングによる多能性の獲得の過程において,代謝の制御が重要な役割をはたすことが明らかになっている.
ここでは,ES細胞(embryonic stem cell,胚性幹細胞)やiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)といった多能性幹細胞,および,哺乳類の骨髄ニッチに存在する造血幹細胞を中心として,幹細胞性の維持,増殖,分化,そして,リプログラミングの過程における代謝プログラムとその制御機構について解説する.
1.多能性幹細胞の維持および分化のときそれぞれの代謝の特性
初期胚の胚盤胞にある内部細胞塊では,細胞内へグルコースを輸送するGlut1やGlut3の発現が高くグルコースの取り込み能が高い.その結果,解糖系の代謝流束が高く,乳酸の産生能も高いことが知られている1,2)(図1a).こうした解糖系に依存した代謝特性が胚盤胞において重要であることは,各種の解糖系の酵素を欠損すると着床前致死となることからも支持される3-6).胚盤胞では解糖系だけでなくミトコンドリアにおける酸化的リン酸化の活性も高まり酸素の消費も高くなることが知られているが7),これは,むしろ栄養外胚葉のミトコンドリアが高い膜電位を保つことによるものであり,内部細胞塊のミトコンドリアは膜電位の低い状態を保っている8).
胚盤胞から得られ培養により維持される多能性幹細胞であるES細胞も,同様に解糖系に大きく依存した代謝特性を示す9-14).また,分化した細胞からiPS細胞へのリプログラミングの過程においても,酸化的リン酸化への依存から解糖系を中心とした代謝への再移行が認められ,iPS細胞が樹立されたのちはES細胞と同様に解糖系への依存性を示す.したがって,多能性を獲得するリプログラミングの過程においては,代謝特性についてもリプログラミングが起こっている.このとき,解糖系の再活性化は多能性マーカーの誘導にさきだって起こることが知られており15),リプログラミングの効率を上げることの知られている細胞の増殖亢進が分化した細胞に誘導された結果,代謝は細胞の増殖に適した解糖系にリプログラミングされていると考えられる.このとき,解糖系の阻害や酸化的リン酸化の活性化はiPS細胞へのリプログラミングを抑制することから,代謝動態の変化も多能性の獲得の促進に貢献すると考えられている16,17).また,解糖系の副経路であるペントースリン酸経路はマウスのES細胞において活性化しており,この経路から活発な細胞の増殖のため必要な核酸が供給されていると考えられる12,18,19).
このように,ES細胞では酸化的リン酸化の活性は低く,ATPの産生は解糖系に依存している.すなわち,解糖系はミトコンドリアにおける代謝に比べ相対的に活性化していると考えられる.こうした状況において,ミトコンドリアにおける酸素の消費もまた重要な役割をはたしている.具体的には,電子伝達系においてNADHをNAD+へと酸化してTCA回路の代謝流束を維持することにより,ES細胞は細胞における酸化還元の状態を適切に保ち,クエン酸からの脂質の合成や,オキサロ酢酸やαケトグルタル酸からのアミノ酸の合成を進めていると考えられる20)(図1a).実際に,ES細胞の集団全体としては低いミトコンドリア膜電位を示すが,そのなかで,相対的に高いミトコンドリア膜電位を示す分画と低いミトコンドリア膜電位を示す分画とを取り分けてテラトーマの形成能を比較すると,相対的に高いミトコンドリア膜電位を示す分画のES細胞のほうがより効率的にテラトーマを形成することが知られている21).さらに,ミトコンドリアにおいてピルビン酸からアセチルCoAを産生するピルビン酸脱水素酵素複合体を失った胚盤胞は発生に異常を呈することからも22,23),解糖系と同様に,ミトコンドリアにおいて代謝プログラムが適切に維持されることは多能性幹細胞の維持に不可欠であることがわかる.
一方で,マウスのES細胞は多能性を担保するエピゲノムの状態を維持するため,培地からのスレオニンの取り込みをとくに必要としている.これは,ほかの線維芽細胞や細胞株にはみられない特徴である24).さらに,取り込まれたスレオニンをグリシンとアセチルCoAへ異化するときの律速酵素であるスレオニン水酸化酵素は,初期の胚盤胞,ES細胞,iPS細胞において発現の上昇していることが知られている.このスレオニン水酸化酵素が介する反応により得られたグリシンは,ミトコンドリアにおいてグリシンの開裂にはたらくグリシン脱炭酸酵素により,細胞において葉酸に依存性の1-炭素プールを維持するために用いられる(図1a).グリシン脱炭酸酵素はスレオニン水酸化酵素と同様に多能性幹細胞において高く発現している25).スレオニン水酸化酵素の阻害や発現の抑制によりマウスES細胞の増殖は抑制されることから,スレオニンに由来する代謝産物は多能性幹細胞の維持に必要であると考えられる.スレオニン水酸化酵素とグリシン脱炭酸酵素は5-メチルテトラヒドロ葉酸の産生を誘導し,5-メチルテトラヒドロ葉酸-ホモシステインメチルトランスフェラーゼを介したホモシステインからのメチオニンの再生を促進する.その結果,ヒストンH3の4番目のリジン残基のトリメチル化においてメチル基を供与する,S-アデノシルメチオニンの産生が誘導される25).ヒストンH3の4番目のリジン残基のトリメチル化は,多能性維持と自己複製能を担保するユークロマチンの開いた構造の維持のため必要である.さらに,スレオニン水酸化酵素を介した葉酸に依存性の1-炭素プールは核酸の合成を促進するため24),これも増殖の速い多能性幹細胞を維持するために都合がよいと考えられる.
一方で,ES細胞が分化していくときには解糖系の代謝流束が低下し,スレオニンを好んで取り込みグリシンを産生するという代謝特性も失われる.代わりに,ミトコンドリアにおける酸化的リン酸化がグルコースや脂肪酸に由来する代謝産物により駆動されるようになる9,24,26,27)(図1b).その結果,活性酸素種の産生が増加し細胞の酸化還元の環境はより酸化状態へとかたむく.もともと,ES細胞には酸化されやすい炭素二重結合を含む不飽和脂肪酸が多く存在する.そのため,細胞において活性酸素種が産生されるようになると,これらが酸化されエイコサノイドを供給するようになる.エイコサノイド合成経路の阻害剤をくわえることによりES細胞の多能性の維持は促進されることが知られていることから28),代謝特性の変化により産生されるエイコサノイドはES細胞の未分化性を失わせ,分化へとむかわせると考えられる.このように,分化した細胞と多能性幹細胞とは代謝特性が異なるため,これをうまく利用することにより分化した細胞を効率的に産生することが可能になる.その一例が,代謝特性を利用した多能性幹細胞から心筋細胞の誘導系である.胎生期の心筋前駆細胞は乳酸を取り込んで酸化的リン酸化経路を活性化することが知られている29).ヒトのES細胞やiPS細胞から心筋細胞を分化させるときに培地のグルコースを除き乳酸をくわえておくと,胚葉体から多能性幹細胞を含まない純度の高い機能的な心筋細胞を得ることができる30).つまり,幹細胞と分化した細胞の代謝特性の理解は,幹細胞および分化した細胞それぞれに新しい操作技術をもたらす可能性がある.
2.静止状態にある成体の幹細胞の代謝特性
つねに増殖しているES細胞とは異なり,生体の多くの幹細胞は静止状態にある.具体的には,骨髄の造血幹細胞や間葉系幹細胞,脳の神経幹細胞,毛包バルジ領域の表皮幹細胞や筋肉の衛星細胞が,こうした静止状態の幹細胞のカテゴリーに含まれる.一般的に,この種の幹細胞は活性酸素種による細胞傷害からのがれ老化することなく生涯にわたる自己複製能を保持するため,細胞周期が静止期にあると考えられている31).
造血系において,胎生期や生後すぐの骨髄では造血幹細胞は活発に増殖している.対照的に,成体では造血幹細胞は骨髄ニッチにより細胞周期が静止期に維持されており,その分裂の頻度はマウスでは145日に1回と計算され生涯に5回程度しか分裂しないと見積もられている32).造血幹細胞は感染や出血など各種の造血ストレスが負荷されたときには活発に増殖するが,ひとたび増殖をはじめた造血幹細胞も,ふたたび静止状態にもどることのできることが知られている32).しかし,造血幹細胞や造血前駆細胞における時期や状況に応じた代謝の制御機構は不明であった.
正常の造血幹細胞と造血前駆細胞の代謝プロファイルを検討するため,マウスから大量の造血幹細胞,造血前駆細胞,分化した血球細胞を集めてキャピラリー電気泳動-飛行時間型質量分析計によるメタボローム解析を実施すると33),造血幹細胞において解糖系の活性化を示唆する代謝プロファイルが得られる.実際に,in vitroにおいて,造血幹細胞のミトコンドリアにおける酸化的リン酸化を阻害しても造血幹細胞の特徴のひとつであるSP(side population)形質はよく保たれるが,解糖系を阻害するとこのSP形質は維持されない.したがって,成体の造血幹細胞において解糖系は活性化していると考えられる.こうした代謝特性には,骨髄の低酸素の微小環境により解糖系のマスターレギュレーターであるHIF-1αが活性化することが重要であると考えられている.HIF-1αはbHLH-PAS型の転写因子であり,通常の大気の酸素分圧では酸素に依存性のプロリン水酸化酵素とアスパラギン水酸化酵素により,ODDドメインのプロリン残基とC-TADドメインのアスパラギン残基がそれぞれ水酸化されている.ODDドメインのプロリン残基が水酸化されたHIF-1αは,ユビキチンリガーゼであるVHLにより認識されユビキチン-プロテアソーム系により分解される.また,C-TADドメインのアスパラギン残基が水酸化されたHIF-1αは,転写因子p300/CBPと相互作用できなくなるため,その転写活性をフルに発揮できなくなる.一方で,低酸素の環境ではプロリン水酸化酵素およびアスパラギン水酸化酵素は活性を失うため,HIF-1αは安定して存在できるようになり,酸素に非依存性のサブユニットであるHIF-1βとともに核へと移行して,ヘテロ二量体の転写因子HIF-1として低酸素の環境に適応するために必要な遺伝子の発現を制御する.
HIF-1αを欠損した造血幹細胞では,幹細胞としての活性が障害されると同時に,ミトコンドリアにおける活性酸素種の産生が増加し解糖系の活性が低下する33,34).一方で,VHLをヘテロで欠損した造血幹細胞では活性酸素種の産生が減少する.さらに,VHLをホモで欠損した造血幹細胞ではミトコンドリアの量が非常に減少する.造血幹細胞は活性酸素種に対し脆弱であり,活性酸素種への過剰な曝露は幹細胞にアポトーシスや分化を誘導し幹細胞の枯渇をまねくことが知られていることから35,36),造血幹細胞において,HIF-1αはミトコンドリアへの代謝流束を抑制し活性酸素種の産生を低下させ,その一方で,解糖系を活性化させて幹細胞を維持していることが示唆される33,34)(図2a).同様に,低酸素の環境にある神経幹細胞も活性酸素種への曝露に対し同様の反応を示すことが知られている37).こうした観察は,解糖系の活性化は単なる低酸素の環境への適応機構ではなく,静止期における幹細胞の維持に必要な代謝プログラムであることを示唆している.実際に,HIF-1αの発現それ自体は造血幹細胞に特異的な転写因子であるMeis1により転写の段階で誘導および維持されており38),その結果として,解糖系の酵素の発現が維持されていると考えられる.HIF-1αはファミリータンパク質であるHIF-2αと共通する標的遺伝子をある程度もつとされているが,成体においてHIF-2αを欠損した造血幹細胞の幹細胞としての活性には異常のないことから39),HIF-1αに特異的な標的遺伝子のあることが示唆されている.また,造血幹細胞は骨髄の血管からの距離にかかわりなく細胞における低酸素状態を維持しているという報告もあり40),たんに骨髄の低酸素の部位に造血幹細胞が局在するという“低酸素ニッチ”モデルよりも,なんらかのニッチのシグナルや細胞における酸素の消費を含む代謝特性が,造血幹細胞の低酸素状態の維持に寄与している可能性が示唆されている.また,こうした造血幹細胞の代謝プログラムがその自己複製能の維持に必須であるのか,それとも,低酸素の環境に対するたんなる適応機構であるのかはまだ確定していない.
さて,造血幹細胞はES細胞と同様にミトコンドリアの量が少なく,形態学的にも未熟であり,低いミトコンドリア膜電位と少ないNADHの量を示すことが報告されている38,41).こうした低ミトコンドリア膜電位の形質を説明する分子機構としては,ピルビン酸脱水素酵素に対するリン酸化酵素によるものがあげられる.ピルビン酸脱水素酵素はミトコンドリアにおいて解糖系に由来するピルビン酸をアセチルCoAへと変換する.ピルビン酸脱水素酵素リン酸化酵素は,ピルビン酸脱水素酵素をリン酸化することによりその活性を抑制する.ピルビン酸脱水素酵素のリン酸化の状態を検討したところ,実際に,造血幹細胞では造血前駆細胞に比べピルビン酸脱水素酵素は高くリン酸化されており,ピルビン酸脱水素酵素リン酸化酵素の活性の高いことが示唆された33)(図2a).哺乳類では,ピルビン酸脱水素酵素リン酸化酵素はPdk1遺伝子~Pdk4遺伝子までの4つの遺伝子にコードされたファミリーを形成している.HIF-1αの発現とピルビン酸脱水素酵素リン酸化酵素の発現との相関について検討すると,Pdk2とPdk4がHIF-1αの発現量と正の相関を示す.さらに,HIF-1αを欠損した造血幹細胞の移植における生着能の異常はPdk2あるいはPdk4の過剰発現により回復することから,これらはHIF-1αの機能的な下流タンパク質と考えられる.Pdk2あるいはPdk4を欠損した造血幹細胞は解糖系の活性の低下を認め,ミトコンドリアの量の増加と活性酸素種の産生の増加を認めた.また,細胞周期の亢進による細胞老化の形質を示した.したがって,Pdk2とPdk4は造血幹細胞の代謝特性を維持するため重要な機能をはたしていると考えられる33).残るファミリーメンバーであるPdk1とPdk3についても造血幹細胞において高く発現していることが報告されており42),Pdkファミリーは幹細胞の代謝特性と幹細胞としての活性とを協調的に維持していると思われる.ただし,ミトコンドリアにおけるエネルギー代謝が障害されている変異マウスでも,造血幹細胞の代謝特性と幹細胞としての活性は障害されるため43-46),ミトコンドリアにおけるエネルギー代謝も解糖系と同様に重要であることが示唆されている.
さらに,恒常性の維持だけでなく腫瘍の発生にもミトコンドリアに由来する代謝産物の寄与していることが示されている.TCA回路の中間代謝産物であるαケトグルタル酸は,ヒストンのリジン残基を脱メチル化する酵素であるJmjCドメイン含有型ヒストン脱メチル化酵素が活性を発揮するために必要であることが知られている.TCA回路の酵素であるイソクエン酸脱水素酵素のアイソザイムIDH1およびIDH2の体細胞変異は,脳腫瘍や急性骨髄性白血病などの腫瘍において認められる.変異IDH1や変異IDH2はαケトグルタル酸から2-ヒドロキシグルタル酸を産生する活性を獲得しているため,αケトグルタル酸の量が低下する.すなわち,JmjCドメイン含有型ヒストン脱メチル化酵素の活性が低下し,本来は脱メチル化されるべきヒストンに異常を呈する.組織幹細胞からの分化のときにヒストンの脱メチル化が重要であることは知られており,実際に,変異IDHの発現は造血幹細胞の分化の阻害を誘導することが知られている47,48).一方で,変異IDHはヒストンのメチル化だけでなくDNAのメチル化の状態にも影響を及ぼす.TET2はαケトグルタル酸に依存して5-メチルシトシンを5-ヒドロキシメチルシトシンへと変換する酵素であり,IDH変異によるαケトグルタル酸の減少にともない活性が低下する.5-ヒドロキシメチルシトシンは細胞分裂やDNA塩基除去修復機構により非メチル化シトシンへと置換されて脱メチル化される.すなわち,変異IDHによるTET2の酵素活性の低下は,5-ヒドロキシメチルシトシンの産生を抑制しDNAのメチル化を亢進する.また,2-ヒドロキシグルタル酸の光学異性体である (R)-エナンチオマーはプロリン水酸化酵素の活性を亢進させるため,細胞におけるHIF-αの量が低下することも知られており49),こうした代謝産物の変化にはじまるさまざまな変化の総和として細胞の増殖や分化に異常が生じ,腫瘍が発生すると考えられる.
一方で,骨髄に存在するもうひとつの幹細胞である間葉系幹細胞も低酸素の環境にあることが知られている.間葉系幹細胞から分化して生じる骨芽細胞と比べると,間葉系幹細胞は解糖系の酵素を高く発現し,一方で,ミトコンドリアにおける酸化的リン酸化にはたらく酵素の発現は低いことから,やはり,解糖系に依存していることが示唆されている50).間葉系幹細胞それ自体は,通常の大気の酸素分圧での培養においては酸素の高い消費を示し酸化的リン酸化を利用して増殖することが知られており,コロニーの形成能も高いことが知られている.ただし,その代償として細胞老化の傾向を示し,自己複製能を失い分化しやすくなる51,52).したがって,解糖系に依存しているのはたんなる骨髄の低酸素の環境への適応反応であったとしても,結果として,幹細胞の活性を維持するためには有効な戦略であるといえる.間葉系幹細胞は造血幹細胞のニッチとして機能することが知られており53),近接する細胞どうしの代謝特性がいかに協調的に制御され相互に影響しあっているかは,今後,解明されるべき課題である.
3.増殖する幹細胞および前駆細胞の代謝特性
静止状態の幹細胞にくわえ,増殖期にある幹細胞や前駆細胞も組織の恒常性の維持において重要な役割をはたすことが知られている.造血幹細胞と,そこから分化して生じる骨髄球系の造血前駆細胞のプロテオームを比較すると,静止期にある造血幹細胞は解糖系に依存しているのに対し,造血前駆細胞では好気的解糖と酸化的リン酸化を同時に利用していることが示唆される(図2b).実際に,解糖系の最初の反応を触媒するヘキソキナーゼのアイソザイムの発現に注目すると,造血幹細胞ではおもに解糖系を介したATPの産生を促進するHk1の発現が高く,骨髄球系の造血前駆細胞ではペントースリン酸経路の活性化を介し脂肪酸の生合成を促進するとされるHk2とHk3の発現が高い42,54).したがって,造血幹細胞では解糖系をおもにエネルギーの産生に用い,造血前駆細胞では解糖系を異化作用に用いていると考えられる.骨髄球系の分化に必要な転写因子であるPU.1はHk3の発現を誘導することから,細胞の分化のプログラムが直接に代謝を制御していることが示唆される.一方で,ピルビン酸脱水素酵素リン酸化酵素の発現についても,造血前駆細胞において発現が低下することから骨髄球系への分化にともない酸化的リン酸化の抑制が解除されることが示唆される33,42).これにくわえ,ミトコンドリアにおけるカルジオリピンの合成の過程でホスファチジルグリセロールリン酸の脱リン酸化にはたらく脱リン酸化酵素PTPMT1は,造血幹細胞から造血前駆細胞へと分化するときに酸化的リン酸化にスイッチを入れるため必要であると考えられている55)(図2b).このように,造血前駆細胞において酸化的リン酸化のスイッチが入ると活性酸素種の産生が高まることになる.興味深いことに,ショウジョウバエにおける哺乳類の骨髄球系前駆細胞様の細胞(medullary zone progenitor)は分化した血球細胞を産生するときに活性酸素種を必要とすることが知られており56),哺乳類においても,造血前駆細胞における代謝の変動と活性酸素種の産生そのものが,分化能を規定する要素である可能性がある.また,造血幹細胞に比べると活発に増殖をくり返す精子幹細胞は,活性酸素種が多すぎると細胞周期の停止とアポトーシスが誘導される一方,細胞増殖のためには適度な量の活性酸素種を必要とすることが報告されている57,58).したがって,活性酸素種とそれを産生する代謝プログラムは,いつでも分化や老化を誘導するという幹細胞にとり負の効果を発揮するわけではなく,活性酸素の量や細胞種,あるいは,状況に依存して幹細胞と前駆細胞の運命を決定すると考えられる.
4.幹細胞の代謝特性と細胞老化
体性幹細胞が組織の恒常性を適切に維持することは,個体老化の進行にかかわると考えられている.その一方で,幹細胞の機能や数が低下することは老化関連疾患の一因となることが想定されている.実際に,活性酸素種による細胞傷害の蓄積は幹細胞の自己複製を傷害し,老化を促進することが知られている46,59).個体老化を制御することが知られているインスリン-Aktシグナル伝達系,AMPKシグナル伝達系,mTORシグナル伝達系といった各種の栄養感受性のシグナル伝達系は,幹細胞の自己複製と静止状態とのバランスをとることにより細胞老化を制御していることが知られている.たとえば,インスリン-Aktシグナル伝達系により負に制御される転写因子FOXOを欠損すると,造血幹細胞はストレスへの耐性を失い幹細胞が枯渇する35,36).また,AMPKを活性化するLkb1の欠損により造血幹細胞のミトコンドリアには異常が起こり,静止状態が失われて幹細胞が枯渇する43-45).さらに,mTOR複合体1の活性を負に制御するTsc1の欠損により造血幹細胞においてミトコンドリアが増加し,細胞の増殖が誘発され,結果として,幹細胞が枯渇することが示されている60).これと一致するように,ラパマイシンによりmTOR複合体1の活性を抑制すると,造血幹細胞の細胞老化を抑制して自己複製能や多分化能を維持できるとの報告もなされている61).こうした代謝センサーにくわえ,ピルビン酸脱水素酵素リン酸化酵素によるミトコンドリアへの代謝流束の制御も,幹細胞の活性を操作するあたりその標的となりうる.ピルビン酸脱水素酵素の阻害作用のある1-アミノエチルホスフィン酸を添加して造血幹細胞あるいは造血前駆細胞を培養すると,この添加はいずれも強力な増殖の抑制作用を示し,造血前駆細胞は死滅した.ところが,造血幹細胞は増殖が抑制されたまま1カ月にわたり培養することが可能であり,その時点でも造血幹細胞としての表面マーカーを保ちつつ,骨髄に移植しても生着能と多分化能を保持した.一方で,1-アミノエチルホスフィン酸を添加していない造血幹細胞では骨髄移植ののちの生着能は完全に失われていた.そのとき,1-アミノエチルホスフィン酸を添加した造血幹細胞は,添加していない造血幹細胞に比べ細胞老化の形質の出現が抑制されていた33).こうした観察は,幹細胞の代謝制御により静止状態や自己複製能,多分化能を一括して操作し老化を抑制できる可能性を示唆している.
おわりに
細胞が環境や状況に応じ代謝プログラムを変動させることは生物の基本的な生存戦略であるが,幹細胞における代謝プログラムと,それが発揮する効果には不明な点が多い.ここでは,多能性幹細胞と造血幹細胞それぞれの代謝制御機構と,その幹細胞システムの維持に対する影響について紹介した.現在,造血幹細胞をはじめとする各種の幹細胞において,代謝制御プログラムがその維持や機能の発揮に重要な役割をはたすことが報告されてきている.細胞において代謝を制御する化合物は数多く存在するため,今後は,こうした代謝プログラムを人為的に制御することが,幹細胞の機能の新しい改変法や,幹細胞の老化の抑制にもとづく抗老化法の開発につながることが期待される.さらに,正常の幹細胞とがん幹細胞との代謝制御の異同の理解は,がん幹細胞に特異的な治療法の開発にもつながることが期待される.このとき問題となるのは,幹細胞の代謝特性を網羅的かつ経時的に把握する技術である.また,とくに体性幹細胞の場合には,数が少ないうえニッチとのかかわりも問題となるため,空間的な情報も加味した高感度の代謝解析が重要となる.こうした技術的な困難をのりこえていくことにより,教科書的な知識の膨大な集積と思われがちな代謝が,幹細胞ヒエラルキーの各段階でいかに精巧かつダイナミックに制御されているか,ひとつひとつ明らかになっていくものと思われる.
文 献
- Leese, H. J. & Barton, A. M.: Pyruvate and glucose uptake by mouse ova and preimplantation embryos. J. Reprod. Fertil., 72, 9-13 (1984)[PubMed]
- Pantaleon, M. & Kaye, P. L.: Glucose transporters in preimplantation development. Rev. Reprod., 3, 77-81 (1998)[PubMed]
- Merkle, S. & Pretsch, W.: Characterization of triosephosphate isomerase mutants with reduced enzyme activity in Mus musculus. Genetics, 123, 837-844 (1989)[PubMed]
- West, J. D., Flockhart, J. H., Peters, J. et al.: Death of mouse embryos that lack a functional gene for glucose phosphate isomerase. Genet. Res., 56, 223-236 (1990)[PubMed]
- Merkle, S., Favor, J., Graw, J. et al.: Hereditary lactate dehydrogenase A-subunit deficiency as cause of early postimplantation death of homozygotes in Mus musculus. Genetics, 131, 413-421 (1992)[PubMed]
- Pretsch, W.: Enzyme-activity mutants in Mus musculus. I. Phenotypic description and genetic characterization of ethylnitrosourea-induced mutations. Mamm. Genome, 11, 537-542 (2000)[PubMed]
- Brinster, R. L.: Embryo development. J. Anim. Sci., 38, 1003-1012 (1974)[PubMed]
- Van Blerkom, J., Davis, P., Mathwig, V. et al.: Domains of high-polarized and low-polarized mitochondria may occur in mouse and human oocytes and early embryos. Hum. Reprod., 17, 393-406 (2002)[PubMed]
- Chung, S., Dzeja, P. P., Faustino, R. S. et al.: Mitochondrial oxidative metabolism is required for the cardiac differentiation of stem cells. Nat. Clin. Pract. Cardiovasc. Med., Suppl.1, S60-S67 (2007)[PubMed]
- Kondoh, H., Lleonart, M. E., Nakashima, Y. et al.: A high glycolytic flux supports the proliferative potential of murine embryonic stem cells. Antioxid. Redox. Signal., 9, 293-299 (2007)[PubMed]
- Prigione, A., Fauler, B., Lurz, R. et al.: The senescence-related mitochondrial/oxidative stress pathway is repressed in human induced pluripotent stem cells. Stem Cells, 28, 721-733 (2010)[PubMed]
- Varum, S., Rodrigues, A. S., Moura, M. B. et al.: Energy metabolism in human pluripotent stem cells and their differentiated counterparts. PLoS One, 6, e20914 (2011)[PubMed]
- Zhang, J., Khvorostov, I., Hong, J. S. et al.: UCP2 regulates energy metabolism and differentiation potential of human pluripotent stem cells. EMBO J., 30, 4860-4873 (2011)[PubMed]
- Panopoulos, A. D., Yanes, O., Ruiz, S. et al.: The metabolome of induced pluripotent stem cells reveals metabolic changes occurring in somatic cell reprogramming. Cell Res., 22, 168-177 (2012)[PubMed]
- Hansson, J., Rafiee, M. R., Reiland, S. et al.: Highly coordinated proteome dynamics during reprogramming of somatic cells to pluripotency. Cell Rep., 2, 1579-1592 (2012)[PubMed]
- Yoshida, Y., Takahashi, K., Okita, K. et al.: Hypoxia enhances the generation of induced pluripotent stem cells. Cell Stem Cell, 5, 237-241 (2009)[PubMed]
- Folmes, C. D., Nelson, T. J., Martinez-Fernandez, A. et al.: Somatic oxidative bioenergetics transitions into pluripotency-dependent glycolysis to facilitate nuclear reprogramming. Cell Metab., 14, 264-271 (2011)[PubMed]
- Filosa, S., Fico, A., Paglialunga, F. et al.: Failure to increase glucose consumption through the pentose-phosphate pathway results in the death of glucose-6-phosphate dehydrogenase gene-deleted mouse embryonic stem cells subjected to oxidative stress. Biochem. J., 370, 935-943 (2003)[PubMed]
- Manganelli, G., Fico, A., Masullo, U. et al.: Modulation of the pentose phosphate pathway induces endodermal differentiation in embryonic stem cells. PLoS One, 7, e29321 (2012)[PubMed]
- Shyh-Chang, N., Zheng, Y., Locasale, J. W. et al.: Human pluripotent stem cells decouple respiration from energy production. EMBO J., 30, 4851-4852 (2011)[PubMed]
- Schieke, S. M., Ma, M., Cao, L. et al.: Mitochondrial metabolism modulates differentiation and teratoma formation capacity in mouse embryonic stem cells. J. Biol. Chem., 283, 28506-28512 (2008)[PubMed]
- Johnson, M. T., Yang, H. S., Magnuson, T. et al.: Targeted disruption of the murine dihydrolipoamide dehydrogenase gene (Dld) results in perigastrulation lethality. Proc. Natl. Acad. Sci. USA, 94, 14512-14517 (1997)[PubMed]
- Johnson, M. T., Mahmood, S., Hyatt, S. L. et al.: Inactivation of the murine pyruvate dehydrogenase (Pdha1) gene and its effect on early embryonic development. Mol. Genet. Metab., 74, 293-302 (2001)[PubMed]
- Wang, J., Alexander, P., Wu, L. et al.: Dependence of mouse embryonic stem cells on threonine catabolism. Science, 325, 435-439 (2009)[PubMed]
- Shyh-Chang, N., Locasale, J. W., Lyssiotis, C. A. et al.: Influence of threonine metabolism on S-adenosylmethionine and histone methylation. Science, 339, 222-226 (2013)[PubMed]
- Cho, Y. M., Kwon, S., Pak, Y. K. et al.: Dynamic changes in mitochondrial biogenesis and antioxidant enzymes during the spontaneous differentiation of human embryonic stem cells. Biochem. Biophys. Res. Commun., 348, 1472-1478 (2006)[PubMed]
- Facucho-Oliveira, J. M., Alderson, J., Spikings, E. C. et al.: Mitochondrial DNA replication during differentiation of murine embryonic stem cells. J. Cell Sci., 120, 4025-4034 (2007)[PubMed]
- Yanes, O., Clark, J., Wong, D. M. et al.: Metabolic oxidation regulates embryonic stem cell differentiation. Nat. Chem. Biol., 6, 411-417 (2010)[PubMed]
- Werner, J. C. & Sicard, R. E.: Lactate metabolism of isolated, perfused fetal, and newborn pig hearts. Pediatr. Res., 22, 552-556 (1987)[PubMed]
- Tohyama, S., Hattori, F., Sano, M. et al.: Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell, 12, 127-137 (2013)[PubMed] [新着論文レビュー]
- Suda, T., Takubo, K. & Semenza, G. L.: Metabolic regulation of hematopoietic stem cells in the hypoxic niche. Cell Stem Cell, 9, 298-310 (2011)[PubMed]
- Wilson, A., Laurenti, E., Oser, G. et al.: Hematopoietic stem cells reversibly switch from dormancy to self-renewal during homeostasis and repair. Cell, 135, 1118-1129 (2008)[PubMed]
- Takubo, K., Nagamatsu, G., Kobayashi, C. I. et al.: Regulation of glycolysis by Pdk functions as a metabolic checkpoint for cell cycle quiescence in hematopoietic stem cells. Cell Stem Cell, 12, 49-61 (2013)[PubMed]
- Takubo, K., Goda, N., Yamada, W. et al.: Regulation of the HIF-1α level is essential for hematopoietic stem cells. Cell Stem Cell, 7, 391-402 (2010)[PubMed] [新着論文レビュー]
- Tothova, Z., Kollipara, R., Huntly, B. J. et al.: FoxOs are critical mediators of hematopoietic stem cell resistance to physiologic oxidative stress. Cell, 128, 325-339 (2007)[PubMed]
- Miyamoto, K., Araki, K. Y., Naka, K. et al.: Foxo3a is essential for maintenance of the hematopoietic stem cell pool. Cell Stem Cell, 1, 101-112 (2007)[PubMed]
- Renault, V. M., Rafalski, V. A., Morgan, A. A. et al.: FoxO3 regulates neural stem cell homeostasis. Cell Stem Cell, 5, 527-539 (2009)[PubMed]
- Simsek, T., Kocabas, F., Zheng, J. et al.: The distinct metabolic profile of hematopoietic stem cells reflects their location in a hypoxic niche. Cell Stem Cell, 7, 380-390 (2010)[PubMed]
- Guitart, A. V., Subramani, C., Armesilla-Diaz, A. et al.: Hif-2α is not essential for cell-autonomous hematopoietic stem cell maintenance. Blood, 122, 1741-1745 (2013)[PubMed]
- Nombela-Arrieta, C., Pivarnik, G., Winkel, B. et al.: Quantitative imaging of haematopoietic stem and progenitor cell localization and hypoxic status in the bone marrow microenvironment. Nat. Cell Biol., 15, 533-543 (2013)[PubMed]
- Kim, M., Cooper, D. D., Hayes, S. F. et al.: Rhodamine-123 staining in hematopoietic stem cells of young mice indicates mitochondrial activation rather than dye efflux. Blood, 91, 4106-4117 (1998)[PubMed]
- Klimmeck, D., Hansson, J., Raffel, S. et al.: Proteomic cornerstones of hematopoietic stem cell differentiation: distinct signatures of multipotent progenitors and myeloid committed cells. Mol. Cell. Proteomics, 11, 286-302 (2012)[PubMed]
- Nakada, D., Saunders, T. L. & Morrison, S. J.: Lkb1 regulates cell cycle and energy metabolism in haematopoietic stem cells. Nature, 468, 653-658 (2010)[PubMed] [新着論文レビュー]
- Gurumurthy, S., Xie, S. Z., Alagesan, B. et al.: The Lkb1 metabolic sensor maintains haematopoietic stem cell survival. Nature, 468, 659-663 (2010)[PubMed]
- Gan, B., Hu, J., Jiang, S. et al.: Lkb1 regulates quiescence and metabolic homeostasis of haematopoietic stem cells. Nature, 468, 701-704 (2010)[PubMed]
- Sahin, E., Colla, S., Liesa, M. et al.: Telomere dysfunction induces metabolic and mitochondrial compromise. Nature, 470, 359-365 (2011)[PubMed]
- Figueroa, M. E., Abdel-Wahab, O., Lu, C. et al.: Leukemic IDH1 and IDH2 mutations result in a hypermethylation phenotype, disrupt TET2 function, and impair hematopoietic differentiation. Cancer Cell, 18, 553-567 (2010)[PubMed]
- Sasaki, M., Knobbe, C. B., Munger, J. C. et al.: IDH1(R132H) mutation increases murine haematopoietic progenitors and alters epigenetics. Nature, 488, 656-659 (2012)[PubMed]
- Koivunen, P., Lee, S., Duncan, C. G. et al.: Transformation by the (R)-enantiomer of 2-hydroxyglutarate linked to EGLN activation. Nature, 483, 484-488 (2012)[PubMed]
- Chen, C. T., Shih, Y. R., Kuo, T. K. et al.: Coordinated changes of mitochondrial biogenesis and antioxidant enzymes during osteogenic differentiation of human mesenchymal stem cells. Stem Cells, 26, 960-968 (2008)[PubMed]
- Pattappa, G., Heywood, H. K., de, Bruijn J. D. et al.: The metabolism of human mesenchymal stem cells during proliferation and differentiation. J. Cell. Physiol., 226, 2562-2570 (2011)[PubMed]
- Pattappa, G., Thorpe, S. D., Jegard, N. C. et al.: Continuous and uninterrupted oxygen tension influences the colony formation and oxidative metabolism of human mesenchymal stem cells. Tissue Eng. Part C. Methods, 19, 68-79 (2013)[PubMed]
- Mendez-Ferrer, S., Michurina, T. V., Ferraro, F. et al.: Mesenchymal and haematopoietic stem cells form a unique bone marrow niche. Nature, 466, 829-834 (2010)[PubMed]
- Wilson, J. E.: Isozymes of mammalian hexokinase: structure, subcellular localization and metabolic function. J. Exp. Biol., 206, 2049-2057 (2003)[PubMed]
- Yu, W. M., Liu, X., Shen, J. et al.: Metabolic regulation by the mitochondrial phosphatase PTPMT1 is required for hematopoietic stem cell differentiation. Cell Stem Cell, 12, 62-74 (2013)[PubMed]
- Owusu-Ansah, E. & Banerjee, U.: Reactive oxygen species prime Drosophila haematopoietic progenitors for differentiation. Nature, 461, 537-541 (2009)[PubMed]
- Takubo, K., Ohmura, M., Azuma, M. et al.: Stem cell defects in ATM-deficient undifferentiated spermatogonia through DNA damage-induced cell-cycle arrest. Cell Stem Cell, 2, 170-182 (2008)[PubMed]
- Morimoto, H., Iwata, K., Ogonuki, N. et al.: ROS are required for mouse spermatogonial stem cell self-renewal. Cell Stem Cell, 12, 774-786 (2013)[PubMed]
- Rossi, D. J., Jamieson, C. H. & Weissman, I. L.: Stems cells and the pathways to aging and cancer. Cell, 132, 681-696 (2008)[PubMed]
- Chen, C., Liu, Y., Liu, R. et al.: TSC-mTOR maintains quiescence and function of hematopoietic stem cells by repressing mitochondrial biogenesis and reactive oxygen species. J. Exp. Med., 205, 2397-2408 (2008)[PubMed]
- Chen, C., Liu, Y., Liu, Y. et al.: mTOR regulation and therapeutic rejuvenation of aging hematopoietic stem cells. Sci. Signal., 2, ra75 (2009)[PubMed]
著者プロフィール
略歴:2007年 慶應義塾大学大学院医学研究科 修了,慶應義塾大学医学部 助教を経て,2011年より同 専任講師.
研究テーマ:幹細胞とニッチとの相互作用と,その破綻の分子機構.
抱負:成体における幹細胞の解析を手がかりにして,難解な生命現象からシンプルな法則を見い出したい.
© 2013 田久保 圭誉 Licensed under CC 表示 2.1 日本