Ca2+/カルモジュリン依存性プロテインキナーゼIIとカルシニューリンによる神経入力の非線形的なデコード
2013/11/29
藤井 哉・尾藤晴彦
(東京大学大学院医学系研究科 神経生化学分野)
email:藤井 哉,尾藤晴彦
領域融合レビュー, 2, e014 (2013) DOI: 10.7875/leading.author.2.e014
Hajime Fujii & Haruhiko Bito: Nonlinear decoding of neuronal input information by Ca2+/calmodulin-dependent protein kinase II and Calcineurin.

神経系においてシナプスは活動電位から生化学反応へと情報を変換することにより,記憶や学習などの脳の機能において重要な役割をはたしている.この変換の過程を解析するため,単一のシナプスを異なる頻度および回数で刺激し2つの酵素の活性をリアルタイムで観察するdFOMAイメージング法を開発した.この方法により,Ca2+/カルモジュリン依存性プロテインキナーゼIIとカルシニューリンは刺激の頻度および回数に対し異なる応答特性をもつことを明らかにし,この異なる特性を組み合わせた情報処理の機構が示唆された.
おもしろいか,つまらないか? いま,読者の頭のなかでは,このレビューを最後まで読むかどうかを判断していることであろう.このように,生物は時々刻々と変化してゆく環境から重要な情報を抽出し,意思決定と反応(行動)をつうじて適応している.こうした情報処理は,脳部位,神経ネットワーク,ニューロン,シナプスといったさまざまなレベルにおいて起こる,生物にとり生存や生殖の成功にかかわる重要な機能である.たとえば,シナプスでは,入力(この場合は,電気刺激やグルタミン酸による刺激など)の頻度や回数(これが,神経活動にコードされた情報である)に応じ,さまざまな細胞内シグナル分子による生化学反応をつうじて,受容体の数やシナプスの形態を変化させていることがわかっている1-3).つまり,シナプスではさまざまな分子が化学反応を起こして入力のパラメーターを抽出し,そのパラメーターに応じた細胞の応答へと変える一種の情報処理を行っているのである.ここでは,こうした情報処理の過程を分子や細胞のレベルからボトムアップのアプローチにより理解するため,ニューロンおよびシナプスにおけるCa2+シグナル伝達系による情報処理に注目する.そして,情報の媒体とコード,シナプスにおける生化学反応の特殊性,技術的な側面(光による操作および顕微鏡イメージング)について述べ,筆者らによる,シナプスにおける複数のCa2+依存的な酵素の活性の可視化による情報処理の過程の研究について解説する.
“Information is physical”という言葉が示すとおり,情報にはそれを表現する媒体(メディア)が必要であり,その情報を読み出すためには,どのように情報が格納されているかというコードの方式を知ることが重要である.たとえば,この文章はサーバーのハードディスクの磁気媒体に01の配列の状態でコードされ,その配列がインターネットを介して読者のもとに届き,パソコンにおいてふたたび01から文字へとデコードされディスプレイに表示されることにより読むことができる.分子生物学においては,遺伝情報の媒体(DNA)の同定とコードの解読(コドン表の完成)を皮切りに膨大な知識が得られてきたことはいうまでもないだろう.
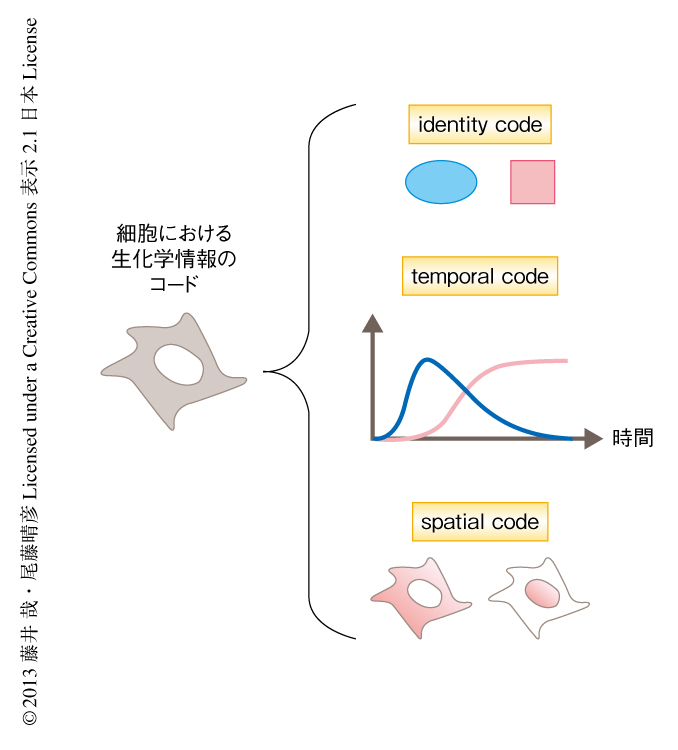
細胞のレベルにおいては,細胞内の生化学反応が細胞外からのシグナルやその細胞のさまざまな状態を表現する媒体である.では,そのなかに情報はどのようにコードされているのだろうか? 生化学反応には大まかに3種類のコードの方式があると考えられる(図1).
もっとも単純なのはidentity codeで,分子の種類や組合せがひとつの情報を伝えるものである.たとえば,誘引物質や忌避物質などはその分子自体でひとつの情報を表現する.また,DNAからタンパク質が生合成される過程において3つの塩基の配列により1つのアミノ酸を指定する遺伝コードも,順列によるidentity codeと考えることができる.
2つ目はtemporal codeで,分子の濃度や活性の時間的な変化(振幅,期間,周波数など)に情報をコードする方法であり4),たとえば,Ca2+シグナルはその持続時間や濃度の振動周期により異なる生理的な意味をもつこと5),MAPキナーゼは活性化の持続時間により増殖あるいは分化という異なる細胞の応答をひき起こす情報をコードすることがわかっている.
3つ目はspatial code,すなわち,分子の濃度や活性の空間的な分布の変化である.たとえば,発生の過程ではモルフォゲンの濃度勾配により個体における位置情報がコードされる.また,細胞内のマイクロドメインやコンパートメントなどの区画における分子の活性化は,ほかの区画における活性化とは細胞における“意味”が異なる.
生化学反応をこの3つの視点から解析することが,生物による情報処理を理解するための第一歩である.とくに,分子生物学の発展により遺伝子やタンパク質が網羅的に同定されidentity codeの実態が解明されている現代の生命科学においては,temporal codeおよびspatial codeの解読こそが,これまでかくされていた生命の動作原理をひもとくうえで非常に重要な意味をもつだろう.
これまでの酵素学的な実験の多くは,試験管のなかで酵素と基質を反応させ,生成物をオートラジオグラフィーなどで定量することにより行われてきた.このようなin vitro再構築系における生化学反応は,よくかくはんされた均一な溶液における反応である6).また,精製された酵素および基質を用いることにより,反応にかかわる分子種を限定することができ,反応の方向性を制御することは容易である.こうした再構築系においてMichaelis定数やHill係数を測定することがひとつの理解のしかたであった.
しかし,シナプスにおける生化学反応は,この試験管における反応とは異なる特徴をもつ.たとえば,シナプスは直径が約1マイクロメートル,体積が約1フェムトリットル(フェムトは,10-15)という大きさである.長さの比率で考えると,人間のからだ(約175 cm)からみたシナプスの大きさは,なんと,日本列島(約3000 km)からみた人間の大きさほどでしかない.こうした微小体積のシナプスに存在する遊離のCa2+は数個にすぎず,その数の少数性と変動性から,その反応はよくかくはんされた均一な溶液におけるものとは異なると考えられる7,8).また,シナプスにおいては膜の表面の受容体を中心に足場タンパク質や細胞骨格,シグナル伝達タンパク質が複雑に相互作用した複合体が形成されていて,分子の局在は非常にかたよっており9),この相互作用により複雑なフィードバックループあるいはフィードフォワードループが形成され時空間的に非常にダイナミックかつ不均一な生化学反応が制御されていると考えられる.よって,試験管内の再構築系だけでなく,実際のシナプスにおいて生化学反応を測定することが重要であると考えられる.
こうした生化学反応の直接的な測定を可能にしたのが顕微鏡によるイメージング技術である.近年のハードウェア(顕微鏡),サンプル(プローブや生体試料),ソフトウェア(制御法や解析法)の発展により,生命現象が時々刻々と変化していくようすが解析の対象となっている.とくに,GFP(green fluorecent protein,緑色蛍光タンパク質)の発見と応用により,さまざまなタンパク質の挙動を生きた細胞において観察することができるようになった.また,単なる分子の局在や動態だけでなく,FRETを用いて細胞におけるさまざまな生化学反応の可視化もできるようになった.
FRET(Fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)とは,励起状態にある分子(ドナー)から,ほかの分子(アクセプター)へとそのエネルギーが移動する現象であり,どのくらいのエネルギーが移動するか(FRET効率)は,ドナーとアクセプターとの距離や角度,および,ドナーの蛍光スペクトルとアクセプターの吸収スペクトルとの重なりにより決まる.異なる2色の蛍光タンパク質のあいだでFRETを起こすことにより,タンパク質間の相互作用や細胞内シグナル伝達を可視化することのできるプローブが開発された10).たとえば,Ca2+インジケーターであるCameleonは,ドナーとアクセプターとのあいだにはさまれたカルモジュリンがCa2+と結合すると,その標的であるM13と結合することによりプローブ全体のコンフォメーションが変化し,ドナーとアクセプターとのあいだの距離や角度が変化することによりそれらの蛍光強度の比が変化する11)(図2).ドナーとアクセプターの蛍光強度の比をとることによりCa2+の濃度を定量することができ,プローブの濃度が不均一な細胞においても活性化の度合いを定量することができる.これまで,Ca2+だけでなく,cAMP,cGMP,ホスファチジルイノシトールリン酸などのセカンドメッセンジャー,酵素活性,タンパク質間の相互作用など,FRETを用いたさまざまなプローブが作製されており12),現在も,さまざまな生命現象のうらにある細胞内シグナル伝達の動態が解明されつつある.
FRETを用いてたんに生化学反応を観察するだけでなく,生化学反応を細胞の任意の場所で意図した時点において直接的に操作する方法があれば,生化学反応の情報処理に対してさまざまな介入を行う実験が可能になる.
2005年にチャネルロドプシンの応用が発表されて以来,光に感受性のあるイオンチャネルやイオンポンプを用いてニューロンの活動を活性化あるいは抑制する光遺伝学(optogenetics)が可能になり,現在では,非常によく用いられる新たなツールとなっている.とくに,細胞に特異的な遺伝子プロモーターやウイルスによる局所的な遺伝子導入と組み合わせ,さまざまなニューロンや神経回路の機能をin vivoにおいて検討する実験が多く行われている13).また,神経活動だけでなく,光に感受性のドメインを用いることにより細胞内シグナル伝達の制御も可能になっており,こうした光による操作はオンとオフの時間分解能が高く可逆的であるため,生体における情報処理の解析においてますます重要度があがっている.
一方で,シナプスひとつひとつを光により操作する技術も開発されている.とくに,ケージド化合物に対する光融解法では,保護基により不活性な状態におかれているケージド化合物に対し,光を照射することで保護基を脱離させることにより,非常に小さな領域に限局して化合物を活性化し単一のシナプスを刺激することが可能である.たとえば,二光子顕微鏡によるグルタミン酸の光融解法によりシナプスに存在するAMPA型グルタミン酸受容体の局在がマッピングされ14),ひとつひとつのシナプスにおいて個別に長期増強を誘導することが可能であることが示された15).また,二光子励起による光融解法とFRETを用いた測定を組み合わせることにより,長期増強のときの細胞内シグナル伝達が可視化された16,17).
現在もこうした光操作とFRETイメージング法との融合は進んでおり,今後,シグナル伝達の研究においてますます重要度が増すものと思われる.しかしながら,これまでの方法は1種類のシグナルの活性化しか可視化することができなかったため,酵素のあいだでの相互作用,あるいは,個々のシナプスにおける変動などを調べることができなかった.シナプスにおいて複数の分子がネットワークを形成して情報を処理する過程を解析するために,単一のシナプスを刺激しつつ複数の酵素の活性を測定する方法の開発が待たれてきた.
筆者らは,こうした背景から,2つのFRETプローブからのシグナルを同時に可視化するデュアルFRETイメージング法と光融解法とを組み合わせたdFOMA法(dual FRET imaging with optical manipulation)を開発した18).これまで,世界中のさまざまなグループにより,それぞれ独自のデュアルFRETイメージング法が開発されてきたが19),3~4種類の蛍光タンパク質から蛍光シグナルを分離するために4波長の測定など複雑な光学系が必要であり,簡便性や汎用性といった点で難があった.また,デュアルFRETイメージング法のコンセプト自体はだされていたものの,生物学的な研究には十分には応用されていなかった.このような背景から,2つのFRETプローブからのシグナルをより簡便に分離することのできる,新たなデュアルFRETイメージング法の開発が待ち望まれていたのである.
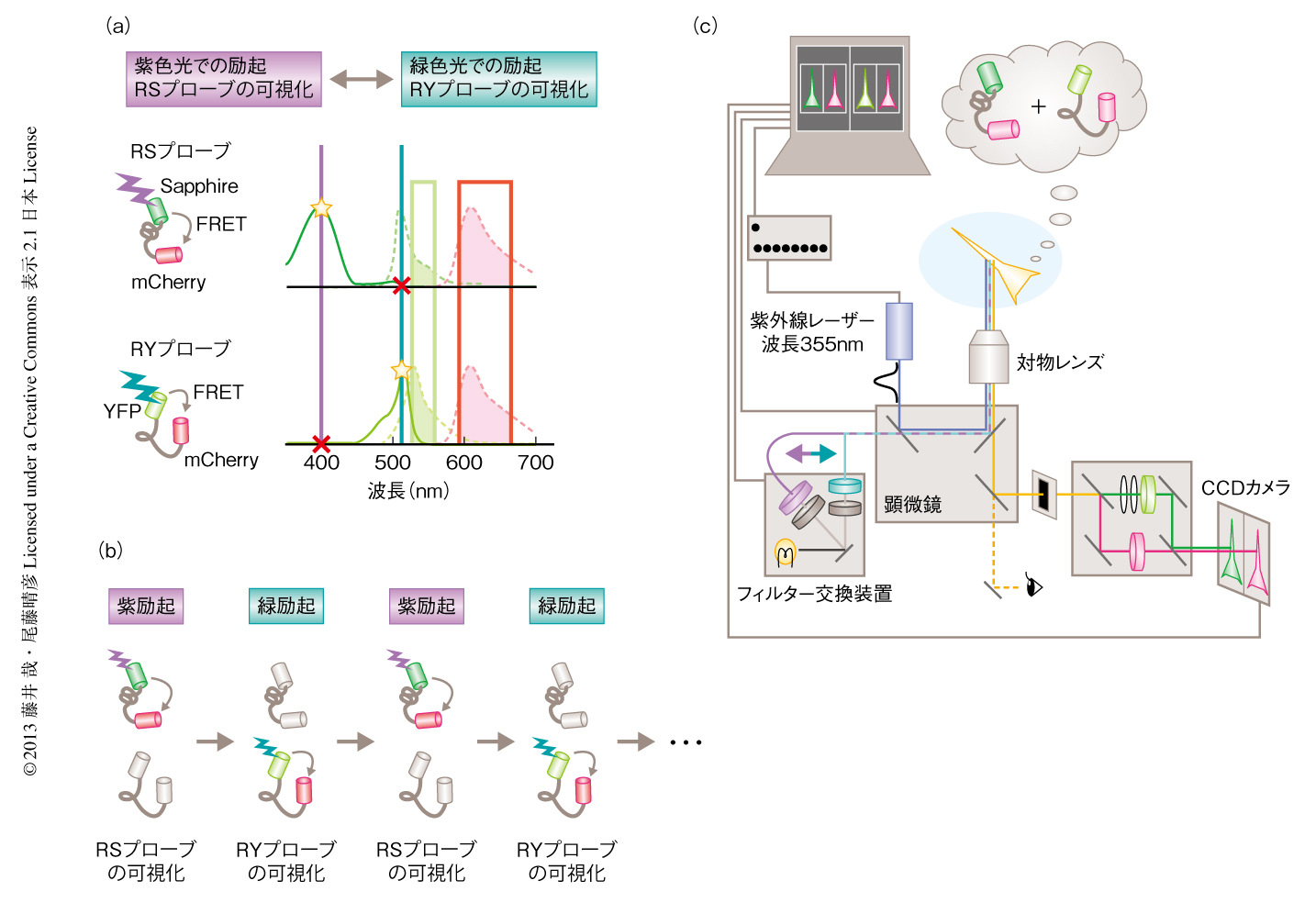
dFOMA法は,これまでよく用いられてきた蛍光スペクトルの違いではなく,励起スペクトルの違いによりシグナルを分離することで,より簡便に2つのFRETプローブからのシグナルを測定する方法として考案された.このために,近年,開発されたさまざまな励起スペクトルおよび蛍光スペクトルをもつ蛍光タンパク質を用いて,新たなFRETプローブのペアによるデュアルFRETイメージング法を開発した20).以下,2つのFRETプローブからのシグナルを分離する原理を簡単に説明する.1つ目のプローブはSapphire(ストークスシフトの大きいGFP変異体)をドナー,mCherry(明るいタイプのmRFP)をアクセプターとし,2つ目のプローブはYFPをドナー,mCherryをアクセプターとした20-22)(図3a).2つのプローブのドナーおよびアクセプターはよく似た蛍光スペクトルをもつため,それらの分離はむずかしそうに思えるが,励起スペクトルの違いを用いることでこれらを簡単に分離することができる.1つ目のプローブのドナーであるSapphireは波長405 nm付近の紫色の光で励起され,波長514 nm付近の緑色の光では励起されない.一方,2つ目のプローブのドナーであるYFPは波長405 nm付近の紫色の光では励起されないが,波長514 nm付近の緑色の光で励起され,これはちょうどSapphireとは相補的である.よって,紫色の光と緑色の光でそれぞれのプローブを交互に励起し,2つの蛍光チャネルにより測定すれば,2つのFRETプローブを可視化することができる(図3b).交互に2つのプローブを観察するという点において完全な同時計測ではないが,励起波長の切り替えが計測したい現象よりも十分に速ければ,2つのFRETシグナルを比較することは十分に可能である.また,紫外領域の励起光を用いないため,紫外光レーザーを用いた光融解法による局所の刺激も可能である.このように,dFOMA法は測定光学系が2波長での励起に対する2波長での測定と単純なので(図3c),蛍光顕微鏡のほか共焦点顕微鏡やプレートリーダーなどのハイスループットな計測系にも応用が容易であり,今後,さまざまなアプリケーションに応用されていくものと考えられる.
具体例として,筆者らが,このdFOMA法を用いて行った,Ca2+/カルモジュリン依存性プロテインキナーゼIIαとカルシニューリンによる神経入力の情報処理の過程の解析について紹介する18).
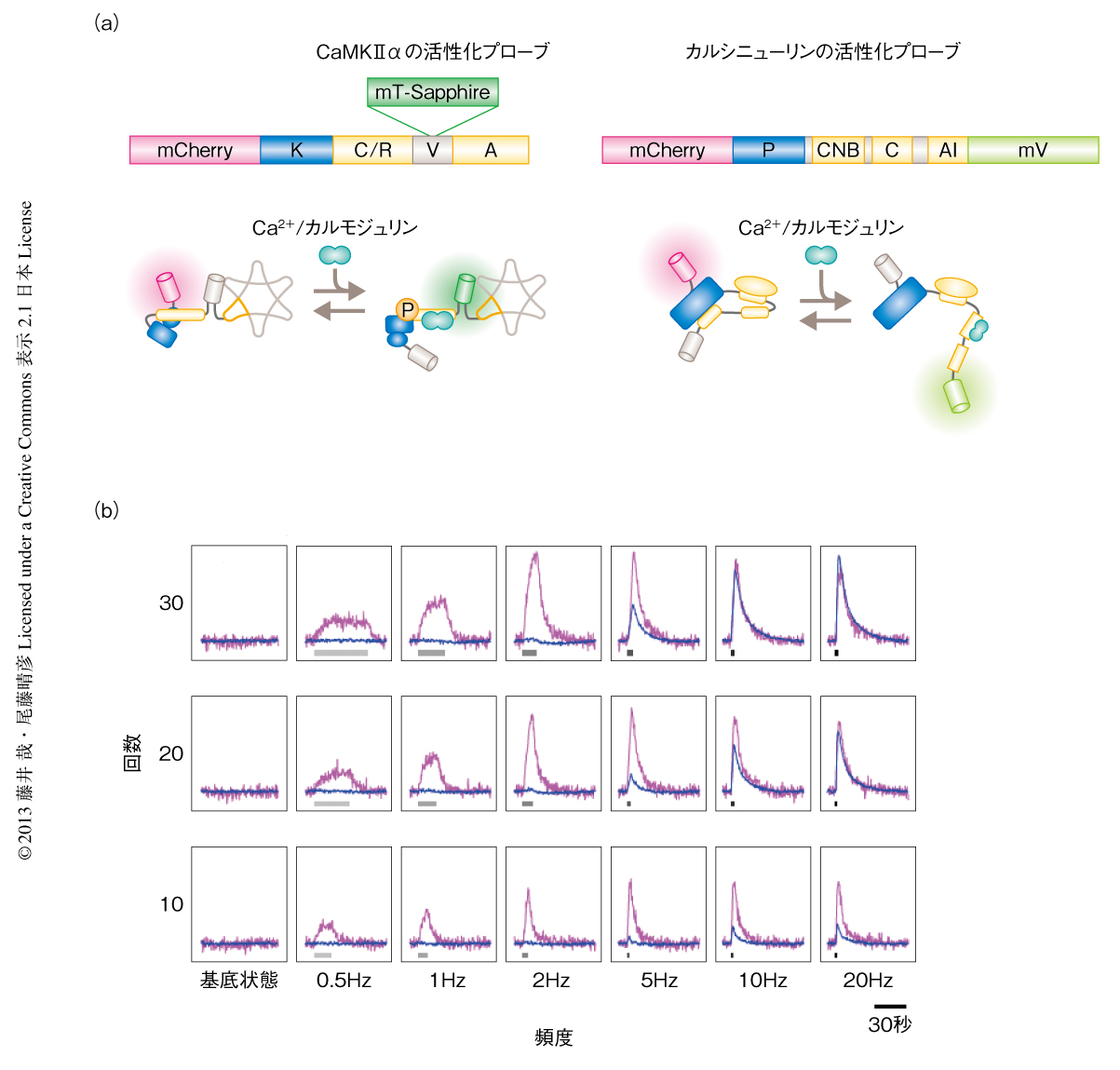
ニューロンやシナプスにおいてCa2+シグナル伝達のエフェクターとして中心的な役割をはたすリン酸化酵素および脱リン酸化酵素が,Ca2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンである.どちらの酵素も,遺伝子改変マウスを用いた行動の解析,電気生理学的な解析,薬理学的な解析などから,シナプスの可塑性と記憶および学習に重要な役割をはたすことが示されてきた.とくに,Ca2+/カルモジュリン依存性プロテインキナーゼIIはCa2+濃度の形成するパルスのtemporal code(頻度)を読み解くことのできる性質をもつことがin vitroにおいて示されており23),実際のシナプスにおいて入力情報を読み解くしくみの解明が待たれていた.どちらの酵素もCa2+濃度が十分に低く,Ca2+/カルモジュリンが結合していない状態では自己抑制ドメインにより酵素活性が抑制されているが,Ca2+/カルモジュリンが結合するとコンフォメーションが変化し,この抑制がはずれて酵素反応は活性化する.この活性化にともなうコンフォメーションの変化をFRETシグナルの変化として検出することのできるCa2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンのFRETプローブを開発した(図4a).Ca2+/カルモジュリン依存性プロテインキナーゼIIαのFRETプローブとしては,mCherryをN末端に,mT-Sapphireを可変ドメインに挿入したプローブを開発した.in vitroにおける実験から,Ca2+/カルモジュリン依存性プロテインキナーゼIIαに対するこのFRETプローブのシグナルは酵素活性と定量的に相関すること,変異体や阻害剤による実験によりCa2+/カルモジュリンの結合および自己リン酸化によりFRETシグナルが変化することが明らかになった.とくに,自己リン酸化によりFRETシグナルが変化することから,このFRETプローブがCa2+ではなく,Ca2+/カルモジュリン依存性プロテインキナーゼIIαの酵素活性のインジケーターとして機能していることが示された.こうしたFRETプローブの評価により,FRETによる酵素活性の測定における定量性が担保されると考えた.
ニューロンのあいだの情報伝達は,活動電位の全か無かの法則による発火と,それにともなうシナプス前終末からの神経伝達物質の放出により行われている.とくに,情報は活動電位の発火の頻度および回数によりコードされると考えられている.これが神経伝達物質と受容体の活性化をつうじて,後シナプスにおいて生化学反応として情報の媒体を変化させることになる.
こうしたニューロンにおける生化学反応による情報処理をどのように解析すればいいだろうか? 以下の順序で細胞内シグナル伝達による神経入力の情報処理の過程を検討した.1)刺激の入力をパラメトリックに変化させる(今回は,刺激の頻度を0.5~20 Hz,回数を10~30回のあいだで変動させた).2)細胞体におけるCa2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンの酵素反応の活性化のパターンを検出する.3)活性化パラメーターの抽出し入力パラメーターに対しプロットする.
グルタミン酸の光融解法を用いた単一のニューロンへの局所の刺激と,デュアルFRETイメージング法とを組み合わせて生化学反応による情報処理の過程を解析した.海馬培養ニューロンに対し,Ca2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンに対する2種類のFRETプローブを共発現し,光融解法によるグルタミン酸の刺激に対する酵素反応を測定した.まず,Ca2+/カルモジュリン依存性プロテインキナーゼIIαの酵素反応からみると,刺激の回数が少ないときはほとんど活性化が認められなかったが,回数が20回以上かつ頻度が5 Hz以上の刺激の場合には活性化が認められた(図4b).このことは,Ca2+/カルモジュリン依存性プロテインキナーゼIIαは刺激入力の頻度と回数の両方の情報をデコードする機能をもつことを示唆した.一方,カルシニューリンの酵素反応は低頻度の刺激の場合において頻度に依存した活性化がみられたが,5 Hz以上の頻度ではほとんど変わらず,刺激の回数に対する依存性は高かった.このことから,カルシニューリンは刺激入力の回数をデコードすることが示唆された.この2つの酵素のもつ応答特性の違いから,神経入力の情報コード(頻度および回数)から生化学反応(酵素反応の活性化のパターン)への変換の過程が,生きたニューロンにおいてはじめて明らかになった.
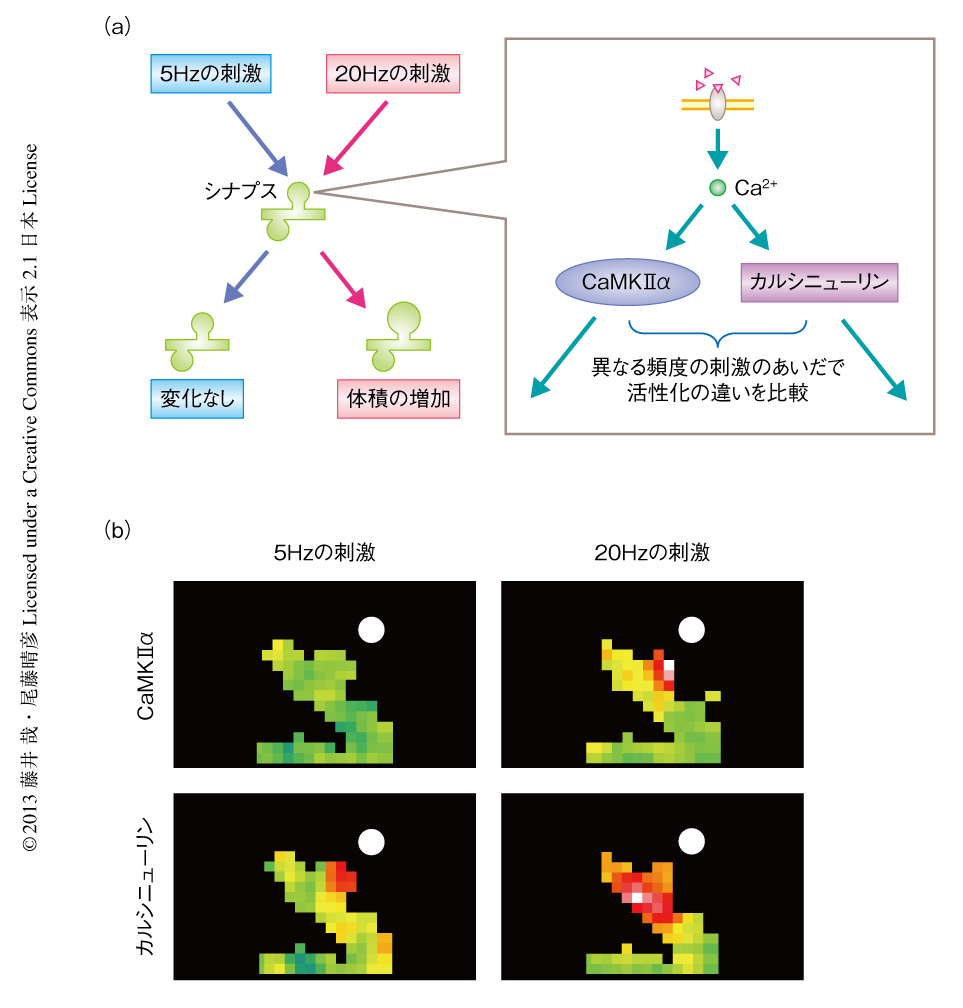
こうした神経入力の生化学反応によるデコードは,神経の機能としてどのように利用されているのだろうか? dFOMA法をさらに発展させ,単一のシナプスにおける刺激と,それに対するCa2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンの酵素反応の解析を行った.その結果,5 Hzの頻度の刺激に対しシナプスの形態に変化はみられなかったが,20 Hzの頻度の刺激に対してはシナプスの形態が大きくなった.この現象は構造的なシナプス可塑性として知られており,機能的なシナプス可塑性と相関することが明らかになっている15).この構造の変化を起こすかどうかを生化学反応はどのように決定しているかを知るため,5 Hzおよび20 Hzの頻度の刺激に対するCa2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンの単一のシナプスにおける酵素反応をdFOMA法により解析した.まず,シナプスの形態を観察するためmCherry単体を発現させ,光融解法によるグルタミン酸の単一のシナプスに対する刺激を低頻度(5 Hz,100回)および高頻度(20 Hz,100回)で行った.そうすると,5 Hzの頻度の刺激に対してはシナプスの形態は変わらなかったのに対して,20 Hzの頻度の刺激ではシナプスの大きさは大きくなった(図5a).このことから,シナプスにおける生化学反応により刺激入力の情報は読み解かれ,シナプスの形態の変化をひき起こすという情報処理が行われていることが示唆された.そこで,dFOMA法を用いて,Ca2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンの酵素反応の活性化を5 Hzと20 Hzの頻度の刺激のあいだで比較した.その結果,Ca2+/カルモジュリン依存性プロテインキナーゼIIαの酵素反応は5 Hzの頻度の刺激では活性化されないが,20 Hzの頻度の刺激では活性化が認められた(図5b).一方で,カルシニューリンは,5 Hzおよび20 Hzの頻度の刺激の両方でシナプスにおいて酵素反応の活性化が認められた一方,20 Hzの頻度の刺激に対しては樹状突起への活性の広がりがみられた.こうした酵素反応の活性化のパターンの違いの生理的な意義については今度の課題であるが,たとえば,カルシニューリンは樹状突起の内部におけるシグナル伝達により核へと情報を伝達している可能性が考えられる.Ca2+/カルモジュリン依存性プロテインキナーゼIIαとカルシニューリンの異なるデコードの特性により,神経入力の情報を読み解き,神経活動に依存的なさまざまな過程が制御されていることがわかった.
今後,dFOMA法を用いて,さらに樹状突起のなかでの生化学反応の演算の過程や,シナプスから核へと伝達されていくシグナルの実態が明らかになるものと期待される.
生体において“情報”がどのようにコードされているのかを理解することは,長いあいだ(そして,いま現在も)重要な研究課題である.ここで紹介した,筆者らの最近の研究は,神経入力,生化学反応,生理的な意義の関連性を実際のシナプスにおいて実証したものであり,ニューロンにおけるシステムを形成する遺伝子,神経活動,生化学反応の動的な情報統合の過程の理解に役だつものである.また,dFOMA法は,技術的にもさまざまな計測系への応用,とくに,ハイスループットな計測系における利用が期待されるほか,応用の観点からは,分子自体ではなく複数の細胞内シグナルのtemporal codeあるいはspatial codeを制御することにより効果を発揮するような薬剤の開発など,新たな創薬のコンセプトにつながる可能性がある.
今後の課題として,生化学情報システムからの生命の理解について3つの方向性をあげる.1つ目は,identity code,temporal code,spatial codeという別々のコードで表現された情報の統合の過程の理解である.このためには,網羅的かつハイスループットな計測,理論およびシミュレーションによる研究,合成生物学的なアプローチによる人工的な生化学システムの設計にくわえ,dFOMA法を応用して複数の分子によるtemporal codeとspatial codeとの相互作用を解明することが重要であると考えられる.こうした複数の分子のあいだの動的な相互作用の研究を進めることにより,生化学システムの上流から下流へのフローチャート的な現在の理解から,循環的なオートポイエーシス(autopoiesis)のような自己組織化像へと発展する可能性が秘められている.
2つ目は,生化学情報の処理ユニットの個性あるいは個体差の解明である.ヒトの脳の基礎代謝は約20ワットでしかなく,少数のニューロンの活動に情報の意味が効率的にコードされていると考えられている24).よって,シナプスにおける生化学システムについても,シナプス前細胞の発火の頻度によりその分子の構成や機能が制御されている可能性がある.dFOMA法は個々のシナプスにおける生化学反応をひとつひとつ分離して検討することができるので,シナプスごとの個体差(分子の構成だけでなく,動的な活性の違い)や,その機能的な意義についての解明が進むと期待される.
3つ目は,生化学情報の処理システムの設計や進化の過程の解明である.現代のわれわれにとりシナプスにおける生化学システムは既存のデファクトスタンダードであり,そもそも,なぜCa2+/カルモジュリン依存性プロテインキナーゼIIαとカルシニューリンの情報処理の特性に違いがなくてはならないか,その必然的な答えはない(その違いの機能的な意義や分子機構について研究することはできるが).しかし,この進化の過程をたどることにより,どのようにして現在のすがたに発展したのか,その拘束条件や進化的な意義を考察することはできる.近年では,比較進化学的な研究により,シナプスにおける生化学システムのパーツの進化の過程や,細胞における分子の局在の進化的な意味あいが解明されている25,26).こうした比較進化的な視点を顕微鏡イメージングにとりいれ,進化による構成分子の追加あるいは欠失や,変異により細胞における情報コード自体あるいはその意味がどのように変化してきたのかを研究することは,生化学情報の処理システムの設計思想や進化学的な意味の理解につながると考えられる.とくに,dFOMA法は同一の条件をとる同一の細胞において,2つの種からのオーソログ,あるいは,同一の種の2つのパラログの遺伝子産物の活性を比較検討することが可能であるので,そうした比較による情報コードの進化についての研究への応用が期待される.
今後,こうした研究をとおして,個々の分子と生化学反応との集合体がどのように統合されて全体として生命というシステムを構築しているのか,その理解に少しずつ進んでいくことが期待される.
略歴:2008年 東京大学大学院医学系研究科 修了,同年 同 特任研究員を経て,2012年より同 特任助教(現 助教).
抱負:生物のなかで情報を実験的にどのように定義すればよいか,情報により物質と生命のあいだをつなぐことが可能なのか,日々考えながら試行錯誤をくり返している.脳,遺伝子,社会・文化に表現された情報がどのように相互作用して生命システムをつくりあげているのか,その実態にせまってゆきたい.テニスとビールと温泉が好きな関西人.蛍光タンパク質の情報サイト“I love GFP”(URL:https://sites.google.com/site/ilovegfp/)を随時更新中.
尾藤 晴彦(Haruhiko Bito)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.neurochem.m.u-tokyo.ac.jp/
© 2013 藤井 哉・尾藤晴彦 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 神経生化学分野)
email:藤井 哉,尾藤晴彦
領域融合レビュー, 2, e014 (2013) DOI: 10.7875/leading.author.2.e014
Hajime Fujii & Haruhiko Bito: Nonlinear decoding of neuronal input information by Ca2+/calmodulin-dependent protein kinase II and Calcineurin.
要 約
神経系においてシナプスは活動電位から生化学反応へと情報を変換することにより,記憶や学習などの脳の機能において重要な役割をはたしている.この変換の過程を解析するため,単一のシナプスを異なる頻度および回数で刺激し2つの酵素の活性をリアルタイムで観察するdFOMAイメージング法を開発した.この方法により,Ca2+/カルモジュリン依存性プロテインキナーゼIIとカルシニューリンは刺激の頻度および回数に対し異なる応答特性をもつことを明らかにし,この異なる特性を組み合わせた情報処理の機構が示唆された.
はじめに
おもしろいか,つまらないか? いま,読者の頭のなかでは,このレビューを最後まで読むかどうかを判断していることであろう.このように,生物は時々刻々と変化してゆく環境から重要な情報を抽出し,意思決定と反応(行動)をつうじて適応している.こうした情報処理は,脳部位,神経ネットワーク,ニューロン,シナプスといったさまざまなレベルにおいて起こる,生物にとり生存や生殖の成功にかかわる重要な機能である.たとえば,シナプスでは,入力(この場合は,電気刺激やグルタミン酸による刺激など)の頻度や回数(これが,神経活動にコードされた情報である)に応じ,さまざまな細胞内シグナル分子による生化学反応をつうじて,受容体の数やシナプスの形態を変化させていることがわかっている1-3).つまり,シナプスではさまざまな分子が化学反応を起こして入力のパラメーターを抽出し,そのパラメーターに応じた細胞の応答へと変える一種の情報処理を行っているのである.ここでは,こうした情報処理の過程を分子や細胞のレベルからボトムアップのアプローチにより理解するため,ニューロンおよびシナプスにおけるCa2+シグナル伝達系による情報処理に注目する.そして,情報の媒体とコード,シナプスにおける生化学反応の特殊性,技術的な側面(光による操作および顕微鏡イメージング)について述べ,筆者らによる,シナプスにおける複数のCa2+依存的な酵素の活性の可視化による情報処理の過程の研究について解説する.
1.情報の媒体とコードの方式
“Information is physical”という言葉が示すとおり,情報にはそれを表現する媒体(メディア)が必要であり,その情報を読み出すためには,どのように情報が格納されているかというコードの方式を知ることが重要である.たとえば,この文章はサーバーのハードディスクの磁気媒体に01の配列の状態でコードされ,その配列がインターネットを介して読者のもとに届き,パソコンにおいてふたたび01から文字へとデコードされディスプレイに表示されることにより読むことができる.分子生物学においては,遺伝情報の媒体(DNA)の同定とコードの解読(コドン表の完成)を皮切りに膨大な知識が得られてきたことはいうまでもないだろう.
細胞のレベルにおいては,細胞内の生化学反応が細胞外からのシグナルやその細胞のさまざまな状態を表現する媒体である.では,そのなかに情報はどのようにコードされているのだろうか? 生化学反応には大まかに3種類のコードの方式があると考えられる(図1).
もっとも単純なのはidentity codeで,分子の種類や組合せがひとつの情報を伝えるものである.たとえば,誘引物質や忌避物質などはその分子自体でひとつの情報を表現する.また,DNAからタンパク質が生合成される過程において3つの塩基の配列により1つのアミノ酸を指定する遺伝コードも,順列によるidentity codeと考えることができる.
2つ目はtemporal codeで,分子の濃度や活性の時間的な変化(振幅,期間,周波数など)に情報をコードする方法であり4),たとえば,Ca2+シグナルはその持続時間や濃度の振動周期により異なる生理的な意味をもつこと5),MAPキナーゼは活性化の持続時間により増殖あるいは分化という異なる細胞の応答をひき起こす情報をコードすることがわかっている.
3つ目はspatial code,すなわち,分子の濃度や活性の空間的な分布の変化である.たとえば,発生の過程ではモルフォゲンの濃度勾配により個体における位置情報がコードされる.また,細胞内のマイクロドメインやコンパートメントなどの区画における分子の活性化は,ほかの区画における活性化とは細胞における“意味”が異なる.
生化学反応をこの3つの視点から解析することが,生物による情報処理を理解するための第一歩である.とくに,分子生物学の発展により遺伝子やタンパク質が網羅的に同定されidentity codeの実態が解明されている現代の生命科学においては,temporal codeおよびspatial codeの解読こそが,これまでかくされていた生命の動作原理をひもとくうえで非常に重要な意味をもつだろう.
2.シナプスにおける生化学反応の特殊性
これまでの酵素学的な実験の多くは,試験管のなかで酵素と基質を反応させ,生成物をオートラジオグラフィーなどで定量することにより行われてきた.このようなin vitro再構築系における生化学反応は,よくかくはんされた均一な溶液における反応である6).また,精製された酵素および基質を用いることにより,反応にかかわる分子種を限定することができ,反応の方向性を制御することは容易である.こうした再構築系においてMichaelis定数やHill係数を測定することがひとつの理解のしかたであった.
しかし,シナプスにおける生化学反応は,この試験管における反応とは異なる特徴をもつ.たとえば,シナプスは直径が約1マイクロメートル,体積が約1フェムトリットル(フェムトは,10-15)という大きさである.長さの比率で考えると,人間のからだ(約175 cm)からみたシナプスの大きさは,なんと,日本列島(約3000 km)からみた人間の大きさほどでしかない.こうした微小体積のシナプスに存在する遊離のCa2+は数個にすぎず,その数の少数性と変動性から,その反応はよくかくはんされた均一な溶液におけるものとは異なると考えられる7,8).また,シナプスにおいては膜の表面の受容体を中心に足場タンパク質や細胞骨格,シグナル伝達タンパク質が複雑に相互作用した複合体が形成されていて,分子の局在は非常にかたよっており9),この相互作用により複雑なフィードバックループあるいはフィードフォワードループが形成され時空間的に非常にダイナミックかつ不均一な生化学反応が制御されていると考えられる.よって,試験管内の再構築系だけでなく,実際のシナプスにおいて生化学反応を測定することが重要であると考えられる.
3.FRETを用いた生細胞における生化学反応の可視化
こうした生化学反応の直接的な測定を可能にしたのが顕微鏡によるイメージング技術である.近年のハードウェア(顕微鏡),サンプル(プローブや生体試料),ソフトウェア(制御法や解析法)の発展により,生命現象が時々刻々と変化していくようすが解析の対象となっている.とくに,GFP(green fluorecent protein,緑色蛍光タンパク質)の発見と応用により,さまざまなタンパク質の挙動を生きた細胞において観察することができるようになった.また,単なる分子の局在や動態だけでなく,FRETを用いて細胞におけるさまざまな生化学反応の可視化もできるようになった.
FRET(Fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)とは,励起状態にある分子(ドナー)から,ほかの分子(アクセプター)へとそのエネルギーが移動する現象であり,どのくらいのエネルギーが移動するか(FRET効率)は,ドナーとアクセプターとの距離や角度,および,ドナーの蛍光スペクトルとアクセプターの吸収スペクトルとの重なりにより決まる.異なる2色の蛍光タンパク質のあいだでFRETを起こすことにより,タンパク質間の相互作用や細胞内シグナル伝達を可視化することのできるプローブが開発された10).たとえば,Ca2+インジケーターであるCameleonは,ドナーとアクセプターとのあいだにはさまれたカルモジュリンがCa2+と結合すると,その標的であるM13と結合することによりプローブ全体のコンフォメーションが変化し,ドナーとアクセプターとのあいだの距離や角度が変化することによりそれらの蛍光強度の比が変化する11)(図2).ドナーとアクセプターの蛍光強度の比をとることによりCa2+の濃度を定量することができ,プローブの濃度が不均一な細胞においても活性化の度合いを定量することができる.これまで,Ca2+だけでなく,cAMP,cGMP,ホスファチジルイノシトールリン酸などのセカンドメッセンジャー,酵素活性,タンパク質間の相互作用など,FRETを用いたさまざまなプローブが作製されており12),現在も,さまざまな生命現象のうらにある細胞内シグナル伝達の動態が解明されつつある.
4.光による操作
FRETを用いてたんに生化学反応を観察するだけでなく,生化学反応を細胞の任意の場所で意図した時点において直接的に操作する方法があれば,生化学反応の情報処理に対してさまざまな介入を行う実験が可能になる.
2005年にチャネルロドプシンの応用が発表されて以来,光に感受性のあるイオンチャネルやイオンポンプを用いてニューロンの活動を活性化あるいは抑制する光遺伝学(optogenetics)が可能になり,現在では,非常によく用いられる新たなツールとなっている.とくに,細胞に特異的な遺伝子プロモーターやウイルスによる局所的な遺伝子導入と組み合わせ,さまざまなニューロンや神経回路の機能をin vivoにおいて検討する実験が多く行われている13).また,神経活動だけでなく,光に感受性のドメインを用いることにより細胞内シグナル伝達の制御も可能になっており,こうした光による操作はオンとオフの時間分解能が高く可逆的であるため,生体における情報処理の解析においてますます重要度があがっている.
一方で,シナプスひとつひとつを光により操作する技術も開発されている.とくに,ケージド化合物に対する光融解法では,保護基により不活性な状態におかれているケージド化合物に対し,光を照射することで保護基を脱離させることにより,非常に小さな領域に限局して化合物を活性化し単一のシナプスを刺激することが可能である.たとえば,二光子顕微鏡によるグルタミン酸の光融解法によりシナプスに存在するAMPA型グルタミン酸受容体の局在がマッピングされ14),ひとつひとつのシナプスにおいて個別に長期増強を誘導することが可能であることが示された15).また,二光子励起による光融解法とFRETを用いた測定を組み合わせることにより,長期増強のときの細胞内シグナル伝達が可視化された16,17).
現在もこうした光操作とFRETイメージング法との融合は進んでおり,今後,シグナル伝達の研究においてますます重要度が増すものと思われる.しかしながら,これまでの方法は1種類のシグナルの活性化しか可視化することができなかったため,酵素のあいだでの相互作用,あるいは,個々のシナプスにおける変動などを調べることができなかった.シナプスにおいて複数の分子がネットワークを形成して情報を処理する過程を解析するために,単一のシナプスを刺激しつつ複数の酵素の活性を測定する方法の開発が待たれてきた.
5.dFOMAイメージング法の開発
筆者らは,こうした背景から,2つのFRETプローブからのシグナルを同時に可視化するデュアルFRETイメージング法と光融解法とを組み合わせたdFOMA法(dual FRET imaging with optical manipulation)を開発した18).これまで,世界中のさまざまなグループにより,それぞれ独自のデュアルFRETイメージング法が開発されてきたが19),3~4種類の蛍光タンパク質から蛍光シグナルを分離するために4波長の測定など複雑な光学系が必要であり,簡便性や汎用性といった点で難があった.また,デュアルFRETイメージング法のコンセプト自体はだされていたものの,生物学的な研究には十分には応用されていなかった.このような背景から,2つのFRETプローブからのシグナルをより簡便に分離することのできる,新たなデュアルFRETイメージング法の開発が待ち望まれていたのである.
dFOMA法は,これまでよく用いられてきた蛍光スペクトルの違いではなく,励起スペクトルの違いによりシグナルを分離することで,より簡便に2つのFRETプローブからのシグナルを測定する方法として考案された.このために,近年,開発されたさまざまな励起スペクトルおよび蛍光スペクトルをもつ蛍光タンパク質を用いて,新たなFRETプローブのペアによるデュアルFRETイメージング法を開発した20).以下,2つのFRETプローブからのシグナルを分離する原理を簡単に説明する.1つ目のプローブはSapphire(ストークスシフトの大きいGFP変異体)をドナー,mCherry(明るいタイプのmRFP)をアクセプターとし,2つ目のプローブはYFPをドナー,mCherryをアクセプターとした20-22)(図3a).2つのプローブのドナーおよびアクセプターはよく似た蛍光スペクトルをもつため,それらの分離はむずかしそうに思えるが,励起スペクトルの違いを用いることでこれらを簡単に分離することができる.1つ目のプローブのドナーであるSapphireは波長405 nm付近の紫色の光で励起され,波長514 nm付近の緑色の光では励起されない.一方,2つ目のプローブのドナーであるYFPは波長405 nm付近の紫色の光では励起されないが,波長514 nm付近の緑色の光で励起され,これはちょうどSapphireとは相補的である.よって,紫色の光と緑色の光でそれぞれのプローブを交互に励起し,2つの蛍光チャネルにより測定すれば,2つのFRETプローブを可視化することができる(図3b).交互に2つのプローブを観察するという点において完全な同時計測ではないが,励起波長の切り替えが計測したい現象よりも十分に速ければ,2つのFRETシグナルを比較することは十分に可能である.また,紫外領域の励起光を用いないため,紫外光レーザーを用いた光融解法による局所の刺激も可能である.このように,dFOMA法は測定光学系が2波長での励起に対する2波長での測定と単純なので(図3c),蛍光顕微鏡のほか共焦点顕微鏡やプレートリーダーなどのハイスループットな計測系にも応用が容易であり,今後,さまざまなアプリケーションに応用されていくものと考えられる.
6.Ca2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンの活性化を測定するFRETプローブの作製
具体例として,筆者らが,このdFOMA法を用いて行った,Ca2+/カルモジュリン依存性プロテインキナーゼIIαとカルシニューリンによる神経入力の情報処理の過程の解析について紹介する18).
ニューロンやシナプスにおいてCa2+シグナル伝達のエフェクターとして中心的な役割をはたすリン酸化酵素および脱リン酸化酵素が,Ca2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンである.どちらの酵素も,遺伝子改変マウスを用いた行動の解析,電気生理学的な解析,薬理学的な解析などから,シナプスの可塑性と記憶および学習に重要な役割をはたすことが示されてきた.とくに,Ca2+/カルモジュリン依存性プロテインキナーゼIIはCa2+濃度の形成するパルスのtemporal code(頻度)を読み解くことのできる性質をもつことがin vitroにおいて示されており23),実際のシナプスにおいて入力情報を読み解くしくみの解明が待たれていた.どちらの酵素もCa2+濃度が十分に低く,Ca2+/カルモジュリンが結合していない状態では自己抑制ドメインにより酵素活性が抑制されているが,Ca2+/カルモジュリンが結合するとコンフォメーションが変化し,この抑制がはずれて酵素反応は活性化する.この活性化にともなうコンフォメーションの変化をFRETシグナルの変化として検出することのできるCa2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンのFRETプローブを開発した(図4a).Ca2+/カルモジュリン依存性プロテインキナーゼIIαのFRETプローブとしては,mCherryをN末端に,mT-Sapphireを可変ドメインに挿入したプローブを開発した.in vitroにおける実験から,Ca2+/カルモジュリン依存性プロテインキナーゼIIαに対するこのFRETプローブのシグナルは酵素活性と定量的に相関すること,変異体や阻害剤による実験によりCa2+/カルモジュリンの結合および自己リン酸化によりFRETシグナルが変化することが明らかになった.とくに,自己リン酸化によりFRETシグナルが変化することから,このFRETプローブがCa2+ではなく,Ca2+/カルモジュリン依存性プロテインキナーゼIIαの酵素活性のインジケーターとして機能していることが示された.こうしたFRETプローブの評価により,FRETによる酵素活性の測定における定量性が担保されると考えた.
7.Ca2+/カルモジュリン依存性プロテインキナーゼIIαとカルシニューリンによる入力情報のデコード
ニューロンのあいだの情報伝達は,活動電位の全か無かの法則による発火と,それにともなうシナプス前終末からの神経伝達物質の放出により行われている.とくに,情報は活動電位の発火の頻度および回数によりコードされると考えられている.これが神経伝達物質と受容体の活性化をつうじて,後シナプスにおいて生化学反応として情報の媒体を変化させることになる.
こうしたニューロンにおける生化学反応による情報処理をどのように解析すればいいだろうか? 以下の順序で細胞内シグナル伝達による神経入力の情報処理の過程を検討した.1)刺激の入力をパラメトリックに変化させる(今回は,刺激の頻度を0.5~20 Hz,回数を10~30回のあいだで変動させた).2)細胞体におけるCa2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンの酵素反応の活性化のパターンを検出する.3)活性化パラメーターの抽出し入力パラメーターに対しプロットする.
グルタミン酸の光融解法を用いた単一のニューロンへの局所の刺激と,デュアルFRETイメージング法とを組み合わせて生化学反応による情報処理の過程を解析した.海馬培養ニューロンに対し,Ca2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンに対する2種類のFRETプローブを共発現し,光融解法によるグルタミン酸の刺激に対する酵素反応を測定した.まず,Ca2+/カルモジュリン依存性プロテインキナーゼIIαの酵素反応からみると,刺激の回数が少ないときはほとんど活性化が認められなかったが,回数が20回以上かつ頻度が5 Hz以上の刺激の場合には活性化が認められた(図4b).このことは,Ca2+/カルモジュリン依存性プロテインキナーゼIIαは刺激入力の頻度と回数の両方の情報をデコードする機能をもつことを示唆した.一方,カルシニューリンの酵素反応は低頻度の刺激の場合において頻度に依存した活性化がみられたが,5 Hz以上の頻度ではほとんど変わらず,刺激の回数に対する依存性は高かった.このことから,カルシニューリンは刺激入力の回数をデコードすることが示唆された.この2つの酵素のもつ応答特性の違いから,神経入力の情報コード(頻度および回数)から生化学反応(酵素反応の活性化のパターン)への変換の過程が,生きたニューロンにおいてはじめて明らかになった.
8.dFOMA法による単一のシナプスにおける解析
こうした神経入力の生化学反応によるデコードは,神経の機能としてどのように利用されているのだろうか? dFOMA法をさらに発展させ,単一のシナプスにおける刺激と,それに対するCa2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンの酵素反応の解析を行った.その結果,5 Hzの頻度の刺激に対しシナプスの形態に変化はみられなかったが,20 Hzの頻度の刺激に対してはシナプスの形態が大きくなった.この現象は構造的なシナプス可塑性として知られており,機能的なシナプス可塑性と相関することが明らかになっている15).この構造の変化を起こすかどうかを生化学反応はどのように決定しているかを知るため,5 Hzおよび20 Hzの頻度の刺激に対するCa2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンの単一のシナプスにおける酵素反応をdFOMA法により解析した.まず,シナプスの形態を観察するためmCherry単体を発現させ,光融解法によるグルタミン酸の単一のシナプスに対する刺激を低頻度(5 Hz,100回)および高頻度(20 Hz,100回)で行った.そうすると,5 Hzの頻度の刺激に対してはシナプスの形態は変わらなかったのに対して,20 Hzの頻度の刺激ではシナプスの大きさは大きくなった(図5a).このことから,シナプスにおける生化学反応により刺激入力の情報は読み解かれ,シナプスの形態の変化をひき起こすという情報処理が行われていることが示唆された.そこで,dFOMA法を用いて,Ca2+/カルモジュリン依存性プロテインキナーゼIIαおよびカルシニューリンの酵素反応の活性化を5 Hzと20 Hzの頻度の刺激のあいだで比較した.その結果,Ca2+/カルモジュリン依存性プロテインキナーゼIIαの酵素反応は5 Hzの頻度の刺激では活性化されないが,20 Hzの頻度の刺激では活性化が認められた(図5b).一方で,カルシニューリンは,5 Hzおよび20 Hzの頻度の刺激の両方でシナプスにおいて酵素反応の活性化が認められた一方,20 Hzの頻度の刺激に対しては樹状突起への活性の広がりがみられた.こうした酵素反応の活性化のパターンの違いの生理的な意義については今度の課題であるが,たとえば,カルシニューリンは樹状突起の内部におけるシグナル伝達により核へと情報を伝達している可能性が考えられる.Ca2+/カルモジュリン依存性プロテインキナーゼIIαとカルシニューリンの異なるデコードの特性により,神経入力の情報を読み解き,神経活動に依存的なさまざまな過程が制御されていることがわかった.
今後,dFOMA法を用いて,さらに樹状突起のなかでの生化学反応の演算の過程や,シナプスから核へと伝達されていくシグナルの実態が明らかになるものと期待される.
おわりに
生体において“情報”がどのようにコードされているのかを理解することは,長いあいだ(そして,いま現在も)重要な研究課題である.ここで紹介した,筆者らの最近の研究は,神経入力,生化学反応,生理的な意義の関連性を実際のシナプスにおいて実証したものであり,ニューロンにおけるシステムを形成する遺伝子,神経活動,生化学反応の動的な情報統合の過程の理解に役だつものである.また,dFOMA法は,技術的にもさまざまな計測系への応用,とくに,ハイスループットな計測系における利用が期待されるほか,応用の観点からは,分子自体ではなく複数の細胞内シグナルのtemporal codeあるいはspatial codeを制御することにより効果を発揮するような薬剤の開発など,新たな創薬のコンセプトにつながる可能性がある.
今後の課題として,生化学情報システムからの生命の理解について3つの方向性をあげる.1つ目は,identity code,temporal code,spatial codeという別々のコードで表現された情報の統合の過程の理解である.このためには,網羅的かつハイスループットな計測,理論およびシミュレーションによる研究,合成生物学的なアプローチによる人工的な生化学システムの設計にくわえ,dFOMA法を応用して複数の分子によるtemporal codeとspatial codeとの相互作用を解明することが重要であると考えられる.こうした複数の分子のあいだの動的な相互作用の研究を進めることにより,生化学システムの上流から下流へのフローチャート的な現在の理解から,循環的なオートポイエーシス(autopoiesis)のような自己組織化像へと発展する可能性が秘められている.
2つ目は,生化学情報の処理ユニットの個性あるいは個体差の解明である.ヒトの脳の基礎代謝は約20ワットでしかなく,少数のニューロンの活動に情報の意味が効率的にコードされていると考えられている24).よって,シナプスにおける生化学システムについても,シナプス前細胞の発火の頻度によりその分子の構成や機能が制御されている可能性がある.dFOMA法は個々のシナプスにおける生化学反応をひとつひとつ分離して検討することができるので,シナプスごとの個体差(分子の構成だけでなく,動的な活性の違い)や,その機能的な意義についての解明が進むと期待される.
3つ目は,生化学情報の処理システムの設計や進化の過程の解明である.現代のわれわれにとりシナプスにおける生化学システムは既存のデファクトスタンダードであり,そもそも,なぜCa2+/カルモジュリン依存性プロテインキナーゼIIαとカルシニューリンの情報処理の特性に違いがなくてはならないか,その必然的な答えはない(その違いの機能的な意義や分子機構について研究することはできるが).しかし,この進化の過程をたどることにより,どのようにして現在のすがたに発展したのか,その拘束条件や進化的な意義を考察することはできる.近年では,比較進化学的な研究により,シナプスにおける生化学システムのパーツの進化の過程や,細胞における分子の局在の進化的な意味あいが解明されている25,26).こうした比較進化的な視点を顕微鏡イメージングにとりいれ,進化による構成分子の追加あるいは欠失や,変異により細胞における情報コード自体あるいはその意味がどのように変化してきたのかを研究することは,生化学情報の処理システムの設計思想や進化学的な意味の理解につながると考えられる.とくに,dFOMA法は同一の条件をとる同一の細胞において,2つの種からのオーソログ,あるいは,同一の種の2つのパラログの遺伝子産物の活性を比較検討することが可能であるので,そうした比較による情報コードの進化についての研究への応用が期待される.
今後,こうした研究をとおして,個々の分子と生化学反応との集合体がどのように統合されて全体として生命というシステムを構築しているのか,その理解に少しずつ進んでいくことが期待される.
文 献
- Dudek, S. M. & Bear, M. F.: Homosynaptic long-term depression in area CA1 of hippocampus and effects of N-methyl-D-aspartate receptor blockade. Proc. Natl. Acad. Sci. USA, 89, 4363-4367 (1992)[PubMed]
- Bliss, T. V. & Collingridge, G. L.: A synaptic model of memory: long-term potentiation in the hippocampus. Nature, 361, 31-39 (1993)[PubMed]
- Deisseroth, K., Bito, H., Schulman, H. et al.: Synaptic plasticity: a molecular mechanism for metaplasticity. Curr. Biol., 5, 1334-1338 (1995)[PubMed]
- Behar, M. & Hoffmann, A.: Understanding the temporal codes of intra-cellular signals. Curr. Opin. Genet. Dev., 20, 684-693 (2010)[PubMed]
- Boulware, M. J. & Marchant, J. S.: Timing in cellular Ca2+ signaling. Curr. Biol., 18, R769-R776 (2008)[PubMed]
- Kennedy, M. B., Beale, H. C., Carlisle, H. J.et al.: Integration of biochemical signalling in spines. Nat. Rev. Neurosci., 6, 423-434 (2005)[PubMed]
- Bhalla, U. S.: Signaling in small subcellular volumes. I. Stochastic and diffusion effects on individual pathways. Biophys. J., 87, 733-744 (2002)[PubMed]
- Bito, H.: The chemical biology of synapses and neuronal circuits. Nat. Chem. Biol., 6, 560-563 (2010)[PubMed]
- Sheng, M. & Hoogenraad, C. C.: The postsynaptic architecture of excitatory synapses: a more quantitative view. Annu. Rev. Biochem., 76, 823-847 (2007)[PubMed]
- 原口徳子, 平岡 泰, 木村 宏: 講義と実習 生細胞蛍光イメージング. 共立出版 (2007)
- Miyawaki, A., Llopis, J., Heim, R. et al.: Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature, 388, 882-887 (2007)[PubMed]
- Ueda, Y., Kwok, S. & Hayashi, Y.: Application of FRET probes in the analysis of neuronal plasticity. Front. Neural Circuits, 7, 163 (2013)[PubMed]
- Tye, K. M. & Deisseroth, K.: Optogenetic investigation of neural circuits underlying brain disease in animal models. Nat. Rev. Neurosci., 13, 251-266 (2012)[PubMed]
- Matsuzaki, M., Ellis-Davies, G. C,, Nemoto, T. et al.: Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nat. Neurosci., 4, 1086-1092 (2001)[PubMed]
- Matsuzaki, M., Honkura, N., Ellis-Davies, G. C. et al.: Structural basis of long-term potentiation in single dendritic spines. Nature, 429, 761-766 (2004)[PubMed]
- Lee, S. J., Escobedo-Lozoya, Y., Szatmari, E. M. et al.: Activation of CaMKII in single dendritic spines during long-term potentiation. Nature, 458, 299-304 (2009)[PubMed]
- Murakoshi, H., Wang, H. & Yasuda, R.: Local, persistent activation of Rho GTPases during plasticity of single dendritic spines. Nature, 472, 100-104 (2011)[PubMed]
- Fujii, H., Inoue, M., Okuno, H. et al.: Nonlinear decoding and asymmetric representation of neuronal input information by CaMKIIα and calcienurin. Cell Rep., 3, 978-987 (2013)[PubMed]
- Carlson, H. J. & Campbell, R. E.: Genetically encoded FRET-based biosensors for multiparameter fluorescence imaging. Curr. Opin. Biotechnol., 20, 19-27 (2009)[PubMed]
- Shaner, N. C., Campbell, R. E., Steinbach, P. A. et al.: Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat. Biotechnol., 22, 1567-1572 (2004)[PubMed]
- Nagai, T., Ibata, K., Park, E. S. et al.: A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat. Biotechnol., 20, 87-90 (2002)[PubMed]
- Zapata-Hommer, O. & Griesbeck, O.: Efficiently folding and circularly permuted variants of the Sapphire mutant of GFP. BMC Biotechnol., 22, 3-5 (2003)[PubMed]
- De Koninck, P. & Schulman, H.: Sensitivity of CaM kinase II to the frequency of Ca2+ oscillations. Science, 279, 227-230 (1998)[PubMed]
- Bullmore, E. & Sporns, O.: The economy of brain network organization. Nat. Rev. Neurosci., 13, 336-349 (2012)[PubMed]
- Solovei, I., Kreysing, M., Lanctot, C. et al.: Nuclear architecture of rod photoreceptor cells adapts to vision in mammalian evolution. Cell, 137, 356-368 (2009)[PubMed]
- Ryan, T. J. & Grant, S. G.: The origin and evolution of synapses. Nat. Rev. Neurosci., 10, 701-712 (2009)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院医学系研究科 修了,同年 同 特任研究員を経て,2012年より同 特任助教(現 助教).
抱負:生物のなかで情報を実験的にどのように定義すればよいか,情報により物質と生命のあいだをつなぐことが可能なのか,日々考えながら試行錯誤をくり返している.脳,遺伝子,社会・文化に表現された情報がどのように相互作用して生命システムをつくりあげているのか,その実態にせまってゆきたい.テニスとビールと温泉が好きな関西人.蛍光タンパク質の情報サイト“I love GFP”(URL:https://sites.google.com/site/ilovegfp/)を随時更新中.
尾藤 晴彦(Haruhiko Bito)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.neurochem.m.u-tokyo.ac.jp/
© 2013 藤井 哉・尾藤晴彦 Licensed under CC 表示 2.1 日本