大脳新皮質での神経回路の形成における軸索ガイダンス機構
2014/02/18
新明洋平・田中英明
(熊本大学大学院生命科学研究部 神経分化学分野)
email:新明洋平
領域融合レビュー, 3, e002 (2014) DOI: 10.7875/leading.author.3.e002
Yohei Shinmyo & Hideaki Tanaka: Axon guidance mechanisms in forebrain connections.

脳においては膨大な数のニューロンが精巧な神経回路ネットワークを形成している.神経回路がどのようにして形成されるのかを理解することは脳の機能を理解するために重要であるのみならず,今後の神経に対する再生医療を実現するためにも必要不可欠である.この20年間,Netrinをはじめとする軸索ガイダンスタンパク質とそれらの受容体が同定されたことにより,軸索ガイダンスの基盤となる分子機構が解明された.さらに,遺伝子改変マウスを用いた個体レベルでの遺伝子の機能解析から,脳での神経回路の形成における軸索ガイダンスタンパク質の役割が明らかにされてきた.ここでは,軸索ガイダンス機構に着目し,マウスの大脳新皮質における主要な神経回路がどのようなしくみにより形成されるのかを解説する.
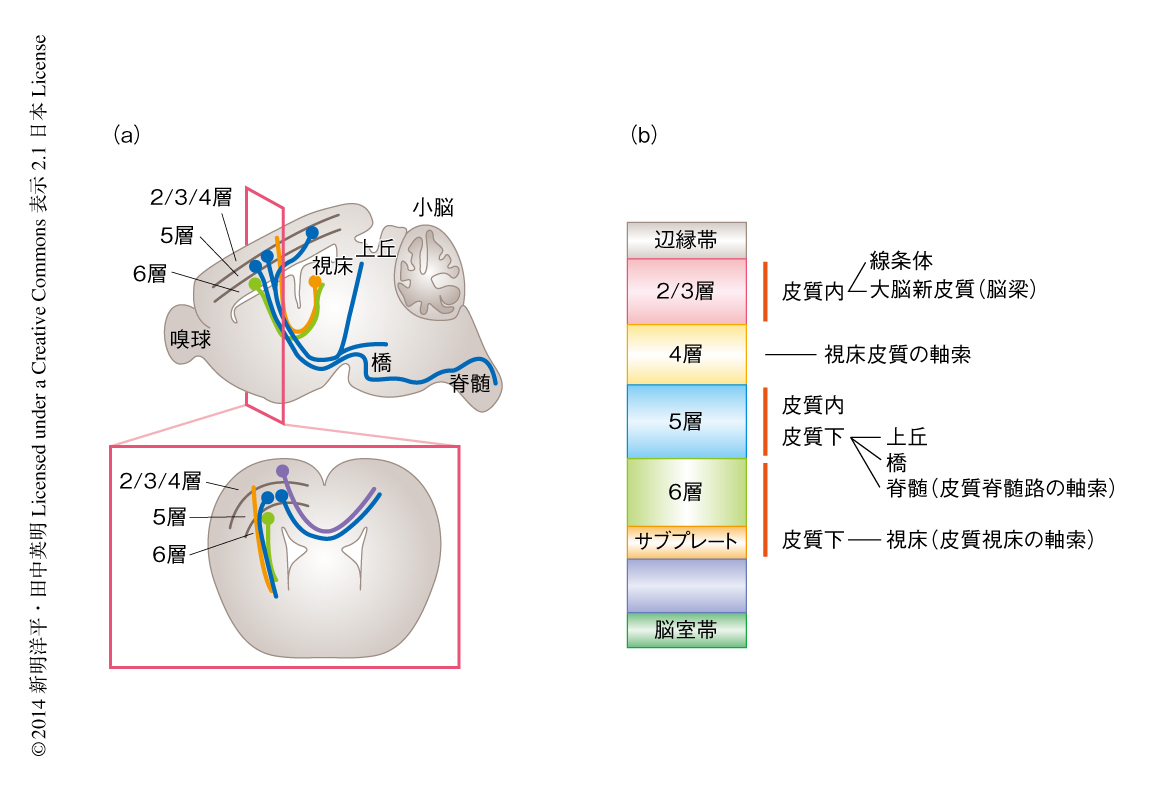
大脳新皮質は思考などさまざまな高次の脳機能をつかさどる器官であり,ヒトでは中脳や間脳をおおうほどの大きさをしめる.大脳新皮質では特徴的な細胞層が観察され,層構造にもとづいた神経回路ネットワークが形成されている(図1).その神経回路は非常に複雑であるが,驚くほど精巧で美しい構造をもつ1,2).たとえば,第2/3層のニューロンからの軸索は同側あるいは反対側の大脳皮質(脳梁)へ投射し,第4層は視床皮質からの軸索投射をうける入力層である.第5層には,脳梁を形成するニューロンと,内包を経由して上丘,橋,脊髄など遠方の領域へ投射するニューロンが存在する.第6層およびサブプレートニューロンの軸索は視床へ投射する.ここでは,この多様な神経回路がどのようなしくみにより形成されるのかについて,軸索ガイダンスタンパク質の役割に焦点をあてて解説する3).
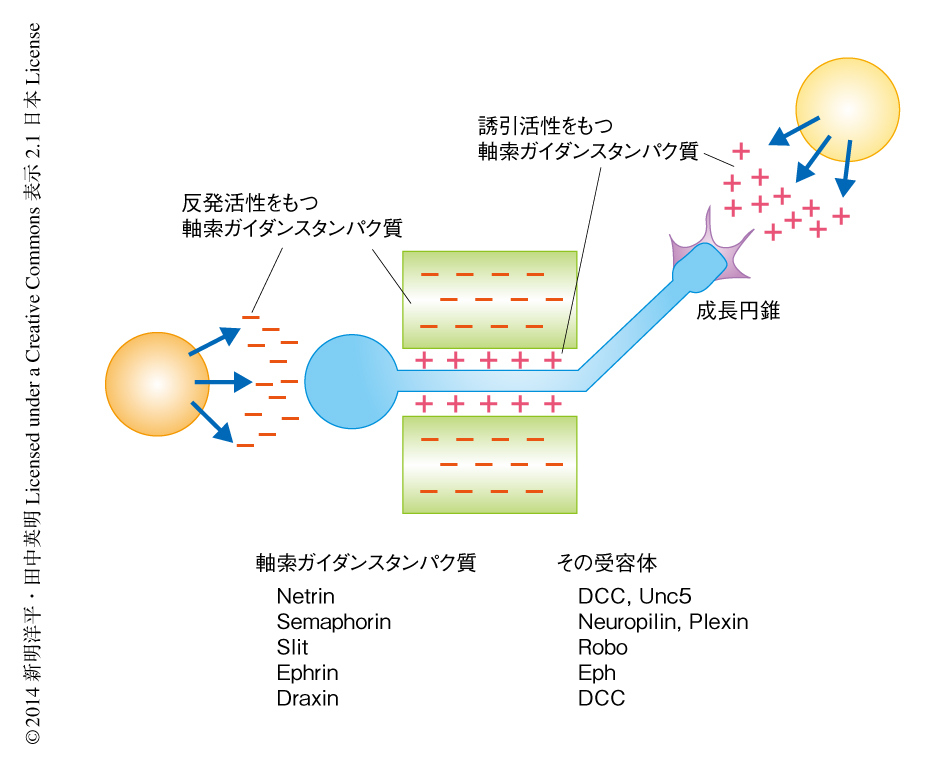
正確な神経回路ネットワークの形成には,発生期に軸索が標的のニューロンにむかって正しく伸長しシナプス結合を形成する必要がある.この軸索ガイダンスにかかわるタンパク質を軸索ガイダンスタンパク質とよぶ.軸索ガイダンスタンパク質のなかには,細胞の外に分泌されて拡散勾配を形成する遠距離作動性のものと,分泌されずに細胞の表面においてはたらく短距離作動性のものとが存在する4)(図2).両者ともに,誘引活性をもつあるいは反発活性をもつ軸索ガイダンスタンパク質がある.ここでは,軸索ガイダンスタンパク質として,Netrin,Semaphorin,Slit,Ephrinについて紹介する.
軸索を標的のニューロンまでみちびく誘引物質の存在は,スペインの解剖学者Cajalにより1世紀以上もまえから提案されていたが,そのような物質が実際に存在するかどうかは長らく不明であった.1980年代になり,神経培養系において特定の軸索を誘引する因子の存在が示され,そののち,ニワトリの胚の脳から分泌型で誘引活性をもつ軸索ガイダンスタンパク質としてNetrinが同定された5).Netrinは約80 kDaのタンパク質で,細胞外基質タンパク質であるラミニンのγ鎖と相同性をもつ.Netrinの受容体としては,ヒトの大腸がんにおける腫瘍抑制タンパク質であるDCC,および,線虫の変異体から同定されたUNC5がよく知られている6,7).成長円錐の反応性はこれら2つの受容体の発現パターンに依存し,DCCのみでは誘引,DCCおよびUNC5が共発現し細胞膜においてヘテロ二量体を形成すると反発を示す8).
大きなファミリーを形成する軸索ガイダンスタンパク質としてSemaphorin(Sema)がある.Semaphorinはニワトリの後根神経節細胞の成長円錐を退縮させるタンパク質として同定された9).そののち,20種類以上のSemaphorinが同定され,構造における特徴から7つのクラスに分類されている10).すべてのSemaphorinはN末端に約500アミノ酸残基からなるSemaドメインとよばれる特徴的な配列をもつが,それ以外のドメインは多様化しており,分泌型,膜貫通型,GPI結合型など,さまざまなタイプが存在する.Semaphorinは軸索の反発や伸長を阻害するタンパク質として広く認知されているが,軸索の誘引に機能する場合もある11).Semaphorinの受容体としてはNeuropilinおよびPlexinが同定されている12).
脳や脊髄などさまざまな軸索に対し反発活性をもつ軸索ガイダンスタンパク質としてSlitがある13).Slitは約1500アミノ酸残基からなる分泌型タンパク質であり,ロイシンリッチリピート配列,EGFリピート配列,ALPS(Agrin-Laminin-Perlecan-Slit spacer)配列をもつ.Slitはその受容体であるRoboを介してシグナルが伝達されるが,脊椎動物においてはSlitおよびRoboにはともに3つの相同遺伝子が存在する.
Ephrinはニワトリの眼の網膜から脳の1次視覚中枢である視蓋(マウスでは,上丘に相当)への投射においてよく研究されている軸索ガイダンスタンパク質である14).EphrinにはGPI結合型および膜貫通型があり,それぞれEphrinAおよびEphrinBと区分されている.Ephrinの受容体であるEphは細胞内にチロシンキナーゼドメインをもち,受容体との特異性にもとづきEphAおよびEphBに分けられる.さらに,EphとEphrinによる前向きのシグナル伝達系のほか,EphAがリガンド,EphrinAが受容体として機能する逆向きのシグナル伝達系が存在し,この双方向性のシグナル伝達により軸索投射機構は高度かつ複雑に制御されている15).
さて,筆者らは,新規の軸索ガイダンスタンパク質を同定するため,膜タンパク質や分泌タンパク質のcDNAを選択的にクローニングするシグナルシークエンストラップ法を用いて分子スクリーニングを行った.その結果,既知の軸索ガイダンスタンパク質とはまったく相同性のない新規の分泌型の軸索ガイダンスタンパク質を見い出し,Draxin(Dorsal repulsive axon guidance protein)と命名した16).Draxin遺伝子はニワトリあるいはマウスの胚において脳から脊髄にいたる中枢神経系の背側に発現し,脳や脊髄の交連ニューロンの軸索に対し反発活性をもっていた.たとえば,ニワトリの胚の脊髄にエレクトロポレーション法によりDraxinを過剰に発現させると,脊髄の交連ニューロンの軸索の成長が阻害された.さらに,Draxinノックアウトマウスでは大脳のすべての交連ニューロン(脳梁,海馬交連,前交連)において軸索の完全な欠損が観察された.これらの神経回路の異常は,これまでに述べた軸索ガイダンスタンパク質における変異マウスの表現型と比べてもより重篤であったことから,Draxinは脳における神経回路の形成においてきわめて重要な軸索ガイダンスタンパク質であると考えられた.
Draxinの受容体を同定するため,既知の軸索ガイダンスタンパク質の受容体のうちノックアウトマウスの表現型が類似するものについて,免疫沈降法によりDraxinとの結合性を調べた.その結果,DraxinはSlitの受容体であるRobo1やSemaphorinの受容体であるNeuropilin1とは結合しないが,Netrinの受容体であるDCCと特異的に結合することがわかった17).DCCノックアウトマウスではDraxinノックアウトマウスと同様に大脳のすべての交連ニューロンの形成不全が報告されており,これらの軸索投射においてDCCがDraxinの受容体として機能している可能性が示唆された.両者の関係をin vivoにおいて調べるため,DraxinとDCCとのダブルへテロノックアウトマウスの交連ニューロンを解析した.それぞれの単独のヘテロノックアウトマウスでは脳梁の完全な欠損はほぼ観察されなかった一方,ダブルへテロノックアウトマウスにおいては脳梁の完全な欠損が高頻度に観察され,DraxinとDCCとのあいだの遺伝的な相互作用が示された.さらに,DCCノックアウトマウスに由来する大脳新皮質の組織片(脳梁のニューロンを含む)では,野生型マウスに由来するニューロンを用いた場合に比べ,Draxinによる神経突起の伸長阻害が低減した.これらの結果から,Draxinノックアウトマウスにおける脳梁の形成異常はDCCを介したDraxinの反発活性の欠損により起こると考えられた.一方で,DraxinはDCCだけでなく,Netrinの受容体として知られているUNC5,Neogenin,Dscamとも結合する.今後,Draxinがこれらの受容体とどのように相互作用しシグナル伝達系を構成しているのかを理解する必要がある.
脳梁は左右の大脳半球をつなぐ交連線維の束である.哺乳動物の脳において脳梁はもっとも大きな神経束で,左右の大脳新皮質のあいだの情報をやりとりする重要な経路となっている.マウスの脳梁の場合,約80%のニューロンは第2/3層のニューロンから生じ,約20%のニューロンは第5層のニューロンから生じる.
脳梁における軸索の通路の選択にはおもに6箇所の決定ポイントがある18)(図3).最初,脳の表面の辺縁帯から分泌される反発活性をもつ軸索ガイダンスタンパク質Semaphorin3Aのはたらきにより,脳梁の軸索は腹側の中間帯にむかって伸長する19)(ポイント1).さらに,Semaphorin3Aは内外軸にそった濃度勾配を形成しており(内側で低く,外側で強い発現),脳梁の軸索が中間帯において正中線の側にむかうよう制御する20)(ポイント2).そののち,脳梁の軸索は正中線に存在するglial wedge,indusium griseum,subcallosal slingといった細胞のはたらきにより正中線を交差する21)(ポイント3).glial wedgeは左右対称に存在するグリア細胞であり,反発活性をもつ軸索ガイダンスタンパク質であるSlit2,Draxin,Wnt5aを発現している21).Slit2とDraxinは正中線を交差するまえの脳梁の軸索に対し反発活性を示し,その正中線の交差において必須である16,22)(ポイント3).一方,Wnt5aは正中線を交差したのちの脳梁の軸索に対し反発活性を示し,反対側の大脳新皮質にむかって伸長する過程において重要であると考えられている23)(ポイント4).indusium griseumは脳梁において軸索の背側にあるグリア細胞で,反発活性をもつ軸索ガイダンスタンパク質であるSlit2およびDraxinを発現することにより背側の障壁としてはたらく.また,ニューロンであるsubcallosal slingはSemaphorin3Cを発現し,その受容体であるNeuropilin1を発現する帯状皮質の軸索を誘引する24).重要なことに,帯状皮質の軸索は脳梁の軸索よりもさきに正中線を交差し,パイオニア軸索として脳梁の軸索の正中線の交差にかかわる25).最近,正中線の付近に発現するNetrin1の機能につき興味深い報告があった26).Netrin1は帯状皮質の軸索に対しては誘引活性をもつが,脳梁の軸索に対しては反応性がない.それにくわえ,脳梁の軸索が正中線にむかって伸長できるようNetrin1はSlit2の反発活性を抑制する.Ephrin-Ephシグナルも脳梁における軸索投射にかかわる.脳梁の軸索と正中線の付近のグリア細胞とのあいだのEphBとEphrinBとの相互作用が,脳梁の軸索が正中線を交差するのに重要である27).さらに,EphrinA-EphAシグナルが脳梁の軸索のあいだの相互作用を介してその軸索投射にかかわる28,29).大脳新皮質の内側から生じる軸索は脳梁の背側を,大脳新皮質の外側に由来する軸索は腹側を走行し,EphA3がこの軸索の分離を制御することが示されている.そのほか興味深い報告として,髄膜から分泌されるBMP7が脳梁における軸索投射にかかわることが示されている30).正中線を交差した脳梁の軸索は大脳新皮質に侵入し(ポイント5),最終的には神経活動に依存的な機構により正しい標的ニューロンへ投射する(ポイント6).
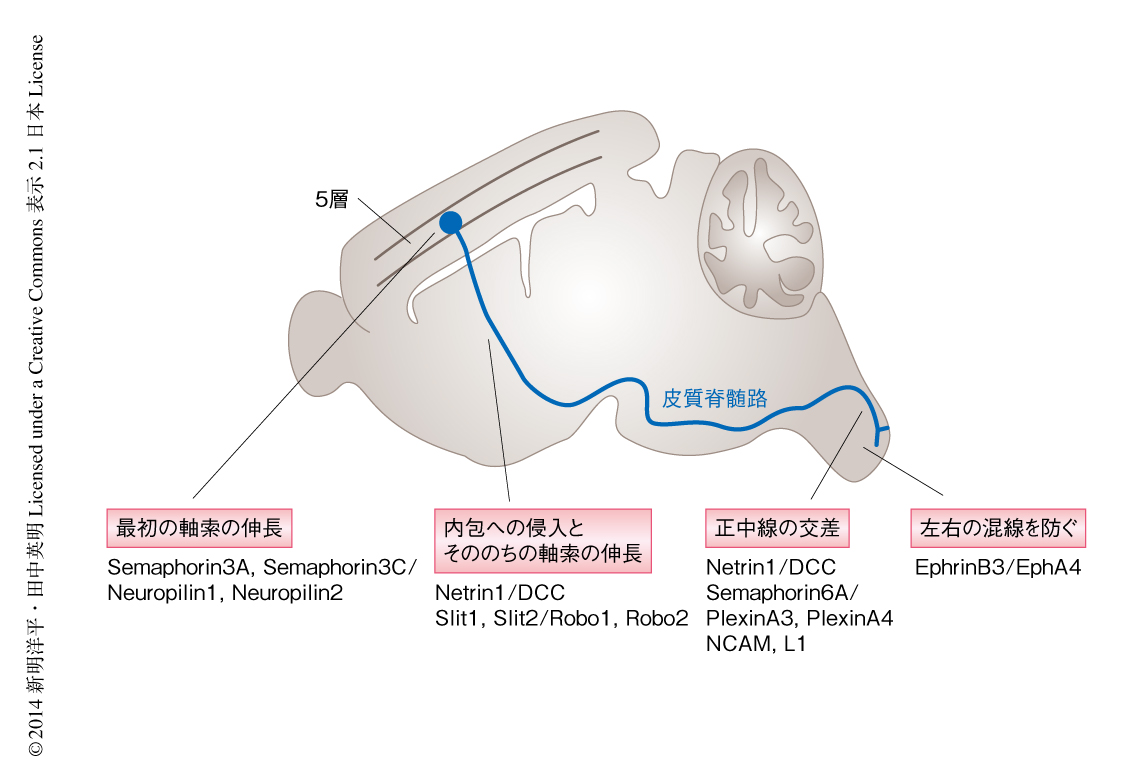
皮質脊髄路は大脳新皮質から脊髄にかけて走行する軸索で,おもに皮質運動野の第5層のニューロンに発する(図4).皮質運動野から生じる皮質脊髄路の軸索は内包を下行し,中脳,後脳を通過したのち,延髄においてほとんどの軸索(80~85%)が反対側に交差し錐体交差を形成する.最終的に,皮質脊髄路の軸索は脊髄灰白質のニューロンに投射する.
最初,皮質脊髄路の軸索は誘引活性をもつ軸索ガイダンスタンパク質Semaphorin3Cと反発活性をもつ軸索ガイダンスタンパク質Semaphorin3Aのはたらきにより皮質板から中間帯にむけて伸長する31).さらに,基底核原基から分泌される誘引活性をもつ軸索ガイダンスタンパク質Netrin1のはたらきにより内包へ誘導され32,33),そののち,皮質視床の軸索とは分離して中脳の大脳脚に入る.皮質脊髄のニューロンに発現するRobo1とRobo2とのダブルノックアウトマウスでは皮質脊髄路の軸索は正中線を異常に交差することから,反発活性をもつ軸索ガイダンスタンパク質Slit1およびSlit2が,その受容体であるRobo1およびRobo2を介して正中線の側へむかわないよう制御していると考えられる34).後脳に侵入した皮質脊髄路の軸索の多くは延髄において正中線を交差するが,この過程には,軸索ガイダンスタンパク質であるNetrin1およびSemaphorin6A,細胞接着分子であるNCAMおよびL1など,複数のタンパク質が関与している35-38).たとえば,Semaphorin6Aの反発活性,NCAMとL1による軸索のあいだの相互作用が皮質脊髄路の軸索が正中線を交差するのに重要である.そのほか,Ephrin-Ephシグナルは皮質脊髄路の軸索の再交差による左右の神経回路の混線を防ぐように機能する.つまり,皮質脊髄路の軸索に発現するEphA4と,正中線の腹側に発現するEphrinB3との反発性の相互作用により,皮質脊髄路の軸索がふたたび正中線を交差しないように制御されている.興味深いことに,Ephrin-Ephシグナルに関連するタンパク質の変異マウスは,ウサギのように左右の脚をそろえてはねる歩き方を示す.同様の表現型を示す変異マウスの系統の確立と,それにつづくポジショナルクローニングにより,αキメリンに変異が同定された39).さらに,生化学的な手法を含む詳細な解析により,αキメリンがEphrin-Ephシグナルの下流において皮質脊髄路の軸索の伸長を促進するRacのはたらきを抑制することが明らかにされた.
皮質脊髄路の軸索は,随意運動神経の障害をひき起こす筋萎縮性側索硬化症や脊髄の損傷による運動機能の障害などに直結するため,その発生や再生の研究は臨床的にも重要である.ヒトなどの霊長類では中枢神経の軸索の再生能力が低いため,脊髄の損傷により運動機能の脱落症状が生じると生涯にわたり後遺症が残る.この要因のひとつとして,中枢神経系には損傷ののち軸索の再生を阻害するタンパク質が発現すると考えられている.実際に,損傷の周辺には軸索伸長の阻害タンパク質であるNogoや,反発活性をもつ軸索ガイダンスタンパク質であるSemaphorin3Aが発現する40).また,GPIアンカータンパク質であるRGMの発現が脊髄の損傷部位において上昇することが見い出され41,42),さらに,ラットの脊髄を損傷したのちRGMの効果を中和する抗体を投与することにより,皮質脊髄路の軸索の再生と運動機能の改善に成功した.このような軸索の再生を阻害するタンパク質を標的とした治療法の開発により,将来的には機能的な中枢神経の再生をみちびくことが可能になると期待される.
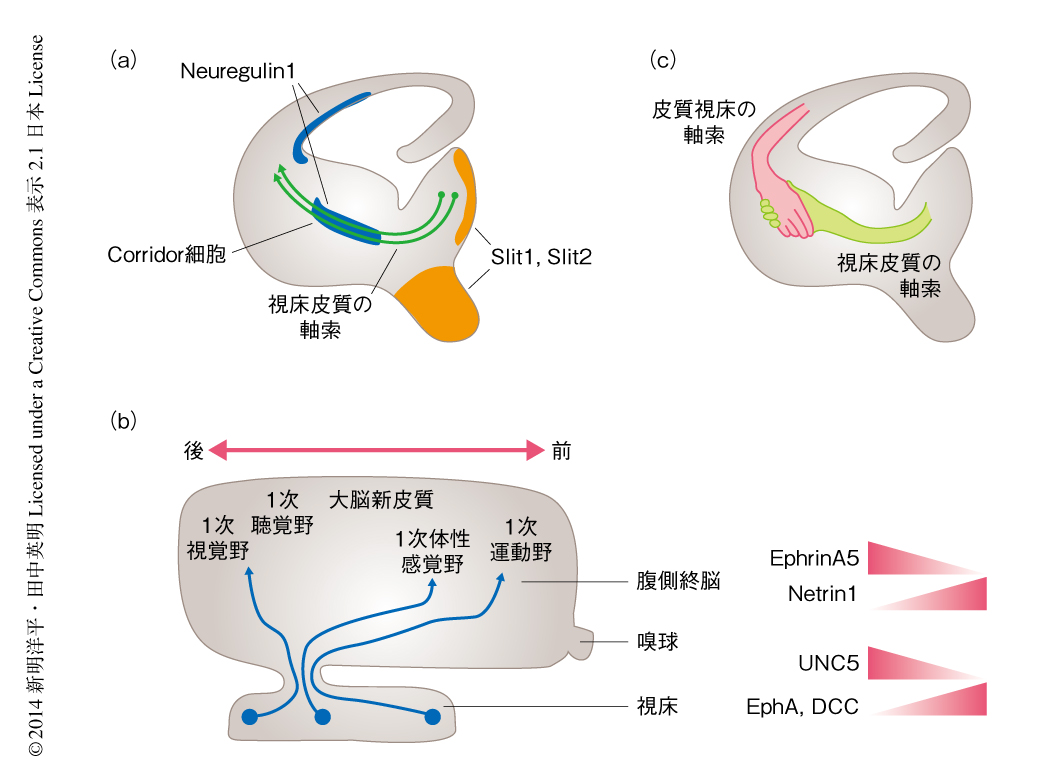
哺乳動物において,視床は嗅覚のほかのあらゆる感覚情報(体性感覚,痛覚,視覚,聴覚,味覚など)を大脳新皮質へと伝達する中継地である.それぞれの感覚情報は視床核に発する視床皮質の軸索により大脳新皮質の特異的な領域に伝達される43).視床皮質の軸索は視床下部にむかって伸長を開始し,そののち,内包にむけてその方向を変える.Slit1とSlit2とのダブルノックアウトマウスの解析から,視床下部および正中線に発現する軸索ガイダンスタンパク質Slitの反発活性がこの軸索ガイダンスに重要であることが示されている44)(図5a).視床下部とは対照的に,腹側終脳は視床皮質の軸索に対し誘引作用をもつ.とくに,Corridor細胞と名づけられたニューロンが視床皮質の軸索の走行に重要である45).Corridor細胞は外側基底核原基に発し,視床皮質の軸索に対し誘引活性をもつ軸索ガイダンスタンパク質Neuregulin1を発現する(図5a).
このように,腹側終脳は視床皮質の軸索の中間標的部位として重要であるが,さらに,視床皮質の軸索のトポグラフィックな投射を最初に制御する領域でもある.トポグラフィクな投射とは,ある領域のニューロンが互いの相対的な位置情報を保持した状態のまま標的となる領域のニューロンにシナプスを形成することである.視床皮質の軸索の場合,前後軸にそったトポグラフィクな投射パターンが観察される46).たとえば,外側腹側核から発する軸索は前頭皮質に投射し,外側膝状核から発する軸索は1次視覚野に投射する(図5b).つまり,視床の前部から生じる軸索は大脳新皮質の前方の領域に,視床の後部から生じる軸索は大脳新皮質の後方の領域に投射するというトポグラフィックな投射が存在する.最初,腹側終脳に発現する転写因子Ebf1およびDlx1,Dlx2の変異マウスの解析から,大脳新皮質に侵入するまえの腹側終脳において視床皮質の軸索のトポグラフィックな投射が制御されていることが示された47).その数年後,EphrinA-EphAシグナルがこの過程にかかわることが明らかにされた48).EphrinA5の受容体であるEphA3,EphA4,EphA7の発現は,背側視床において前部で高く後部で低い濃度勾配をもつ(図5b).この濃度勾配は,腹側終脳において後部で高く前部で低いEphrinA5の濃度勾配とは相補的である(図5b).さらに,in vitroにおいてEphrinA5は反発活性をもつ示したことから,EphAを高発現する視床の前部からの軸索は,EphrinA5を高発現する腹側終脳の後部の領域をさけるよう投射すると考えられる.実際に,EphrinA5とEphA4とのダブルノックアウトマウスでは,視床の前部からの軸索投射は腹側終脳において後方へとシフトした.
軸索ガイダンスタンパク質Netrin1も腹側終脳において前部で高く後部で低い濃度勾配をもち発現する49)(図5b).Netrin1は視床の前部に発する軸索に対しては誘引活性をもつ一方,視床の後部に発する軸索に対しては反発活性を示す.この反応性の違いは,さきに述べた受容体の発現の差異により生じる.背側視床においてDCCは前部に高く後部に低い濃度勾配をもつことから,視床の前部に発する軸索に対する誘引活性にNetrin1-DCCシグナルが重要であると考えられる.一方,Unc5A,Unc5B,Unc5Cは視床の後部に強く発現することから,Netrin1-DCC//-Unc5シグナルが視床の後部に発する軸索に対する反発活性を制御していると考えられる.そのほか,反発活性をもつ軸索ガイダンスタンパク質Slit1が腹側終脳においてNetrin1と同様の濃度勾配をもち,視床皮質の軸索のトポグラフィックな投射にかかわることが示されている50).
腹側終脳において分離された視床皮質の軸索は,最終的には大脳新皮質において特異的な領域に投射するよう制御される.ラットの胎仔16日目の大脳新皮質の前部の領域を出生後のラットの大脳新皮質の後部の領域に移植すると,外側腹側核および内側腹側核からの軸索が正常な標的である前頭部のみならず,移植された後方の領域へ投射される.このことから,大脳新皮質は視床皮質における軸索投射を制御する重要なタンパク質を発現していると考えられる.重要なことに,大脳新皮質に発現するタンパク質の機能解析から,モルフォゲンであるFGF8が大脳新皮質の領野の形成に必要であることが示されている51).子宮内エレクトロポレーション法によりFGF8を異所的に発現させると,後頭部において異所的なバレル野が誘導された.さらに,この異所的なバレル野の形成は視床皮質の軸索のトポグラフィックな投射にも影響をあたえた52).このように,視床皮質の軸索のトポグラフィックな投射は,腹側終脳にくわえ大脳新皮質に発現するタンパク質により制御されている.
視床皮質の軸索は内包を通過したのち大脳新皮質に侵入するが,この過程には大脳新皮質から内包にむかう皮質下行性の軸索が必須である.たとえば,皮質下行性のパイオニア軸索をもつサブプレートニューロンを破壊すると視床皮質の軸索の投射に異常が生じる53).1990年,皮質下行性の軸索と視床皮質の軸索とが内包において出会ったのち,互いに軸索投射をガイドするというハンドシェイクモデルが提唱された54)(図5c).そののち,Tbr1,Fez-like,Pax6,Gbx2,Emx2など,さまざまな転写因子の変異マウスの解析から,皮質下行性の軸索と視床皮質の軸索の投射は互いに依存することが示唆され,ハンドシェイクモデルを支持する報告が数多くなされた43).一方で,この軸索のあいだの相互作用の存在に否定的な報告もある.たとえば,皮質下行性の軸索と視床皮質の軸索とは大脳新皮質の中間帯において異なる区画に存在するため,直接的には相互作用しないのではないかというものである55).また,培養実験において皮質下行性の軸索と視床皮質の軸索の成長円錐が反発しあうことが観察されており,これは両者の軸索が誘引しあうことを想定するハンドシェイクモデルとは矛盾するように思われる56).
最近になり,新たにハンドシェイクモデルを支持する2つの報告がなされた.すなわち,皮質下行性の軸索のみに異常をもつコンディショナルノックアウトマウスでは視床皮質の軸索は大脳新皮質に侵入できないことが示された57).これは,皮質下行性の軸索が視床皮質の軸索の投射に必須であることを示す直接的な証拠となった.また反対に,視床皮質ニューロンを破壊すると皮質下行性の軸索の投射に異常の生じることが観察され58),視床皮質の軸索が皮質下行性の軸索の投射に必須であることが示された.このように,さまざまな実験結果からハンドシェイクモデルが支持されているが,この議論に決着をつけるためには,この軸索のあいだの相互作用に直接的にかかわるタンパク質の同定が必要である.
軸索ガイダンスタンパク質の機能を制御する機構として,成長円錐における局所的な翻訳が重要であることが報告されている59).軸索ガイダンスタンパク質Netrin1の非存在下ではDCCとリボソームとが結合し翻訳を抑制するが,DCCにNetrin1が結合するとDCCからリボソームが解離し翻訳が開始することが示された.実際に,脊髄の交連ニューロンの軸索に対するNetrin1の誘引活性に成長円錐における翻訳が必要であることが示されている.SemaphorinやSlitなどほかの軸索ガイダンスタンパク質に関しても局所的な翻訳がそれらの機能において必要であることが明らかにされており,今後,より詳細な分子レベルでの解析が期待される.
最近,視床皮質の軸索の発生の機構に関して2つの興味深い報告があった.発生の初期段階における視床のニューロンでの自発的な神経活動が,視床皮質の軸索の伸長の速度を制御することが示された60).その分子機構として,視床のニューロンにおけるRobo1の発現が自発的な神経活動により制御されることが明らかにされている.また,出生が神経回路の形成の開始を制御することが報告された61).出生を契機とした細胞外のセロトニン濃度の低下が大脳新皮質の1次体性感覚野に存在するバレルの形成を制御することが示され,出生による神経回路の形成の制御という新しい概念が提示された.
ここでは,大脳新皮質の主要な神経回路である脳梁,皮質脊髄路の軸索,視床皮質の軸索がどのように形成されるかについて解説した.これまでの多くの遺伝子改変動物の解析から,単一の軸索ガイダンスタンパク質の役割についての理解は深まっている.一方で,実際の神経回路の形成期には複数の軸索ガイダンスタンパク質が共同ではたらくと考えられる.近年,神経回路の形成のさまざまな局面において,複数の軸索ガイダンスシグナルのクロストークが明らかにされつつある.今後,脳における複雑かつ精巧な神経回路の形成の機構を理解するためには,複数の軸索ガイダンスシグナルがニューロンにおいてどのように統合されているのかを明らかにする必要がある.さらに,最後に述べた,成長円錐における局所的な翻訳,発生の初期段階におけるニューロンの自発的な神経活動,あるいは,出生など新たな観点からの研究により,今後,脳における神経回路の形成の理解がますます進むと期待される.
略歴:2005年 徳島大学大学院工学研究科博士課程 修了,同年 熊本大学発生医学研究センター 研究員を経て,2006年より熊本大学大学院生命科学研究部 助教.
研究テーマ:脳における神経回路ネットワークの多様性をみちびく分子機構に興味をもち,軸索ガイダンスタンパク質Draxinについて研究している.
田中 英明(Hideaki Tanaka)
熊本大学大学院生命科学研究部 元 教授.
研究室URL:http://kumamoto.devneurobiology-u.jp/
© 2014 新明洋平・田中英明 Licensed under CC 表示 2.1 日本
(熊本大学大学院生命科学研究部 神経分化学分野)
email:新明洋平
領域融合レビュー, 3, e002 (2014) DOI: 10.7875/leading.author.3.e002
Yohei Shinmyo & Hideaki Tanaka: Axon guidance mechanisms in forebrain connections.
要 約
脳においては膨大な数のニューロンが精巧な神経回路ネットワークを形成している.神経回路がどのようにして形成されるのかを理解することは脳の機能を理解するために重要であるのみならず,今後の神経に対する再生医療を実現するためにも必要不可欠である.この20年間,Netrinをはじめとする軸索ガイダンスタンパク質とそれらの受容体が同定されたことにより,軸索ガイダンスの基盤となる分子機構が解明された.さらに,遺伝子改変マウスを用いた個体レベルでの遺伝子の機能解析から,脳での神経回路の形成における軸索ガイダンスタンパク質の役割が明らかにされてきた.ここでは,軸索ガイダンス機構に着目し,マウスの大脳新皮質における主要な神経回路がどのようなしくみにより形成されるのかを解説する.
はじめに
大脳新皮質は思考などさまざまな高次の脳機能をつかさどる器官であり,ヒトでは中脳や間脳をおおうほどの大きさをしめる.大脳新皮質では特徴的な細胞層が観察され,層構造にもとづいた神経回路ネットワークが形成されている(図1).その神経回路は非常に複雑であるが,驚くほど精巧で美しい構造をもつ1,2).たとえば,第2/3層のニューロンからの軸索は同側あるいは反対側の大脳皮質(脳梁)へ投射し,第4層は視床皮質からの軸索投射をうける入力層である.第5層には,脳梁を形成するニューロンと,内包を経由して上丘,橋,脊髄など遠方の領域へ投射するニューロンが存在する.第6層およびサブプレートニューロンの軸索は視床へ投射する.ここでは,この多様な神経回路がどのようなしくみにより形成されるのかについて,軸索ガイダンスタンパク質の役割に焦点をあてて解説する3).
1.軸索ガイダンスタンパク質
正確な神経回路ネットワークの形成には,発生期に軸索が標的のニューロンにむかって正しく伸長しシナプス結合を形成する必要がある.この軸索ガイダンスにかかわるタンパク質を軸索ガイダンスタンパク質とよぶ.軸索ガイダンスタンパク質のなかには,細胞の外に分泌されて拡散勾配を形成する遠距離作動性のものと,分泌されずに細胞の表面においてはたらく短距離作動性のものとが存在する4)(図2).両者ともに,誘引活性をもつあるいは反発活性をもつ軸索ガイダンスタンパク質がある.ここでは,軸索ガイダンスタンパク質として,Netrin,Semaphorin,Slit,Ephrinについて紹介する.
軸索を標的のニューロンまでみちびく誘引物質の存在は,スペインの解剖学者Cajalにより1世紀以上もまえから提案されていたが,そのような物質が実際に存在するかどうかは長らく不明であった.1980年代になり,神経培養系において特定の軸索を誘引する因子の存在が示され,そののち,ニワトリの胚の脳から分泌型で誘引活性をもつ軸索ガイダンスタンパク質としてNetrinが同定された5).Netrinは約80 kDaのタンパク質で,細胞外基質タンパク質であるラミニンのγ鎖と相同性をもつ.Netrinの受容体としては,ヒトの大腸がんにおける腫瘍抑制タンパク質であるDCC,および,線虫の変異体から同定されたUNC5がよく知られている6,7).成長円錐の反応性はこれら2つの受容体の発現パターンに依存し,DCCのみでは誘引,DCCおよびUNC5が共発現し細胞膜においてヘテロ二量体を形成すると反発を示す8).
大きなファミリーを形成する軸索ガイダンスタンパク質としてSemaphorin(Sema)がある.Semaphorinはニワトリの後根神経節細胞の成長円錐を退縮させるタンパク質として同定された9).そののち,20種類以上のSemaphorinが同定され,構造における特徴から7つのクラスに分類されている10).すべてのSemaphorinはN末端に約500アミノ酸残基からなるSemaドメインとよばれる特徴的な配列をもつが,それ以外のドメインは多様化しており,分泌型,膜貫通型,GPI結合型など,さまざまなタイプが存在する.Semaphorinは軸索の反発や伸長を阻害するタンパク質として広く認知されているが,軸索の誘引に機能する場合もある11).Semaphorinの受容体としてはNeuropilinおよびPlexinが同定されている12).
脳や脊髄などさまざまな軸索に対し反発活性をもつ軸索ガイダンスタンパク質としてSlitがある13).Slitは約1500アミノ酸残基からなる分泌型タンパク質であり,ロイシンリッチリピート配列,EGFリピート配列,ALPS(Agrin-Laminin-Perlecan-Slit spacer)配列をもつ.Slitはその受容体であるRoboを介してシグナルが伝達されるが,脊椎動物においてはSlitおよびRoboにはともに3つの相同遺伝子が存在する.
Ephrinはニワトリの眼の網膜から脳の1次視覚中枢である視蓋(マウスでは,上丘に相当)への投射においてよく研究されている軸索ガイダンスタンパク質である14).EphrinにはGPI結合型および膜貫通型があり,それぞれEphrinAおよびEphrinBと区分されている.Ephrinの受容体であるEphは細胞内にチロシンキナーゼドメインをもち,受容体との特異性にもとづきEphAおよびEphBに分けられる.さらに,EphとEphrinによる前向きのシグナル伝達系のほか,EphAがリガンド,EphrinAが受容体として機能する逆向きのシグナル伝達系が存在し,この双方向性のシグナル伝達により軸索投射機構は高度かつ複雑に制御されている15).
さて,筆者らは,新規の軸索ガイダンスタンパク質を同定するため,膜タンパク質や分泌タンパク質のcDNAを選択的にクローニングするシグナルシークエンストラップ法を用いて分子スクリーニングを行った.その結果,既知の軸索ガイダンスタンパク質とはまったく相同性のない新規の分泌型の軸索ガイダンスタンパク質を見い出し,Draxin(Dorsal repulsive axon guidance protein)と命名した16).Draxin遺伝子はニワトリあるいはマウスの胚において脳から脊髄にいたる中枢神経系の背側に発現し,脳や脊髄の交連ニューロンの軸索に対し反発活性をもっていた.たとえば,ニワトリの胚の脊髄にエレクトロポレーション法によりDraxinを過剰に発現させると,脊髄の交連ニューロンの軸索の成長が阻害された.さらに,Draxinノックアウトマウスでは大脳のすべての交連ニューロン(脳梁,海馬交連,前交連)において軸索の完全な欠損が観察された.これらの神経回路の異常は,これまでに述べた軸索ガイダンスタンパク質における変異マウスの表現型と比べてもより重篤であったことから,Draxinは脳における神経回路の形成においてきわめて重要な軸索ガイダンスタンパク質であると考えられた.
Draxinの受容体を同定するため,既知の軸索ガイダンスタンパク質の受容体のうちノックアウトマウスの表現型が類似するものについて,免疫沈降法によりDraxinとの結合性を調べた.その結果,DraxinはSlitの受容体であるRobo1やSemaphorinの受容体であるNeuropilin1とは結合しないが,Netrinの受容体であるDCCと特異的に結合することがわかった17).DCCノックアウトマウスではDraxinノックアウトマウスと同様に大脳のすべての交連ニューロンの形成不全が報告されており,これらの軸索投射においてDCCがDraxinの受容体として機能している可能性が示唆された.両者の関係をin vivoにおいて調べるため,DraxinとDCCとのダブルへテロノックアウトマウスの交連ニューロンを解析した.それぞれの単独のヘテロノックアウトマウスでは脳梁の完全な欠損はほぼ観察されなかった一方,ダブルへテロノックアウトマウスにおいては脳梁の完全な欠損が高頻度に観察され,DraxinとDCCとのあいだの遺伝的な相互作用が示された.さらに,DCCノックアウトマウスに由来する大脳新皮質の組織片(脳梁のニューロンを含む)では,野生型マウスに由来するニューロンを用いた場合に比べ,Draxinによる神経突起の伸長阻害が低減した.これらの結果から,Draxinノックアウトマウスにおける脳梁の形成異常はDCCを介したDraxinの反発活性の欠損により起こると考えられた.一方で,DraxinはDCCだけでなく,Netrinの受容体として知られているUNC5,Neogenin,Dscamとも結合する.今後,Draxinがこれらの受容体とどのように相互作用しシグナル伝達系を構成しているのかを理解する必要がある.
2.脳梁の形成機構
脳梁は左右の大脳半球をつなぐ交連線維の束である.哺乳動物の脳において脳梁はもっとも大きな神経束で,左右の大脳新皮質のあいだの情報をやりとりする重要な経路となっている.マウスの脳梁の場合,約80%のニューロンは第2/3層のニューロンから生じ,約20%のニューロンは第5層のニューロンから生じる.
脳梁における軸索の通路の選択にはおもに6箇所の決定ポイントがある18)(図3).最初,脳の表面の辺縁帯から分泌される反発活性をもつ軸索ガイダンスタンパク質Semaphorin3Aのはたらきにより,脳梁の軸索は腹側の中間帯にむかって伸長する19)(ポイント1).さらに,Semaphorin3Aは内外軸にそった濃度勾配を形成しており(内側で低く,外側で強い発現),脳梁の軸索が中間帯において正中線の側にむかうよう制御する20)(ポイント2).そののち,脳梁の軸索は正中線に存在するglial wedge,indusium griseum,subcallosal slingといった細胞のはたらきにより正中線を交差する21)(ポイント3).glial wedgeは左右対称に存在するグリア細胞であり,反発活性をもつ軸索ガイダンスタンパク質であるSlit2,Draxin,Wnt5aを発現している21).Slit2とDraxinは正中線を交差するまえの脳梁の軸索に対し反発活性を示し,その正中線の交差において必須である16,22)(ポイント3).一方,Wnt5aは正中線を交差したのちの脳梁の軸索に対し反発活性を示し,反対側の大脳新皮質にむかって伸長する過程において重要であると考えられている23)(ポイント4).indusium griseumは脳梁において軸索の背側にあるグリア細胞で,反発活性をもつ軸索ガイダンスタンパク質であるSlit2およびDraxinを発現することにより背側の障壁としてはたらく.また,ニューロンであるsubcallosal slingはSemaphorin3Cを発現し,その受容体であるNeuropilin1を発現する帯状皮質の軸索を誘引する24).重要なことに,帯状皮質の軸索は脳梁の軸索よりもさきに正中線を交差し,パイオニア軸索として脳梁の軸索の正中線の交差にかかわる25).最近,正中線の付近に発現するNetrin1の機能につき興味深い報告があった26).Netrin1は帯状皮質の軸索に対しては誘引活性をもつが,脳梁の軸索に対しては反応性がない.それにくわえ,脳梁の軸索が正中線にむかって伸長できるようNetrin1はSlit2の反発活性を抑制する.Ephrin-Ephシグナルも脳梁における軸索投射にかかわる.脳梁の軸索と正中線の付近のグリア細胞とのあいだのEphBとEphrinBとの相互作用が,脳梁の軸索が正中線を交差するのに重要である27).さらに,EphrinA-EphAシグナルが脳梁の軸索のあいだの相互作用を介してその軸索投射にかかわる28,29).大脳新皮質の内側から生じる軸索は脳梁の背側を,大脳新皮質の外側に由来する軸索は腹側を走行し,EphA3がこの軸索の分離を制御することが示されている.そのほか興味深い報告として,髄膜から分泌されるBMP7が脳梁における軸索投射にかかわることが示されている30).正中線を交差した脳梁の軸索は大脳新皮質に侵入し(ポイント5),最終的には神経活動に依存的な機構により正しい標的ニューロンへ投射する(ポイント6).
3.皮質脊髄路の形成機構
皮質脊髄路は大脳新皮質から脊髄にかけて走行する軸索で,おもに皮質運動野の第5層のニューロンに発する(図4).皮質運動野から生じる皮質脊髄路の軸索は内包を下行し,中脳,後脳を通過したのち,延髄においてほとんどの軸索(80~85%)が反対側に交差し錐体交差を形成する.最終的に,皮質脊髄路の軸索は脊髄灰白質のニューロンに投射する.
最初,皮質脊髄路の軸索は誘引活性をもつ軸索ガイダンスタンパク質Semaphorin3Cと反発活性をもつ軸索ガイダンスタンパク質Semaphorin3Aのはたらきにより皮質板から中間帯にむけて伸長する31).さらに,基底核原基から分泌される誘引活性をもつ軸索ガイダンスタンパク質Netrin1のはたらきにより内包へ誘導され32,33),そののち,皮質視床の軸索とは分離して中脳の大脳脚に入る.皮質脊髄のニューロンに発現するRobo1とRobo2とのダブルノックアウトマウスでは皮質脊髄路の軸索は正中線を異常に交差することから,反発活性をもつ軸索ガイダンスタンパク質Slit1およびSlit2が,その受容体であるRobo1およびRobo2を介して正中線の側へむかわないよう制御していると考えられる34).後脳に侵入した皮質脊髄路の軸索の多くは延髄において正中線を交差するが,この過程には,軸索ガイダンスタンパク質であるNetrin1およびSemaphorin6A,細胞接着分子であるNCAMおよびL1など,複数のタンパク質が関与している35-38).たとえば,Semaphorin6Aの反発活性,NCAMとL1による軸索のあいだの相互作用が皮質脊髄路の軸索が正中線を交差するのに重要である.そのほか,Ephrin-Ephシグナルは皮質脊髄路の軸索の再交差による左右の神経回路の混線を防ぐように機能する.つまり,皮質脊髄路の軸索に発現するEphA4と,正中線の腹側に発現するEphrinB3との反発性の相互作用により,皮質脊髄路の軸索がふたたび正中線を交差しないように制御されている.興味深いことに,Ephrin-Ephシグナルに関連するタンパク質の変異マウスは,ウサギのように左右の脚をそろえてはねる歩き方を示す.同様の表現型を示す変異マウスの系統の確立と,それにつづくポジショナルクローニングにより,αキメリンに変異が同定された39).さらに,生化学的な手法を含む詳細な解析により,αキメリンがEphrin-Ephシグナルの下流において皮質脊髄路の軸索の伸長を促進するRacのはたらきを抑制することが明らかにされた.
皮質脊髄路の軸索は,随意運動神経の障害をひき起こす筋萎縮性側索硬化症や脊髄の損傷による運動機能の障害などに直結するため,その発生や再生の研究は臨床的にも重要である.ヒトなどの霊長類では中枢神経の軸索の再生能力が低いため,脊髄の損傷により運動機能の脱落症状が生じると生涯にわたり後遺症が残る.この要因のひとつとして,中枢神経系には損傷ののち軸索の再生を阻害するタンパク質が発現すると考えられている.実際に,損傷の周辺には軸索伸長の阻害タンパク質であるNogoや,反発活性をもつ軸索ガイダンスタンパク質であるSemaphorin3Aが発現する40).また,GPIアンカータンパク質であるRGMの発現が脊髄の損傷部位において上昇することが見い出され41,42),さらに,ラットの脊髄を損傷したのちRGMの効果を中和する抗体を投与することにより,皮質脊髄路の軸索の再生と運動機能の改善に成功した.このような軸索の再生を阻害するタンパク質を標的とした治療法の開発により,将来的には機能的な中枢神経の再生をみちびくことが可能になると期待される.
4.視床皮質における軸索投射機構
哺乳動物において,視床は嗅覚のほかのあらゆる感覚情報(体性感覚,痛覚,視覚,聴覚,味覚など)を大脳新皮質へと伝達する中継地である.それぞれの感覚情報は視床核に発する視床皮質の軸索により大脳新皮質の特異的な領域に伝達される43).視床皮質の軸索は視床下部にむかって伸長を開始し,そののち,内包にむけてその方向を変える.Slit1とSlit2とのダブルノックアウトマウスの解析から,視床下部および正中線に発現する軸索ガイダンスタンパク質Slitの反発活性がこの軸索ガイダンスに重要であることが示されている44)(図5a).視床下部とは対照的に,腹側終脳は視床皮質の軸索に対し誘引作用をもつ.とくに,Corridor細胞と名づけられたニューロンが視床皮質の軸索の走行に重要である45).Corridor細胞は外側基底核原基に発し,視床皮質の軸索に対し誘引活性をもつ軸索ガイダンスタンパク質Neuregulin1を発現する(図5a).
このように,腹側終脳は視床皮質の軸索の中間標的部位として重要であるが,さらに,視床皮質の軸索のトポグラフィックな投射を最初に制御する領域でもある.トポグラフィクな投射とは,ある領域のニューロンが互いの相対的な位置情報を保持した状態のまま標的となる領域のニューロンにシナプスを形成することである.視床皮質の軸索の場合,前後軸にそったトポグラフィクな投射パターンが観察される46).たとえば,外側腹側核から発する軸索は前頭皮質に投射し,外側膝状核から発する軸索は1次視覚野に投射する(図5b).つまり,視床の前部から生じる軸索は大脳新皮質の前方の領域に,視床の後部から生じる軸索は大脳新皮質の後方の領域に投射するというトポグラフィックな投射が存在する.最初,腹側終脳に発現する転写因子Ebf1およびDlx1,Dlx2の変異マウスの解析から,大脳新皮質に侵入するまえの腹側終脳において視床皮質の軸索のトポグラフィックな投射が制御されていることが示された47).その数年後,EphrinA-EphAシグナルがこの過程にかかわることが明らかにされた48).EphrinA5の受容体であるEphA3,EphA4,EphA7の発現は,背側視床において前部で高く後部で低い濃度勾配をもつ(図5b).この濃度勾配は,腹側終脳において後部で高く前部で低いEphrinA5の濃度勾配とは相補的である(図5b).さらに,in vitroにおいてEphrinA5は反発活性をもつ示したことから,EphAを高発現する視床の前部からの軸索は,EphrinA5を高発現する腹側終脳の後部の領域をさけるよう投射すると考えられる.実際に,EphrinA5とEphA4とのダブルノックアウトマウスでは,視床の前部からの軸索投射は腹側終脳において後方へとシフトした.
軸索ガイダンスタンパク質Netrin1も腹側終脳において前部で高く後部で低い濃度勾配をもち発現する49)(図5b).Netrin1は視床の前部に発する軸索に対しては誘引活性をもつ一方,視床の後部に発する軸索に対しては反発活性を示す.この反応性の違いは,さきに述べた受容体の発現の差異により生じる.背側視床においてDCCは前部に高く後部に低い濃度勾配をもつことから,視床の前部に発する軸索に対する誘引活性にNetrin1-DCCシグナルが重要であると考えられる.一方,Unc5A,Unc5B,Unc5Cは視床の後部に強く発現することから,Netrin1-DCC//-Unc5シグナルが視床の後部に発する軸索に対する反発活性を制御していると考えられる.そのほか,反発活性をもつ軸索ガイダンスタンパク質Slit1が腹側終脳においてNetrin1と同様の濃度勾配をもち,視床皮質の軸索のトポグラフィックな投射にかかわることが示されている50).
腹側終脳において分離された視床皮質の軸索は,最終的には大脳新皮質において特異的な領域に投射するよう制御される.ラットの胎仔16日目の大脳新皮質の前部の領域を出生後のラットの大脳新皮質の後部の領域に移植すると,外側腹側核および内側腹側核からの軸索が正常な標的である前頭部のみならず,移植された後方の領域へ投射される.このことから,大脳新皮質は視床皮質における軸索投射を制御する重要なタンパク質を発現していると考えられる.重要なことに,大脳新皮質に発現するタンパク質の機能解析から,モルフォゲンであるFGF8が大脳新皮質の領野の形成に必要であることが示されている51).子宮内エレクトロポレーション法によりFGF8を異所的に発現させると,後頭部において異所的なバレル野が誘導された.さらに,この異所的なバレル野の形成は視床皮質の軸索のトポグラフィックな投射にも影響をあたえた52).このように,視床皮質の軸索のトポグラフィックな投射は,腹側終脳にくわえ大脳新皮質に発現するタンパク質により制御されている.
視床皮質の軸索は内包を通過したのち大脳新皮質に侵入するが,この過程には大脳新皮質から内包にむかう皮質下行性の軸索が必須である.たとえば,皮質下行性のパイオニア軸索をもつサブプレートニューロンを破壊すると視床皮質の軸索の投射に異常が生じる53).1990年,皮質下行性の軸索と視床皮質の軸索とが内包において出会ったのち,互いに軸索投射をガイドするというハンドシェイクモデルが提唱された54)(図5c).そののち,Tbr1,Fez-like,Pax6,Gbx2,Emx2など,さまざまな転写因子の変異マウスの解析から,皮質下行性の軸索と視床皮質の軸索の投射は互いに依存することが示唆され,ハンドシェイクモデルを支持する報告が数多くなされた43).一方で,この軸索のあいだの相互作用の存在に否定的な報告もある.たとえば,皮質下行性の軸索と視床皮質の軸索とは大脳新皮質の中間帯において異なる区画に存在するため,直接的には相互作用しないのではないかというものである55).また,培養実験において皮質下行性の軸索と視床皮質の軸索の成長円錐が反発しあうことが観察されており,これは両者の軸索が誘引しあうことを想定するハンドシェイクモデルとは矛盾するように思われる56).
最近になり,新たにハンドシェイクモデルを支持する2つの報告がなされた.すなわち,皮質下行性の軸索のみに異常をもつコンディショナルノックアウトマウスでは視床皮質の軸索は大脳新皮質に侵入できないことが示された57).これは,皮質下行性の軸索が視床皮質の軸索の投射に必須であることを示す直接的な証拠となった.また反対に,視床皮質ニューロンを破壊すると皮質下行性の軸索の投射に異常の生じることが観察され58),視床皮質の軸索が皮質下行性の軸索の投射に必須であることが示された.このように,さまざまな実験結果からハンドシェイクモデルが支持されているが,この議論に決着をつけるためには,この軸索のあいだの相互作用に直接的にかかわるタンパク質の同定が必要である.
5.軸索ガイダンス研究の新展開
軸索ガイダンスタンパク質の機能を制御する機構として,成長円錐における局所的な翻訳が重要であることが報告されている59).軸索ガイダンスタンパク質Netrin1の非存在下ではDCCとリボソームとが結合し翻訳を抑制するが,DCCにNetrin1が結合するとDCCからリボソームが解離し翻訳が開始することが示された.実際に,脊髄の交連ニューロンの軸索に対するNetrin1の誘引活性に成長円錐における翻訳が必要であることが示されている.SemaphorinやSlitなどほかの軸索ガイダンスタンパク質に関しても局所的な翻訳がそれらの機能において必要であることが明らかにされており,今後,より詳細な分子レベルでの解析が期待される.
最近,視床皮質の軸索の発生の機構に関して2つの興味深い報告があった.発生の初期段階における視床のニューロンでの自発的な神経活動が,視床皮質の軸索の伸長の速度を制御することが示された60).その分子機構として,視床のニューロンにおけるRobo1の発現が自発的な神経活動により制御されることが明らかにされている.また,出生が神経回路の形成の開始を制御することが報告された61).出生を契機とした細胞外のセロトニン濃度の低下が大脳新皮質の1次体性感覚野に存在するバレルの形成を制御することが示され,出生による神経回路の形成の制御という新しい概念が提示された.
おわりに
ここでは,大脳新皮質の主要な神経回路である脳梁,皮質脊髄路の軸索,視床皮質の軸索がどのように形成されるかについて解説した.これまでの多くの遺伝子改変動物の解析から,単一の軸索ガイダンスタンパク質の役割についての理解は深まっている.一方で,実際の神経回路の形成期には複数の軸索ガイダンスタンパク質が共同ではたらくと考えられる.近年,神経回路の形成のさまざまな局面において,複数の軸索ガイダンスシグナルのクロストークが明らかにされつつある.今後,脳における複雑かつ精巧な神経回路の形成の機構を理解するためには,複数の軸索ガイダンスシグナルがニューロンにおいてどのように統合されているのかを明らかにする必要がある.さらに,最後に述べた,成長円錐における局所的な翻訳,発生の初期段階におけるニューロンの自発的な神経活動,あるいは,出生など新たな観点からの研究により,今後,脳における神経回路の形成の理解がますます進むと期待される.
文 献
- Molyneaux, B. J., Arlotta, P., Menezes, J. R. et al.: Neuronal subtype specification in the cerebral cortex. Nat. Rev. Neurosci., 8, 427-437 (2007)[PubMed]
- Fishell, G. & Hanashima, C.: Pyramidal neurons grow up and change their mind. Neuron, 57, 333-338 (2008)[PubMed]
- Leyva-Diaz, E. & Lopez-Bendito, G.: In and out from the cortex: development of major forebrain connections. Neuroscience, 254, 26-44 (2013)[PubMed]
- Tessier-Lavigne, M. & Goodman, C. S.: The molecular biology of axon guidance. Science, 274, 1123-1133 (1996)[PubMed]
- Serafini, T., Kennedy, T. E., Galko, M. J. et al.: The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6. Cell, 78, 409-424 (1994)[PubMed]
- Keino-Masu, K., Masu, M., Hinck, L. et al.: Deleted in Colorectal Cancer (DCC) encodes a netrin receptor. Cell, 87, 175-185 (1996)[PubMed]
- Leonardo, E. D., Hinck, L., Masu, M. et al.: Vertebrate homologues of C. elegans UNC-5 are candidate netrin receptors. Nature, 386, 833-838 (1997)[PubMed]
- Hong, K., Hinck, L., Nishiyama, M. et al.: A ligand-gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion. Cell, 97, 927-941 (1999)[PubMed]
- Luo, Y., Raible, D. & Raper, J. A.: Collapsin: a protein in brain that induces the collapse and paralysis of neuronal growth cones. Cell, 75, 217-227 (1993)[PubMed]
- Chisholm, A. & Tessier-Lavigne, M.: Conservation and divergence of axon guidance mechanisms. Curr. Opin. Neurobiol., 9, 603-615 (1999)[PubMed]
- Kantor, D. B., Chivatakarn, O., Peer, K. L. et al.: Semaphorin 5A is a bifunctional axon guidance cue regulated by heparan and chondroitin sulfate proteoglycans. Neuron, 44, 961-975 (2004)[PubMed]
- Fujisawa, H.: Discovery of semaphorin receptors, neuropilin and plexin, and their functions in neural development. J. Neurobiol., 59, 24-33 (2004)[PubMed]
- Brose, K. & Tessier-Lavigne, M.: Slit proteins: key regulators of axon guidance, axonal branching, and cell migration. Curr. Opin. Neurobiol., 10, 95-102 (2000)[PubMed]
- Flanagan, J. G. & Vanderhaeghen, P.: The ephrins and Eph receptors in neural development. Annu. Rev. Neurosci., 21, 309-345 (1998)[PubMed]
- Rashid, T., Upton, A. L., Blentic, A. et al.: Opposing gradients of ephrin-As and EphA7 in the superior colliculus are essential for topographic mapping in the mammalian visual system. Neuron, 47, 57-69 (2005)[PubMed]
- Islam, S. M., Shinmyo, Y., Okafuji, T. et al.: Draxin, a repulsive guidance protein for spinal cord and forebrain commissures. Science, 323, 388-393 (2009)[PubMed]
- Ahmed, G., Shinmyo, Y., Ohta, K. et al.: Draxin inhibits axonal outgrowth through the netrin receptor DCC. J. Neurosci., 31, 14018-14023 (2011)[PubMed]
- Richards, L. J., Plachez, C. & Ren, T.: Mechanisms regulating the development of the corpus callosum and its agenesis in mouse and human. Clin. Genet., 66, 276-289 (2004)[PubMed]
- Polleux, F., Giger, R. J., Ginty, D. D. et al.: Patterning of cortical efferent projections by semaphorin-neuropilin interactions. Science, 282, 1904-1906 (1998)[PubMed]
- Zhao, H., Maruyama, T., Hattori, Y. et al.: A molecular mechanism that regulates medially oriented axonal growth of upper layer neurons in the developing neocortex. J. Comp. Neurol., 519, 834-848 (2011)[PubMed]
- Lindwall, C., Fothergill, T. & Richards, L. J.: Commissure formation in the mammalian forebrain. Curr. Opin. Neurobiol., 17, 3-14 (2007)[PubMed]
- Shu, T. & Richards, L. J.: Cortical axon guidance by the glial wedge during the development of the corpus callosum. J. Neurosci., 21, 2749-2758 (2001)[PubMed]
- Keeble, T. R., Halford, M. M., Seaman, C. et al.: The Wnt receptor Ryk is required for Wnt5a-mediated axon guidance on the contralateral side of the corpus callosum. J. Neurosci., 26, 5840-5848 (2006)[PubMed]
- Niquille, M., Garel, S., Mann, F. et al.: Transient neuronal populations are required to guide callosal axons: a role for semaphorin 3C. PLoS Biol., 7, e1000230 (2009)[PubMed]
- Piper, M., Plachez, C., Zalucki, O. et al.: Neuropilin 1-Sema signaling regulates crossing of cingulate pioneering axons during development of the corpus callosum. Cereb. Cortex, 19 (Suppl.1), i11-i21 (2009)[PubMed]
- Fothergill, T., Donahoo, A. L., Douglass, A. et al.: Netrin-DCC signaling regulates corpus callosum formation through attraction of pioneering axons and by modulating Slit2-mediated repulsion. Cereb. Cortex, 24, 1138-1151 (2014)[PubMed]
- Mendes, S. W., Henkemeyer, M. & Liebl, D. J.: Multiple Eph receptors and B-class ephrins regulate midline crossing of corpus callosum fibers in the developing mouse forebrain. J. Neurosci., 26, 882-892 (2006)[PubMed]
- Nishikimi, M., Oishi, K. & Nakajima, K.: Axon guidance mechanisms for establishment of callosal connections. Neural Plast., 2013, 149060 (2013)[PubMed]
- Nishikimi, M., Oishi, K., Tabata, H. et al.: Segregation and pathfinding of callosal axons through EphA3 signaling. J. Neurosci., 31, 16251-16260 (2011)[PubMed]
- Choe, Y., Siegenthaler, J. A. & Pleasure, S. J.: A cascade of morphogenic signaling initiated by the meninges controls corpus callosum formation. Neuron, 73, 698-712 (2012)[PubMed]
- Bagnard, D., Lohrum, M., Uziel, D. et al.: Semaphorins act as attractive and repulsive guidance signals during the development of cortical projections. Development, 125, 5043-5053 (1998)[PubMed]
- Richards, L. J., Koester, S. E., Tuttle, R. et al.: Directed growth of early cortical axons is influenced by a chemoattractant released from an intermediate target. J. Neurosci., 17, 2445-2458 (1997)[PubMed]
- Metin, C., Deleglise, D., Serafini, T. et al.: A role for netrin-1 in the guidance of cortical efferents. Development, 124, 5063-5074 (1997)[PubMed]
- Lopez-Bendito, G., Flames, N., Ma, L. et al.: Robo1 and Robo2 cooperate to control the guidance of major axonal tracts in the mammalian forebrain. J. Neurosci., 27, 3395-3407 (2007)[PubMed]
- Finger, J. H., Bronson, R. T., Harris, B. et al.: The netrin 1 receptors Unc5h3 and Dcc are necessary at multiple choice points for the guidance of corticospinal tract axons. J. Neurosci., 22, 10346-10356 (2002)[PubMed]
- Cohen, S. & Greenberg, M. E.: Communication between the synapse and the nucleus in neuronal development, plasticity, and disease. Annu. Rev. Cell Dev. Biol., 24, 183-209 (2008)[PubMed]
- Runker, A. E., Little, G. E., Suto, F. et al.: Semaphorin-6A controls guidance of corticospinal tract axons at multiple choice points. Neural Dev., 3, 34 (2008)[PubMed]
- Faulkner, R. L., Low, L. K., Liu, X. B. et al.: Dorsal turning of motor corticospinal axons at the pyramidal decussation requires plexin signaling. Neural Dev., 3, 21 (2008)[PubMed]
- Iwasato, T., Katoh, H., Nishimaru, H. et al.: Rac-GAP α-chimerin regulates motor-circuit formation as a key mediator of EphrinB3/EphA4 forward signaling. Cell, 130, 742-753 (2007)[PubMed]
- Ueno, M. & Yamashita, T.: Strategies for regenerating injured axons after spinal cord injury - insights from brain development. Biologics, 2, 253-264 (2008)[PubMed]
- Hata, K., Fujitani, M., Yasuda, Y. et al.: RGMa inhibition promotes axonal growth and recovery after spinal cord injury. J. Cell Biol., 173, 47-58 (2006)[PubMed]
- Hata, K., Kaibuchi, K., Inagaki, S. et al.: Unc5B associates with LARG to mediate the action of repulsive guidance molecule. J. Cell Biol., 184, 737-750 (2009)[PubMed]
- Lopez-Bendito, G. & Molnar, Z.: Thalamocortical development: how are we going to get there? Nat. Rev. Neurosci., 4, 276-289 (2003)[PubMed]
- Bagri, A., Marin, O., Plump, A. S. et al.: Slit proteins prevent midline crossing and determine the dorsoventral position of major axonal pathways in the mammalian forebrain. Neuron, 33, 233-248 (2002)[PubMed]
- Lopez-Bendito, G., Cautinat, A., Sanchez, J. A. et al.: Tangential neuronal migration controls axon guidance: a role for neuregulin-1 in thalamocortical axon navigation. Cell, 125, 127-142 (2006)[PubMed]
- Vanderhaeghen, P. & Polleux, F.: Developmental mechanisms patterning thalamocortical projections: intrinsic, extrinsic and in between. Trends Neurosci., 27, 384-391 (2004)[PubMed]
- Garel, S., Yun, K., Grosschedl, R. et al.: The early topography of thalamocortical projections is shifted in Ebf1 and Dlx1/2 mutant mice. Development, 129, 5621-5634 (2002)[PubMed]
- Dufour, A., Seibt, J., Passante, L. et al.: Area specificity and topography of thalamocortical projections are controlled by ephrin/Eph genes. Neuron, 39, 453-465 (2003)[PubMed]
- Powell, A. W., Sassa, T., Wu, Y. et al.: Topography of thalamic projections requires attractive and repulsive functions of Netrin-1 in the ventral telencephalon. PLoS Biol., 6, e116 (2008)[PubMed]
- Bielle, F., Marcos-Mondejar, P., Leyva-Diaz, E. et al.: Emergent growth cone responses to combinations of Slit1 and Netrin 1 in thalamocortical axon topography. Curr. Biol., 21, 1748-1755 (2011)[PubMed]
- Fukuchi-Shimogori, T. & Grove, E. A.: Neocortex patterning by the secreted signaling molecule FGF8. Science, 294, 1071-1074 (2001)[PubMed]
- Shimogori, T. & Grove, E. A.: Fibroblast growth factor 8 regulates neocortical guidance of area-specific thalamic innervation. J. Neurosci., 25, 6550-6560 (2005)[PubMed]
- Ghosh, A., Antonini, A., McConnell, S. K. et al.: Requirement for subplate neurons in the formation of thalamocortical connections. Nature, 347, 179-181 (1990)[PubMed]
- Blakemore, C. & Molnar, Z.: Factors involved in the establishment of specific interconnections between thalamus and cerebral cortex. Cold Spring Harb. Symp. Quant. Biol., 55, 491-504 (1990)[PubMed]
- Miller, B., Chou, L. & Finlay, B. L.: The early development of thalamocortical and corticothalamic projections. J. Comp. Neurol., 335, 16-41 (1993)[PubMed]
- Bagnard, D., Chounlamountri, N., Puschel, A. W. et al.: Axonal surface molecules act in combination with semaphorin 3a during the establishment of corticothalamic projections. Cereb. Cortex, 11, 278-285 (2001)[PubMed]
- Chen, Y., Magnani, D., Theil, T. et al.: Evidence that descending cortical axons are essential for thalamocortical axons to cross the pallial-subpallial boundary in the embryonic forebrain. PLoS One, 7, e33105 (2012)[PubMed]
- Deck, M., Lokmane, L., Chauvet, S. et al.: Pathfinding of corticothalamic axons relies on a rendezvous with thalamic projections. Neuronn 77, 472-484 (2013)[PubMed]
- Tcherkezian, J., Brittis, P. A., Thomas, F. et al.: Transmembrane receptor DCC associates with protein synthesis machinery and regulates translation. Cell, 141, 632-644 (2010)[PubMed]
- Mire, E., Mezzera, C., Leyva-Diaz, E. et al.: Spontaneous activity regulates Robo1 transcription to mediate a switch in thalamocortical axon growth. Nat. Neurosci., 15, 1134-1143 (2012)[PubMed]
- Toda, T., Homma, D., Tokuoka, H. et al.: Birth regulates the initiation of sensory map formation through serotonin signaling. Dev. Cell, 27, 32-46 (2013)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:2005年 徳島大学大学院工学研究科博士課程 修了,同年 熊本大学発生医学研究センター 研究員を経て,2006年より熊本大学大学院生命科学研究部 助教.
研究テーマ:脳における神経回路ネットワークの多様性をみちびく分子機構に興味をもち,軸索ガイダンスタンパク質Draxinについて研究している.
田中 英明(Hideaki Tanaka)
熊本大学大学院生命科学研究部 元 教授.
研究室URL:http://kumamoto.devneurobiology-u.jp/
© 2014 新明洋平・田中英明 Licensed under CC 表示 2.1 日本