低容量ストレスに対する細胞応答
2014/04/23
樽本雄介・石川冬木
(京都大学大学院生命科学研究科 細胞周期学分野)
email:樽本雄介,石川冬木
領域融合レビュー, 3, e004 (2014) DOI: 10.7875/leading.author.3.e004
Yusuke Tarumoto & Fuyuki Ishikawa: Cellular response to low-dose stress.

生物が生存するうえで環境変化を要因とする種々のストレスに適応することは重要である.遺伝子の発現制御は細胞のストレス応答において中心的な役割を担っており,転写や翻訳など多段階において綿密な制御をうけている.生物のさらされるストレスの多くは単独では明確な表現型をもたらさない低容量のストレスであり,それらの蓄積が老化やがんなどの疾患にかかわると示唆されている.しかし,これまでのストレスの研究は細胞死など表現型の観察の容易な高容量のストレスへの応答の解析が中心であり,低容量ストレスへの応答についての理解は十分ではない.このレビューでは,細胞レベルにおけるストレス応答を中心に,低容量ストレスに対する応答につき明らかになっている知見を述べ,そののち,分裂酵母を用いた低容量ストレス応答の解析に関する筆者らの研究につきふれる.
すべての生物は周囲からさまざまな情報を得て生存しており,温度や栄養状態の変化など環境変動を要因とするストレスをうけている.そのようなストレスに対し迅速に適応することは生物の生存や子孫の繁栄において有利であることから,生物は進化の過程で巧妙なストレス防御機構を獲得し発達させてきたと考えられる.これまでの研究においてストレス応答にかかわる多くのタンパク質が同定され,それらの機能する複雑な分子機構が明らかにされてきた.
生物のうける環境からのストレスの多くは,それ単独では細胞死など明確な表現型を示さないような低容量のストレスであると考えられる.たとえば,好気的な条件に存在する生物はみな低容量の紫外線によるストレスおよび低容量の活性酸素による酸化ストレスにさらされている.また,自然の環境は一定ではなくつねに変動しているため,生物がうけるストレスの強度や種類も時間とともに変動するであろう.そういった環境における生存のため,生物は低容量のストレスや変動するストレスに対する防御機構を基本的な機能として備えていると考えられる.
温度,浸透圧,pH,活性酸素,栄養分などの環境が変化することは細胞内の恒常性を維持するうえで好ましくなく,細胞にとりストレスとなる.これは単細胞生物においてだけではなく,多細胞生物のひとつの細胞も,程度に違いはあるものの周囲の環境からのストレスをうけており,細胞レベルにおける適切なストレス応答は重要である.ストレスの種類や強度あるいは生物種により多少の違いはあるが,ストレス応答機構として主要なものが遺伝子の発現制御である.
細胞がストレスにさらされた際に,それに応答して遺伝子の発現が起こるためには多くの重要な段階がある.詳細はほかの総説にゆだねるが1-3),以下,その概要を述べる.まず,細胞内外の変化をストレスとして感知するセンサーが必要である.たとえば,熱ショックタンパク質は温度変化により変性したタンパク質を検出し,熱ストレス応答をひき起こすセンサーとなる.ストレスの種類によりそれを認識する分子機構は異なっており,多くは細胞膜あるいは細胞質に存在するタンパク質がストレスセンサーとして機能する.ただし,そのようなセンサーがまだ明らかでない場合もある.
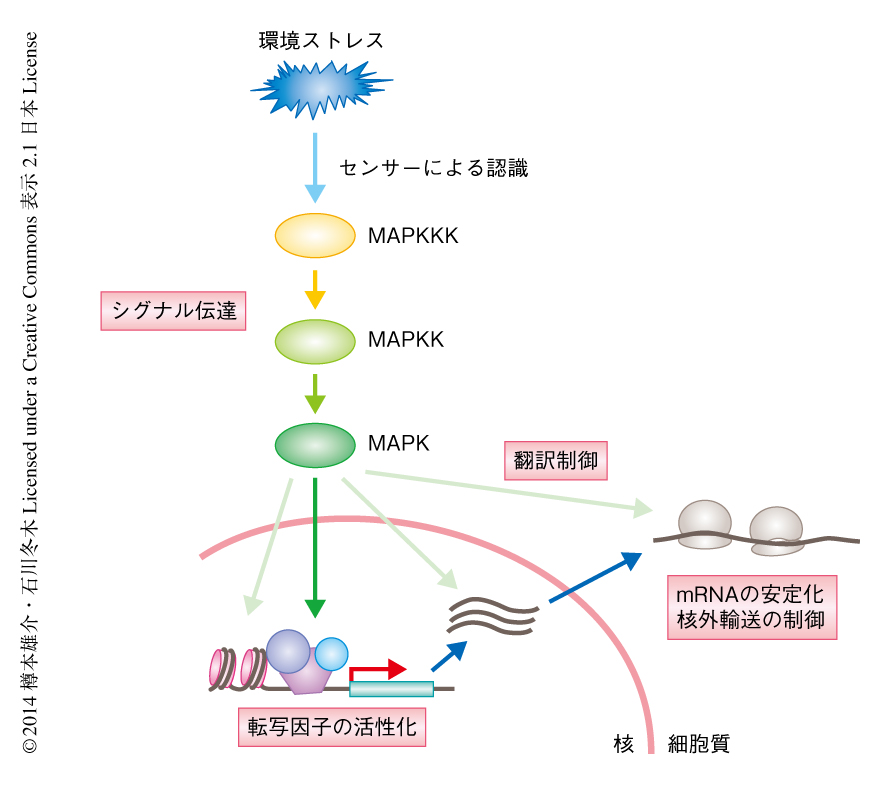
ついで,センサーからのシグナルは核へと伝達される2)(図1).もっとも重要なシグナル伝達経路のひとつはMAPキナーゼを介するものであり,MAPキナーゼキナーゼキナーゼ(MAPKKK),MAPキナーゼキナーゼ(MAPKK),MAPキナーゼ(MAPK)と,酵母からヒトまでよく保存された3つのリン酸化酵素によるシグナル伝達カスケードからなる.哺乳類の細胞ではp38とJNK(c-Jun N-terminal kinase)の2つがストレス応答性MAPキナーゼとして知られており,さまざまなストレスのもとで活性化される.活性化したMAPキナーゼは核において転写因子をリン酸化により活性化することでストレス応答性遺伝子の発現を誘導する.また,それ以外にも,MAPキナーゼはクロマチン制御に関与するタンパク質,mRNAの安定性や翻訳にかかわるタンパク質など,さまざまなタンパク質の機能制御をとおして遺伝子の発現制御に関与することが知られている.なお,このようなストレス応答性のシグナル伝達や遺伝子発現が過剰に起こると細胞の生存や増殖に悪影響を及ぼすため,活性化あるいは発現の誘導されたタンパク質による負のフィードバック制御がはたらいている.すばやいオンとオフの切り替えを可能にすることにより,細胞は変動する環境に適応することができると考えられる.
酵母やヒトなどにおいてはストレス応答性遺伝子の転写の特徴として,ハウスキーピング遺伝子や増殖に関連した遺伝子と比較して,遺伝子プロモーターにTATAボックスをもつ割合が高く,転写を開始する際にヒストンアセチル化酵素を含むSAGA複合体による制御が重要であることが知られている1).また,ショウジョウバエにおいては熱ショックタンパク質のひとつHsp70の遺伝子の領域に転写開始の直後の状態で停止したRNAポリメラーゼが局在しており,ストレス応答の際の転写はRNAポリメラーゼの伸長段階から再開することですばやい転写が可能になっている.このような停止したポリメラーゼの存在は哺乳類の細胞においても知られており,刺激に対する迅速な細胞応答を可能にしていると考えられている2).
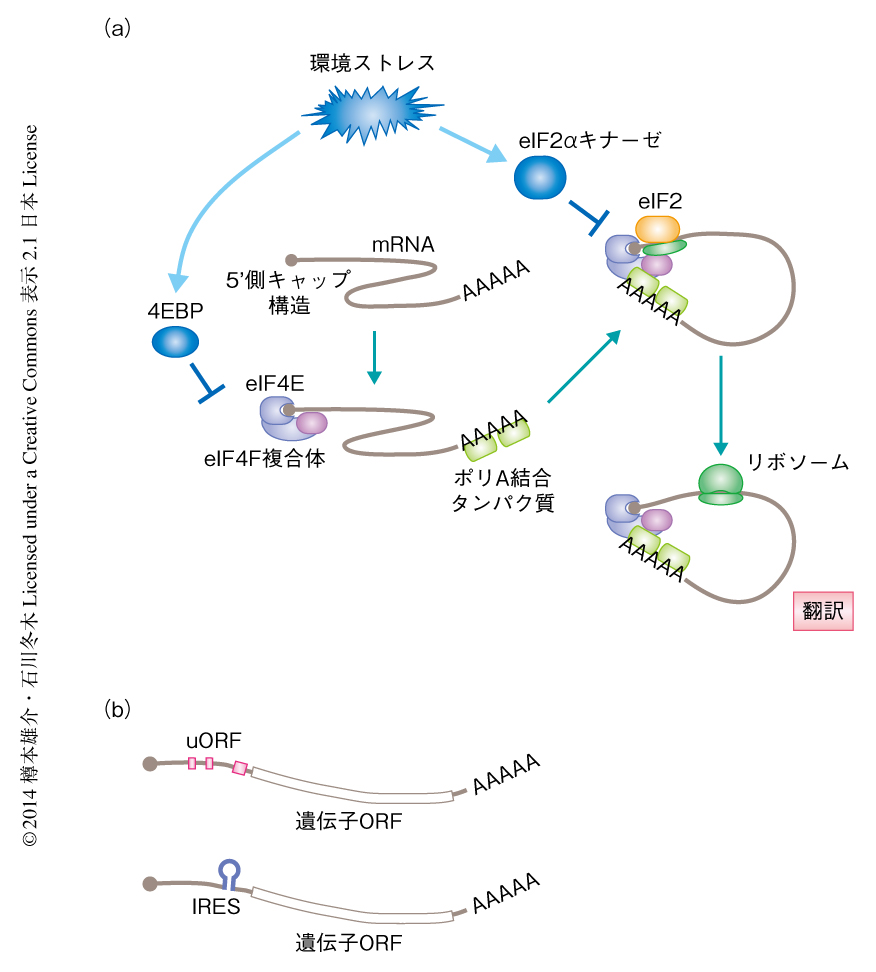
mRNAが転写されたのちの遺伝子の発現制御,とくに,翻訳開始の段階の制御もストレス応答機構として重要である.典型的な翻訳は,mRNAの5’側キャップ構造に翻訳開始因子複合体であるeIF4F複合体が,3’側にポリA結合タンパク質が結合し,mRNAがループ状の構造をとったのち,開始tRNAを含むeIF2複合体や翻訳に必要なほかのタンパク質が供給されることにより開始する.eIF2は翻訳開始とともにリボソームから離れたのち,ふたたび活性化されてつぎの翻訳開始に使用される.しかし,細胞がストレスにさらされるとeIF2のαサブユニット(eIF2α)のリン酸化により再活性化が阻害されるため,開始tRNAの供給量が減少して細胞全体の翻訳開始が抑制される(図2a).eIF2αキナーゼは複数あり(哺乳類では,GCN2,PKR,PERK,HRIの4つ),それぞれ異なる種類のストレスにより活性化される4).また,eIF4F複合体に含まれるeIF4Eは結合タンパク質である4EBPにより阻害される(図2a).栄養が十分にあるときはTorキナーゼが4EBPを抑制しているが,栄養飢餓の際にはその抑制が低下し4EBPがeIF4Eの機能を阻害することにより翻訳の効率は大きく低下する3).一方で,このような条件においても選択的に翻訳される遺伝子が存在する(図2b).まずあげられるのは,mRNAの5’側非翻訳領域に複数の小さなORF(uORF)をもつ遺伝子である.たとえば,ストレス応答に重要な転写因子である出芽酵母のGCN4や哺乳類のATF4などをコードするmRNAは,eIF2αのリン酸化が起こった際に翻訳の効率が上昇する4).また,IRES(internal ribosome entry site)をもつmRNAは5’側キャップ構造に非依存的に翻訳が開始できることから,eIF4Eが阻害された場合でも翻訳される3).さらに,ストレス応答の際に発現するマイクロRNAによっても特定の遺伝子の翻訳が制御される.翻訳が抑制されたmRNAは細胞質においてストレス顆粒あるいはPボディとよばれる構造体を形成し,少なくともその一部はストレスが除かれたのち翻訳が再開することが知られている5).
ここまで述べたストレス応答機構の多くは,低容量のストレスに対しても機能すると考えられる.しかし,入力となる刺激が小さい場合には,細胞の応答が確率論的な影響をうける場合がある.たとえば,出芽酵母において低容量の浸透圧ストレスを処理した際には,集団にはそのストレスに応答して遺伝子を発現した細胞と応答しなかった細胞とが現われる6).このとき,浸透圧ストレス応答に重要なMAPキナーゼであるHog1(哺乳類のp38のホモログ)の活性化の程度はストレスの強度に比例して増加し,Hog1により誘導される遺伝子の発現量とは必ずしも相関しない.つまり,転写の活性化には閾値のあることが示唆される.このような二峰性の応答においてはクロマチン構造の制御が重要だと考えられている6).また,低容量ストレスあるいは高容量ストレスにより処理した出芽酵母のmRNAおよびタンパク質の量を網羅的に調べた結果では,高容量ストレスを処理したときには多くのmRNAおよびタンパク質の発現量が変動し,おのおのの遺伝子においてmRNAの変動とタンパク質の変動とは相関したが,低容量ストレスを処理したときにはmRNAの変動とタンパク質の変動とは必ずしも相関しない7).同時に,低容量ストレスに応答する際の細胞内のタンパク質の変動にあたえる影響は,転写によるものより翻訳によるもののほうが大きいことが示されている.一方,分裂酵母では酸化ストレスの強度に応じて異なる転写因子による遺伝子の発現が中心的な役割を担うことが知られている8).これらの報告は,ストレスの強度により異なる分子機構あるいは異なる制御機構で遺伝子の発現が制御されていることを示しており,細胞のストレス応答の全容を明らかにするためには低容量ストレスに対する応答に着目した研究が必要であることを示している.
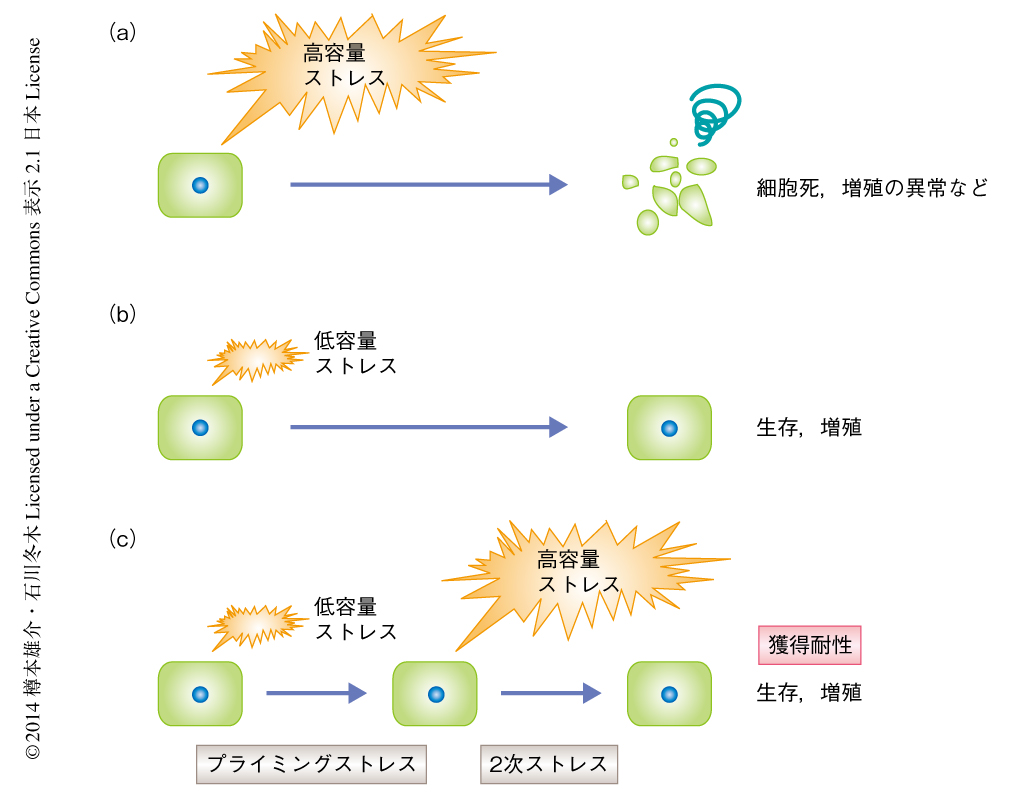
ストレスに対する適応応答のひとつに,細胞を低容量のストレス(プライミングストレス)にさらすと,そののちにさらされる高容量のストレス(2次ストレス)に対し抵抗性を獲得するという現象が知られている(図3).この現象は獲得耐性(acquired tolerance)とよばれており,細胞のレベルにかぎらず個体のレベルにおいてもさまざまな生物種において報告されている.このストレスに対する抵抗性の獲得は一過的な現象であり,プライミングストレスを処理したのちある程度の時間が経過すると観察されなくなる.つまり,ストレス処理により耐性変異体が現われることでは説明がつかない.また,このような抵抗性はプライミングストレスとは異なる種類の2次ストレスに対しても獲得され,これを交差耐性(cross-toleranceあるいはcross protection)とよぶ.交差耐性は化学構造や作用機序の類似した化学物質のあいだで多く観察される現象であるが,温度変化と浸透圧ストレスのようにあまり関係がないと思われるストレスのあいだでも起こりうる.
ホルミシス(hormesis,閾下増進効果)とは,高濃度あるいは大量に用いられると有害である物質(毒物)が,低濃度あるいは微量で用いられると逆に有益に作用するといった,用量反応相関を示す現象のことをさす9).たとえば,われわれの生存に必要な酸素は高濃度では肺の障害など悪影響を及ぼすが,大気よりやや高い濃度の酸素はスポーツ選手のけがの治療に用いられるなど有益な側面ももちあわせている(ただし,すべての物質がそのような用量反応相関を示すわけではない).現在はまだ議論の余地が大きいが,ホルミシス効果と抗がんあるいは抗老化との関連を示唆するような報告もある.さきに述べた獲得耐性および交差耐性はホルミシス効果の一種ととらえることもできる.
獲得耐性あるいは交差耐性の分子機構については不明な点が多いが,プライミングストレス処理の際にタンパク質合成を阻害することにより抵抗性の獲得が抑制されることから,プライミングストレス応答の際に発現の誘導される遺伝子産物による効果が大きいと考えられる.さまざまなストレス処理のもとで共通して発現の誘導される遺伝子の存在がマイクロアレイ解析により明らかにされており,出芽酵母ではESR(environmental stress response),分裂酵母ではCESR(core environmental stress response)とよばれ,それぞれ数百の遺伝子が含まれている10,11).こういったさまざまなストレスに応答して発現の上昇する遺伝子の数は生物種により異なり,出芽酵母に近い種でもカンジダ症の原因であるCandida albicansでは非常に少ない1).また,哺乳類の細胞においても少数の遺伝子のみが複数のストレスにより共通して発現の上昇することが報告されており,これは細胞種によっても異なる2).
獲得耐性あるいは交差耐性が観察されるストレスは生物種により異なる.たとえば,出芽酵母ではプライミングストレスを熱ストレス,2次ストレスを酸化ストレスとした場合に交差耐性が起こるが,逆の組合せでは起こらない12).一方,分裂酵母ではどちらの組合せでも交差耐性が誘導され,2次ストレスに対する生存率が上昇する13).ESRやCESRを構成する遺伝子には多様な生理機能をもつタンパク質がコードされているが,必ずしも直前に処理したストレスへの応答に必須でないものも含まれており,それらは将来的に遭遇すると期待されるストレスに対する防御機能になるというモデルが提唱されている12).出芽酵母でみられるような応答の非対称性はほかの生物種でも観察されており,その生物あるいは細胞がおかれている環境にもっとも適応したかたちで進化してきた結果と考えられる14).
細胞に低容量のストレスを単独で処理した場合には,細胞死など判別の容易な表現型は観察できない.そのため,従来の研究では高容量のストレスを細胞に処理した場合に観察される表現型を指標としてストレス応答に関与するタンパク質を探索してきた.しかし,この条件では低容量ストレスに対する応答においてとくに重要な機能をもつタンパク質は,それを欠損させても高容量ストレスに対する応答の際の表現型にはほとんど影響しないため,研究の対象から除外されてしまうことが予想される.
さきに述べた獲得耐性や交差耐性は連続してストレスにさらされる際の現象であり,変動する環境におけるストレス応答の研究のすぐれたモデルになる.同時に,それらの現象における細胞の抵抗性の獲得は,プライミングストレスに対する細胞の応答を反映していると考えられる.つまり,獲得耐性あるいは交差耐性を指標とすることにより,単独では表現型の観察しにくい低容量ストレスに対する応答を,そののちにあたえる高容量ストレスに対する応答から間接的に判断できることを意味する.このとき,適切な強度の2次ストレスを用いることにより,細胞の生死を指標として獲得耐性あるいは交差耐性の有無を定量的に観察することができる.低容量ストレス応答に必要なタンパク質の異常により交差耐性に欠損を示すことが予想されることから,筆者らは,低容量ストレス応答にかかわるタンパク質を同定するため,分裂酵母において交差耐性に欠損を示す細胞株の遺伝学的なスクリーニングを行った.その結果,複数の交差耐性欠損株が得られており,以下,それらの原因遺伝子産物として同定された2つのタンパク質の機能について詳細に述べる.
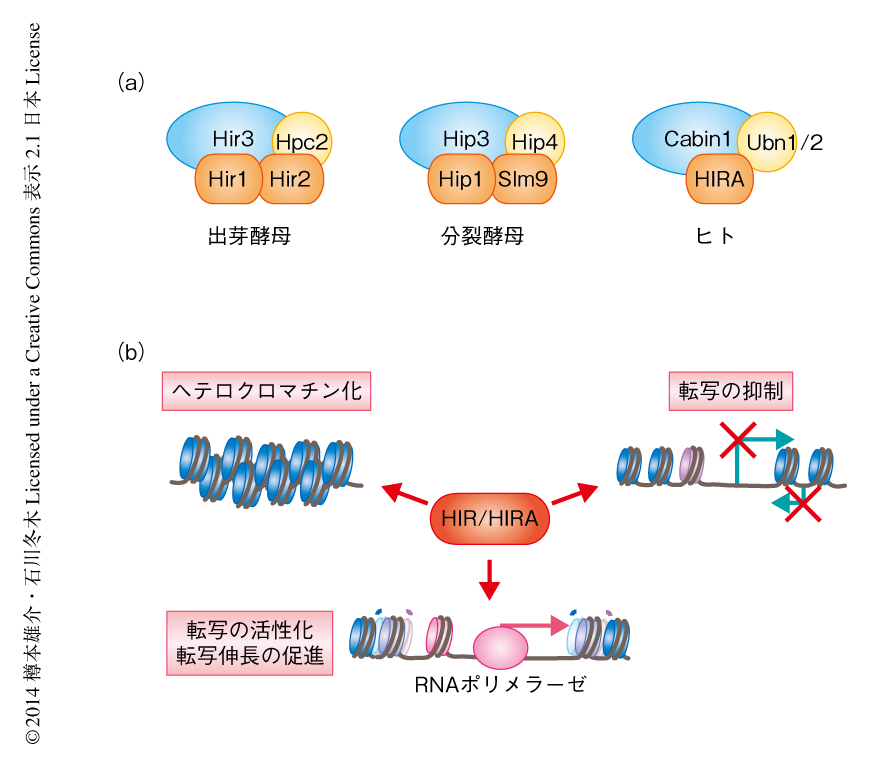
分裂酵母において交差耐性欠損株の原因遺伝子として得られたslm9+遺伝子は,出芽酵母HIRあるいは哺乳類HIRAのホモログであるSlm9をコードする13).HIR/HIRAは複合体として機能しており,出芽酵母ではHir1,Hir2,Hir3,Hpc2,分裂酵母ではHip1,Slm9,Hip3,Hip4,哺乳類ではHIRA,Cabin1,Ubinuclein(UBN1およびUBN2)からそれぞれ構成されている(図4a).HIR/HIRAは主要なヒストンH3-H4シャペロンのひとつであり,DNA複製に非依存的にヌクレオソームをDNAに配置するのに重要である15).一方,ほかのヒストンH3-H4シャペロンであるCAF-1はDNA複製装置に含まれるPCNAと結合し,DNA複製期に新規に合成されるDNAにヌクレオソームを配置する.ヒストンH3にはいくつかのバリアントが存在するが,そのなかでヒトのHIRAはヒストンH3.3と,CAF-1はヒストンH3.1およびヒストンH3.2と選択的に結合する.ヒストンH3.3を含むヌクレオソームはDNAにおける動きの自由度が高いことから,ほかのヒストンH3バリアントを含むヌクレオソームとは機能的に異なると考えられる.
HIR/HIRAは遺伝子の発現制御にも深くかかわっている(図4b).出芽酵母のHIRはDNA複製期以外におけるヒストンの遺伝子の転写を抑制するタンパク質として同定された.そののち,HIRはヘテロクロマチンの形成および維持,遺伝子の近傍の潜在的な(cryptic)遺伝子プロモーターからの転写の抑制に重要であることが明らかになり,より広い範囲において転写制御にかかわっている15).分裂酵母においても,ヘテロクロマチンの形成,レトロトランスポゾンの発現抑制,アンチセンス転写産物の発現抑制などに機能する.また,哺乳類の細胞では細胞老化に特異的なヘテロクロマチン構造であるSAHF(senescence-associated heterochromatic foci)の形成に重要である.これらにくわえて,HIR/HIRAは転写を正に制御する機能をもつ.実際に,哺乳類の細胞においてヒストンH3.3を含むヌクレオソームは,転写の抑制されている遺伝子領域だけでなく,転写の活性化されている遺伝子領域にも多く観察される.筋分化を決定するMyoD遺伝子の発現にはHIRAによる遺伝子プロモーター領域へのヒストンH3.3の配置が重要であることが示されており,これはHIRAが転写を正に制御している例である.また,出芽酵母および哺乳類の細胞において,RNAポリメラーゼが遺伝子領域を通過したのちのヌクレオソームの再構成にHIR/HIRAがかかわっているとの報告もあり,HIR/HIRAは転写伸長の段階におけるクロマチン構造の維持に重要だというモデルもある15).
筆者らの研究にて13),分裂酵母においてhip1+遺伝子,hip3+遺伝子,hip4+遺伝子をそれぞれ遺伝子破壊するとslm9破壊株と同様に交差耐性に欠損を示したことから,HIRA複合体としての機能が交差耐性において重要であると考えられた.HIRA複合体の構成タンパク質をコードするslm9+遺伝子,hip1+遺伝子,hip3+遺伝子,hip4+遺伝子の破壊株と,ストレス応答性MAPキナーゼをコードするspc1+遺伝子(哺乳類のp38遺伝子のホモログ)の破壊株に対して,低容量あるいは高容量の熱ストレスや酸化ストレスを処理すると,spc1破壊株はどちらの条件においても強い感受性を示したのに対し,slm9破壊株などは低容量ストレスに対してのみ強い感受性を示したことから,分裂酵母のHIRA複合体は低容量ストレスに応答する際により重要であることが示された.このことは,交差耐性を指標としたスクリーニング系が低容量ストレス応答にかかわるタンパク質の同定に有効であることを支持した.
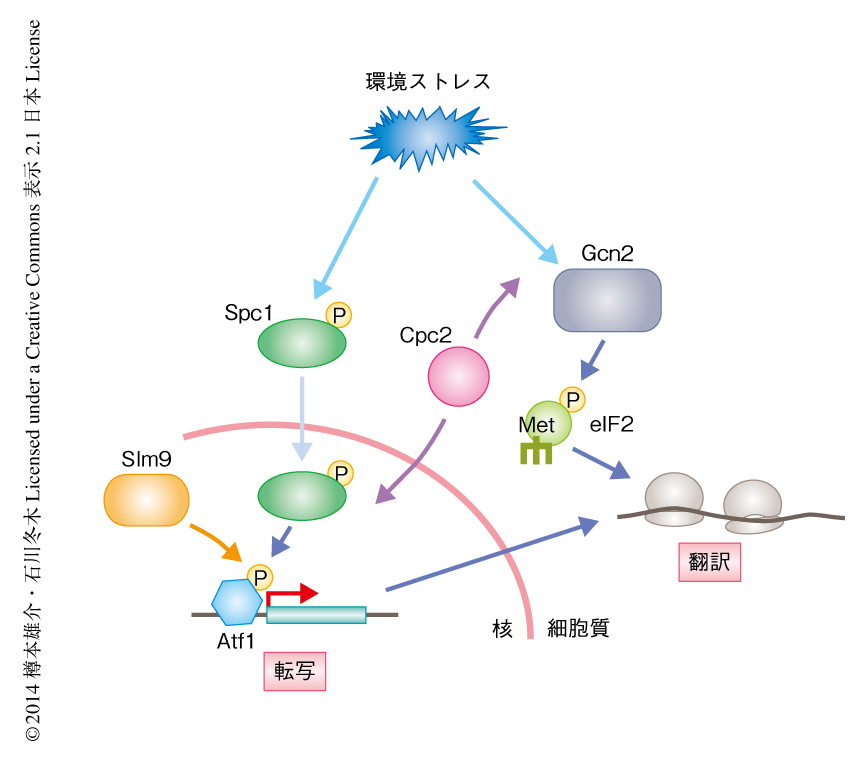
分裂酵母のHIRA複合体がストレス応答に機能する分子機構を検討するため,野生型株およびslm9破壊株あるいはhip1破壊株のストレス応答の際の遺伝子発現パターンをマイクロアレイにより解析し,それらの株で発現量に差がある遺伝子の特徴を遺伝子オントロジー項目により比較したところ,“cellular response to stress”,“cellular response to stimulus”などのストレス応答にかかわる遺伝子オントロジー項目が有意に濃縮された(なお,野生型株と比べ,HIRA複合体の構成タンパク質をコードする遺伝子の破壊株ではストレス応答にかかわる遺伝子の発現変動は小さかった).つまり,HIRA複合体はストレス応答性遺伝子の発現制御において重要な役割をもつことが示唆された.また,ストレス処理した細胞において,ストレス応答性遺伝子のORFおよびその遺伝子プロモーターの近傍の領域へのHIRAの局在がクロマチン免疫沈降実験により確認された.ストレス応答性遺伝子の発現に重要な転写因子Atf1を欠失した細胞ではこれらの領域へのHIRAの結合がみられなくなったため,HIRAのクロマチンへの局在はストレス刺激により制御されていることが示された.さらに,slm9破壊株ではストレス応答性遺伝子の領域に結合するRNAポリメラーゼの量が減少したことから,分裂酵母のHIRAは転写の活性化に機能することが裏づけられた.遺伝子の5’側の領域にはヌクレオソームが規則正しく配置されていることが知られており,遺伝子発現が活性化される際にはその周辺のヌクレオソームの量が減少する.これにより“開いた”DNA構造が形成され,転写に必要なタンパク質がDNAに作用しやすくなると考えられている.slm9破壊株ではこのようなヌクレオソームの解離が起こらなくなっていたことから,分裂酵母のHIRAはプライミングストレスに応答してヌクレオソームを再編成し,転写開始複合体やRNAポリメラーゼを遺伝子プロモーターの近傍に呼び込みストレス応答性遺伝子の発現を促進することにより,交差耐性に寄与していると考えられる13)(図5).
熱ストレス処理した出芽酵母におけるRNAポリメラーゼを含む基本転写因子複合体のゲノムワイドな局在の解析では,すべての構成タンパク質のそろった転写開始複合体だけでなく,その一部を欠いた転写開始複合体の結合したストレス応答性の遺伝子プロモーターの存在が示されている16).これはつづけて酸化ストレス処理をすることにより完全な転写開始複合体へと変化したことから,このような不完全に構築された転写開始複合体は,のちにさらされる可能性のあるストレスに細胞がすばやく応答するための中間状態として機能するというモデルが提案されている.この現象がほかのストレスや生物種にも一般化できるかどうかは不明であるが,HIR/HIRA複合体によるヌクレオソームの再編成も,転写に必要なタンパク質のDNAへの結合を促進し,迅速に転写応答の誘導できる(competent)状態のクロマチン構造を形成している可能性が考えられる.
筆者らのスクリーニングにより得られた分裂酵母の交差耐性欠損株のうち,複数の細胞株の原因遺伝子として同定されたのがcpc2+遺伝子である(未発表).真核生物において酵母からヒトまでよく保存されたタンパク質をコードしており,哺乳類などの高等真核生物では活性化したプロテインキナーゼCと結合するタンパク質として同定されたことからRACK1(receptor for activated C-kinase)と名づけられている.GNB2L1(guanine nucleotide-binding protein subunit beta-2-like-1)という別名をもち,三量体Gタンパク質のβサブユニットと高い相同性を示す.トリプトファン残基(W)とアスパラギン酸残基(D)との特徴的な配置からなる約40アミノ酸残基のWDリピート(WD40リピート)を7個もち,それらがβプロペラ構造をとっている17).WDリピートはタンパク質間相互作用ドメインとして知られており,SH2ドメインやPHドメイン,プロテインキナーゼCのもつC2ドメインなど,ほかのタンパク質間相互作用ドメインと結合することができる.WDリピートを含むタンパク質は細胞内に多く,100種類以上もみつかっている(HIRAもWDリピートをもつ).RACK1は酵素活性を示すようなドメインをもたないため,その機能はほかのタンパク質と複合体を形成することにより発揮されると考えられる.これまでに,プロテインキナーゼCのアイソフォームにくわえ,多くのタンパク質がRACK1ホモログと相互作用することが報告されている.細胞内においてさまざまな機能をもつタンパク質と複合体を形成することにより,RACK1ホモログの関与する細胞応答は,生存,増殖,アポトーシス,運動あるいは極性,免疫応答など多岐にわたり,たとえば,プロテインキナーゼC,MAPキナーゼ,Srcなどといったキナーゼと結合してその活性を上昇あるいは抑制する,キナーゼの基質やほかのタンパク質との結合を促進する,シグナル伝達のクロストークを促進する,といった機能をもつ.また,RACK1がβインテグリン受容体やインスリン様成長因子I受容体などの膜貫通型受容体や受容体チロシンキナーゼと結合し,その周囲にシグナル伝達複合体の形成を促進する例も報告されている.このように,RACK1ホモログは複数のタンパク質と同時に結合し,その反応の足場(scaffold)あるいはハブとして機能することにより細胞内で起こる反応を時空間的に制御する機能をもつと示唆される17).
一方で,RACK1はリボソームの構成タンパク質でもある.RACK1を含むリボソーム複合体の結晶構造解析から,RACK1は40SリボソームサブユニットにおいてmRNAの出口となるトンネルの近傍に結合することが明らかにされている18).スクロース密度勾配遠心法による細胞抽出液の分画から,細胞内の大部分のRACK1はリボソームに結合していると考えられる.リボソームに結合したRACK1ホモログの翻訳制御への関与について,これまでに多くの報告がなされている18,19).たとえば,哺乳類のRACK1はプロテインキナーゼCβIIによる翻訳開始因子eIF6のリン酸化に重要である.このリン酸化はeIF6を60Sリボソームサブユニットから解離させることにより80Sリボソーム複合体の形成を促進する.また,出芽酵母のRACK1のホモログであるAsc1は翻訳開始因子eIF3c/NIP1と結合することにより翻訳開始複合体をリボソームへと呼び込むのに機能する.このように,全体的なタンパク質合成の促進にくわえ,出芽酵母ではAsc1はRNA結合タンパク質Scp160をリボソームへ呼び込むことにより特定のタンパク質の翻訳を亢進させることが示唆されている.一方,線虫やヒトではRACK1ホモログがマイクロRNAに依存的な翻訳抑制に機能することも示されている.翻訳の効率の制御だけではなく,新規に合成されたタンパク質の品質管理においてもRACK1ホモログの関与が報告されており,RACK1ホモログが翻訳制御にはたす機能は多様である.
分裂酵母のCpc2が交差耐性に機能する分子機構はまだ明らかではないが,RACK1ホモログはストレス応答の際にも重要な役割を担うことはいくつか報告されている.哺乳類のRACK1はプロテインキナーゼCおよびJNKと結合し,紫外線を照射したときのプロテインキナーゼCによるJNKのリン酸化(活性化)を促進する20).RACK1の発現を抑制したメラノーマ細胞では,紫外線の照射によるアポトーシスの増加,ヌードマウスへ移植したときの腫瘍形成能の低下が観察される.一方,X線の照射などのストレスにおいては,RACK1がMAPキナーゼキナーゼキナーゼのひとつであるMTK1と結合しストレス応答性MAPキナーゼ経路の活性化によるアポトーシスを亢進させることが報告されており21),細胞種やストレスの種類によりRACK1は異なる分子機能を担いうる.ただし,いずれの場合においてもRACK1はシグナル伝達を促進することによりストレス応答に寄与している.一般的に,高容量ストレスに対する細胞応答と比較して,低容量ストレスが直接的に活性化する分子の数は少なく,その活性化の程度は低いことが予想される.そのような微弱な応答によるシグナル伝達の際には足場タンパク質のように反応を促進するタンパク質の重要性がより大きくなると考えられ,RACK1の低容量ストレス応答の際の機能はシグナル伝達の活性化のための閾値を低下させることにあると考えられる.
分裂酵母においても,cpc2欠損株においては細胞内のAtf1の量が減少することが報告されており22),Cpc2がストレス応答性MAPキナーゼ経路の制御に関与することが示唆される.分裂酵母においてストレス応答性MAPキナーゼ経路はさきに述べたCESRの発現を誘導し,さまざまなストレスに対応する一連のストレス応答性遺伝子の発現を上昇させることから,交差耐性に重要である.Cpc2はこのシグナル伝達経路の活性化を促進することにより細胞の低容量ストレス応答に寄与するというモデルが考えられる.もうひとつの仮説として,低容量ストレス応答の際の遺伝子発現パターンの変化は翻訳制御によるものの割合が大きいことを考慮すると,Cpc2がストレス応答の際の翻訳制御をとおして交差耐性に寄与していることも考えられる.実際に筆者らの研究により,分裂酵母のCpc2がアミノ酸飢餓ストレス応答の際にeIF2αキナーゼであるGcn2の活性化を促進することから,eIF2αのリン酸化を介する翻訳制御において重要であることが明らかになっている23).これらの仮説は互いに矛盾するものではなく,Cpc2が複数の経路により低容量ストレス応答に寄与している可能性も考えられる(図5).
低容量ストレスに対する出芽酵母の遺伝子発現が二峰性となる現象は,細胞を集団として解析せず,1細胞のレベルで遺伝子発現を解析したことにより明らかになった6).確率論的な反応の影響が大きくなるような弱い刺激に対する応答を明らかにしていくためには,1細胞のなかで起こっている反応を観察することの重要性は高い.従来の解析手法にくわえ,このような1細胞レベルでの解析手法を組み合わせることにより,これまで知られていなかったストレス応答の分子機構の明らかになることが期待される.
ストレス応答機構の破綻が,がんや老化を含むさまざまな疾患と密接にかかわることはすでに知られており24),頻度の高い低容量ストレスに対する細胞応答がそれらの疾患をふせぐのに重要な役割を担っていることは想像にかたくない.また,進化の過程において生物が環境変化によるストレスに対しどのように適応して生存してきたのかを理解するうえでも,より生理的である低容量のストレスに対する細胞応答の分子機構の解明が重要である.
略歴:2009年 京都大学大学院生命科学研究科博士課程 修了,同年より同 助教.
研究テーマ:環境変化に対する細胞のストレス応答機構.とくに,低容量ストレスや変動する環境におけるストレス応答機構を明らかにしたい.
石川 冬木(Fuyuki Ishikawa)
京都大学大学院生命科学研究科 教授.
研究室URL:http://www.lif.kyoto-u.ac.jp/labs/fish/
© 2014 樽本雄介・石川冬木 Licensed under CC 表示 2.1 日本
(京都大学大学院生命科学研究科 細胞周期学分野)
email:樽本雄介,石川冬木
領域融合レビュー, 3, e004 (2014) DOI: 10.7875/leading.author.3.e004
Yusuke Tarumoto & Fuyuki Ishikawa: Cellular response to low-dose stress.
要 約
生物が生存するうえで環境変化を要因とする種々のストレスに適応することは重要である.遺伝子の発現制御は細胞のストレス応答において中心的な役割を担っており,転写や翻訳など多段階において綿密な制御をうけている.生物のさらされるストレスの多くは単独では明確な表現型をもたらさない低容量のストレスであり,それらの蓄積が老化やがんなどの疾患にかかわると示唆されている.しかし,これまでのストレスの研究は細胞死など表現型の観察の容易な高容量のストレスへの応答の解析が中心であり,低容量ストレスへの応答についての理解は十分ではない.このレビューでは,細胞レベルにおけるストレス応答を中心に,低容量ストレスに対する応答につき明らかになっている知見を述べ,そののち,分裂酵母を用いた低容量ストレス応答の解析に関する筆者らの研究につきふれる.
はじめに
すべての生物は周囲からさまざまな情報を得て生存しており,温度や栄養状態の変化など環境変動を要因とするストレスをうけている.そのようなストレスに対し迅速に適応することは生物の生存や子孫の繁栄において有利であることから,生物は進化の過程で巧妙なストレス防御機構を獲得し発達させてきたと考えられる.これまでの研究においてストレス応答にかかわる多くのタンパク質が同定され,それらの機能する複雑な分子機構が明らかにされてきた.
生物のうける環境からのストレスの多くは,それ単独では細胞死など明確な表現型を示さないような低容量のストレスであると考えられる.たとえば,好気的な条件に存在する生物はみな低容量の紫外線によるストレスおよび低容量の活性酸素による酸化ストレスにさらされている.また,自然の環境は一定ではなくつねに変動しているため,生物がうけるストレスの強度や種類も時間とともに変動するであろう.そういった環境における生存のため,生物は低容量のストレスや変動するストレスに対する防御機構を基本的な機能として備えていると考えられる.
1.細胞のストレス応答
温度,浸透圧,pH,活性酸素,栄養分などの環境が変化することは細胞内の恒常性を維持するうえで好ましくなく,細胞にとりストレスとなる.これは単細胞生物においてだけではなく,多細胞生物のひとつの細胞も,程度に違いはあるものの周囲の環境からのストレスをうけており,細胞レベルにおける適切なストレス応答は重要である.ストレスの種類や強度あるいは生物種により多少の違いはあるが,ストレス応答機構として主要なものが遺伝子の発現制御である.
細胞がストレスにさらされた際に,それに応答して遺伝子の発現が起こるためには多くの重要な段階がある.詳細はほかの総説にゆだねるが1-3),以下,その概要を述べる.まず,細胞内外の変化をストレスとして感知するセンサーが必要である.たとえば,熱ショックタンパク質は温度変化により変性したタンパク質を検出し,熱ストレス応答をひき起こすセンサーとなる.ストレスの種類によりそれを認識する分子機構は異なっており,多くは細胞膜あるいは細胞質に存在するタンパク質がストレスセンサーとして機能する.ただし,そのようなセンサーがまだ明らかでない場合もある.
ついで,センサーからのシグナルは核へと伝達される2)(図1).もっとも重要なシグナル伝達経路のひとつはMAPキナーゼを介するものであり,MAPキナーゼキナーゼキナーゼ(MAPKKK),MAPキナーゼキナーゼ(MAPKK),MAPキナーゼ(MAPK)と,酵母からヒトまでよく保存された3つのリン酸化酵素によるシグナル伝達カスケードからなる.哺乳類の細胞ではp38とJNK(c-Jun N-terminal kinase)の2つがストレス応答性MAPキナーゼとして知られており,さまざまなストレスのもとで活性化される.活性化したMAPキナーゼは核において転写因子をリン酸化により活性化することでストレス応答性遺伝子の発現を誘導する.また,それ以外にも,MAPキナーゼはクロマチン制御に関与するタンパク質,mRNAの安定性や翻訳にかかわるタンパク質など,さまざまなタンパク質の機能制御をとおして遺伝子の発現制御に関与することが知られている.なお,このようなストレス応答性のシグナル伝達や遺伝子発現が過剰に起こると細胞の生存や増殖に悪影響を及ぼすため,活性化あるいは発現の誘導されたタンパク質による負のフィードバック制御がはたらいている.すばやいオンとオフの切り替えを可能にすることにより,細胞は変動する環境に適応することができると考えられる.
酵母やヒトなどにおいてはストレス応答性遺伝子の転写の特徴として,ハウスキーピング遺伝子や増殖に関連した遺伝子と比較して,遺伝子プロモーターにTATAボックスをもつ割合が高く,転写を開始する際にヒストンアセチル化酵素を含むSAGA複合体による制御が重要であることが知られている1).また,ショウジョウバエにおいては熱ショックタンパク質のひとつHsp70の遺伝子の領域に転写開始の直後の状態で停止したRNAポリメラーゼが局在しており,ストレス応答の際の転写はRNAポリメラーゼの伸長段階から再開することですばやい転写が可能になっている.このような停止したポリメラーゼの存在は哺乳類の細胞においても知られており,刺激に対する迅速な細胞応答を可能にしていると考えられている2).
mRNAが転写されたのちの遺伝子の発現制御,とくに,翻訳開始の段階の制御もストレス応答機構として重要である.典型的な翻訳は,mRNAの5’側キャップ構造に翻訳開始因子複合体であるeIF4F複合体が,3’側にポリA結合タンパク質が結合し,mRNAがループ状の構造をとったのち,開始tRNAを含むeIF2複合体や翻訳に必要なほかのタンパク質が供給されることにより開始する.eIF2は翻訳開始とともにリボソームから離れたのち,ふたたび活性化されてつぎの翻訳開始に使用される.しかし,細胞がストレスにさらされるとeIF2のαサブユニット(eIF2α)のリン酸化により再活性化が阻害されるため,開始tRNAの供給量が減少して細胞全体の翻訳開始が抑制される(図2a).eIF2αキナーゼは複数あり(哺乳類では,GCN2,PKR,PERK,HRIの4つ),それぞれ異なる種類のストレスにより活性化される4).また,eIF4F複合体に含まれるeIF4Eは結合タンパク質である4EBPにより阻害される(図2a).栄養が十分にあるときはTorキナーゼが4EBPを抑制しているが,栄養飢餓の際にはその抑制が低下し4EBPがeIF4Eの機能を阻害することにより翻訳の効率は大きく低下する3).一方で,このような条件においても選択的に翻訳される遺伝子が存在する(図2b).まずあげられるのは,mRNAの5’側非翻訳領域に複数の小さなORF(uORF)をもつ遺伝子である.たとえば,ストレス応答に重要な転写因子である出芽酵母のGCN4や哺乳類のATF4などをコードするmRNAは,eIF2αのリン酸化が起こった際に翻訳の効率が上昇する4).また,IRES(internal ribosome entry site)をもつmRNAは5’側キャップ構造に非依存的に翻訳が開始できることから,eIF4Eが阻害された場合でも翻訳される3).さらに,ストレス応答の際に発現するマイクロRNAによっても特定の遺伝子の翻訳が制御される.翻訳が抑制されたmRNAは細胞質においてストレス顆粒あるいはPボディとよばれる構造体を形成し,少なくともその一部はストレスが除かれたのち翻訳が再開することが知られている5).
2.低容量のストレスによる細胞応答
ここまで述べたストレス応答機構の多くは,低容量のストレスに対しても機能すると考えられる.しかし,入力となる刺激が小さい場合には,細胞の応答が確率論的な影響をうける場合がある.たとえば,出芽酵母において低容量の浸透圧ストレスを処理した際には,集団にはそのストレスに応答して遺伝子を発現した細胞と応答しなかった細胞とが現われる6).このとき,浸透圧ストレス応答に重要なMAPキナーゼであるHog1(哺乳類のp38のホモログ)の活性化の程度はストレスの強度に比例して増加し,Hog1により誘導される遺伝子の発現量とは必ずしも相関しない.つまり,転写の活性化には閾値のあることが示唆される.このような二峰性の応答においてはクロマチン構造の制御が重要だと考えられている6).また,低容量ストレスあるいは高容量ストレスにより処理した出芽酵母のmRNAおよびタンパク質の量を網羅的に調べた結果では,高容量ストレスを処理したときには多くのmRNAおよびタンパク質の発現量が変動し,おのおのの遺伝子においてmRNAの変動とタンパク質の変動とは相関したが,低容量ストレスを処理したときにはmRNAの変動とタンパク質の変動とは必ずしも相関しない7).同時に,低容量ストレスに応答する際の細胞内のタンパク質の変動にあたえる影響は,転写によるものより翻訳によるもののほうが大きいことが示されている.一方,分裂酵母では酸化ストレスの強度に応じて異なる転写因子による遺伝子の発現が中心的な役割を担うことが知られている8).これらの報告は,ストレスの強度により異なる分子機構あるいは異なる制御機構で遺伝子の発現が制御されていることを示しており,細胞のストレス応答の全容を明らかにするためには低容量ストレスに対する応答に着目した研究が必要であることを示している.
3.低容量ストレスによる獲得耐性および交差耐性
ストレスに対する適応応答のひとつに,細胞を低容量のストレス(プライミングストレス)にさらすと,そののちにさらされる高容量のストレス(2次ストレス)に対し抵抗性を獲得するという現象が知られている(図3).この現象は獲得耐性(acquired tolerance)とよばれており,細胞のレベルにかぎらず個体のレベルにおいてもさまざまな生物種において報告されている.このストレスに対する抵抗性の獲得は一過的な現象であり,プライミングストレスを処理したのちある程度の時間が経過すると観察されなくなる.つまり,ストレス処理により耐性変異体が現われることでは説明がつかない.また,このような抵抗性はプライミングストレスとは異なる種類の2次ストレスに対しても獲得され,これを交差耐性(cross-toleranceあるいはcross protection)とよぶ.交差耐性は化学構造や作用機序の類似した化学物質のあいだで多く観察される現象であるが,温度変化と浸透圧ストレスのようにあまり関係がないと思われるストレスのあいだでも起こりうる.
ホルミシス(hormesis,閾下増進効果)とは,高濃度あるいは大量に用いられると有害である物質(毒物)が,低濃度あるいは微量で用いられると逆に有益に作用するといった,用量反応相関を示す現象のことをさす9).たとえば,われわれの生存に必要な酸素は高濃度では肺の障害など悪影響を及ぼすが,大気よりやや高い濃度の酸素はスポーツ選手のけがの治療に用いられるなど有益な側面ももちあわせている(ただし,すべての物質がそのような用量反応相関を示すわけではない).現在はまだ議論の余地が大きいが,ホルミシス効果と抗がんあるいは抗老化との関連を示唆するような報告もある.さきに述べた獲得耐性および交差耐性はホルミシス効果の一種ととらえることもできる.
獲得耐性あるいは交差耐性の分子機構については不明な点が多いが,プライミングストレス処理の際にタンパク質合成を阻害することにより抵抗性の獲得が抑制されることから,プライミングストレス応答の際に発現の誘導される遺伝子産物による効果が大きいと考えられる.さまざまなストレス処理のもとで共通して発現の誘導される遺伝子の存在がマイクロアレイ解析により明らかにされており,出芽酵母ではESR(environmental stress response),分裂酵母ではCESR(core environmental stress response)とよばれ,それぞれ数百の遺伝子が含まれている10,11).こういったさまざまなストレスに応答して発現の上昇する遺伝子の数は生物種により異なり,出芽酵母に近い種でもカンジダ症の原因であるCandida albicansでは非常に少ない1).また,哺乳類の細胞においても少数の遺伝子のみが複数のストレスにより共通して発現の上昇することが報告されており,これは細胞種によっても異なる2).
獲得耐性あるいは交差耐性が観察されるストレスは生物種により異なる.たとえば,出芽酵母ではプライミングストレスを熱ストレス,2次ストレスを酸化ストレスとした場合に交差耐性が起こるが,逆の組合せでは起こらない12).一方,分裂酵母ではどちらの組合せでも交差耐性が誘導され,2次ストレスに対する生存率が上昇する13).ESRやCESRを構成する遺伝子には多様な生理機能をもつタンパク質がコードされているが,必ずしも直前に処理したストレスへの応答に必須でないものも含まれており,それらは将来的に遭遇すると期待されるストレスに対する防御機能になるというモデルが提唱されている12).出芽酵母でみられるような応答の非対称性はほかの生物種でも観察されており,その生物あるいは細胞がおかれている環境にもっとも適応したかたちで進化してきた結果と考えられる14).
4.交差耐性を指標とした低容量ストレスに関連するタンパク質の探索
細胞に低容量のストレスを単独で処理した場合には,細胞死など判別の容易な表現型は観察できない.そのため,従来の研究では高容量のストレスを細胞に処理した場合に観察される表現型を指標としてストレス応答に関与するタンパク質を探索してきた.しかし,この条件では低容量ストレスに対する応答においてとくに重要な機能をもつタンパク質は,それを欠損させても高容量ストレスに対する応答の際の表現型にはほとんど影響しないため,研究の対象から除外されてしまうことが予想される.
さきに述べた獲得耐性や交差耐性は連続してストレスにさらされる際の現象であり,変動する環境におけるストレス応答の研究のすぐれたモデルになる.同時に,それらの現象における細胞の抵抗性の獲得は,プライミングストレスに対する細胞の応答を反映していると考えられる.つまり,獲得耐性あるいは交差耐性を指標とすることにより,単独では表現型の観察しにくい低容量ストレスに対する応答を,そののちにあたえる高容量ストレスに対する応答から間接的に判断できることを意味する.このとき,適切な強度の2次ストレスを用いることにより,細胞の生死を指標として獲得耐性あるいは交差耐性の有無を定量的に観察することができる.低容量ストレス応答に必要なタンパク質の異常により交差耐性に欠損を示すことが予想されることから,筆者らは,低容量ストレス応答にかかわるタンパク質を同定するため,分裂酵母において交差耐性に欠損を示す細胞株の遺伝学的なスクリーニングを行った.その結果,複数の交差耐性欠損株が得られており,以下,それらの原因遺伝子産物として同定された2つのタンパク質の機能について詳細に述べる.
5.HIR/HIRAによるストレス応答の制御
分裂酵母において交差耐性欠損株の原因遺伝子として得られたslm9+遺伝子は,出芽酵母HIRあるいは哺乳類HIRAのホモログであるSlm9をコードする13).HIR/HIRAは複合体として機能しており,出芽酵母ではHir1,Hir2,Hir3,Hpc2,分裂酵母ではHip1,Slm9,Hip3,Hip4,哺乳類ではHIRA,Cabin1,Ubinuclein(UBN1およびUBN2)からそれぞれ構成されている(図4a).HIR/HIRAは主要なヒストンH3-H4シャペロンのひとつであり,DNA複製に非依存的にヌクレオソームをDNAに配置するのに重要である15).一方,ほかのヒストンH3-H4シャペロンであるCAF-1はDNA複製装置に含まれるPCNAと結合し,DNA複製期に新規に合成されるDNAにヌクレオソームを配置する.ヒストンH3にはいくつかのバリアントが存在するが,そのなかでヒトのHIRAはヒストンH3.3と,CAF-1はヒストンH3.1およびヒストンH3.2と選択的に結合する.ヒストンH3.3を含むヌクレオソームはDNAにおける動きの自由度が高いことから,ほかのヒストンH3バリアントを含むヌクレオソームとは機能的に異なると考えられる.
HIR/HIRAは遺伝子の発現制御にも深くかかわっている(図4b).出芽酵母のHIRはDNA複製期以外におけるヒストンの遺伝子の転写を抑制するタンパク質として同定された.そののち,HIRはヘテロクロマチンの形成および維持,遺伝子の近傍の潜在的な(cryptic)遺伝子プロモーターからの転写の抑制に重要であることが明らかになり,より広い範囲において転写制御にかかわっている15).分裂酵母においても,ヘテロクロマチンの形成,レトロトランスポゾンの発現抑制,アンチセンス転写産物の発現抑制などに機能する.また,哺乳類の細胞では細胞老化に特異的なヘテロクロマチン構造であるSAHF(senescence-associated heterochromatic foci)の形成に重要である.これらにくわえて,HIR/HIRAは転写を正に制御する機能をもつ.実際に,哺乳類の細胞においてヒストンH3.3を含むヌクレオソームは,転写の抑制されている遺伝子領域だけでなく,転写の活性化されている遺伝子領域にも多く観察される.筋分化を決定するMyoD遺伝子の発現にはHIRAによる遺伝子プロモーター領域へのヒストンH3.3の配置が重要であることが示されており,これはHIRAが転写を正に制御している例である.また,出芽酵母および哺乳類の細胞において,RNAポリメラーゼが遺伝子領域を通過したのちのヌクレオソームの再構成にHIR/HIRAがかかわっているとの報告もあり,HIR/HIRAは転写伸長の段階におけるクロマチン構造の維持に重要だというモデルもある15).
筆者らの研究にて13),分裂酵母においてhip1+遺伝子,hip3+遺伝子,hip4+遺伝子をそれぞれ遺伝子破壊するとslm9破壊株と同様に交差耐性に欠損を示したことから,HIRA複合体としての機能が交差耐性において重要であると考えられた.HIRA複合体の構成タンパク質をコードするslm9+遺伝子,hip1+遺伝子,hip3+遺伝子,hip4+遺伝子の破壊株と,ストレス応答性MAPキナーゼをコードするspc1+遺伝子(哺乳類のp38遺伝子のホモログ)の破壊株に対して,低容量あるいは高容量の熱ストレスや酸化ストレスを処理すると,spc1破壊株はどちらの条件においても強い感受性を示したのに対し,slm9破壊株などは低容量ストレスに対してのみ強い感受性を示したことから,分裂酵母のHIRA複合体は低容量ストレスに応答する際により重要であることが示された.このことは,交差耐性を指標としたスクリーニング系が低容量ストレス応答にかかわるタンパク質の同定に有効であることを支持した.
分裂酵母のHIRA複合体がストレス応答に機能する分子機構を検討するため,野生型株およびslm9破壊株あるいはhip1破壊株のストレス応答の際の遺伝子発現パターンをマイクロアレイにより解析し,それらの株で発現量に差がある遺伝子の特徴を遺伝子オントロジー項目により比較したところ,“cellular response to stress”,“cellular response to stimulus”などのストレス応答にかかわる遺伝子オントロジー項目が有意に濃縮された(なお,野生型株と比べ,HIRA複合体の構成タンパク質をコードする遺伝子の破壊株ではストレス応答にかかわる遺伝子の発現変動は小さかった).つまり,HIRA複合体はストレス応答性遺伝子の発現制御において重要な役割をもつことが示唆された.また,ストレス処理した細胞において,ストレス応答性遺伝子のORFおよびその遺伝子プロモーターの近傍の領域へのHIRAの局在がクロマチン免疫沈降実験により確認された.ストレス応答性遺伝子の発現に重要な転写因子Atf1を欠失した細胞ではこれらの領域へのHIRAの結合がみられなくなったため,HIRAのクロマチンへの局在はストレス刺激により制御されていることが示された.さらに,slm9破壊株ではストレス応答性遺伝子の領域に結合するRNAポリメラーゼの量が減少したことから,分裂酵母のHIRAは転写の活性化に機能することが裏づけられた.遺伝子の5’側の領域にはヌクレオソームが規則正しく配置されていることが知られており,遺伝子発現が活性化される際にはその周辺のヌクレオソームの量が減少する.これにより“開いた”DNA構造が形成され,転写に必要なタンパク質がDNAに作用しやすくなると考えられている.slm9破壊株ではこのようなヌクレオソームの解離が起こらなくなっていたことから,分裂酵母のHIRAはプライミングストレスに応答してヌクレオソームを再編成し,転写開始複合体やRNAポリメラーゼを遺伝子プロモーターの近傍に呼び込みストレス応答性遺伝子の発現を促進することにより,交差耐性に寄与していると考えられる13)(図5).
熱ストレス処理した出芽酵母におけるRNAポリメラーゼを含む基本転写因子複合体のゲノムワイドな局在の解析では,すべての構成タンパク質のそろった転写開始複合体だけでなく,その一部を欠いた転写開始複合体の結合したストレス応答性の遺伝子プロモーターの存在が示されている16).これはつづけて酸化ストレス処理をすることにより完全な転写開始複合体へと変化したことから,このような不完全に構築された転写開始複合体は,のちにさらされる可能性のあるストレスに細胞がすばやく応答するための中間状態として機能するというモデルが提案されている.この現象がほかのストレスや生物種にも一般化できるかどうかは不明であるが,HIR/HIRA複合体によるヌクレオソームの再編成も,転写に必要なタンパク質のDNAへの結合を促進し,迅速に転写応答の誘導できる(competent)状態のクロマチン構造を形成している可能性が考えられる.
6.RACK1/Cpc2によるストレス応答の制御
筆者らのスクリーニングにより得られた分裂酵母の交差耐性欠損株のうち,複数の細胞株の原因遺伝子として同定されたのがcpc2+遺伝子である(未発表).真核生物において酵母からヒトまでよく保存されたタンパク質をコードしており,哺乳類などの高等真核生物では活性化したプロテインキナーゼCと結合するタンパク質として同定されたことからRACK1(receptor for activated C-kinase)と名づけられている.GNB2L1(guanine nucleotide-binding protein subunit beta-2-like-1)という別名をもち,三量体Gタンパク質のβサブユニットと高い相同性を示す.トリプトファン残基(W)とアスパラギン酸残基(D)との特徴的な配置からなる約40アミノ酸残基のWDリピート(WD40リピート)を7個もち,それらがβプロペラ構造をとっている17).WDリピートはタンパク質間相互作用ドメインとして知られており,SH2ドメインやPHドメイン,プロテインキナーゼCのもつC2ドメインなど,ほかのタンパク質間相互作用ドメインと結合することができる.WDリピートを含むタンパク質は細胞内に多く,100種類以上もみつかっている(HIRAもWDリピートをもつ).RACK1は酵素活性を示すようなドメインをもたないため,その機能はほかのタンパク質と複合体を形成することにより発揮されると考えられる.これまでに,プロテインキナーゼCのアイソフォームにくわえ,多くのタンパク質がRACK1ホモログと相互作用することが報告されている.細胞内においてさまざまな機能をもつタンパク質と複合体を形成することにより,RACK1ホモログの関与する細胞応答は,生存,増殖,アポトーシス,運動あるいは極性,免疫応答など多岐にわたり,たとえば,プロテインキナーゼC,MAPキナーゼ,Srcなどといったキナーゼと結合してその活性を上昇あるいは抑制する,キナーゼの基質やほかのタンパク質との結合を促進する,シグナル伝達のクロストークを促進する,といった機能をもつ.また,RACK1がβインテグリン受容体やインスリン様成長因子I受容体などの膜貫通型受容体や受容体チロシンキナーゼと結合し,その周囲にシグナル伝達複合体の形成を促進する例も報告されている.このように,RACK1ホモログは複数のタンパク質と同時に結合し,その反応の足場(scaffold)あるいはハブとして機能することにより細胞内で起こる反応を時空間的に制御する機能をもつと示唆される17).
一方で,RACK1はリボソームの構成タンパク質でもある.RACK1を含むリボソーム複合体の結晶構造解析から,RACK1は40SリボソームサブユニットにおいてmRNAの出口となるトンネルの近傍に結合することが明らかにされている18).スクロース密度勾配遠心法による細胞抽出液の分画から,細胞内の大部分のRACK1はリボソームに結合していると考えられる.リボソームに結合したRACK1ホモログの翻訳制御への関与について,これまでに多くの報告がなされている18,19).たとえば,哺乳類のRACK1はプロテインキナーゼCβIIによる翻訳開始因子eIF6のリン酸化に重要である.このリン酸化はeIF6を60Sリボソームサブユニットから解離させることにより80Sリボソーム複合体の形成を促進する.また,出芽酵母のRACK1のホモログであるAsc1は翻訳開始因子eIF3c/NIP1と結合することにより翻訳開始複合体をリボソームへと呼び込むのに機能する.このように,全体的なタンパク質合成の促進にくわえ,出芽酵母ではAsc1はRNA結合タンパク質Scp160をリボソームへ呼び込むことにより特定のタンパク質の翻訳を亢進させることが示唆されている.一方,線虫やヒトではRACK1ホモログがマイクロRNAに依存的な翻訳抑制に機能することも示されている.翻訳の効率の制御だけではなく,新規に合成されたタンパク質の品質管理においてもRACK1ホモログの関与が報告されており,RACK1ホモログが翻訳制御にはたす機能は多様である.
分裂酵母のCpc2が交差耐性に機能する分子機構はまだ明らかではないが,RACK1ホモログはストレス応答の際にも重要な役割を担うことはいくつか報告されている.哺乳類のRACK1はプロテインキナーゼCおよびJNKと結合し,紫外線を照射したときのプロテインキナーゼCによるJNKのリン酸化(活性化)を促進する20).RACK1の発現を抑制したメラノーマ細胞では,紫外線の照射によるアポトーシスの増加,ヌードマウスへ移植したときの腫瘍形成能の低下が観察される.一方,X線の照射などのストレスにおいては,RACK1がMAPキナーゼキナーゼキナーゼのひとつであるMTK1と結合しストレス応答性MAPキナーゼ経路の活性化によるアポトーシスを亢進させることが報告されており21),細胞種やストレスの種類によりRACK1は異なる分子機能を担いうる.ただし,いずれの場合においてもRACK1はシグナル伝達を促進することによりストレス応答に寄与している.一般的に,高容量ストレスに対する細胞応答と比較して,低容量ストレスが直接的に活性化する分子の数は少なく,その活性化の程度は低いことが予想される.そのような微弱な応答によるシグナル伝達の際には足場タンパク質のように反応を促進するタンパク質の重要性がより大きくなると考えられ,RACK1の低容量ストレス応答の際の機能はシグナル伝達の活性化のための閾値を低下させることにあると考えられる.
分裂酵母においても,cpc2欠損株においては細胞内のAtf1の量が減少することが報告されており22),Cpc2がストレス応答性MAPキナーゼ経路の制御に関与することが示唆される.分裂酵母においてストレス応答性MAPキナーゼ経路はさきに述べたCESRの発現を誘導し,さまざまなストレスに対応する一連のストレス応答性遺伝子の発現を上昇させることから,交差耐性に重要である.Cpc2はこのシグナル伝達経路の活性化を促進することにより細胞の低容量ストレス応答に寄与するというモデルが考えられる.もうひとつの仮説として,低容量ストレス応答の際の遺伝子発現パターンの変化は翻訳制御によるものの割合が大きいことを考慮すると,Cpc2がストレス応答の際の翻訳制御をとおして交差耐性に寄与していることも考えられる.実際に筆者らの研究により,分裂酵母のCpc2がアミノ酸飢餓ストレス応答の際にeIF2αキナーゼであるGcn2の活性化を促進することから,eIF2αのリン酸化を介する翻訳制御において重要であることが明らかになっている23).これらの仮説は互いに矛盾するものではなく,Cpc2が複数の経路により低容量ストレス応答に寄与している可能性も考えられる(図5).
おわりに
低容量ストレスに対する出芽酵母の遺伝子発現が二峰性となる現象は,細胞を集団として解析せず,1細胞のレベルで遺伝子発現を解析したことにより明らかになった6).確率論的な反応の影響が大きくなるような弱い刺激に対する応答を明らかにしていくためには,1細胞のなかで起こっている反応を観察することの重要性は高い.従来の解析手法にくわえ,このような1細胞レベルでの解析手法を組み合わせることにより,これまで知られていなかったストレス応答の分子機構の明らかになることが期待される.
ストレス応答機構の破綻が,がんや老化を含むさまざまな疾患と密接にかかわることはすでに知られており24),頻度の高い低容量ストレスに対する細胞応答がそれらの疾患をふせぐのに重要な役割を担っていることは想像にかたくない.また,進化の過程において生物が環境変化によるストレスに対しどのように適応して生存してきたのかを理解するうえでも,より生理的である低容量のストレスに対する細胞応答の分子機構の解明が重要である.
文 献
- Lopez-Maury, L., Marguerat, S. & Bahler, J.: Tuning gene expression to changing environments: from rapid responses to evolutionary adaptation. Nat. Rev. Genet., 9, 583-593 (2008)[PubMed]
- de Nadal, E., Ammerer, G. & Posas, F.: Controlling gene expression in response to stress. Nat. Rev. Genet., 12, 833-845 (2011)[PubMed]
- Spriggs, K. A., Bushell, M. & Willis, A. E.: Translational regulation of gene expression during conditions of cell stress. Mol. Cell, 40, 228-237 (2010)[PubMed]
- Holcik, M. & Sonenberg, N.: Translational control in stress and apoptosis. Nat. Rev. Mol Cell. Biol., 6, 318-327 (2005)[PubMed]
- Decker, C. J. & Parker, R.: P-bodies and stress granules: possible roles in the control of translation and mRNA degradation. Cold Spring Harb. Perspect. Biol., 4, a012286 (2012)[PubMed]
- Pelet, S., Rudolf, F., Nadal-Ribelles, M. et al.: Transient activation of the HOG MAPK pathway regulates bimodal gene expression. Science, 332, 732-735 (2011)[PubMed]
- Halbeisen, R. E. & Gerber, A. P.: Stress-dependent coordination of transcriptome and translatome in yeast. PLoS Biol., 7, e1000105 (2009)[PubMed]
- Vivancos, A. P., Jara, M., Zuin, A. et al.: Oxidative stress in Schizosaccharomyces pombe: different H2O2 levels, different response pathways. Mol. Genet. Genomics 276, 495-502 (2006)[PubMed]
- Gems, D. & Partridge, L.: Stress-response hormesis and aging: “that which does not kill us makes us stronger”. Cell Metab., 7, 200-203 (2008)[PubMed]
- Gasch, A. P., Spellman, P. T., Kao, C. M. et al.: Genomic expression programs in the response of yeast cells to environmental changes. Mol. Biol. Cell, 11, 4241-4257 (2000)[PubMed]
- Chen, D., Toone, W. M., Mata, J. et al.: Global transcriptional responses of fission yeast to environmental stress. Mol. Biol. Cell, 14, 214-229 (2003)[PubMed]
- Berry, D. B. & Gasch, A. P.: Stress-activated genomic expression changes serve a preparative role for impending stress in yeast. Mol. Biol. Cell, 19, 4580-4587 (2008)[PubMed]
- Chujo, M., Tarumoto, Y., Miyatake, K. et al.: HIRA, a conserved histone chaperone, plays an essential role in low-dose stress response via transcriptional stimulation in fission yeast. J. Biol. Chem., 287, 23440-23450 (2012)[PubMed]
- Mitchell, A., Romano, G. H., Groisman, B. et al.: Adaptive prediction of environmental changes by microorganisms. Nature, 460, 220-224 (2009)[PubMed]
- Amin, A. D., Vishnoi, N. & Prochasson, P.: A global requirement for the HIR complex in the assembly of chromatin. Biochim. Biophys. Acta, 1819, 264-276 (2012)[PubMed]
- Zanton, S. J. & Pugh, B. F.: Full and partial genome-wide assembly and disassembly of the yeast transcription machinery in response to heat shock. Genes Dev., 20, 2250-2265 (2006)[PubMed]
- Adams, D. R., Ron, D. & Kiely, P. A.: RACK1, a multifaceted scaffolding protein: structure and function. Cell Commun. Signal., 9, 22 (2011)[PubMed]
- Nilsson, J., Sengupta, J., Frank, J. et al.: Regulation of eukaryotic translation by the RACK1 protein: a platform for signalling molecules on the ribosome. EMBO Rep., 5, 1137-1141 (2004)[PubMed]
- Gandin, V., Senft, D., Topisirovic, I. et al.: RACK1 function in cell motility and protein synthesis. Genes Cancer, 4, 369-377 (2013)[PubMed]
- Lopez-Bergami, P., Habelhah, H., Bhoumik, A. et al.: RACK1 mediates activation of JNK by protein kinase C. Mol. Cell, 19, 309-320 (2005)[PubMed]
- Arimoto, K., Fukuda, H., Imajoh-Ohmi, S. et al.: Formation of stress granules inhibits apoptosis by suppressing stress-responsive MAPK pathways. Nat. Cell Biol., 10, 1324-1332 (2008)[PubMed]
- Nunez, A., Franco, A., Madrid, M. et al.: Role for RACK1 orthologue Cpc2 in the modulation of stress response in fission yeast. Mol. Biol. Cell, 20, 3996-4009 (2009)[PubMed]
- Tarumoto, Y., Kanoh, J. & Ishikawa, F.: Receptor for activated C-kinase (RACK1) homolog Cpc2 facilitates the general amino acid control response through Gcn2 kinase in fission yeast. J. Biol. Chem., 288, 19260-19268 (2013)[PubMed]
- Haigis, M. C. & Yankner, B. A.: The aging stress response. Mol. Cell, 40, 333-344 (2010)[PubMed]
- de Nadal, E., Ammerer, G. & Posas, F.: Controlling gene expression in response to stress. Nat. Rev. Genet., 12, 833-845 (2011)[PubMed]
著者プロフィール
略歴:2009年 京都大学大学院生命科学研究科博士課程 修了,同年より同 助教.
研究テーマ:環境変化に対する細胞のストレス応答機構.とくに,低容量ストレスや変動する環境におけるストレス応答機構を明らかにしたい.
石川 冬木(Fuyuki Ishikawa)
京都大学大学院生命科学研究科 教授.
研究室URL:http://www.lif.kyoto-u.ac.jp/labs/fish/
© 2014 樽本雄介・石川冬木 Licensed under CC 表示 2.1 日本