軸索再生の制御機構:融合研究としての神経糖鎖科学
2014/05/29
門松 健治
(名古屋大学大学院医学系研究科 分子生物学分野)
email:門松健治
領域融合レビュー, 3, e005 (2014) DOI: 10.7875/leading.author.3.e005
Kenji Kadomatsu: Mechanisms of axon regeneration and its inhibition: Glyco-neuroscience as a research of combined disciplines.

末梢神経の軸索は損傷したのちにも再生する.しかし,中枢神経の軸索はいちど損傷をうけるとほとんど再生しない.再生する軸索の末端は成長円錐を形成するが,中枢神経の損傷部には代わりにdystrophic endballとよばれる軸索の末端が出現する.微小管が軸索の長軸と平行に再構築されると成長円錐が形成されるが,dystrophic endballではそれが乱れている.ただし,これは細胞に内在性の要因によるものではなく,細胞外の因子により誘導される.この細胞外因子のなかでもプロテオグリカンは重要である.培養基質にプロテオグリカンの濃度勾配を形成することにより,in vitroにおいてもdystrophic endballを誘導することができる.プロテオグリカンはコアタンパク質と長大な糖鎖からなり,その糖鎖としてコンドロイチン硫酸,ケラタン硫酸,ヘパラン硫酸などが知られている.コンドロイチン硫酸およびケラタン硫酸は細胞外において阻害因子としてはたらくが,おもしろいことに,ヘパラン硫酸は軸索に存在して促進因子としてもはたらく.くわえて,コンドロイチン硫酸はシナプスの可塑性において重要な抑制因子であることもわかってきた.このように,糖鎖科学と神経科学との融合によりはじめてみえる神経の機能制御が明らかになりつつある.このレビューでは,軸索再生の制御機構について説明したのち,コンドロイチン硫酸とケラタン硫酸を中心に糖鎖の作用機構にせまる.
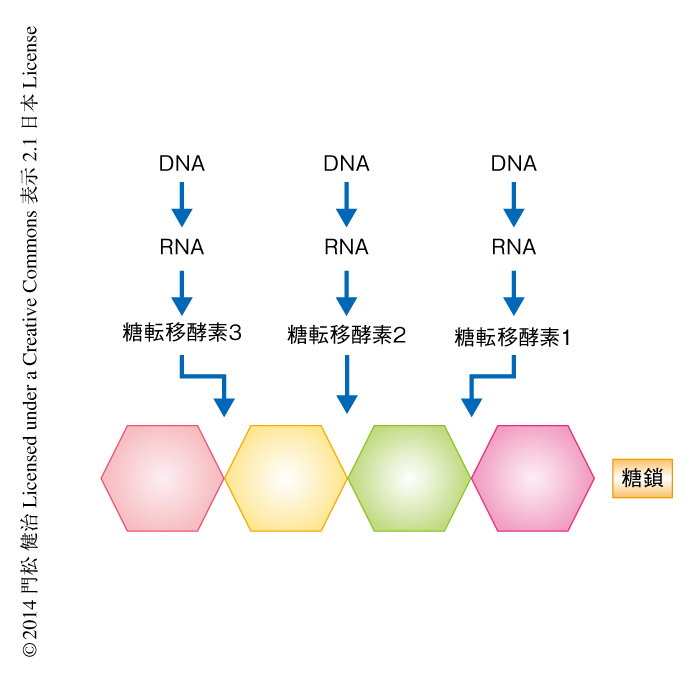
生体の鎖状高分子(バイオポリマー)として,核酸,タンパク質,糖鎖がある.核酸,タンパク質とならんで糖鎖が第3の生命鎖とよばれるゆえんである.しかしながら,糖鎖の作動原理あるいは機能の理解は限定的である.もとより,糖鎖の結合の様式は一様ではなく,分岐があり,また,複数のステップの結合に複数の酵素がかかわっている(図1).このことは,ひとつの鎖を生合成するのに幾多の独立したセントラルドグマの制御を時空間的にうけていることを意味し,そのため,微小環境の影響をうけやすい.つまり,糖鎖の生合成はセントラルドグマから一歩さきの少し離れたところで制御されている(図1).
一方,糖鎖が結合するタンパク質や脂質は多岐にわたる.糖鎖はこれらタンパク質や脂質の違いにかかわらず共通の機能をもちうるが,逆に,タンパク質や脂質に依存する場合も多い.また,糖鎖合成酵素のノックアウトを想定しても,糖鎖が結合するタンパク質や脂質を選ぶことはできないし,また,相補的に別の構造をもつ糖鎖の生合成が誘導されることもある.このことも,糖鎖の生合成はセントラルドグマから少し離れたところで制御されていることを意味する.
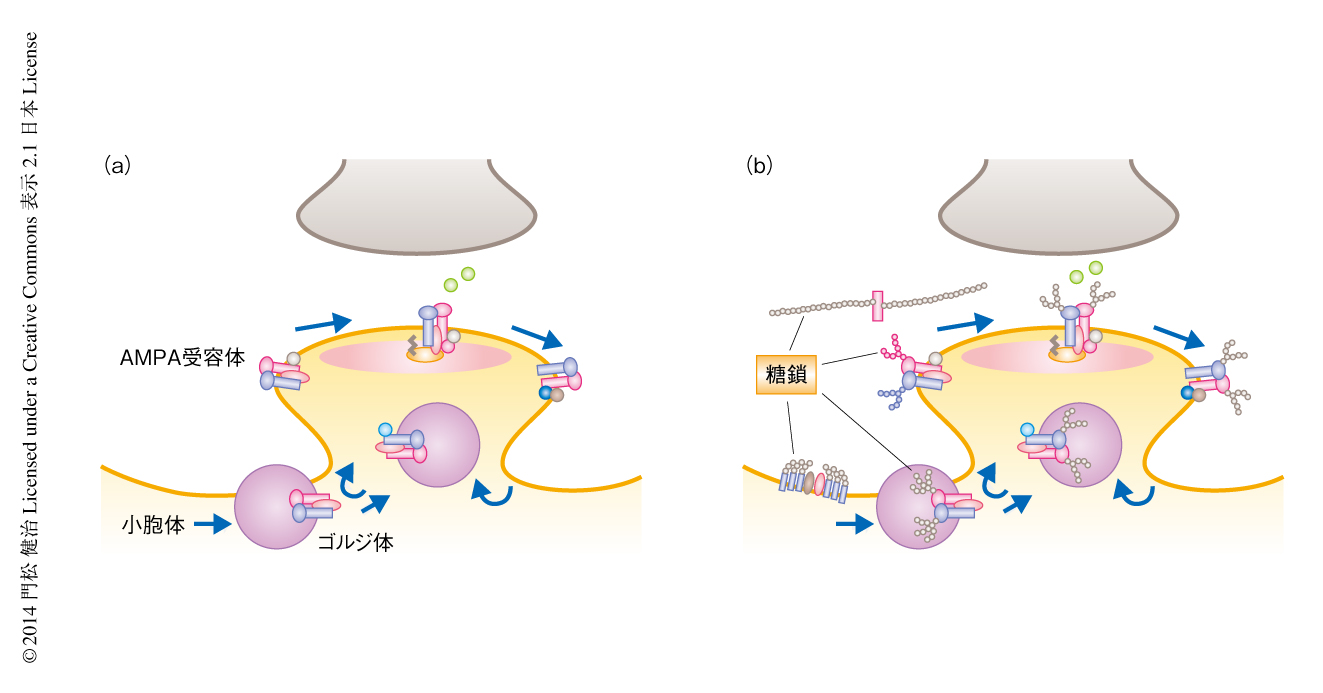
糖鎖科学でつちかわれた技術および知識は,ちょうど現在の分子生物学がそうであるように,究極的にはあらゆる生命科学に生かされるべきである.糖鎖は重要であるはずだが,ほかの分野の生命科学者にとり糖鎖ほど扱いにくく敷居の高いものはないであろう.その壮大なゴールをめざすには,糖鎖の解析のための技術革新など,さまざまな課題の解決が必要である.しかし,ひとり糖鎖科学のがんばりだけではこれは不可能であり,生命科学のほかの分野との共同作業が重要である.すなわち,糖鎖による生命科学の深堀の事例がちまたにあふれるとき,糖鎖科学および生命科学の真の発展が期待できる.筆者が専門とする神経糖鎖生物学においても,糖鎖の視点がくわわることにより,これまでみえなかった新しい神経機能の制御機構が明らかになりつつある(図2).
このレビューでは,神経科学と糖鎖科学との融合研究のなかでも世界的にとくに進んでいる分野のひとつとして,軸索再生とその阻害の機構をとりあげる.まず,現在までに知られている軸索再生の制御機構についてまとめ,つづいて,そこでの糖鎖の機能の意義および作用機構に言及する.
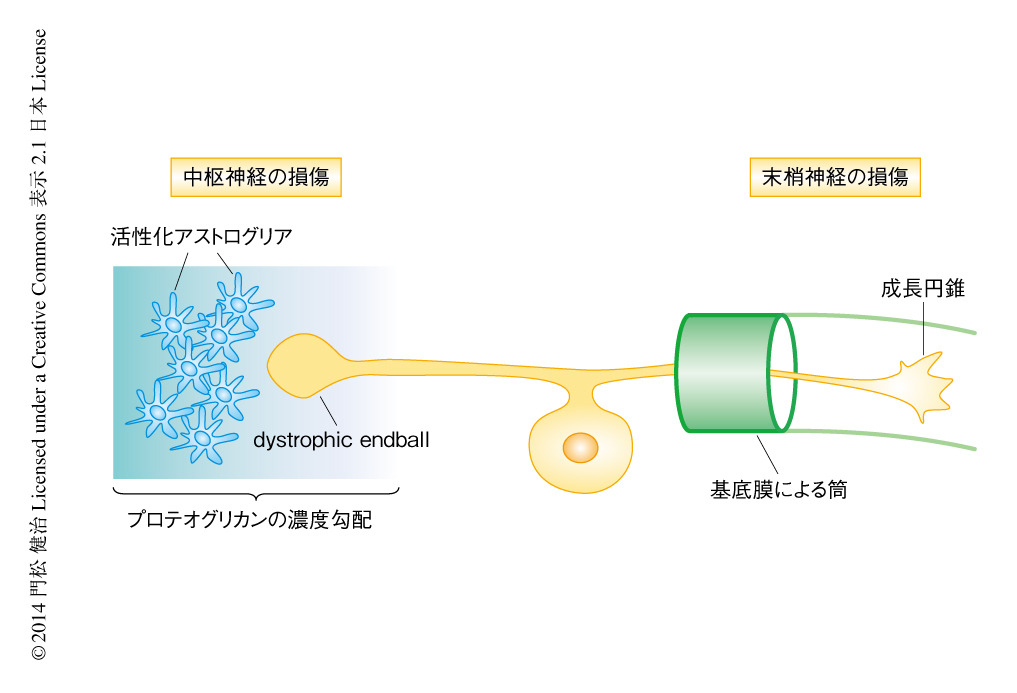
スペインの神経解剖学者Cajalはニューロン説の提唱によりノーベル医学生理学賞を受賞したが,ほかにも数々の業績を残している.“いちど傷害をうけた中枢神経は2度と再生しない”.Cajalが1世紀もまえに残した言葉である.Cajalは損傷した中枢神経の軸索の末端がいびつな球形の形態を呈することを発見した.dystrophic endball(あるいは,retraction bulb,frustrated growth cone)とよばれるこの形態は,中枢神経の損傷のひとつの象徴的なマーカーである(図3).損傷をうけた中枢神経では損傷部においてグリア細胞の活性化および集積が起こり,グリア性瘢痕が形成される.とくに,活性化アストログリアからは多くのタンパク質が産生され軸索再生を直接に阻害する.したがって,グリア性瘢痕は物理的な障壁としてだけでなく,分子的な障壁としても軸索再生を阻害しているといえる.また,末梢神経にみられる内在性の軸索再生の機構が中枢神経では十分にはたらかないことが,中枢神経における軸索再生をむずかしくしているもうひとつの理由である.
末梢神経はSchwann細胞によりおおわれているが,Schwann細胞はまた,ラミニン,IV型コラーゲン,へパラン硫酸プロテオグリカンなど,細胞外マトリックスを構成する分子を産生し基底膜を形成する(図3).その結果,末梢神経の軸索の束は基底膜により形成された筒におおわれる.この基底膜の筒は損傷ののちも残るため,Waller変性におちいった軸索は基底膜をガイドにして正確に再生される.というのも,ラミニン,IV型コラーゲン,へパラン硫酸プロテオグリカンは軸索再生の促進因子でもあるからである.Waller変性にともなうミエリンの分解産物はSchwann細胞やマクロファージによりすみやかに除去されることも,軸索再生の阻害因子の作用をふせぐという観点から重要である.こうして,損傷ののち,末梢神経の軸索の末端は成長円錐の形態をとり軸索は再生される.dystrophic endballを形成して再生しない中枢神経の軸索とは好対照である(図3).
なお,中枢神経の軸索再生を記述するときsprouting(分枝)という言葉を併記することが多い.これは,中枢神経の軸索がそのまま再生することはほとんどなく,むしろ,分枝により新たなネットワークを形成することがほとんどであること,そして,再生と分枝とが見分けにくいことによる.しかしながら,分枝の末端もdystrophic endballを形成することから,細胞の内外のシグナルは再生と分枝とで変わらないように思われる.したがって,このレビューでは,これらをまとめて軸索再生とよぶ.
後根神経節神経は感覚神経であり1本の軸索をもつ.しかし,その軸索は末梢と中枢の2本に枝分かれしている.末梢枝は筋肉や皮膚などに達し,中枢枝は脊髄に達する.脊髄損傷などにより中枢枝が損傷しても軸索は再生しないが,あらかじめ末梢枝を損傷しておき(peripheral conditioning lesion,末梢条件づけ傷害という),そののちに中枢枝を損傷した場合には軸索再生は促進される.このことは,末梢条件づけ傷害により再生のシグナルがあらかじめ核へと伝達されたことを意味し,また,中枢神経の軸索再生において内在性の再生能の促進という戦略が成り立つことを示唆する.
さて,再生のシグナルが核に伝達されるには,損傷ののち数十秒で核に伝達されるCa2+波と,微小管によるタンパク質逆行輸送の波の2つが必要である.Ca2+波はテトロドトキシン感受性Na+チャネル,Na+/Ca2+交換輸送体,電位開口型Ca2+チャネル,イノシトールトリスリン酸受容体といったいくつかの装置により伝達される1).この波はプロテインキナーゼCμのリン酸化,ヒストン脱アセチル化酵素HDAC5のリン酸化,リン酸化HDAC5の核外への移行,ヒストンのアセチル化の亢進,という一連の反応をひき起こし,軸索再生に必要なタンパク質をコードする遺伝子の転写の促進に寄与する2).タンパク質逆行輸送はダイニンをモータータンパク質として使うが,その積荷はバラエティに富んでいる.積荷にはリン酸化DLK,リン酸化JNK3,リン酸化STAT3,リン酸化ERKなどが含まれる1).STAT3およびERKは局所において翻訳され,同じく局所において翻訳されたimportinαおよびvimentinとそれぞれ結合し,importinβとともに積荷として輸送されている.
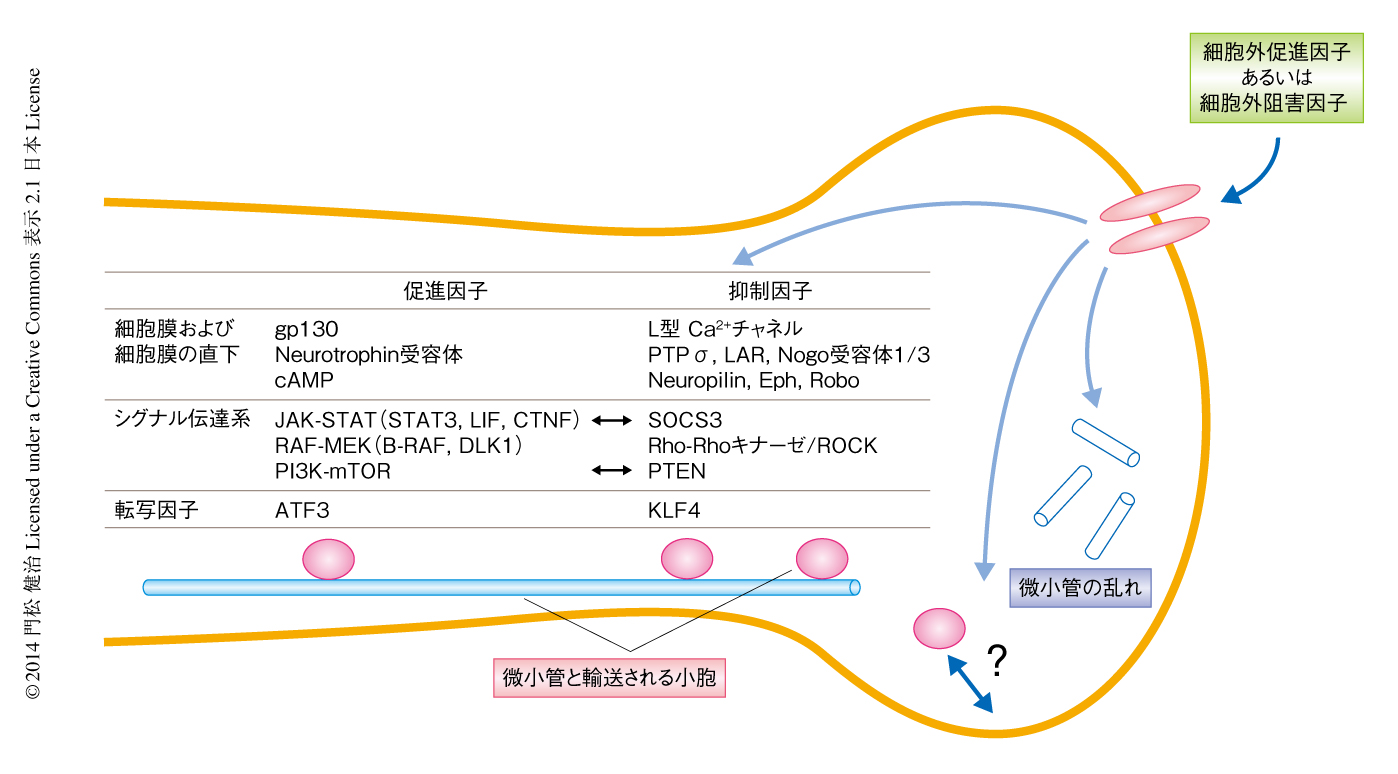
軸索再生の促進に寄与する細胞内のシグナル伝達系としては,少なくとも3つあげられる.すなわち,JAK-STAT系,RAF-MEK系,PI3K-mTOR系である(図4).
gp130はさまざまなリガンドに対する受容体複合体の構成タンパク質となり,その下流においてJAK-STAT系が機能する.たとえば,gp130のリガンドのひとつであるLIFを欠損したマウスは末梢条件づけ傷害に反応しない3).SOCS3はJAK-STAT系における抑制タンパク質だが,その欠損により視神経の損傷における軸索再生が促進される4).gp130の別のリガンドであるCNTFの発現は神経の損傷により誘導され,CNTFとSOCS3の二重欠損により軸索再生は相乗的に促進されるが,gp130とSOCS3の二重欠損ではこの効果はまったく失われる4)(図4).
古典的なシグナル伝達系であるRAF-MEK系については,これまで軸索再生について相反する説が提出されていたが,最近のエレガントな実験によりいちおうの決着をみた.すなわち,後根神経節細胞および視神経において特異的にB-RAFを発現させると軸索再生が促進され,この効果はMEK1あるいはMEK2の欠損により解除される5)(図4).RAF-MEK系の下流においてどのタンパク質が機能しているかについてはいまだ不明であるが,RAF-MEK系は微小管の安定化において重要なHDAC6を制御しており,ここに機能している可能性がある.
PTENはPI3K-mTOR系における抑制タンパク質である.視神経において特異的にPTENを欠損させると視神経の軸索再生が促進される6)(図4).さらに,B-RAFの発現とPTENの欠損は軸索再生に対し相乗的にはたらく5).つまり,RAF-MEK系とPI3K-mTOR系はクロストークしている可能性がある.
これら3つのシグナル伝達系にくわえ,cAMP,ATF3,DLK-1の重要性についてもふれる.後根神経節神経における細胞内cAMPのレベルは生後3~4日目に急激に低下する.これに呼応して,ミエリンやミエリン関連糖タンパク質による後根神経節神経の軸索の伸長は抑制される.この抑制はcAMPのアナログにより解除される7)(図4).ATF3はcAMPに依存性の転写因子である.ATF3は末梢条件づけ傷害により発現が亢進する.ATF3を発現するトランスジェニックマウスでは末梢神経の損傷において軸索再生が促進されているが,脊髄損傷のような中枢神経の損傷においては効果ない(図4).このことは,細胞外に存在する軸索再生の阻害因子に対抗する効果はもたないものの,ATF3が軸索再生の促進因子であることを示している.DLK-1はRAFと同じくMAPKKKに属する.線虫においてdaf-2変異は長寿命を示すのみでなく,軸索再生が顕著に亢進している.DAF-2の下流において抑制される転写因子DAF-16/FOXOは,daf-2変異体においては抑制されないため,その下流のDLK-1の発現が上昇する.DLK-1とその下流のシグナルは微小管の再構成に重要であるため,成長円錐の形成に必須である8)(図4).
細胞外の促進因子については,CNTFにくわえ,GDNFやneurotrophinが重要であり,これらは神経の損傷に際してだけでなく,損傷ののちのリハビリテーションにおいても発現の上昇することが知られている9)(図4).さらに,VEGFも血管の新生を介して軸索再生を促進すると考えられる.これらのタンパク質の受容体およびその下流のシグナル伝達系を考えると,JAK-STAT系,RAF-MEK系,PI3K-mTOR系が軸索再生を促進するというコンセプトは理にかなっているのかもしれない.しかしながら,このような細胞外因子と細胞内シグナルとの連関については,軸索再生において十分に検証されているとはいえない.
細胞内の阻害因子のなかでも,PTEN,SOCS3,Rho,KLF4,L型Ca2+チャネルは重要である(図4).Rhoはミエリン由来タンパク質の下流において共通にはたらき,Rhoキナーゼ/ROCKを介してアクチンの重合を促進し,軸索の伸長を抑制する10,11).KLF4は転写抑制因子である.KLF4ノックアウトマウスでは視神経を損傷したのちの軸索再生が野生型マウスに比べ有意に促進される12).L型Ca2+チャネルの重要性は,末梢条件づけ傷害により感覚神経の発火が減少するという現象から明らかになった13).この発火の減少は,L型Ca2+チャネルのサブユニットであるCav1.2の発現の低下によるものである.実際に,Cav1.2ノックアウトマウスでは軸索再生が促進される13).細胞の活動が軸索再生を抑制することを示すL型Ca2+チャンネルのデータは興味深い.
細胞外の阻害因子は,ミエリン由来タンパク質,軸索ガイダンスタンパク質,プロテオグリカン,の3つのカテゴリーに分けることができる.
ミエリン由来タンパク質は,細胞外に存在する軸索再生の阻害因子として歴史的にもっともよく研究されてきた.軸索の損傷とそれにひきつづくWaller変性により,軸索をおおうミエリンも分解される.そのミエリンに由来するタンパク質が軸索の末端と接することが,再生阻害の一因になる.この考えは,1988年,ミエリン由来タンパク質に対する抗体が軸索再生を促進するという結果により支持されるようになった14,15).そして2000年,この抗体が認識する抗原はNogo-Aであることが報告された16).いまでは,ミエリン由来タンパク質はおもにNogo,MAG,OMgpの3つで,Nogo受容体とp75を中核とする受容体複合体により,Rho-Rhoキナーゼ/ROCKなどのシグナル伝達系を活性化することがわかっている.しかしながら,Nogo,MAG,OMgpのトリプルノックアウトマウスにおける神経損傷ののちの軸索再生および機能の回復については研究グループにより結論が異なっており,この3つのタンパク質がin vivoにおける軸索再生の阻害に関与しているのかどうかは必ずしも明確ではない.
軸索ガイダンスタンパク質のなかでも,反発因子のsemaphorin,ephrin,slitはそれぞれにグループを形成するが,これらは神経発生の際のガイダンスタンパク質として機能するばかりでなく,神経損傷の際にも発現が誘導され軸索再生の阻害にはたらく(図4).
3つ目の阻害因子としてとみに注目されてきたのが,プロテオグリカンである.プロテオグリカンはコアタンパク質とそれに共有結合する長大な糖鎖(グリコサミノグリカン)からなる.プロテオグリカンに結合するグリコサミノグリカンとしては,コンドロイチン硫酸,ケラタン硫酸,ヘパラン硫酸,デルマタン硫酸が知られている.コンドロイチン硫酸の結合したプロテオグリカンを総称してコンドロイチン硫酸プロテオグリカンとよぶ.同様に,ケラタン硫酸プロテオグリカン,ヘパラン硫酸プロテオグリカンなどの総称がある.ひとつのコアタンパク質にコンドロイチン硫酸とケラタン硫酸の両方が結合するプロテオグリカン(ケラタン硫酸/コンドロイチン硫酸プロテオグリカン)もあるが,ケラタン硫酸とコンドロイチン硫酸は別々の糖鎖であり,同一の糖鎖のうえでケラタン硫酸とコンドロイチン硫酸とがつながることはない.
神経損傷の際に活性化されたアストログリアは,ガイダンスタンパク質にくわえプロテオグリカンを産生する.ニワトリの胎仔の後根神経節細胞の軸索はプロテオグリカンを含むニトロセルロースの短冊を横断できないと報告されたのが,1990年のことである.このときに用いられたプロテオグリカンはコンドロイチン硫酸およびケラタン硫酸を含むもので,コンドロイチン硫酸やケラタン硫酸を酵素により分解することでこの阻害活性は失われた17).プロテオグリカンは実際に損傷部位において産生されている18).さらに2001年および2002年には,in vivoにおいてコンドロイチン硫酸分解酵素の投与により軸索再生および機能の回復が促進されたことが報告された19,20).このように,これまでコンドロイチン硫酸が中心に考えられており,1990年の報告にあったケラタン硫酸の重要性は証明されていなかったが,筆者らは,高硫酸化したケラタン硫酸を欠損したマウスの作製に成功し,2006年,このケラタン硫酸欠損マウスでは損傷ののちに神経突起の伸長が促進されることを報告した21).ケラタン硫酸欠損マウスはまた,脊髄損傷ののちの軸索再生および機能の回復も亢進した22).さらに,ケラタン硫酸分解酵素の投与により,脊髄損傷ののちの軸索再生および機能の回復は促進された23).
ケラタン硫酸あるいはコンドロイチン硫酸が大事だとしても,プロテオグリカンにおいてコアタンパク質は単なる足場ではない.コアタンパク質を熱変性させたりアルブミンと置き換えて人工的なプロテオグリカンを構築したりすると,軸索再生の阻害活性は失われる23).さらに,aggrecan,phosphacan,brevican,neurocanといったプロテオグリカンのコアタンパク質を酵素により分解することによっても,軸索再生の阻害活性は失われる24).したがって,コアタンパク質による糖鎖の適切な提示が軸索再生の阻害において重要だと思われる23,25).
成長円錐とdystrophic endballとの違いはどこにあるのだろうか? アメフラシの神経軸索の成長円錐の形成においては,微小管の再構成が重要である26).すなわち,損傷をうけた軸索の末端は微小管が長軸と平行に再構成されることにより細胞骨格が形成され,小胞輸送が長軸の方向へむけ正常にはたらくことにより軸索再生が順調に進むと考えられる.線虫においても微小管の再構成の重要性が確認されており,そこにはDLK-1とその下流のシグナルが関与している8)(図4).dystrophic endballが中枢神経の損傷においてみられるのは,微小管の再構成の不全が一因である27).実際に,微小管再構成の阻害剤であるノコダゾールは成長円錐をdystrophic endballへと変換することができるし,一方,微小管の安定化剤であるタキソールはdystrophic endballの形成を抑制できる27).ここで重要なのは,dystrophic endballの形成そのものは中枢神経にもともと備わった形質ではなく,微小環境(細胞外因子)によるものであることである.たとえば,後根神経節細胞の軸索の末梢枝は損傷をうけると成長円錐を形成するが,中枢枝は損傷ののちdystrophic endballを形成する.後根神経節細胞をプロテオグリカンの濃度勾配のある培養基質において培養すると,in vitroにおいてもdystrophic endballの形成を誘導することができる18)(図3).実際に,脊髄損傷の部位にはプロテオグリカンが集積しており,in vivoにおいてもプロテオグリカンの濃度勾配が存在すると思われる18).つまり,損傷部におけるプロテオグリカンの産生こそがdystrophic endballの形成の原因であり,軸索再生の阻害の中心になっている可能性がある.
それでは,プロテオグリカンはどのような受容体を介してそのシグナルを神経軸索に伝達しているのだろうか? これまで,コンドロイチン硫酸の受容体として,受容体型チロシンホスファターゼ,Nogo受容体,Contactin-1が報告されている.
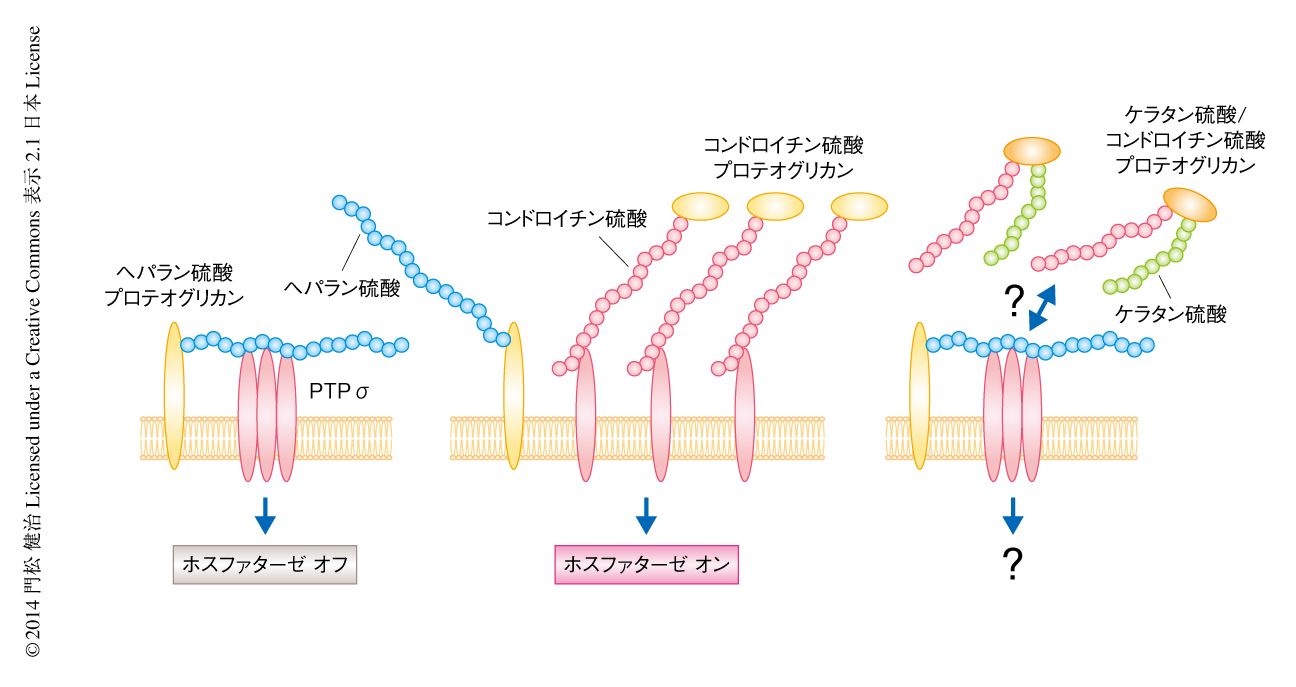
PTPσとLARは受容体型チロシンホスファターゼの同じサブファミリーに属し(図4),コンドロイチン硫酸と結合し機能的な受容体としてはたらく.PTPσノックアウトマウスは脊髄損傷ののちの軸索再生および機能の回復が亢進しており28),in vitroにおいてもプロテオグリカンの濃度勾配に逆らって軸索を伸長することができる.PTPσはヘパラン硫酸とも結合し,しかも,ヘパラン硫酸によりオリゴマー化する(図5).コンドロイチン硫酸とヘパラン硫酸はPTPσの同じN末端側の免疫グロブリン様ドメインに競合的に結合するが,コンドロイチン硫酸はPTPσのオリゴマー化を起こさない29)(図5).さらに,PTPσとヘパラン硫酸プロテオグリカンは軸索において共局在するがコンドロイチン硫酸プロテオグリカンは細胞外マトリックスに存在する.このことから,ヘパラン硫酸プロテオグリカンとシスで結合しオリゴマー化したPTPσが,細胞外に産生されたコンドロイチン硫酸プロテオグリカンとトランスに結合すると単量体化する,という機構が提案されている29)(図5).一般に,受容体型チロシンホスファターゼは単量体では活性型となり,オリゴマーとなることで不活性化すると考えられている.したがって,軸索の損傷の際にコンドロイチン硫酸プロテオグリカンと結合することによりPTPσのホスファターゼ活性が上昇することが,dystrophic endballの形成までの一連の反応の引き金になっていると想像される.しかしながら,このホスファターゼの活性化を含む一連の反応が証明されたわけではない.LARのN末端側にある免疫グロブリン様ドメインもPTPσのものと似ており,コンドロイチン硫酸と結合する29).LARノックアウトマウスの神経軸索はコンドロイチン硫酸プロテオグリカンを含む培養基質においても伸長する30)(図4).LARの2種類の阻害ペプチドも野生型の神経軸索の伸長を促進する.さらに,コンドロイチン硫酸プロテオグリカンはCOS-7細胞に発現させたLARのホスファターゼ活性を亢進する.ところが,LARの2種類の阻害ペプチドは,それぞれ,LARのオリゴマー化の阻害およびホスファターゼ活性の阻害のために開発されたものである.つまり,LARはPTPσとは逆に,オリゴマーが活性型である可能性がある.LARおよびPTPσにおけるヘパラン硫酸プロテオグリカンおよびコンドロイチン硫酸プロテオグリカンの関係については,さらなる研究が必要であると思われる.
Nogo受容体はNogo,MAG,OMgpの共通の受容体である.ところが,Nogo受容体1およびNogo受容体3はコンドロイチン硫酸とも結合する31).Nogo受容体1とNogo受容体3のダブルノックアウトマウスは損傷ののちの軸索再生が亢進している(図4).これは,Nogo受容体1あるいはNogo受容体3の単独のノックアウトではみられない.Nogo受容体1,Nogo受容体3,PTPσをトリプルノックアウトマウスではさらに軸索再生が亢進していることから,Nogo受容体1およびNogo受容体3とPTPσの2つの系はクロストークしている可能性がある.
Contactin-1はコンドロイチン硫酸による神経突起の伸長の促進にかかわる受容体として同定された.コンドロイチン硫酸はこれまで軸索再生の阻害因子として解説してきたが,そのうちコンドロイチン硫酸Eは,ある条件においてはむしろ神経突起の伸長にはたらく.Contactin-1はコンドロイチン硫酸Eと結合し,コンドロイチン硫酸Eによる神経突起の伸長はContactin-1のノックダウンにより抑制される32).軸索ガイダンスタンパク質netrinが基質の種類により誘引性にも反発性にもはたらくのと同様に,コンドロイチン硫酸も共存する基質の種類により軸索の伸長の促進にも阻害にもはたらく可能性がある.したがって,Contactin-1もin vivoにおいてコンドロイチン硫酸の機能的な受容体としてはたらいている可能性がある.
ここまでコンドロイチン硫酸受容体について述べてきたが,ケラタン硫酸受容体については依然として不明である(図5).脊髄損傷ののちの軸索再生および機能の回復の促進効果は,ケラタン硫酸分解酵素とコンドロイチン硫酸分解酵素とで同等である23).また,筆者らの予備的なデータによると,in vivoにおいて軸索再生の阻害の中心になるのは,ケラタン硫酸/コンドロイチン硫酸プロテオグリカンであると思われる.したがって,ケラタン硫酸,コンドロイチン硫酸,糖鎖受容体の3者の関係を解くことが,今後のこの分野の発展に重要である.
コンドロイチン硫酸プロテオグリカンは軸索再生の阻害にとどまらず,神経の可塑性においても重要である.ペリニューロナルネットはパルブアルブミン陽性の介在ニューロンの特別な細胞外マトリックスであり,そのおもな成分はコンドロイチン硫酸プロテオグリカン,ヒアルロン酸,tenascin Rである.通常,幼児期の臨界期にしかみられない経験に依存的な神経可塑性を,コンドロイチン硫酸分解酵素の投与により成体において起こすことができる33,34).また,幼児型の硫酸化パターンを示すコンドロイチン硫酸のトランスジェニックマウスでは,成体においても経験に依存的な神経可塑性がみられる35).このとき,成体においてもペリニューロナルネットは臨界期の幼児のようにゆるい構造になっている.このことは,全長のコンドロイチン硫酸よりも,硫酸化のパターンにより区別されるコンドロイチン硫酸の機能ドメインがペリニューロナルネットの形成において重要であり,経験に依存的な神経可塑性を制御していることを示唆する.
神経可塑性の基盤にはシナプスの可塑性がある.コンドロイチン硫酸分解酵素やヒアルロン酸分解酵素はAMPA受容体の側方への移動を促進する36).この側方移動は興奮性神経のシナプス可塑性において重要なステップなので,細胞外マトリックスの成分であるコンドロイチン硫酸およびヒアルロン酸がこのシナプス可塑性を負に制御しているといえる.また,コンドロイチン硫酸分解酵素はシナプスの後部を形成する樹状突起におけるスパインの可動性および隆起を促進する37).このことも,コンドロイチン硫酸がシナプス形成の抑制因子としてはたらくことを示唆する.さらに,特異的なリハビリテーションとコンドロイチン硫酸分解酵素の併用は,ラットにおいて脊髄損傷ののちの手の器用さの回復に効果を発揮するという報告もある38).
以上のデータは,コンドロイチン硫酸の抑制的な機能は,軸索再生に対してだけでなく,神経可塑性にも及ぶことを示している.
軸索の再生を理解するためには,細胞内および細胞外の促進因子および阻害因子のすべてに配慮する必要がある.さらに,神経損傷ののちの機能の回復の機構をたどると,損傷した軸索末端の細胞膜のほころびの修復,軸索の伸長,目的の場所への到達,シナプスの形成,機能的な神経ネットワークの再編,といくつものステップを想定できる.現在のところ治療法のない中枢神経の損傷に新たな治療法を見い出したいなら,これらをふまえて標的となる分子を決定しなければならない.コンドロイチン硫酸は軸索再生にくわえてシナプス可塑性をも抑制するので,コンドロイチン硫酸を標的とすることは十分に意味があるだろう.一方,これまで使われてきたコンドロイチン硫酸分解酵素は細菌に由来するものであり,ヒトに対して反復使用はできないだろう.したがって,コンドロイチン硫酸合成系やコンドロイチン硫酸受容体はその代替の手段として有効だと思われる.しかし,そのためにはコンドロイチン硫酸受容体の正確な作用機構の解明が必要である.なかでもケラタン硫酸/コンドロイチン硫酸プロテオグリカンが主役であるなら,ケラタン硫酸受容体の同定と解析は欠かすことのできない課題である.Cajalは1世紀まえにつぎのようにも言っている.“もし,中枢神経の損傷ののちの再生が可能になるとするなら,それは後世の科学者の努力によるものであろう”.
略歴:1988年 九州大学大学院医学研究科 修了,同年 鹿児島大学医学部 助手,1994年 名古屋大学医学部 講師,1996年 同 助教授を経て,2004年より名古屋大学大学院医学系研究科 教授.
研究テーマ:硫酸化糖鎖による軸索再生の制御機構.神経芽腫の発生と自然退縮の機構.
関心事:目下の最大の関心事は,ケラタン硫酸受容体とdystrophic endballの形成とのかかわり.もうひとつは,神経芽腫の極初期の解析を介して,このがんの発生機構を解くこと.細胞分裂をおえた神経と,細胞分裂を無限につづけるがんとを扱うこれら2つのプロジェクトは,いっけん別物にみえるが底流ではつながり,互いに教えてくれるものが多い.
研究室URL:http://www.med.nagoya-u.ac.jp/biochem/
© 2014 門松 健治 Licensed under CC 表示 2.1 日本
(名古屋大学大学院医学系研究科 分子生物学分野)
email:門松健治
領域融合レビュー, 3, e005 (2014) DOI: 10.7875/leading.author.3.e005
Kenji Kadomatsu: Mechanisms of axon regeneration and its inhibition: Glyco-neuroscience as a research of combined disciplines.
要 約
末梢神経の軸索は損傷したのちにも再生する.しかし,中枢神経の軸索はいちど損傷をうけるとほとんど再生しない.再生する軸索の末端は成長円錐を形成するが,中枢神経の損傷部には代わりにdystrophic endballとよばれる軸索の末端が出現する.微小管が軸索の長軸と平行に再構築されると成長円錐が形成されるが,dystrophic endballではそれが乱れている.ただし,これは細胞に内在性の要因によるものではなく,細胞外の因子により誘導される.この細胞外因子のなかでもプロテオグリカンは重要である.培養基質にプロテオグリカンの濃度勾配を形成することにより,in vitroにおいてもdystrophic endballを誘導することができる.プロテオグリカンはコアタンパク質と長大な糖鎖からなり,その糖鎖としてコンドロイチン硫酸,ケラタン硫酸,ヘパラン硫酸などが知られている.コンドロイチン硫酸およびケラタン硫酸は細胞外において阻害因子としてはたらくが,おもしろいことに,ヘパラン硫酸は軸索に存在して促進因子としてもはたらく.くわえて,コンドロイチン硫酸はシナプスの可塑性において重要な抑制因子であることもわかってきた.このように,糖鎖科学と神経科学との融合によりはじめてみえる神経の機能制御が明らかになりつつある.このレビューでは,軸索再生の制御機構について説明したのち,コンドロイチン硫酸とケラタン硫酸を中心に糖鎖の作用機構にせまる.
はじめに
生体の鎖状高分子(バイオポリマー)として,核酸,タンパク質,糖鎖がある.核酸,タンパク質とならんで糖鎖が第3の生命鎖とよばれるゆえんである.しかしながら,糖鎖の作動原理あるいは機能の理解は限定的である.もとより,糖鎖の結合の様式は一様ではなく,分岐があり,また,複数のステップの結合に複数の酵素がかかわっている(図1).このことは,ひとつの鎖を生合成するのに幾多の独立したセントラルドグマの制御を時空間的にうけていることを意味し,そのため,微小環境の影響をうけやすい.つまり,糖鎖の生合成はセントラルドグマから一歩さきの少し離れたところで制御されている(図1).
一方,糖鎖が結合するタンパク質や脂質は多岐にわたる.糖鎖はこれらタンパク質や脂質の違いにかかわらず共通の機能をもちうるが,逆に,タンパク質や脂質に依存する場合も多い.また,糖鎖合成酵素のノックアウトを想定しても,糖鎖が結合するタンパク質や脂質を選ぶことはできないし,また,相補的に別の構造をもつ糖鎖の生合成が誘導されることもある.このことも,糖鎖の生合成はセントラルドグマから少し離れたところで制御されていることを意味する.
糖鎖科学でつちかわれた技術および知識は,ちょうど現在の分子生物学がそうであるように,究極的にはあらゆる生命科学に生かされるべきである.糖鎖は重要であるはずだが,ほかの分野の生命科学者にとり糖鎖ほど扱いにくく敷居の高いものはないであろう.その壮大なゴールをめざすには,糖鎖の解析のための技術革新など,さまざまな課題の解決が必要である.しかし,ひとり糖鎖科学のがんばりだけではこれは不可能であり,生命科学のほかの分野との共同作業が重要である.すなわち,糖鎖による生命科学の深堀の事例がちまたにあふれるとき,糖鎖科学および生命科学の真の発展が期待できる.筆者が専門とする神経糖鎖生物学においても,糖鎖の視点がくわわることにより,これまでみえなかった新しい神経機能の制御機構が明らかになりつつある(図2).
このレビューでは,神経科学と糖鎖科学との融合研究のなかでも世界的にとくに進んでいる分野のひとつとして,軸索再生とその阻害の機構をとりあげる.まず,現在までに知られている軸索再生の制御機構についてまとめ,つづいて,そこでの糖鎖の機能の意義および作用機構に言及する.
1.末梢神経と中枢神経
スペインの神経解剖学者Cajalはニューロン説の提唱によりノーベル医学生理学賞を受賞したが,ほかにも数々の業績を残している.“いちど傷害をうけた中枢神経は2度と再生しない”.Cajalが1世紀もまえに残した言葉である.Cajalは損傷した中枢神経の軸索の末端がいびつな球形の形態を呈することを発見した.dystrophic endball(あるいは,retraction bulb,frustrated growth cone)とよばれるこの形態は,中枢神経の損傷のひとつの象徴的なマーカーである(図3).損傷をうけた中枢神経では損傷部においてグリア細胞の活性化および集積が起こり,グリア性瘢痕が形成される.とくに,活性化アストログリアからは多くのタンパク質が産生され軸索再生を直接に阻害する.したがって,グリア性瘢痕は物理的な障壁としてだけでなく,分子的な障壁としても軸索再生を阻害しているといえる.また,末梢神経にみられる内在性の軸索再生の機構が中枢神経では十分にはたらかないことが,中枢神経における軸索再生をむずかしくしているもうひとつの理由である.
末梢神経はSchwann細胞によりおおわれているが,Schwann細胞はまた,ラミニン,IV型コラーゲン,へパラン硫酸プロテオグリカンなど,細胞外マトリックスを構成する分子を産生し基底膜を形成する(図3).その結果,末梢神経の軸索の束は基底膜により形成された筒におおわれる.この基底膜の筒は損傷ののちも残るため,Waller変性におちいった軸索は基底膜をガイドにして正確に再生される.というのも,ラミニン,IV型コラーゲン,へパラン硫酸プロテオグリカンは軸索再生の促進因子でもあるからである.Waller変性にともなうミエリンの分解産物はSchwann細胞やマクロファージによりすみやかに除去されることも,軸索再生の阻害因子の作用をふせぐという観点から重要である.こうして,損傷ののち,末梢神経の軸索の末端は成長円錐の形態をとり軸索は再生される.dystrophic endballを形成して再生しない中枢神経の軸索とは好対照である(図3).
なお,中枢神経の軸索再生を記述するときsprouting(分枝)という言葉を併記することが多い.これは,中枢神経の軸索がそのまま再生することはほとんどなく,むしろ,分枝により新たなネットワークを形成することがほとんどであること,そして,再生と分枝とが見分けにくいことによる.しかしながら,分枝の末端もdystrophic endballを形成することから,細胞の内外のシグナルは再生と分枝とで変わらないように思われる.したがって,このレビューでは,これらをまとめて軸索再生とよぶ.
2.軸索再生の促進機構:細胞内および細胞外の促進因子
後根神経節神経は感覚神経であり1本の軸索をもつ.しかし,その軸索は末梢と中枢の2本に枝分かれしている.末梢枝は筋肉や皮膚などに達し,中枢枝は脊髄に達する.脊髄損傷などにより中枢枝が損傷しても軸索は再生しないが,あらかじめ末梢枝を損傷しておき(peripheral conditioning lesion,末梢条件づけ傷害という),そののちに中枢枝を損傷した場合には軸索再生は促進される.このことは,末梢条件づけ傷害により再生のシグナルがあらかじめ核へと伝達されたことを意味し,また,中枢神経の軸索再生において内在性の再生能の促進という戦略が成り立つことを示唆する.
さて,再生のシグナルが核に伝達されるには,損傷ののち数十秒で核に伝達されるCa2+波と,微小管によるタンパク質逆行輸送の波の2つが必要である.Ca2+波はテトロドトキシン感受性Na+チャネル,Na+/Ca2+交換輸送体,電位開口型Ca2+チャネル,イノシトールトリスリン酸受容体といったいくつかの装置により伝達される1).この波はプロテインキナーゼCμのリン酸化,ヒストン脱アセチル化酵素HDAC5のリン酸化,リン酸化HDAC5の核外への移行,ヒストンのアセチル化の亢進,という一連の反応をひき起こし,軸索再生に必要なタンパク質をコードする遺伝子の転写の促進に寄与する2).タンパク質逆行輸送はダイニンをモータータンパク質として使うが,その積荷はバラエティに富んでいる.積荷にはリン酸化DLK,リン酸化JNK3,リン酸化STAT3,リン酸化ERKなどが含まれる1).STAT3およびERKは局所において翻訳され,同じく局所において翻訳されたimportinαおよびvimentinとそれぞれ結合し,importinβとともに積荷として輸送されている.
軸索再生の促進に寄与する細胞内のシグナル伝達系としては,少なくとも3つあげられる.すなわち,JAK-STAT系,RAF-MEK系,PI3K-mTOR系である(図4).
gp130はさまざまなリガンドに対する受容体複合体の構成タンパク質となり,その下流においてJAK-STAT系が機能する.たとえば,gp130のリガンドのひとつであるLIFを欠損したマウスは末梢条件づけ傷害に反応しない3).SOCS3はJAK-STAT系における抑制タンパク質だが,その欠損により視神経の損傷における軸索再生が促進される4).gp130の別のリガンドであるCNTFの発現は神経の損傷により誘導され,CNTFとSOCS3の二重欠損により軸索再生は相乗的に促進されるが,gp130とSOCS3の二重欠損ではこの効果はまったく失われる4)(図4).
古典的なシグナル伝達系であるRAF-MEK系については,これまで軸索再生について相反する説が提出されていたが,最近のエレガントな実験によりいちおうの決着をみた.すなわち,後根神経節細胞および視神経において特異的にB-RAFを発現させると軸索再生が促進され,この効果はMEK1あるいはMEK2の欠損により解除される5)(図4).RAF-MEK系の下流においてどのタンパク質が機能しているかについてはいまだ不明であるが,RAF-MEK系は微小管の安定化において重要なHDAC6を制御しており,ここに機能している可能性がある.
PTENはPI3K-mTOR系における抑制タンパク質である.視神経において特異的にPTENを欠損させると視神経の軸索再生が促進される6)(図4).さらに,B-RAFの発現とPTENの欠損は軸索再生に対し相乗的にはたらく5).つまり,RAF-MEK系とPI3K-mTOR系はクロストークしている可能性がある.
これら3つのシグナル伝達系にくわえ,cAMP,ATF3,DLK-1の重要性についてもふれる.後根神経節神経における細胞内cAMPのレベルは生後3~4日目に急激に低下する.これに呼応して,ミエリンやミエリン関連糖タンパク質による後根神経節神経の軸索の伸長は抑制される.この抑制はcAMPのアナログにより解除される7)(図4).ATF3はcAMPに依存性の転写因子である.ATF3は末梢条件づけ傷害により発現が亢進する.ATF3を発現するトランスジェニックマウスでは末梢神経の損傷において軸索再生が促進されているが,脊髄損傷のような中枢神経の損傷においては効果ない(図4).このことは,細胞外に存在する軸索再生の阻害因子に対抗する効果はもたないものの,ATF3が軸索再生の促進因子であることを示している.DLK-1はRAFと同じくMAPKKKに属する.線虫においてdaf-2変異は長寿命を示すのみでなく,軸索再生が顕著に亢進している.DAF-2の下流において抑制される転写因子DAF-16/FOXOは,daf-2変異体においては抑制されないため,その下流のDLK-1の発現が上昇する.DLK-1とその下流のシグナルは微小管の再構成に重要であるため,成長円錐の形成に必須である8)(図4).
細胞外の促進因子については,CNTFにくわえ,GDNFやneurotrophinが重要であり,これらは神経の損傷に際してだけでなく,損傷ののちのリハビリテーションにおいても発現の上昇することが知られている9)(図4).さらに,VEGFも血管の新生を介して軸索再生を促進すると考えられる.これらのタンパク質の受容体およびその下流のシグナル伝達系を考えると,JAK-STAT系,RAF-MEK系,PI3K-mTOR系が軸索再生を促進するというコンセプトは理にかなっているのかもしれない.しかしながら,このような細胞外因子と細胞内シグナルとの連関については,軸索再生において十分に検証されているとはいえない.
3.軸索再生の阻害機構:細胞内および細胞外の阻害因子
細胞内の阻害因子のなかでも,PTEN,SOCS3,Rho,KLF4,L型Ca2+チャネルは重要である(図4).Rhoはミエリン由来タンパク質の下流において共通にはたらき,Rhoキナーゼ/ROCKを介してアクチンの重合を促進し,軸索の伸長を抑制する10,11).KLF4は転写抑制因子である.KLF4ノックアウトマウスでは視神経を損傷したのちの軸索再生が野生型マウスに比べ有意に促進される12).L型Ca2+チャネルの重要性は,末梢条件づけ傷害により感覚神経の発火が減少するという現象から明らかになった13).この発火の減少は,L型Ca2+チャネルのサブユニットであるCav1.2の発現の低下によるものである.実際に,Cav1.2ノックアウトマウスでは軸索再生が促進される13).細胞の活動が軸索再生を抑制することを示すL型Ca2+チャンネルのデータは興味深い.
細胞外の阻害因子は,ミエリン由来タンパク質,軸索ガイダンスタンパク質,プロテオグリカン,の3つのカテゴリーに分けることができる.
ミエリン由来タンパク質は,細胞外に存在する軸索再生の阻害因子として歴史的にもっともよく研究されてきた.軸索の損傷とそれにひきつづくWaller変性により,軸索をおおうミエリンも分解される.そのミエリンに由来するタンパク質が軸索の末端と接することが,再生阻害の一因になる.この考えは,1988年,ミエリン由来タンパク質に対する抗体が軸索再生を促進するという結果により支持されるようになった14,15).そして2000年,この抗体が認識する抗原はNogo-Aであることが報告された16).いまでは,ミエリン由来タンパク質はおもにNogo,MAG,OMgpの3つで,Nogo受容体とp75を中核とする受容体複合体により,Rho-Rhoキナーゼ/ROCKなどのシグナル伝達系を活性化することがわかっている.しかしながら,Nogo,MAG,OMgpのトリプルノックアウトマウスにおける神経損傷ののちの軸索再生および機能の回復については研究グループにより結論が異なっており,この3つのタンパク質がin vivoにおける軸索再生の阻害に関与しているのかどうかは必ずしも明確ではない.
軸索ガイダンスタンパク質のなかでも,反発因子のsemaphorin,ephrin,slitはそれぞれにグループを形成するが,これらは神経発生の際のガイダンスタンパク質として機能するばかりでなく,神経損傷の際にも発現が誘導され軸索再生の阻害にはたらく(図4).
3つ目の阻害因子としてとみに注目されてきたのが,プロテオグリカンである.プロテオグリカンはコアタンパク質とそれに共有結合する長大な糖鎖(グリコサミノグリカン)からなる.プロテオグリカンに結合するグリコサミノグリカンとしては,コンドロイチン硫酸,ケラタン硫酸,ヘパラン硫酸,デルマタン硫酸が知られている.コンドロイチン硫酸の結合したプロテオグリカンを総称してコンドロイチン硫酸プロテオグリカンとよぶ.同様に,ケラタン硫酸プロテオグリカン,ヘパラン硫酸プロテオグリカンなどの総称がある.ひとつのコアタンパク質にコンドロイチン硫酸とケラタン硫酸の両方が結合するプロテオグリカン(ケラタン硫酸/コンドロイチン硫酸プロテオグリカン)もあるが,ケラタン硫酸とコンドロイチン硫酸は別々の糖鎖であり,同一の糖鎖のうえでケラタン硫酸とコンドロイチン硫酸とがつながることはない.
神経損傷の際に活性化されたアストログリアは,ガイダンスタンパク質にくわえプロテオグリカンを産生する.ニワトリの胎仔の後根神経節細胞の軸索はプロテオグリカンを含むニトロセルロースの短冊を横断できないと報告されたのが,1990年のことである.このときに用いられたプロテオグリカンはコンドロイチン硫酸およびケラタン硫酸を含むもので,コンドロイチン硫酸やケラタン硫酸を酵素により分解することでこの阻害活性は失われた17).プロテオグリカンは実際に損傷部位において産生されている18).さらに2001年および2002年には,in vivoにおいてコンドロイチン硫酸分解酵素の投与により軸索再生および機能の回復が促進されたことが報告された19,20).このように,これまでコンドロイチン硫酸が中心に考えられており,1990年の報告にあったケラタン硫酸の重要性は証明されていなかったが,筆者らは,高硫酸化したケラタン硫酸を欠損したマウスの作製に成功し,2006年,このケラタン硫酸欠損マウスでは損傷ののちに神経突起の伸長が促進されることを報告した21).ケラタン硫酸欠損マウスはまた,脊髄損傷ののちの軸索再生および機能の回復も亢進した22).さらに,ケラタン硫酸分解酵素の投与により,脊髄損傷ののちの軸索再生および機能の回復は促進された23).
ケラタン硫酸あるいはコンドロイチン硫酸が大事だとしても,プロテオグリカンにおいてコアタンパク質は単なる足場ではない.コアタンパク質を熱変性させたりアルブミンと置き換えて人工的なプロテオグリカンを構築したりすると,軸索再生の阻害活性は失われる23).さらに,aggrecan,phosphacan,brevican,neurocanといったプロテオグリカンのコアタンパク質を酵素により分解することによっても,軸索再生の阻害活性は失われる24).したがって,コアタンパク質による糖鎖の適切な提示が軸索再生の阻害において重要だと思われる23,25).
4.糖鎖の受容体
成長円錐とdystrophic endballとの違いはどこにあるのだろうか? アメフラシの神経軸索の成長円錐の形成においては,微小管の再構成が重要である26).すなわち,損傷をうけた軸索の末端は微小管が長軸と平行に再構成されることにより細胞骨格が形成され,小胞輸送が長軸の方向へむけ正常にはたらくことにより軸索再生が順調に進むと考えられる.線虫においても微小管の再構成の重要性が確認されており,そこにはDLK-1とその下流のシグナルが関与している8)(図4).dystrophic endballが中枢神経の損傷においてみられるのは,微小管の再構成の不全が一因である27).実際に,微小管再構成の阻害剤であるノコダゾールは成長円錐をdystrophic endballへと変換することができるし,一方,微小管の安定化剤であるタキソールはdystrophic endballの形成を抑制できる27).ここで重要なのは,dystrophic endballの形成そのものは中枢神経にもともと備わった形質ではなく,微小環境(細胞外因子)によるものであることである.たとえば,後根神経節細胞の軸索の末梢枝は損傷をうけると成長円錐を形成するが,中枢枝は損傷ののちdystrophic endballを形成する.後根神経節細胞をプロテオグリカンの濃度勾配のある培養基質において培養すると,in vitroにおいてもdystrophic endballの形成を誘導することができる18)(図3).実際に,脊髄損傷の部位にはプロテオグリカンが集積しており,in vivoにおいてもプロテオグリカンの濃度勾配が存在すると思われる18).つまり,損傷部におけるプロテオグリカンの産生こそがdystrophic endballの形成の原因であり,軸索再生の阻害の中心になっている可能性がある.
それでは,プロテオグリカンはどのような受容体を介してそのシグナルを神経軸索に伝達しているのだろうか? これまで,コンドロイチン硫酸の受容体として,受容体型チロシンホスファターゼ,Nogo受容体,Contactin-1が報告されている.
PTPσとLARは受容体型チロシンホスファターゼの同じサブファミリーに属し(図4),コンドロイチン硫酸と結合し機能的な受容体としてはたらく.PTPσノックアウトマウスは脊髄損傷ののちの軸索再生および機能の回復が亢進しており28),in vitroにおいてもプロテオグリカンの濃度勾配に逆らって軸索を伸長することができる.PTPσはヘパラン硫酸とも結合し,しかも,ヘパラン硫酸によりオリゴマー化する(図5).コンドロイチン硫酸とヘパラン硫酸はPTPσの同じN末端側の免疫グロブリン様ドメインに競合的に結合するが,コンドロイチン硫酸はPTPσのオリゴマー化を起こさない29)(図5).さらに,PTPσとヘパラン硫酸プロテオグリカンは軸索において共局在するがコンドロイチン硫酸プロテオグリカンは細胞外マトリックスに存在する.このことから,ヘパラン硫酸プロテオグリカンとシスで結合しオリゴマー化したPTPσが,細胞外に産生されたコンドロイチン硫酸プロテオグリカンとトランスに結合すると単量体化する,という機構が提案されている29)(図5).一般に,受容体型チロシンホスファターゼは単量体では活性型となり,オリゴマーとなることで不活性化すると考えられている.したがって,軸索の損傷の際にコンドロイチン硫酸プロテオグリカンと結合することによりPTPσのホスファターゼ活性が上昇することが,dystrophic endballの形成までの一連の反応の引き金になっていると想像される.しかしながら,このホスファターゼの活性化を含む一連の反応が証明されたわけではない.LARのN末端側にある免疫グロブリン様ドメインもPTPσのものと似ており,コンドロイチン硫酸と結合する29).LARノックアウトマウスの神経軸索はコンドロイチン硫酸プロテオグリカンを含む培養基質においても伸長する30)(図4).LARの2種類の阻害ペプチドも野生型の神経軸索の伸長を促進する.さらに,コンドロイチン硫酸プロテオグリカンはCOS-7細胞に発現させたLARのホスファターゼ活性を亢進する.ところが,LARの2種類の阻害ペプチドは,それぞれ,LARのオリゴマー化の阻害およびホスファターゼ活性の阻害のために開発されたものである.つまり,LARはPTPσとは逆に,オリゴマーが活性型である可能性がある.LARおよびPTPσにおけるヘパラン硫酸プロテオグリカンおよびコンドロイチン硫酸プロテオグリカンの関係については,さらなる研究が必要であると思われる.
Nogo受容体はNogo,MAG,OMgpの共通の受容体である.ところが,Nogo受容体1およびNogo受容体3はコンドロイチン硫酸とも結合する31).Nogo受容体1とNogo受容体3のダブルノックアウトマウスは損傷ののちの軸索再生が亢進している(図4).これは,Nogo受容体1あるいはNogo受容体3の単独のノックアウトではみられない.Nogo受容体1,Nogo受容体3,PTPσをトリプルノックアウトマウスではさらに軸索再生が亢進していることから,Nogo受容体1およびNogo受容体3とPTPσの2つの系はクロストークしている可能性がある.
Contactin-1はコンドロイチン硫酸による神経突起の伸長の促進にかかわる受容体として同定された.コンドロイチン硫酸はこれまで軸索再生の阻害因子として解説してきたが,そのうちコンドロイチン硫酸Eは,ある条件においてはむしろ神経突起の伸長にはたらく.Contactin-1はコンドロイチン硫酸Eと結合し,コンドロイチン硫酸Eによる神経突起の伸長はContactin-1のノックダウンにより抑制される32).軸索ガイダンスタンパク質netrinが基質の種類により誘引性にも反発性にもはたらくのと同様に,コンドロイチン硫酸も共存する基質の種類により軸索の伸長の促進にも阻害にもはたらく可能性がある.したがって,Contactin-1もin vivoにおいてコンドロイチン硫酸の機能的な受容体としてはたらいている可能性がある.
ここまでコンドロイチン硫酸受容体について述べてきたが,ケラタン硫酸受容体については依然として不明である(図5).脊髄損傷ののちの軸索再生および機能の回復の促進効果は,ケラタン硫酸分解酵素とコンドロイチン硫酸分解酵素とで同等である23).また,筆者らの予備的なデータによると,in vivoにおいて軸索再生の阻害の中心になるのは,ケラタン硫酸/コンドロイチン硫酸プロテオグリカンであると思われる.したがって,ケラタン硫酸,コンドロイチン硫酸,糖鎖受容体の3者の関係を解くことが,今後のこの分野の発展に重要である.
5.糖鎖と神経の可塑性
コンドロイチン硫酸プロテオグリカンは軸索再生の阻害にとどまらず,神経の可塑性においても重要である.ペリニューロナルネットはパルブアルブミン陽性の介在ニューロンの特別な細胞外マトリックスであり,そのおもな成分はコンドロイチン硫酸プロテオグリカン,ヒアルロン酸,tenascin Rである.通常,幼児期の臨界期にしかみられない経験に依存的な神経可塑性を,コンドロイチン硫酸分解酵素の投与により成体において起こすことができる33,34).また,幼児型の硫酸化パターンを示すコンドロイチン硫酸のトランスジェニックマウスでは,成体においても経験に依存的な神経可塑性がみられる35).このとき,成体においてもペリニューロナルネットは臨界期の幼児のようにゆるい構造になっている.このことは,全長のコンドロイチン硫酸よりも,硫酸化のパターンにより区別されるコンドロイチン硫酸の機能ドメインがペリニューロナルネットの形成において重要であり,経験に依存的な神経可塑性を制御していることを示唆する.
神経可塑性の基盤にはシナプスの可塑性がある.コンドロイチン硫酸分解酵素やヒアルロン酸分解酵素はAMPA受容体の側方への移動を促進する36).この側方移動は興奮性神経のシナプス可塑性において重要なステップなので,細胞外マトリックスの成分であるコンドロイチン硫酸およびヒアルロン酸がこのシナプス可塑性を負に制御しているといえる.また,コンドロイチン硫酸分解酵素はシナプスの後部を形成する樹状突起におけるスパインの可動性および隆起を促進する37).このことも,コンドロイチン硫酸がシナプス形成の抑制因子としてはたらくことを示唆する.さらに,特異的なリハビリテーションとコンドロイチン硫酸分解酵素の併用は,ラットにおいて脊髄損傷ののちの手の器用さの回復に効果を発揮するという報告もある38).
以上のデータは,コンドロイチン硫酸の抑制的な機能は,軸索再生に対してだけでなく,神経可塑性にも及ぶことを示している.
おわりに
軸索の再生を理解するためには,細胞内および細胞外の促進因子および阻害因子のすべてに配慮する必要がある.さらに,神経損傷ののちの機能の回復の機構をたどると,損傷した軸索末端の細胞膜のほころびの修復,軸索の伸長,目的の場所への到達,シナプスの形成,機能的な神経ネットワークの再編,といくつものステップを想定できる.現在のところ治療法のない中枢神経の損傷に新たな治療法を見い出したいなら,これらをふまえて標的となる分子を決定しなければならない.コンドロイチン硫酸は軸索再生にくわえてシナプス可塑性をも抑制するので,コンドロイチン硫酸を標的とすることは十分に意味があるだろう.一方,これまで使われてきたコンドロイチン硫酸分解酵素は細菌に由来するものであり,ヒトに対して反復使用はできないだろう.したがって,コンドロイチン硫酸合成系やコンドロイチン硫酸受容体はその代替の手段として有効だと思われる.しかし,そのためにはコンドロイチン硫酸受容体の正確な作用機構の解明が必要である.なかでもケラタン硫酸/コンドロイチン硫酸プロテオグリカンが主役であるなら,ケラタン硫酸受容体の同定と解析は欠かすことのできない課題である.Cajalは1世紀まえにつぎのようにも言っている.“もし,中枢神経の損傷ののちの再生が可能になるとするなら,それは後世の科学者の努力によるものであろう”.
文 献
- Rishal, I. & Fainzilber, M.: Axon-soma communication in neuronal injury. Nat. Rev. Neurosci., 15, 32-42 (2014)[PubMed]
- Cho, Y., Sloutsky, R., Naegle, K. M. et al.: Injury-induced HDAC5 nuclear export is essential for axon regeneration. Cell, 155, 894-908 (2013)[PubMed]
- Cafferty, W. B., Gardiner, N. J., Gavazzi, I. et al.: Leukemia inhibitory factor determines the growth status of injured adult sensory neurons. J. Neurosci., 21, 7161-7170 (2001)[PubMed]
- Smith, P. D., Sun, F., Park, K. K. et al.: SOCS3 deletion promotes optic nerve regeneration in vivo. Neuron, 64, 617-623 (2009)[PubMed]
- O'Donovan, K. J., Ma, K., Guo, H. et al.: B-RAF kinase drives developmental axon growth and promotes axon regeneration in the injured mature CNS. J. Exp. Med., 211, 801-814 (2014)[PubMed]
- Park, K. K., Liu, K., Hu, Y. et al.: Promoting axon regeneration in the adult CNS by modulation of the PTEN/mTOR pathway. Science, 322, 963-966 (2008)[PubMed]
- Cai, D., Shen, Y., De Bellard, M. et al.: Prior exposure to neurotrophins blocks inhibition of axonal regeneration by MAG and myelin via a cAMP-dependent mechanism. Neuron, 22, 89-101 (1999)[PubMed]
- Hammarlund, M., Nix, P., Hauth, L. et al.: Axon regeneration requires a conserved MAP kinase pathway. Science, 323, 802-806 (2009)[PubMed]
- Richner, M., Ulrichsen, M., Elmegaard, S. L. et al.: Peripheral nerve injury modulates neurotrophin signaling in the peripheral and central nervous system. Mol. Neurobiol., 50, 945-970 (2014)[PubMed]
- Schwab, M. E. & Strittmatter, S. M.: Nogo limits neural plasticity and recovery from injury. Curr. Opin. Neurobiol., 27C, 53-60 (2014)[PubMed]
- Harel, N. Y. & Strittmatter, S. M.: Can regenerating axons recapitulate developmental guidance during recovery from spinal cord injury? Nat. Rev. Neurosci., 7, 603-616 (2006)[PubMed]
- Moore, D. L., Blackmore, M. G., Hu. Y. et al.: KLF family members regulate intrinsic axon regeneration ability. Science, 326, 298-301 (2009)[PubMed]
- Enes, J., Langwieser, N., Ruschel, J. et al.: Electrical activity suppresses axon growth through Cav1.2 channels in adult primary sensory neurons. Curr. Biol., 20, 1154-1164 (2010)[PubMed]
- Caroni, P. & Schwab, M. E.: Antibody against myelin-associated inhibitor of neurite growth neutralizes nonpermissive substrate properties of CNS white matter. Neuron, 1, 85-96 (1988)[PubMed]
- Caroni, P. & Schwab, M. E.: Two membrane protein fractions from rat central myelin with inhibitory properties for neurite growth and fibroblast spreading. J Cell Biol., 106, 1281-1288 (1988)[PubMed]
- Chen, M. S., Huber, A. B., van der Haar, M. E. et al.: Nogo-A is a myelin-associated neurite outgrowth inhibitor and an antigen for monoclonal antibody IN-1. Nature, 403, 434-439 (2000)[PubMed]
- Snow, D. M., Lemmon, V., Carrino, D. A. et al.: Sulfated proteoglycans in astroglial barriers inhibit neurite outgrowth in vitro. Exp. Neurol., 109, 111-130 (1990)[PubMed]
- Davies, S. J., Goucher, D. R., Doller, C. et al.: Robust regeneration of adult sensory axons in degenerating white matter of the adult rat spinal cord. J. Neurosci., 19, 5810-5822 (1999)[PubMed]
- Moon, L. D., Asher, R. A., Rhodes, K. E. et al.: Regeneration of CNS axons back to their target following treatment of adult rat brain with chondroitinase ABC. Nat. Neurosci., 4, 465-466 (2001)[PubMed]
- Bradbury, E. J., Moon, L. D., Popat, R. J. et al.: Chondroitinase ABC promotes functional recovery after spinal cord injury. Nature, 416, 636-640 (2002)[PubMed]
- Zhang, H., Muramatsu, T., Murase, A. et al.: N-Acetylglucosamine 6-O-sulfotransferase-1 is required for brain keratan sulfate biosynthesis and glial scar formation after brain injury. Glycobiology, 16, 702-710 (2006)[PubMed]
- Ito, Z., Sakamoto, K., Imagama, S. et al.: N-acetylglucosamine 6-O-sulfotransferase-1-deficient mice show better functional recovery after spinal cord injury. J. Neurosci., 30, 5937-5947 (2010)[PubMed]
- Imagama, S., Sakamoto, K., Tauchi, R. et al.: Keratan sulfate restricts neural plasticity after spinal cord injury. J. Neurosci., 31, 17091-17102 (2011)[PubMed]
- Tauchi, R., Imagama, S., Natori, T. et al.: The endogenous proteoglycan-degrading enzyme ADAMTS-4 promotes functional recovery after spinal cord injury. J. Neuroinflammation, 9, 53 (2012)[PubMed]
- Kadomatsu, K. & Sakamoto, K.: Sulfated glycans in network rewiring and plasticity after neuronal injuries. Neurosci. Res., 78, 50-54 (2014)[PubMed]
- Erez, H., Malkinson, G., Prager-Khoutorsky, M. et al.: Formation of microtubule-based traps controls the sorting and concentration of vesicles to restricted sites of regenerating neurons after axotomy. J. Cell Biol., 176, 497-507 (2007)[PubMed]
- Erturk, A., Hellal, F., Enes, J. et al.: Disorganized microtubules underlie the formation of retraction bulbs and the failure of axonal regeneration. J. Neurosci., 27, 9169-9180 (2007)[PubMed]
- Shen, Y., Tenney, A. P., Busch, S. A. et al.: PTPσ is a receptor for chondroitin sulfate proteoglycan, an inhibitor of neural regeneration. Science, 326, 592-596 (2009)[PubMed]
- Coles, C. H., Shen, Y., Tenney, A. P. et al.: Proteoglycan-specific molecular switch for RPTPσ clustering and neuronal extension. Science, 332, 484-488 (2011)[PubMed]
- Fisher, D., Xing, B., Dill, J. et al.: Leukocyte common antigen-related phosphatase is a functional receptor for chondroitin sulfate proteoglycan axon growth inhibitors. Neurosci., 31, 14051-14066 (2011)[PubMed]
- Dickendesher, T. L., Baldwin, K. T., Mironova, Y. A. et al.: NgR1 and NgR3 are receptors for chondroitin sulfate proteoglycans. Nat. Neurosci., 15, 703-712 (2012)[PubMed]
- Mikami, T., Yasunaga, D. & Kitagawa, H.: Contactin-1 is a functional receptor for neuroregulatory chondroitin sulfate-E. J. Biol. Chem., 284, 4494-4499 (2009)[PubMed]
- Pizzorusso, T., Medini, P., Berardi, N. et al.: Reactivation of ocular dominance plasticity in the adult visual cortex. Science, 298, 1248-1251 (2002)[PubMed]
- Gogolla, N., Caroni, P., Luthi, A. et al.: Perineuronal nets protect fear memories from erasure. Science, 325, 1258-1261 (2009)[PubMed]
- Miyata, S., Komatsu, Y., Yoshimura, Y. et al.: Persistent cortical plasticity by upregulation of chondroitin 6-sulfation. Nat. Neurosci., 15, 414-422 (2012)[PubMed] [新着論文レビュー]
- Frischknecht, R., Heine, M., Perrais, D. et al.: Brain extracellular matrix affects AMPA receptor lateral mobility and short-term synaptic plasticity. Nat. Neurosci., 12, 897-904 (2009)[PubMed]
- Orlando, C., Ster, J., Gerber, U. et al.: Perisynaptic chondroitin sulfate proteoglycans restrict structural plasticity in an integrin-dependent manner. J. Neurosci., 32, 18009-18017 (2012)[PubMed]
- Garcia-Alias, G., Barkhuysen, S., Buckle, M. et al.: Chondroitinase ABC treatment opens a window of opportunity for task-specific rehabilitation. Nat. Neurosci., 12, 1145-1151 (2009)[PubMed]
著者プロフィール
略歴:1988年 九州大学大学院医学研究科 修了,同年 鹿児島大学医学部 助手,1994年 名古屋大学医学部 講師,1996年 同 助教授を経て,2004年より名古屋大学大学院医学系研究科 教授.
研究テーマ:硫酸化糖鎖による軸索再生の制御機構.神経芽腫の発生と自然退縮の機構.
関心事:目下の最大の関心事は,ケラタン硫酸受容体とdystrophic endballの形成とのかかわり.もうひとつは,神経芽腫の極初期の解析を介して,このがんの発生機構を解くこと.細胞分裂をおえた神経と,細胞分裂を無限につづけるがんとを扱うこれら2つのプロジェクトは,いっけん別物にみえるが底流ではつながり,互いに教えてくれるものが多い.
研究室URL:http://www.med.nagoya-u.ac.jp/biochem/
© 2014 門松 健治 Licensed under CC 表示 2.1 日本