神経管および体節中胚葉に分化する体軸幹細胞の制御
2014/07/09
竹本 龍也
(徳島大学藤井節郎記念医科学センター 初期発生研究分野)
email:竹本龍也
領域融合レビュー, 3, e007 (2014) DOI: 10.7875/leading.author.3.e007
Tatsuya Takemoto: Regulation of the axial stem cells deriving neural tube and paraxial mesoderm.

脊椎動物を構成する多様な細胞は,発生の初期に多能性をもつ細胞の集団であるエピブラストを出発点として分化する.教科書の記述によれば,この時期の胚はまず外胚葉,中胚葉,内胚葉に分離し,それにより細胞の運命がせばめられるとされてきた.そして,神経管は外胚葉から表皮と分離することにより分化すると考えられてきた.しかしながら,最近の研究により,体幹部の神経管は体節中胚葉との共通の前駆体細胞である体軸幹細胞から分化することが示された.この新しい細胞運命の分岐点である体軸幹細胞が,神経管の細胞に分化するか体節中胚葉の細胞に分化するかは,2つの転写因子,Sox2およびTbx6により制御されていた.Tbx6は体節中胚葉となる細胞においてSox2遺伝子の発現を抑制することにより神経管の発生を抑制する.体軸幹細胞はSox2およびTbx6に依存して2つの体細胞系列に分化しつつ,Wnt-Brachyuryシグナル伝達経路に依存した制御をうけて維持されることにより,体幹部の組織を段階的に形成している.
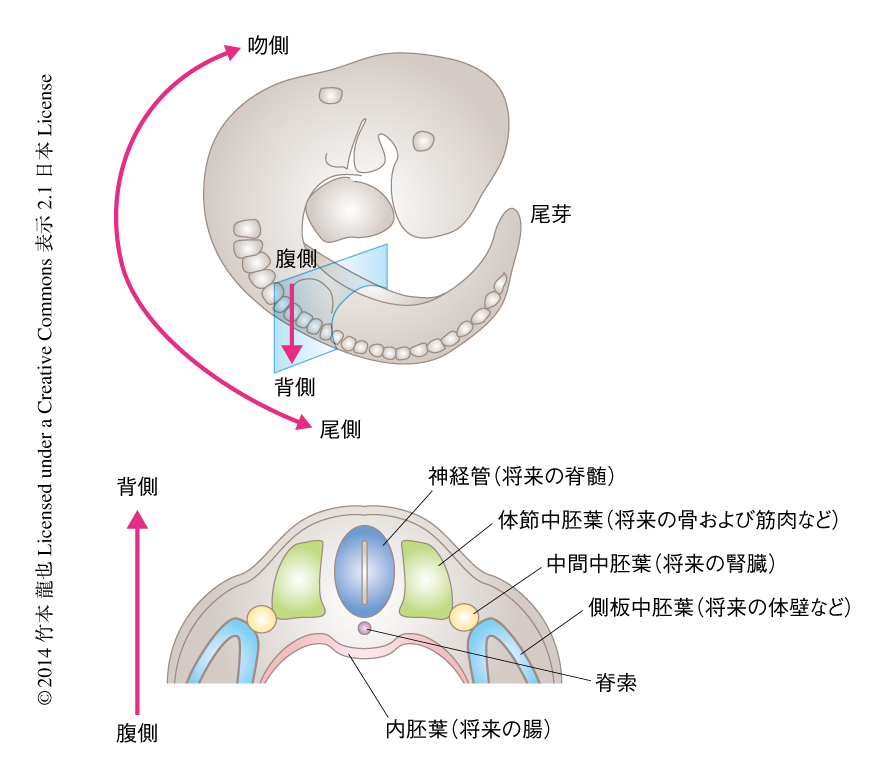
脊椎動物の初期の発生において最初に形成されるのが頭部の組織である.そののち,体幹部の組織が発生の進行とともに頸部から尾部にむかい段階的に形成される.マウスの胚においては,妊娠7~8日目において頭部の組織が形成され,つづいて,体幹部(および,尾部)の組織が約5日(妊娠8~13日目)をかけて形成される.この時期の胚では,神経管を中心として側方に体節中胚葉,中間中胚葉,側板中胚葉が形成される.また,神経管の腹側には脊索および内胚葉が形成される(図1).こういった体幹部および尾部の段階的な形成は脊椎動物をつうじ保存されている.ニワトリの胚においては,孵卵18~22時間の時期に頭部が形成され,体幹部や尾部は,頭部が形成されたのち,約6日をかけて段階的に形成される.このように,体幹部の組織が頸部から尾部にかけて段階的に付加されながら形成される過程を体軸伸長とよぶ.体軸伸長において,体幹部や尾部の組織は原腸陥入の場である原条とその周辺のエピブラスト(胚盤葉上層)あるいは尾芽から供給される細胞により形成される.
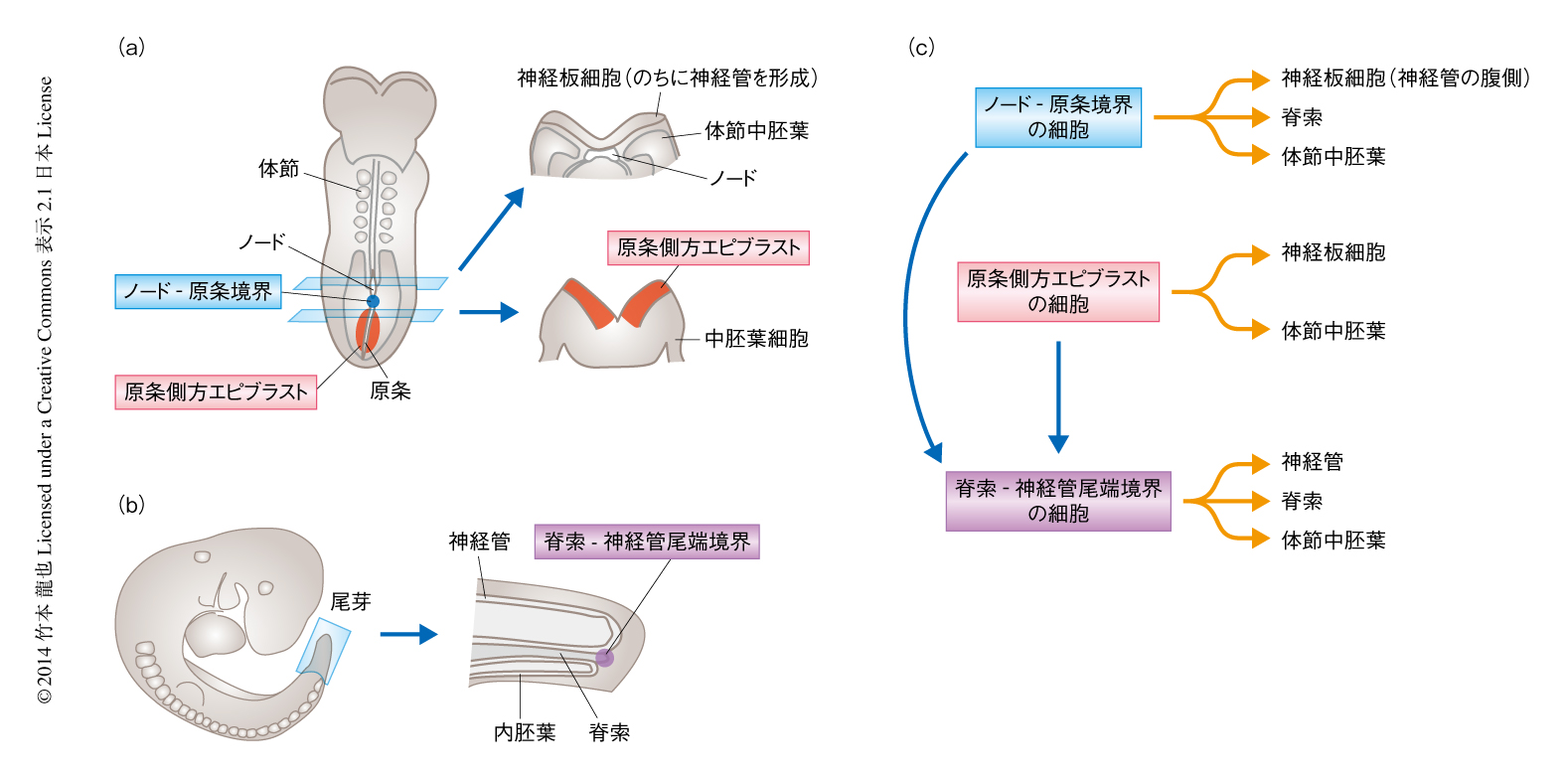
それでは,原条の周辺の領域にはどういった細胞が存在するのだろうか? 原条の周辺の領域をいくつかの区画に分割し,それぞれの区画にいる細胞がどの体細胞系列へと寄与したかが解析された1,2).原条の前方端であるノードの細胞は神経管の腹側,脊索,腸管の背側へと寄与し,原条の細胞は体節および側板中胚葉へと分化した.一方で,神経管へと寄与する細胞の多くは原条の前側の側方にあるエピブラスト(マウスでは原条の前側4/5の側方,ニワトリでは原条の前半1/2の側方)に存在していた.この領域には,体節中胚葉へと寄与する細胞も含まれていた.この神経管になる細胞および体節中胚葉になる細胞が存在するエピブラストは原条側方エピブラスト(caudal lateral epiblast)とよばれる2)(図2).神経管へと寄与する細胞はノードと原条との境目であるノード-原条境界(node-streak border)にも存在しており,この領域の細胞も体節中胚葉へと寄与することが示されている.原条側方エピブラストおよびノード-原条境界の細胞は,のちに形成される脊索-神経管尾端境界(chordoneural hinge)にも寄与して,より尾側の神経管および体節中胚葉に細胞を供給する(図2).
こういった細胞運命地図の結果から,原条側方エピブラスト,ノード-原条境界,脊索-神経管尾端境界には,体幹部の複数の体細胞系列に寄与できる幹細胞が存在し,体軸の伸長にともない体細胞系列を供給している可能性が示唆された1,2).この仮説は,尾部組織に分化する脊索-神経管尾端境界の細胞を,体軸伸長が開始する妊娠8日目の胚のノード-原条境界に移植して,その分化能を解析した研究からも支持された.ノード-原条境界に移植された脊索-神経管尾端境界の細胞は,本来,脊索-神経管尾端境界の細胞の分化する尾部の細胞のみならず,発生のより初期に分化する胸部の神経管や体節中胚葉の細胞にも分化した.また,この胚が妊娠12日目の胚へと発生したのち,再度,脊索-神経管尾端境界の細胞を取り出し別の妊娠8日目の胚のノード-原条境界に移植すると,その細胞はふたたび胸部や腰部の組織へと寄与した.同様の研究はニワトリ胚でも行われている.体幹部の組織の形成が開始するステージ6において,原条の周辺のエピブラストの少数の細胞を標識し,標識された細胞が胚のどの領域の組織へと寄与するのかが解析された3).標識された細胞の一部は単一の体細胞系列へと寄与したが,一部は神経管と体節中胚葉といった複数の体細胞系列へと寄与した.また,ニワトリの胚において,ステージ15(すでに尾部の途中までの形成は完了している)の脊索-神経管尾端境界の細胞をステージ8(胸部を形成している時期)の胚に移植すると,マウスの胚で行われた研究と同様に,より吻側の組織である胸部の組織へと寄与した4).こういった細胞運命地図や細胞移植の研究から,原条側方エピブラスト,ノード-原条境界,脊索-神経管尾端境界には,体幹部の組織の複数の体細胞系列へと寄与できる幹細胞の存在する可能性が示された.また,尾側の組織に分化する脊索-神経管尾端境界の細胞であっても,胸部や腰部の体幹部の組織に分化する能力を維持していることが示された.しかしながら,これらの研究は,少数ではあるが複数の細胞の標識あるいは移植の結果であったことから,複数の体細胞系列に寄与できる幹細胞が存在するのか,あるいは,それぞれの体細胞の前駆体細胞が個別に存在するのかを明確に区別することはできなかった.
2009年,胚の1細胞を標識してその細胞運命を記述する研究が行われた5).この研究では,不活性型のLacZ遺伝子を胚のすべての細胞で発現するトランスジェニックマウスが用いられた.この不活性型LacZ遺伝子は発現しても活性をもたないが,その内部にある重複領域が相同組換えにより除かれることで発現したLacZが活性をもつように,また,この相同組換えの頻度は胚あたり1つ以下の細胞で起こるように設計されていた.したがって,胚においてLacZ陽性細胞として染色された細胞は,それ以前の発生の段階で相同組換えを起こした1細胞に由来することになる.LacZ陽性細胞の数から相同組換えの起こった発生の時期(つまり,標識された時期)を推定することができる.この研究から,妊娠8~10日目に標識された1細胞に由来する細胞が神経管および中胚葉の両方に寄与し,また,体軸の伸長端である尾芽にも寄与することが明らかになった.この研究により,妊娠8~10日目の胚に,神経管および中胚葉の両方に寄与する共通の前駆体細胞である体軸幹細胞の存在が示された.
しかしながら,この研究では胚のどの領域の1細胞が最初に標識されたのかを知ることはできず,神経管および中胚葉に寄与する共通の前駆体細胞の分布は不明のままであった.また,この共通の前駆体細胞がどういった制御により神経管あるいは中胚葉に分化するのかも不明であった.
筆者らは,神経板において特異的に発現するSox2遺伝子の発現の制御機構を出発点として,体幹部の神経板が体節中胚葉と分離されることにより分化することを明らかにした6,7).神経板におけるSox2遺伝子の発現は,胚の領域あるいは発生の段階に応じて異なるエンハンサーにより担われている8).このうち,N1エンハンサーおよびN2エンハンサーは,それぞれ,体幹部および頭部におけるSox2遺伝子の発現の開始に関与する.それぞれの発現の制御機構はまったく異なることから,体幹部と頭部とでは神経板の発生のしくみが異なることが示唆された9,10).
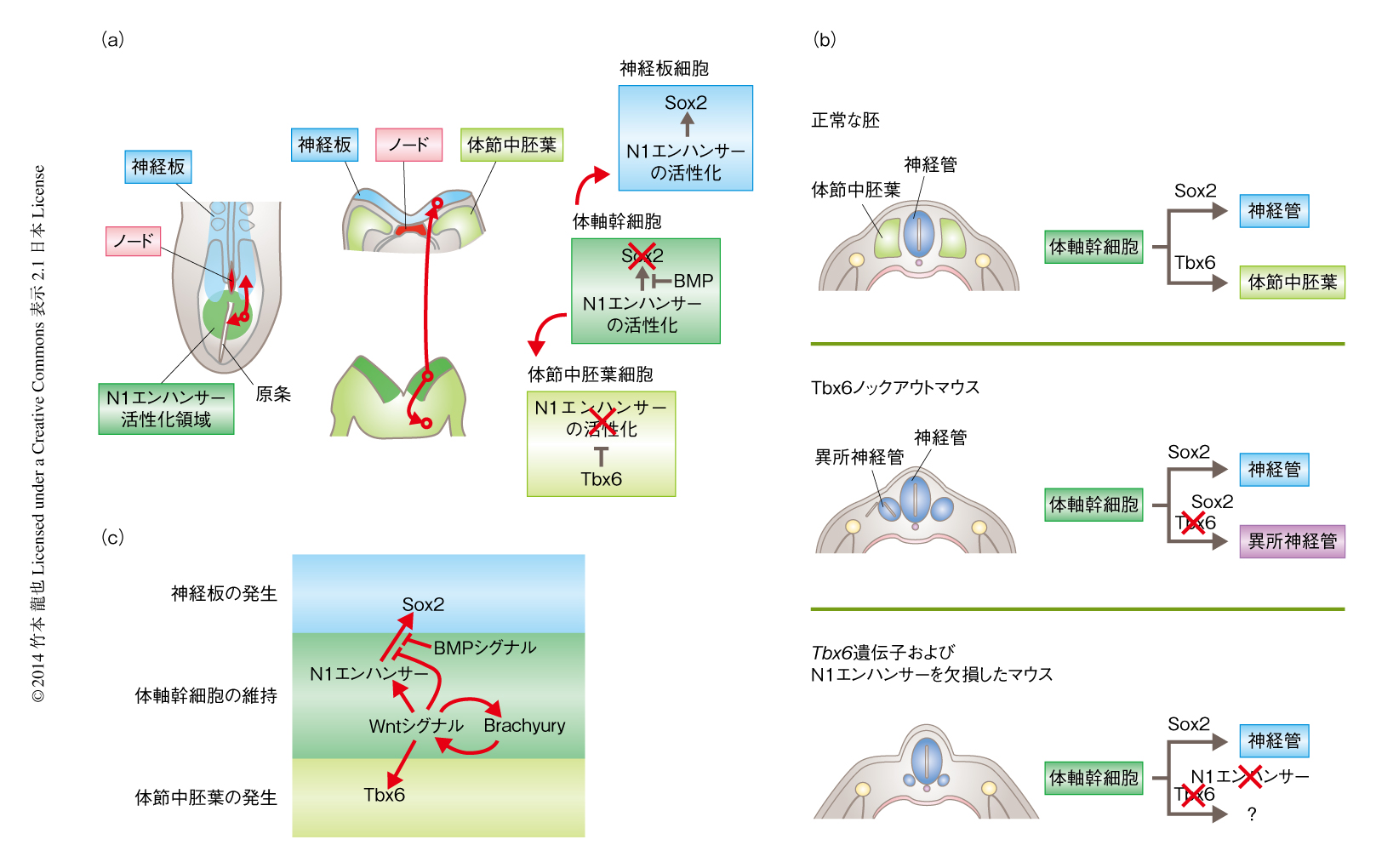
Sox2遺伝子のN1エンハンサーは原条とその周辺のエピブラストにおいて活性化され,発生の進行にともない原条の周辺の領域から離れた細胞では活性が消失する.この活性化の領域は,神経管に分化する細胞と体節中胚葉に分化する細胞とが存在する原条側方エピブラストとほぼ一致する.予想どおり,N1エンハンサーが活性化された細胞は神経板のみならず,原条を通過して中胚葉の領域へと陥入して体節中胚葉へと分化した.中胚葉領域へと移動した細胞ではN1エンハンサーが不活性化される(図3a).それでは,Sox2遺伝子のN1エンハンサーを活性化していた中胚葉に分化する細胞は,神経板の細胞になりうるのだろうか? その答えは,それよりも以前,1998年に発表された論文にあった.
1998年,Tbx6ノックアウトマウスが作製されその表現型が報告された11).Tbx6遺伝子はTボックス型の転写因子をコードし,原条を通過した細胞において発現が開始し,そののちも中胚葉において発現が維持される12).原条の領域において表層側でのみ活性化されるSox2遺伝子のN1エンハンサーとは排他的に発現している.Tbx6ノックアウトマウスの胚は妊娠9日目において顕著な表現型が観察された.正常な胚では胚の正中線上に神経管が形成され,その両側に骨や筋肉へと分化する体節中胚葉が形成されるが,Tbx6ノックアウトマウスの胚では体節中胚葉が形成されず,代わりにその場所に異所的な神経管が形成された(図3b).このことは,転写因子Tbx6が体節中胚葉となる細胞において神経管への分化を抑制していることを示唆していた.しかしながら,当時はそれ以上の解析はなされなかった.
筆者らは,Tbx6の役割を明らかにすることにより,神経板と体節中胚葉とが共通する前駆体細胞から分化することを示し,また,その分化のしくみを解明できると考えた7,13).Tbx6ノックアウトマウスの胚では中胚葉の領域へ陥入したのちの細胞においてもSox2遺伝子のN1エンハンサーが不活性化されず,ひきつづき活性化状態が維持された.その結果,体節中胚葉となる細胞においてSox2遺伝子が異所的に活性化された.そして,異所的にSox2遺伝子を発現した細胞は,本来なら体節中胚葉の形成される領域に神経管を形成した.Tbx6ノックアウトマウスの胚においてゲノムからN1エンハンサーを除くと,中胚葉となる細胞におけるSox2遺伝子の異所性の発現が消失し,さらに,神経管が中胚葉の領域において異所的に形成されなくなった(図3b).この研究から,Tbx6はN1エンハンサーを不活性化してSox2遺伝子の発現を抑制することにより,神経管の形成を抑制していることが示された(図3a).そして,N1エンハンサーの活性化により標識される原条の周辺の領域の細胞が,神経板にも体節中胚葉にもなりうる共通の前駆体細胞である体軸幹細胞であることが示された.
筆者らのノックアウトマウスを用いた研究は,それだけで体軸幹細胞の存在を強く証明するものではない.しかしながら,さきに紹介した1細胞の細胞系譜の解析の結果とあわせて考えると,原条の周辺の領域に神経管と中胚葉との共通の前駆体細胞である体軸幹細胞の存在することは明らかであろう13,14).
体軸幹細胞は神経板と中胚葉の2つの体細胞系列に分化する能力を維持しながら,神経板あるいは中胚葉に分化する細胞を産出することにより体幹部を形成している.この過程において,神経板への分化はSox2,中胚葉への分化はTbx6という2つの転写因子によりそれぞれ担われていることが明らかになった.それでは,体軸幹細胞が幹細胞として維持されるしくみはどうなっているのだろうか?
体軸幹細胞を含む原条の周辺の領域ではSox2遺伝子のN1エンハンサーが活性化されているが,その大部分の細胞ではSox2遺伝子は発現していない.そして,そのうち一部の細胞は原腸陥入とともにN1エンハンサーを不活性化して体節中胚葉の細胞へと分化する.なぜ,原条の周辺の細胞はSox2遺伝子を発現しないのであろうか? それは,この領域ではBMPシグナルの作用によりSox2遺伝子の発現が抑制されているからである6,7)(図3a).そして,ノードではBMPシグナルの阻害タンパク質であるChordinあるいはNogginが発現しており,その周辺の細胞ではBMPシグナルによる抑制が解除されている.BMPシグナルから解放された細胞はSox2遺伝子を発現して神経板へと分化する(図3a).強制発現により原条の領域でのBMPシグナルを抑制すると,Sox2遺伝子の発現する領域は本来の発現領域よりも尾側に拡大して,N1エンハンサーが活性化されている領域と一致した6,7).また,この胚はより尾側の組織を形成しなくなった.おそらく,体軸幹細胞がすべて神経板の細胞へと分化してしまったからであろう.以上のことから,BMPシグナルはSox2遺伝子の発現を抑制することにより体軸幹細胞の維持に関与していると考えられる.
また,これまでに報告されている遺伝子変異マウスの表現型から,Wntシグナルが転写因子Brachyuryとともに体軸幹細胞の維持に関与していることが示唆されている13,14)(図3c).原条において発現しているWnt3aおよびBrachyuryは互いの発現を活性化していることが知られている15).Wnt3aノックアウトマウスおよびBrachyuryノックアウトマウスの胚においては,原条の周辺の領域においてSox2遺伝子の異所的な発現とTbx6遺伝子の発現の消失が観察され,前肢より尾側の体幹部が形成されなくなる16-18).これらの観察から,Wnt-Brachyuryシグナル伝達経路の不活性化により体軸幹細胞が維持されず,すべて神経板の細胞へと分化して枯渇してしまったと考えられる.また,Wnt3a遺伝子およびBrachyury遺伝子の発現は妊娠13日目に消失するが,これは尾部の形成(伸長)が終了するタイミングとも一致している.Wnt3aの発現の消失と体幹部の形成の終了との関係は,Wnt3a遺伝子の発現の低下したマウスの研究からも示されている19).Wnt3a遺伝子の発現の低下したvtマウスのホモ変異胚では尾部の形成が途中で停止して短尾なマウスが産まれる.また,vtマウスとWnt3aノックアウトマウスとの二重ヘテロマウスの胚では後肢より尾側の組織がいっさい形成されない.こういった観察から,Wntシグナルがあるレベルを下まわると体軸幹細胞が枯渇して体幹部の形成が予定よりも早く停止してしまう.
Wnt3aノックアウトマウスの胚の表現型から,WntシグナルはSox2遺伝子の発現を抑制することによる体軸幹細胞の維持とTbx6の発現を介した中胚葉への分化を制御していると考えられる.しかしながら,WntシグナルはSox2遺伝子のN1エンハンサーを活性化するシグナルのひとつである6)(図3c).したがって,Wntシグナルは複雑な制御により,体軸幹細胞の維持と2つの体細胞系列への分化とのいずれをも制御していると考えられる.現在のところ,Wntシグナルがどのようにして体軸幹細胞の維持と分化の制御を使い分けているのかはまったくわかっていない.また,体軸幹細胞を維持していると考えられるWntシグナルとBMPシグナルとがどのような関係にあるのかも不明であり,今後の研究課題である.
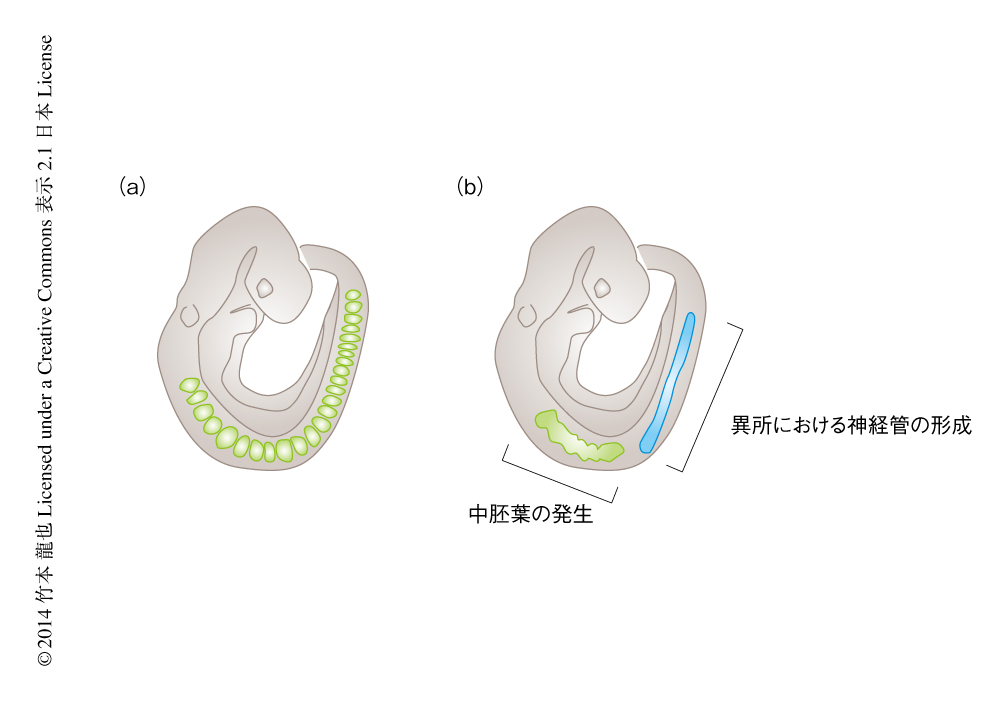
体軸幹細胞から形成されるのは,頭尾軸のすべての神経板あるいは体節中胚葉ではない.このことは,体軸幹細胞の制御にかかわる遺伝子の変異マウスの胚の表現型からも示唆される.Tbx6ノックアウトマウスの胚では,体節中胚葉となる領域に異所的に神経管が形成されるが,この表現型がみられるのは第7体節より尾側のみである.より吻側では不完全ながらも約6つの体節が形成され,筋のマーカー遺伝子であるMyoD遺伝子やMyf5遺伝子なども発現する7,11)(図4).Wnt3a遺伝子あるいはBrachyury遺伝子に変異をもつマウスの胚において体幹部が形成されなくなることはすでに述べたが,これらの変異マウスの胚においても第6体節までの神経板や中胚葉の組織は正常に形成される.したがって,神経板に分化するか体節中胚葉に分化するかという細胞運命の分岐は第7体節より尾側でのみ起こり,より吻側の体節中胚葉(将来の頭頸部)はまったく異なる制御により形成されると考えられる(図4).
体節中胚葉の発生のしくみが頭頸部と体幹部とで異なることは,それぞれの体節中胚葉が由来する胚の細胞の状態を反映している可能性がある.近年,エピブラストに対応した培養細胞であるエピブラスト幹細胞が着床ののちの胚から樹立された.このエピブラスト幹細胞は妊娠8日目よりもまえの胚からは樹立できるが,それ以降の胚からは樹立できない20).また,樹立されたエピブラスト幹細胞は,妊娠8日目よりまえの胚に移植するとさまざまな体細胞系列へと寄与するが,妊娠8日目よりあとの胚に移植しても体細胞へは分化しない20).発生の初期にまず頭頸部が分化し,つづいて体幹部が分化することを考えると,おそらく第6体節(頭頸部)までの体節中胚葉はエピブラストから直接に分化し,それより尾側の体節中胚葉は体軸幹細胞に由来するであろう.
体幹部には体軸幹細胞から分化する神経板および体節中胚葉のほかに,側板中胚葉,中間中胚葉,中軸中胚葉,内胚葉の細胞が分化する(図1).これらの組織に寄与する体細胞系列が,どういった細胞から,どういった細胞と分離されて分化するのかはまったくわかっていない.マウスの胚を用いた移植実験では,ノード-原条境界の細胞が神経板腹側,脊索,体節中胚葉へと寄与することが示されていることから,異なるセットの体細胞に分化する幹細胞が存在する可能性がある.
高校の生物の教科書には,“原腸胚で生じた3種類の胚葉からいろいろな組織が形成される”と記されている.そして,“外胚葉からは神経管と表皮が分化し,中胚葉からは骨や筋肉(体節中胚葉)が分化する”と書かれている.しかしながら,このレビューにおいて紹介した一連の研究により,体幹部の神経管および体節中胚葉は共通の前駆体細胞である体軸幹細胞から分化することが明らかになった.これらの研究成果は,けっして三胚葉そのものを否定するものではない.分化した組織はその位置に応じていずれかの胚葉に分類される.つまり,三胚葉とはあくまで組織の解剖学的な位置の記述であって,細胞運命の分岐ではない.体軸幹細胞という新しい細胞運命の分岐点の発見が,同じ時期に分化する多様な組織の起源を再考するきっかけになることが期待される.
略歴:2005年 大阪大学大学院理学研究科 修了,同年 大阪大学大学院生命機能研究科 特任助手を経て,2013年より徳島大学藤井節郎記念医科学センター 特任助教.
研究テーマ:脊椎動物の原腸陥入の時期における細胞運命の決定のしくみ.
研究室URL:http://www.tokushima-u.ac.jp/fujii/research/embryology/
© 2014 竹本 龍也 Licensed under CC 表示 2.1 日本
(徳島大学藤井節郎記念医科学センター 初期発生研究分野)
email:竹本龍也
領域融合レビュー, 3, e007 (2014) DOI: 10.7875/leading.author.3.e007
Tatsuya Takemoto: Regulation of the axial stem cells deriving neural tube and paraxial mesoderm.
要 約
脊椎動物を構成する多様な細胞は,発生の初期に多能性をもつ細胞の集団であるエピブラストを出発点として分化する.教科書の記述によれば,この時期の胚はまず外胚葉,中胚葉,内胚葉に分離し,それにより細胞の運命がせばめられるとされてきた.そして,神経管は外胚葉から表皮と分離することにより分化すると考えられてきた.しかしながら,最近の研究により,体幹部の神経管は体節中胚葉との共通の前駆体細胞である体軸幹細胞から分化することが示された.この新しい細胞運命の分岐点である体軸幹細胞が,神経管の細胞に分化するか体節中胚葉の細胞に分化するかは,2つの転写因子,Sox2およびTbx6により制御されていた.Tbx6は体節中胚葉となる細胞においてSox2遺伝子の発現を抑制することにより神経管の発生を抑制する.体軸幹細胞はSox2およびTbx6に依存して2つの体細胞系列に分化しつつ,Wnt-Brachyuryシグナル伝達経路に依存した制御をうけて維持されることにより,体幹部の組織を段階的に形成している.
はじめに
脊椎動物の初期の発生において最初に形成されるのが頭部の組織である.そののち,体幹部の組織が発生の進行とともに頸部から尾部にむかい段階的に形成される.マウスの胚においては,妊娠7~8日目において頭部の組織が形成され,つづいて,体幹部(および,尾部)の組織が約5日(妊娠8~13日目)をかけて形成される.この時期の胚では,神経管を中心として側方に体節中胚葉,中間中胚葉,側板中胚葉が形成される.また,神経管の腹側には脊索および内胚葉が形成される(図1).こういった体幹部および尾部の段階的な形成は脊椎動物をつうじ保存されている.ニワトリの胚においては,孵卵18~22時間の時期に頭部が形成され,体幹部や尾部は,頭部が形成されたのち,約6日をかけて段階的に形成される.このように,体幹部の組織が頸部から尾部にかけて段階的に付加されながら形成される過程を体軸伸長とよぶ.体軸伸長において,体幹部や尾部の組織は原腸陥入の場である原条とその周辺のエピブラスト(胚盤葉上層)あるいは尾芽から供給される細胞により形成される.
1.細胞系譜の研究から明らかになった神経管および体節中胚葉に分化する体軸幹細胞
それでは,原条の周辺の領域にはどういった細胞が存在するのだろうか? 原条の周辺の領域をいくつかの区画に分割し,それぞれの区画にいる細胞がどの体細胞系列へと寄与したかが解析された1,2).原条の前方端であるノードの細胞は神経管の腹側,脊索,腸管の背側へと寄与し,原条の細胞は体節および側板中胚葉へと分化した.一方で,神経管へと寄与する細胞の多くは原条の前側の側方にあるエピブラスト(マウスでは原条の前側4/5の側方,ニワトリでは原条の前半1/2の側方)に存在していた.この領域には,体節中胚葉へと寄与する細胞も含まれていた.この神経管になる細胞および体節中胚葉になる細胞が存在するエピブラストは原条側方エピブラスト(caudal lateral epiblast)とよばれる2)(図2).神経管へと寄与する細胞はノードと原条との境目であるノード-原条境界(node-streak border)にも存在しており,この領域の細胞も体節中胚葉へと寄与することが示されている.原条側方エピブラストおよびノード-原条境界の細胞は,のちに形成される脊索-神経管尾端境界(chordoneural hinge)にも寄与して,より尾側の神経管および体節中胚葉に細胞を供給する(図2).
こういった細胞運命地図の結果から,原条側方エピブラスト,ノード-原条境界,脊索-神経管尾端境界には,体幹部の複数の体細胞系列に寄与できる幹細胞が存在し,体軸の伸長にともない体細胞系列を供給している可能性が示唆された1,2).この仮説は,尾部組織に分化する脊索-神経管尾端境界の細胞を,体軸伸長が開始する妊娠8日目の胚のノード-原条境界に移植して,その分化能を解析した研究からも支持された.ノード-原条境界に移植された脊索-神経管尾端境界の細胞は,本来,脊索-神経管尾端境界の細胞の分化する尾部の細胞のみならず,発生のより初期に分化する胸部の神経管や体節中胚葉の細胞にも分化した.また,この胚が妊娠12日目の胚へと発生したのち,再度,脊索-神経管尾端境界の細胞を取り出し別の妊娠8日目の胚のノード-原条境界に移植すると,その細胞はふたたび胸部や腰部の組織へと寄与した.同様の研究はニワトリ胚でも行われている.体幹部の組織の形成が開始するステージ6において,原条の周辺のエピブラストの少数の細胞を標識し,標識された細胞が胚のどの領域の組織へと寄与するのかが解析された3).標識された細胞の一部は単一の体細胞系列へと寄与したが,一部は神経管と体節中胚葉といった複数の体細胞系列へと寄与した.また,ニワトリの胚において,ステージ15(すでに尾部の途中までの形成は完了している)の脊索-神経管尾端境界の細胞をステージ8(胸部を形成している時期)の胚に移植すると,マウスの胚で行われた研究と同様に,より吻側の組織である胸部の組織へと寄与した4).こういった細胞運命地図や細胞移植の研究から,原条側方エピブラスト,ノード-原条境界,脊索-神経管尾端境界には,体幹部の組織の複数の体細胞系列へと寄与できる幹細胞の存在する可能性が示された.また,尾側の組織に分化する脊索-神経管尾端境界の細胞であっても,胸部や腰部の体幹部の組織に分化する能力を維持していることが示された.しかしながら,これらの研究は,少数ではあるが複数の細胞の標識あるいは移植の結果であったことから,複数の体細胞系列に寄与できる幹細胞が存在するのか,あるいは,それぞれの体細胞の前駆体細胞が個別に存在するのかを明確に区別することはできなかった.
2009年,胚の1細胞を標識してその細胞運命を記述する研究が行われた5).この研究では,不活性型のLacZ遺伝子を胚のすべての細胞で発現するトランスジェニックマウスが用いられた.この不活性型LacZ遺伝子は発現しても活性をもたないが,その内部にある重複領域が相同組換えにより除かれることで発現したLacZが活性をもつように,また,この相同組換えの頻度は胚あたり1つ以下の細胞で起こるように設計されていた.したがって,胚においてLacZ陽性細胞として染色された細胞は,それ以前の発生の段階で相同組換えを起こした1細胞に由来することになる.LacZ陽性細胞の数から相同組換えの起こった発生の時期(つまり,標識された時期)を推定することができる.この研究から,妊娠8~10日目に標識された1細胞に由来する細胞が神経管および中胚葉の両方に寄与し,また,体軸の伸長端である尾芽にも寄与することが明らかになった.この研究により,妊娠8~10日目の胚に,神経管および中胚葉の両方に寄与する共通の前駆体細胞である体軸幹細胞の存在が示された.
しかしながら,この研究では胚のどの領域の1細胞が最初に標識されたのかを知ることはできず,神経管および中胚葉に寄与する共通の前駆体細胞の分布は不明のままであった.また,この共通の前駆体細胞がどういった制御により神経管あるいは中胚葉に分化するのかも不明であった.
2.体軸幹細胞からの神経管あるいは中胚葉への分化を制御するしくみ
筆者らは,神経板において特異的に発現するSox2遺伝子の発現の制御機構を出発点として,体幹部の神経板が体節中胚葉と分離されることにより分化することを明らかにした6,7).神経板におけるSox2遺伝子の発現は,胚の領域あるいは発生の段階に応じて異なるエンハンサーにより担われている8).このうち,N1エンハンサーおよびN2エンハンサーは,それぞれ,体幹部および頭部におけるSox2遺伝子の発現の開始に関与する.それぞれの発現の制御機構はまったく異なることから,体幹部と頭部とでは神経板の発生のしくみが異なることが示唆された9,10).
Sox2遺伝子のN1エンハンサーは原条とその周辺のエピブラストにおいて活性化され,発生の進行にともない原条の周辺の領域から離れた細胞では活性が消失する.この活性化の領域は,神経管に分化する細胞と体節中胚葉に分化する細胞とが存在する原条側方エピブラストとほぼ一致する.予想どおり,N1エンハンサーが活性化された細胞は神経板のみならず,原条を通過して中胚葉の領域へと陥入して体節中胚葉へと分化した.中胚葉領域へと移動した細胞ではN1エンハンサーが不活性化される(図3a).それでは,Sox2遺伝子のN1エンハンサーを活性化していた中胚葉に分化する細胞は,神経板の細胞になりうるのだろうか? その答えは,それよりも以前,1998年に発表された論文にあった.
1998年,Tbx6ノックアウトマウスが作製されその表現型が報告された11).Tbx6遺伝子はTボックス型の転写因子をコードし,原条を通過した細胞において発現が開始し,そののちも中胚葉において発現が維持される12).原条の領域において表層側でのみ活性化されるSox2遺伝子のN1エンハンサーとは排他的に発現している.Tbx6ノックアウトマウスの胚は妊娠9日目において顕著な表現型が観察された.正常な胚では胚の正中線上に神経管が形成され,その両側に骨や筋肉へと分化する体節中胚葉が形成されるが,Tbx6ノックアウトマウスの胚では体節中胚葉が形成されず,代わりにその場所に異所的な神経管が形成された(図3b).このことは,転写因子Tbx6が体節中胚葉となる細胞において神経管への分化を抑制していることを示唆していた.しかしながら,当時はそれ以上の解析はなされなかった.
筆者らは,Tbx6の役割を明らかにすることにより,神経板と体節中胚葉とが共通する前駆体細胞から分化することを示し,また,その分化のしくみを解明できると考えた7,13).Tbx6ノックアウトマウスの胚では中胚葉の領域へ陥入したのちの細胞においてもSox2遺伝子のN1エンハンサーが不活性化されず,ひきつづき活性化状態が維持された.その結果,体節中胚葉となる細胞においてSox2遺伝子が異所的に活性化された.そして,異所的にSox2遺伝子を発現した細胞は,本来なら体節中胚葉の形成される領域に神経管を形成した.Tbx6ノックアウトマウスの胚においてゲノムからN1エンハンサーを除くと,中胚葉となる細胞におけるSox2遺伝子の異所性の発現が消失し,さらに,神経管が中胚葉の領域において異所的に形成されなくなった(図3b).この研究から,Tbx6はN1エンハンサーを不活性化してSox2遺伝子の発現を抑制することにより,神経管の形成を抑制していることが示された(図3a).そして,N1エンハンサーの活性化により標識される原条の周辺の領域の細胞が,神経板にも体節中胚葉にもなりうる共通の前駆体細胞である体軸幹細胞であることが示された.
筆者らのノックアウトマウスを用いた研究は,それだけで体軸幹細胞の存在を強く証明するものではない.しかしながら,さきに紹介した1細胞の細胞系譜の解析の結果とあわせて考えると,原条の周辺の領域に神経管と中胚葉との共通の前駆体細胞である体軸幹細胞の存在することは明らかであろう13,14).
3.体軸幹細胞を維持するしくみ
体軸幹細胞は神経板と中胚葉の2つの体細胞系列に分化する能力を維持しながら,神経板あるいは中胚葉に分化する細胞を産出することにより体幹部を形成している.この過程において,神経板への分化はSox2,中胚葉への分化はTbx6という2つの転写因子によりそれぞれ担われていることが明らかになった.それでは,体軸幹細胞が幹細胞として維持されるしくみはどうなっているのだろうか?
体軸幹細胞を含む原条の周辺の領域ではSox2遺伝子のN1エンハンサーが活性化されているが,その大部分の細胞ではSox2遺伝子は発現していない.そして,そのうち一部の細胞は原腸陥入とともにN1エンハンサーを不活性化して体節中胚葉の細胞へと分化する.なぜ,原条の周辺の細胞はSox2遺伝子を発現しないのであろうか? それは,この領域ではBMPシグナルの作用によりSox2遺伝子の発現が抑制されているからである6,7)(図3a).そして,ノードではBMPシグナルの阻害タンパク質であるChordinあるいはNogginが発現しており,その周辺の細胞ではBMPシグナルによる抑制が解除されている.BMPシグナルから解放された細胞はSox2遺伝子を発現して神経板へと分化する(図3a).強制発現により原条の領域でのBMPシグナルを抑制すると,Sox2遺伝子の発現する領域は本来の発現領域よりも尾側に拡大して,N1エンハンサーが活性化されている領域と一致した6,7).また,この胚はより尾側の組織を形成しなくなった.おそらく,体軸幹細胞がすべて神経板の細胞へと分化してしまったからであろう.以上のことから,BMPシグナルはSox2遺伝子の発現を抑制することにより体軸幹細胞の維持に関与していると考えられる.
また,これまでに報告されている遺伝子変異マウスの表現型から,Wntシグナルが転写因子Brachyuryとともに体軸幹細胞の維持に関与していることが示唆されている13,14)(図3c).原条において発現しているWnt3aおよびBrachyuryは互いの発現を活性化していることが知られている15).Wnt3aノックアウトマウスおよびBrachyuryノックアウトマウスの胚においては,原条の周辺の領域においてSox2遺伝子の異所的な発現とTbx6遺伝子の発現の消失が観察され,前肢より尾側の体幹部が形成されなくなる16-18).これらの観察から,Wnt-Brachyuryシグナル伝達経路の不活性化により体軸幹細胞が維持されず,すべて神経板の細胞へと分化して枯渇してしまったと考えられる.また,Wnt3a遺伝子およびBrachyury遺伝子の発現は妊娠13日目に消失するが,これは尾部の形成(伸長)が終了するタイミングとも一致している.Wnt3aの発現の消失と体幹部の形成の終了との関係は,Wnt3a遺伝子の発現の低下したマウスの研究からも示されている19).Wnt3a遺伝子の発現の低下したvtマウスのホモ変異胚では尾部の形成が途中で停止して短尾なマウスが産まれる.また,vtマウスとWnt3aノックアウトマウスとの二重ヘテロマウスの胚では後肢より尾側の組織がいっさい形成されない.こういった観察から,Wntシグナルがあるレベルを下まわると体軸幹細胞が枯渇して体幹部の形成が予定よりも早く停止してしまう.
Wnt3aノックアウトマウスの胚の表現型から,WntシグナルはSox2遺伝子の発現を抑制することによる体軸幹細胞の維持とTbx6の発現を介した中胚葉への分化を制御していると考えられる.しかしながら,WntシグナルはSox2遺伝子のN1エンハンサーを活性化するシグナルのひとつである6)(図3c).したがって,Wntシグナルは複雑な制御により,体軸幹細胞の維持と2つの体細胞系列への分化とのいずれをも制御していると考えられる.現在のところ,Wntシグナルがどのようにして体軸幹細胞の維持と分化の制御を使い分けているのかはまったくわかっていない.また,体軸幹細胞を維持していると考えられるWntシグナルとBMPシグナルとがどのような関係にあるのかも不明であり,今後の研究課題である.
4.体軸幹細胞から形成される胚の領域
体軸幹細胞から形成されるのは,頭尾軸のすべての神経板あるいは体節中胚葉ではない.このことは,体軸幹細胞の制御にかかわる遺伝子の変異マウスの胚の表現型からも示唆される.Tbx6ノックアウトマウスの胚では,体節中胚葉となる領域に異所的に神経管が形成されるが,この表現型がみられるのは第7体節より尾側のみである.より吻側では不完全ながらも約6つの体節が形成され,筋のマーカー遺伝子であるMyoD遺伝子やMyf5遺伝子なども発現する7,11)(図4).Wnt3a遺伝子あるいはBrachyury遺伝子に変異をもつマウスの胚において体幹部が形成されなくなることはすでに述べたが,これらの変異マウスの胚においても第6体節までの神経板や中胚葉の組織は正常に形成される.したがって,神経板に分化するか体節中胚葉に分化するかという細胞運命の分岐は第7体節より尾側でのみ起こり,より吻側の体節中胚葉(将来の頭頸部)はまったく異なる制御により形成されると考えられる(図4).
体節中胚葉の発生のしくみが頭頸部と体幹部とで異なることは,それぞれの体節中胚葉が由来する胚の細胞の状態を反映している可能性がある.近年,エピブラストに対応した培養細胞であるエピブラスト幹細胞が着床ののちの胚から樹立された.このエピブラスト幹細胞は妊娠8日目よりもまえの胚からは樹立できるが,それ以降の胚からは樹立できない20).また,樹立されたエピブラスト幹細胞は,妊娠8日目よりまえの胚に移植するとさまざまな体細胞系列へと寄与するが,妊娠8日目よりあとの胚に移植しても体細胞へは分化しない20).発生の初期にまず頭頸部が分化し,つづいて体幹部が分化することを考えると,おそらく第6体節(頭頸部)までの体節中胚葉はエピブラストから直接に分化し,それより尾側の体節中胚葉は体軸幹細胞に由来するであろう.
5.神経板と体節中胚葉以外の体幹部の組織が形成される機構
体幹部には体軸幹細胞から分化する神経板および体節中胚葉のほかに,側板中胚葉,中間中胚葉,中軸中胚葉,内胚葉の細胞が分化する(図1).これらの組織に寄与する体細胞系列が,どういった細胞から,どういった細胞と分離されて分化するのかはまったくわかっていない.マウスの胚を用いた移植実験では,ノード-原条境界の細胞が神経板腹側,脊索,体節中胚葉へと寄与することが示されていることから,異なるセットの体細胞に分化する幹細胞が存在する可能性がある.
おわりに
高校の生物の教科書には,“原腸胚で生じた3種類の胚葉からいろいろな組織が形成される”と記されている.そして,“外胚葉からは神経管と表皮が分化し,中胚葉からは骨や筋肉(体節中胚葉)が分化する”と書かれている.しかしながら,このレビューにおいて紹介した一連の研究により,体幹部の神経管および体節中胚葉は共通の前駆体細胞である体軸幹細胞から分化することが明らかになった.これらの研究成果は,けっして三胚葉そのものを否定するものではない.分化した組織はその位置に応じていずれかの胚葉に分類される.つまり,三胚葉とはあくまで組織の解剖学的な位置の記述であって,細胞運命の分岐ではない.体軸幹細胞という新しい細胞運命の分岐点の発見が,同じ時期に分化する多様な組織の起源を再考するきっかけになることが期待される.
文 献
- Cambray, N. & Wilson, V.: Two distinct sources for a population of maturing axial progenitors. Development, 134, 2829-2840 (2007)[PubMed]
- Wilson, V., Olivera-Martinez, I. & Storey, K.: Stem cells, signals and vertebrate body axis extension. Development, 136, 1591-1604 (2009)[PubMed]
- Brown, J. & Storey, K.: A region of the vertebrate neural plate in which neighbouring cells can adopt neural or epidermal fates. Curr. Biol., 10, 869-872 (2000)[PubMed]
- McGrew, M. J., Sherman, A., Lillico, S. G. et al.: Localised axial progenitor cell populations in the avian tail bud are not committed to a posterior Hox identity. Development, 135, 2289-2299 (2008)[PubMed]
- Tzouanacou, E., Wegener, A., Wymeersch, F. et al.: Redefining the progression of lineage segregations during mammalian embryogenesis by clonal analysis. Dev. Cell, 17, 365-376 (2009)[PubMed]
- Takemoto, T., Uchikawa, M., Kamachi, Y et al.: Convergence of Wnt and FGF signals in the genesis of posterior neural plate through activation of the Sox2 enhancer N-1. Development, 133, 297-306 (2006)[PubMed]
- Takemoto, T., Uchikawa, M., Yoshida, M. et al.: Tbx6-dependent Sox2 regulation determines neural or mesodermal fate in axial stem cells. Nature, 470, 394-398 (2011)[PubMed] [新着論文レビュー]
- Uchikawa, M., Ishida, Y., Takemoto, T. et al.: Functional analysis of chicken Sox2 enhancers highlights an array of diverse regulatory elements that are conserved in mammals. Dev. Cell, 4, 509-519 (2003)[PubMed]
- Iwafuchi-Doi, M., Yoshida. Y., Onichtchouk, D. et al.: The Pou5f1/Pou3f-dependent but SoxB-independent regulation of conserved enhancer N2 initiates Sox2 expression during epiblast to neural plate stages in vertebrates. Dev. Biol, 352, 354-366 (2011)[PubMed]
- Iwafuchi-Doi, M., Matsuda, K., Murakami, K. et al.: Transcriptional regulatory networks in epiblast cells and during anterior neural plate development as modeled in epiblast stem cells. Development, 139, 3926-3937 (2012)[PubMed]
- Chapman, D. & Papaioannou, V.: Three neural tubes in mouse embryos with mutations in the T-box gene Tbx6. Nature, 391, 695-697 (1998)[PubMed]
- Chapman, D., Agulnik, I., Hancock, S. et al.: Tbx6, a mouse T-Box gene implicated in paraxial mesoderm formation at gastrulation. Dev. Biol., 180, 534-542 (1996)[PubMed]
- Kondoh, H. & Takemoto, T.: Axial stem cells deriving both posterior neural and mesodermal tissues during gastrulation. Curr. Opin. Genet. Dev., 22, 374-380 (2012)[PubMed]
- Takemoto, T.: Regulation of axial stem cells deriving neural and mesodermal tissues during posterior axial elongation. in New Principles in Developmental Processes (eds. Kondoh, H. & Kuroiwa, A.). pp.85-96, Springer, Tokyo (2014)
- Yamaguchi, T., Takada, S., Yoshikawa, Y. et al.: T (Brachyury) is a direct target of Wnt3a during paraxial mesoderm specification. Genes Dev., 13, 3185-3190 (1999)[PubMed]
- Takada, S., Stark, K., Shea, M. et al.: Wnt-3a regulates somite and tailbud formation in the mouse embryo. Genes Dev., 8, 174-189 (1994)[PubMed]
- Yoshikawa, Y., Fujimori, T., McMahon, A. et al.: Evidence that absence of Wnt-3a signaling promotes neuralization instead of paraxial mesoderm development in the mouse. Dev. Biol, 183, 234-242 (1997)[PubMed]
- Chesley, P.: Development of the short-tailed mutant in the mouse mouse. J. Exp. Zool., 70, 429-459 (1935)
- Greco, T. L., Takada, S., Newhouse M. M. et al.: Analysis of the vestigial tail mutation demonstrates that Wnt-3a gene dosage regulates mouse axial development. Genes Dev., 10, 313-324 (1996)[PubMed]
- Osorno, R., Tsakiridis, A., Wong, F. et al.: The developmental dismantling of pluripotency is reversed by ectopic Oct4 expression. Development, 139, 2288-2298 (2012)[PubMed]
著者プロフィール
略歴:2005年 大阪大学大学院理学研究科 修了,同年 大阪大学大学院生命機能研究科 特任助手を経て,2013年より徳島大学藤井節郎記念医科学センター 特任助教.
研究テーマ:脊椎動物の原腸陥入の時期における細胞運命の決定のしくみ.
研究室URL:http://www.tokushima-u.ac.jp/fujii/research/embryology/
© 2014 竹本 龍也 Licensed under CC 表示 2.1 日本