体性感覚系における神経回路の形成の時空間的な制御機構
2014/09/26
河崎 洋志
(金沢大学医薬保健研究域 脳・肝インターフェースメディシン研究センター分子神経科学部門)
email:河崎洋志
領域融合レビュー, 3, e010 (2014) DOI: 10.7875/leading.author.3.e010
Hiroshi Kawasaki: Spatiotemporal regulation of the formation of the somatosensory system.

マウスやラットの大脳皮質の1次体性感覚野は口のまわりのヒゲに対応したバレルとよばれる構造をもち,神経回路の形成や神経の可塑性などの研究に多く用いられている.ノックアウトマウスなどを用いた逆遺伝学的な解析により,バレルという空間的なパターンの形成を制御する遺伝子が明らかにされてきた.グルタミン酸受容体,および,セロトニンに関連するセロトニン輸送体やモノアミン酸化酵素などが,バレルの形成に必須である.また,バレルの形成の時間的な制御機構についても明らかになってきた.バレルは生後1週間ほどで形成されるが,出生がバレルの形成開始を制御していることも明らかになった.出生の下流に位置する制御機構の解析も進んでいる.体性感覚系において見い出された制御機構はほかの神経系にもあてはまるのか,その一般性についても興味深い.
脳はもっとも複雑かつ精緻な臓器である.発生および発達の過程において,この精緻な脳神経系を正しく形成することは正常な高次脳機能を発揮するために必須である.したがって,発生および発達の過程における脳神経系の形成機構の解明,および,その異常がひき起こす病態の解明は脳神経医学における重要な研究課題である.
脳神経系の形成を理解するためには3つの要素が重要である.1)素子としてのニューロン,2)ニューロンのあいだをつなぐ神経回路,3)ニューロンのまわりに存在するグリア細胞,である.ニューロンには非常に多くの種類があり,それぞれのニューロンの個性を決定する機構を理解することが重要である.また,脳神経系の特徴は神経回路によるシグナル伝達にあることから,神経回路の形成機構も精力的に研究されている.また,近年では,グリア細胞の重要性も再認識されてきている.このレビューでは,おもに神経回路に焦点をしぼり,体性感覚系を用いた研究について解説する.
脳神経系の形成機構の研究には,体性感覚系や視覚系などの感覚神経系がよく用いられる.感覚神経系を用いるのは,いくつかの重要な特徴があるためである.第1に,遺伝要因と環境要因の機能的な分担を解明しやすいという点である.脳神経系の形成や疾患の病態生理に影響を及ぼす要因として遺伝要因と環境要因とが重要であるが,感覚神経系においては環境要因を選択的に操作することが容易である.たとえば,視覚系では研究の対象となる動物を暗黒条件におくことで視覚入力を遮断することができ,環境要因を排除した実験環境を構築することができる.2つの眼からの入力のバランスを検討するには,片方の眼のみを遮蔽すればよい.また,視覚系の環境要因を操作することにより,異なる感覚,たとえば,体性感覚系への影響を検討することもできる.体性感覚系の実験においては,マウスのヒゲからの触覚がよく用いられるが,ヒゲを除去することにより入力を操作することができる.
第2に,神経の可塑性の研究に適している点である.脳神経系は可塑性により外界からの入力に対し機能的あるいは構造的に変化する.さきに述べたように,感覚神経系においては入力の操作が容易であることから,神経の可塑性を起こしやすい.
第3に,可塑性における臨界期の研究に適している点である.神経の可塑性は必ずしも生涯いつでもみられるわけではなく,基本的には,出生ののち,発達の初期のある一時期にのみ限定してみられることが多い.この可塑的な変化の起こりうる時期は臨界期(あるいは,感受性期)とよばれる.発達において,臨界期の開始および終了を制御する分子機構の解明も精力的に行われている.このように,感覚神経系は脳神経系の形成機構の研究において重要な位置をしめている.
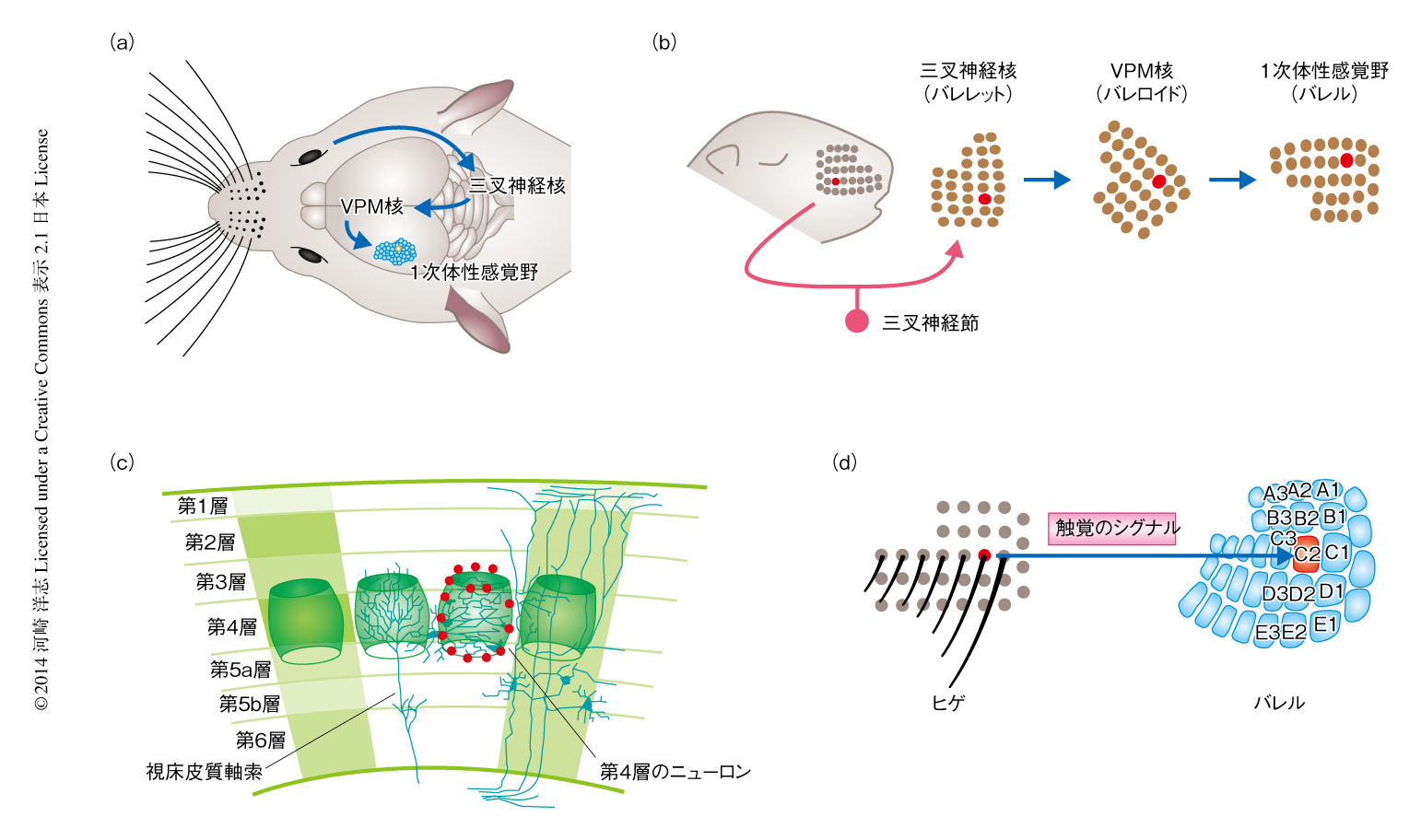
感覚神経系のなかでも体性感覚系,とくに,マウスやラットなどげっ歯類のヒゲからの触覚を伝達する体性感覚系は神経回路の形成の研究に広く用いられている1,2).ヒゲにより検出された触覚のシグナルは,三叉神経により三叉神経節へと伝達され,そののち,脳幹部の三叉神経核,視床のVPM核を経由して,大脳皮質の1次体性感覚野へと伝達される(図1a).げっ歯類ではヒゲからの感覚入力が大きなウェイトをしめるため,1次体性感覚野のなかでもヒゲに対応する部位が大きな領域をしめている.
げっ歯類の体性感覚系にはヒゲの分布を反映した体性感覚地図の存在していることが特徴的である.ヒゲに対応する組織の構造は,三叉神経核ではバレレット(barrelette),VPM核ではバレロイド(barreloid),1次体性感覚野ではバレル(barrel)とよばれている(図1b).とくに,バレルは大脳皮質の第4層に存在し,ニューロンの樽状の空間分布である(図1c).1個のバレルは基本的には1本のヒゲからの入力をうけると考えられており,口のまわりのヒゲの分布に対応して,1次体性感覚野にバレルが分布している(図1d).バレルの内部にはシグナルの入力元であるVPM核からの視床皮質軸索が分布する(図1c).バレルはニューロンを染め出すNeuNによる免疫染色により可視化することができる.さらに,視床皮質軸索を染色するVGluT2による免疫染色やセロトニン輸送体による免疫染色,さらには,シトクロムオキシダーゼ染色でも可視化できる.このように,簡便な方法により内部の構造を可視化できることもバレルの特徴であり,多くの研究に用いられる理由でもある.
大脳皮質の第4層におけるバレルとバレルのあいだの領域はセプタとよばれ,バレルとは異なる末梢からのシグナルを伝達すると考えられている.バレルは視床のVPM核からの入力をうけるが,セプタは視床でもPoM核からの入力をうける.つまり,バレルとセプタはいずれも体性感覚系に属するが異なる質のシグナルを伝達している.バレルはヒゲにおける触覚を伝達するのに対して,セプタのニューロンは触覚刺激への反応性が弱い.むしろ,セプタのニューロンはリズミカルなヒゲの動きに反応することから,セプタはヒゲの積極的な動きをモニターしていると考えられている.
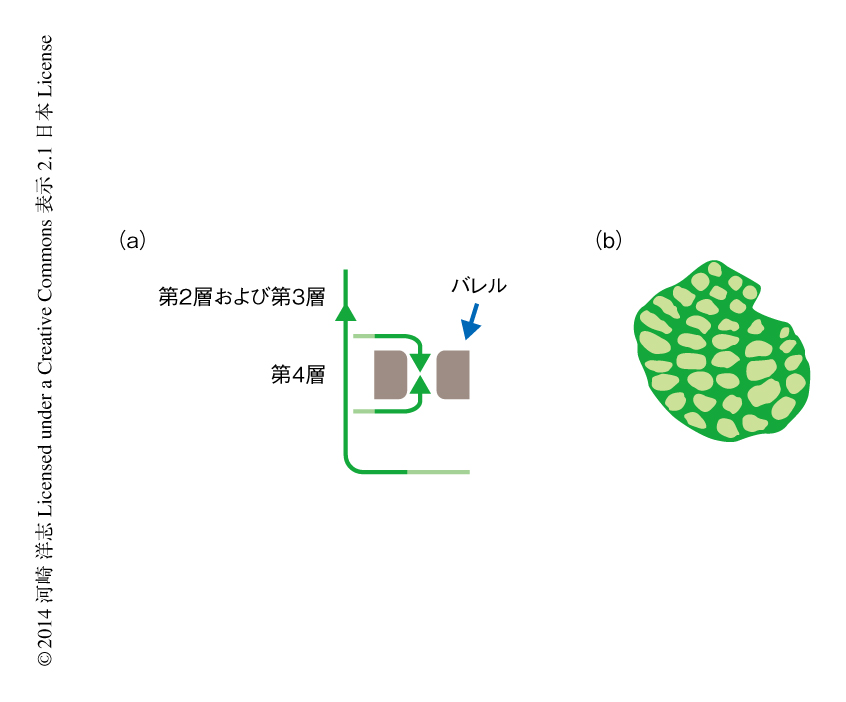
このように,末梢から大脳皮質の第4層のニューロンへいたる触覚の入力経路については詳細に研究されてきたが,実際に情報処理を行う大脳皮質の内部の神経回路についてはまだ不明な点が残っていた.そこで筆者らは,子宮内電気穿孔法により大脳皮質の第2層および第3層のニューロンにおいて選択的にGFPを発現させ軸索の走行を解析した.その結果,大脳皮質の第4層においてセプタに対し集中的に投射していることを見い出し,この投射のパターンをバレルネット(barrel net)と命名した3,4)(図2).おもしろいことに,mCherryとシナプトフィシン-GFP融合タンパク質を大脳皮質の第2層および第3層のニューロンに共発現させたところ,バレルネットにシナプスの存在することが示唆され,バレルネットは機能的に重要である可能性が示唆された.もしかすると,バレルネットはバレルとセプタのシグナルを結びつける神経回路なのかもしれない.現時点では,バレルやバレルネットなどの構築の機能的な意義は明らかになっておらず,今後の解析が待たれる.
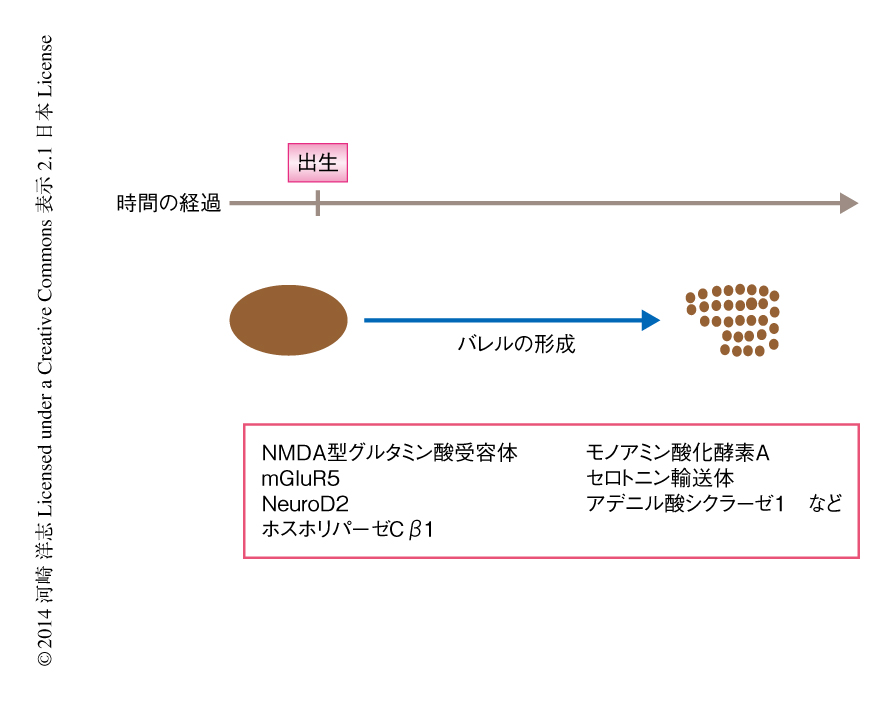
バレルを含めた体性感覚系の形成の過程もくわしく調べられている.バレルの形成の初期には,三叉神経核,VPM核,1次体性感覚野のいずれにおいても,投射している軸索はヒゲごとの分離をせずに重なり合っており,複数のヒゲからのシグナルが混ざり合って投射している(図3).この状態から徐々に末梢の側より1個1個のヒゲへの分離が進み,順に,バレレット,バレロイド,バレルが形成する.このように,バレルの形成の初期には1本の視床皮質軸索が複数のヒゲに対応するバレルに投射しているが,形成が進むと1本のヒゲに対応するバレルに投射が限定されるようになる.また,大脳皮質の第4層のニューロンの配置についても,バレルの形成の初期には一様に分布しているが,形成が進むとバレルの形状に再配置される.
大脳皮質の第4層の個々のニューロンについて樹状突起の形態を観察すると,バレルの形成の初期にはあらゆる方向に放射状に樹状突起を伸ばしているが,バレルの形成が進むにつれて樹状突起はバレルの中心の方向に限定して存在するようになる.最近,2光子顕微鏡を用いることにより,この樹状突起の再構築を生後まもない生きたマウスの脳において観察することが可能になった5)(新着論文レビュー でも掲載).再構築に際しては樹状突起を伸び縮みさせながらバレルの中心にむかい徐々に伸ばしていくダイナミックな変化が観察された.NMDA型グルタミン酸受容体を欠損させると,樹状突起のバレルの中心への指向性は失われランダムに分布する過程が観察された5).
これまで述べたように,体性感覚系のバレルは形成の過程が詳細に記述されており,また,分子遺伝学的な解析の容易なマウスを用いて研究できることから,神経回路の形成や再構築のモデル系として多く用いられている2,6-8)(図3).NMDA型グルタミン酸受容体のノックアウトマウスでは,脳幹部におけるバレレットの形成が阻害されていることが報告された.さらに,大脳皮質の興奮性ニューロンに限定してNMDA型グルタミン酸受容体のNR1サブユニットを欠損するCxNR1ノックアウトマウスでは,バレレットとバレロイドは正常であるがバレルに異常がみられた9).大脳皮質の第4層においてバレルの構造が欠失し,対応する視床皮質軸索の形成が不完全であった.さらに,正常なマウスではバレルの中心の方向にむいている大脳皮質の第4層のニューロンの樹状突起が,バレルの中心への指向性を失っていた.また,代謝型グルタミン酸受容体mGluR5のノックアウトマウスにおいてもバレルの形成に異常がみられた10).これらの結果は,大脳皮質におけるグルタミン酸による神経伝達がバレルの形成に必須であることを示唆している.グルタミン酸受容体の下流に位置するタンパク質として,NeuroD2およびホスホリパーゼCβ1が考えられている.NeuroD2はCa2+により誘導される転写因子であり,NeuroD2のノックアウトマウスはバレルの形成に異常をきたす11).NMDA型グルタミン酸受容体から流入したCa2+がNeuroD2を介してバレルの形成を制御している可能性がある.また,ホスホリパーゼCβ1のノックアウトマウスもバレルに異常をきたす10).ホスホリパーゼCβ1がmGluR5の下流ではたらいている可能性がある.ただし,これらが大脳皮質の第4層のニューロンにおいてはたらいているかなど,全体像を明確にするためにはさらに詳細な解析が必要であろう.
また,神経伝達物質であるセロトニンもバレルの形成に関与していることが知られている(図3).セロトニン分解酵素であるモノアミン酸化酵素Aのノックアウトマウスにおいては,大脳皮質の第4層のニューロンの分布および対応する視床皮質軸索のいずれについても,バレルの形成が失われた12).この結果は,セロトニンの濃度が上昇するとバレルの形成が阻害されることを意味している.さらに,セロトニンを細胞に取り込むセロトニン輸送体のノックアウトマウスにおいてもバレルの形成が阻害されていたことから,細胞外のセロトニン濃度の上昇がバレルの形成の異常につながったと考えられる13).さらに,これらのノックアウトマウスとセロトニン1B受容体のノックアウトマウスとを掛け合わせることにより,バレルの形成の異常は軽減されることが示された14).この結果は,細胞外のセロトニン濃度の上昇は,少なくとも部分的にはセロトニン1B受容体が検出していることを示唆している.さらに,アデニル酸シクラーゼ1に異常のあるマウスにおいてはバレルの欠損することが知られている.細胞外のセロトニン濃度の上昇によりセロトニン1B受容体が刺激され,その下流においてアデニル酸シクラーゼ1が抑制されてバレルの形成の異常につながると推測されている.
また,大脳皮質の第4層のニューロンにおける樹状突起の形態的な発達の機構についても解析されている.おもにバレルの中心において発現のみられるBtbd3の発現をshRNAによりノックダウンすると,正常ではバレルの中心の方向に選択的にむくはずの樹状突起が,セプタにもみられ放射状に分布することがわかった15)(新着論文レビュー でも掲載).さらに,Btbd3を視覚野に強制発現させ神経活動に強弱を形成するため片眼を遮蔽すると,樹状突起の形態に変化の起こることがわかった.これらの結果は,Btbd3が大脳皮質の第4層のニューロンにおける樹状突起の再構築に重要であることを意味している15).また,Btbd3は野生型マウスでは核に集積しているが,NMDA型グルタミン酸受容体のノックアウトマウスでは細胞質に局在していた.この結果は,グルタミン酸による神経伝達がきっかけとなり,Btbd3が核へと移行することにより樹状突起の形態の再構築がひき起こされる可能性を示唆している15).
最近,筆者らは,さきに述べたバレルネットを用いて,大脳皮質の局所における神経回路の形成機構について検討した16).子宮内電気穿孔法を用いて大脳皮質の第2層および第3層のニューロンにGFPを発現させることによりバレルネットを可視化できることから,GFPとともに,バレルネットの形成を制御する可能性のある候補タンパク質を共導入した.その結果,優性不能型カドヘリンを導入した際にバレルネットの形成が阻害されることを見い出した.さらに,初期から優性不能型カドヘリンを発現させるとバレルネットの形成は阻害されるが,バレルネットがいったん形成されたあとに優性不能型カドヘリンを発現させてもバレルネットは壊れないことがわかった.このことは,細胞接着分子であるカドヘリンがバレルネットの維持ではなく形成に重要であることを示唆している16).カドヘリンは神経回路の選択的な形成に重要ではないかと考えられ,実際に,中脳や海馬における神経回路の形成に重要であることが報告されてきた.しかしながら,高次脳機能の中枢である大脳皮質におけるカドヘリンの役割については不明な点が多かった.この研究の結果は,カドヘリンは大脳皮質の局所における神経回路の形成にも重要であることを示唆している16).
脳神経系の形成機構を理解するためには2つの視点が重要であろう.第1は,空間的なパターンの形成機構の理解であり,これまで述べてきたように,多くの先駆的な研究成果が得られている.第2は,時間的な制御機構の理解である.すなわち,ある特定の形成イベントは発生あるいは発達の過程においてある特定のタイミングで起こることが必須であることから,そのタイミングを規定する時間的な制御機構の理解も重要なのである.ある特定の形成イベントが本来とはまったく異なる時期に起こると,形成の異常につながると予想される.このように,時間的な制御機構は重要であるにもかかわらず,空間的なパターンの形成機構に比べ不明な点が多い.
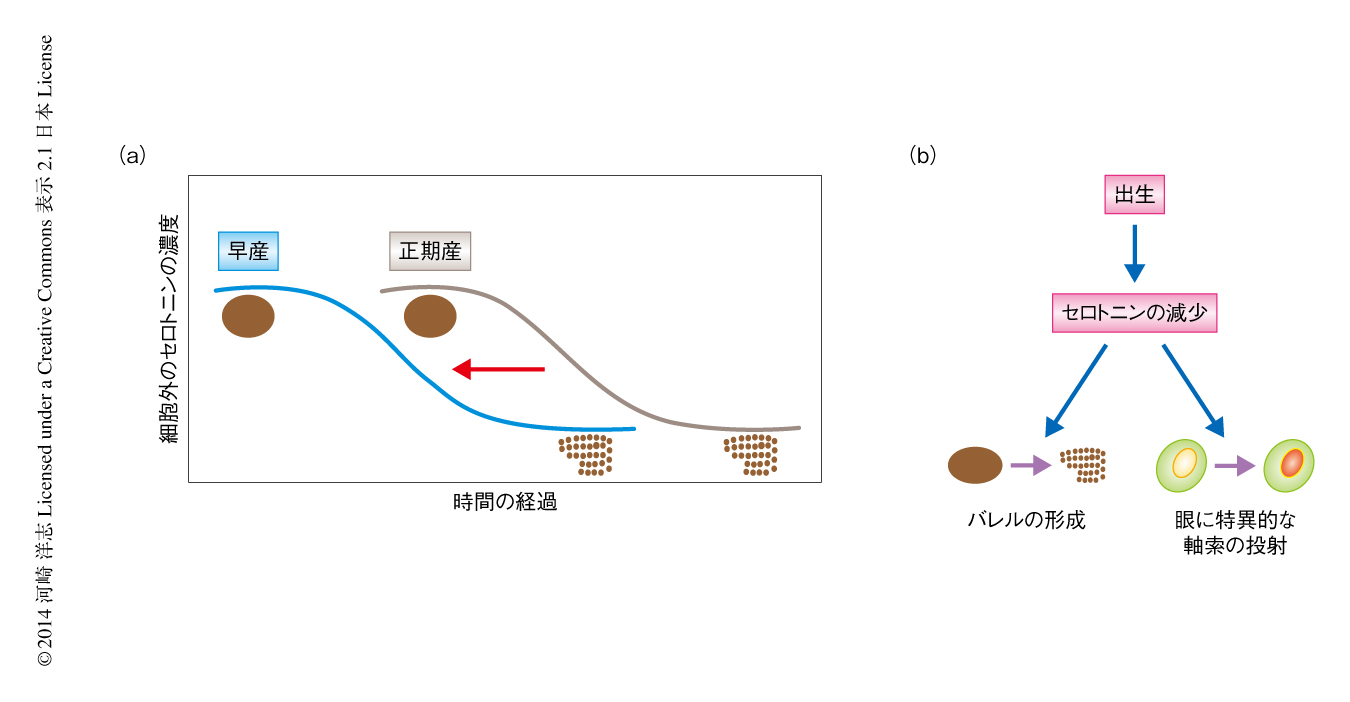
筆者らは,1次体性感覚野におけるバレルの形成の時間的な制御機構について解析した.マウスの胎仔が母親から生まれてすぐにバレルの形成は進行することから,出生それ自体がバレルの形成開始のスイッチであるとの仮説をたてた17)(新着論文レビュー でも掲載).この仮説を検証するため,マウスに人為的に早産を誘導し,バレルの形成時期について検討した.出産の時期を正確に記録するため,分娩を赤外線ビデオレコーダーを用いて記録し,その結果,早産で生まれたマウスでは正期産のマウスに比較してバレルが有意に早期に形成されることを見い出した(図4a).このバレルの早期形成は,形成の速度が増加したのではなく,形成の時期が早まることが原因であった.これらのことから,出生がバレルの形成の開始時期を規定していること,および,出生がバレルの形成開始を制御していることが示唆された17)(図4b).
さらに,出生とバレルの形成とをつなぐ分子機構について解析した.バレルの空間的なパターンの形成にかかわる遺伝子のいずれかが,じつは時間的な律速段階であり出生の下流に位置するのではないかと考えた.神経伝達物質であるセロトニンの細胞外濃度が異常に高いモノアミン酸化酵素Aノックアウトマウスではバレルの形成が阻害されることが報告されていたが,正常な発達におけるセロトニンの生理的な役割は不明であった.そこで,セロトニンが出生の下流に位置しバレルの形成の開始を制御しているのではないかと考えた(図4).実際に,脳脊髄液においてセロトニンの濃度を測定したところ,出生ののちにセロトニン濃度は低下すること,および,早産によりセロトニン濃度の低下する時期は早まることを見い出した.この結果は,出生がセロトニンの濃度低下を制御していることを示唆している17).つづいて,セロトニンの濃度低下がバレルの形成開始を制御しているのかどうか検討した.まず,セロトニンの濃度低下の十分性について検討するため,セロトニンの合成を阻害してセロトニンの濃度低下を早期に生じさせたところ,バレルの形成の時期も早まることを見い出した.逆に,セロトニンの濃度低下の必要性について検討するため,セロトニンの分解を阻害したところ,バレルの形成時期に対する早産の効果が阻害された.これらの結果は,セロトニンの濃度低下が出生によるバレルの形成開始に必要かつ十分であることを示唆している17)(図4).
出生が体性感覚系における神経回路の形成を制御していることがわかったが,機能的な発達も出生により制御されているのかどうか検討した.そこで,出生ののちに発達する哺乳行動に注目した18).マウスの新生仔は出生の直後には乳首をみつけて吸いつき哺乳をはじめるまでに時間がかかるが,徐々に上達し短時間で哺乳できるようになる.この哺乳までの時間の短縮が出生により制御されているかどうか検討した.早産で生まれたマウスと正期産で生まれたマウスの哺乳までの時間短縮について検討したところ,早産で生まれた場合には時間短縮が促進されることを見い出した18).おもしろいことに,運動機能の指標である起きあがり反射は早産の影響をうけなかった.これらの結果は,哺乳行動の発達も出生により制御されていることを示唆している18).
体性感覚系をモデルとして見い出された,出生→セロトニンの濃度低下→神経回路の形成,という新たな制御機構が,ほかの神経回路の形成も制御する一般的な制御機構であるかどうかを検討した17).さきに述べたように,脳脊髄液におけるセロトニンの濃度は出生ののちに低下したが,脳脊髄液は脳のさまざまな部位にふれていることから,セロトニンの濃度の変化は脳のさまざまな部位に影響をあたえている可能性があると考えた.そこで,バレルと同様に出生の直後に形成され,モノアミン酸化酵素Aノックアウトマウスにおいて異常になる眼に特異的な軸索投射に着目した.成体では,右眼あるいは左眼に由来する眼球の網膜神経節細胞の軸索は,その投射先である外側膝状体において異なる領域に分離して投射しており,眼に特異的な軸索投射とよばれる.眼に特異的な軸索投射は出生の直後にはまだ完成しておらず,両眼に由来する網膜神経節細胞の軸索は外側膝状体において混在しているが,出生から10日ほどで右眼および左眼に由来する網膜神経節細胞の軸索は分離し眼に特異的な軸索投射が完成する.この眼に特異的な軸索投射の形成は早産により促進されること,さらに,セロトニンの濃度低下により促進されることが見い出された17).この結果は,出生からセロトニンの濃度低下にいたる制御機構が,視覚系における神経回路の形成も制御していることを意味している17)(図4).この制御機構が,さらに多くの脳領域における神経回路の形成を制御しているのか興味深い.
感覚神経系を用いた研究において,神経の可塑性あるいは臨界期の終了の制御の機構も注目をあつめている.体性感覚系では,ヒゲを傷害することにより1次体性感覚野のバレルに可塑的な変化をひき起こすことができ,これはヒゲの傷害によるバレルの可塑性とよばれる.すなわち,傷害したヒゲに対するバレルが縮小し,隣接するバレルが拡大する.このヒゲの傷害によるバレルの可塑性の機構にはいまだ不明な点が多いが,グルタミン酸輸送体1のノックアウトマウスにおいては,バレルの形成は正常であるがヒゲの傷害によるバレルの可塑性に異常のみられることが報告された19).また,グルタミン酸-アスパラギン酸輸送体のノックアウトマウスでもヒゲの傷害によるバレルの可塑性に異常がみられた19).これらの結果は,グルタミン酸輸送体がヒゲの傷害によるバレルの可塑性を亢進させていることを示唆している.
また,ヒゲの傷害によるバレルの可塑性は出生の直後の一時期においてみられ,この臨界期をすぎると誘発されない.このように,臨界期が終了するとヒゲの傷害によるバレルの可塑性が失われる機構も注目されており,バレルにおける神経伝達物質であるセロトニンやグルタミン酸の関与が検討された.セロトニン分解酵素であるモノアミン酸化酵素Aの阻害剤クロルギリンあるいはモノアミン酸化酵素Aノックアウトマウスを用いた解析では,臨界期の終了時期に影響はみられなかった20).また,大脳皮質の興奮性ニューロンに限定してNMDA型グルタミン酸受容体のNR1サブユニットを欠損するCxNR1ノックアウトマウスでも,臨界期は正常に終了していた21).これらの結果は,ヒゲの傷害によるバレルの可塑性における臨界期の終了時期はセロトニンやグルタミン酸により制御されていないことを示唆している.
視覚野では軸索再生阻害タンパク質であるNogoAおよびNogoB,また,その受容体が臨界期の終了を制御していることが報告された22).また,軸索再生阻害タンパク質としてほかにもMAGやOMgpなどのあることが知られていた.筆者らは,これらがオリゴデンドロサイトに共通して発現していることを利用し,オリゴデンドロサイトを除去することによりこれらの軸索再生阻害タンパク質の発現をまとめて阻害した23).オリゴデンドロサイトの発生に必須な転写因子Olig1のノックアウトマウスを解析したが,ヒゲの傷害によるバレルの可塑性における臨界期の終了時期は延長していなかった23).この結果は,ヒゲの傷害によるバレルの可塑性における臨界期の終了にはオリゴデンドロサイトは不要であることを示唆している23).このように,体性感覚系における臨界期の終了の機構には不明な点が多く,今後の解析が待たれる.
このレビューでは,体性感覚系の発生および発達の過程に焦点をしぼり,最近の研究成果について紹介した.体性感覚系は,発達期における神経の可塑性,可塑性における臨界期,神経回路の形成における空間的および時間的な制御など,幅広い研究に用いられている.体性感覚系で得られた知見が,ほかの感覚神経系あるいはほかの脳領域にもあてはまるか,興味深い.脳領域ごとの機構の多様性や一般性も,今後の重要な研究テーマである.
略歴:1998年 京都大学大学院医学研究科 修了,同年 京都大学再生医科学研究所 助手,2001年 同 講師,2002年 米国Duke大学 研究員,2004年 東京大学大学院医学系研究科 特任助教授を経て,2013年より金沢大学医薬保健研究域 教授.
研究テーマ:哺乳類における脳神経系の形成機構およびその異常がひき起こす病態.
研究室URL:http://square.umin.ac.jp/top/kawasaki/
© 2014 河崎 洋志 Licensed under CC 表示 2.1 日本
(金沢大学医薬保健研究域 脳・肝インターフェースメディシン研究センター分子神経科学部門)
email:河崎洋志
領域融合レビュー, 3, e010 (2014) DOI: 10.7875/leading.author.3.e010
Hiroshi Kawasaki: Spatiotemporal regulation of the formation of the somatosensory system.
要 約
マウスやラットの大脳皮質の1次体性感覚野は口のまわりのヒゲに対応したバレルとよばれる構造をもち,神経回路の形成や神経の可塑性などの研究に多く用いられている.ノックアウトマウスなどを用いた逆遺伝学的な解析により,バレルという空間的なパターンの形成を制御する遺伝子が明らかにされてきた.グルタミン酸受容体,および,セロトニンに関連するセロトニン輸送体やモノアミン酸化酵素などが,バレルの形成に必須である.また,バレルの形成の時間的な制御機構についても明らかになってきた.バレルは生後1週間ほどで形成されるが,出生がバレルの形成開始を制御していることも明らかになった.出生の下流に位置する制御機構の解析も進んでいる.体性感覚系において見い出された制御機構はほかの神経系にもあてはまるのか,その一般性についても興味深い.
はじめに
脳はもっとも複雑かつ精緻な臓器である.発生および発達の過程において,この精緻な脳神経系を正しく形成することは正常な高次脳機能を発揮するために必須である.したがって,発生および発達の過程における脳神経系の形成機構の解明,および,その異常がひき起こす病態の解明は脳神経医学における重要な研究課題である.
脳神経系の形成を理解するためには3つの要素が重要である.1)素子としてのニューロン,2)ニューロンのあいだをつなぐ神経回路,3)ニューロンのまわりに存在するグリア細胞,である.ニューロンには非常に多くの種類があり,それぞれのニューロンの個性を決定する機構を理解することが重要である.また,脳神経系の特徴は神経回路によるシグナル伝達にあることから,神経回路の形成機構も精力的に研究されている.また,近年では,グリア細胞の重要性も再認識されてきている.このレビューでは,おもに神経回路に焦点をしぼり,体性感覚系を用いた研究について解説する.
1.感覚神経系を用いた研究の特徴
脳神経系の形成機構の研究には,体性感覚系や視覚系などの感覚神経系がよく用いられる.感覚神経系を用いるのは,いくつかの重要な特徴があるためである.第1に,遺伝要因と環境要因の機能的な分担を解明しやすいという点である.脳神経系の形成や疾患の病態生理に影響を及ぼす要因として遺伝要因と環境要因とが重要であるが,感覚神経系においては環境要因を選択的に操作することが容易である.たとえば,視覚系では研究の対象となる動物を暗黒条件におくことで視覚入力を遮断することができ,環境要因を排除した実験環境を構築することができる.2つの眼からの入力のバランスを検討するには,片方の眼のみを遮蔽すればよい.また,視覚系の環境要因を操作することにより,異なる感覚,たとえば,体性感覚系への影響を検討することもできる.体性感覚系の実験においては,マウスのヒゲからの触覚がよく用いられるが,ヒゲを除去することにより入力を操作することができる.
第2に,神経の可塑性の研究に適している点である.脳神経系は可塑性により外界からの入力に対し機能的あるいは構造的に変化する.さきに述べたように,感覚神経系においては入力の操作が容易であることから,神経の可塑性を起こしやすい.
第3に,可塑性における臨界期の研究に適している点である.神経の可塑性は必ずしも生涯いつでもみられるわけではなく,基本的には,出生ののち,発達の初期のある一時期にのみ限定してみられることが多い.この可塑的な変化の起こりうる時期は臨界期(あるいは,感受性期)とよばれる.発達において,臨界期の開始および終了を制御する分子機構の解明も精力的に行われている.このように,感覚神経系は脳神経系の形成機構の研究において重要な位置をしめている.
2.体性感覚系の基本的な構築および形成の過程
感覚神経系のなかでも体性感覚系,とくに,マウスやラットなどげっ歯類のヒゲからの触覚を伝達する体性感覚系は神経回路の形成の研究に広く用いられている1,2).ヒゲにより検出された触覚のシグナルは,三叉神経により三叉神経節へと伝達され,そののち,脳幹部の三叉神経核,視床のVPM核を経由して,大脳皮質の1次体性感覚野へと伝達される(図1a).げっ歯類ではヒゲからの感覚入力が大きなウェイトをしめるため,1次体性感覚野のなかでもヒゲに対応する部位が大きな領域をしめている.
げっ歯類の体性感覚系にはヒゲの分布を反映した体性感覚地図の存在していることが特徴的である.ヒゲに対応する組織の構造は,三叉神経核ではバレレット(barrelette),VPM核ではバレロイド(barreloid),1次体性感覚野ではバレル(barrel)とよばれている(図1b).とくに,バレルは大脳皮質の第4層に存在し,ニューロンの樽状の空間分布である(図1c).1個のバレルは基本的には1本のヒゲからの入力をうけると考えられており,口のまわりのヒゲの分布に対応して,1次体性感覚野にバレルが分布している(図1d).バレルの内部にはシグナルの入力元であるVPM核からの視床皮質軸索が分布する(図1c).バレルはニューロンを染め出すNeuNによる免疫染色により可視化することができる.さらに,視床皮質軸索を染色するVGluT2による免疫染色やセロトニン輸送体による免疫染色,さらには,シトクロムオキシダーゼ染色でも可視化できる.このように,簡便な方法により内部の構造を可視化できることもバレルの特徴であり,多くの研究に用いられる理由でもある.
大脳皮質の第4層におけるバレルとバレルのあいだの領域はセプタとよばれ,バレルとは異なる末梢からのシグナルを伝達すると考えられている.バレルは視床のVPM核からの入力をうけるが,セプタは視床でもPoM核からの入力をうける.つまり,バレルとセプタはいずれも体性感覚系に属するが異なる質のシグナルを伝達している.バレルはヒゲにおける触覚を伝達するのに対して,セプタのニューロンは触覚刺激への反応性が弱い.むしろ,セプタのニューロンはリズミカルなヒゲの動きに反応することから,セプタはヒゲの積極的な動きをモニターしていると考えられている.
このように,末梢から大脳皮質の第4層のニューロンへいたる触覚の入力経路については詳細に研究されてきたが,実際に情報処理を行う大脳皮質の内部の神経回路についてはまだ不明な点が残っていた.そこで筆者らは,子宮内電気穿孔法により大脳皮質の第2層および第3層のニューロンにおいて選択的にGFPを発現させ軸索の走行を解析した.その結果,大脳皮質の第4層においてセプタに対し集中的に投射していることを見い出し,この投射のパターンをバレルネット(barrel net)と命名した3,4)(図2).おもしろいことに,mCherryとシナプトフィシン-GFP融合タンパク質を大脳皮質の第2層および第3層のニューロンに共発現させたところ,バレルネットにシナプスの存在することが示唆され,バレルネットは機能的に重要である可能性が示唆された.もしかすると,バレルネットはバレルとセプタのシグナルを結びつける神経回路なのかもしれない.現時点では,バレルやバレルネットなどの構築の機能的な意義は明らかになっておらず,今後の解析が待たれる.
バレルを含めた体性感覚系の形成の過程もくわしく調べられている.バレルの形成の初期には,三叉神経核,VPM核,1次体性感覚野のいずれにおいても,投射している軸索はヒゲごとの分離をせずに重なり合っており,複数のヒゲからのシグナルが混ざり合って投射している(図3).この状態から徐々に末梢の側より1個1個のヒゲへの分離が進み,順に,バレレット,バレロイド,バレルが形成する.このように,バレルの形成の初期には1本の視床皮質軸索が複数のヒゲに対応するバレルに投射しているが,形成が進むと1本のヒゲに対応するバレルに投射が限定されるようになる.また,大脳皮質の第4層のニューロンの配置についても,バレルの形成の初期には一様に分布しているが,形成が進むとバレルの形状に再配置される.
大脳皮質の第4層の個々のニューロンについて樹状突起の形態を観察すると,バレルの形成の初期にはあらゆる方向に放射状に樹状突起を伸ばしているが,バレルの形成が進むにつれて樹状突起はバレルの中心の方向に限定して存在するようになる.最近,2光子顕微鏡を用いることにより,この樹状突起の再構築を生後まもない生きたマウスの脳において観察することが可能になった5)(新着論文レビュー でも掲載).再構築に際しては樹状突起を伸び縮みさせながらバレルの中心にむかい徐々に伸ばしていくダイナミックな変化が観察された.NMDA型グルタミン酸受容体を欠損させると,樹状突起のバレルの中心への指向性は失われランダムに分布する過程が観察された5).
3.体性感覚神経系の空間的な形成の制御機構
これまで述べたように,体性感覚系のバレルは形成の過程が詳細に記述されており,また,分子遺伝学的な解析の容易なマウスを用いて研究できることから,神経回路の形成や再構築のモデル系として多く用いられている2,6-8)(図3).NMDA型グルタミン酸受容体のノックアウトマウスでは,脳幹部におけるバレレットの形成が阻害されていることが報告された.さらに,大脳皮質の興奮性ニューロンに限定してNMDA型グルタミン酸受容体のNR1サブユニットを欠損するCxNR1ノックアウトマウスでは,バレレットとバレロイドは正常であるがバレルに異常がみられた9).大脳皮質の第4層においてバレルの構造が欠失し,対応する視床皮質軸索の形成が不完全であった.さらに,正常なマウスではバレルの中心の方向にむいている大脳皮質の第4層のニューロンの樹状突起が,バレルの中心への指向性を失っていた.また,代謝型グルタミン酸受容体mGluR5のノックアウトマウスにおいてもバレルの形成に異常がみられた10).これらの結果は,大脳皮質におけるグルタミン酸による神経伝達がバレルの形成に必須であることを示唆している.グルタミン酸受容体の下流に位置するタンパク質として,NeuroD2およびホスホリパーゼCβ1が考えられている.NeuroD2はCa2+により誘導される転写因子であり,NeuroD2のノックアウトマウスはバレルの形成に異常をきたす11).NMDA型グルタミン酸受容体から流入したCa2+がNeuroD2を介してバレルの形成を制御している可能性がある.また,ホスホリパーゼCβ1のノックアウトマウスもバレルに異常をきたす10).ホスホリパーゼCβ1がmGluR5の下流ではたらいている可能性がある.ただし,これらが大脳皮質の第4層のニューロンにおいてはたらいているかなど,全体像を明確にするためにはさらに詳細な解析が必要であろう.
また,神経伝達物質であるセロトニンもバレルの形成に関与していることが知られている(図3).セロトニン分解酵素であるモノアミン酸化酵素Aのノックアウトマウスにおいては,大脳皮質の第4層のニューロンの分布および対応する視床皮質軸索のいずれについても,バレルの形成が失われた12).この結果は,セロトニンの濃度が上昇するとバレルの形成が阻害されることを意味している.さらに,セロトニンを細胞に取り込むセロトニン輸送体のノックアウトマウスにおいてもバレルの形成が阻害されていたことから,細胞外のセロトニン濃度の上昇がバレルの形成の異常につながったと考えられる13).さらに,これらのノックアウトマウスとセロトニン1B受容体のノックアウトマウスとを掛け合わせることにより,バレルの形成の異常は軽減されることが示された14).この結果は,細胞外のセロトニン濃度の上昇は,少なくとも部分的にはセロトニン1B受容体が検出していることを示唆している.さらに,アデニル酸シクラーゼ1に異常のあるマウスにおいてはバレルの欠損することが知られている.細胞外のセロトニン濃度の上昇によりセロトニン1B受容体が刺激され,その下流においてアデニル酸シクラーゼ1が抑制されてバレルの形成の異常につながると推測されている.
また,大脳皮質の第4層のニューロンにおける樹状突起の形態的な発達の機構についても解析されている.おもにバレルの中心において発現のみられるBtbd3の発現をshRNAによりノックダウンすると,正常ではバレルの中心の方向に選択的にむくはずの樹状突起が,セプタにもみられ放射状に分布することがわかった15)(新着論文レビュー でも掲載).さらに,Btbd3を視覚野に強制発現させ神経活動に強弱を形成するため片眼を遮蔽すると,樹状突起の形態に変化の起こることがわかった.これらの結果は,Btbd3が大脳皮質の第4層のニューロンにおける樹状突起の再構築に重要であることを意味している15).また,Btbd3は野生型マウスでは核に集積しているが,NMDA型グルタミン酸受容体のノックアウトマウスでは細胞質に局在していた.この結果は,グルタミン酸による神経伝達がきっかけとなり,Btbd3が核へと移行することにより樹状突起の形態の再構築がひき起こされる可能性を示唆している15).
最近,筆者らは,さきに述べたバレルネットを用いて,大脳皮質の局所における神経回路の形成機構について検討した16).子宮内電気穿孔法を用いて大脳皮質の第2層および第3層のニューロンにGFPを発現させることによりバレルネットを可視化できることから,GFPとともに,バレルネットの形成を制御する可能性のある候補タンパク質を共導入した.その結果,優性不能型カドヘリンを導入した際にバレルネットの形成が阻害されることを見い出した.さらに,初期から優性不能型カドヘリンを発現させるとバレルネットの形成は阻害されるが,バレルネットがいったん形成されたあとに優性不能型カドヘリンを発現させてもバレルネットは壊れないことがわかった.このことは,細胞接着分子であるカドヘリンがバレルネットの維持ではなく形成に重要であることを示唆している16).カドヘリンは神経回路の選択的な形成に重要ではないかと考えられ,実際に,中脳や海馬における神経回路の形成に重要であることが報告されてきた.しかしながら,高次脳機能の中枢である大脳皮質におけるカドヘリンの役割については不明な点が多かった.この研究の結果は,カドヘリンは大脳皮質の局所における神経回路の形成にも重要であることを示唆している16).
4.体性感覚神経系の時間的な形成の制御機構の理解およびほかの神経系への波及効果
脳神経系の形成機構を理解するためには2つの視点が重要であろう.第1は,空間的なパターンの形成機構の理解であり,これまで述べてきたように,多くの先駆的な研究成果が得られている.第2は,時間的な制御機構の理解である.すなわち,ある特定の形成イベントは発生あるいは発達の過程においてある特定のタイミングで起こることが必須であることから,そのタイミングを規定する時間的な制御機構の理解も重要なのである.ある特定の形成イベントが本来とはまったく異なる時期に起こると,形成の異常につながると予想される.このように,時間的な制御機構は重要であるにもかかわらず,空間的なパターンの形成機構に比べ不明な点が多い.
筆者らは,1次体性感覚野におけるバレルの形成の時間的な制御機構について解析した.マウスの胎仔が母親から生まれてすぐにバレルの形成は進行することから,出生それ自体がバレルの形成開始のスイッチであるとの仮説をたてた17)(新着論文レビュー でも掲載).この仮説を検証するため,マウスに人為的に早産を誘導し,バレルの形成時期について検討した.出産の時期を正確に記録するため,分娩を赤外線ビデオレコーダーを用いて記録し,その結果,早産で生まれたマウスでは正期産のマウスに比較してバレルが有意に早期に形成されることを見い出した(図4a).このバレルの早期形成は,形成の速度が増加したのではなく,形成の時期が早まることが原因であった.これらのことから,出生がバレルの形成の開始時期を規定していること,および,出生がバレルの形成開始を制御していることが示唆された17)(図4b).
さらに,出生とバレルの形成とをつなぐ分子機構について解析した.バレルの空間的なパターンの形成にかかわる遺伝子のいずれかが,じつは時間的な律速段階であり出生の下流に位置するのではないかと考えた.神経伝達物質であるセロトニンの細胞外濃度が異常に高いモノアミン酸化酵素Aノックアウトマウスではバレルの形成が阻害されることが報告されていたが,正常な発達におけるセロトニンの生理的な役割は不明であった.そこで,セロトニンが出生の下流に位置しバレルの形成の開始を制御しているのではないかと考えた(図4).実際に,脳脊髄液においてセロトニンの濃度を測定したところ,出生ののちにセロトニン濃度は低下すること,および,早産によりセロトニン濃度の低下する時期は早まることを見い出した.この結果は,出生がセロトニンの濃度低下を制御していることを示唆している17).つづいて,セロトニンの濃度低下がバレルの形成開始を制御しているのかどうか検討した.まず,セロトニンの濃度低下の十分性について検討するため,セロトニンの合成を阻害してセロトニンの濃度低下を早期に生じさせたところ,バレルの形成の時期も早まることを見い出した.逆に,セロトニンの濃度低下の必要性について検討するため,セロトニンの分解を阻害したところ,バレルの形成時期に対する早産の効果が阻害された.これらの結果は,セロトニンの濃度低下が出生によるバレルの形成開始に必要かつ十分であることを示唆している17)(図4).
出生が体性感覚系における神経回路の形成を制御していることがわかったが,機能的な発達も出生により制御されているのかどうか検討した.そこで,出生ののちに発達する哺乳行動に注目した18).マウスの新生仔は出生の直後には乳首をみつけて吸いつき哺乳をはじめるまでに時間がかかるが,徐々に上達し短時間で哺乳できるようになる.この哺乳までの時間の短縮が出生により制御されているかどうか検討した.早産で生まれたマウスと正期産で生まれたマウスの哺乳までの時間短縮について検討したところ,早産で生まれた場合には時間短縮が促進されることを見い出した18).おもしろいことに,運動機能の指標である起きあがり反射は早産の影響をうけなかった.これらの結果は,哺乳行動の発達も出生により制御されていることを示唆している18).
体性感覚系をモデルとして見い出された,出生→セロトニンの濃度低下→神経回路の形成,という新たな制御機構が,ほかの神経回路の形成も制御する一般的な制御機構であるかどうかを検討した17).さきに述べたように,脳脊髄液におけるセロトニンの濃度は出生ののちに低下したが,脳脊髄液は脳のさまざまな部位にふれていることから,セロトニンの濃度の変化は脳のさまざまな部位に影響をあたえている可能性があると考えた.そこで,バレルと同様に出生の直後に形成され,モノアミン酸化酵素Aノックアウトマウスにおいて異常になる眼に特異的な軸索投射に着目した.成体では,右眼あるいは左眼に由来する眼球の網膜神経節細胞の軸索は,その投射先である外側膝状体において異なる領域に分離して投射しており,眼に特異的な軸索投射とよばれる.眼に特異的な軸索投射は出生の直後にはまだ完成しておらず,両眼に由来する網膜神経節細胞の軸索は外側膝状体において混在しているが,出生から10日ほどで右眼および左眼に由来する網膜神経節細胞の軸索は分離し眼に特異的な軸索投射が完成する.この眼に特異的な軸索投射の形成は早産により促進されること,さらに,セロトニンの濃度低下により促進されることが見い出された17).この結果は,出生からセロトニンの濃度低下にいたる制御機構が,視覚系における神経回路の形成も制御していることを意味している17)(図4).この制御機構が,さらに多くの脳領域における神経回路の形成を制御しているのか興味深い.
5.体性感覚神経系における神経の可塑性および臨界期の終了の制御
感覚神経系を用いた研究において,神経の可塑性あるいは臨界期の終了の制御の機構も注目をあつめている.体性感覚系では,ヒゲを傷害することにより1次体性感覚野のバレルに可塑的な変化をひき起こすことができ,これはヒゲの傷害によるバレルの可塑性とよばれる.すなわち,傷害したヒゲに対するバレルが縮小し,隣接するバレルが拡大する.このヒゲの傷害によるバレルの可塑性の機構にはいまだ不明な点が多いが,グルタミン酸輸送体1のノックアウトマウスにおいては,バレルの形成は正常であるがヒゲの傷害によるバレルの可塑性に異常のみられることが報告された19).また,グルタミン酸-アスパラギン酸輸送体のノックアウトマウスでもヒゲの傷害によるバレルの可塑性に異常がみられた19).これらの結果は,グルタミン酸輸送体がヒゲの傷害によるバレルの可塑性を亢進させていることを示唆している.
また,ヒゲの傷害によるバレルの可塑性は出生の直後の一時期においてみられ,この臨界期をすぎると誘発されない.このように,臨界期が終了するとヒゲの傷害によるバレルの可塑性が失われる機構も注目されており,バレルにおける神経伝達物質であるセロトニンやグルタミン酸の関与が検討された.セロトニン分解酵素であるモノアミン酸化酵素Aの阻害剤クロルギリンあるいはモノアミン酸化酵素Aノックアウトマウスを用いた解析では,臨界期の終了時期に影響はみられなかった20).また,大脳皮質の興奮性ニューロンに限定してNMDA型グルタミン酸受容体のNR1サブユニットを欠損するCxNR1ノックアウトマウスでも,臨界期は正常に終了していた21).これらの結果は,ヒゲの傷害によるバレルの可塑性における臨界期の終了時期はセロトニンやグルタミン酸により制御されていないことを示唆している.
視覚野では軸索再生阻害タンパク質であるNogoAおよびNogoB,また,その受容体が臨界期の終了を制御していることが報告された22).また,軸索再生阻害タンパク質としてほかにもMAGやOMgpなどのあることが知られていた.筆者らは,これらがオリゴデンドロサイトに共通して発現していることを利用し,オリゴデンドロサイトを除去することによりこれらの軸索再生阻害タンパク質の発現をまとめて阻害した23).オリゴデンドロサイトの発生に必須な転写因子Olig1のノックアウトマウスを解析したが,ヒゲの傷害によるバレルの可塑性における臨界期の終了時期は延長していなかった23).この結果は,ヒゲの傷害によるバレルの可塑性における臨界期の終了にはオリゴデンドロサイトは不要であることを示唆している23).このように,体性感覚系における臨界期の終了の機構には不明な点が多く,今後の解析が待たれる.
おわりに
このレビューでは,体性感覚系の発生および発達の過程に焦点をしぼり,最近の研究成果について紹介した.体性感覚系は,発達期における神経の可塑性,可塑性における臨界期,神経回路の形成における空間的および時間的な制御など,幅広い研究に用いられている.体性感覚系で得られた知見が,ほかの感覚神経系あるいはほかの脳領域にもあてはまるか,興味深い.脳領域ごとの機構の多様性や一般性も,今後の重要な研究テーマである.
文 献
- Erzurumlu, R. S. & Gaspar, P.: Development and critical period plasticity of the barrel cortex. Eur. J. Neurosci., 35, 1540-1553 (2012)[PubMed]
- Lopez-Bendito, G. & Molnar, Z.: Thalamocortical development: how are we going to get there? Nat. Rev. Neurosci., 4, 276-289 (2003)[PubMed]
- Sehara, K., Toda, T., Iwai, L. et al.: Whisker-related axonal patterns and plasticity of layer 2/3 neurons in the mouse barrel cortex. J. Neurosci., 30, 3082-3092 (2010)[PubMed]
- Sehara, K., Wakimoto, M., Ako, R. et al.: Distinct developmental principles underlie the formation of ipsilateral and contralateral whisker-related axonal patterns of layer 2/3 neurons in the barrel cortex. Neuroscience, 226, 289-304 (2012)[PubMed]
- Mizuno, H., Luo, W., Tarusawa, E. et al.: NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates. Neuron, 82, 365-379 (2014)[PubMed] [新着論文レビュー]
- Erzurumlu, R. S. & Kind, P. C.: Neural activity: sculptor of 'barrels' in the neocortex. Trends Neurosci., 24, 589-595 (2001)[PubMed]
- Rebsam, A. & Gaspar, P.: Presynaptic mechanisms controlling axon terminals remodeling in the thalamocortical and retinogeniculate systems. in Development and Plasticity in Sensory Thalamus and Cortex (Erzurumlu, R. S., Guido, W. & Molnar, Z. eds.), pp.183-207, Springer-Verlag, New York (2006)
- O'Leary, D. D., Ruff, N. L. & Dyck, R. H.: Development, critical period plasticity, and adult reorganizations of mammalian somatosensory systems. Curr. Opin. Neurobiol., 4, 535-544 (1994)[PubMed]
- Iwasato, T., Datwani, A., Wolf, A. M. et al.: Cortex-restricted disruption of NMDAR1 impairs neuronal patterns in the barrel cortex. Nature, 406, 726-731 (2000)[PubMed]
- Hannan, A. J., Blakemore, C., Katsnelson, A. et al.: PLC-β1, activated via mGluRs, mediates activity-dependent differentiation in cerebral cortex. Nat. Neurosci., 4, 282-288 (2001)[PubMed]
- Ince-Dunn, G., Hall, B. J., Hu, S. C. et al.: Regulation of thalamocortical patterning and synaptic maturation by NeuroD2. Neuron, 49, 683-695 (2006)[PubMed]
- Cases, O., Vitalis, T., Seif, I. et al.: Lack of barrels in the somatosensory cortex of monoamine oxidase A-deficient mice: role of a serotonin excess during the critical period. Neuron, 16, 297-307 (1996)[PubMed]
- Persico, A. M., Mengual, E., Moessner, R. et al.: Barrel pattern formation requires serotonin uptake by thalamocortical afferents, and not vesicular monoamine release. J. Neurosci., 21, 6862-6873 (2001)[PubMed]
- Salichon, N., Gaspar, P., Upton, A. L. et al.: Excessive activation of serotonin (5-HT) 1B receptors disrupts the formation of sensory maps in monoamine oxidase A and 5-HT transporter knock-out mice. J. Neurosci., 21, 884-896 (2001)[PubMed]
- Matsui, A., Tran, M., Yoshida, A. C. et al.: BTBD3 controls dendrite orientation toward active axons in mammalian neocortex. Science, 342, 1114-1118 (2013)[PubMed] [新着論文レビュー]
- Wakimoto, M., Sehara, K., Ebisu, H. et al.: Classic cadherins mediate selective intracortical circuit formation in the mouse neocortex. Cereb. Cortex, 25, 3535-3546 (2015)[PubMed]
- Toda, T., Homma, D., Tokuoka, H. et al.: Birth regulates the initiation of sensory map formation through serotonin signaling. Dev. Cell, 27, 32-46 (2013)[PubMed] [新着論文レビュー]
- Toda, T. & Kawasaki, H.: The development of suckling behavior of neonatal mice is regulated by birth. Mol. Brain, 7, 8 (2014)[PubMed]
- Takasaki, C., Okada, R., Mitani, A. et al.: Glutamate transporters regulate lesion-induced plasticity in the developing somatosensory cortex. J. Neurosci., 28, 4995-5006 (2008)[PubMed]
- Rebsam, A., Seif, I. & Gaspar, P.: Dissociating barrel development and lesion-induced plasticity in the mouse somatosensory cortex. J. Neurosci., 25, 706-710 (2005)[PubMed]
- Datwani, A., Iwasato, T., Itohara, S. et al.: Lesion-induced thalamocortical axonal plasticity in the S1 cortex is independent of NMDA receptor function in excitatory cortical neurons. J. Neurosci., 22, 9171-9175 (2002)[PubMed]
- McGee, A. W., Yang, Y., Fischer, Q. S. et al.: Experience-driven plasticity of visual cortex limited by myelin and Nogo receptor. Science, 309, 2222-2226 (2005)[PubMed]
- Toda, T., Hayakawa, I., Matsubayashi, Y. et al.: Termination of lesion-induced plasticity in the mouse barrel cortex in the absence of oligodendrocytes. Mol. Cell. Neurosci., 39, 40-49 (2008)[PubMed]
参考図書
Fox, K.: Barrel Cortex. Cambridge University Press, Cambridge (2008)
Erzurumlu, R. S., Guido, W. & Molnar, Z. (eds.): Development and Plasticity in Sensory Thalamus and Cortex. Springer-Verlag, New York (2006)
著者プロフィール
略歴:1998年 京都大学大学院医学研究科 修了,同年 京都大学再生医科学研究所 助手,2001年 同 講師,2002年 米国Duke大学 研究員,2004年 東京大学大学院医学系研究科 特任助教授を経て,2013年より金沢大学医薬保健研究域 教授.
研究テーマ:哺乳類における脳神経系の形成機構およびその異常がひき起こす病態.
研究室URL:http://square.umin.ac.jp/top/kawasaki/
© 2014 河崎 洋志 Licensed under CC 表示 2.1 日本