染色体の高次構造を介した遺伝子の発現制御とその破綻に起因する発生の異常および疾患
2015/01/14
武藤 彰彦
(広島大学大学院理学研究科 生物科学専攻発生生物学研究室)
email:武藤彰彦
領域融合レビュー, 4, e002 (2015) DOI: 10.7875/leading.author.4.e002
Akihiko Muto: Gene regulation mediated by higher-order chromosome structure and its implications for the pathogenesis of human diseases.

遺伝子発現の適切な制御は細胞の運命決定や機能制御において重要であり,その破綻は発生の異常や疾患などの原因になる.時期や組織など特定の状況のもとで遺伝子発現を制御する特異的なエンハンサーは,その多くが標的となるプロモーターから離れており,このエンハンサーとプロモーターとの長距離の相互作用には染色体の高次構造のダイナミックな変化が必要である.最近の研究から,コヒーシンやその機能制御タンパク質であるNIPBLが染色体においてループ構造の形成および維持に関与することが示され,染色体の高次構造を介した遺伝子発現の制御機構の実態が徐々に明らかにされてきた.このレビューでは,コヒーシンおよびNIPBLによる染色体の高次構造および遺伝子発現の制御機構に関する最近の知見,および,その機能の欠損にともなう発生の異常や疾患の分子機構について,おもに四肢の発生への影響を中心に,筆者らによる最近の成果をまじえ解説する.
遺伝子の発現制御とは狭義には転写制御をさし,遺伝子の機能を適切に発揮させるために重要な段階である.時期あるいは組織に特異的な遺伝子の発現制御はさまざまな細胞に個性と秩序をもたらし,多細胞生物としての生命の機能を維持するために必須である.転写制御の分子機構を単純化すれば,プロモーターにおけるエンハンサーと結合した転写因子によるRNAポリメラーゼの活性化,ということができる.四半世紀ほどまえには,関連する転写因子の発現の有無および組合せが,時期や組織に応じた遺伝子発現を説明するおもな(唯一の)手段であった.しかし,エピジェネティクスによる制御の発見や染色体の構造に対する理解の深まりにより,その考え方は一変した.いわゆるエピジェネティック制御とよばれるヒストンやDNAの修飾はクロマチンの構造を変化させ,転写制御にかかわるタンパク質の結合や活性化の状態に影響を及ぼす.転写にかかわるタンパク質としては,古典的な基本転写因子やエンハンサーなどに結合する転写因子にくわえ,ヒストン修飾酵素やクロマチンリモデリングタンパク質,転写伸長因子など,さまざまな転写共役因子がみつかっている.また,非コードRNAのはたらきも重要であることが示唆されている.こうしたさまざまな制御機構のなかで,筆者らは現在,染色体の高次構造の役割に興味をもち研究している.
染色体はけして静的なものではなく,その構造はダイナミックに変化する.その最たるものは分裂期の染色体の凝縮であろう.しかし,間期の核においても染色体はランダムに分布しているわけではなく,状況に応じて適切な配置あるいは高次構造をとるよう制御されている.間期における染色体の動態を直接的に可視化することは現在でもまだむずかしい.しかし,近年の生化学的あるいは分子生物学的な解析技術の進歩により,その構造を推測するに足るだけの多くの情報が提供されるようになってきた.染色体の高次構造の解析は,かつては蛍光in situハイブリダイゼーションによる特定の(少数の)遺伝子座を標的とした解析が主流であったが,染色体構造捕獲(chromosome conformation capture:3C)法の登場とその応用法の実現によりゲノムワイドかつ高解像度な解析が可能になった.その結果,染色体は直線的な単なる“ひも”ではなく,無数の長距離の相互作用を介した複雑かつ秩序だった構造体であることが明らかになってきた.また,クロマチン免疫沈降(chromatin immunoprecipitation:ChIP)法の発展により,染色体の高次構造の形成に関与するタンパク質の実態が解明されてきた.このような解析と従来からの遺伝学的あるいは発生生物学的な機能解析との組合せにより,染色体の高次構造の制御の生理的な意義が明らかにされつつある.
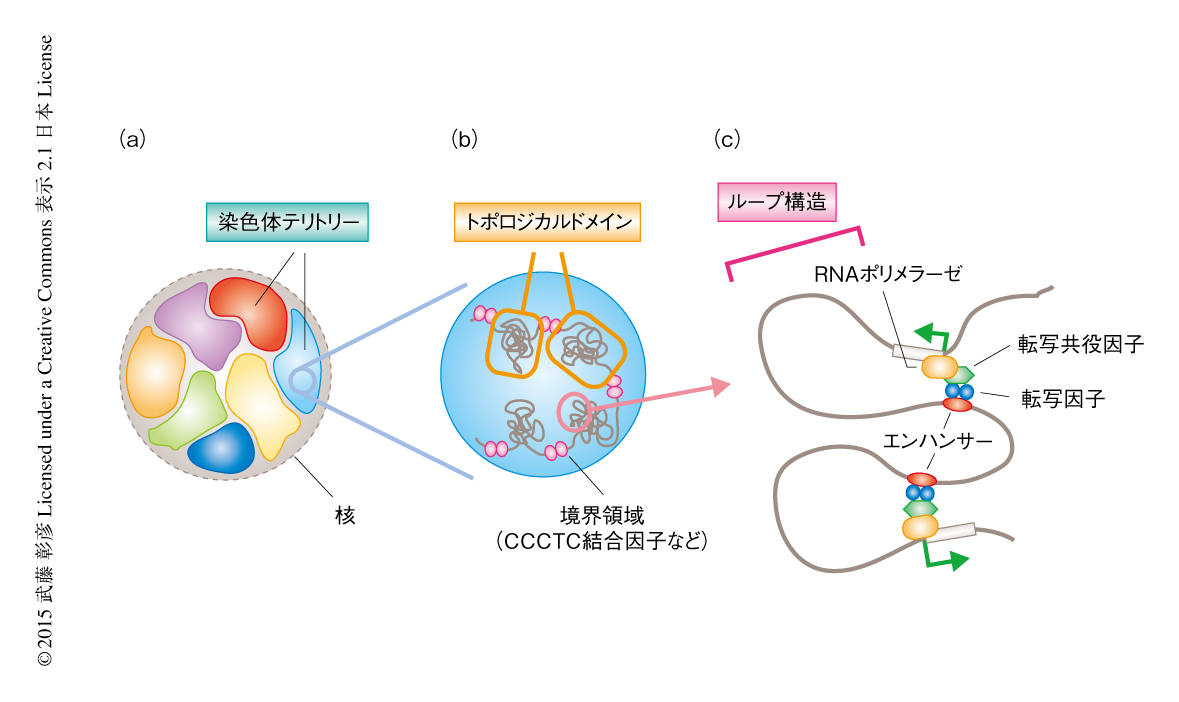
染色体の高次構造は階層的に制御されている(図1).それぞれの染色体は基本的に核において独立した空間にコンパクトに収められており,隣接する染色体とは領域を共有しない.これを染色体テリトリーとよぶ1).染色体テリトリーの内部の染色体は機能的に独立したMbサイズの領域に区分けされており,トポロジカルドメインと名づけられている2).トポロジカルドメインのあいだの境界領域には,インスレーター結合タンパク質であるCCCTC結合因子やtRNA遺伝子,ハウスキーピング遺伝子など,インスレーター(境界)としての機能をもつ因子が高密度に局在しており,隣接するトポロジカルドメインのあいだの物理的な相互作用を抑制し機能的な独立性を維持している.一方,染色体構造捕獲法の応用法を用いた解析から,トポロジカルドメインの内部にはより小規模な相互作用があり多数のループ構造が存在することが明らかになった2).トポロジカルドメインは生物種や細胞種などをこえて安定であり,染色体の高次構造をささえる基盤になっていると考えられている.これに対し,ループ構造には細胞種における特異性などの可塑性が認められること,また,その足場としてプロモーターやエンハンサーなどを含む領域が高頻度に使われていることなどから,ループ構造が時期あるいは組織に特異的な遺伝子の発現制御に重要であることが示唆された.最近の研究では,ループ構造の形成とそれを介した遺伝子の発現制御にコヒーシンやその関連タンパク質の関与することが明らかになってきた3,4).
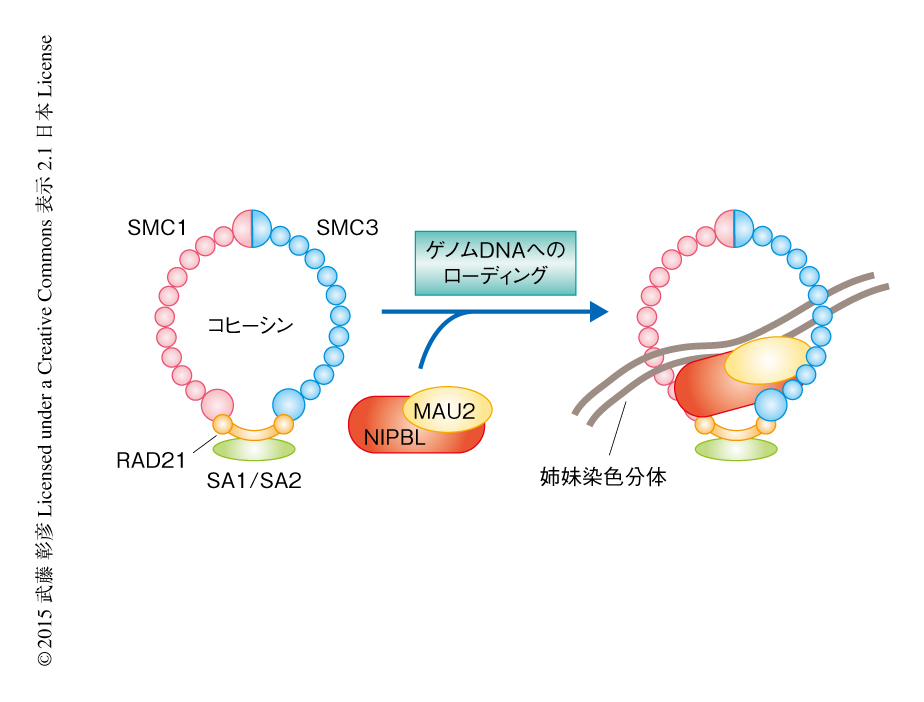
コヒーシンは4つのサブユニット,SMC1,SMC3,RAD21,SA1/SA2からなるリング状のタンパク質複合体である(図2).細胞分裂のときに姉妹染色分体をリングの内側に束ねる機能をもつと考えられており,複製された染色体が娘細胞に均等に分配されるよう制御している.コヒーシンの染色体への結合はコヒーシンローダーとよばれる,NIPBL/Scc2とMAU2/Scc4とのタンパク質複合体により制御されている(図2).いずれも生物種のあいだで高度に保存されており,細胞分裂において必須のはたらきをしている.コヒーシンの機能の欠損による細胞増殖の異常ががんの発症に関与するとの指摘があり,いくつかのがん細胞においてコヒーシンのサブユニットをコードする遺伝子やNIPBL遺伝子に変異や発現量の変化がみつかっている5).コヒーシンの機能不全にともなう染色体の不安定性が一因であるという説があるが6),染色体の異数性をともなわないケースもみつかっており5),その要因は明らかではない.
NIPBL遺伝子やコヒーシンサブユニットの遺伝子は遺伝子の発現制御にも関与しており,これが発生の過程において重要であることが明らかになってきている.ショウジョウバエのNipped変異体はcut遺伝子の発現の低下により翅の形態異常をひき起こすが,その原因遺伝子として同定されたNipped-B遺伝子はNIPBL遺伝子のショウジョウバエにおけるホモログである7).転写制御の機能は脊椎動物においても保存されており,NIPBLやコヒーシンサブユニットの機能の欠損によりひき起こされる,コヒーシン病とよばれるいくつかの先天性疾患ではそれらの遺伝子の発現に異常が認められている8).代表的なコヒーシン病であるCornelia de Lange症候群は,NIPBL遺伝子のハプロ不全変異(一部の軽症の患者では,コヒーシンサブユニットやコヒーシン制御タンパク質をコードする遺伝子の変異)に起因する疾患で,新生児1万人に約1人の割合で発症するといわれている.心臓,消化器官,四肢などさまざまな器官における形態的あるいは機能的な異常,成長阻害,精神遅滞など多岐にわたる症状を呈する9,10).患者に由来する細胞ではさまざまな遺伝子の発現量が変化しているが,姉妹染色分体の接着には顕著な異常が認められない.同様の結果は,筆者らが作製した,Cornelia de Lange症候群のモデル生物であるNipbl遺伝子ヘテロ変異マウス,および,Nipblの発現をアンチセンスモルフォリノオリゴヌクレオチドの導入によりノックダウンしたゼブラフィッシュの胚においても再現され,Cornelia de Lange症候群においてみられるさまざまな遺伝子の発現の変化や多様な表現型が,すべてNIPBLの部分的な機能の欠損により生じることが証明された11-13).では,NIPBLあるいはコヒーシンはどのようにして遺伝子発現を制御しているのだろうか?
NIPBLやコヒーシンによる遺伝子発現の制御機構については諸説があり,いまだはっきりとしていない.これまでのさまざまな知見からは,複数の異なる分子機構の存在が示唆されている.
もっともはじめに提唱されたのは,染色体の高次構造を介した制御機構である.さきに述べた,ショウジョウバエの翅の発生に重要なcut遺伝子の発現は,その約85 kb上流にある翅に特異的なエンハンサーにより制御されており,Nipped-Bはこのエンハンサーとプロモーターとの長距離の相互作用において重要であることが示された7).哺乳動物の細胞においては,グロビン14) やプロトカドヘリン15) などの遺伝子の発現やその遺伝子座の周辺の高次構造の形成にコヒーシンに対する依存性のあることが報告されている.
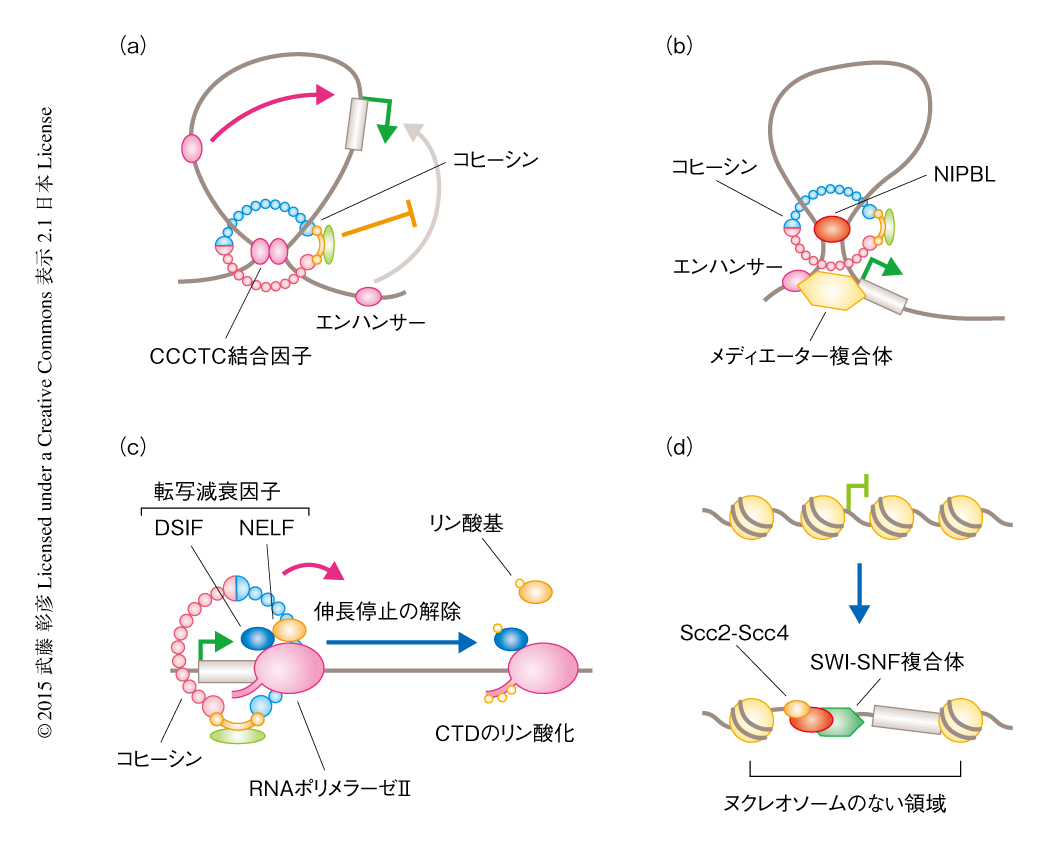
NIPBLやコヒーシンの染色体の高次構造の制御への関与は,インスレーター結合タンパク質であるCCCTC結合因子や転写共役因子であるメディエーター複合体などとの協調的な作用によっても支持されている.クロマチン免疫沈降法によるゲノムワイドな解析により,NIPBLおよびコヒーシンとも染色体にランダムに結合しているわけではなく,活発に転写される遺伝子の転写開始点の近傍など,特定の領域に濃縮される傾向が認められた.コヒーシンの結合パターンはCCCTC結合因子のゲノムにおける局在と類似しており,生化学的な解析の結果とあわせて,コヒーシンとCCCTC結合因子とが染色体において高頻度に共局在し相互作用していることが示された16,17).この相互作用は機能的であり,コヒーシン(によるループ構造の形成)がインスレーター活性の実態を担うこと,コヒーシンはCCCTC結合因子との相互作用をとおしてインスレーター活性を発揮すべき適切な場所に配置されること,などが明らかにされた(図3a).またES細胞を用いた解析により,メディエーター複合体がコヒーシン,NIPBL,RNAポリメラーゼIIなどとプロモーターやエンハンサーにおいて共局在し,ループ構造の形成を介してES細胞の未分化性の維持にかかわる遺伝子の発現を制御していることが報告された18)(図3b).のちに述べるように,メディエーター複合体との相互作用は,ES細胞のみならず,個体の発生の過程における組織に特異的な遺伝子の発現制御においても重要な役割をはたしていると考えられる13).
こうした染色体における共局在や相互作用が明らかにされる一方,これらのタンパク質の役割は必ずしも重複していないことが示唆されている.コヒーシンの局在とCCCTC結合因子の局在はゲノムの広い領域において重複しているが,遺伝子発現や染色体の領域のあいだの相互作用におけるはたらきには違いが認められる.その機能差はトポロジカルドメインの形成においてとくに顕著で,どちらもトポロジカルドメインの境界部分に結合するにもかかわらず,境界の形成にはCCCTC結合因子のみが関与している19).また,コヒーシン,メディエーター,NIPBLの共局在の領域が,コヒーシンとCCCTC結合因子の共局在の領域とは大きく異なっていること18),NIPBLがコヒーシンに非依存的に染色体との結合や遺伝子の発現制御を行うことなども報告されている20).これらの結果は,NIPBLやコヒーシンを含む複数の(機能的に)異なる転写制御複合体が存在し,それらが状況に応じて使い分けられている可能性を示唆する.NIPBLの変異による病態とコヒーシンの変異による病態が必ずしも一致しないこととも関係があるのかもしれない.
さらに最近では,新たな転写制御機構への関与も明らかになってきた.ショウジョウバエを用いた解析では,コヒーシンが結合する遺伝子の多くでRNAポリメラーゼIIによる転写伸長の一時停止が認められており,この一時停止の解除にはコヒーシンが必要である21)(図3c).また,酵母ではSWI-SNFクロマチンリモデリング複合体による,転写制御にかかわる領域に高頻度に認められるヌクレオソームのない領域の形成や遺伝子の発現制御に,Scc2-Scc4コヒーシンローダーとの相互作用が必要であることが示された22)(図3d).RNAポリメラーゼIIの一時停止やSWI-SNF複合体によるクロマチンのリモデリングは生物種のあいだで広く利用される転写制御機構であるが,Nipblやコヒーシンの関与が脊椎動物においても保存されているかどうかは今後の研究を待たなくてはならない.
培養細胞を用いた生化学的あるいは分子生物学的な解析は,NIPBLやコヒーシンによる遺伝子の発現制御の分子機構について多大な知見をもたらした.しかし,Cornelia de Lange症候群にみられるように個体レベルへの影響は多様であり,実際の発生の異常においてどのような遺伝子が関与しているのか,また,その制御においてどのようなタンパク質と相互作用するのか,などについては多くの点が明らかにされていない.一方,筆者らは,NIPBLのノックダウンによる個体レベルでの表現型と,そこで影響をうける遺伝子との因果関係に着目し,モデル生物の個体を用い解析してきた11-13).これらの知見を組み合わせることにより,NIPBLおよびコヒーシンによる発生の制御機構の実態が分子レベルにおいて少しずつ明らかにされてきている.以下,最近,筆者らが研究している四肢の発生を例として解説する.
脊椎動物の四肢の発生は発生生物学や進化生物学の分野において古くから研究されており,その分子機構に関しては膨大な知見が蓄積している.また,魚類および両生類は高い再生能をもつことから,最近では,再生の研究の有用なモデルになるなどふたたび脚光をあびている.陸上の四足動物である哺乳類や鳥類の手(翼)および足(脚)と魚類の対鰭(左右1対のヒレで,胸ビレと腹ビレ)とは,形態的には大きく異なるが進化的には共通の起源をもつ.このことは,分子レベルの解析において明確に示され,とくに,発生の初期における肢芽(四肢やヒレの原基)の形成の過程は,その制御機構も含め非常によく似ている23).四肢の異常はCornelia de Lange症候群のもっとも顕著な症状のひとつであり,患者の多くは生まれながらに腕,足,指など四肢になんらかの欠損をもつ.症状の程度は患者によりさまざまであるが,とくにNIPBLに変異をもつ患者の一部では腕の遠位部を大きく欠損するような重篤な症状も認められる.同様の異常は,筆者らがCornelia de Lange症候群のモデルとして作製したNipblをノックダウンしたゼブラフィッシュの胚においても認められており13),生物種をこえて保存された四肢の発生の制御機構にNIPBLが重要な役割をはたしていることが示唆される.
肢芽は側板中胚葉に由来する間葉系の組織とそれをおおう外胚葉性の上皮からなる器官で,体幹部からのレチノイン酸シグナルにより分化が誘導される.四肢形成の初期の段階では間葉系細胞の増殖により外側にむかって伸長するが,その増殖は外胚葉性頂堤とよばれる先端部の上皮組織からのFgfシグナルに依存している(図4a).一方,外胚葉性頂堤におけるfgf遺伝子の発現は間葉系細胞からのSHHシグナルやFGF10シグナルにより誘導されているが,これらの遺伝子や,その発現制御をつかさどるHOXDやTBX5などの転写因子も肢芽の発生には重要である(図4b).
HoxD遺伝子群やShh遺伝子は肢芽のほかさまざまな部位においても発現しているが,肢芽に特異的な発現はそれらの遺伝子から離れた領域にあるエンハンサーにより制御されていることが知られている.Hox遺伝子群は染色体においてクラスターを形成しており(図5a),すべての遺伝子は同一の方向に転写される24).クラスターの上流側に位置する遺伝子を5’-hox遺伝子,下流側に位置する遺伝子を3’-hox遺伝子とよび,5’側に近い遺伝子ほど大きな番号がつけられている(たとえば,マウスのHoxDクラスターでは,もっとも上流(5’側)にHoxd13遺伝子,もっとも下流(3’側)にHoxd1遺伝子が位置する).共通の祖先遺伝子からゲノムの倍化により複数の遺伝子クラスターが形成されたと考えられており25),哺乳動物ではHoxA~HoxDの4種類,ゼブラフィッシュなどの硬骨魚類では7種類(ゼブラフィッシュでは,HoxDが1つ,それ以外がすべて2組)の遺伝子クラスターが存在する.クラスターのすべての遺伝子はエンハンサーの共有により連携して(非独立的に)制御されており,遺伝子の相対的な位置と発現の時間的および空間的なパターンとのあいだにみられる相関性が前後軸や四肢のパターン形成に重要である.Hox遺伝子群の肢芽に特異的な発現は,遺伝子クラスターに隣接した遺伝子の密度の低い領域に存在するエンハンサーとのループ構造を介した遠距離の相互作用により制御されている.これに対し,体幹部(神経系の組織)における発現に関与するエンハンサーは,遺伝子クラスターの内部の遺伝子の近傍に局在することが知られている(図5b).Hox遺伝子群の組織の特異的な発現の制御機構の詳細については多くの総説があるので,そちらを参照されたい24,26).
一方,Shh遺伝子の肢芽における発現においても染色体の高次構造が関与している.Shh遺伝子の肢芽に特異的なエンハンサーは隣接するLmbr1遺伝子のイントロンに存在するが,哺乳類の場合,その距離は約1 Mbである.マウスの肢芽の細胞を用いた3次元の蛍光in situハイブリダイゼーションによる解析により,エンハンサーとプロモーターがループ構造を介して物理的に相互作用していることが示されている27).
四肢の欠損はCornelia de Lange症候群における代表的な症状のひとつであるが,その発症機構の詳細は明らかでなかった.筆者らは,ゼブラフィッシュをモデルとしてNipblによる四肢の発生の制御機構の解明を試みた13).ゼブラフィッシュにおいては前肢(胸ビレ)の発生の過程が分子レベルで詳細に解析されており28),また,その制御機構も哺乳動物との共通性が高いことから,Nipblによる四肢の形成機構の解析に非常に有用である.
ゼブラフィッシュの胚では,肢芽の成長は受精後30時間ごろから観察され,受精後72時間ごろにはみた目にも明らかなヒレの形態をとるようになる.ほかの脊椎動物と同様に,肢芽の成長は間葉系細胞の増殖をともない,その制御には外胚葉性頂堤からのFgfシグナルが必要である.外胚葉性頂堤におけるfgf遺伝子の発現に必要なshh遺伝子やfgf10遺伝子の発現は,異なる遺伝子カスケードの下流において制御されており,shh遺伝子の制御にはhand2遺伝子やhoxd遺伝子が,fgf10遺伝子の制御にはtbx5遺伝子やfgf24遺伝子が関与する.Nipblをノックダウンした胚においては肢芽の成長にいちじるしい遅延が認められ,間葉系細胞の増殖の低下とそれにともなう細胞数の減少が観察された.既存の情報をもとに,さきに述べた肢芽の発生に関連する遺伝子の発現について解析したところ,間葉系細胞におけるHoxd-Hand2-Shh経路の遺伝子の発現,および,外胚葉性頂堤におけるfgf遺伝子の発現が顕著に低下していた(図4b).HoxD遺伝子群やShh遺伝子の肢芽における発現はNipbl変異マウスでも低下しており13),また,HoxD遺伝子群やShh遺伝子の変異マウスではCornelia de Lange症候群のような四肢の短縮が認められたことから29-31),Hoxd遺伝子群,Hand2遺伝子,Shh遺伝子などがCornelia de Lange症候群における肢芽の欠損にかかわる重要な制御点である可能性が示唆された.
Nipblをノックダウンした胚の肢芽においてはhoxd遺伝子群の発現が非常に特徴的な影響をうけていた13)(図5a).ゼブラフィッシュのhoxdクラスターに含まれる7つの遺伝子はすべてNipblの制御下にあった.Nipblのノックダウンによる影響はクラスターにおける遺伝子の相対位置と関連しており,肢芽の発生に重要な5’-hoxd遺伝子(hoxd9遺伝子~hoxd13遺伝子)の発現がすべて低下していたのに対し,下流側に位置する3’-hoxd遺伝子(hoxd3遺伝子およびhoxd4遺伝子)では発現の顕著な上昇が認められた.また,Nipblのノックダウンの影響は肢芽に特異的であり,遺伝子クラスターの内部のエンハンサーにより制御される体幹部における発現には影響を及ぼさなかった.さらに,3次元の蛍光in situハイブリダイゼーションによる解析により,hoxdクラスターの周辺の高次構造がNipblに依存していることをより直接的に証明することにも成功した13).以上のすべての結果は,Nipblがエンハンサーとプロモーターとのあいだの相互作用を介して遺伝子発現を制御するという仮説と一致した(図5b).興味深いことに,hoxdクラスターにおいてみられた5’-hox遺伝子の発現抑制と3’-hox遺伝子の発現上昇という位置に特異的な影響は,肢芽に発現するhoxaクラスターやhoxcクラスターにおいても認められた13)(図5a).これは,Nipblによる染色体の高次構造を介した発現制御機構が,異なるhoxクラスターにも普遍的に保存された共通の機構である可能性を示唆した.いくつかのhox遺伝子群の発現はShhの下流においてフィードバックにより制御されることが示唆されており,Nipblによるshh遺伝子の制御の可能性も考えられた.しかし,Shhシグナルの阻害剤により処理した胚における肢芽にかかわる遺伝子の発現の変化はNipblをノックダウンした胚の結果とは異なっており,少なくとも,肢芽の発生への影響という点においては主要な標的ではないと予想された13).
Nipblはさまざまなタンパク質と協調して遺伝子発現を制御していることはすでに述べた.では,肢芽の発生やhox遺伝子の発現制御においてはどのような分子機構が関与しているのだろうか? 筆者らの研究では,少なくとも,メディエーター複合体との協働作用が重要であることが明らかにされた13).メディエーター複合体のサブユニットのひとつであるMed12の発現をノックダウンしたゼブラフィッシュの胚では,Nipblをノックダウンした胚と同様に,胸ビレの顕著な萎縮がみられた.肢芽の発生にかかわる遺伝子の発現への影響や,3次元の蛍光in situハイブリダイゼーション法によるhoxdクラスターの周辺の高次構造の解析などは,すべて,Nipblをノックダウンしたときと同様の結果を示した(図4b,図5).メディエーター複合体とNipblとの相互作用は,ES細胞では示されていたものの,個体においては明らかにされておらず,筆者らの研究がin vivoにおけるはじめての証明になった.
一方,Nipblのパートナーとしてもっとも有名なコヒーシンであるが,そのサブユニットであるRad21をノックダウンしたところ,遺伝子発現への影響などはNipblあるいはMed12をノックダウンした胚の結果とは必ずしも一致しなかった13).コヒーシンの変異に起因するタイプのCornelia de Lange症候群は全体的に症状が軽く四肢に対する顕著な影響がみられないことが知られており,これとなんらかの関連があるのかもしれない.
染色体の高次構造の制御は遺伝子の時期あるいは組織における特異的な発現を実現する重要な機構のひとつである.コヒーシンとの関連づけによりその分子機構の理解が大きく進み,さらに,Cornelia de Lange症候群のようなコヒーシン病の発症機構の解明にも一定の貢献があったことは,ここ10年ほどの大きな成果であるといえる.その一方,染色体の領域のあいだの相互作用の形成やその特異性の決定に関する分子機構については,現時点でもほとんどわかっていない.染色体の特定の領域どうし,たとえば,エンハンサーとその標的となるプロモーターは,どのようにして互いを認識するのか? ダイナミックな染色体の高次構造の変化をささえる動力は何か? そこには当然,コヒーシンやNIPBLなども関連してくるだろう.今後,1細胞レベルでの解析技術や生細胞における染色体の可視化技術などの向上により,こうした分子機構がさらに明らかにされると予想される.まだまだ興味のつきない分野である.
略歴:1995年 東京大学大学院理学系研究科 修了,同年 東京大学医科学研究所 博士研究員,2007年 米国California大学Irvine校Project Scientistを経て,2013年より広島大学大学院理学研究科 特任助教.
研究テーマ:染色体の構造と遺伝子発現,および,それに関連した疾患の発症の機構.
© 2015 武藤 彰彦 Licensed under CC 表示 2.1 日本
(広島大学大学院理学研究科 生物科学専攻発生生物学研究室)
email:武藤彰彦
領域融合レビュー, 4, e002 (2015) DOI: 10.7875/leading.author.4.e002
Akihiko Muto: Gene regulation mediated by higher-order chromosome structure and its implications for the pathogenesis of human diseases.
要 約
遺伝子発現の適切な制御は細胞の運命決定や機能制御において重要であり,その破綻は発生の異常や疾患などの原因になる.時期や組織など特定の状況のもとで遺伝子発現を制御する特異的なエンハンサーは,その多くが標的となるプロモーターから離れており,このエンハンサーとプロモーターとの長距離の相互作用には染色体の高次構造のダイナミックな変化が必要である.最近の研究から,コヒーシンやその機能制御タンパク質であるNIPBLが染色体においてループ構造の形成および維持に関与することが示され,染色体の高次構造を介した遺伝子発現の制御機構の実態が徐々に明らかにされてきた.このレビューでは,コヒーシンおよびNIPBLによる染色体の高次構造および遺伝子発現の制御機構に関する最近の知見,および,その機能の欠損にともなう発生の異常や疾患の分子機構について,おもに四肢の発生への影響を中心に,筆者らによる最近の成果をまじえ解説する.
はじめに
遺伝子の発現制御とは狭義には転写制御をさし,遺伝子の機能を適切に発揮させるために重要な段階である.時期あるいは組織に特異的な遺伝子の発現制御はさまざまな細胞に個性と秩序をもたらし,多細胞生物としての生命の機能を維持するために必須である.転写制御の分子機構を単純化すれば,プロモーターにおけるエンハンサーと結合した転写因子によるRNAポリメラーゼの活性化,ということができる.四半世紀ほどまえには,関連する転写因子の発現の有無および組合せが,時期や組織に応じた遺伝子発現を説明するおもな(唯一の)手段であった.しかし,エピジェネティクスによる制御の発見や染色体の構造に対する理解の深まりにより,その考え方は一変した.いわゆるエピジェネティック制御とよばれるヒストンやDNAの修飾はクロマチンの構造を変化させ,転写制御にかかわるタンパク質の結合や活性化の状態に影響を及ぼす.転写にかかわるタンパク質としては,古典的な基本転写因子やエンハンサーなどに結合する転写因子にくわえ,ヒストン修飾酵素やクロマチンリモデリングタンパク質,転写伸長因子など,さまざまな転写共役因子がみつかっている.また,非コードRNAのはたらきも重要であることが示唆されている.こうしたさまざまな制御機構のなかで,筆者らは現在,染色体の高次構造の役割に興味をもち研究している.
染色体はけして静的なものではなく,その構造はダイナミックに変化する.その最たるものは分裂期の染色体の凝縮であろう.しかし,間期の核においても染色体はランダムに分布しているわけではなく,状況に応じて適切な配置あるいは高次構造をとるよう制御されている.間期における染色体の動態を直接的に可視化することは現在でもまだむずかしい.しかし,近年の生化学的あるいは分子生物学的な解析技術の進歩により,その構造を推測するに足るだけの多くの情報が提供されるようになってきた.染色体の高次構造の解析は,かつては蛍光in situハイブリダイゼーションによる特定の(少数の)遺伝子座を標的とした解析が主流であったが,染色体構造捕獲(chromosome conformation capture:3C)法の登場とその応用法の実現によりゲノムワイドかつ高解像度な解析が可能になった.その結果,染色体は直線的な単なる“ひも”ではなく,無数の長距離の相互作用を介した複雑かつ秩序だった構造体であることが明らかになってきた.また,クロマチン免疫沈降(chromatin immunoprecipitation:ChIP)法の発展により,染色体の高次構造の形成に関与するタンパク質の実態が解明されてきた.このような解析と従来からの遺伝学的あるいは発生生物学的な機能解析との組合せにより,染色体の高次構造の制御の生理的な意義が明らかにされつつある.
1.間期の核における染色体の高次構造
染色体の高次構造は階層的に制御されている(図1).それぞれの染色体は基本的に核において独立した空間にコンパクトに収められており,隣接する染色体とは領域を共有しない.これを染色体テリトリーとよぶ1).染色体テリトリーの内部の染色体は機能的に独立したMbサイズの領域に区分けされており,トポロジカルドメインと名づけられている2).トポロジカルドメインのあいだの境界領域には,インスレーター結合タンパク質であるCCCTC結合因子やtRNA遺伝子,ハウスキーピング遺伝子など,インスレーター(境界)としての機能をもつ因子が高密度に局在しており,隣接するトポロジカルドメインのあいだの物理的な相互作用を抑制し機能的な独立性を維持している.一方,染色体構造捕獲法の応用法を用いた解析から,トポロジカルドメインの内部にはより小規模な相互作用があり多数のループ構造が存在することが明らかになった2).トポロジカルドメインは生物種や細胞種などをこえて安定であり,染色体の高次構造をささえる基盤になっていると考えられている.これに対し,ループ構造には細胞種における特異性などの可塑性が認められること,また,その足場としてプロモーターやエンハンサーなどを含む領域が高頻度に使われていることなどから,ループ構造が時期あるいは組織に特異的な遺伝子の発現制御に重要であることが示唆された.最近の研究では,ループ構造の形成とそれを介した遺伝子の発現制御にコヒーシンやその関連タンパク質の関与することが明らかになってきた3,4).
2.コヒーシンと疾患
コヒーシンは4つのサブユニット,SMC1,SMC3,RAD21,SA1/SA2からなるリング状のタンパク質複合体である(図2).細胞分裂のときに姉妹染色分体をリングの内側に束ねる機能をもつと考えられており,複製された染色体が娘細胞に均等に分配されるよう制御している.コヒーシンの染色体への結合はコヒーシンローダーとよばれる,NIPBL/Scc2とMAU2/Scc4とのタンパク質複合体により制御されている(図2).いずれも生物種のあいだで高度に保存されており,細胞分裂において必須のはたらきをしている.コヒーシンの機能の欠損による細胞増殖の異常ががんの発症に関与するとの指摘があり,いくつかのがん細胞においてコヒーシンのサブユニットをコードする遺伝子やNIPBL遺伝子に変異や発現量の変化がみつかっている5).コヒーシンの機能不全にともなう染色体の不安定性が一因であるという説があるが6),染色体の異数性をともなわないケースもみつかっており5),その要因は明らかではない.
NIPBL遺伝子やコヒーシンサブユニットの遺伝子は遺伝子の発現制御にも関与しており,これが発生の過程において重要であることが明らかになってきている.ショウジョウバエのNipped変異体はcut遺伝子の発現の低下により翅の形態異常をひき起こすが,その原因遺伝子として同定されたNipped-B遺伝子はNIPBL遺伝子のショウジョウバエにおけるホモログである7).転写制御の機能は脊椎動物においても保存されており,NIPBLやコヒーシンサブユニットの機能の欠損によりひき起こされる,コヒーシン病とよばれるいくつかの先天性疾患ではそれらの遺伝子の発現に異常が認められている8).代表的なコヒーシン病であるCornelia de Lange症候群は,NIPBL遺伝子のハプロ不全変異(一部の軽症の患者では,コヒーシンサブユニットやコヒーシン制御タンパク質をコードする遺伝子の変異)に起因する疾患で,新生児1万人に約1人の割合で発症するといわれている.心臓,消化器官,四肢などさまざまな器官における形態的あるいは機能的な異常,成長阻害,精神遅滞など多岐にわたる症状を呈する9,10).患者に由来する細胞ではさまざまな遺伝子の発現量が変化しているが,姉妹染色分体の接着には顕著な異常が認められない.同様の結果は,筆者らが作製した,Cornelia de Lange症候群のモデル生物であるNipbl遺伝子ヘテロ変異マウス,および,Nipblの発現をアンチセンスモルフォリノオリゴヌクレオチドの導入によりノックダウンしたゼブラフィッシュの胚においても再現され,Cornelia de Lange症候群においてみられるさまざまな遺伝子の発現の変化や多様な表現型が,すべてNIPBLの部分的な機能の欠損により生じることが証明された11-13).では,NIPBLあるいはコヒーシンはどのようにして遺伝子発現を制御しているのだろうか?
3.NIPBLあるいはコヒーシンによる遺伝子発現の制御機構
NIPBLやコヒーシンによる遺伝子発現の制御機構については諸説があり,いまだはっきりとしていない.これまでのさまざまな知見からは,複数の異なる分子機構の存在が示唆されている.
もっともはじめに提唱されたのは,染色体の高次構造を介した制御機構である.さきに述べた,ショウジョウバエの翅の発生に重要なcut遺伝子の発現は,その約85 kb上流にある翅に特異的なエンハンサーにより制御されており,Nipped-Bはこのエンハンサーとプロモーターとの長距離の相互作用において重要であることが示された7).哺乳動物の細胞においては,グロビン14) やプロトカドヘリン15) などの遺伝子の発現やその遺伝子座の周辺の高次構造の形成にコヒーシンに対する依存性のあることが報告されている.
NIPBLやコヒーシンの染色体の高次構造の制御への関与は,インスレーター結合タンパク質であるCCCTC結合因子や転写共役因子であるメディエーター複合体などとの協調的な作用によっても支持されている.クロマチン免疫沈降法によるゲノムワイドな解析により,NIPBLおよびコヒーシンとも染色体にランダムに結合しているわけではなく,活発に転写される遺伝子の転写開始点の近傍など,特定の領域に濃縮される傾向が認められた.コヒーシンの結合パターンはCCCTC結合因子のゲノムにおける局在と類似しており,生化学的な解析の結果とあわせて,コヒーシンとCCCTC結合因子とが染色体において高頻度に共局在し相互作用していることが示された16,17).この相互作用は機能的であり,コヒーシン(によるループ構造の形成)がインスレーター活性の実態を担うこと,コヒーシンはCCCTC結合因子との相互作用をとおしてインスレーター活性を発揮すべき適切な場所に配置されること,などが明らかにされた(図3a).またES細胞を用いた解析により,メディエーター複合体がコヒーシン,NIPBL,RNAポリメラーゼIIなどとプロモーターやエンハンサーにおいて共局在し,ループ構造の形成を介してES細胞の未分化性の維持にかかわる遺伝子の発現を制御していることが報告された18)(図3b).のちに述べるように,メディエーター複合体との相互作用は,ES細胞のみならず,個体の発生の過程における組織に特異的な遺伝子の発現制御においても重要な役割をはたしていると考えられる13).
こうした染色体における共局在や相互作用が明らかにされる一方,これらのタンパク質の役割は必ずしも重複していないことが示唆されている.コヒーシンの局在とCCCTC結合因子の局在はゲノムの広い領域において重複しているが,遺伝子発現や染色体の領域のあいだの相互作用におけるはたらきには違いが認められる.その機能差はトポロジカルドメインの形成においてとくに顕著で,どちらもトポロジカルドメインの境界部分に結合するにもかかわらず,境界の形成にはCCCTC結合因子のみが関与している19).また,コヒーシン,メディエーター,NIPBLの共局在の領域が,コヒーシンとCCCTC結合因子の共局在の領域とは大きく異なっていること18),NIPBLがコヒーシンに非依存的に染色体との結合や遺伝子の発現制御を行うことなども報告されている20).これらの結果は,NIPBLやコヒーシンを含む複数の(機能的に)異なる転写制御複合体が存在し,それらが状況に応じて使い分けられている可能性を示唆する.NIPBLの変異による病態とコヒーシンの変異による病態が必ずしも一致しないこととも関係があるのかもしれない.
さらに最近では,新たな転写制御機構への関与も明らかになってきた.ショウジョウバエを用いた解析では,コヒーシンが結合する遺伝子の多くでRNAポリメラーゼIIによる転写伸長の一時停止が認められており,この一時停止の解除にはコヒーシンが必要である21)(図3c).また,酵母ではSWI-SNFクロマチンリモデリング複合体による,転写制御にかかわる領域に高頻度に認められるヌクレオソームのない領域の形成や遺伝子の発現制御に,Scc2-Scc4コヒーシンローダーとの相互作用が必要であることが示された22)(図3d).RNAポリメラーゼIIの一時停止やSWI-SNF複合体によるクロマチンのリモデリングは生物種のあいだで広く利用される転写制御機構であるが,Nipblやコヒーシンの関与が脊椎動物においても保存されているかどうかは今後の研究を待たなくてはならない.
4.四肢の発生の過程と遺伝子の発現制御
培養細胞を用いた生化学的あるいは分子生物学的な解析は,NIPBLやコヒーシンによる遺伝子の発現制御の分子機構について多大な知見をもたらした.しかし,Cornelia de Lange症候群にみられるように個体レベルへの影響は多様であり,実際の発生の異常においてどのような遺伝子が関与しているのか,また,その制御においてどのようなタンパク質と相互作用するのか,などについては多くの点が明らかにされていない.一方,筆者らは,NIPBLのノックダウンによる個体レベルでの表現型と,そこで影響をうける遺伝子との因果関係に着目し,モデル生物の個体を用い解析してきた11-13).これらの知見を組み合わせることにより,NIPBLおよびコヒーシンによる発生の制御機構の実態が分子レベルにおいて少しずつ明らかにされてきている.以下,最近,筆者らが研究している四肢の発生を例として解説する.
脊椎動物の四肢の発生は発生生物学や進化生物学の分野において古くから研究されており,その分子機構に関しては膨大な知見が蓄積している.また,魚類および両生類は高い再生能をもつことから,最近では,再生の研究の有用なモデルになるなどふたたび脚光をあびている.陸上の四足動物である哺乳類や鳥類の手(翼)および足(脚)と魚類の対鰭(左右1対のヒレで,胸ビレと腹ビレ)とは,形態的には大きく異なるが進化的には共通の起源をもつ.このことは,分子レベルの解析において明確に示され,とくに,発生の初期における肢芽(四肢やヒレの原基)の形成の過程は,その制御機構も含め非常によく似ている23).四肢の異常はCornelia de Lange症候群のもっとも顕著な症状のひとつであり,患者の多くは生まれながらに腕,足,指など四肢になんらかの欠損をもつ.症状の程度は患者によりさまざまであるが,とくにNIPBLに変異をもつ患者の一部では腕の遠位部を大きく欠損するような重篤な症状も認められる.同様の異常は,筆者らがCornelia de Lange症候群のモデルとして作製したNipblをノックダウンしたゼブラフィッシュの胚においても認められており13),生物種をこえて保存された四肢の発生の制御機構にNIPBLが重要な役割をはたしていることが示唆される.
肢芽は側板中胚葉に由来する間葉系の組織とそれをおおう外胚葉性の上皮からなる器官で,体幹部からのレチノイン酸シグナルにより分化が誘導される.四肢形成の初期の段階では間葉系細胞の増殖により外側にむかって伸長するが,その増殖は外胚葉性頂堤とよばれる先端部の上皮組織からのFgfシグナルに依存している(図4a).一方,外胚葉性頂堤におけるfgf遺伝子の発現は間葉系細胞からのSHHシグナルやFGF10シグナルにより誘導されているが,これらの遺伝子や,その発現制御をつかさどるHOXDやTBX5などの転写因子も肢芽の発生には重要である(図4b).
HoxD遺伝子群やShh遺伝子は肢芽のほかさまざまな部位においても発現しているが,肢芽に特異的な発現はそれらの遺伝子から離れた領域にあるエンハンサーにより制御されていることが知られている.Hox遺伝子群は染色体においてクラスターを形成しており(図5a),すべての遺伝子は同一の方向に転写される24).クラスターの上流側に位置する遺伝子を5’-hox遺伝子,下流側に位置する遺伝子を3’-hox遺伝子とよび,5’側に近い遺伝子ほど大きな番号がつけられている(たとえば,マウスのHoxDクラスターでは,もっとも上流(5’側)にHoxd13遺伝子,もっとも下流(3’側)にHoxd1遺伝子が位置する).共通の祖先遺伝子からゲノムの倍化により複数の遺伝子クラスターが形成されたと考えられており25),哺乳動物ではHoxA~HoxDの4種類,ゼブラフィッシュなどの硬骨魚類では7種類(ゼブラフィッシュでは,HoxDが1つ,それ以外がすべて2組)の遺伝子クラスターが存在する.クラスターのすべての遺伝子はエンハンサーの共有により連携して(非独立的に)制御されており,遺伝子の相対的な位置と発現の時間的および空間的なパターンとのあいだにみられる相関性が前後軸や四肢のパターン形成に重要である.Hox遺伝子群の肢芽に特異的な発現は,遺伝子クラスターに隣接した遺伝子の密度の低い領域に存在するエンハンサーとのループ構造を介した遠距離の相互作用により制御されている.これに対し,体幹部(神経系の組織)における発現に関与するエンハンサーは,遺伝子クラスターの内部の遺伝子の近傍に局在することが知られている(図5b).Hox遺伝子群の組織の特異的な発現の制御機構の詳細については多くの総説があるので,そちらを参照されたい24,26).
一方,Shh遺伝子の肢芽における発現においても染色体の高次構造が関与している.Shh遺伝子の肢芽に特異的なエンハンサーは隣接するLmbr1遺伝子のイントロンに存在するが,哺乳類の場合,その距離は約1 Mbである.マウスの肢芽の細胞を用いた3次元の蛍光in situハイブリダイゼーションによる解析により,エンハンサーとプロモーターがループ構造を介して物理的に相互作用していることが示されている27).
5.ゼブラフィッシュをモデルとした四肢の発生過程におけるNipblの機能の解析
四肢の欠損はCornelia de Lange症候群における代表的な症状のひとつであるが,その発症機構の詳細は明らかでなかった.筆者らは,ゼブラフィッシュをモデルとしてNipblによる四肢の発生の制御機構の解明を試みた13).ゼブラフィッシュにおいては前肢(胸ビレ)の発生の過程が分子レベルで詳細に解析されており28),また,その制御機構も哺乳動物との共通性が高いことから,Nipblによる四肢の形成機構の解析に非常に有用である.
ゼブラフィッシュの胚では,肢芽の成長は受精後30時間ごろから観察され,受精後72時間ごろにはみた目にも明らかなヒレの形態をとるようになる.ほかの脊椎動物と同様に,肢芽の成長は間葉系細胞の増殖をともない,その制御には外胚葉性頂堤からのFgfシグナルが必要である.外胚葉性頂堤におけるfgf遺伝子の発現に必要なshh遺伝子やfgf10遺伝子の発現は,異なる遺伝子カスケードの下流において制御されており,shh遺伝子の制御にはhand2遺伝子やhoxd遺伝子が,fgf10遺伝子の制御にはtbx5遺伝子やfgf24遺伝子が関与する.Nipblをノックダウンした胚においては肢芽の成長にいちじるしい遅延が認められ,間葉系細胞の増殖の低下とそれにともなう細胞数の減少が観察された.既存の情報をもとに,さきに述べた肢芽の発生に関連する遺伝子の発現について解析したところ,間葉系細胞におけるHoxd-Hand2-Shh経路の遺伝子の発現,および,外胚葉性頂堤におけるfgf遺伝子の発現が顕著に低下していた(図4b).HoxD遺伝子群やShh遺伝子の肢芽における発現はNipbl変異マウスでも低下しており13),また,HoxD遺伝子群やShh遺伝子の変異マウスではCornelia de Lange症候群のような四肢の短縮が認められたことから29-31),Hoxd遺伝子群,Hand2遺伝子,Shh遺伝子などがCornelia de Lange症候群における肢芽の欠損にかかわる重要な制御点である可能性が示唆された.
Nipblをノックダウンした胚の肢芽においてはhoxd遺伝子群の発現が非常に特徴的な影響をうけていた13)(図5a).ゼブラフィッシュのhoxdクラスターに含まれる7つの遺伝子はすべてNipblの制御下にあった.Nipblのノックダウンによる影響はクラスターにおける遺伝子の相対位置と関連しており,肢芽の発生に重要な5’-hoxd遺伝子(hoxd9遺伝子~hoxd13遺伝子)の発現がすべて低下していたのに対し,下流側に位置する3’-hoxd遺伝子(hoxd3遺伝子およびhoxd4遺伝子)では発現の顕著な上昇が認められた.また,Nipblのノックダウンの影響は肢芽に特異的であり,遺伝子クラスターの内部のエンハンサーにより制御される体幹部における発現には影響を及ぼさなかった.さらに,3次元の蛍光in situハイブリダイゼーションによる解析により,hoxdクラスターの周辺の高次構造がNipblに依存していることをより直接的に証明することにも成功した13).以上のすべての結果は,Nipblがエンハンサーとプロモーターとのあいだの相互作用を介して遺伝子発現を制御するという仮説と一致した(図5b).興味深いことに,hoxdクラスターにおいてみられた5’-hox遺伝子の発現抑制と3’-hox遺伝子の発現上昇という位置に特異的な影響は,肢芽に発現するhoxaクラスターやhoxcクラスターにおいても認められた13)(図5a).これは,Nipblによる染色体の高次構造を介した発現制御機構が,異なるhoxクラスターにも普遍的に保存された共通の機構である可能性を示唆した.いくつかのhox遺伝子群の発現はShhの下流においてフィードバックにより制御されることが示唆されており,Nipblによるshh遺伝子の制御の可能性も考えられた.しかし,Shhシグナルの阻害剤により処理した胚における肢芽にかかわる遺伝子の発現の変化はNipblをノックダウンした胚の結果とは異なっており,少なくとも,肢芽の発生への影響という点においては主要な標的ではないと予想された13).
Nipblはさまざまなタンパク質と協調して遺伝子発現を制御していることはすでに述べた.では,肢芽の発生やhox遺伝子の発現制御においてはどのような分子機構が関与しているのだろうか? 筆者らの研究では,少なくとも,メディエーター複合体との協働作用が重要であることが明らかにされた13).メディエーター複合体のサブユニットのひとつであるMed12の発現をノックダウンしたゼブラフィッシュの胚では,Nipblをノックダウンした胚と同様に,胸ビレの顕著な萎縮がみられた.肢芽の発生にかかわる遺伝子の発現への影響や,3次元の蛍光in situハイブリダイゼーション法によるhoxdクラスターの周辺の高次構造の解析などは,すべて,Nipblをノックダウンしたときと同様の結果を示した(図4b,図5).メディエーター複合体とNipblとの相互作用は,ES細胞では示されていたものの,個体においては明らかにされておらず,筆者らの研究がin vivoにおけるはじめての証明になった.
一方,Nipblのパートナーとしてもっとも有名なコヒーシンであるが,そのサブユニットであるRad21をノックダウンしたところ,遺伝子発現への影響などはNipblあるいはMed12をノックダウンした胚の結果とは必ずしも一致しなかった13).コヒーシンの変異に起因するタイプのCornelia de Lange症候群は全体的に症状が軽く四肢に対する顕著な影響がみられないことが知られており,これとなんらかの関連があるのかもしれない.
おわりに
染色体の高次構造の制御は遺伝子の時期あるいは組織における特異的な発現を実現する重要な機構のひとつである.コヒーシンとの関連づけによりその分子機構の理解が大きく進み,さらに,Cornelia de Lange症候群のようなコヒーシン病の発症機構の解明にも一定の貢献があったことは,ここ10年ほどの大きな成果であるといえる.その一方,染色体の領域のあいだの相互作用の形成やその特異性の決定に関する分子機構については,現時点でもほとんどわかっていない.染色体の特定の領域どうし,たとえば,エンハンサーとその標的となるプロモーターは,どのようにして互いを認識するのか? ダイナミックな染色体の高次構造の変化をささえる動力は何か? そこには当然,コヒーシンやNIPBLなども関連してくるだろう.今後,1細胞レベルでの解析技術や生細胞における染色体の可視化技術などの向上により,こうした分子機構がさらに明らかにされると予想される.まだまだ興味のつきない分野である.
文 献
- Cremer, T. & Cremer, M.: Chromosome territories. Cold Spring Harb. Perspect. Biol., 2, a003889 (2010)[PubMed]
- Dixon, J. R., Selvaraj, S., Yue, F. et al.: Topological domains in mammalian genomes identified by analysis of chromatin interactions. Nature, 485, 376-380 (2012)[PubMed]
- Dorsett, D. & Strom, L.: The ancient and evolving roles of cohesin in gene expression and DNA repair. Curr. Biol., 22, R240-R250 (2012)[PubMed]
- Remeseiro, S. & Losada, A.: Cohesin, a chromatin engagement ring. Curr. Opin. Cell Biol., 25, 63-71 (2013)[PubMed]
- Losada, A.: Cohesin in cancer: chromosome segregation and beyond. Nat. Rev. Cancer, 14, 389-393 (2014)[PubMed]
- Solomon, D. A., Kim, T., Diaz-Martinez, L. A. et al.: Mutational inactivation of STAG2 causes aneuploidy in human cancer. Science, 333, 1039-1043 (2011)[PubMed]
- Rollins, R. A., Korom, M., Aulner, N. et al.: Drosophila Nipped-B protein supports sister chromatid cohesion and opposes the Stromalin/Scc3 cohesion factor to facilitate long-range activation of the cut gene. Mol. Cell. Biol., 24, 3100-3111 (2004)[PubMed]
- Bose, T. & Gerton, J. L.: Cohesinopathies, gene expression, and chromatin organization. J. Cell Biol., 189, 201-210 (2010)[PubMed]
- Tonkin, E. T., Wang, T. -J., Lisgo, S. et al.: NIPBL, encoding a homolog of fungal Scc2-type sister chromatid cohesion proteins and fly Nipped-B, is mutated in Cornelia de Lange syndrome. Nat. Genet., 36, 636-641 (2004)[PubMed]
- Krantz, I. D., McCallum, J., DeScipio, C. et al.: Cornelia de Lange syndrome is caused by mutations in NIPBL, the human homolog of Drosophila melanogaster Nipped-B. Nat. Genet., 36, 631-635 (2004)[PubMed]
- Kawauchi, S., Calof, A. L., Santos, R. et al.: Multiple organ system defects and transcriptional dysregulation in the Nipbl+/- mouse, a model of Cornelia de Lange syndrome. PLoS Genet., 5, e1000650 (2009)[PubMed]
- Muto, A., Calof, A. L., Lander, A. D. et al.: Multifactorial origins of heart and gut defects in nipbl-deficient zebrafish, a model of Cornelia de Lange syndrome. PLoS Biol., 9, e1001181 (2011)[PubMed]
- Muto, A., Ikeda, S., Lopez-Burks, M. E. et al.: Nipbl and mediator cooperatively regulate gene expression to control limb development. PLoS Genet., 10, e1004671 (2014)[PubMed]
- Chien, R., Zeng, W., Kawauchi, S. et al.: Cohesin mediates chromatin interactions that regulate mammalian β-globin expression. J. Biol. Chem., 286, 17870-17878 (2011)[PubMed]
- Guo, Y., Monahan, K., Wu, H. et al.: CTCF/cohesin-mediated DNA looping is required for protocadherin α promoter choice. Proc. Natl. Acad. Sci. USA, 109, 21081-21086 (2012)[PubMed]
- Wendt, K. S., Yoshida, K., Itoh, T. et al.: Cohesin mediates transcriptional insulation by CCCTC-binding factor. Nature, 451, 796-801 (2008)[PubMed]
- Parelho, V., Hadjur, S., Spivakov, M. et al.: Cohesins functionally associate with CTCF on mammalian chromosome arms. Cell, 132, 422-433 (2008)[PubMed]
- Kagey, M. H., Newman, J. J., Bilodeau, S. et al.: Mediator and cohesin connect gene expression and chromatin architecture. Nature, 467, 430-435 (2010)[PubMed]
- Zuin, J., Dixon, J. R., van der Reijden, M. I. et al.: Cohesin and CTCF differentially affect chromatin architecture and gene expression in human cells. Proc. Natl. Acad. Sci. USA, 111, 996-1001 (2014)[PubMed]
- Zuin, J., Franke, V., van Ijcken, W. F. et al.: A cohesin-independent role for NIPBL at promoters provides insights in CdLS. PLoS Genet., 10, e1004153 (2014)[PubMed]
- Schaaf, C. A., Kwak, H., Koenig, A. et al.: Genome-wide control of RNA polymerase II activity by cohesin. PLoS Genet., 9, e1003382 (2013)[PubMed]
- Lopez-Serra, L., Kelly, G., Patel, H. et al.: The Scc2-Scc4 complex acts in sister chromatid cohesion and transcriptional regulation by maintaining nucleosome-free regions. Nat. Genet., 46, 1147-1151 (2014)[PubMed]
- Mercader, N.: Early steps of paired fin development in zebrafish compared with tetrapod limb development. Dev. Growth Differ., 49, 421-437 (2007)[PubMed]
- Tschopp, P. & Duboule, D.: A genetic approach to the transcriptional regulation of Hox gene clusters. Annu. Rev. Genet., 45, 145-166 (2011)[PubMed]
- Lappin, T. R., Grier, D. G., Thompson, A. et al.: HOX genes: seductive science, mysterious mechanisms. Ulster Med. J., 75, 23-31 (2006)[PubMed]
- Spitz, F.: Control of vertebrate Hox clusters by remote and global cis-acting regulatory sequences. Adv. Exp. Med. Biol., 689, 63-78 (2010)[PubMed]
- Amano, T., Sagai, T., Tanabe, H. et al.: Chromosomal dynamics at the Shh locus: limb bud-specific differential regulation of competence and active transcription. Dev. Cell, 16, 47-57 (2009)[PubMed]
- Mari-Beffa, M. & Murciano, C.: Dermoskeleton morphogenesis in zebrafish fins. Dev. Dyn., 239, 2779-2794 (2010)[PubMed]
- Kmita, M., Tarchini, B., Zakany, J. et al.: Early developmental arrest of mammalian limbs lacking HoxA/HoxD gene function. Nature, 435, 1113-1116 (2005)[PubMed]
- Kraus, P., Fraidenraich, D. & Loomis, C. A.: Some distal limb structures develop in mice lacking Sonic hedgehog signaling. Mech. Dev., 100, 45-58 (2001)[PubMed]
- Chiang, C., Litingtung, Y., Harris, M. P. et al.: Manifestation of the limb prepattern: limb development in the absence of sonic hedgehog function. Dev. Biol., 236, 421-435 (2001)[PubMed]
著者プロフィール
略歴:1995年 東京大学大学院理学系研究科 修了,同年 東京大学医科学研究所 博士研究員,2007年 米国California大学Irvine校Project Scientistを経て,2013年より広島大学大学院理学研究科 特任助教.
研究テーマ:染色体の構造と遺伝子発現,および,それに関連した疾患の発症の機構.
© 2015 武藤 彰彦 Licensed under CC 表示 2.1 日本