循環器疾患におけるアディポサイエンスの重要性
2015/04/15
大橋浩二・大内乗有
(名古屋大学大学院医学系研究科 分子心血管病学講座)
email:大橋浩二,大内乗有
領域融合レビュー, 4, e004 (2015) DOI: 10.7875/leading.author.4.e004
Koji Ohashi & Noriyuki Ouchi: Recent progress in adiposcience for the cardiovascular system.

脂肪組織はアディポサイトカインと総称される生理活性物質を分泌して近傍あるいは遠隔の臓器に作用する内分泌臓器である.アディポサイトカインとしてレプチンやアディポネクチンが発見されてから,肥満合併症におけるアディポサイトカインの重要性についてつぎつぎと報告されている.アディポネクチンは糖代謝の改善作用にくわえ,心血管疾患に対しても直接的な防御作用をもち,肥満状態におけるアディポネクチンの発現の低下が循環器疾患の進展につながると考えられている.さらに最近では,心血管系に対し保護的に作用するアディポサイトカインもいくつか同定されている.アディポサイエンスは循環器疾患の病態の解明において重要であり,このレビューでは,心血管系に作用するアディポサイトカインの意義について,筆者らの最近の研究成果をふくめ解説する.
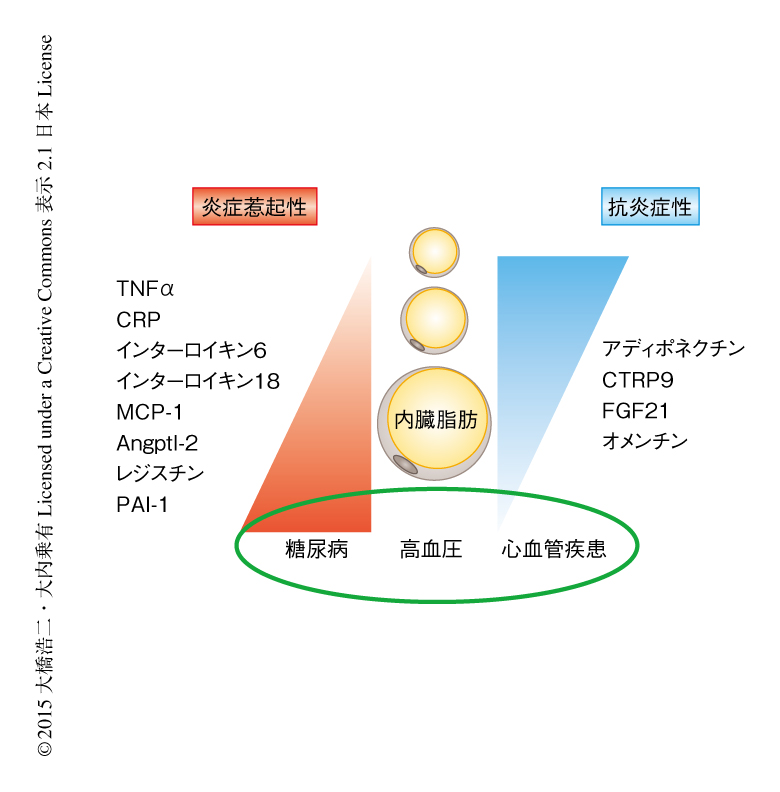
過食や運動不足から生じる肥満,とくに内臓脂肪の過剰な蓄積は,2型糖尿病,高血圧,脂質異常をひき起こし最終的に心血管疾患にいたるが,その分子機序については十分に解明されていない.脂肪組織はアディポサイトカインと総称される多くの生理活性物質を産生し,近傍あるいは遠隔の臓器にさまざまな影響を及ぼすことが明らかにされてきた.アディポサイトカインとして,TNFα(tumor necrosis factor-α,腫瘍壊死因子α),CRP(C-reactive protein,C反応性タンパク質),インターロイキン6,インターロイキン18,MCP-1(monocyte chemoattractant protein-1),Angptl-2(angiopoietin-like protein-2),レジスチンなど,炎症惹起性で糖代謝や心血管疾患を増悪させるものや,PAI-1(plasminogen activator inhibitor-1)のように易血栓性を促進させるものが知られており,これらのアディポサイトカインは肥満とともに発現が上昇する(図1).一方,アディポネクチンのように,抗炎症性にはたらき血管疾患を含むさまざまな肥満関連疾患に対し防御的に作用するアディポサイトカインについても,近年,報告が増えている(図1).抗炎症性のアディポサイトカインの多くは肥満により血中濃度が低下し,抗炎症性のアディポサイトカインの発現の低下と炎症性のアディポサイトカインの発現の上昇というアンバランスが生じることにより肥満関連疾患の進展につながることが明らかにされてきている.このレビューでは,アディポネクチンをふくむ抗炎症性にはたらき心血管疾患に防御的に作用するアディポサイトカインについて,筆者らの研究を中心に解説する.
アディポネクチンは脂肪組織においてもっとも発現量の多い分泌タンパク質として,1996年に遺伝子がクローニングされた1).アディポネクチンは脂肪組織から分泌されるにもかかわらず,その血中濃度は肥満指数(body mass index:BMI)や内臓脂肪の面積と有意な負の相関を示すことが報告されている2).アディポネクチンの血中濃度は,肥満にくわえ,2型糖尿病の患者においても低下することが報告されている3).さらに,心血管疾患との関連についても,冠動脈に有意な狭窄が認められた冠動脈疾患の患者は有意な低アディポネクチン血症を示した4).また,アディポネクチンの血中濃度を低値から高値まで4つに分けて検討したところ,ほかの冠動脈の危険因子により補正したあとでも低アディポネクチン血症群では正常アディポネクチン血症群と比較してオッズ比約2.1倍の冠動脈疾患の危険率をもつことが明らかにされた5).したがって,アディポネクチンは冠動脈疾患における有用なバイオマーカーになることが示唆された.
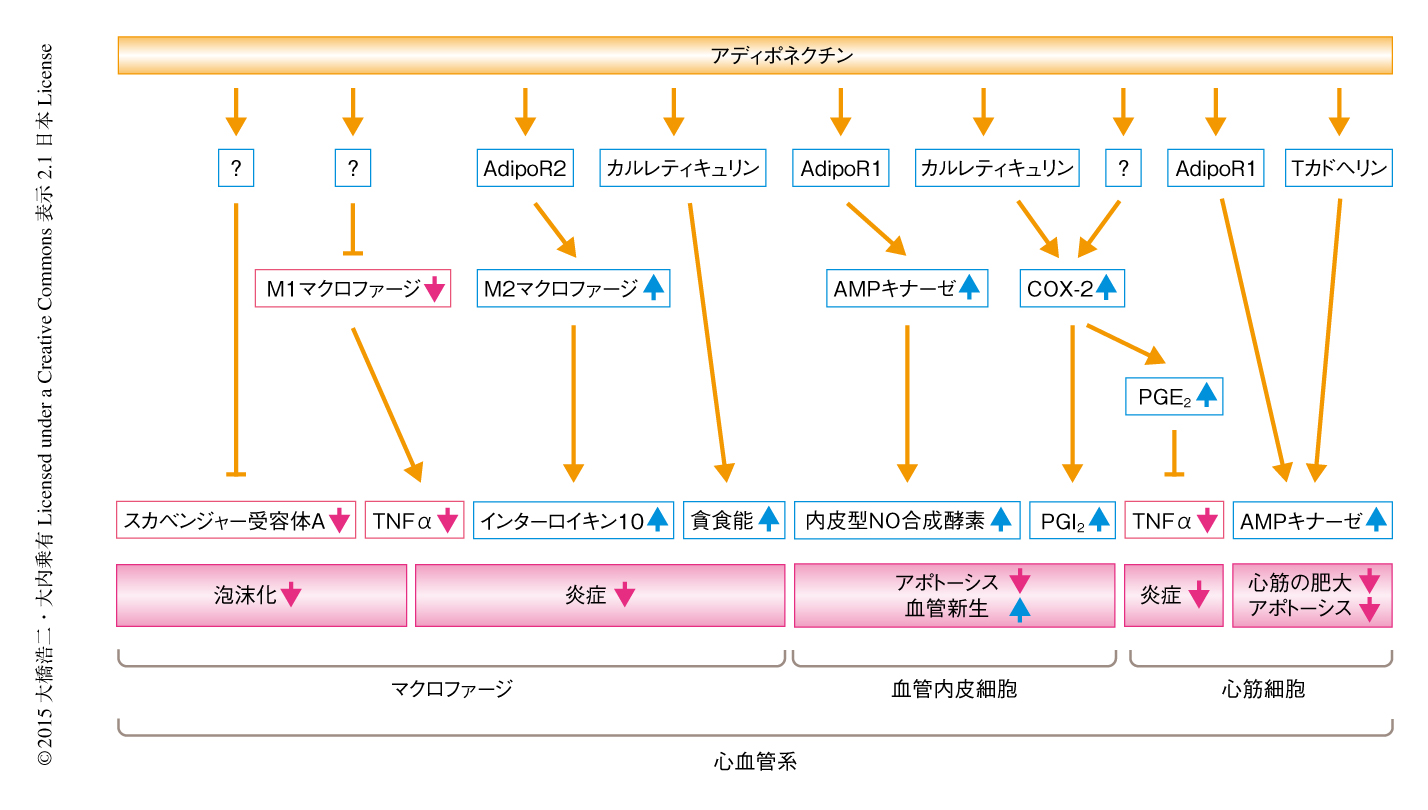
アディポネクチンが動脈硬化の進展に影響を及ぼすことが個体レベルでも明らかにされている.動脈硬化モデルマウスであるApoEノックアウトマウスにアデノウイルスベクターを用いてアディポネクチンを過剰に発現させたところ,大動脈血管壁における脂肪滴の面積が有意に減少し,細胞接着因子であるVCAM,スカベンジャー受容体A,TNFαの低下もともなった6).また,アディポネクチンはマクロファージに作用し,スカベンジャー受容体Aの発現を低下させることにより泡沫化を抑制することも明らかにされている(図2).さらに,アディポネクチンノックアウトマウスを用いた解析では,生理的な条件では血管系に異常は認められなかったが,ApoEノックアウトマウスと交配してApoEとアディポネクチンのダブルノックアウトマウスを作製したところ大動脈血管壁において動脈硬化巣の増大が認められ,動脈硬化巣へのT細胞の集積が有意に増加していた7).
慢性の炎症は動脈硬化の進展において非常に重要な役割をはたしている.炎症反応において中心的な役割をはたすマクロファージに関しては,アディポネクチンは炎症性サイトカインの発現を抑制すること8),抗炎症サイトカインであるインターロイキン10の発現を誘導することなどが報告されている9)(図2).さらに,アディポネクチンがマクロファージの極性を変化させる,つまり,TNFαなどの炎症性サイトカインを分泌し炎症惹起性にはたらくM1マクロファージから,インターロイキン10などの抗炎症性サイトカインを分泌し抗炎症的にはたらくM2マクロファージへの変換を誘導することが報告されている10,11)(図2).
アディポネクチンによるM2マクロファージへの転換の誘導は,アディポネクチン受容体のひとつであるAdipoR2を介することも報告されている12)(図2).AdipoR1およびAdipoR2は,2003年にアディポネクチン受容体として同定された膜タンパク質である13).7回膜貫通型の構造をもつが,既知のGタンパク質共役型受容体ファミリーとは構造的および機能的に異なるファミリーに属すると考えられている.興味深いことに,アディポネクチンによるM2マクロファージへの転換の誘導は脂肪組織から採取した脂肪細胞以外の画分(マクロファージおよび血管内皮細胞や平滑筋細胞など血管壁を構成する細胞を含む)においても認められており,アディポネクチンが脂肪組織における炎症の制御にも関与している可能性が示唆された10).また,炎症の制御において重要であるマクロファージによるアポトーシス細胞の貪食能に対し,アディポネクチンが促進的に作用し抗炎症作用を発揮することが報告されている14).その分子機構として,アディポネクチンが新たなアディポネクチンの受容体として同定された細胞の表面のカルレティキュリンに結合し,膜貫通ドメインをもつCD91をアダプタータンパク質として,アポトーシスを起こしている細胞をすみやかに貪食し除去することも報告されている14)(図2).以上より,肥満状態において,マクロファージにおける抗炎症作用をもつアディポネクチンの発現の低下が動脈硬化の進展につながる可能性が示唆された.
また,アディポネクチンの虚血性心疾患に対する保護的な作用についても明らかにされている.アディポネクチンノックアウトマウスにおいて心臓虚血再灌流モデルを作製しアディポネクチンの虚血性心疾患に対する直接的な作用について検討したところ,心筋梗塞の範囲は有意に大きく,心筋障害の指標であるクレアチンキナーゼ濃度も有意に高値を示した15).このとき,アディポネクチンノックアウトマウスの虚血心筋組織では心筋細胞のアポトーシスおよび炎症反応が有意に増加していた.新生仔ラットの心筋細胞を用いたin vitroにおける実験では,アディポネクチンはCOX-2-PGE2シグナル伝達経路を介したTNFαの発現の抑制による抗炎症作用と,AMPキナーゼシグナルを介した心筋細胞の抗アポトーシス作用により,心血管保護作用を発揮することが示唆された(図2).また,アディポネクチンはマウスの心臓虚血再灌流モデルにおいて,AdipoR1とカベオリン3との複合体を介するシグナル伝達経路およびTカドヘリンを介するシグナル伝達経路によりAMPキナーゼを活性化し心血管保護作用を発揮することも報告されている16,17).Tカドヘリンはアディポネクチンの受容体として同定されたが,膜貫通ドメインをもたず,どのようにAMPキナーゼシグナルを活性化するのかについては今後の成果が期待される.
アディポネクチンノックアウトマウスにおいてアデノウイルスベクターを用いてアディポネクチンを発現させると,増大した心筋梗塞の範囲が有意に減少し野生型のマウスと同じ程度にまで改善した15).さらに,アディポネクチンノックアウトマウスに大動脈縮窄手術を施行し圧負荷モデルを作製したところ,心肥大が増悪した.このマウスにアデノウイルスベクターによりアディポネクチンを発現させると,心肥大は有意に減少し野生型のマウスと同じ程度にまで改善した18).培養心筋細胞をフェニレフリンで処理することにより生じた心筋細胞の肥大に対し,アディポネクチンはAMPキナーゼシグナルを介して防御的に作用した(図2).また,アディポネクチンは培養心筋細胞のアポトーシスをセラミダーゼ活性の上昇によるスフィンゴシン1-リン酸の産生の増加を介し抑制することも報告されている19).アディポネクチンは低酸素再酸素化傷害によりひき起こされる培養心筋細胞のアポトーシスについても,酸化ストレスを低下させることにより抑制することが報告されている20).さらに,前臨床的なブタのモデルにおいても,冠動脈虚血再灌流のときにアディポネクチンを冠動脈に注入することにより,心筋梗塞の範囲は減少し心機能が改善することが見い出されている21).これらより,低アディポネクチン血症は心筋に障害をひき起こし,アディポネクチンの補充は動脈硬化や心筋の障害に対し防御的にはたらくことが明らかにされた.以上より,アディポネクチンは急性心筋梗塞の治療法の開発における新たな標的となる可能性が示唆された.
一方,心不全の患者においてはアディポネクチンの血中濃度が上昇しており,アディポネクチンの血中濃度が高くなるほど予後の増悪することが報告されている22).しかし,アディポネクチンノックアウトマウスの左冠動脈を結紮することにより心筋梗塞モデルを作製したところ,4週間のちには心機能が有意に増悪し,これはアデノウイルスベクターによりアディポネクチンを発現させることにより有意に改善した23).さらに,アディポネクチンノックアウトマウスにドキソルビシンを投与することにより心不全モデルを作製したところ,心機能に重度の異常を示し,これはアデノウイルスベクターによりアディポネクチンを発現させることにより改善された24).これらの動物実験の結果より,アディポネクチンが心不全の進展に対し防御作用をもち,心不全の状態におけるアディポネクチンの血中濃度の上昇は代償的な変化である可能性が高いことが考えられた.
心不全の患者においてアディポネクチンの血中濃度が上昇する分子機構として,心房性ナトリウム利尿ペプチドや脳性ナトリウム利尿ペプチドなどナトリウム利尿ペプチドの関与が報告されている.心房性ナトリウム利尿ペプチドおよび脳性ナトリウム利尿ペプチドは心不全のときに心臓で合成され分泌されるホルモンであり,心不全の重症化およびその血中濃度とは正の相関を示すことが報告されている.ナトリウム利尿ペプチドは利尿作用や血管拡張作用など強い心血管保護作用をもち,臨床の現場においても心不全治療薬として用いられている.心不全の患者においてはアディポネクチンの血中濃度と正の相関を示しており,多変量解析において脳性ナトリウム利尿ペプチドはアディポネクチンの血中濃度の独立した予測因子であった25).また,ヒト初代培養脂肪細胞に心房性ナトリウム利尿ペプチドあるいは脳性ナトリウム利尿ペプチドを添加するとアディポネクチンの発現が上昇すること,心不全の患者に心房性ナトリウム利尿ペプチドを投与するとアディポネクチンの血中濃度が上昇することが示されている.これより,心不全のときの高アディポネクチン血症は,心不全のときに増加するANP心房性ナトリウム利尿ペプチドやBNP脳性ナトリウム利尿ペプチドによるアディポネクチンの分泌促進作用による可能性が示唆された26).
動脈硬化の発症および進展において血管内皮の障害は非常に重要な因子である.アディポネクチンノックアウトマウスにおいて作製した下肢虚血モデルにおいては血管新生が障害されていた27).一方,野生型のマウスに対しアデノウイルスベクターによりアディポネクチンを過剰に発現させると血管新生が促進された.この反応はドミナントネガティブ型のAMPキナーゼの過剰発現により抑制されたことから,アディポネクチンによる血管内皮の保護作用はAMPキナーゼを介すると考えられた.また,培養血管内皮細胞において,アディポネクチンはAMPキナーゼを介して内皮型NO合成酵素を活性化することにより,血管新生に重要な血管内皮細胞の遊走や管様構造の形成を促進しアポトーシスを抑制することも明らかにされた28)(図2).また,培養血管内皮細胞においてsiRNAによりAdipoR1をノックダウンするとアディポネクチンの添加によるAMPキナーゼシグナルがブロックされたことから,アディポネクチンはAdipoR1-AMPキナーゼ-内皮型NO合成酵素シグナル伝達経路を介して血管内皮の保護作用を発揮する可能性が示唆された29).
さらに,アディポネクチンは培養血管内皮細胞においてCOX-2の発現を上昇させ,PGI2の分泌を促進することにより血管内皮の保護作用を発揮することも明らかにされている29)(図2).血管内皮に特異的なCOX-2ノックアウトマウスにおいて下肢虚血モデルを作製すると,血管新生が有意に障害されていた29).血管内皮に特異的なCOX-2ノックアウトマウスにおいてアデノウイルスベクターによりアディポネクチンを過剰に発現させると,血管新生の促進作用が認められず,アディポネクチンはAMPキナーゼシグナルにくわえ,COX-2-PGI2シグナル伝達経路を介して血管内皮の保護作用を発揮することが示された.また,アディポネクチンがCOX-2の発現を上昇させる分子機構としては,カルレティキュリンとそのアダプタータンパク質であるCD91を介してPI3キナーゼ-Aktシグナル伝達系を活性化することによることが示された29).
低アディポネクチン血症は高血圧にも関与することが報告されている.疫学的な検討により低アディポネクチン血症は高血圧の独立した危険因子であることが示された30).また,アディポネクチンノックアウトマウスに高食塩食を負荷すると2週間で有意な血圧の上昇を示したが31),アデノウイルスベクターによりアディポネクチンを発現させると高食塩食の負荷による血圧の上昇は認められなくなった.また,肥満および糖尿病のモデルであるKKAyマウスは週齢とともに血圧が上昇するが,アディポネクチンを過剰に発現させることにより血圧の上昇は抑制されることも明らかにされた31).アディポネクチンノックアウトマウスは高食塩食の負荷によりインスリン抵抗性は生じておらず,血管および腎臓における内皮型NO合成酵素の発現の低下がみられたことから,アディポネクチンは血管内皮に直接的に作用し,内皮型NO合成酵素の活性化によりNOの産生を上昇させることで血圧の上昇を抑制することが示唆された.以上のように,アディポネクチンはマクロファージおよび血管内皮細胞や心筋細胞といった心血管を構成する細胞に対し,さまざまな受容体を介して直接に作用し,炎症の抑制をはじめとする表現型を制御することにより多彩な心血管保護作用を発揮すると考えられた.しかし,受容体を介したシグナル伝達経路については十分に解明されておらず,さらなる研究成果が期待される.
CTRP(C1q/TNF-related protein)ファミリータンパク質は補体C1qに構造が類似したC1q様ドメインおよびコラーゲンドメインをもち,アディポネクチンと構造的に類似していることからアディポネクチンパラログに分類されている32).CTRP9はCTRPファミリータンパク質のうちアディポネクチンとアミノ酸相同性がもっとも高く,アディポネクチンと同様にCTRP9の血中濃度は肥満モデルマウスにおいて低下することが報告されている33).また,心臓虚血再灌流モデルおよび心筋梗塞モデルにおいてもCTRP9の血中濃度は低下することが報告されている34,35).心筋障害モデルにおいて遊離脂肪酸の血中濃度が上昇しており,脂肪組織における酸化ストレスマーカーが上昇していること,培養脂肪細胞にパルミチン酸やH2O2を添加することによりCTRP9の発現が低下することから,CTRP9の発現は肥満においても心筋障害においても同様の機序により制御されている可能性があり興味深い34).
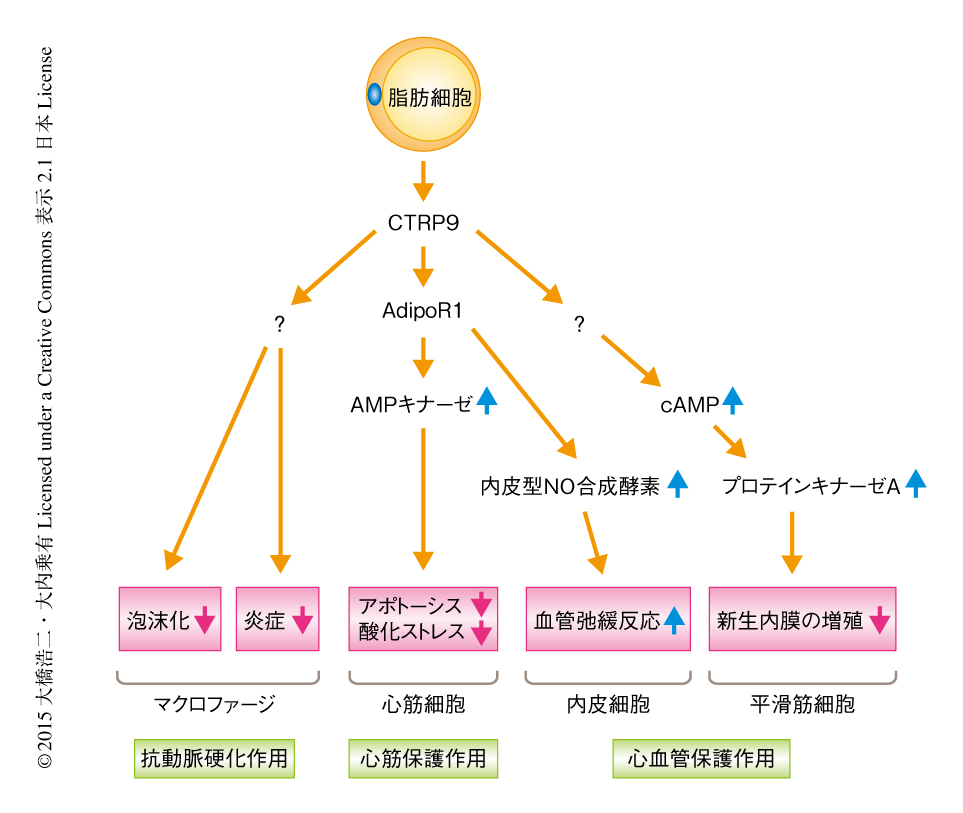
CTRP9は心血管疾患に対し防御的な作用をもつことが報告されている.マウスの心臓虚血再灌流モデルにおいてCTRP9の投与は心筋梗塞の範囲を減少させた34).心臓虚血再灌流ののちの心臓組織においてはAMPキナーゼによるリン酸化のレベルが亢進しているが,CTRP9の投与はAMPキナーゼによるリン酸化のレベルをさらに亢進した.培養心筋細胞を用いた検討において,ドミナントネガティブ型のAMPキナーゼを用いてAMPキナーゼシグナルをブロックすることによりCTRP9による心筋細胞のアポトーシスの抑制効果は消失したことから,CTRP9はアディポネクチンと同様にAMPキナーゼシグナルを介して心血管保護作用を発揮することが示唆された(図3).さらに,AdipoR1をsiRNAによりノックダウンするとCTRP9によるAMPキナーゼシグナルの亢進が阻害されたことから,CTRP9は心筋細胞においてAdipoR1-AMPキナーゼシグナル伝達経路を介して心筋保護作用を発揮することが示唆された34).また,2型糖尿病マウスにおける心筋梗塞モデルにおいても,CTRP9の投与は酸化ストレスを抑制することにより心筋保護作用を発揮することが報告されている36)(図3).また,血管壁に対しては,CTRP9の投与はアディポネクチンと同様にAdipoR1-AMPキナーゼ-内皮型NO合成酵素シグナル伝達経路を介して血管内皮に依存性の血管弛緩反応を促進することが報告されている37)(図3).
マウスの大腿動脈傷害モデルにおいても,CTRP9の投与は新生内膜の増加を抑制することが報告されている38)(図3).培養血管平滑筋細胞における検討では,CTRP9は平滑筋細胞の増殖を抑制し,その機序についてはCTRP9はAdipoR1やAMPキナーゼシグナルを介さずcAMP-プロテインキナーゼAシグナル伝達経路を介することが報告されている38)(図3).アディポネクチンはAMPキナーゼシグナルを介して平滑筋細胞の増殖を抑制し,平滑筋細胞においてcAMP-プロテインキナーゼAシグナル伝達経路を活性化しないため,CTRP9はアディポネクチンとは異なる機序により平滑筋細胞に作用すると考えられ,CTRP9によるcAMP-プロテインキナーゼAシグナル伝達経路の活性化に関与する受容体の同定が期待される.さらに,ApoEノックアウトマウスに対しレンチウイルスベクターを用いてCTRP9を長期間にわたり過剰に発現させることにより,頸動脈の動脈硬化巣における脂肪滴の面積および炎症性サイトカインの発現が抑制され,線維化および血管平滑筋細胞を増加させることによりプラークの安定化が促進されることも報告されている39).培養マクロファージにおいて,酸化した低密度リポタンパク質の添加により上昇する炎症性サイトカインの発現は,レンチウイルスベクターを用いてCTRP9を過剰に発現させることにより有意に抑制されることも報告されている39).
CTRP9はアディポネクチンと受容体を共有するだけでなく,アディポネクチンとオリゴマーを形成することも報告されている33).アディポネクチンノックアウトマウスは大腿動脈傷害モデルにおいて野生型のマウスに比べ新生内膜の増加の大きいことが報告されている40).アディポネクチンノックアウトマウスにCTRP9を過剰に発現させることにより新生内膜の増加が抑制されることも報告されており,CTRP9はアディポネクチンの一部の作用を代償している可能性が示唆された41).
FGF21はFGF(fibroblast growth factor,線維芽細胞増殖因子)ファミリーに属する分泌タンパク質である42,43).近年,FGF21は肝臓や骨格筋にくわえ,脂肪組織においても高く発現することが報告されている44,45).FGF21ノックアウトマウスは脂肪萎縮変性症の病態を呈し,インスリン抵抗性が増悪した46).一方,FGF21トランスジェニックマウスは肥満や2型糖尿病に対し抵抗性であった43).さらに,肥満マウスにFGF21を投与することにより血糖値や中性脂肪の血中濃度が劇的に改善したことが報告されている43).興味深いことに,FGF21は脂肪組織においてアディポネクチンの発現を上昇させること,さらに,アディポネクチンノックアウトマウスにおいてはFGF21のインスリン抵抗性に対する改善作用がなくなることが報告されており,FGF21による2型糖尿病に対する改善作用はアディポネクチンの発現の上昇を介することが示唆された47,48).
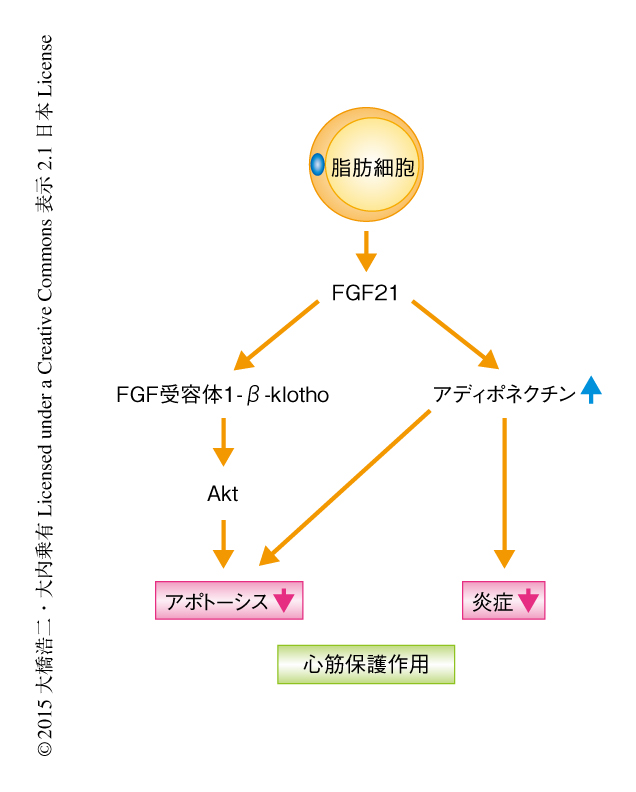
最近になり,マウスにおいてFGF21は圧負荷による心肥大や心臓虚血再灌流傷害に対し保護作用をもつことが報告されている49-51).マウスの心臓虚血再灌流モデルを作製したところ,肝臓および脂肪組織においてFGF21の発現が上昇し,心筋細胞においてFGF受容体1-β-klotho-Aktシグナル伝達経路を介して心筋細胞のアポトーシスが抑制されることが報告されている51)(図4).筆者らによる最新の報告では,アデノウイルスベクターによりFGF21の発現を上昇させると,野生型のマウスにおいてはアディポネクチンの血中濃度が上昇し,マウスの心筋梗塞モデルにおける心筋の肥大,肺のうっ血,心機能が著明に改善されたが,アディポネクチンノックアウトマウスではこれらは部分的にしか改善されなかった52).これより,FGF21による心筋梗塞ののちの心臓リモデリングの抑制作用は,少なくとも一部はアディポネクチンの分泌の促進を介していることが示唆された.一方,FGF21の投与による心筋梗塞ののちの炎症性サイトカインの抑制作用は,アディポネクチンノックアウトマウスにおいては完全に消失することより,FGF21による心筋梗塞ののちの炎症反応の抑制作用はアディポネクチンの分泌の促進を介することが示唆された(図4).
オメンチンはインテレクチン1ともよばれており,もともと可溶性のガラクトフラノース結合レクチンとして同定された53).オメンチンは血中に分泌され三量体を形成することが報告されている53).脂肪組織,とくに内臓脂肪組織において高い発現が認められ,その血中濃度はアディポネクチンと同様に肥満において低下することが報告されている54,55).
近年,動脈硬化および冠動脈疾患とオメンチンとの関連についても報告されており,オメンチンの血中濃度は頸動脈壁の肥厚と負の相関を示すことが報告されている56,57).また,冠動脈疾患の患者ではオメンチンの血中濃度が有意に低いことが報告されている58).したがって,オメンチンはアディポネクチンと同様に,冠動脈疾患における有用なバイオマーカーになるうることが示唆された.
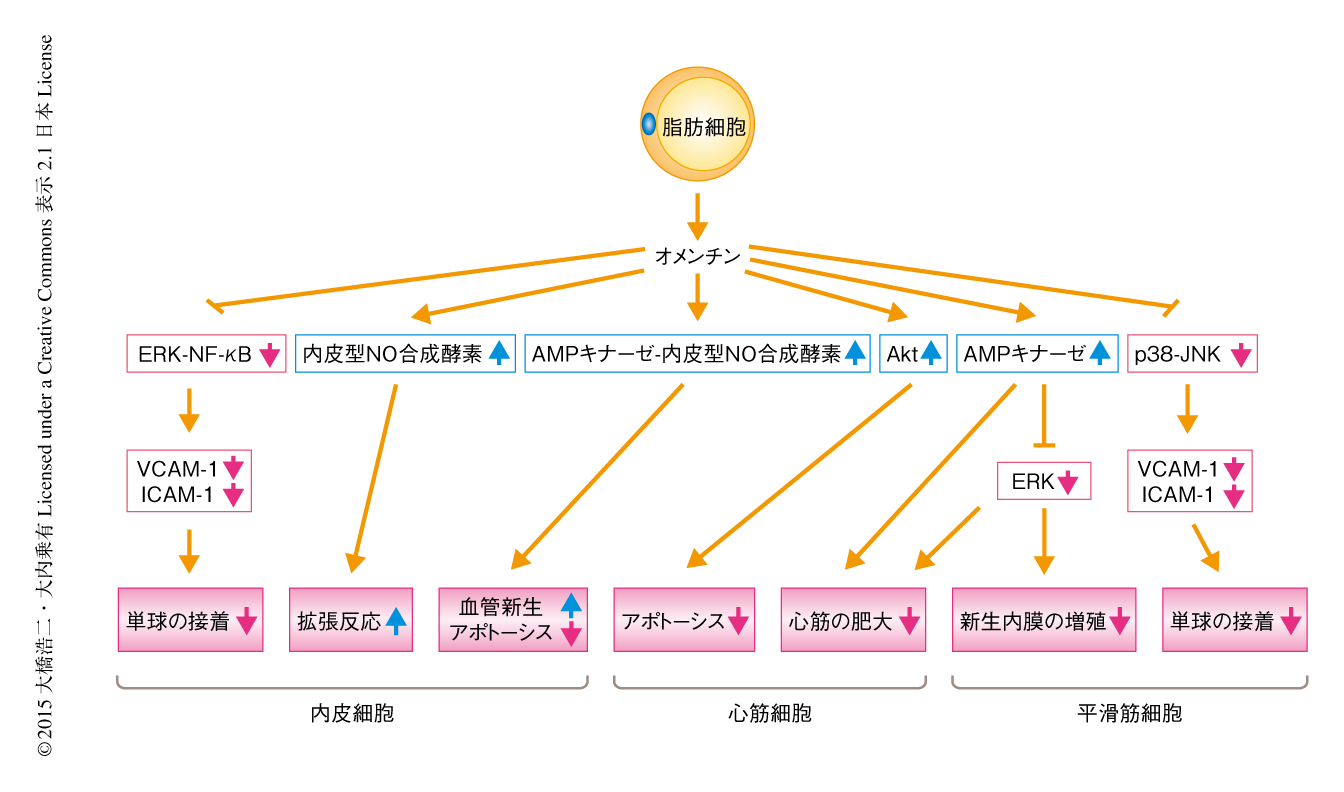
最近,筆者らは,マウスの心臓虚血再灌流モデルにおいて,オメンチンの投与により梗塞の範囲が著明に減少することを報告した59).ラットの新生仔心筋細胞を用いたin vitroにおける検討により,オメンチンはAMPキナーゼとAktの独立した2つのシグナル伝達経路を介して心筋細胞のアポトーシスを抑制することが明らかにされた59).さらに,脂肪組織に特異的なオメンチントランスジェニックマウスに大動脈縮窄手術を施行し圧負荷モデルを作製したところ,心肥大が著明に改善した60).また,オメンチンの前投与はAMPキナーゼシグナルを介したERKシグナルの抑制により,培養心筋細胞をフェニレフリンで処理することにより生じる心筋細胞の肥大を抑制することが報告されている60)(図5).以上より,オメンチンは肥満にともない生じる虚血性心疾患や心肥大の治療法の新たな標的になりうることが示唆された.
実験レベルにおいては,オメンチンは心血管保護作用をもつことが報告されている.オメンチンの添加は内皮型NO合成酵素の活性化を介して血管内皮に依存性の血管拡張反応を増強する61)(図5).また,野生型のマウスにオメンチンを全身投与すると,下肢虚血モデルにおける血流改善が内皮型NO合成酵素シグナルを介し促進されることも明らかにされた62).培養血管内皮細胞を用いた検討では,オメンチンの投与はAMPキナーゼ-内皮型NO合成酵素シグナル伝達経路を介してマトリゲルにおける血管新生を促進し,血管内皮細胞のアポトーシスを抑制することが報告されている62)(図5).さらに,オメンチンは血管内皮細胞のERK-NF-κBシグナル伝達経路を抑制することにより,VCAMやICAMなどの細胞接着因子の発現を抑制し単球の接着を抑制することが報告されている63).また,マウスの大腿動脈傷害モデルにおいて,オメンチンの投与はAMPキナーゼシグナルを介してERKシグナルを抑制することにより,新生内膜の増殖を抑制することが報告されている64)(図5).オメンチンは平滑筋細胞においてp38-JNKシグナル伝達経路を抑制し,VCAMやICAMなどの細胞接着因子の発現を抑制することも報告されている65).
以上のように,オメンチンは心血管疾患に対し,アディポネクチンと類似したシグナルを介して防御的な作用を発揮する.しかし,アディポネクチンがAMPキナーゼシグナルを介して心筋細胞のアポトーシスを抑制するのに対し,オメンチンはAMPキナーゼとAktの独立した2つのシグナル伝達経路を介して心筋細胞のアポトーシスを抑制するなど,アディポネクチンとは異なる機序により心血管保護作用を発揮することが考えられ,オメンチンの受容体の同定を含めた詳細なシグナル伝達経路の解明が期待される.
炎症性アディポサイトカインと抗炎症性アディポサイトカインとのバランスの破綻が肥満関連疾患に及ぼす影響について,多くの知見が集積されつつある.このレビューにおいて紹介した,アディポネクチン,CTRP9,FGF21,オメンチンなど抗炎症性アディポサイトカインの肥満にともなう発現の低下は,脂肪組織あるいは遠隔の臓器において炎症を惹起し代謝性疾患や心血管疾患の進展に寄与している.それゆえ,これら抗炎症性アディポサイトカインの発現を上昇させることやその下流のシグナル伝達経路を増強させることは,肥満関連疾患の治療における新たな標的として有望である.また,CTRP9はアディポネクチンパラログであり,受容体としてアディポネクチンの受容体であるAdipoR1を共有することも報告されていることから,今後,アディポネクチンとアディポネクチンパラログとの相互作用,また,共通のシグナル伝達経路の解析が重要になると考えられる.ほかのアディポサイトカインとのあいだの相互作用に関しても,FGF21は脂肪組織におけるアディポネクチンの発現を上昇させることが報告されている.また,オメンチンの受容体はまだ明らかではないが,AMPキナーゼシグナルやAktシグナルなどアディポネクチンと共通のシグナルを活性化することから,アディポネクチンとの相互作用についてもさらなる研究が必要である.今後,これらの抗炎症性アディポサイトカイン,さらには,新規のアディポサイトカインの発現制御,機能,相互作用の検討が,肥満にともない惹起された臓器の炎症と,その結果としての心血管疾患の発症,その進展の分子機構の解明につながることが考えられる.
略歴:2006年 大阪大学大学院医学系研究科 修了,2007年 米国Boston大学School of Medicine研究員を経て,2010年より名古屋大学大学院医学系研究科 助教.
大内 乗有(Noriyuki Ouchi)
名古屋大学大学院医学系研究科 教授.
© 2015 大橋浩二・大内乗有 Licensed under CC 表示 2.1 日本
(名古屋大学大学院医学系研究科 分子心血管病学講座)
email:大橋浩二,大内乗有
領域融合レビュー, 4, e004 (2015) DOI: 10.7875/leading.author.4.e004
Koji Ohashi & Noriyuki Ouchi: Recent progress in adiposcience for the cardiovascular system.
要 約
脂肪組織はアディポサイトカインと総称される生理活性物質を分泌して近傍あるいは遠隔の臓器に作用する内分泌臓器である.アディポサイトカインとしてレプチンやアディポネクチンが発見されてから,肥満合併症におけるアディポサイトカインの重要性についてつぎつぎと報告されている.アディポネクチンは糖代謝の改善作用にくわえ,心血管疾患に対しても直接的な防御作用をもち,肥満状態におけるアディポネクチンの発現の低下が循環器疾患の進展につながると考えられている.さらに最近では,心血管系に対し保護的に作用するアディポサイトカインもいくつか同定されている.アディポサイエンスは循環器疾患の病態の解明において重要であり,このレビューでは,心血管系に作用するアディポサイトカインの意義について,筆者らの最近の研究成果をふくめ解説する.
はじめに
過食や運動不足から生じる肥満,とくに内臓脂肪の過剰な蓄積は,2型糖尿病,高血圧,脂質異常をひき起こし最終的に心血管疾患にいたるが,その分子機序については十分に解明されていない.脂肪組織はアディポサイトカインと総称される多くの生理活性物質を産生し,近傍あるいは遠隔の臓器にさまざまな影響を及ぼすことが明らかにされてきた.アディポサイトカインとして,TNFα(tumor necrosis factor-α,腫瘍壊死因子α),CRP(C-reactive protein,C反応性タンパク質),インターロイキン6,インターロイキン18,MCP-1(monocyte chemoattractant protein-1),Angptl-2(angiopoietin-like protein-2),レジスチンなど,炎症惹起性で糖代謝や心血管疾患を増悪させるものや,PAI-1(plasminogen activator inhibitor-1)のように易血栓性を促進させるものが知られており,これらのアディポサイトカインは肥満とともに発現が上昇する(図1).一方,アディポネクチンのように,抗炎症性にはたらき血管疾患を含むさまざまな肥満関連疾患に対し防御的に作用するアディポサイトカインについても,近年,報告が増えている(図1).抗炎症性のアディポサイトカインの多くは肥満により血中濃度が低下し,抗炎症性のアディポサイトカインの発現の低下と炎症性のアディポサイトカインの発現の上昇というアンバランスが生じることにより肥満関連疾患の進展につながることが明らかにされてきている.このレビューでは,アディポネクチンをふくむ抗炎症性にはたらき心血管疾患に防御的に作用するアディポサイトカインについて,筆者らの研究を中心に解説する.
1.アディポネクチンと心血管疾患
アディポネクチンは脂肪組織においてもっとも発現量の多い分泌タンパク質として,1996年に遺伝子がクローニングされた1).アディポネクチンは脂肪組織から分泌されるにもかかわらず,その血中濃度は肥満指数(body mass index:BMI)や内臓脂肪の面積と有意な負の相関を示すことが報告されている2).アディポネクチンの血中濃度は,肥満にくわえ,2型糖尿病の患者においても低下することが報告されている3).さらに,心血管疾患との関連についても,冠動脈に有意な狭窄が認められた冠動脈疾患の患者は有意な低アディポネクチン血症を示した4).また,アディポネクチンの血中濃度を低値から高値まで4つに分けて検討したところ,ほかの冠動脈の危険因子により補正したあとでも低アディポネクチン血症群では正常アディポネクチン血症群と比較してオッズ比約2.1倍の冠動脈疾患の危険率をもつことが明らかにされた5).したがって,アディポネクチンは冠動脈疾患における有用なバイオマーカーになることが示唆された.
アディポネクチンが動脈硬化の進展に影響を及ぼすことが個体レベルでも明らかにされている.動脈硬化モデルマウスであるApoEノックアウトマウスにアデノウイルスベクターを用いてアディポネクチンを過剰に発現させたところ,大動脈血管壁における脂肪滴の面積が有意に減少し,細胞接着因子であるVCAM,スカベンジャー受容体A,TNFαの低下もともなった6).また,アディポネクチンはマクロファージに作用し,スカベンジャー受容体Aの発現を低下させることにより泡沫化を抑制することも明らかにされている(図2).さらに,アディポネクチンノックアウトマウスを用いた解析では,生理的な条件では血管系に異常は認められなかったが,ApoEノックアウトマウスと交配してApoEとアディポネクチンのダブルノックアウトマウスを作製したところ大動脈血管壁において動脈硬化巣の増大が認められ,動脈硬化巣へのT細胞の集積が有意に増加していた7).
慢性の炎症は動脈硬化の進展において非常に重要な役割をはたしている.炎症反応において中心的な役割をはたすマクロファージに関しては,アディポネクチンは炎症性サイトカインの発現を抑制すること8),抗炎症サイトカインであるインターロイキン10の発現を誘導することなどが報告されている9)(図2).さらに,アディポネクチンがマクロファージの極性を変化させる,つまり,TNFαなどの炎症性サイトカインを分泌し炎症惹起性にはたらくM1マクロファージから,インターロイキン10などの抗炎症性サイトカインを分泌し抗炎症的にはたらくM2マクロファージへの変換を誘導することが報告されている10,11)(図2).
アディポネクチンによるM2マクロファージへの転換の誘導は,アディポネクチン受容体のひとつであるAdipoR2を介することも報告されている12)(図2).AdipoR1およびAdipoR2は,2003年にアディポネクチン受容体として同定された膜タンパク質である13).7回膜貫通型の構造をもつが,既知のGタンパク質共役型受容体ファミリーとは構造的および機能的に異なるファミリーに属すると考えられている.興味深いことに,アディポネクチンによるM2マクロファージへの転換の誘導は脂肪組織から採取した脂肪細胞以外の画分(マクロファージおよび血管内皮細胞や平滑筋細胞など血管壁を構成する細胞を含む)においても認められており,アディポネクチンが脂肪組織における炎症の制御にも関与している可能性が示唆された10).また,炎症の制御において重要であるマクロファージによるアポトーシス細胞の貪食能に対し,アディポネクチンが促進的に作用し抗炎症作用を発揮することが報告されている14).その分子機構として,アディポネクチンが新たなアディポネクチンの受容体として同定された細胞の表面のカルレティキュリンに結合し,膜貫通ドメインをもつCD91をアダプタータンパク質として,アポトーシスを起こしている細胞をすみやかに貪食し除去することも報告されている14)(図2).以上より,肥満状態において,マクロファージにおける抗炎症作用をもつアディポネクチンの発現の低下が動脈硬化の進展につながる可能性が示唆された.
また,アディポネクチンの虚血性心疾患に対する保護的な作用についても明らかにされている.アディポネクチンノックアウトマウスにおいて心臓虚血再灌流モデルを作製しアディポネクチンの虚血性心疾患に対する直接的な作用について検討したところ,心筋梗塞の範囲は有意に大きく,心筋障害の指標であるクレアチンキナーゼ濃度も有意に高値を示した15).このとき,アディポネクチンノックアウトマウスの虚血心筋組織では心筋細胞のアポトーシスおよび炎症反応が有意に増加していた.新生仔ラットの心筋細胞を用いたin vitroにおける実験では,アディポネクチンはCOX-2-PGE2シグナル伝達経路を介したTNFαの発現の抑制による抗炎症作用と,AMPキナーゼシグナルを介した心筋細胞の抗アポトーシス作用により,心血管保護作用を発揮することが示唆された(図2).また,アディポネクチンはマウスの心臓虚血再灌流モデルにおいて,AdipoR1とカベオリン3との複合体を介するシグナル伝達経路およびTカドヘリンを介するシグナル伝達経路によりAMPキナーゼを活性化し心血管保護作用を発揮することも報告されている16,17).Tカドヘリンはアディポネクチンの受容体として同定されたが,膜貫通ドメインをもたず,どのようにAMPキナーゼシグナルを活性化するのかについては今後の成果が期待される.
アディポネクチンノックアウトマウスにおいてアデノウイルスベクターを用いてアディポネクチンを発現させると,増大した心筋梗塞の範囲が有意に減少し野生型のマウスと同じ程度にまで改善した15).さらに,アディポネクチンノックアウトマウスに大動脈縮窄手術を施行し圧負荷モデルを作製したところ,心肥大が増悪した.このマウスにアデノウイルスベクターによりアディポネクチンを発現させると,心肥大は有意に減少し野生型のマウスと同じ程度にまで改善した18).培養心筋細胞をフェニレフリンで処理することにより生じた心筋細胞の肥大に対し,アディポネクチンはAMPキナーゼシグナルを介して防御的に作用した(図2).また,アディポネクチンは培養心筋細胞のアポトーシスをセラミダーゼ活性の上昇によるスフィンゴシン1-リン酸の産生の増加を介し抑制することも報告されている19).アディポネクチンは低酸素再酸素化傷害によりひき起こされる培養心筋細胞のアポトーシスについても,酸化ストレスを低下させることにより抑制することが報告されている20).さらに,前臨床的なブタのモデルにおいても,冠動脈虚血再灌流のときにアディポネクチンを冠動脈に注入することにより,心筋梗塞の範囲は減少し心機能が改善することが見い出されている21).これらより,低アディポネクチン血症は心筋に障害をひき起こし,アディポネクチンの補充は動脈硬化や心筋の障害に対し防御的にはたらくことが明らかにされた.以上より,アディポネクチンは急性心筋梗塞の治療法の開発における新たな標的となる可能性が示唆された.
一方,心不全の患者においてはアディポネクチンの血中濃度が上昇しており,アディポネクチンの血中濃度が高くなるほど予後の増悪することが報告されている22).しかし,アディポネクチンノックアウトマウスの左冠動脈を結紮することにより心筋梗塞モデルを作製したところ,4週間のちには心機能が有意に増悪し,これはアデノウイルスベクターによりアディポネクチンを発現させることにより有意に改善した23).さらに,アディポネクチンノックアウトマウスにドキソルビシンを投与することにより心不全モデルを作製したところ,心機能に重度の異常を示し,これはアデノウイルスベクターによりアディポネクチンを発現させることにより改善された24).これらの動物実験の結果より,アディポネクチンが心不全の進展に対し防御作用をもち,心不全の状態におけるアディポネクチンの血中濃度の上昇は代償的な変化である可能性が高いことが考えられた.
心不全の患者においてアディポネクチンの血中濃度が上昇する分子機構として,心房性ナトリウム利尿ペプチドや脳性ナトリウム利尿ペプチドなどナトリウム利尿ペプチドの関与が報告されている.心房性ナトリウム利尿ペプチドおよび脳性ナトリウム利尿ペプチドは心不全のときに心臓で合成され分泌されるホルモンであり,心不全の重症化およびその血中濃度とは正の相関を示すことが報告されている.ナトリウム利尿ペプチドは利尿作用や血管拡張作用など強い心血管保護作用をもち,臨床の現場においても心不全治療薬として用いられている.心不全の患者においてはアディポネクチンの血中濃度と正の相関を示しており,多変量解析において脳性ナトリウム利尿ペプチドはアディポネクチンの血中濃度の独立した予測因子であった25).また,ヒト初代培養脂肪細胞に心房性ナトリウム利尿ペプチドあるいは脳性ナトリウム利尿ペプチドを添加するとアディポネクチンの発現が上昇すること,心不全の患者に心房性ナトリウム利尿ペプチドを投与するとアディポネクチンの血中濃度が上昇することが示されている.これより,心不全のときの高アディポネクチン血症は,心不全のときに増加するANP心房性ナトリウム利尿ペプチドやBNP脳性ナトリウム利尿ペプチドによるアディポネクチンの分泌促進作用による可能性が示唆された26).
動脈硬化の発症および進展において血管内皮の障害は非常に重要な因子である.アディポネクチンノックアウトマウスにおいて作製した下肢虚血モデルにおいては血管新生が障害されていた27).一方,野生型のマウスに対しアデノウイルスベクターによりアディポネクチンを過剰に発現させると血管新生が促進された.この反応はドミナントネガティブ型のAMPキナーゼの過剰発現により抑制されたことから,アディポネクチンによる血管内皮の保護作用はAMPキナーゼを介すると考えられた.また,培養血管内皮細胞において,アディポネクチンはAMPキナーゼを介して内皮型NO合成酵素を活性化することにより,血管新生に重要な血管内皮細胞の遊走や管様構造の形成を促進しアポトーシスを抑制することも明らかにされた28)(図2).また,培養血管内皮細胞においてsiRNAによりAdipoR1をノックダウンするとアディポネクチンの添加によるAMPキナーゼシグナルがブロックされたことから,アディポネクチンはAdipoR1-AMPキナーゼ-内皮型NO合成酵素シグナル伝達経路を介して血管内皮の保護作用を発揮する可能性が示唆された29).
さらに,アディポネクチンは培養血管内皮細胞においてCOX-2の発現を上昇させ,PGI2の分泌を促進することにより血管内皮の保護作用を発揮することも明らかにされている29)(図2).血管内皮に特異的なCOX-2ノックアウトマウスにおいて下肢虚血モデルを作製すると,血管新生が有意に障害されていた29).血管内皮に特異的なCOX-2ノックアウトマウスにおいてアデノウイルスベクターによりアディポネクチンを過剰に発現させると,血管新生の促進作用が認められず,アディポネクチンはAMPキナーゼシグナルにくわえ,COX-2-PGI2シグナル伝達経路を介して血管内皮の保護作用を発揮することが示された.また,アディポネクチンがCOX-2の発現を上昇させる分子機構としては,カルレティキュリンとそのアダプタータンパク質であるCD91を介してPI3キナーゼ-Aktシグナル伝達系を活性化することによることが示された29).
低アディポネクチン血症は高血圧にも関与することが報告されている.疫学的な検討により低アディポネクチン血症は高血圧の独立した危険因子であることが示された30).また,アディポネクチンノックアウトマウスに高食塩食を負荷すると2週間で有意な血圧の上昇を示したが31),アデノウイルスベクターによりアディポネクチンを発現させると高食塩食の負荷による血圧の上昇は認められなくなった.また,肥満および糖尿病のモデルであるKKAyマウスは週齢とともに血圧が上昇するが,アディポネクチンを過剰に発現させることにより血圧の上昇は抑制されることも明らかにされた31).アディポネクチンノックアウトマウスは高食塩食の負荷によりインスリン抵抗性は生じておらず,血管および腎臓における内皮型NO合成酵素の発現の低下がみられたことから,アディポネクチンは血管内皮に直接的に作用し,内皮型NO合成酵素の活性化によりNOの産生を上昇させることで血圧の上昇を抑制することが示唆された.以上のように,アディポネクチンはマクロファージおよび血管内皮細胞や心筋細胞といった心血管を構成する細胞に対し,さまざまな受容体を介して直接に作用し,炎症の抑制をはじめとする表現型を制御することにより多彩な心血管保護作用を発揮すると考えられた.しかし,受容体を介したシグナル伝達経路については十分に解明されておらず,さらなる研究成果が期待される.
2.CTRP9と心血管疾患
CTRP(C1q/TNF-related protein)ファミリータンパク質は補体C1qに構造が類似したC1q様ドメインおよびコラーゲンドメインをもち,アディポネクチンと構造的に類似していることからアディポネクチンパラログに分類されている32).CTRP9はCTRPファミリータンパク質のうちアディポネクチンとアミノ酸相同性がもっとも高く,アディポネクチンと同様にCTRP9の血中濃度は肥満モデルマウスにおいて低下することが報告されている33).また,心臓虚血再灌流モデルおよび心筋梗塞モデルにおいてもCTRP9の血中濃度は低下することが報告されている34,35).心筋障害モデルにおいて遊離脂肪酸の血中濃度が上昇しており,脂肪組織における酸化ストレスマーカーが上昇していること,培養脂肪細胞にパルミチン酸やH2O2を添加することによりCTRP9の発現が低下することから,CTRP9の発現は肥満においても心筋障害においても同様の機序により制御されている可能性があり興味深い34).
CTRP9は心血管疾患に対し防御的な作用をもつことが報告されている.マウスの心臓虚血再灌流モデルにおいてCTRP9の投与は心筋梗塞の範囲を減少させた34).心臓虚血再灌流ののちの心臓組織においてはAMPキナーゼによるリン酸化のレベルが亢進しているが,CTRP9の投与はAMPキナーゼによるリン酸化のレベルをさらに亢進した.培養心筋細胞を用いた検討において,ドミナントネガティブ型のAMPキナーゼを用いてAMPキナーゼシグナルをブロックすることによりCTRP9による心筋細胞のアポトーシスの抑制効果は消失したことから,CTRP9はアディポネクチンと同様にAMPキナーゼシグナルを介して心血管保護作用を発揮することが示唆された(図3).さらに,AdipoR1をsiRNAによりノックダウンするとCTRP9によるAMPキナーゼシグナルの亢進が阻害されたことから,CTRP9は心筋細胞においてAdipoR1-AMPキナーゼシグナル伝達経路を介して心筋保護作用を発揮することが示唆された34).また,2型糖尿病マウスにおける心筋梗塞モデルにおいても,CTRP9の投与は酸化ストレスを抑制することにより心筋保護作用を発揮することが報告されている36)(図3).また,血管壁に対しては,CTRP9の投与はアディポネクチンと同様にAdipoR1-AMPキナーゼ-内皮型NO合成酵素シグナル伝達経路を介して血管内皮に依存性の血管弛緩反応を促進することが報告されている37)(図3).
マウスの大腿動脈傷害モデルにおいても,CTRP9の投与は新生内膜の増加を抑制することが報告されている38)(図3).培養血管平滑筋細胞における検討では,CTRP9は平滑筋細胞の増殖を抑制し,その機序についてはCTRP9はAdipoR1やAMPキナーゼシグナルを介さずcAMP-プロテインキナーゼAシグナル伝達経路を介することが報告されている38)(図3).アディポネクチンはAMPキナーゼシグナルを介して平滑筋細胞の増殖を抑制し,平滑筋細胞においてcAMP-プロテインキナーゼAシグナル伝達経路を活性化しないため,CTRP9はアディポネクチンとは異なる機序により平滑筋細胞に作用すると考えられ,CTRP9によるcAMP-プロテインキナーゼAシグナル伝達経路の活性化に関与する受容体の同定が期待される.さらに,ApoEノックアウトマウスに対しレンチウイルスベクターを用いてCTRP9を長期間にわたり過剰に発現させることにより,頸動脈の動脈硬化巣における脂肪滴の面積および炎症性サイトカインの発現が抑制され,線維化および血管平滑筋細胞を増加させることによりプラークの安定化が促進されることも報告されている39).培養マクロファージにおいて,酸化した低密度リポタンパク質の添加により上昇する炎症性サイトカインの発現は,レンチウイルスベクターを用いてCTRP9を過剰に発現させることにより有意に抑制されることも報告されている39).
CTRP9はアディポネクチンと受容体を共有するだけでなく,アディポネクチンとオリゴマーを形成することも報告されている33).アディポネクチンノックアウトマウスは大腿動脈傷害モデルにおいて野生型のマウスに比べ新生内膜の増加の大きいことが報告されている40).アディポネクチンノックアウトマウスにCTRP9を過剰に発現させることにより新生内膜の増加が抑制されることも報告されており,CTRP9はアディポネクチンの一部の作用を代償している可能性が示唆された41).
3.FGF21と心血管疾患
FGF21はFGF(fibroblast growth factor,線維芽細胞増殖因子)ファミリーに属する分泌タンパク質である42,43).近年,FGF21は肝臓や骨格筋にくわえ,脂肪組織においても高く発現することが報告されている44,45).FGF21ノックアウトマウスは脂肪萎縮変性症の病態を呈し,インスリン抵抗性が増悪した46).一方,FGF21トランスジェニックマウスは肥満や2型糖尿病に対し抵抗性であった43).さらに,肥満マウスにFGF21を投与することにより血糖値や中性脂肪の血中濃度が劇的に改善したことが報告されている43).興味深いことに,FGF21は脂肪組織においてアディポネクチンの発現を上昇させること,さらに,アディポネクチンノックアウトマウスにおいてはFGF21のインスリン抵抗性に対する改善作用がなくなることが報告されており,FGF21による2型糖尿病に対する改善作用はアディポネクチンの発現の上昇を介することが示唆された47,48).
最近になり,マウスにおいてFGF21は圧負荷による心肥大や心臓虚血再灌流傷害に対し保護作用をもつことが報告されている49-51).マウスの心臓虚血再灌流モデルを作製したところ,肝臓および脂肪組織においてFGF21の発現が上昇し,心筋細胞においてFGF受容体1-β-klotho-Aktシグナル伝達経路を介して心筋細胞のアポトーシスが抑制されることが報告されている51)(図4).筆者らによる最新の報告では,アデノウイルスベクターによりFGF21の発現を上昇させると,野生型のマウスにおいてはアディポネクチンの血中濃度が上昇し,マウスの心筋梗塞モデルにおける心筋の肥大,肺のうっ血,心機能が著明に改善されたが,アディポネクチンノックアウトマウスではこれらは部分的にしか改善されなかった52).これより,FGF21による心筋梗塞ののちの心臓リモデリングの抑制作用は,少なくとも一部はアディポネクチンの分泌の促進を介していることが示唆された.一方,FGF21の投与による心筋梗塞ののちの炎症性サイトカインの抑制作用は,アディポネクチンノックアウトマウスにおいては完全に消失することより,FGF21による心筋梗塞ののちの炎症反応の抑制作用はアディポネクチンの分泌の促進を介することが示唆された(図4).
4.オメンチンと心血管疾患
オメンチンはインテレクチン1ともよばれており,もともと可溶性のガラクトフラノース結合レクチンとして同定された53).オメンチンは血中に分泌され三量体を形成することが報告されている53).脂肪組織,とくに内臓脂肪組織において高い発現が認められ,その血中濃度はアディポネクチンと同様に肥満において低下することが報告されている54,55).
近年,動脈硬化および冠動脈疾患とオメンチンとの関連についても報告されており,オメンチンの血中濃度は頸動脈壁の肥厚と負の相関を示すことが報告されている56,57).また,冠動脈疾患の患者ではオメンチンの血中濃度が有意に低いことが報告されている58).したがって,オメンチンはアディポネクチンと同様に,冠動脈疾患における有用なバイオマーカーになるうることが示唆された.
最近,筆者らは,マウスの心臓虚血再灌流モデルにおいて,オメンチンの投与により梗塞の範囲が著明に減少することを報告した59).ラットの新生仔心筋細胞を用いたin vitroにおける検討により,オメンチンはAMPキナーゼとAktの独立した2つのシグナル伝達経路を介して心筋細胞のアポトーシスを抑制することが明らかにされた59).さらに,脂肪組織に特異的なオメンチントランスジェニックマウスに大動脈縮窄手術を施行し圧負荷モデルを作製したところ,心肥大が著明に改善した60).また,オメンチンの前投与はAMPキナーゼシグナルを介したERKシグナルの抑制により,培養心筋細胞をフェニレフリンで処理することにより生じる心筋細胞の肥大を抑制することが報告されている60)(図5).以上より,オメンチンは肥満にともない生じる虚血性心疾患や心肥大の治療法の新たな標的になりうることが示唆された.
実験レベルにおいては,オメンチンは心血管保護作用をもつことが報告されている.オメンチンの添加は内皮型NO合成酵素の活性化を介して血管内皮に依存性の血管拡張反応を増強する61)(図5).また,野生型のマウスにオメンチンを全身投与すると,下肢虚血モデルにおける血流改善が内皮型NO合成酵素シグナルを介し促進されることも明らかにされた62).培養血管内皮細胞を用いた検討では,オメンチンの投与はAMPキナーゼ-内皮型NO合成酵素シグナル伝達経路を介してマトリゲルにおける血管新生を促進し,血管内皮細胞のアポトーシスを抑制することが報告されている62)(図5).さらに,オメンチンは血管内皮細胞のERK-NF-κBシグナル伝達経路を抑制することにより,VCAMやICAMなどの細胞接着因子の発現を抑制し単球の接着を抑制することが報告されている63).また,マウスの大腿動脈傷害モデルにおいて,オメンチンの投与はAMPキナーゼシグナルを介してERKシグナルを抑制することにより,新生内膜の増殖を抑制することが報告されている64)(図5).オメンチンは平滑筋細胞においてp38-JNKシグナル伝達経路を抑制し,VCAMやICAMなどの細胞接着因子の発現を抑制することも報告されている65).
以上のように,オメンチンは心血管疾患に対し,アディポネクチンと類似したシグナルを介して防御的な作用を発揮する.しかし,アディポネクチンがAMPキナーゼシグナルを介して心筋細胞のアポトーシスを抑制するのに対し,オメンチンはAMPキナーゼとAktの独立した2つのシグナル伝達経路を介して心筋細胞のアポトーシスを抑制するなど,アディポネクチンとは異なる機序により心血管保護作用を発揮することが考えられ,オメンチンの受容体の同定を含めた詳細なシグナル伝達経路の解明が期待される.
おわりに
炎症性アディポサイトカインと抗炎症性アディポサイトカインとのバランスの破綻が肥満関連疾患に及ぼす影響について,多くの知見が集積されつつある.このレビューにおいて紹介した,アディポネクチン,CTRP9,FGF21,オメンチンなど抗炎症性アディポサイトカインの肥満にともなう発現の低下は,脂肪組織あるいは遠隔の臓器において炎症を惹起し代謝性疾患や心血管疾患の進展に寄与している.それゆえ,これら抗炎症性アディポサイトカインの発現を上昇させることやその下流のシグナル伝達経路を増強させることは,肥満関連疾患の治療における新たな標的として有望である.また,CTRP9はアディポネクチンパラログであり,受容体としてアディポネクチンの受容体であるAdipoR1を共有することも報告されていることから,今後,アディポネクチンとアディポネクチンパラログとの相互作用,また,共通のシグナル伝達経路の解析が重要になると考えられる.ほかのアディポサイトカインとのあいだの相互作用に関しても,FGF21は脂肪組織におけるアディポネクチンの発現を上昇させることが報告されている.また,オメンチンの受容体はまだ明らかではないが,AMPキナーゼシグナルやAktシグナルなどアディポネクチンと共通のシグナルを活性化することから,アディポネクチンとの相互作用についてもさらなる研究が必要である.今後,これらの抗炎症性アディポサイトカイン,さらには,新規のアディポサイトカインの発現制御,機能,相互作用の検討が,肥満にともない惹起された臓器の炎症と,その結果としての心血管疾患の発症,その進展の分子機構の解明につながることが考えられる.
文 献
- Maeda, K., Okubo, K., Shimomura, I. et al.: cDNA cloning and expression of a novel adipose specific collagen-like factor, apM1 (AdiPose Most abundant Gene transcript 1). Biochem. Biophys. Res. Commun., 221, 286-289 (1996)[PubMed]
- Arita, Y., Kihara, S., Ouchi, N. et al.: Paradoxical decrease of an adipose-specific protein, adiponectin, in obesity. Biochem. Biophys. Res. Commun., 257, 79-83 (1999)[PubMed]
- Weyer, C., Funahashi, T., Tanaka, S. et al.: Hypoadiponectinemia in obesity and type 2 diabetes, close association with insulin resistance and hyperinsulinemia. J. Clin. Endocrinol. Metab., 86, 1930-1935 (2001)[PubMed]
- Ouchi, N., Kihara, S., Arita, Y. et al.: Novel modulator for endothelial adhesion molecules: adipocyte-derived plasma protein adiponectin. Circulation, 100, 2473-2476 (1999)[PubMed]
- Kumada, M., Kihara, S., Sumitsuji, S. et al.: Association of hypoadiponectinemia with coronary artery disease in men. Arterioscler. Thromb. Vasc. Biol., 23, 85-89 (2003)[PubMed]
- Okamoto, Y., Kihara, S., Ouchi, N. et al.: Adiponectin reduces atherosclerosis in apolipoprotein E-deficient mice. Circulation, 106, 2767-2770 (2002)[PubMed]
- Okamoto, Y., Folco, E. J., Minami, M. et al.: Adiponectin inhibits the production of CXC receptor 3 chemokine ligands in macrophages and reduces T-lymphocyte recruitment in atherogenesis. Circ. Res., 102, 218-225 (2008)[PubMed]
- Yokota, T., Oritani, K., Takahashi, I. et al.: Adiponectin, a new member of the family of soluble defense collagens, negatively regulates the growth of myelomonocytic progenitors and the functions of macrophages. Blood, 96, 1723-1732 (2000)[PubMed]
- Kumada, M., Kihara, S., Ouchi, N. et al.: Adiponectin specifically increased tissue inhibitor of metalloproteinase-1 through interleukin-10 expression in human macrophages. Circulation, 109, 2046-2049 (2004)[PubMed]
- Ohashi, K., Parker, J. L., Ouchi, N. et al.: Adiponectin promotes macrophage polarization toward an anti-inflammatory phenotype. J. Biol. Chem., 285, 6153-6160 (2010)[PubMed]
- Lovren, F., Pan, Y., Quan, A. et al.: Adiponectin primes human monocytes into alternative anti-inflammatory M2 macrophages. Am. J. Physiol. Heart Circ. Physiol., 299, H656-H663 (2010)[PubMed]
- Mandal, P., Pratt, B. T., Barnes, M. et al.: Molecular mechanism for adiponectin-dependent M2 macrophage polarization: link between the metabolic and innate immune activity of full-length adiponectin. J. Biol. Chem., 286, 13460-13469 (2011)[PubMed]
- Yamauchi, T., Kamon, J., Ito, Y. et al.: Cloning of adiponectin receptors that mediate antidiabetic metabolic effects. Nature, 423, 762-769 (2003)[PubMed]
- Takemura, Y., Ouchi, N., Shibata, R. et al.: Adiponectin modulates inflammatory reactions via calreticulin receptor-dependent clearance of early apoptotic bodies. J. Clin. Invest., 117, 375-386 (2007)[PubMed]
- Shibata, R., Sato, K., Pimentel, D. R. et al.: Adiponectin protects against myocardial ischemia-reperfusion injury through AMPK- and COX-2-dependent mechanisms. Nat. Med., 11, 1096-1103 (2005)[PubMed]
- Wang, Y., Wang, X., Jasmin, J. F. et al.: Essential role of caveolin-3 in adiponectin signalsome formation and adiponectin cardioprotection. Arterioscler. Thromb. Vasc. Biol., 32, 934-942 (2012)[PubMed]
- Denzel, M. S., Scimia, M. C., Zumstein, P. M. et al.: T-cadherin is critical for adiponectin-mediated cardioprotection in mice. J. Clin. Invest., 120, 4342-4352 (2010)[PubMed]
- Shibata, R., Ouchi, N., Ito, M. et al.: Adiponectin-mediated modulation of hypertrophic signals in the heart. Nat. Med., 10, 1384-1389 (2004)[PubMed]
- Holland, W. L., Miller, R. A., Wang, Z. V. et al.: Receptor-mediated activation of ceramidase activity initiates the pleiotropic actions of adiponectin. Nat. Med., 17, 55-63 (2011)[PubMed]
- Tao, L., Gao, E., Jiao, X. et al.: Adiponectin cardioprotection after myocardial ischemia/reperfusion involves the reduction of oxidative/nitrative stress. Circulation, 115, 1408-1416 (2007)[PubMed]
- Kondo, K., Shibata, R., Unno, K. et al.: Impact of a single intracoronary administration of adiponectin on myocardial ischemia/reperfusion injury in a pig model. Circ. Cardiovasc. Interv., 3, 166-173 (2010)[PubMed]
- Kistorp, C., Faber, J., Galatius, S. et al.: Plasma adiponectin, body mass index, and mortality in patients with chronic heart failure. Circulation, 112, 1756-1762 (2005)[PubMed]
- Shibata, R., Izumiya, Y., Sato, K. et al.: Adiponectin protects against the development of systolic dysfunction following myocardial infarction. J. Mol. Cell. Cardiol., 42, 1065-1074 (2007)[PubMed]
- Maruyama, S., Shibata, R., Ohashi, K. et al.: Adiponectin ameliorates doxorubicin-induced cardiotoxicity through Akt protein-dependent mechanism. J. Biol. Chem., 286, 32790-32800 (2011)[PubMed]
- Ohara, T., Kim, J., Asakura, M. et al.: Plasma adiponectin is associated with plasma brain natriuretic peptide and cardiac function in healthy subjects. Hypertens Res., 31, 825-831 (2008)[PubMed]
- Tsukamoto, O., Fujita, M., Kato, M. et al.: Natriuretic peptides enhance the production of adiponectin in human adipocytes and in patients with chronic heart failure. J. Am. Coll. Cardiol., 53, 2070-2077 (2009)[PubMed]
- Shibata, R., Ouchi, N., Kihara, S. et al.: Adiponectin stimulates angiogenesis in response to tissue ischemia through stimulation of amp-activated protein kinase signaling. J. Biol. Chem., 279, 28670-28674 (2004)[PubMed]
- Ouchi, N., Kobayashi, H., Kihara, S. et al.: Adiponectin stimulates angiogenesis by promoting cross-talk between AMP-activated protein kinase and Akt signaling in endothelial cells. J. Biol. Chem., 279, 1304-1309 (2004)[PubMed]
- Ohashi, K., Ouchi, N., Sato, K. et al.: Adiponectin promotes revascularization of ischemic muscle through a cyclooxygenase 2-dependent mechanism. Mol. Cell. Biol., 29, 3487-3499 (2009)[PubMed]
- Iwashima, Y., Katsuya, T., Ishikawa, K. et al.: Hypoadiponectinemia is an independent risk factor for hypertension. Hypertension, 43, 1318-1323 (2004)[PubMed]
- Ohashi, K., Kihara, S., Ouchi, N. et al.: Adiponectin replenishment ameliorates obesity-related hypertension. Hypertension, 47, 1108-1116 (2006)[PubMed]
- Wong, G. W., Krawczyk, S. A., Kitidis-Mitrokostas, C. et al.: Molecular, biochemical and functional characterizations of C1q/TNF family members, adipose-tissue-selective expression patterns, regulation by PPAR-γ agonist, cysteine-mediated oligomerizations, combinatorial associations and metabolic functions. Biochem. J., 416, 161-177 (2008)[PubMed]
- Wong, G. W., Krawczyk, S. A., Kitidis-Mitrokostas, C. et al.: Identification and characterization of CTRP9, a novel secreted glycoprotein, from adipose tissue that reduces serum glucose in mice and forms heterotrimers with adiponectin. FASEB J., 23, 241-258 (2009)[PubMed]
- Kambara, T., Ohashi, K., Shibata, R. et al.: CTRP9 protein protects against myocardial injury following ischemia-reperfusion through AMP-activated protein kinase (AMPK)-dependent mechanism. J. Biol. Chem., 287, 18965-18973 (2012)[PubMed]
- Sun, Y., Yi, W., Yuan, Y. et al.: C1q/tumor necrosis factor-related protein-9, a novel adipocyte-derived cytokine, attenuates adverse remodeling in the ischemic mouse heart via protein kinase A activation. Circulation, 128, S113-S120 (2013)[PubMed]
- Su, H., Yuan, Y., Wang, X. M. et al.: Inhibition of CTRP9, a novel and cardiac-abundantly expressed cell survival molecule, by TNFα-initiated oxidative signaling contributes to exacerbated cardiac injury in diabetic mice. Basic Res. Cardiol., 108, 315 (2013)[PubMed]
- Zheng, Q., Yuan, Y., Yi, W. et al.: C1q/TNF-related proteins, a family of novel adipokines, induce vascular relaxation through the adiponectin receptor-1/AMPK/eNOS/nitric oxide signaling pathway. Arterioscler. Thromb. Vasc. Biol., 31, 2616-2623 (2011)[PubMed]
- Uemura, Y., Shibata, R., Ohashi, K. et al.: Adipose-derived factor CTRP9 attenuates vascular smooth muscle cell proliferation and neointimal formation. FASEB J., 27, 25-33 (2013)[PubMed]
- Li, J., Zhang, P., Li, T. et al.: CTRP9 enhances carotid plaque stability by reducing pro-inflammatory cytokines in macrophages. Biochem. Biophys. Res. Commun., 458, 890-895 (2015)[PubMed]
- Matsuda, M., Shimomura, I., Sata, M. et al.: Role of adiponectin in preventing vascular stenosis. The missing link of adipo-vascular axis. J. Biol. Chem., 277, 37487-37491 (2002)[PubMed]
- Uemura. Y., Shibata, R., Ohashi, K. et al.: Adipose-derived factor CTRP9 attenuates vascular smooth muscle cell proliferation and neointimal formation. FASEB J., 27, 25-33 (2013)[PubMed]
- Nishimura, T., Nakatake, Y., Konishi, M. et al.: Identification of a novel FGF, FGF-21, preferentially expressed in the liver. Biochim. Biophys. Acta, 1492, 203-206 (2000)[PubMed]
- Kharitonenkov, A., Shiyanova, T. L., Koester, A. et al.: FGF-21 as a novel metabolic regulator. J. Clin. Invest., 115, 1627-1635 (2005)[PubMed]
- Zhang, X., Yeung, D. C., Karpisek, M. et al.: Serum FGF21 levels are increased in obesity and are independently associated with the metabolic syndrome in humans. Diabetes, 57, 1246-1253 (2008)[PubMed]
- Muise, E. S., Azzolina, B., Kuo, D. W. et al.: Adipose fibroblast growth factor 21 is up-regulated by peroxisome proliferator-activated receptor γ and altered metabolic states. Mol. Pharmacol., 74, 403-412 (2008)[PubMed]
- Dutchak, P. A., Katafuchi, T., Bookout, A. L. et al.: Fibroblast growth factor-21 regulates PPARγ activity and the antidiabetic actions of thiazolidinediones. Cell, 148, 556-567 (2012)[PubMed]
- Lin, Z., Tian, H., Lam, K. S. et al.: Adiponectin mediates the metabolic effects of FGF21 on glucose homeostasis and insulin sensitivity in mice. Cell Metab., 17, 779-789 (2013)[PubMed]
- Holland, W. L., Adams, A. C., Brozinick, J. T. et al.: An FGF21-adiponectin-ceramide axis controls energy expenditure and insulin action in mice. Cell Metab., 17, 790-797 (2013)[PubMed]
- Planavila, A., Redondo, I., Hondares, E. et al.: Fibroblast growth factor 21 protects against cardiac hypertrophy in mice. Nat. Commun., 4, 2019 (2013)[PubMed]
- Cong, W. T., Ling, J., Tian, H. S. et al.: Proteomic study on the protective mechanism of fibroblast growth factor 21 to ischemia-reperfusion injury. Can. J. Physiol. Pharmacol., 91, 973-984 (2013)[PubMed]
- Liu, S. Q., Roberts, D., Kharitonenkov, A. et al.: Endocrine protection of ischemic myocardium by FGF21 from the liver and adipose tissue. Sci. Rep., 3, 2767 (2013)[PubMed]
- Joki, Y., Ohashi, K., Yuasa, D. et al.: FGF21 attenuates pathological myocardial remodeling following myocardial infarction through the adiponectin-dependent mechanism. Biochem. Biophys. Res. Commun., 459, 124-130 (2015)[PubMed]
- Tsuji, S., Uehori, J., Matsumoto, M. et al.: Human intelectin is a novel soluble lectin that recognizes galactofuranose in carbohydrate chains of bacterial cell wall. J. Biol. Chem., 276, 23456-23463 (2001)[PubMed]
- Yang, R. Z., Lee, M. J., Hu, H. et al.: Identification of omentin as a novel depot-specific adipokine in human adipose tissue, possible role in modulating insulin action. Am. J. Physiol. Endocrinol. Metab., 290, E1253-E1261 (2006)[PubMed]
- de Souza Batista, C. M, Yang, R. Z., Lee, M. J. et al.: Omentin plasma levels and gene expression are decreased in obesity. Diabetes, 56, 1655-1661 (2007)[PubMed]
- Shibata, R., Takahashi, R., Kataoka, Y. et al.: Association of a fat-derived plasma protein omentin with carotid artery intima-media thickness in apparently healthy men. Hypertens. Res., 34, 1309-1312 (2011)[PubMed]
- Yoo, H. J., Hwang, S. Y., Hong, H. C. et al.: Association of circulating omentin-1 level with arterial stiffness and carotid plaque in type 2 diabetes. Cardiovasc. Diabetol., 10, 103 (2011)[PubMed]
- Shibata, R., Ouchi, N., Kikuchi, R. et al.: Circulating omentin is associated with coronary artery disease in men. Atherosclerosis, 219, 811-814 (2011)[PubMed]
- Kataoka, Y., Shibata, R., Ohashi, K. et al.: Omentin prevents myocardial ischemic injury through AMPK- and Akt-dependent mechanisms. J. Am. Coll. Cardiol., 63, 2722-2733 (2014)[PubMed]
- Matsuo, K., Shibata, R., Ohashi, K. et al.: Omentin functions to attenuate cardiac hypertrophic response. J. Mol. Cell. Cardiol., 79, 195-202 (2015)[PubMed]
- Yamawaki, H., Tsubaki, N., Mukohda, M. et al.: Omentin, a novel adipokine, induces vasodilation in rat isolated blood vessels. Biochem. Biophys. Res. Commun., 393, 668-672 (2010)[PubMed]
- Maruyama, S., Shibata, R., Kikuchi, R. et al.: Fat-derived factor omentin stimulates endothelial cell function and ischemia-induced revascularization via endothelial nitric oxide synthase-dependent mechanism. J. Biol. Chem., 287, 408-417 (2012)[PubMed]
- Zhong, X., Li, X., Liu, F. et al.: Omentin inhibits TNF-α-induced expression of adhesion molecules in endothelial cells via ERK/NF-κB pathway. Biochem. Biophys. Res. Commun., 425, 401-406 (2012)[PubMed]
- Uemura, Y., Shibata, R., Kanemura, N. et al.: Adipose-derived protein omentin prevents neointimal formation after arterial injury. FASEB J., 29, 141-151 (2015)[PubMed]
- Kazama, K., Usui, T., Okada, M. et al.: Omentin plays an anti-inflammatory role through inhibition of TNF-α-induced superoxide production in vascular smooth muscle cells. Eur. J. Pharmacol., 686, 116-123 (2012)[PubMed]
著者プロフィール
略歴:2006年 大阪大学大学院医学系研究科 修了,2007年 米国Boston大学School of Medicine研究員を経て,2010年より名古屋大学大学院医学系研究科 助教.
大内 乗有(Noriyuki Ouchi)
名古屋大学大学院医学系研究科 教授.
© 2015 大橋浩二・大内乗有 Licensed under CC 表示 2.1 日本