がん免疫療法:基礎研究から臨床応用にむけて
2015/04/21
杉山大介・西川博嘉
(国立がん研究センター先端医療開発センター 免疫TR分野)
email:杉山大介
領域融合レビュー, 4, e005 (2015) DOI: 10.7875/leading.author.4.e005
Daisuke Sugiyama & Hiroyoshi Nishikawa: Cancer immunology: bench to bedside.

近年,がんの新たな治療法としてがん免疫療法が脚光をあびている.その契機となったのは,抗CTLA-4抗体および抗PD-1抗体ががんの治療薬として承認されたことである.いずれの医薬品も,からだに備わる免疫系を操作し,がんを排除する免疫力を強化することによりがんを治療する.この“免疫によりがんを排除する”という概念が医薬品になったことは,これまでのがん治療に新たな選択肢をもたらした.このレビューでは,これまでのがん免疫学における基礎研究を紹介しつつ,基礎研究から臨床応用への橋渡し研究の成功例を示し,今後のがん免疫療法の進展について考察する.
現在では,2人に1人ががんを発症し,3人に1人ががんにより死亡するとの統計が算出されている.がんの治療法は日々進歩しており,治癒率および生存率は向上している.しかしながら,依然としてがんによる死亡率は上昇しつづけており,新たな治療法の開発がもとめられている.そのなかで,がん免疫療法ががんの新たな治療法として注目されている.ヒトにおいては1日に数千個ものがん細胞が発生しているといわれているが,必ずしもそれらすべてががんの発症には直結しない.その理由のひとつは,からだに備わる免疫機構がこれらのがん細胞を排除しているからである.われわれのからだにおいては,がんを排除する免疫機構とがんが生き延びる機構とがつねに拮抗しており,バランスが後者にかたむくことによりがんが発症する.このレビューでは,がんの排除にかかわる免疫機構およびがんの生存を手助けする免疫機構に着目しつつ,免疫チェックポイントタンパク質を中心に解説する.
ここ十数年のうちに,がん免疫療法の存在が世に広く知られ,急速に発展し,その研究も多くなされるようになった.過剰な免疫応答によりがんが排除されるという現象は,丹毒に感染した悪性腫瘍の患者において腫瘍の退縮が確認されたという1868年の報告が起源とされている1).そののち1893年には,丹毒の原因である連鎖球菌の注入による激しい免疫応答を利用した,切除不能の悪性腫瘍に対する治療が実施された2).これらの事象から,免疫系ががんの発生を抑制するという説が1909年にはじめて提唱された.そののち1950年から1970年にかけ,免疫系ががん細胞を排除することによりがんの発生を抑制しているという“cancer immunosurveillance”という考えが提唱されたが,1974年に,ヌードマウス(免疫不全マウス)を用いた実験において免疫系の有無により発がんに差異はみられないことが報告され,がん免疫の研究は後退した.しかしのちに,ヌードマウスは完全な免疫不全を示しておらず,より免疫不全を示すRAGノックアウトマウスを用いた実験において免疫による発がんの遅延が実証されるとともに,ヒトのがん抗原の発見によりがん免疫の研究はふたたび進展することになった3).現在では,CTLA-4やPD-1といった免疫チェックポイントタンパク質の研究,腫瘍の局所における免疫細胞の機能に関する研究など,広く応用が進められている.
がん免疫にはさまざまな免疫細胞が関与しており,がん細胞の駆逐を担う細胞とがん細胞の生存および増殖を助ける細胞とが存在する.前者にはキラーT細胞(CD8陽性T細胞),ナチュラルキラー細胞,樹状細胞,マクロファージが含まれ,後者には制御性T細胞,骨髄由来抑制細胞が含まれる.
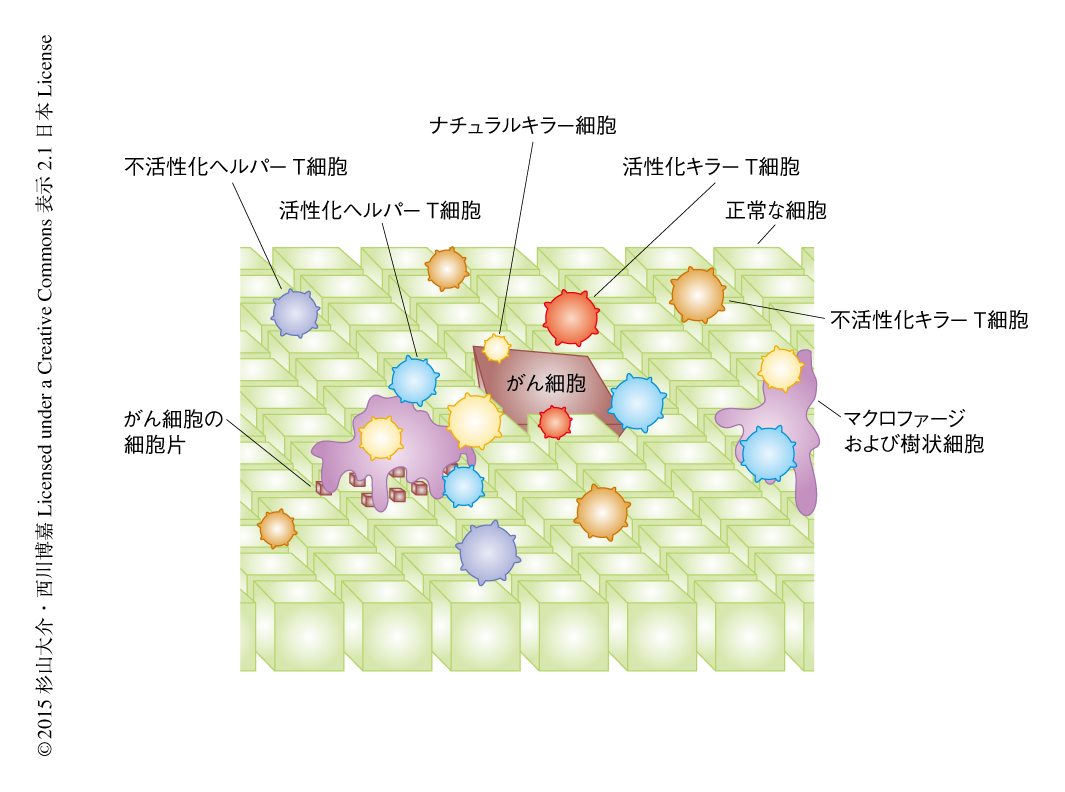
がんの発生初期にはナチュラルキラー細胞によりがん細胞が破壊され,その細胞片を樹状細胞やマクロファージが取り込み,がん細胞片に含まれるがん抗原を分解しがん抗原ペプチドを生成する.これらの細胞は抗原提示細胞とよばれ,MHC(major histocompatibility complex,主要組織適合遺伝子複合体)のクラスI分子あるいはクラスII分子においてがん抗原ペプチドを提示する(図1).ヒトの場合,MHCはHLA(human leukocyte antigen,ヒト白血球型抗原)ともよばれている.キラーT細胞はMHCクラスI分子に提示されたがん抗原ペプチドをT細胞受容体により認識しシグナルを伝達するとともに,抗原提示細胞の表面に存在する共刺激タンパク質と相互作用することにより,がん細胞を攻撃する活性化キラーT細胞になる.
がん細胞はさまざまな免疫逃避機構をもち,そのなかには制御性T細胞や骨髄由来抑制細胞といった免疫抑制細胞のリクルートもふくまれる.制御性T細胞は抗原提示細胞の共刺激タンパク質の機能を低下させキラーT細胞を不活性化させる.骨髄由来抑制細胞はサイトカインあるいは細胞傷害タンパク質を産生しキラーT細胞の機能および生存を低下させる.抗がん免疫応答を担う免疫細胞とその抑制を担う免疫細胞の機能についてはまだ不明な点が多く,それらを解明することでより効果的ながん免疫療法の開発が可能になると思われる.
CTLA-4(cytotoxic T-lymphocyte-associated antigen 4)は1987年にマウスに由来するキラーT細胞クローンのcDNAライブラリーから遺伝子がクローニングされた,リンパ球に特有の免疫グロブリンスーパーファミリーに属する糖タンパク質である4).1988年にはヒトにおいても同定され5),1991年および1992年にCTLA-4-免疫グロブリン融合タンパク質を用いた実験によりCTLA-4を介する分子機構がT細胞の免疫応答を抑制することが示された6,7).同じ時期に,CTLA-4と同じく免疫グロブリンスーパーファミリーに属する糖タンパク質であるCD28が同定され,CTLA-4とは対称的にT細胞を活性化する機能をもつことが報告された.CTLA-4およびCD28の機能を考慮し,CTLA-4の機能を抑制させCD28シグナルによるT細胞の活性化を促進させることががんの退縮につながると報告されはじめ,1996年には担がんマウスへの抗CTLA-4抗体の投与により腫瘍の退縮効果が観察されたことが報告された8).この報告が,生体において抗CTLA-4抗体の投与による免疫応答の活性化が腫瘍の退縮を促進することを示した,はじめての例である.
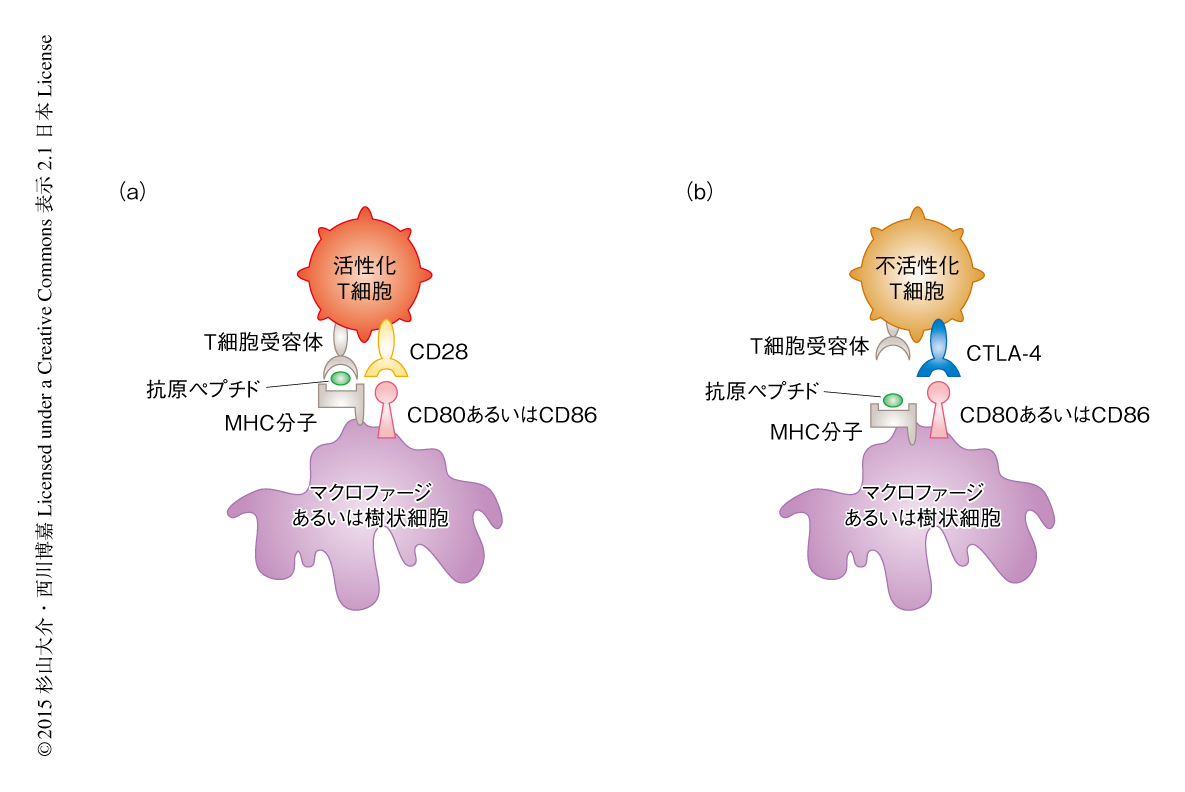
CTLA-4を介した免疫細胞の不活性化はCD28シグナルとの競合に依存する.CTLA-4およびCD28はともに,抗原提示細胞あるいはがん細胞の表面に存在するCD80(B7-1)あるいはCD86(B7-2)と相互作用することにより機能する.CD28は恒常的にT細胞の表面に発現しているが,CTLA-4はT細胞が活性化していないときには細胞の内部に存在し活性化されると細胞の表面へと移行する.CD28シグナルによるT細胞の活性化ののち,CTLA-4が機能することによりT細胞の活性化は抑制されるが,CTLA-4とCD80あるいはCD86との親和性はCD28とCD80あるいはCD86との親和性よりも10~100倍も高く,T細胞の活性化ののちにはCTLA-4が優先的に機能する9).このフィードバック機構により,活性化したT細胞の過剰な応答は抑制されている(図2).
CTLA-4はCD28とCD80あるいはCD86との相互作用を阻害すること,または,CD80あるいはCD86を細胞から奪うことにより免疫抑制機構を担うと考えられている.後者の場合,のちに述べる制御性T細胞(CTLA-4が恒常的に細胞の表面に発現している)が深く関与しており,CD80あるいはCD86を失った細胞はT細胞を活性化することができなくなる.そのほかの抑制機構としては,相互作用によるCTLA-4の下流のシグナルによる直接的な抑制がある.これまでの研究により,CTLA-4の細胞内ドメインに作用するいくつかのタンパク質が報告されているが,抑制機構を直接に担うタンパク質は確定されておらず,現在もその解明にむけた研究がなされている10).
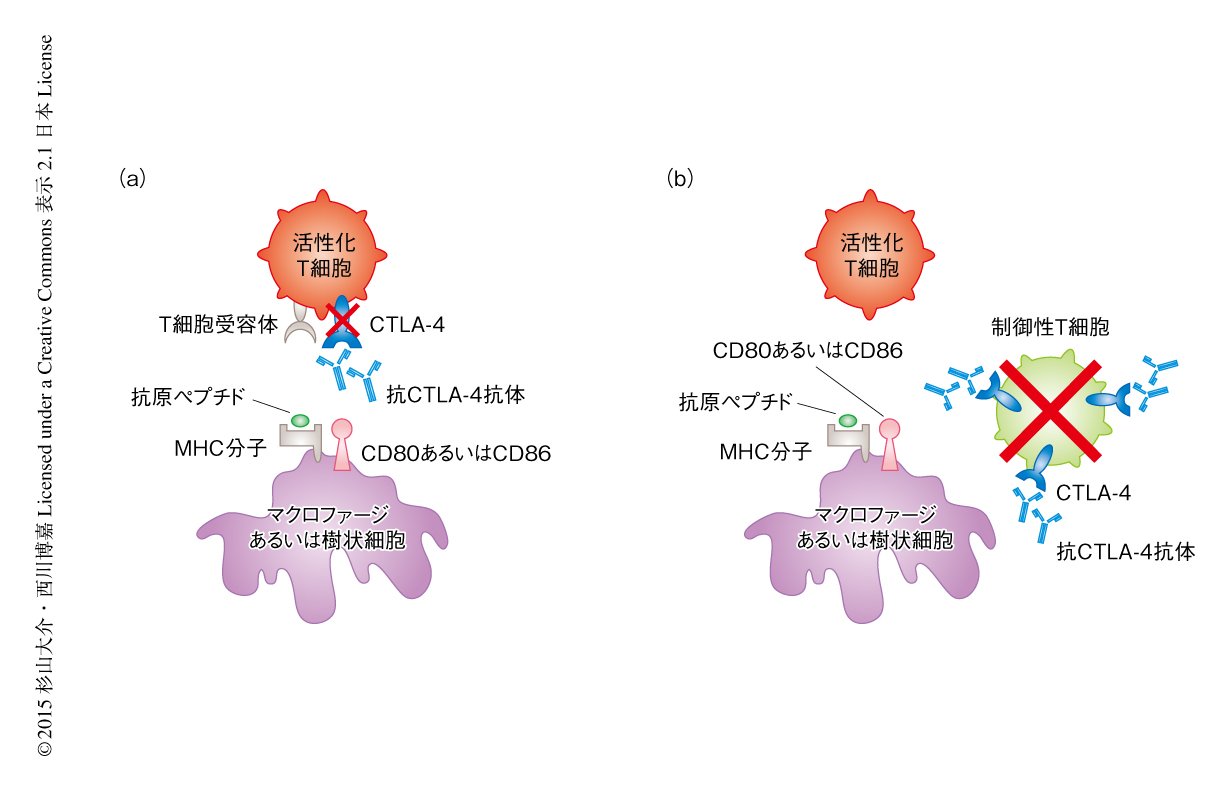
1996年の報告につづき,マウスにおいて抗CTLA-4抗体の投与による腫瘍の退縮効果がさまざまながん腫において確認されている11)(図3).これらの実験結果をふまえ,2000年にはじめて,ヒトにおいて抗CTLA-4抗体の有効性の評価が試みられ,悪性がんの患者および転移性がんの患者への投与により,悪性黒色腫および卵巣がんにおいて一定の抗腫瘍免疫応答の増強効果が確認された12).この第I相臨床試験では重篤な有害事象が確認されなかったため,ひきつづき,第II相臨床試験および第III相臨床試験が実施された.第III相臨床試験は切除不能かつ化学療法抵抗性の悪性黒色腫の患者676人を対象とし,抗ヒトCTLA-4モノクローナル抗体(イピリムマブ)単独,イピリムマブとgp100ペプチドワクチンとの併用,gp100ペプチドワクチン単独,の3グループで実施された13).gp100は悪性黒色腫に特異的な腫瘍抗原であり,使用されたペプチドはキラーT細胞がgp100を認識するエピトープ配列から作製された.臨床試験の結果,イピリムマブ単独,イピリムマブとgp100ペプチドワクチンとの併用,gp100ペプチドワクチン単独のそれぞれの治療による12カ月生存率は45.6%,43.6%,25.3%,24カ月生存率は23.5%,21.6%,13.7%であり,イピリムマブの投与による延命効果が確認された.この臨床試験の結果にもとづき,2011年にイピリムマブは米国Food and Drug Administration(FDA,食品医薬品局)から世界初の免疫活性化抗体医薬として承認された.2012年には,初発悪性黒色腫の患者を対象としたイピリムマブとダカルバジン(悪性黒色腫に対する抗悪性腫瘍剤)の併用投与を実施した第III相臨床試験の結果が報告され,ダカルバジン単独よりイピリムマブとの併用において延命効果が認められた14).現在,イピリムマブはほかの悪性腫瘍への効果あるいはほかの標準化学療法との併用が試みられ,悪性黒色腫への承認からの適応の拡大が進められている15).
イピリムマブの投与により抗腫瘍免疫応答は増強されるが,一方で,免疫活性を総体的に増強するために自己免疫疾患を発症することが報告されている.ある臨床試験においてはイピリムマブを投与した患者の60%に有害事象がみられ,その多くが皮膚あるいは消化管に関する自己免疫疾患であった13).ほかの臨床試験においてもイピリムマブを投与した患者のうち約半数が同様の自己免疫疾患を発症したと報告されている14).このような副作用を抑えるため,イピリムマブを投与した患者へは免疫抑制剤が投与されているが,副作用を抑えつつ抗腫瘍免疫応答を維持するのに今後の検討が必要と考えられる.
PD-1(programmed death 1)は1992年に細胞死を誘導したマウスのT細胞株に由来するcDNAライブラリーから遺伝子がクローニングされた,免疫グロブリンスーパーファミリーに属する膜タンパク質であり16),1994年にはヒトにおいても同定された17).当初,PD-1はプログラム細胞死をひき起こすと考えられていたが,リガンドであるPD-L1(B7-H1)あるいはPD-L2(B7-H2)と相互作用することによりT細胞の活性化を抑制することが明らかにされた18).PD-1はT細胞だけでなく,B細胞,ナチュラルキラー細胞,ナチュラルキラーT細胞,骨髄系細胞にも発現している18).また,PD-L1は抗原提示細胞だけでなく,がん細胞あるいは感染細胞といったさまざまな細胞において恒常的に発現しているが,PD-L2は抗原提示細胞あるいは一部のB細胞でのみ恒常的に発現し,腫瘍の局所において種々のサイトカインにより発現が誘導される19).PD-1シグナルによるT細胞の活性化の抑制機構はPD-1とPD-L1あるいはPD-L2との相互作用にともない促進される.すなわち,相互作用ののちにPD-1の細胞質ドメインにチロシン脱リン酸化酵素の一種であるSHP-2がリクルートされ,T細胞受容体シグナル伝達タンパク質であるZAP70を不活性化させることによりT細胞の機能を抑制する18).また,PD-L1はCD80との相互作用することが可能であり,その結果,T細胞の活性化が抑制されることも報告されている20).
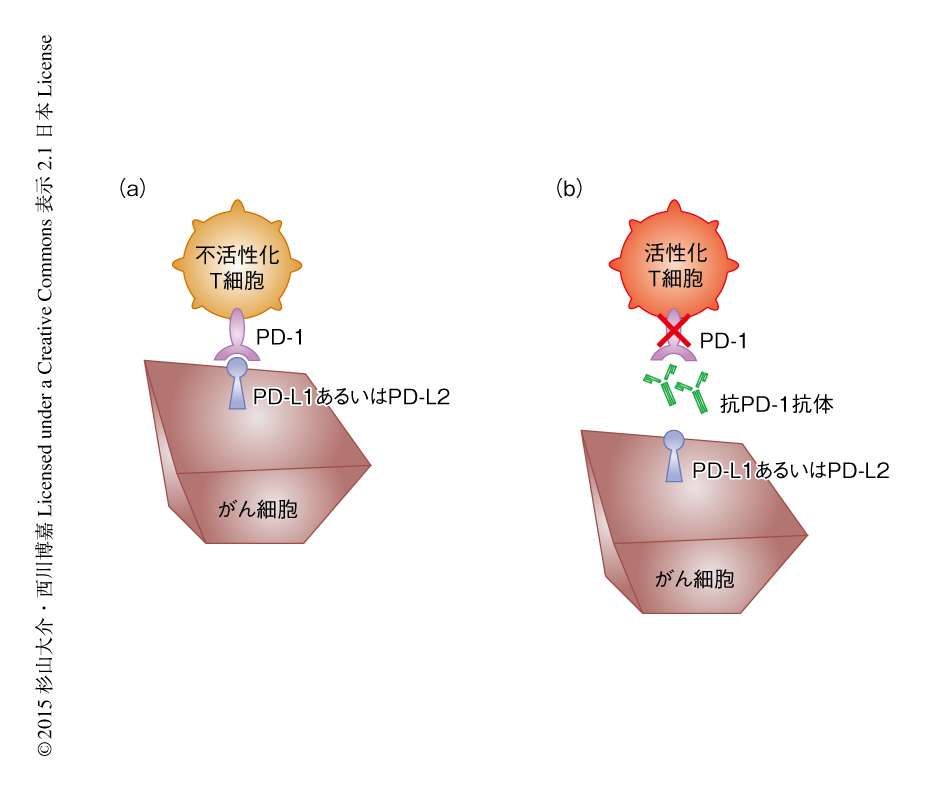
腫瘍の局所ではキラーT細胞およびナチュラルキラー細胞がPD-1を高く発現しており,抗腫瘍免疫応答の減弱の原因とされている.このPD-1シグナルを抗PD-1抗体あるいは抗PD-L1抗体を使用して阻害し抗腫瘍免疫応答の減弱を抑制することによりその増強効果が得られることが推察され,抗PD-1抗体あるいは抗PD-L1抗体を用いPD-1とPD-L1との相互作用を阻害することによりがん免疫応答を増強できることが報告されている21,22).また,抗PD-1抗体は担がんに存在するPD-1陽性CD8陽性T細胞を再活性化することが報告されている(図4).
動物実験の結果,抗PD-1抗体あるいは抗PD-L1抗体の投与による抗腫瘍免疫応答の増強が確認されたことから,これらの抗体を用いたがん患者を対象とする臨床試験が開始され,一定の臨床効果が認められたとの報告がなされている23).完全ヒト化抗体である抗PD-1抗体(ニボルマブ)の第I相臨床試験では,悪性黒色腫の患者に対し28%,非小細胞肺がんの患者に対し18%,腎細胞がんの患者に対し27%の奏効率を示した.のちの臨床試験の結果から,2014年にニボルマブは悪性黒色腫の患者を対象とした治療薬として日本で承認された.ニボルマブの効果をより高めるためイピリムマブとの併用療法も試みられており,悪性黒色腫の患者において,イピリムマブ単独の投与が11%,ニボルマブ単独の投与が31%の臨床的な効果であったのに対し,併用投与では65%の効果を示したことが報告されている24).現在,ニボルマブは悪性黒色腫のほかのがん腫を対象とした臨床試験が多く実施され,化学療法との併用治療も試みられており,いずれも臨床的な効果が期待されている.抗PD-1抗体の投与は全身の免疫応答を増強させるため,抗CTLA-4を投与した患者と同様に自己免疫疾患を発症する患者が確認されており,対応策を考える必要がある24).
抗PD-L1抗体を投与した臨床試験の結果は2012年にはじめて報告され,固形がんの患者を対象とした臨床試験の結果では,悪性黒色腫の患者に対し17%,腎細胞がんの患者に対し12%,非小細胞肺がんの患者に対し10%,卵巣がんの患者に対し5%の奏功率を示した25).この結果は抗PD-1抗体の単独での投与の効果より低いものであったが,この臨床試験において使用された抗体とは異なる抗PD-L1抗体を用いた臨床試験では,悪性黒色腫の患者に対し29%の奏功率,あるいは,非小細胞肺がんの患者に対し22%,腎細胞がんの患者に対し13%の奏功率を示したことが報告されている23).
これまで述べたCTLA-4およびPD-1のほかにも免疫チェックポイントタンパク質が見い出されており,今後の臨床への応用が期待されている.
TIM-3(T-cell immunoglobulin and mucin containing protein-3)は2002年にCD4陽性Th1細胞あるいはCD8陽性T細胞に発現していることが見い出された,免疫グロブリンスーパーファミリーに属する膜タンパク質である26).TIM-3はガレクチン9をリガンドとし,その相互作用によりエフェクターT細胞の活性化を抑制する.腫瘍の局所ではTIM-3のみあるいはTIM-3およびPD-1を共発現するCD8陽性T細胞の抗腫瘍免疫活性の弱いことがヒトおよびマウスにおいて確認されている.このTIM-3シグナルを抗TIM-3抗体により阻害することにより抗腫瘍免疫応答を増強できることがマウスにおいて実証されており,現在,ヒトへの応用が試みられている11).
LAG-3(lymphocyte activation gene-3)は1990年にCD4陽性T細胞において発現が確認された,免疫グロブリンスーパーファミリーに属する膜タンパク質である27).のちの研究により,ナチュラルキラー細胞,B細胞,リンパ球系樹状細胞にも発現していることが見い出され,LAG-3はMHCクラスII分子との相互作用により活性化T細胞を抑制する機能を担う.抗LAG-3抗体を使用したLAG-3シグナルの阻害,および,抗PD-1抗体との併用投与により抗腫瘍免疫応答が増強されることがマウスにおいて証明されている.この実験結果から抗LAG-3抗体はヒトに対し応用されており,第I相臨床試験において悪性黒色腫の患者に対する投与が試みられている11).
B7-H3,B7-H4,B7-H5(VISTA)はB7ファミリーに属する膜タンパク質であり,それぞれ,2001年,2003年,2011年に見い出された28-30).B7-H3はさまざまながん腫および抗原提示細胞に発現しており,T細胞受容体と相互作用することによりT細胞に対し活性化あるいは抑制の両方のシグナルを伝達する.しかし,がん細胞におけるB7-H3の発現が患者の予後不良と相関することから,腫瘍の局所においてB7-H3シグナルは抗腫瘍免疫応答を抑制する機能を担うと考えられている.B7-H4はB7-H3と同様にがん細胞および抗原提示細胞において発現しており,相互作用により活性化T細胞を抑制する機能を担う.とりわけ,腫瘍の局所では腫瘍関連マクロファージにおける発現が腫瘍の増悪に関与している.がん患者においてB7-H4の高い発現が予後不良と相関することも報告されている.B7-H5はT細胞に抑制性のシグナルを伝達する機能を担い,マウスでは腫瘍の局所におけるCD11bの発現と正の相関のあることが報告されている.また,B7-H5シグナルを阻害することにより抗腫瘍免疫応答の増強を促進させることがマウスにおいては確認されている.これら3つのタンパク質と相互作用する受容体は同定されていないが,B7-H3に対するヒト化抗体が開発されており,第I相臨床試験において再発性のがん患者に投与されている11).
TIGIT(T cell immunoreceptor with Ig and ITIM domain)は2009年に見い出された免疫グロブリンスーパーファミリーに属する膜タンパク質であり,活性化されたT細胞およびナチュラルキラー細胞に発現していることが報告されている31).そのリガンドは抗原提示細胞に発現しているCD112およびCD155であり,これらはCD226とよばれる受容体とも相互作用する.これらTIGITあるいはCD226とCD112あるいはCD155との相互作用は,CTLA-4あるいはCD28とCD80あるいはCD86との相互作用と類似しており,TIGITシグナルは免疫抑制機能を担いCD226シグナルは免疫活性機能を担う.TIGITシグナルはCTLA-4シグナルよりも弱い免疫抑制機能をもつが,TIGITシグナルを阻害することにより免疫応答を活性化できることが確認されている11).
1970年代に一部のT細胞が免疫抑制機能をもつとの報告がなされ,1995年に制御性T細胞が同定されてから世界中で注目され多くの研究が進められている32).すなわち,CD4陽性T細胞のうちCD25陽性細胞を除去したT細胞を免疫不全マウス(ヌードマウス)に移入することにより自己免疫疾患が発症し,CD4陽性CD25陽性T細胞の再移入によりその発症が抑制されることが見い出され,制御性T細胞としてCD4陽性CD25陽性T細胞が同定された32).2001年にはヒトにおいても同様の制御性T細胞が同定され,2003年には制御性T細胞のマスター遺伝子として知られるFoxp3遺伝子が同定されたことにより,より厳密に制御性T細胞を定義することが可能になった33)(制御性T細胞については,濱口真英・坂口志文, 領域融合レビュー, 2, e005, 2013 も参照されたい).転写因子であるFoxp3はさまざまな免疫応答関連遺伝子の発現を制御しており,制御性T細胞において恒常的に発現しているCTLA-4の発現制御に関与していることが明らかにされている.このCTLA-4が制御性T細胞による免疫抑制機能に重要であることはさきに述べたが,そのほかの免疫抑制機能としては,抑制性サイトカインの産生による活性化細胞の抑制,活性化細胞へのアポトーシスの誘導などが示唆されている34).
腫瘍免疫において制御性T細胞は抗腫瘍免疫応答を抑制しており,制御性T細胞の除去による腫瘍の退縮効果が検討されている.初期の研究では,抗CD25抗体の投与による制御性T細胞の除去が腫瘍の退縮につながることが実証され35),のちのジフテリア毒素の投与によるFoxp3陽性制御性T細胞の特異的な除去も同様の結果を示している36).CTLA-4と同様に,PD-1およびLAG-3も制御性T細胞に発現していることが報告されており,これらの免疫チェックポイントタンパク質を介した免疫抑制機能の解明が進められている11).とりわけ,抗CTLA-4抗体による抗体に依存性の細胞傷害活性により制御性T細胞が排除されることで抗腫瘍免疫応答が増強することが重要視されている.最近の研究では,制御性T細胞のホーミングおよび細胞内シグナルが注目され,CCR10に依存的な腫瘍の局所へのホーミングの阻害,あるいは,アセチルトランスフェラーゼp300あるいはPI3キナーゼの阻害により,制御性T細胞の抑制機能を解除することで抗腫瘍免疫応答が増強されることが報告されている37-39).
ヒトでは,胃がん,肺がん,肝臓がん,膵臓がん,頭頸部がんなど,多くのがん腫において制御性T細胞が増加していることが明らかにされており40),制御性T細胞の腫瘍の局所への浸潤ががん患者の予後不良因子であることが多く報告されている.これらの臨床データから,制御性T細胞の除去による抗腫瘍免疫応答の増強を目的とした臨床試験がなされており,ヒト化抗CD25抗体(ダクリズマブ)やジフテリア毒素融合IL-2製剤などが開発され使用されている.しかし,CD25は活性化T細胞における発現もみられるため,抗CD25抗体の投与による制御性T細胞の特異的な除去はかぎられており,臨床試験においても一定の結果は得られていない41).現在では,制御性T細胞により特異的に発現するタンパク質を標的とした方法が模索されており,そのひとつとして,腫瘍の局所への制御性T細胞の浸潤の機構に着目した試みがなされている.
筆者らは,そのアプローチとしてケモカイン受容体のひとつCCR4を介した制御性T細胞の腫瘍への浸潤に着目した.CCR4はCCL17およびCCL22をリガンドとし,それらがさまざまな細胞により腫瘍の局所において放出されるとCCR4陽性制御性T細胞が腫瘍の局所にリクルートされる.このCCR4強陽性制御性T細胞が悪性黒色腫の局所に多く浸潤しており,抗CCR4抗体を用いることによりこれらの制御性T細胞の除去が可能であり,それにともない抗腫瘍免疫応答が増強されることを見い出した42).現在,この研究をもとに,固形がんの患者への抗CCR4抗体の投与が試みられており,腫瘍の局所において制御性T細胞が減少するかどうか検討がなされている.
免疫チェックポイントタンパク質の阻害によるがん免疫療法は,全身の免疫細胞を非特異的に増強させることで腫瘍の退縮につなげているが,その反面,さきにも述べたように,免疫細胞の活性化にともなう自己免疫疾患を発症してしまう.そこで,がん細胞を特異的に攻撃する免疫細胞のみを活性化させるがんワクチン療法の開発が進められている.がんワクチン療法では特定の免疫細胞のみが活性化されるため,自己免疫疾患の発症を抑えることができる.ワクチンに使用されるがん抗原としては,がん抗原ペプチド,全長のがん抗原,がん抗原ペプチドを提示した樹状細胞が使用されている43).これまで,多数のがん抗原が見い出されており,そのなかからがんワクチン療法に適しているがん抗原がピックアップされている44).この報告では,治療効果,免疫原性,特異性などの項目から考察し,おのおののがん抗原がランクづけされている.それによると,WT-1が最上位に位置しており,つづいてMUC-1が位置するが,さきに述べたイピリムマブの臨床試験において使用されたgp100は16番目に位置している.よって,今後は免疫チェックポイントタンパク質の阻害剤とWT-1あるいはMUC-1といったがん抗原をワクチンとして併用することが,効果的ながん免疫療法になる可能性がある.
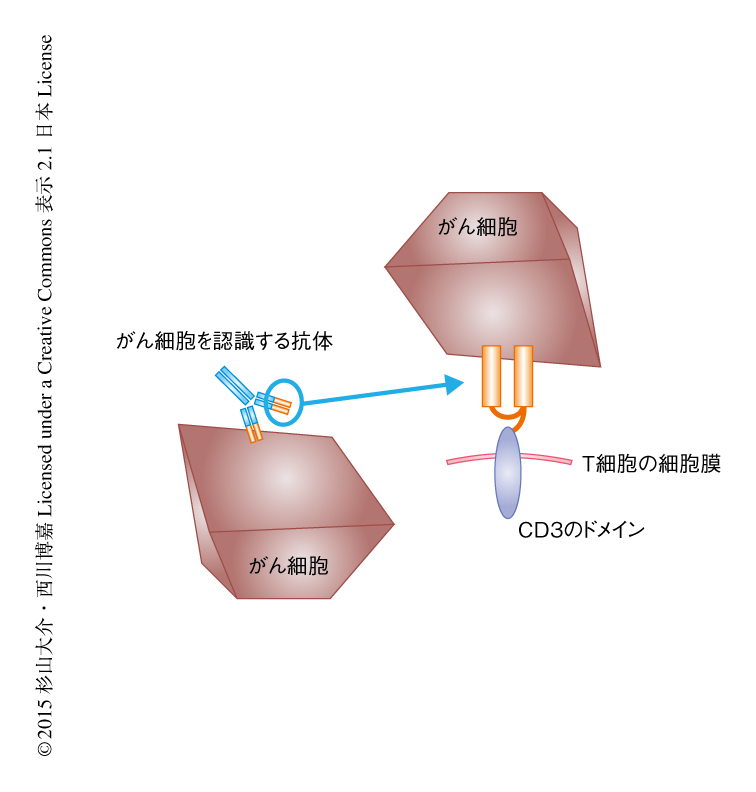
1972年に腫瘍の局所にリンパ球が多く浸潤している患者は予後良好であることが示され,この報告をもとに,腫瘍浸潤リンパ球あるいは遺伝子改変リンパ球を用いた細胞移入療法の開発が進められている45).いずれの場合も,がん抗原に特異的なT細胞を特殊な方法で培養して増幅し,がん患者の体内へそれらを移入することによりがん細胞を強力に排除することを目的としている.腫瘍浸潤リンパ球の移入療法においては,がん患者に由来する腫瘍浸潤リンパ球からがん抗原に特異的なキラーT細胞を取り出し,インターロイキン2の存在のもとで大量培養したのち,それらを患者へ移入している.そのほかのアプローチとしては,がん患者から採取した末梢血単核細胞にがん抗原に特異的なT細胞受容体の遺伝子を導入し,人工的にがん抗原に特異的なキラーT細胞を作製したのち,これらを患者へ移入する方法が実施されている.近年,遺伝子改変リンパ球を作製する方法のなかで発展してきたものが,キメラ抗原受容体を発現させたT細胞を用いた治療法である.このキメラ抗原受容体はがん抗原を認識する抗体をもとに作製されており,すなわち,抗体の2つの抗原認識領域をつないだ受容体様ドメインにCD3あるいは共刺激タンパク質の細胞膜貫通ドメインおよび細胞質内ドメインを結合させた構造になっている(図5).キメラ抗原受容体のすぐれている点は,抗原への結合力がT細胞受容体よりも非常に強いこと,MHC分子を介さずに抗原を直接的に認識できることである.また,細胞膜貫通ドメインあるいは細胞質内ドメインの組合せを変えることにより,キメラ抗原受容体を発現させたT細胞の生存力や殺傷力を向上させることができる.これらの細胞移入療法はさまざまながん腫に対する臨床試験が行なわれており,その効果が期待されている45).
がん免疫療法はこれまでのがん治療を大きく変える有効な治療法となりつつある.現在,もっとも注目されているのが免疫チェックポイントタンパク質阻害薬であり,さまざまな候補タンパク質を標的とした薬剤の開発が急速に進められている.一方で,克服すべき課題は多く,そのひとつが副作用である.免疫チェックポイントタンパク質阻害薬に関しては免疫抑制の解除により自己免疫疾患を発症することが確認されており,細胞移入療法においては過剰のT細胞を移入することにより炎症性サイトカインが多く産生されるサイトカインストームを生じ,自己の細胞の傷害につながっている.今後のがん免疫療法ではこれらの副作用を考慮するのはもちろんのこと,患者にあったがん免疫療法を選択する必要がある.すでに,抗CTLA-4抗体あるいは抗PD-1抗体の投与により腫瘍の退縮効果があった患者は,新規あるいは変異した多くのがん抗原をもっていたことが報告されている.がん免疫療法は急速に発展してきており,さまざまな治療法が開発されている.その治療法を併用していくことが,よりよいがん免疫療法の開発につながっていくと確信している.
略歴:2015年 大阪大学大学院医学系研究科博士課程 修了,同年より国立がん研究センター先端医療開発センター 特任研究員.
研究テーマ:がん免疫にかかわる免疫細胞の機能.
西川 博嘉(Hiroyoshi Nishikawa)
国立がん研究センター先端医療開発センター 分野長.
© 2015 杉山大介・西川博嘉 Licensed under CC 表示 2.1 日本
(国立がん研究センター先端医療開発センター 免疫TR分野)
email:杉山大介
領域融合レビュー, 4, e005 (2015) DOI: 10.7875/leading.author.4.e005
Daisuke Sugiyama & Hiroyoshi Nishikawa: Cancer immunology: bench to bedside.
要 約
近年,がんの新たな治療法としてがん免疫療法が脚光をあびている.その契機となったのは,抗CTLA-4抗体および抗PD-1抗体ががんの治療薬として承認されたことである.いずれの医薬品も,からだに備わる免疫系を操作し,がんを排除する免疫力を強化することによりがんを治療する.この“免疫によりがんを排除する”という概念が医薬品になったことは,これまでのがん治療に新たな選択肢をもたらした.このレビューでは,これまでのがん免疫学における基礎研究を紹介しつつ,基礎研究から臨床応用への橋渡し研究の成功例を示し,今後のがん免疫療法の進展について考察する.
はじめに
現在では,2人に1人ががんを発症し,3人に1人ががんにより死亡するとの統計が算出されている.がんの治療法は日々進歩しており,治癒率および生存率は向上している.しかしながら,依然としてがんによる死亡率は上昇しつづけており,新たな治療法の開発がもとめられている.そのなかで,がん免疫療法ががんの新たな治療法として注目されている.ヒトにおいては1日に数千個ものがん細胞が発生しているといわれているが,必ずしもそれらすべてががんの発症には直結しない.その理由のひとつは,からだに備わる免疫機構がこれらのがん細胞を排除しているからである.われわれのからだにおいては,がんを排除する免疫機構とがんが生き延びる機構とがつねに拮抗しており,バランスが後者にかたむくことによりがんが発症する.このレビューでは,がんの排除にかかわる免疫機構およびがんの生存を手助けする免疫機構に着目しつつ,免疫チェックポイントタンパク質を中心に解説する.
1.がん免疫療法の歴史
ここ十数年のうちに,がん免疫療法の存在が世に広く知られ,急速に発展し,その研究も多くなされるようになった.過剰な免疫応答によりがんが排除されるという現象は,丹毒に感染した悪性腫瘍の患者において腫瘍の退縮が確認されたという1868年の報告が起源とされている1).そののち1893年には,丹毒の原因である連鎖球菌の注入による激しい免疫応答を利用した,切除不能の悪性腫瘍に対する治療が実施された2).これらの事象から,免疫系ががんの発生を抑制するという説が1909年にはじめて提唱された.そののち1950年から1970年にかけ,免疫系ががん細胞を排除することによりがんの発生を抑制しているという“cancer immunosurveillance”という考えが提唱されたが,1974年に,ヌードマウス(免疫不全マウス)を用いた実験において免疫系の有無により発がんに差異はみられないことが報告され,がん免疫の研究は後退した.しかしのちに,ヌードマウスは完全な免疫不全を示しておらず,より免疫不全を示すRAGノックアウトマウスを用いた実験において免疫による発がんの遅延が実証されるとともに,ヒトのがん抗原の発見によりがん免疫の研究はふたたび進展することになった3).現在では,CTLA-4やPD-1といった免疫チェックポイントタンパク質の研究,腫瘍の局所における免疫細胞の機能に関する研究など,広く応用が進められている.
2.がん免疫に関与する免疫細胞
がん免疫にはさまざまな免疫細胞が関与しており,がん細胞の駆逐を担う細胞とがん細胞の生存および増殖を助ける細胞とが存在する.前者にはキラーT細胞(CD8陽性T細胞),ナチュラルキラー細胞,樹状細胞,マクロファージが含まれ,後者には制御性T細胞,骨髄由来抑制細胞が含まれる.
がんの発生初期にはナチュラルキラー細胞によりがん細胞が破壊され,その細胞片を樹状細胞やマクロファージが取り込み,がん細胞片に含まれるがん抗原を分解しがん抗原ペプチドを生成する.これらの細胞は抗原提示細胞とよばれ,MHC(major histocompatibility complex,主要組織適合遺伝子複合体)のクラスI分子あるいはクラスII分子においてがん抗原ペプチドを提示する(図1).ヒトの場合,MHCはHLA(human leukocyte antigen,ヒト白血球型抗原)ともよばれている.キラーT細胞はMHCクラスI分子に提示されたがん抗原ペプチドをT細胞受容体により認識しシグナルを伝達するとともに,抗原提示細胞の表面に存在する共刺激タンパク質と相互作用することにより,がん細胞を攻撃する活性化キラーT細胞になる.
がん細胞はさまざまな免疫逃避機構をもち,そのなかには制御性T細胞や骨髄由来抑制細胞といった免疫抑制細胞のリクルートもふくまれる.制御性T細胞は抗原提示細胞の共刺激タンパク質の機能を低下させキラーT細胞を不活性化させる.骨髄由来抑制細胞はサイトカインあるいは細胞傷害タンパク質を産生しキラーT細胞の機能および生存を低下させる.抗がん免疫応答を担う免疫細胞とその抑制を担う免疫細胞の機能についてはまだ不明な点が多く,それらを解明することでより効果的ながん免疫療法の開発が可能になると思われる.
3.免疫チェックポイントタンパク質CTLA-4
CTLA-4(cytotoxic T-lymphocyte-associated antigen 4)は1987年にマウスに由来するキラーT細胞クローンのcDNAライブラリーから遺伝子がクローニングされた,リンパ球に特有の免疫グロブリンスーパーファミリーに属する糖タンパク質である4).1988年にはヒトにおいても同定され5),1991年および1992年にCTLA-4-免疫グロブリン融合タンパク質を用いた実験によりCTLA-4を介する分子機構がT細胞の免疫応答を抑制することが示された6,7).同じ時期に,CTLA-4と同じく免疫グロブリンスーパーファミリーに属する糖タンパク質であるCD28が同定され,CTLA-4とは対称的にT細胞を活性化する機能をもつことが報告された.CTLA-4およびCD28の機能を考慮し,CTLA-4の機能を抑制させCD28シグナルによるT細胞の活性化を促進させることががんの退縮につながると報告されはじめ,1996年には担がんマウスへの抗CTLA-4抗体の投与により腫瘍の退縮効果が観察されたことが報告された8).この報告が,生体において抗CTLA-4抗体の投与による免疫応答の活性化が腫瘍の退縮を促進することを示した,はじめての例である.
CTLA-4を介した免疫細胞の不活性化はCD28シグナルとの競合に依存する.CTLA-4およびCD28はともに,抗原提示細胞あるいはがん細胞の表面に存在するCD80(B7-1)あるいはCD86(B7-2)と相互作用することにより機能する.CD28は恒常的にT細胞の表面に発現しているが,CTLA-4はT細胞が活性化していないときには細胞の内部に存在し活性化されると細胞の表面へと移行する.CD28シグナルによるT細胞の活性化ののち,CTLA-4が機能することによりT細胞の活性化は抑制されるが,CTLA-4とCD80あるいはCD86との親和性はCD28とCD80あるいはCD86との親和性よりも10~100倍も高く,T細胞の活性化ののちにはCTLA-4が優先的に機能する9).このフィードバック機構により,活性化したT細胞の過剰な応答は抑制されている(図2).
CTLA-4はCD28とCD80あるいはCD86との相互作用を阻害すること,または,CD80あるいはCD86を細胞から奪うことにより免疫抑制機構を担うと考えられている.後者の場合,のちに述べる制御性T細胞(CTLA-4が恒常的に細胞の表面に発現している)が深く関与しており,CD80あるいはCD86を失った細胞はT細胞を活性化することができなくなる.そのほかの抑制機構としては,相互作用によるCTLA-4の下流のシグナルによる直接的な抑制がある.これまでの研究により,CTLA-4の細胞内ドメインに作用するいくつかのタンパク質が報告されているが,抑制機構を直接に担うタンパク質は確定されておらず,現在もその解明にむけた研究がなされている10).
1996年の報告につづき,マウスにおいて抗CTLA-4抗体の投与による腫瘍の退縮効果がさまざまながん腫において確認されている11)(図3).これらの実験結果をふまえ,2000年にはじめて,ヒトにおいて抗CTLA-4抗体の有効性の評価が試みられ,悪性がんの患者および転移性がんの患者への投与により,悪性黒色腫および卵巣がんにおいて一定の抗腫瘍免疫応答の増強効果が確認された12).この第I相臨床試験では重篤な有害事象が確認されなかったため,ひきつづき,第II相臨床試験および第III相臨床試験が実施された.第III相臨床試験は切除不能かつ化学療法抵抗性の悪性黒色腫の患者676人を対象とし,抗ヒトCTLA-4モノクローナル抗体(イピリムマブ)単独,イピリムマブとgp100ペプチドワクチンとの併用,gp100ペプチドワクチン単独,の3グループで実施された13).gp100は悪性黒色腫に特異的な腫瘍抗原であり,使用されたペプチドはキラーT細胞がgp100を認識するエピトープ配列から作製された.臨床試験の結果,イピリムマブ単独,イピリムマブとgp100ペプチドワクチンとの併用,gp100ペプチドワクチン単独のそれぞれの治療による12カ月生存率は45.6%,43.6%,25.3%,24カ月生存率は23.5%,21.6%,13.7%であり,イピリムマブの投与による延命効果が確認された.この臨床試験の結果にもとづき,2011年にイピリムマブは米国Food and Drug Administration(FDA,食品医薬品局)から世界初の免疫活性化抗体医薬として承認された.2012年には,初発悪性黒色腫の患者を対象としたイピリムマブとダカルバジン(悪性黒色腫に対する抗悪性腫瘍剤)の併用投与を実施した第III相臨床試験の結果が報告され,ダカルバジン単独よりイピリムマブとの併用において延命効果が認められた14).現在,イピリムマブはほかの悪性腫瘍への効果あるいはほかの標準化学療法との併用が試みられ,悪性黒色腫への承認からの適応の拡大が進められている15).
イピリムマブの投与により抗腫瘍免疫応答は増強されるが,一方で,免疫活性を総体的に増強するために自己免疫疾患を発症することが報告されている.ある臨床試験においてはイピリムマブを投与した患者の60%に有害事象がみられ,その多くが皮膚あるいは消化管に関する自己免疫疾患であった13).ほかの臨床試験においてもイピリムマブを投与した患者のうち約半数が同様の自己免疫疾患を発症したと報告されている14).このような副作用を抑えるため,イピリムマブを投与した患者へは免疫抑制剤が投与されているが,副作用を抑えつつ抗腫瘍免疫応答を維持するのに今後の検討が必要と考えられる.
4.免疫チェックポイントタンパク質PD-1
PD-1(programmed death 1)は1992年に細胞死を誘導したマウスのT細胞株に由来するcDNAライブラリーから遺伝子がクローニングされた,免疫グロブリンスーパーファミリーに属する膜タンパク質であり16),1994年にはヒトにおいても同定された17).当初,PD-1はプログラム細胞死をひき起こすと考えられていたが,リガンドであるPD-L1(B7-H1)あるいはPD-L2(B7-H2)と相互作用することによりT細胞の活性化を抑制することが明らかにされた18).PD-1はT細胞だけでなく,B細胞,ナチュラルキラー細胞,ナチュラルキラーT細胞,骨髄系細胞にも発現している18).また,PD-L1は抗原提示細胞だけでなく,がん細胞あるいは感染細胞といったさまざまな細胞において恒常的に発現しているが,PD-L2は抗原提示細胞あるいは一部のB細胞でのみ恒常的に発現し,腫瘍の局所において種々のサイトカインにより発現が誘導される19).PD-1シグナルによるT細胞の活性化の抑制機構はPD-1とPD-L1あるいはPD-L2との相互作用にともない促進される.すなわち,相互作用ののちにPD-1の細胞質ドメインにチロシン脱リン酸化酵素の一種であるSHP-2がリクルートされ,T細胞受容体シグナル伝達タンパク質であるZAP70を不活性化させることによりT細胞の機能を抑制する18).また,PD-L1はCD80との相互作用することが可能であり,その結果,T細胞の活性化が抑制されることも報告されている20).
腫瘍の局所ではキラーT細胞およびナチュラルキラー細胞がPD-1を高く発現しており,抗腫瘍免疫応答の減弱の原因とされている.このPD-1シグナルを抗PD-1抗体あるいは抗PD-L1抗体を使用して阻害し抗腫瘍免疫応答の減弱を抑制することによりその増強効果が得られることが推察され,抗PD-1抗体あるいは抗PD-L1抗体を用いPD-1とPD-L1との相互作用を阻害することによりがん免疫応答を増強できることが報告されている21,22).また,抗PD-1抗体は担がんに存在するPD-1陽性CD8陽性T細胞を再活性化することが報告されている(図4).
動物実験の結果,抗PD-1抗体あるいは抗PD-L1抗体の投与による抗腫瘍免疫応答の増強が確認されたことから,これらの抗体を用いたがん患者を対象とする臨床試験が開始され,一定の臨床効果が認められたとの報告がなされている23).完全ヒト化抗体である抗PD-1抗体(ニボルマブ)の第I相臨床試験では,悪性黒色腫の患者に対し28%,非小細胞肺がんの患者に対し18%,腎細胞がんの患者に対し27%の奏効率を示した.のちの臨床試験の結果から,2014年にニボルマブは悪性黒色腫の患者を対象とした治療薬として日本で承認された.ニボルマブの効果をより高めるためイピリムマブとの併用療法も試みられており,悪性黒色腫の患者において,イピリムマブ単独の投与が11%,ニボルマブ単独の投与が31%の臨床的な効果であったのに対し,併用投与では65%の効果を示したことが報告されている24).現在,ニボルマブは悪性黒色腫のほかのがん腫を対象とした臨床試験が多く実施され,化学療法との併用治療も試みられており,いずれも臨床的な効果が期待されている.抗PD-1抗体の投与は全身の免疫応答を増強させるため,抗CTLA-4を投与した患者と同様に自己免疫疾患を発症する患者が確認されており,対応策を考える必要がある24).
抗PD-L1抗体を投与した臨床試験の結果は2012年にはじめて報告され,固形がんの患者を対象とした臨床試験の結果では,悪性黒色腫の患者に対し17%,腎細胞がんの患者に対し12%,非小細胞肺がんの患者に対し10%,卵巣がんの患者に対し5%の奏功率を示した25).この結果は抗PD-1抗体の単独での投与の効果より低いものであったが,この臨床試験において使用された抗体とは異なる抗PD-L1抗体を用いた臨床試験では,悪性黒色腫の患者に対し29%の奏功率,あるいは,非小細胞肺がんの患者に対し22%,腎細胞がんの患者に対し13%の奏功率を示したことが報告されている23).
5.がん免疫療法において期待されるほかの免疫チェックポイントタンパク質
これまで述べたCTLA-4およびPD-1のほかにも免疫チェックポイントタンパク質が見い出されており,今後の臨床への応用が期待されている.
TIM-3(T-cell immunoglobulin and mucin containing protein-3)は2002年にCD4陽性Th1細胞あるいはCD8陽性T細胞に発現していることが見い出された,免疫グロブリンスーパーファミリーに属する膜タンパク質である26).TIM-3はガレクチン9をリガンドとし,その相互作用によりエフェクターT細胞の活性化を抑制する.腫瘍の局所ではTIM-3のみあるいはTIM-3およびPD-1を共発現するCD8陽性T細胞の抗腫瘍免疫活性の弱いことがヒトおよびマウスにおいて確認されている.このTIM-3シグナルを抗TIM-3抗体により阻害することにより抗腫瘍免疫応答を増強できることがマウスにおいて実証されており,現在,ヒトへの応用が試みられている11).
LAG-3(lymphocyte activation gene-3)は1990年にCD4陽性T細胞において発現が確認された,免疫グロブリンスーパーファミリーに属する膜タンパク質である27).のちの研究により,ナチュラルキラー細胞,B細胞,リンパ球系樹状細胞にも発現していることが見い出され,LAG-3はMHCクラスII分子との相互作用により活性化T細胞を抑制する機能を担う.抗LAG-3抗体を使用したLAG-3シグナルの阻害,および,抗PD-1抗体との併用投与により抗腫瘍免疫応答が増強されることがマウスにおいて証明されている.この実験結果から抗LAG-3抗体はヒトに対し応用されており,第I相臨床試験において悪性黒色腫の患者に対する投与が試みられている11).
B7-H3,B7-H4,B7-H5(VISTA)はB7ファミリーに属する膜タンパク質であり,それぞれ,2001年,2003年,2011年に見い出された28-30).B7-H3はさまざまながん腫および抗原提示細胞に発現しており,T細胞受容体と相互作用することによりT細胞に対し活性化あるいは抑制の両方のシグナルを伝達する.しかし,がん細胞におけるB7-H3の発現が患者の予後不良と相関することから,腫瘍の局所においてB7-H3シグナルは抗腫瘍免疫応答を抑制する機能を担うと考えられている.B7-H4はB7-H3と同様にがん細胞および抗原提示細胞において発現しており,相互作用により活性化T細胞を抑制する機能を担う.とりわけ,腫瘍の局所では腫瘍関連マクロファージにおける発現が腫瘍の増悪に関与している.がん患者においてB7-H4の高い発現が予後不良と相関することも報告されている.B7-H5はT細胞に抑制性のシグナルを伝達する機能を担い,マウスでは腫瘍の局所におけるCD11bの発現と正の相関のあることが報告されている.また,B7-H5シグナルを阻害することにより抗腫瘍免疫応答の増強を促進させることがマウスにおいては確認されている.これら3つのタンパク質と相互作用する受容体は同定されていないが,B7-H3に対するヒト化抗体が開発されており,第I相臨床試験において再発性のがん患者に投与されている11).
TIGIT(T cell immunoreceptor with Ig and ITIM domain)は2009年に見い出された免疫グロブリンスーパーファミリーに属する膜タンパク質であり,活性化されたT細胞およびナチュラルキラー細胞に発現していることが報告されている31).そのリガンドは抗原提示細胞に発現しているCD112およびCD155であり,これらはCD226とよばれる受容体とも相互作用する.これらTIGITあるいはCD226とCD112あるいはCD155との相互作用は,CTLA-4あるいはCD28とCD80あるいはCD86との相互作用と類似しており,TIGITシグナルは免疫抑制機能を担いCD226シグナルは免疫活性機能を担う.TIGITシグナルはCTLA-4シグナルよりも弱い免疫抑制機能をもつが,TIGITシグナルを阻害することにより免疫応答を活性化できることが確認されている11).
6.がん免疫と制御性T細胞
1970年代に一部のT細胞が免疫抑制機能をもつとの報告がなされ,1995年に制御性T細胞が同定されてから世界中で注目され多くの研究が進められている32).すなわち,CD4陽性T細胞のうちCD25陽性細胞を除去したT細胞を免疫不全マウス(ヌードマウス)に移入することにより自己免疫疾患が発症し,CD4陽性CD25陽性T細胞の再移入によりその発症が抑制されることが見い出され,制御性T細胞としてCD4陽性CD25陽性T細胞が同定された32).2001年にはヒトにおいても同様の制御性T細胞が同定され,2003年には制御性T細胞のマスター遺伝子として知られるFoxp3遺伝子が同定されたことにより,より厳密に制御性T細胞を定義することが可能になった33)(制御性T細胞については,濱口真英・坂口志文, 領域融合レビュー, 2, e005, 2013 も参照されたい).転写因子であるFoxp3はさまざまな免疫応答関連遺伝子の発現を制御しており,制御性T細胞において恒常的に発現しているCTLA-4の発現制御に関与していることが明らかにされている.このCTLA-4が制御性T細胞による免疫抑制機能に重要であることはさきに述べたが,そのほかの免疫抑制機能としては,抑制性サイトカインの産生による活性化細胞の抑制,活性化細胞へのアポトーシスの誘導などが示唆されている34).
腫瘍免疫において制御性T細胞は抗腫瘍免疫応答を抑制しており,制御性T細胞の除去による腫瘍の退縮効果が検討されている.初期の研究では,抗CD25抗体の投与による制御性T細胞の除去が腫瘍の退縮につながることが実証され35),のちのジフテリア毒素の投与によるFoxp3陽性制御性T細胞の特異的な除去も同様の結果を示している36).CTLA-4と同様に,PD-1およびLAG-3も制御性T細胞に発現していることが報告されており,これらの免疫チェックポイントタンパク質を介した免疫抑制機能の解明が進められている11).とりわけ,抗CTLA-4抗体による抗体に依存性の細胞傷害活性により制御性T細胞が排除されることで抗腫瘍免疫応答が増強することが重要視されている.最近の研究では,制御性T細胞のホーミングおよび細胞内シグナルが注目され,CCR10に依存的な腫瘍の局所へのホーミングの阻害,あるいは,アセチルトランスフェラーゼp300あるいはPI3キナーゼの阻害により,制御性T細胞の抑制機能を解除することで抗腫瘍免疫応答が増強されることが報告されている37-39).
ヒトでは,胃がん,肺がん,肝臓がん,膵臓がん,頭頸部がんなど,多くのがん腫において制御性T細胞が増加していることが明らかにされており40),制御性T細胞の腫瘍の局所への浸潤ががん患者の予後不良因子であることが多く報告されている.これらの臨床データから,制御性T細胞の除去による抗腫瘍免疫応答の増強を目的とした臨床試験がなされており,ヒト化抗CD25抗体(ダクリズマブ)やジフテリア毒素融合IL-2製剤などが開発され使用されている.しかし,CD25は活性化T細胞における発現もみられるため,抗CD25抗体の投与による制御性T細胞の特異的な除去はかぎられており,臨床試験においても一定の結果は得られていない41).現在では,制御性T細胞により特異的に発現するタンパク質を標的とした方法が模索されており,そのひとつとして,腫瘍の局所への制御性T細胞の浸潤の機構に着目した試みがなされている.
筆者らは,そのアプローチとしてケモカイン受容体のひとつCCR4を介した制御性T細胞の腫瘍への浸潤に着目した.CCR4はCCL17およびCCL22をリガンドとし,それらがさまざまな細胞により腫瘍の局所において放出されるとCCR4陽性制御性T細胞が腫瘍の局所にリクルートされる.このCCR4強陽性制御性T細胞が悪性黒色腫の局所に多く浸潤しており,抗CCR4抗体を用いることによりこれらの制御性T細胞の除去が可能であり,それにともない抗腫瘍免疫応答が増強されることを見い出した42).現在,この研究をもとに,固形がんの患者への抗CCR4抗体の投与が試みられており,腫瘍の局所において制御性T細胞が減少するかどうか検討がなされている.
7.がん抗原を用いたワクチン療法
免疫チェックポイントタンパク質の阻害によるがん免疫療法は,全身の免疫細胞を非特異的に増強させることで腫瘍の退縮につなげているが,その反面,さきにも述べたように,免疫細胞の活性化にともなう自己免疫疾患を発症してしまう.そこで,がん細胞を特異的に攻撃する免疫細胞のみを活性化させるがんワクチン療法の開発が進められている.がんワクチン療法では特定の免疫細胞のみが活性化されるため,自己免疫疾患の発症を抑えることができる.ワクチンに使用されるがん抗原としては,がん抗原ペプチド,全長のがん抗原,がん抗原ペプチドを提示した樹状細胞が使用されている43).これまで,多数のがん抗原が見い出されており,そのなかからがんワクチン療法に適しているがん抗原がピックアップされている44).この報告では,治療効果,免疫原性,特異性などの項目から考察し,おのおののがん抗原がランクづけされている.それによると,WT-1が最上位に位置しており,つづいてMUC-1が位置するが,さきに述べたイピリムマブの臨床試験において使用されたgp100は16番目に位置している.よって,今後は免疫チェックポイントタンパク質の阻害剤とWT-1あるいはMUC-1といったがん抗原をワクチンとして併用することが,効果的ながん免疫療法になる可能性がある.
8.細胞移入療法
1972年に腫瘍の局所にリンパ球が多く浸潤している患者は予後良好であることが示され,この報告をもとに,腫瘍浸潤リンパ球あるいは遺伝子改変リンパ球を用いた細胞移入療法の開発が進められている45).いずれの場合も,がん抗原に特異的なT細胞を特殊な方法で培養して増幅し,がん患者の体内へそれらを移入することによりがん細胞を強力に排除することを目的としている.腫瘍浸潤リンパ球の移入療法においては,がん患者に由来する腫瘍浸潤リンパ球からがん抗原に特異的なキラーT細胞を取り出し,インターロイキン2の存在のもとで大量培養したのち,それらを患者へ移入している.そのほかのアプローチとしては,がん患者から採取した末梢血単核細胞にがん抗原に特異的なT細胞受容体の遺伝子を導入し,人工的にがん抗原に特異的なキラーT細胞を作製したのち,これらを患者へ移入する方法が実施されている.近年,遺伝子改変リンパ球を作製する方法のなかで発展してきたものが,キメラ抗原受容体を発現させたT細胞を用いた治療法である.このキメラ抗原受容体はがん抗原を認識する抗体をもとに作製されており,すなわち,抗体の2つの抗原認識領域をつないだ受容体様ドメインにCD3あるいは共刺激タンパク質の細胞膜貫通ドメインおよび細胞質内ドメインを結合させた構造になっている(図5).キメラ抗原受容体のすぐれている点は,抗原への結合力がT細胞受容体よりも非常に強いこと,MHC分子を介さずに抗原を直接的に認識できることである.また,細胞膜貫通ドメインあるいは細胞質内ドメインの組合せを変えることにより,キメラ抗原受容体を発現させたT細胞の生存力や殺傷力を向上させることができる.これらの細胞移入療法はさまざまながん腫に対する臨床試験が行なわれており,その効果が期待されている45).
おわりに
がん免疫療法はこれまでのがん治療を大きく変える有効な治療法となりつつある.現在,もっとも注目されているのが免疫チェックポイントタンパク質阻害薬であり,さまざまな候補タンパク質を標的とした薬剤の開発が急速に進められている.一方で,克服すべき課題は多く,そのひとつが副作用である.免疫チェックポイントタンパク質阻害薬に関しては免疫抑制の解除により自己免疫疾患を発症することが確認されており,細胞移入療法においては過剰のT細胞を移入することにより炎症性サイトカインが多く産生されるサイトカインストームを生じ,自己の細胞の傷害につながっている.今後のがん免疫療法ではこれらの副作用を考慮するのはもちろんのこと,患者にあったがん免疫療法を選択する必要がある.すでに,抗CTLA-4抗体あるいは抗PD-1抗体の投与により腫瘍の退縮効果があった患者は,新規あるいは変異した多くのがん抗原をもっていたことが報告されている.がん免疫療法は急速に発展してきており,さまざまな治療法が開発されている.その治療法を併用していくことが,よりよいがん免疫療法の開発につながっていくと確信している.
文 献
- Busch, W.: Aus der Sitzung der medicinischen Section vom 13 November 1867. Berl. Klin. Wochenschr., 5, 137 (1867)
- Coley, W. B.: Late results of the treatment of inoperable sarcoma by the mixed toxins of Erysipelas and Bacillus prodigosus. Am. J. Med. Sci., 131, 375-430 (1906)
- Dunn, G P., Bruce, A. T., Ikeda, H. et al.: Cancer immunoediting: from immunosurveillance to tumor escape. Nat. Immunol., 3, 991-998 (2002)[PubMed]
- Brunet, J. F., Denizot, F., Luciani, M. F. et al.: A new member of the immunoglobulin superfamily: CTLA-4. Nature, 328, 267-270 (1987)[PubMed]
- Dariavach, P., Mattei, M. G., Golstein, P. et al.: Human Ig superfamily CTLA-4 gene: chromosomal localization and identity of protein sequence between murine and human CTLA-4 cytoplasmic domains. Eur. J. Immunol., 18, 1901-1905 (1988)[PubMed]
- Linsley, P. S., Brady, W., Umes, M. et al.: CTLA-4 is a second receptor for the B cell activation antigen B7. J. Exp. Med., 174, 561-569 (1991)[PubMed]
- Linsley, P. S., Wallace, P. M., Johnson, J. et al.: Immunosuppression in vivo by a soluble form of the CTLA-4 T cell activation molecule. Science, 257, 792-795 (1992)[PubMed]
- Leach, D. R., Krummel, M. F. & Allison, J. P.: Enhancement of antitumor immunity by CTLA-4 blockade. Science, 271, 1734-1736 (1996)[PubMed]
- Collins, A. V., Brodie, D. W., Gilbert, R. J. et al.: The interaction properties of costimulatory molecules revisited. Immunity, 17, 201-210 (2002)[PubMed]
- Walker, L. S. & Sansom, D. M.: Confusing signals: recent progress in CTLA-4 biology. Trends Immunol., 36, 63-70 (2015)[PubMed]
- Shin, D. S. & Ribas, A.: The evolution of checkpoint blockade as a cancer therapy: what's here, what's next? Curr. Opin. Immunol., 23, 23-35 (2015)[PubMed]
- Hodi, F. S., Mihm, M. C., Soiffer, R. J. et al.: Biologic activity of cytotoxic T lymphocyte-associated antigen 4 antibody blockade in previously vaccinated metastatic melanoma and ovarian carcinoma patients. Proc, Natl, Acad, Sci, USA, 100, 4712-4717 (2003)[PubMed]
- Hodi, F. S., O’Day, S. J., McDemott, D. F. et al.: Improved survival with ipilimumab in patients with metastatic melanoma. N. Engl. J. Med., 363, 711-723 (2010)[PubMed]
- Robert, C., Thomas, L., Bondarenko, I. et al.: Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N. Engl. J. Med., 364, 2517-2526 (2011)[PubMed]
- Postow, M. A., Callahan, M. K. & Wolchok, J. D.: Immune checkpoint blockade in cancer therapy. J. Clin. Oncol., 33, 1974-1982 (2015)[PubMed]
- Ishida, Y., Agata, Y., Shibahara, K. et al.: Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J., 11, 3887-3895 (1992)[PubMed]
- Shinohara, T., Taniwaki, M., Ishida, Y. et al.: Structure and chromosomal localization of the human PD-1 gene (PDCD1). Genomics, 23, 704-706 (1994)[PubMed]
- Okazaki, T., Chikuma, S., Iwai, Y. et al.: A rheostat for immune responses: the unique properties of PD-1 and their advantages for clinical application. Nat. Immunol., 14, 1212-1218 (2013)[PubMed]
- Rozali, E. N., Hato, S. V., Robinson, B. W. et al.: Programmed death ligand 2 in cancer-induced immune suppression. Clin. Dev. Immunol., 2012, 656340 (2012)[PubMed]
- Butte, M. J., Keir, M. E., Phamduy, T. B. et al.: PD-L1 interacts specifically with B7-1 to inhibit T cell proliferation. Immunity, 27, 111-122 (2007)[PubMed]
- Hirano, F., Kaneko, K., Tamura, H. et al.: Blockade of B7-H1 and PD-1 by monoclonal antibodies potentiates cancer therapeutic immunity. Cancer Res., 65, 1089-1096 (2005)[PubMed]
- Iwai, Y., Ishida, M., Tanaka, Y. et al.: Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade. Proc. Natl. Acad. Sci. USA, 99, 12293-12297 (2002)[PubMed]
- Momtaz, P. & Postow, M. A.: Immunologic checkpoints in cancer therapy: focus on the programmed death-1 (PD-1) receptor pathway. Pharmgenomics Pers. Med., 15, 357-365 (2014)[PubMed]
- Callahan, M. K., Postow, M. A. & Wolchok, J. D.: CTLA-4 and PD-1 pathway blockade: combinations in the clinic. Front. Oncol., 15, 385 (2015)[PubMed]
- Brahmer, J R., Tykodi, S. S., Chow, L. Q. et al.: Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N. Engl. J. Med., 366, 2455-2465 (2012)[PubMed]
- Monney, L., Sabatos, C. A., Gaglia, J. L. et al.: Th1-specific cell surface protein Tim-3 regulates macrophage activation and severity of an autoimmune disease. Nature, 31, 536-541 (2002)[PubMed]
- Triebel, F., Jitsukawa, S., Baixwras, E. et al.: LAG-3, a novel lymphocyte activation gene closely related to CD4. J. Exp. Med., 171, 1393-1405 (1990)[PubMed]
- Chapoval, A. l., Ni, J., Lau, J. S. et al.: B7-H3: a costimulatory molecule for T cell activation and IFN-γ production. Nat. Immunol., 2, 269-274 (2001)[PubMed]
- Sica, G. L., Choi, I. H., Zhu, G. et al.: B7-H4, a molecule of the B7 family, negatively regulates T cell immunity. Immunity, 18, 849-861 (2003)[PubMed]
- Wang, L., Rubinstein, R., Lines, J. L. et al.: VISTA, a novel mouse Ig superfamily ligand that negatively regulates T cell responses. J. Exp. Med., 208, 577-592 (2011)[PubMed]
- Yu, X., Harden, K., Gonzalez, L. C. et al.: The surface protein TIGIT suppresses T cell activation by promoting the generation of mature immunoregulatory dendritic cells. Nat. Immunol., 10, 48-57 (2009)[PubMed]
- Sakaguchi, S., Sakaguchi, N., Asano, M. et al.: Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J. Immunol., 115, 1151-1164 (1995)[PubMed]
- Hori, S., Nomura, T. & Sakaguchi, S.: Control of regulatory T cell development by the transcription factor Foxp3. Science, 299, 1057-1061 (2003)[PubMed]
- Walker, L. S. & Sansom, D. M.: The emerging role of CTLA4 as a cell-extrinsic regulator of T cell responses. Nat. Rev. Immunol., 11, 852-863 (2011)[PubMed]
- Onizuka, S., Tawara, I., Shimizu, J. et al.: Tumor rejection by in vivo administration of anti-CD25 (interleukin-2 receptor α) monoclonal antibody. Cancer Res., 59, 3128-3133 (1999)[PubMed]
- Klages, K., Mayer, C. T., Lahi, K. et al.: Selective depletion of Foxp3+ regulatory T cells improves effective therapeutic vaccination against established melanoma. Cancer Res., 70, 7788-7799 (2010)[PubMed]
- Facciabene, A., Peng, X., Hagemann, I. S. et al.: Tumour hypoxia promotes tolerance and angiogenesis via CCL28 and Treg cells. Nature, 475, 226-230 (2011)[PubMed]
- Yujie, L., Liqing, W., Jarrod, P. et al.: Inhibition of p300 impairs Foxp3+ T regulatory cell function and promotes antitumor immunity. Nat. Med., 19, 1173-1177 (2013)[PubMed]
- Ali, K., Soond, D. R., Pineiro, R. et al.: Inactivation of PI(3)K p110δ breaks regulatory T-cell-mediated immune tolerance to cancer. Nature, 510, 407-411 (2014)[PubMed]
- Nishikawa, H. & Sakaguchi, S.: Regulatory T cells in tumor immunity. Int. J. Cancer, 127, 759-767 (2010)[PubMed]
- Nizar, S., Meyer, B., Galustian, C. et al.: T regulatory cells, the evolution of targeted immunotherapy. Biochim. Biophys. Acta, 1806, 7-17 (2010)[PubMed]
- Sugiyama, D., Nishikawa, H., Maeda, Y. et al.: Anti-CCR4 mAb selectively depletes effector-type FoxP3+CD4+ regulatory T cells, evoking antitumor immune responses in humans. Proc. Natl. Acad. Sci. USA, 110, 17945-17950 (2013)[PubMed]
- Melero, I., Gaudernack, G., Gerritsen. W. et al.: Therapeutic vaccines for cancer: an overview of clinical trials. Nat. Rev. Clin. Oncol., 11, 509-524 (2014)[PubMed]
- Cheever, M. A., Allison, J. P., Ferris, A. S. et al.: The prioritization of cancer antigens: a national cancer institute pilot project for the acceleration of translational research. Clin. Cancer Res., 15, 5323-5337 (2009)[PubMed]
- Duong, C. P., Yong, C. S., Kershaw, M. H. et al.: Cancer immunotherapy utilizing gene-modified T cells: from the bench to the clinic. Mol. Immunol., 67, 46-57 (2015)[PubMed]
著者プロフィール
略歴:2015年 大阪大学大学院医学系研究科博士課程 修了,同年より国立がん研究センター先端医療開発センター 特任研究員.
研究テーマ:がん免疫にかかわる免疫細胞の機能.
西川 博嘉(Hiroyoshi Nishikawa)
国立がん研究センター先端医療開発センター 分野長.
© 2015 杉山大介・西川博嘉 Licensed under CC 表示 2.1 日本