生物をかたちづくる細胞運動と細胞極性
2015/04/27
鈴木 誠・上野直人
(基礎生物学研究所 形態形成研究部門)
email:鈴木 誠,上野直人
領域融合レビュー, 4, e006 (2015) DOI: 10.7875/leading.author.4.e006
Makoto Suzuki & Naoto Ueno: Cell movement and polarity required for animal development.

生物の形態形成において細胞の移動など組織の3次元リモデリングは必須である.その過程において,細胞はどのように形態や機能の非対称性を獲得し正しく配置されるのだろうか.細胞の分化と個々の細胞のダイナミックな移動あるいは変形をともなう組織のリモデリングとが精妙に協調することが形態形成の鍵である.細胞の集団的な移動や変形といった統合された運動のためには,ある局面では強固な細胞接着が,また別の局面では減弱し大胆な運動を可能にすることが必要になる.細胞の集団は細胞外シグナルにより移動する方向を知り,細胞はそれにしたがい移動の舵とりをする.個々の運動は細胞外シグナルに依存する一方,細胞どうしの密な連携を維持しており,それにより高度に協調した細胞運動を制御している.まさに,細胞が社会を形成しかたちづくりをなしとげているのだ.このレビューでは,筆者らの研究を含めた最近の知見を紹介しながら,形態形成の過程がどのように分子レベルで制御されているのかについて解説する.
ひとつの受精卵は細胞分裂をくり返して胚になり,そののち,生物に固有の形態を獲得する.その発生の過程において,胚は多分化能をもついわゆる幹細胞から,さまざまな性質をもつ特殊化した細胞へと分化する.しかし,細胞の分化はかたちづくりの基盤にあっても,その原動力にはなりえない.細胞個々あるいは集団としての運動により生物のかたちができあがるのだ.細胞集団の協調した運動により,組織は単純なシート構造から管やひだなど複雑な構造を生みだす.このレビューでは,生物の形態形成をささえる細胞運動やその背景にある細胞極性に関する最近の知見を,筆者らの研究成果を含め解説する.
初期の発生において生物をかたちづくる大きな現象として原腸の形成がある.原腸の形成はウニなど棘皮動物から脊椎動物まで進化的に保存された基本的な現象で,細胞が胚の一部(原口)から胚の内側へと流れ込むように陥入することにより腔(原腸)を形成するという,非常にダイナミックな細胞運動である.このとき,胚の表層においては外胚葉細胞が胚の全体におおいかぶさるような運動(エピボリー運動)が起こる.両生類のモデル生物であるアフリカツメガエルは,その胚の大きさ(直径は約1.2 mm)からこの原腸形成の機構の研究に重用されている.アフリカツメガエルの場合,10回の細胞分裂をへて細胞数が約1000になったとき,おもに胚の背側から細胞が陥入しはじめる.そののち,細胞は将来の頭部(前方)にむかって移動し,同時に,胚を内側からおおうように正中線から左右にむかって広がる(図1a).この運動により,内胚葉は胚の腹側,中胚葉は胚の背側,外胚葉は胚の表層側に配置されることから,この細胞運動はのちの器官形成にきわめて重要な意味をもつといえる.
この細胞運動の原動力は,細胞の集団が外胚葉の内側を前方にむかって移動する“集団的な細胞の移動”にある.筆者らの最近の研究により,この移動する細胞集団は一様に移動する力を発揮しているのではなく,先端の一部のみが移動能をもち,後方の細胞集団を牽引していることがわかってきた(図1b).牽引をする細胞は内中胚葉(機能的に分離できない内胚葉細胞と中胚葉細胞の集団)とよばれ,その後方において将来の脊索の形成に寄与する中軸中胚葉細胞とは,発現する遺伝子からも性質の異なることが知られている.内中胚葉(先端に位置することから,先端中胚葉ともよばれる)を胚から切除し外胚葉の内側の細胞外基質を写しとったスライドガラスのうえで培養すると1),内中胚葉は前方に移動するが,中軸中胚葉には移動能がないことがわかった.また,中軸中胚葉の組織のレーザー切断実験から,内中胚葉の細胞集団が前方に移動し後方の中軸中胚葉の細胞集団を牽引することにより,中軸中胚葉では前後の方向に引張力が発生している(中軸中胚葉が引っぱられている)ことも明らかにされた2).
このような細胞集団の移動はどのように起こるのだろうか.細胞の移動に細胞外基質であるフィブロネクチンが必要であることはすでにわかっていたが,フィブロネクチンは移動方向の制御は担っていない.培養細胞を使った研究から,方向性をもつ細胞の移動においては化学誘引物質が鍵となることがわかっており,化学誘引物質を感知しその方向へ移動する性質は走化性とよばれる.胚の発生における集団的な細胞の移動においても,化学誘引物質は必須であることが明らかになりつつある.とくに,原腸の形成においては,SDF-1やPDGFといったタンパク質が化学誘引物質として前方への組織の移動を促進している.化学誘引物質は外胚葉において発現しており,その活性の阻害は内中胚葉の細胞の前方への移動を阻害する1).また別の例として,ゼブラフィッシュの側線ニューロンがある.側線ニューロンの前駆細胞は周辺の組織において発現するSDF-1の濃度に依存して胚の後方へと移動する3).このとき,移動する細胞集団はまえもって形成されたSDF-1の濃度勾配にくわえ,受容体を介したSDF-1の内部への移行により局所的な活性勾配を自己形成し,それらにしたがい移動することが,最近の研究により明らかにされた4).すなわち,これら化学誘引物質の濃度勾配を感知した細胞が,どの方向に移動すべきかを決定しているものと考えられる.原腸の形成の際,内中胚葉の細胞はラメリポディア(膜状突起)を前方にむけ活発に伸ばしており,そのラメリポディアを足がかりに前方へと移動する.つまり,化学誘引物質の濃度の高いほうにラメリポディアを形成するという非対称性が生みだされている.化学誘引物質の濃度勾配を細胞が感知し細胞極性に変換するしくみは,発生のさまざまな過程で用いられる生物の戦略といってもよいだろう.移動する細胞の内部では,通常,ラメリポディアの形成にかかわる低分子量Gタンパク質であるRac1やCdc42が前方で,RhoAが後方で活性化されており,このような活性の非対称性が方向性をもつ細胞の移動を可能にしている.
中軸中胚葉はのちに脊索を形成する.脊索は脊椎動物では発生の後期に消失する組織であるが,発生の初期においては,前後軸と直交する軸(正中線から側方にむかう軸であるため,内外軸とよぶ)の方向にある程度の幅をもっていた脊索の組織が徐々に正中線に集まり前後の方向に細長くなることにより胚を前後軸の方向に伸ばす,という胚の形態形成において重要な役割をもつ.内中胚葉の前方への移動を阻害するとこの脊索の形成も異常になることから,筆者らは,原腸の形成は脊索の形成と連動しているものと考えている.脊索組織は正中線に集まり,同時に前後軸の方向に伸びる運動は脊索組織の全体の変形として“収斂と伸長”(convergence and extension)とよばれる.この組織の変形は個々の細胞の変形をともなうことがよく知られている.この運動の過程では,脊索の細胞は徐々に紡錘形になり,互いのあいだに滑り込むようにして左右の幅をせばめることが観察されている.また,細胞形態の変化とともに,細長くなった細胞の両端には細胞突起(ラメリポディアおよびフィロポディア)が形成されることから,細胞どうしが細胞突起を使って互いに引っ張りあうことが収斂の原動力になっているという説がある(図1c).一方,最近,アクチンが内外軸にそった細胞膜を短縮することにより隣接する細胞を引きつけるという説も提唱された5).いずれにしても,内外軸にそった細胞極性が組織の収斂を,そして,それにより伸長をひき起こすことに変わりない.
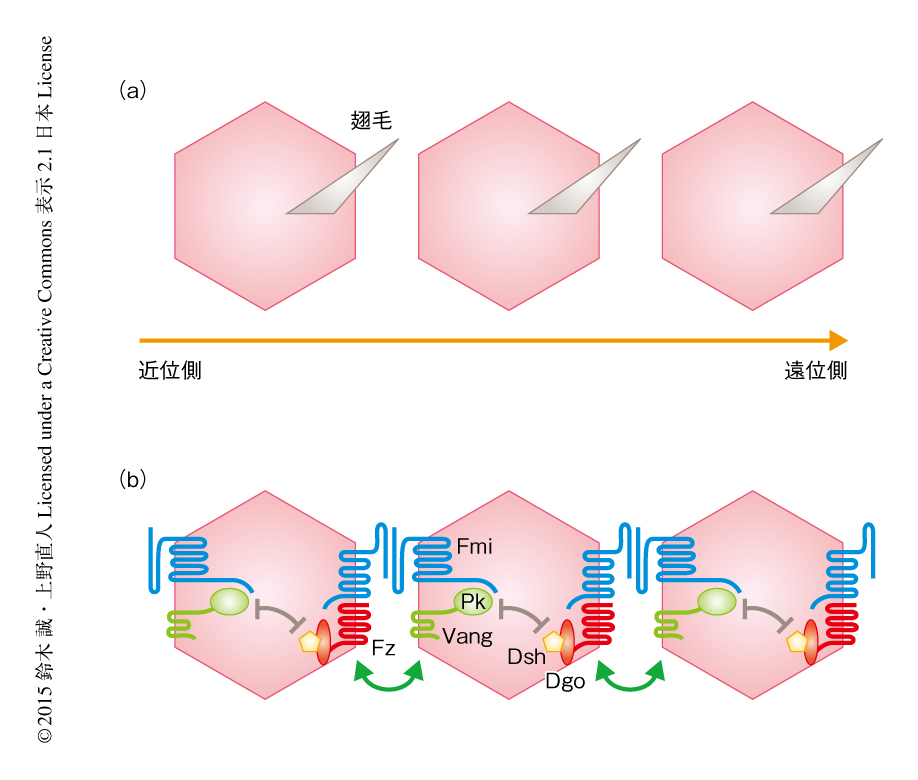
こうした細胞極性を制御するしくみとして,“平面内細胞極性”(planar cell polarity:PCP)が知られている6).平面内細胞極性はショウジョウバエの翅の表面に生える小さな毛(翅毛)の生えるむきや複眼を構成する光受容体の配置を決定するしくみとして研究されてきた(図2a).ショウジョウバエにおける遺伝学的な手法を用いた精力的な研究により,平面内細胞極性のシグナル伝達系を構成する多数のタンパク質が発見されており,多くの生物種で保存された膜タンパク質であるFrizzled(Fz),Strabismus/Van Gogh,Flamingoが,細胞内においてDishevelled,Prickle,Diegoなどと相互作用し,上皮細胞の頂端側に水平方向の極性をあたえる(図2b).脊椎動物においては,これらは非古典的Wnt経路のひとつで,Wnt5やWnt11などのリガンドが引き金となることが知られている.筆者らは,平面内細胞極性シグナルタンパク質であるGlypican4(ゼブラフィッシュでは,knypek遺伝子にコードされる)およびPrickleが脊椎動物においては原腸の形成および脊索の形成に必須であることを明らかにした7,8).つまり,この知見は,平面内細胞極性シグナルが生物種をこえて保存されており,上皮細胞ばかりでなく中胚葉細胞の活発な運動にも必要であることを示している.平面内細胞極性は原腸の形成あるいは脊索の形成ばかりでなく,さまざまな器官の形成,とくに,伸長をともなう器官の形成に用いられている.最近,平面内細胞極性シグナルタンパク質であるVan Gogh-like 2(Vangl2)のノックアウトマウスの表現型から,Vangl2が四肢の伸長に必要であることが示された9).このように,組織の収斂と伸長には同じ原理が使いまわされている可能性がある.また,細胞の非対称性を生むというショウジョウバエの翅毛の形成における役割と同様の機能は,脊椎動物においても明らかにされている.内耳の有毛細胞は組織の軸性にそって規則正しく配置しており,その発生の過程では平面内細胞極性シグナルタンパク質であるFz3やVangl2が細胞の基部の側に局在することが必要である10,11).輸卵管は生殖巣で産生された卵子を子宮へ輸送するため協調した繊毛運動と多数のヒダ構造を形成する.この過程においても平面内細胞極性シグナルタンパク質が機能しており,細胞の基部-先端部軸にそって局在するCelsr1(Flamingoの相同タンパク質)が欠損すると繊毛運動とヒダ構造が不規則になる12).また,発生の初期のノード(胚の腹側のくぼんだ組織)においては,ノード細胞の表層側で1次繊毛が細胞の後方に位置し胚の後方側にかたむいて回転運動することが胚の左右軸の決定に必要であるが,この過程に平面内細胞極性シグナルタンパク質の前後軸にそった非対称な局在が必須であることが明らかにされている11,13).
筆者らは,収斂と伸長の制御機構を探るため,機能的な細胞極性の形成の指標として微小管の動態を観察した.EB1およびEB3は微小管のプラス端(伸長する端)に結合する性質をもつ.したがって,EB1あるいはEB3をGFPとの融合タンパク質にしてその動態を観察すると微小管の伸長の極性を知ることができる.生細胞イメージングによる観察の結果,微小管は脊索とその側方に位置する体節(将来は筋肉になる)との境界にむかって伸長することがわかった14)(図1d).この脊索と体節という異なる組織の境界の脊索側においては,細胞内Ca2+濃度の頻繁な上昇がみられた.異なる組織の接触培養においても同様のCa2+濃度の上昇が観察され,同種の組織の接触培養ではその頻度は低いことから,脊索と体節という異種の組織のあいだの境界がCa2+濃度の上昇の引き金になるなんらかの情報をもつことが予想される15).
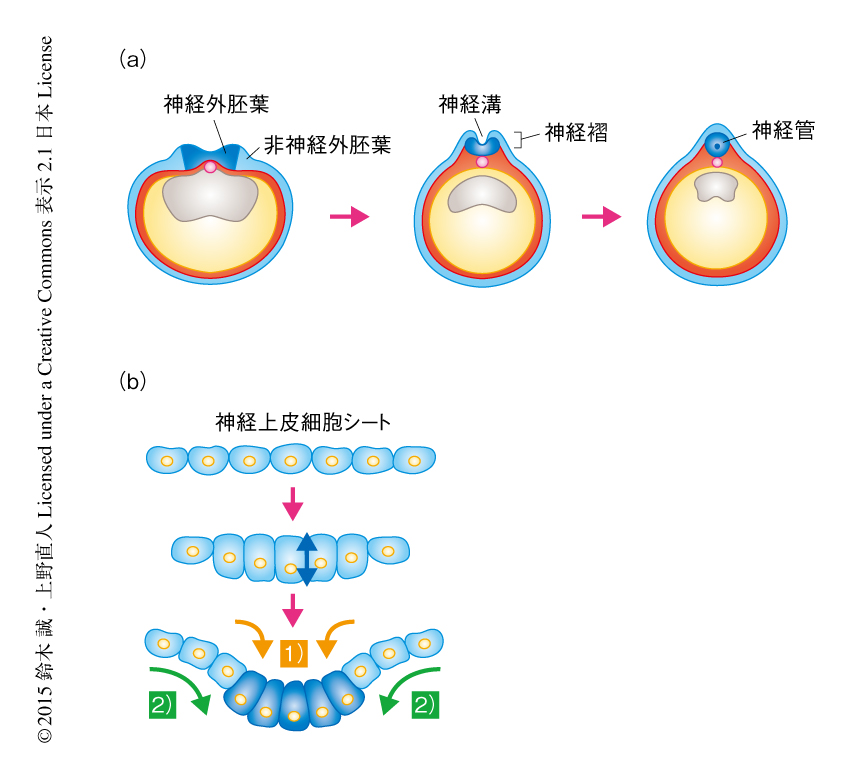
神経管は外胚葉が神経化したのちに生みだされる中枢神経系の原基で,前部では脳,体幹部では脊髄を形成する.神経管は両生類と羊膜類とで共通する特徴的な管形成の過程をへることが知られている(図3a).神経管は外胚葉が誘導をうけ神経化すると神経板とよばれる肥厚したシート状の組織に変化し,そののち,非神経外胚葉との境界に前後軸にそって神経褶とよばれる隆起が形成される.この神経板の中央部において神経板が屈曲することにより,神経褶の頂端が正中線において融合し,神経板のシート構造が管を形成することがわかっている.この管形成が阻害される神経管閉鎖不全はヒトにおいて2000~3000の出産に1例の割合でみられる二分脊椎症の原因であり,遺伝的な背景あるいは環境要因による二分脊椎症の病因の解明,とくに,細胞レベルでの病態の解明は医学において重要な研究課題のひとつである.この神経管の形成における細胞変形の機構の解明においては,母体の外で発生および神経管の形成を観察することのできるアフリカツメガエルの胚やニワトリの胚が大きく貢献している.
これまでの研究においてもっとも着目されてきたのは,神経板の内部で起こる形態形成である(図3b).神経板は上皮構造をとり,胚の外側が頂端側,内側が基底側という明確な頂底極性をもつ.頂端側には強固なタイト結合やアドヘレンス結合が形成され外界からの液体の侵入をふせぎ,また,上皮細胞シートとしての統合性を維持している.神経板の屈曲にかかわる細胞はこの頂底極性にそって細胞伸長および頂端収縮という2つの大きな変化を起こし,その結果として,くさび形の形態へと変化することがわかっている.ヒンジポイントとよばれる領域が先導してこの細胞の変形を起こすことが組織の屈曲の原動力と考えられている.筆者らの最近の研究により,頂底軸の方向への細胞伸長においては微小管の伸長が重要であることがわかってきた.神経管の屈曲部の細胞の微小管を観察すると,頂端側をマイナス端,基底側をプラス端として配向している.この微小管の伸長を制御し神経管の形成にかかわるタンパク質を探索したところ,MID1およびMID2とよばれるヒトのOpitz症候群(咽頭,気道,尿道などの上皮構造の統合性に異常がみられる)の原因遺伝子にコードされるタンパク質が,微小管に結合し細胞の形態変化を促進していることを見い出した16).この遺伝子の機能を阻害すると,神経板において組織の屈曲にかかわる細胞の形態変化が阻害された.安定化した微小管のマーカーであるアセチル化チューブリンを免疫染色したところ,MID1およびMID2による微小管の安定化が低下しており,それにより束化が阻害されたことで細胞伸長が抑制されたものと考えられた.細胞伸長につづいて起こる頂端収縮は,頂端側に集積するアクトミオシン系の活性化により起こる.きんちゃくモデル(purse-string model)とよばれるように,頂端側においてアクチンのひもが細胞をしぼるように変形させるため,細胞は結果としてくさび形になる.このアクトミオシン系の制御には多くのタンパク質がかかわっており,非古典的Wnt経路やアクチン結合タンパク質Shroom3などがRhoAの活性化を介しミオシンのリン酸化の促進に機能することがわかっている17).また,細胞接着も頂端収縮や集団的な細胞の変形において重要であることがわかっており,カドヘリンやネクチンなど細胞接着分子の機能が明らかにされている17,18).これら細胞接着分子の役割は,組織としての統合性を維持するばかりでなく,細胞運動の起点となる移動,収縮,伸展など細胞の物理的な変化を細胞接着を介して周囲の細胞に伝達することにあるのだろう.
このいわば組織自律的な運動に対し,筆者らは,完全な神経管閉鎖には組織非自律的な運動も必要であることを見い出した(図3b).神経管そのものは神経上皮から分化し,頂端収縮がその重要な原動力になっているが,その管形成には非神経上皮も寄与していることがわかってきたのだ19).非神経外胚葉の寄与については,頂端側の表面の伸展,前後軸にそった細胞分裂,収斂と伸長による組織リモデリング,胚の内層から表層にむかう垂直(放射)方向の細胞のすべり込み,などが管形成を促進するといった多くの可能性が提唱されていたが,筆者らの実験および観察では,いずれの可能性をも支持する結果が得られなかった.一方,デジタルスキャン光シート顕微鏡(digital scanned light-sheet microscope:DSLM)を用いた生細胞イメージング観察により,非神経上皮細胞は胚の前後端から中央部腹側にむかって大きく移動しており,その移動は中央部で合流しさらに背側へとむかっていることがわかった.同時に,中央部腹側から背側正中線にむかう細胞は一様にその表層が背腹軸にそって伸長していた.この細胞集団の移動が神経管閉鎖に寄与しているものと考え,さらに詳細に観察した.非神経外胚葉は表層と深層とに分けることができる.表層の細胞は典型的な上皮様の組織を形成し,カドヘリンなどを介した強固な細胞接着により組織としての安定性および統合性を維持しているのに対し,深層の細胞は細胞接着が弱く,中胚葉細胞のように個々の細胞が無定形で細胞突起を伸長しながら背側へと積極的に移動していることがわかった.この深層の細胞運動が表層の上皮細胞を牽引しているものと予想し,レーザーによる組織切断実験を行った.切断した組織の反発から力のかかっている方向を検討したところ,切断面は背側の方向に反発し大きく開放することがわかった.また,インテグリンのノックダウンにより深層の細胞の背側への移動を阻害すると切断ののちの反発は小さくなり,また,神経管閉鎖不全をひき起こした.すなわち,深層の細胞と表層の細胞とのあいだには弱い細胞接着(摩擦力)があり,深層の細胞の活発な移動が非神経上皮の背側への移動を先導し神経板閉鎖を促進しているものと結論づけた19).これらのことから,完全な神経管閉鎖は頂端収縮という組織自律的な機構と非神経外胚葉の移動による組織非自律的な機構の両者により完遂されることが明らかにされた.
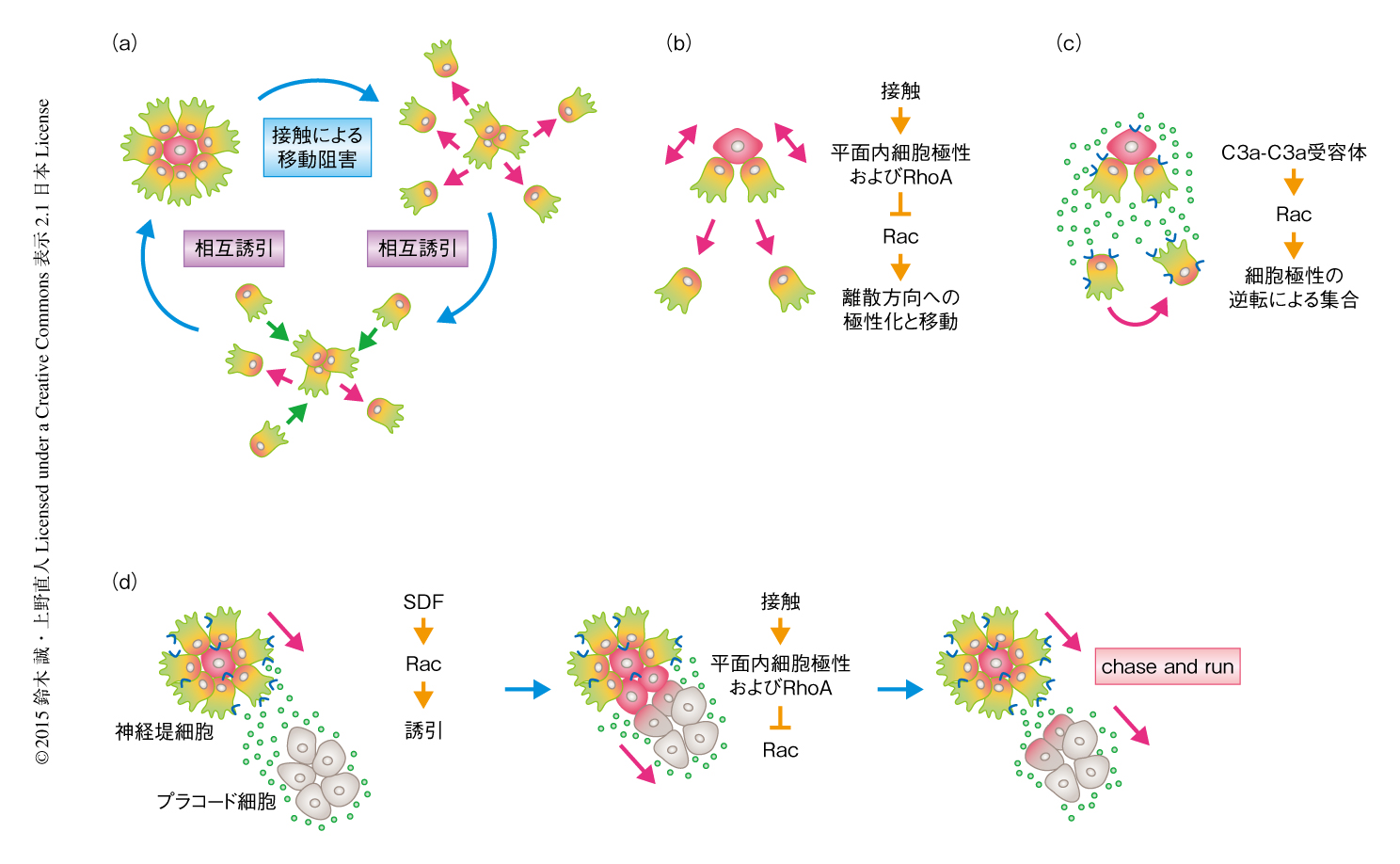
神経管閉鎖においては腹側から背側への細胞の移動が重要であることがわかったが,それとは反対に,背側から腹側への移動もかたちづくりや器官の形成において重要であることがわかっている.神経提細胞は脊椎動物に特徴的な細胞で,神経上皮と非神経上皮との境界に由来し,末梢神経系細胞,骨や軟骨,色素細胞など多様な細胞に分化する.とくに,頭部の神経提細胞は骨や軟骨の形成を介して顔面の形成に寄与する.この神経提細胞は神経管の上部から腹側にむかって長距離を移動するが,移動している同種の細胞どうしが接触すると,きびすを返すように互いに逆方向にむけ離れていく“接触による移動阻害”(contact inhibition of locomotion)を起こすことが報告され(図4a),この現象においては平面内細胞極性シグナルが必要であることが明らかにされた20).すなわち,平面内細胞極性シグナルタンパク質は細胞どうしの接触部位に局在し,その領域においてRhoAを活性化することにより細胞突起の形成を阻害し,細胞の移動を逆方向に転換する(図4b).これにより,移動の先端の細胞は追従する細胞の集団と一定の距離をおきながら腹側へと移動する.
また一方で,神経提細胞は上皮間充織転換(epithelial-mesenchymal transition)により細胞接着が弱まり本来は散逸する傾向にあるが,補体C3aおよびその受容体C3a受容体が細胞どうしの密着度(まとまり)を生むことが見い出され,この現象は“相互誘引”(co-attraction)とよばれている21).C3aによるC3a受容体の活性化はNカドヘリンを介した細胞接着,あるいは,細胞外基質との接着や細胞の移動能には影響しない一方で,Rac1の活性化をとおして細胞突起を安定化しC3aとC3a受容体を共発現する神経提細胞どうしを集合させる(図4c).これにより協調的な細胞移動を可能にしているのだろう.
また最近,神経提細胞のさき(腹側)にあるプラコード細胞が化学誘引物質SDF-1を放出して神経提細胞を誘引する一方,プラコード細胞は平面内細胞極性シグナルやカドヘリンシグナルにより神経提細胞と反発しさらに前方(腹側)に進むという“chase and run”(細胞どうしの“追いかけっこ”)という精妙な機構があることが提唱された22)(図4d).これらの発見は,異なる機構による細胞間相互作用が何重にもはたらくことにより,はじめて集団的で協調的な細胞運動が可能になることを示唆している.
とくに発生の過程のかたちづくりにおいては,個体を構成する細胞は個々が自由にふるまうのではなく,集団としての統合性を維持しながら協調して運動することが重要である.そのためには,細胞および細胞集団の移動や形態変化に非対称性をあたえる細胞極性は必須である.上皮細胞はその強固な細胞接着に依存し,個々の細胞の形態変化が先導して組織のリモデリングを完成させる.この際,どのような3次元の形態形成を獲得するかは細胞極性に依存している.また,活発に移動する中胚葉性のいわゆる間充織細胞においては,化学誘引物質を引き金とし,それにしたがい細胞突起を移動の方向に形成するなど,細胞において機能的な極性が確立することが必須である.また,適正な細胞接着を介した連動性の確保と同時に,互いに密集し衝突をさける機構が存在し,組織としての運動性を維持している.こうした事例をあげていくと,生物のかたちづくりの進化は,放射対称の卵からいかに非対称性を生みだすか,その試行錯誤の連続であったと考えさせられる.極性を感知した細胞の応答が組織集団としての運動を可能にするが,その運動は物理的な力を生み別の組織のふるまいに影響する.遺伝子およびタンパク質のはたらきにくわえ,こうした組織のメカニクスを新たな階層の制御機構として理解を深めていくことが重要だろう.
略歴:2007年 東北大学大学院生命科学研究科 修了,同年 基礎生物学研究所 博士研究員を経て,2008年より同 助教.
研究テーマ:上皮の形態形成における細胞運動の意義およびその制御機構.
上野 直人(Naoto Ueno)
基礎生物学研究所 教授.
研究室URL:http://www.nibb.ac.jp/morphgen/
© 2015 鈴木 誠・上野直人 Licensed under CC 表示 2.1 日本
(基礎生物学研究所 形態形成研究部門)
email:鈴木 誠,上野直人
領域融合レビュー, 4, e006 (2015) DOI: 10.7875/leading.author.4.e006
Makoto Suzuki & Naoto Ueno: Cell movement and polarity required for animal development.
要 約
生物の形態形成において細胞の移動など組織の3次元リモデリングは必須である.その過程において,細胞はどのように形態や機能の非対称性を獲得し正しく配置されるのだろうか.細胞の分化と個々の細胞のダイナミックな移動あるいは変形をともなう組織のリモデリングとが精妙に協調することが形態形成の鍵である.細胞の集団的な移動や変形といった統合された運動のためには,ある局面では強固な細胞接着が,また別の局面では減弱し大胆な運動を可能にすることが必要になる.細胞の集団は細胞外シグナルにより移動する方向を知り,細胞はそれにしたがい移動の舵とりをする.個々の運動は細胞外シグナルに依存する一方,細胞どうしの密な連携を維持しており,それにより高度に協調した細胞運動を制御している.まさに,細胞が社会を形成しかたちづくりをなしとげているのだ.このレビューでは,筆者らの研究を含めた最近の知見を紹介しながら,形態形成の過程がどのように分子レベルで制御されているのかについて解説する.
はじめに
ひとつの受精卵は細胞分裂をくり返して胚になり,そののち,生物に固有の形態を獲得する.その発生の過程において,胚は多分化能をもついわゆる幹細胞から,さまざまな性質をもつ特殊化した細胞へと分化する.しかし,細胞の分化はかたちづくりの基盤にあっても,その原動力にはなりえない.細胞個々あるいは集団としての運動により生物のかたちができあがるのだ.細胞集団の協調した運動により,組織は単純なシート構造から管やひだなど複雑な構造を生みだす.このレビューでは,生物の形態形成をささえる細胞運動やその背景にある細胞極性に関する最近の知見を,筆者らの研究成果を含め解説する.
1.原腸の形成と前後軸の極性
初期の発生において生物をかたちづくる大きな現象として原腸の形成がある.原腸の形成はウニなど棘皮動物から脊椎動物まで進化的に保存された基本的な現象で,細胞が胚の一部(原口)から胚の内側へと流れ込むように陥入することにより腔(原腸)を形成するという,非常にダイナミックな細胞運動である.このとき,胚の表層においては外胚葉細胞が胚の全体におおいかぶさるような運動(エピボリー運動)が起こる.両生類のモデル生物であるアフリカツメガエルは,その胚の大きさ(直径は約1.2 mm)からこの原腸形成の機構の研究に重用されている.アフリカツメガエルの場合,10回の細胞分裂をへて細胞数が約1000になったとき,おもに胚の背側から細胞が陥入しはじめる.そののち,細胞は将来の頭部(前方)にむかって移動し,同時に,胚を内側からおおうように正中線から左右にむかって広がる(図1a).この運動により,内胚葉は胚の腹側,中胚葉は胚の背側,外胚葉は胚の表層側に配置されることから,この細胞運動はのちの器官形成にきわめて重要な意味をもつといえる.
この細胞運動の原動力は,細胞の集団が外胚葉の内側を前方にむかって移動する“集団的な細胞の移動”にある.筆者らの最近の研究により,この移動する細胞集団は一様に移動する力を発揮しているのではなく,先端の一部のみが移動能をもち,後方の細胞集団を牽引していることがわかってきた(図1b).牽引をする細胞は内中胚葉(機能的に分離できない内胚葉細胞と中胚葉細胞の集団)とよばれ,その後方において将来の脊索の形成に寄与する中軸中胚葉細胞とは,発現する遺伝子からも性質の異なることが知られている.内中胚葉(先端に位置することから,先端中胚葉ともよばれる)を胚から切除し外胚葉の内側の細胞外基質を写しとったスライドガラスのうえで培養すると1),内中胚葉は前方に移動するが,中軸中胚葉には移動能がないことがわかった.また,中軸中胚葉の組織のレーザー切断実験から,内中胚葉の細胞集団が前方に移動し後方の中軸中胚葉の細胞集団を牽引することにより,中軸中胚葉では前後の方向に引張力が発生している(中軸中胚葉が引っぱられている)ことも明らかにされた2).
このような細胞集団の移動はどのように起こるのだろうか.細胞の移動に細胞外基質であるフィブロネクチンが必要であることはすでにわかっていたが,フィブロネクチンは移動方向の制御は担っていない.培養細胞を使った研究から,方向性をもつ細胞の移動においては化学誘引物質が鍵となることがわかっており,化学誘引物質を感知しその方向へ移動する性質は走化性とよばれる.胚の発生における集団的な細胞の移動においても,化学誘引物質は必須であることが明らかになりつつある.とくに,原腸の形成においては,SDF-1やPDGFといったタンパク質が化学誘引物質として前方への組織の移動を促進している.化学誘引物質は外胚葉において発現しており,その活性の阻害は内中胚葉の細胞の前方への移動を阻害する1).また別の例として,ゼブラフィッシュの側線ニューロンがある.側線ニューロンの前駆細胞は周辺の組織において発現するSDF-1の濃度に依存して胚の後方へと移動する3).このとき,移動する細胞集団はまえもって形成されたSDF-1の濃度勾配にくわえ,受容体を介したSDF-1の内部への移行により局所的な活性勾配を自己形成し,それらにしたがい移動することが,最近の研究により明らかにされた4).すなわち,これら化学誘引物質の濃度勾配を感知した細胞が,どの方向に移動すべきかを決定しているものと考えられる.原腸の形成の際,内中胚葉の細胞はラメリポディア(膜状突起)を前方にむけ活発に伸ばしており,そのラメリポディアを足がかりに前方へと移動する.つまり,化学誘引物質の濃度の高いほうにラメリポディアを形成するという非対称性が生みだされている.化学誘引物質の濃度勾配を細胞が感知し細胞極性に変換するしくみは,発生のさまざまな過程で用いられる生物の戦略といってもよいだろう.移動する細胞の内部では,通常,ラメリポディアの形成にかかわる低分子量Gタンパク質であるRac1やCdc42が前方で,RhoAが後方で活性化されており,このような活性の非対称性が方向性をもつ細胞の移動を可能にしている.
2.脊索の形成と内外軸の極性
中軸中胚葉はのちに脊索を形成する.脊索は脊椎動物では発生の後期に消失する組織であるが,発生の初期においては,前後軸と直交する軸(正中線から側方にむかう軸であるため,内外軸とよぶ)の方向にある程度の幅をもっていた脊索の組織が徐々に正中線に集まり前後の方向に細長くなることにより胚を前後軸の方向に伸ばす,という胚の形態形成において重要な役割をもつ.内中胚葉の前方への移動を阻害するとこの脊索の形成も異常になることから,筆者らは,原腸の形成は脊索の形成と連動しているものと考えている.脊索組織は正中線に集まり,同時に前後軸の方向に伸びる運動は脊索組織の全体の変形として“収斂と伸長”(convergence and extension)とよばれる.この組織の変形は個々の細胞の変形をともなうことがよく知られている.この運動の過程では,脊索の細胞は徐々に紡錘形になり,互いのあいだに滑り込むようにして左右の幅をせばめることが観察されている.また,細胞形態の変化とともに,細長くなった細胞の両端には細胞突起(ラメリポディアおよびフィロポディア)が形成されることから,細胞どうしが細胞突起を使って互いに引っ張りあうことが収斂の原動力になっているという説がある(図1c).一方,最近,アクチンが内外軸にそった細胞膜を短縮することにより隣接する細胞を引きつけるという説も提唱された5).いずれにしても,内外軸にそった細胞極性が組織の収斂を,そして,それにより伸長をひき起こすことに変わりない.
こうした細胞極性を制御するしくみとして,“平面内細胞極性”(planar cell polarity:PCP)が知られている6).平面内細胞極性はショウジョウバエの翅の表面に生える小さな毛(翅毛)の生えるむきや複眼を構成する光受容体の配置を決定するしくみとして研究されてきた(図2a).ショウジョウバエにおける遺伝学的な手法を用いた精力的な研究により,平面内細胞極性のシグナル伝達系を構成する多数のタンパク質が発見されており,多くの生物種で保存された膜タンパク質であるFrizzled(Fz),Strabismus/Van Gogh,Flamingoが,細胞内においてDishevelled,Prickle,Diegoなどと相互作用し,上皮細胞の頂端側に水平方向の極性をあたえる(図2b).脊椎動物においては,これらは非古典的Wnt経路のひとつで,Wnt5やWnt11などのリガンドが引き金となることが知られている.筆者らは,平面内細胞極性シグナルタンパク質であるGlypican4(ゼブラフィッシュでは,knypek遺伝子にコードされる)およびPrickleが脊椎動物においては原腸の形成および脊索の形成に必須であることを明らかにした7,8).つまり,この知見は,平面内細胞極性シグナルが生物種をこえて保存されており,上皮細胞ばかりでなく中胚葉細胞の活発な運動にも必要であることを示している.平面内細胞極性は原腸の形成あるいは脊索の形成ばかりでなく,さまざまな器官の形成,とくに,伸長をともなう器官の形成に用いられている.最近,平面内細胞極性シグナルタンパク質であるVan Gogh-like 2(Vangl2)のノックアウトマウスの表現型から,Vangl2が四肢の伸長に必要であることが示された9).このように,組織の収斂と伸長には同じ原理が使いまわされている可能性がある.また,細胞の非対称性を生むというショウジョウバエの翅毛の形成における役割と同様の機能は,脊椎動物においても明らかにされている.内耳の有毛細胞は組織の軸性にそって規則正しく配置しており,その発生の過程では平面内細胞極性シグナルタンパク質であるFz3やVangl2が細胞の基部の側に局在することが必要である10,11).輸卵管は生殖巣で産生された卵子を子宮へ輸送するため協調した繊毛運動と多数のヒダ構造を形成する.この過程においても平面内細胞極性シグナルタンパク質が機能しており,細胞の基部-先端部軸にそって局在するCelsr1(Flamingoの相同タンパク質)が欠損すると繊毛運動とヒダ構造が不規則になる12).また,発生の初期のノード(胚の腹側のくぼんだ組織)においては,ノード細胞の表層側で1次繊毛が細胞の後方に位置し胚の後方側にかたむいて回転運動することが胚の左右軸の決定に必要であるが,この過程に平面内細胞極性シグナルタンパク質の前後軸にそった非対称な局在が必須であることが明らかにされている11,13).
筆者らは,収斂と伸長の制御機構を探るため,機能的な細胞極性の形成の指標として微小管の動態を観察した.EB1およびEB3は微小管のプラス端(伸長する端)に結合する性質をもつ.したがって,EB1あるいはEB3をGFPとの融合タンパク質にしてその動態を観察すると微小管の伸長の極性を知ることができる.生細胞イメージングによる観察の結果,微小管は脊索とその側方に位置する体節(将来は筋肉になる)との境界にむかって伸長することがわかった14)(図1d).この脊索と体節という異なる組織の境界の脊索側においては,細胞内Ca2+濃度の頻繁な上昇がみられた.異なる組織の接触培養においても同様のCa2+濃度の上昇が観察され,同種の組織の接触培養ではその頻度は低いことから,脊索と体節という異種の組織のあいだの境界がCa2+濃度の上昇の引き金になるなんらかの情報をもつことが予想される15).
3.神経管の形成と頂底極性
神経管は外胚葉が神経化したのちに生みだされる中枢神経系の原基で,前部では脳,体幹部では脊髄を形成する.神経管は両生類と羊膜類とで共通する特徴的な管形成の過程をへることが知られている(図3a).神経管は外胚葉が誘導をうけ神経化すると神経板とよばれる肥厚したシート状の組織に変化し,そののち,非神経外胚葉との境界に前後軸にそって神経褶とよばれる隆起が形成される.この神経板の中央部において神経板が屈曲することにより,神経褶の頂端が正中線において融合し,神経板のシート構造が管を形成することがわかっている.この管形成が阻害される神経管閉鎖不全はヒトにおいて2000~3000の出産に1例の割合でみられる二分脊椎症の原因であり,遺伝的な背景あるいは環境要因による二分脊椎症の病因の解明,とくに,細胞レベルでの病態の解明は医学において重要な研究課題のひとつである.この神経管の形成における細胞変形の機構の解明においては,母体の外で発生および神経管の形成を観察することのできるアフリカツメガエルの胚やニワトリの胚が大きく貢献している.
これまでの研究においてもっとも着目されてきたのは,神経板の内部で起こる形態形成である(図3b).神経板は上皮構造をとり,胚の外側が頂端側,内側が基底側という明確な頂底極性をもつ.頂端側には強固なタイト結合やアドヘレンス結合が形成され外界からの液体の侵入をふせぎ,また,上皮細胞シートとしての統合性を維持している.神経板の屈曲にかかわる細胞はこの頂底極性にそって細胞伸長および頂端収縮という2つの大きな変化を起こし,その結果として,くさび形の形態へと変化することがわかっている.ヒンジポイントとよばれる領域が先導してこの細胞の変形を起こすことが組織の屈曲の原動力と考えられている.筆者らの最近の研究により,頂底軸の方向への細胞伸長においては微小管の伸長が重要であることがわかってきた.神経管の屈曲部の細胞の微小管を観察すると,頂端側をマイナス端,基底側をプラス端として配向している.この微小管の伸長を制御し神経管の形成にかかわるタンパク質を探索したところ,MID1およびMID2とよばれるヒトのOpitz症候群(咽頭,気道,尿道などの上皮構造の統合性に異常がみられる)の原因遺伝子にコードされるタンパク質が,微小管に結合し細胞の形態変化を促進していることを見い出した16).この遺伝子の機能を阻害すると,神経板において組織の屈曲にかかわる細胞の形態変化が阻害された.安定化した微小管のマーカーであるアセチル化チューブリンを免疫染色したところ,MID1およびMID2による微小管の安定化が低下しており,それにより束化が阻害されたことで細胞伸長が抑制されたものと考えられた.細胞伸長につづいて起こる頂端収縮は,頂端側に集積するアクトミオシン系の活性化により起こる.きんちゃくモデル(purse-string model)とよばれるように,頂端側においてアクチンのひもが細胞をしぼるように変形させるため,細胞は結果としてくさび形になる.このアクトミオシン系の制御には多くのタンパク質がかかわっており,非古典的Wnt経路やアクチン結合タンパク質Shroom3などがRhoAの活性化を介しミオシンのリン酸化の促進に機能することがわかっている17).また,細胞接着も頂端収縮や集団的な細胞の変形において重要であることがわかっており,カドヘリンやネクチンなど細胞接着分子の機能が明らかにされている17,18).これら細胞接着分子の役割は,組織としての統合性を維持するばかりでなく,細胞運動の起点となる移動,収縮,伸展など細胞の物理的な変化を細胞接着を介して周囲の細胞に伝達することにあるのだろう.
このいわば組織自律的な運動に対し,筆者らは,完全な神経管閉鎖には組織非自律的な運動も必要であることを見い出した(図3b).神経管そのものは神経上皮から分化し,頂端収縮がその重要な原動力になっているが,その管形成には非神経上皮も寄与していることがわかってきたのだ19).非神経外胚葉の寄与については,頂端側の表面の伸展,前後軸にそった細胞分裂,収斂と伸長による組織リモデリング,胚の内層から表層にむかう垂直(放射)方向の細胞のすべり込み,などが管形成を促進するといった多くの可能性が提唱されていたが,筆者らの実験および観察では,いずれの可能性をも支持する結果が得られなかった.一方,デジタルスキャン光シート顕微鏡(digital scanned light-sheet microscope:DSLM)を用いた生細胞イメージング観察により,非神経上皮細胞は胚の前後端から中央部腹側にむかって大きく移動しており,その移動は中央部で合流しさらに背側へとむかっていることがわかった.同時に,中央部腹側から背側正中線にむかう細胞は一様にその表層が背腹軸にそって伸長していた.この細胞集団の移動が神経管閉鎖に寄与しているものと考え,さらに詳細に観察した.非神経外胚葉は表層と深層とに分けることができる.表層の細胞は典型的な上皮様の組織を形成し,カドヘリンなどを介した強固な細胞接着により組織としての安定性および統合性を維持しているのに対し,深層の細胞は細胞接着が弱く,中胚葉細胞のように個々の細胞が無定形で細胞突起を伸長しながら背側へと積極的に移動していることがわかった.この深層の細胞運動が表層の上皮細胞を牽引しているものと予想し,レーザーによる組織切断実験を行った.切断した組織の反発から力のかかっている方向を検討したところ,切断面は背側の方向に反発し大きく開放することがわかった.また,インテグリンのノックダウンにより深層の細胞の背側への移動を阻害すると切断ののちの反発は小さくなり,また,神経管閉鎖不全をひき起こした.すなわち,深層の細胞と表層の細胞とのあいだには弱い細胞接着(摩擦力)があり,深層の細胞の活発な移動が非神経上皮の背側への移動を先導し神経板閉鎖を促進しているものと結論づけた19).これらのことから,完全な神経管閉鎖は頂端収縮という組織自律的な機構と非神経外胚葉の移動による組織非自律的な機構の両者により完遂されることが明らかにされた.
4.神経提細胞の移動と細胞極性
神経管閉鎖においては腹側から背側への細胞の移動が重要であることがわかったが,それとは反対に,背側から腹側への移動もかたちづくりや器官の形成において重要であることがわかっている.神経提細胞は脊椎動物に特徴的な細胞で,神経上皮と非神経上皮との境界に由来し,末梢神経系細胞,骨や軟骨,色素細胞など多様な細胞に分化する.とくに,頭部の神経提細胞は骨や軟骨の形成を介して顔面の形成に寄与する.この神経提細胞は神経管の上部から腹側にむかって長距離を移動するが,移動している同種の細胞どうしが接触すると,きびすを返すように互いに逆方向にむけ離れていく“接触による移動阻害”(contact inhibition of locomotion)を起こすことが報告され(図4a),この現象においては平面内細胞極性シグナルが必要であることが明らかにされた20).すなわち,平面内細胞極性シグナルタンパク質は細胞どうしの接触部位に局在し,その領域においてRhoAを活性化することにより細胞突起の形成を阻害し,細胞の移動を逆方向に転換する(図4b).これにより,移動の先端の細胞は追従する細胞の集団と一定の距離をおきながら腹側へと移動する.
また一方で,神経提細胞は上皮間充織転換(epithelial-mesenchymal transition)により細胞接着が弱まり本来は散逸する傾向にあるが,補体C3aおよびその受容体C3a受容体が細胞どうしの密着度(まとまり)を生むことが見い出され,この現象は“相互誘引”(co-attraction)とよばれている21).C3aによるC3a受容体の活性化はNカドヘリンを介した細胞接着,あるいは,細胞外基質との接着や細胞の移動能には影響しない一方で,Rac1の活性化をとおして細胞突起を安定化しC3aとC3a受容体を共発現する神経提細胞どうしを集合させる(図4c).これにより協調的な細胞移動を可能にしているのだろう.
また最近,神経提細胞のさき(腹側)にあるプラコード細胞が化学誘引物質SDF-1を放出して神経提細胞を誘引する一方,プラコード細胞は平面内細胞極性シグナルやカドヘリンシグナルにより神経提細胞と反発しさらに前方(腹側)に進むという“chase and run”(細胞どうしの“追いかけっこ”)という精妙な機構があることが提唱された22)(図4d).これらの発見は,異なる機構による細胞間相互作用が何重にもはたらくことにより,はじめて集団的で協調的な細胞運動が可能になることを示唆している.
おわりに
とくに発生の過程のかたちづくりにおいては,個体を構成する細胞は個々が自由にふるまうのではなく,集団としての統合性を維持しながら協調して運動することが重要である.そのためには,細胞および細胞集団の移動や形態変化に非対称性をあたえる細胞極性は必須である.上皮細胞はその強固な細胞接着に依存し,個々の細胞の形態変化が先導して組織のリモデリングを完成させる.この際,どのような3次元の形態形成を獲得するかは細胞極性に依存している.また,活発に移動する中胚葉性のいわゆる間充織細胞においては,化学誘引物質を引き金とし,それにしたがい細胞突起を移動の方向に形成するなど,細胞において機能的な極性が確立することが必須である.また,適正な細胞接着を介した連動性の確保と同時に,互いに密集し衝突をさける機構が存在し,組織としての運動性を維持している.こうした事例をあげていくと,生物のかたちづくりの進化は,放射対称の卵からいかに非対称性を生みだすか,その試行錯誤の連続であったと考えさせられる.極性を感知した細胞の応答が組織集団としての運動を可能にするが,その運動は物理的な力を生み別の組織のふるまいに影響する.遺伝子およびタンパク質のはたらきにくわえ,こうした組織のメカニクスを新たな階層の制御機構として理解を深めていくことが重要だろう.
文 献
- Nagel, M., Tahinci, E., Symes, K. et al.: Guidance of mesoderm cell migration in the Xenopus gastrula requires PDGF signaling. Development, 131, 2727-2736 (2004)[PubMed]
- Hara, Y., Nagayama, K., Yamamoto, T. S. et al.: Directional migration of leading-edge mesoderm generates physical forces: implication in Xenopus notochord formation during gastrulation. Dev. Biol., 382, 482-495 (2013)[PubMed]
- David, N. B., Sapede, D., Saint-Etienne, L. et al.: Molecular basis of cell migration in the fish lateral line: role of the chemokine receptor CXCR4 and of its ligand, SDF1. Proc. Natl. Acad. Sci. USA, 99, 16297-16302 (2002)[PubMed]
- Dona, E., Barry, J. D., Valentin, G. et al.: Directional tissue migration through a self-generated chemokine gradient. Nature, 503, 285-289 (2013)[PubMed]
- Shindo, A. & Wallingford, J. B.: PCP and septins compartmentalize cortical actomyosin to direct collective cell movement. Science, 343, 649-652 (2014)[PubMed] [新着論文レビュー]
- Devenport, D.: The cell biology of planar cell polarity. J. Cell Biol., 207, 171-179 (2014)[PubMed]
- Ohkawara, B., Yamamoto, T. S., Tada, M. et al.: Role of glypican 4 in the regulation of convergent extension movements during gastrulation in Xenopus laevis. Development, 130, 2129-2138 (2003)[PubMed]
- Takeuchi, M., Nakabayashi, J., Sakaguchi, T. et al.: The prickle-related gene in vertebrates is essential for gastrulation cell movements. Curr. Biol., 13, 674-679 (2003)[PubMed]
- Gao, B., Song, H., Bishop, K. et al.: Wnt signaling gradients establish planar cell polarity by inducing Vangl2 phosphorylation through Ror2. Dev. Cell, 20, 163-176 (2011)[PubMed]
- Montcouquiol, M., Rachel, R. A., Lanford, P. J. et al.: Identification of Vangl2 and Scrb1 as planar polarity genes in mammals. Nature, 423, 173-177 (2003)[PubMed]
- Song, H., Hu, J., Chen, W. et al.: Planar cell polarity breaks bilateral symmetry by controlling ciliary positioning. Nature, 466, 378-382 (2010)[PubMed]
- Shi, D., Komatsu, K., Hirao, M. et al.: Celsr1 is required for the generation of polarity at multiple levels of the mouse oviduct. Development, 141, 4558-4568 (2014)[PubMed]
- Hashimoto, M., Shinohara, K., Wang, J. et al.: Planar polarization of node cells determines the rotational axis of node cilia. Nat. Cell Biol., 12, 170-176 (2010)[PubMed]
- Shindo, A., Yamamoto, T. S. & Ueno, N.: Coordination of cell polarity during Xenopus gastrulation. PLoS One, 3, e1600 (2008)[PubMed]
- Shindo, A., Hara, Y., Yamamoto, T. S. et al.: Tissue-tissue interaction-triggered calcium elevation is required for cell polarization during Xenopus gastrulation. PLoS One, 5, e8897 (2010)[PubMed]
- Suzuki, M., Hara, Y., Takagi, C. et al.: MID1 and MID2 are required for Xenopus neural tube closure through the regulation of microtubule organization. Development, 137, 2329-2339 (2010)[PubMed]
- Suzuki, M., Morita, H. & Ueno, N.: Molecular mechanisms of cell shape changes that contribute to vertebrate neural tube closure. Dev. Growth Differ., 54, 266-276 (2012)[PubMed]
- Morita, H., Nandadasa, S., Yamamoto, T. S. et al.: Nectin-2 and N-cadherin interact through extracellular domains and induce apical accumulation of F-actin in apical constriction of Xenopus neural tube morphogenesis. Development, 137, 1315-1325 (2010)[PubMed]
- Morita, H., Kajiura-Kobayashi, H., Takagi, C. et al.: Cell movements of the deep layer of non-neural ectoderm underlie complete neural tube closure in Xenopus. Development, 139, 1417-1426 (2012)[PubMed]
- Carmona-Fontaine, C., Matthews, H. K., Kuriyama, S. et al.: Contact inhibition of locomotion in vivo controls neural crest directional migration. Nature, 456, 957-961 (2008)[PubMed]
- Carmona-Fontaine, C., Theveneau, E., Tzekou, A. et al.: Complement fragment C3a controls mutual cell attraction during collective cell migration. Dev. Cell, 21, 1026-1037 (2011)[PubMed]
- Theveneau, E., Steventon, B., Scarpa, E. et al.: Chase-and-run between adjacent cell populations promotes directional collective migration. Nat. Cell Biol., 15, 763-772 (2013)[PubMed]
著者プロフィール
略歴:2007年 東北大学大学院生命科学研究科 修了,同年 基礎生物学研究所 博士研究員を経て,2008年より同 助教.
研究テーマ:上皮の形態形成における細胞運動の意義およびその制御機構.
上野 直人(Naoto Ueno)
基礎生物学研究所 教授.
研究室URL:http://www.nibb.ac.jp/morphgen/
© 2015 鈴木 誠・上野直人 Licensed under CC 表示 2.1 日本