セパラーゼの活性制御のしくみからひもとく染色体分離の機構
2015/04/27
進藤軌久・広田 亨
(がん研究会がん研究所 実験病理部)
email:進藤軌久,広田 亨
領域融合レビュー, 4, e007 (2015) DOI: 10.7875/leading.author.4.e007
Norihisa Shindo & Toru Hirota: Mechanism of chromosome segregation: insights from the study on separase regulation.

遺伝情報を担う染色体は細胞分裂の過程において正確に分配されなくてはならない.そのためには,染色体の凝縮から,染色体の分離,紡錘体極の方向への染色体の移動,そして,細胞質分裂へといたる一連のイベントが順序よく適切なタイミングで起こる必要がある.とくに,染色体分離は姉妹染色分体のあいだを接着するコヒーシンの切断という不可逆的な反応をともなうため,その過程における制御の異常は染色体分配の致命的な異常にいたると考えられる.したがって,コヒーシンを切断するプロテアーゼであるセパラーゼの活性制御は,正確な染色体分離を完遂するためにきわめて重要である.このレビューでは,セパラーゼに焦点をあて,その活性を測定するバイオセンサーにより明らかにされた知見をもとに,セパラーゼの活性制御機構の諸説を再考しながら染色体分離の機構について解説する.
細胞の遺伝情報を保持する染色体は娘細胞に正確に均等分配されなくてはならない.細胞には正確な染色体分離を保証する機構が存在しており,その機構の破綻はさまざまな疾患とも関連が深い.たとえば,がん細胞では染色体分離のエラーが頻発し,それにより生じる異数体は正常な細胞とがん細胞との大きな違いとして,100年以上もまえから知られている.さらに,減数分裂における染色体分離のエラーはダウン症をはじめとする多くの先天性疾患や流産の原因にもなりうる.正確な染色体分離を保証する機構を理解することは,これらの疾患を理解し新たな治療戦略を考えるためにも重要である.
染色体の分配を正確に完遂するためには,染色体の凝縮から,紡錘体の形成,染色体の分離,紡錘体極の方向への染色体の移動,そして,細胞質分裂にいたる分裂期の一連のイベントが正常に進行しなくてはならない(図1).これら一連のイベントは相互に連携しており,その順序やタイミングは非常に重要である.とくに,染色体分離は姉妹染色分体のあいだを接着するコヒーシンの切断という不可逆的な反応をともなうため,早すぎても遅すぎても致命的な影響をおよぼす.したがって,コヒーシンを切断するプロテアーゼであるセパラーゼの活性制御は正確な染色体分離を保証する機構の要になる.このレビューでは,まず,セパラーゼの発見と機能の解明の歴史から解説し染色体分離の機構について概観する.そのうえで,筆者らが開発したセパラーゼの活性を測定するバイオセンサーを用いた解析について紹介し,その知見をもとにセパラーゼの活性制御機構をめぐる諸説を再検討する.こうして,染色体分離を正確かつ確実に進めるためのしくみをうきぼりにしたい.
染色体分離の異常を示す変異体はさまざまな生物種において古くから発見されており,セパラーゼの変異体もそれらのうちのひとつとして発見された.最初のセパラーゼ変異体は,約40年前,糸状菌Aspergillus nidulansにおいて発見された.染色体分離の異常を示し分裂期において細胞周期を停止するこの変異体はbimB変異体と名づけられた1).その10年のち,こんどは分裂酵母において,染色体分離を起こさずに細胞質分裂が起こるcutとよばれる表現型を示す変異体としてcut1変異体が単離された2).さらにその2年のち,出芽酵母において染色体分離を起こさずに紡錘極体の複製が進む変異体としてESP1変異体が単離された3).そののち,これら3つの変異体それぞれの原因遺伝子が同定され,コードするタンパク質のアミノ酸配列が明らかにされるとともに,それらのC末端側の領域には高い相同性のあることがわかった4,5).この時点で,BimB,Cut1,ESP1が染色体分離の過程において重要な役割をもつことは明らかであったが,のちにセパラーゼとよばれるこのタンパク質の機能は,それから10年近くも不明のままだった.
1993年,染色体分離の開始のためにはAPC/C(anaphase promoting complex/cyclosome)の未知の基質が分解されることが必須であることが見い出された6).このAPC/Cの基質がどのようなタンパク質であるのかは明らかではなかったが(染色体に結合しているかどうかも不明だった),おそらく,姉妹染色分体のあいだを接着するタンパク質と考えられた.その数年のち,Cut1(分裂酵母のセパラーゼ)およびESP1(出芽酵母のセパラーゼ)に結合するタンパク質として,Cut2(分裂酵母のセキュリン)およびPDS1(出芽酵母のセキュリン)が同定された(図2a).Cut2とPDS1のアミノ酸配列にはほとんど相同性はなかったが,ともに分裂期中期から分裂期後期にかけAPC/Cによるユビキチン化に依存して分解され,その分解が染色体分離の開始に必須であるという興味深い特徴をもっていた7-10)(図2b).脊椎動物のセキュリンもやはり,APC/Cによるユビキチン化に依存的に分裂期中期から分裂期後期にかけて分解され,その分解が染色体分離の開始に必須であった11).このような結果から,1993年に想定されたAPC/Cの基質はセキュリンであることがわかった.そして,セキュリンが姉妹染色分体のあいだを接着する“糊”ではないかと考える,いわゆるセキュリンの“glue仮説”が提唱された.
ところが,セパラーゼに結合するセキュリンについて報告されたころ,出芽酵母においてScc1(あるいはMcd1,ほかの生物ではRad21)とよばれるタンパク質が発見された12,13).コヒーシンというタンパク質複合体のサブユニットのひとつであるScc1は,姉妹染色分体の接着に必須で,染色体分離の開始の際にAPC/Cに依存的に染色体から除去されていた(図2c).“糊”はセキュリンではなくコヒーシンだったのである.そののち,このScc1を染色体から除去するにはESP1(出芽酵母のセパラーゼ)も必要であり,さらに,PDS1(出芽酵母のセキュリン)を欠損させるとScc1がAPC/Cに非依存的に除去されるようになることが明らかにされた.したがって,APC/Cは染色体分離の際にScc1を直接的に除去しているのではなく,セキュリンの分解を介してセパラーゼが活性化し,そのセパラーゼが染色体からScc1を除去していると考えられるようになった10).そののち,過剰量のESP1を含む細胞抽出液は染色体からScc1を除去することができ,さらにこのとき,Scc1は切断されていることが明らかにされた14).この結果およびアミノ酸配列から,セパラーゼはプロテアーゼであることが予想され,2000年,ついにセパラーゼがプロテアーゼとしてScc1を切断することが示された15)(図2c).1975年のbimB変異体の発見から25年目にして,ようやくセパラーゼがプロテアーゼであり,その活性化が染色体分離の引き金になることが明らかにされたのである.
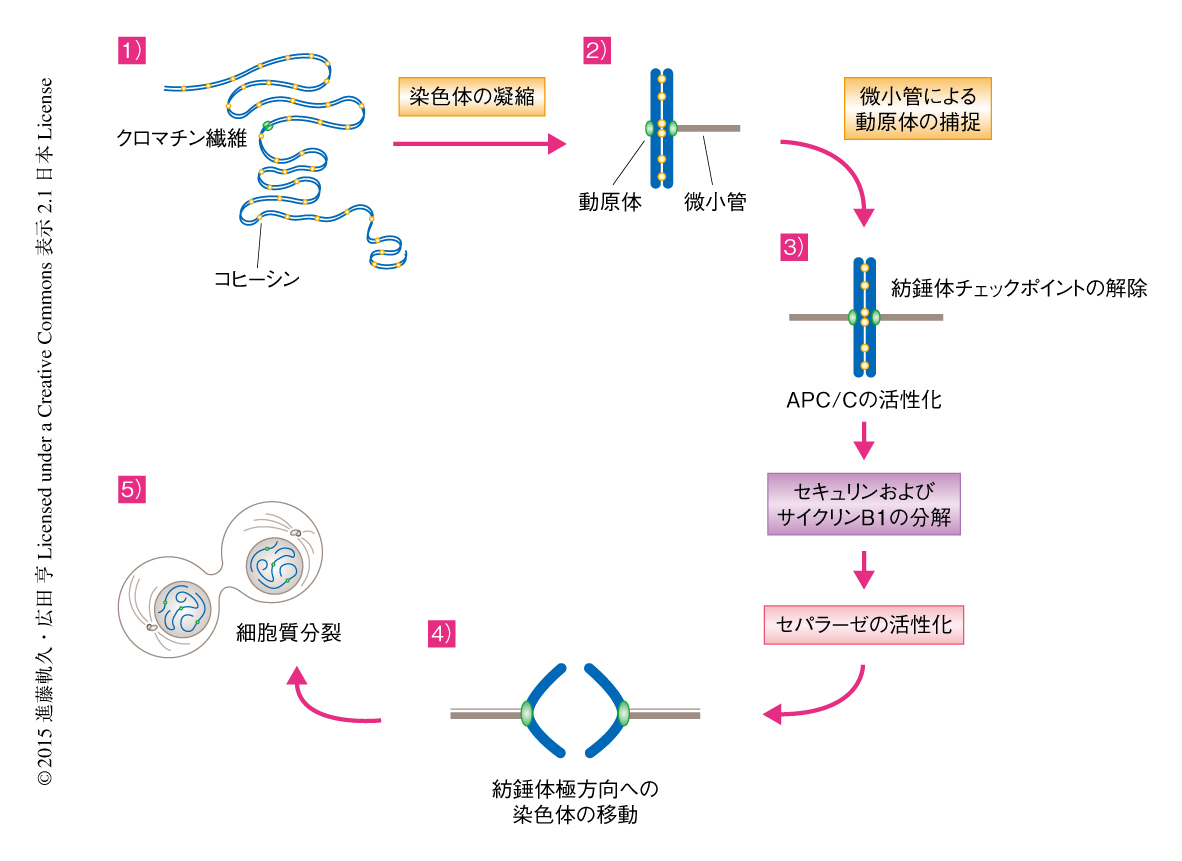
セパラーゼの活性化が染色体分離の引き金になることから,その活性は厳密に抑制されなくてはならないことが容易に推察される.たとえば,複製が完了した細胞の核にはクロマチン繊維とよばれる非常に長い間期染色体が存在する.このとき,DNAには複製により生じたDNAどうしのからまり(カテネーション)が存在し,このままセパラーゼがコヒーシンを切断し染色体を娘細胞に分配すると,DNAどうしが引っ張りあって切断されたり,染色体の長い腕部が反対側の娘細胞に残ってしまったりするかもしれない.このようなことをふせぐため,細胞においては染色体分離までにさまざまな前準備が行われている.まず,分裂期になると染色体は凝縮し,短い棒状の構造へと変化する(図3).このとき,細胞の種類にもよるが,長さが1万分の1になるものもある.そして,DNAのカテネーションは解消され,姉妹染色分体のあいだを接着していたコヒーシンのほとんどはセパラーゼではなくWaplとよばれるタンパク質により除去され,姉妹染色分体が解離しない程度の最小限のコヒーシンがShugoshinとよばれるタンパク質により保護され,おもにセントロメア領域に残る(図3).さらに,両極から伸びてきた微小管によりそれぞれの姉妹染色分体に一対だけ存在する動原体が捕捉され両側から引っ張られた状態になる(図3).すべての染色体がこの状態になるまでセパラーゼは活性化してはならない.
染色体が微小管により両側から引っ張られた状態になるまでを監視する機構を紡錘体チェックポイントという.紡錘体チェックポイントは微小管に捕捉されていない動原体を検出し,APC/CがセキュリンやサイクリンB1をユビキチン化するのを阻害する.すべての動原体が微小管に補足されると紡錘体チェックポイントは解除され,セキュリンやサイクリンB1がAPC/Cによるユビキチン化に依存して分解されセパラーゼは活性化する(図3).活性化したセパラーゼがコヒーシンのScc1サブユニットを切断すると,姉妹染色分体は微小管に引っ張られて両極の方向へと分配されていく.そののち,染色体分離が進行していくとともに紡錘体に大規模な形態変化が起こり,分離したのちの姉妹染色分体のあいだに微小管が逆平行に並んだ中央紡錘体とよばれる構造体が形成される.そして,中央紡錘体が形成されている部分で細胞膜がくびれはじめ細胞質分裂が起こる(図3).セパラーゼの活性化が細胞質分裂よりも遅れると,さきに述べた染色体分離をせずに細胞質分裂がはじまるcut表現型を示すことになるので,セパラーゼは紡錘体チェックポイントの解除から細胞質分裂が起こるまでのあいだいずれかのタイミングで活性化しなくてはならない.
セパラーゼの活性化はどのように規定されるのだろうか.セパラーゼの活性化はその抑制タンパク質であるセキュリンの量の低下により誘導されると考えられるが,分裂期におけるセキュリンの量を経時的に定量することにより,セキュリンは染色体分離の開始より10分以上もまえに分解しはじめ,緩徐にその量が低下し,そして,セキュリンが完全に消失するよりもまえに染色体分離の起こることが示されていた.しかも,セキュリンの分解開始から染色体分離までの時間も,染色体分離の際の残存するセキュリンの量も,細胞のあいだで大きなばらつきがあったため,セパラーゼの活性化のタイミングを読み取るには精度が不十分であった.また,この時期において細胞周期を同調するのは非常にむずかしく,染色体分離とセパラーゼの活性化のタイミングを生化学的に調べるのは困難であった.こうした技術的な限界から,染色体分離そのものをセパラーゼの活性化の指標とする状態が長くつづいた.
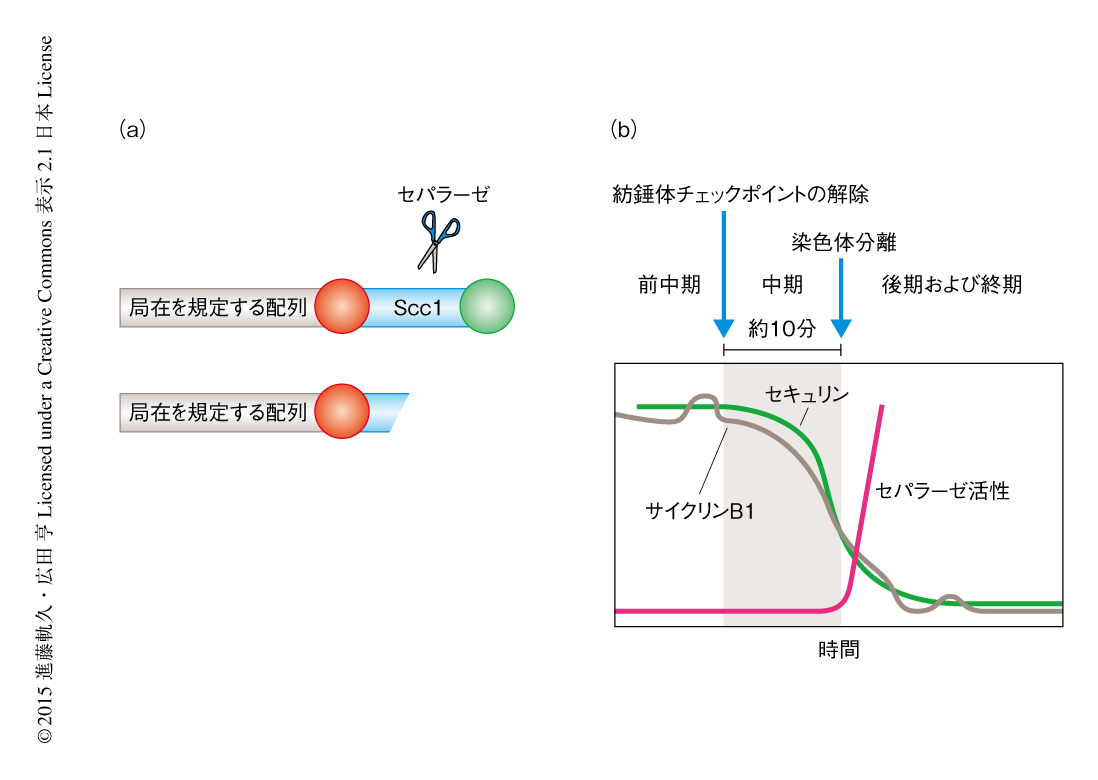
そこで筆者らは,セパラーゼの活性を可視化したいと考えそのバイオセンサーを作製した16)(新着論文レビュー でも掲載).このバイオセンサーの原理は,セパラーゼの基質の両端に2種類の異なる蛍光タンパク質をつなぎ,細胞において特定の場所に局在させ,片方の蛍光タンパク質の消失によりセパラーゼの活性を測定する,という単純なものである(図4a).細胞における局在を規定する配列として,ヒストンH2Bを使用すると染色体全体における,CENP-Bを用いるとセントロメアにおける,セパラーゼの活性を特異的に測定することができる.このバイオセンサーを用いた解析の結果,セパラーゼは染色体分離の直前に急激に活性化することが判明した(図4b).つまり,紡錘体チェックポイントが解除されると,APC/Cによるユビキチン化に依存的にセキュリンやサイクリンB1が分解されはじめるが,セパラーゼの活性の抑制はしばらくつづいており,染色体分離の直前になりセパラーゼは急激に活性化した.
染色体分離の直前にセパラーゼが急激に活性化するという結果は,染色体分離が高い同期性をもって開始するという観察事実をよく説明していた.しかし,セパラーゼが活性化する時期とその抑制タンパク質であるセキュリンやサイクリンB1の分解開始の時期にずれの存在することも明らかにされた.セパラーゼの活性がその抑制タンパク質が分解されているあいだも強く抑制されつづける機構はどのようなものだろうか.分裂期の細胞抽出液における抗セパラーゼ抗体を用いた免疫沈降実験により,分裂期の細胞にはセパラーゼに対し過剰量のセキュリンの存在することが示唆された.分裂期中期から分裂期後期にかけての同調培養の系を用いて同様の免疫沈降を行ったところ,セパラーゼとは結合していないセキュリンは分裂期後期にむかいゆるやかに分解されていったが,セパラーゼと結合しているセキュリンは分裂期後期の開始まで分解されずに安定だった.同様の結果は,ゲルろ過クロマトグラフィーによる細胞抽出液の分画によっても確認された.したがって,過剰量のセキュリンがAPC/Cの活性に対する“緩衝剤”の役割をはたし,安定してセパラーゼに結合しつづける一部のセキュリンによりセパラーゼの活性の抑制が維持されていることがわかった.
この結果はセキュリンの重要性を示したが,不思議なことに,哺乳類の細胞はセキュリンがなくても問題なく生存できる.それは,哺乳類の細胞にはセキュリンのほかもうひとつのセパラーゼの抑制タンパク質としてサイクリンB1が存在するからである.
もうひとつのセパラーゼの抑制タンパク質であるサイクリンB1は,詳細な生化学的な解析により,ヒトのセパラーゼにおいてSer1126(マウスでは,Ser1121)のリン酸化に依存して結合し,その活性を抑制することが報告された17).しかし,サイクリンB1によるセパラーゼの活性の抑制が重要になるのは,微小管の重合を阻害するノコダゾールにて処理することにより分裂期において長時間にわたり細胞周期を停止した場合など限定的な条件にかぎるという報告もあり,その生理学的な意義についてはよくわかっていなかった.
Ser1126をAlaに置換することによりサイクリンB1と結合できないようにした変異セパラーゼを用いたこれまでの解析には,セパラーゼの活性を染色体分離の有無により評価していたという点,そして,変異セパラーゼを過剰発現させることによりその効果を解析していたという点の2つの問題点があった.筆者らは,セパラーゼの活性をバイオセンサーにより評価し,さらに,変異セパラーゼについても過剰発現ではなくゲノムDNAを導入するBACトランスジーン法を用いて生理的な条件に近い発現量において解析することにした.
内在性の野生型セパラーゼをRNAi法によりノックダウンしたうえで,サイクリンB1と結合できない変異セパラーゼを発現させた細胞のセパラーゼ活性をバイオセンサーにより測定したところ,同様に野生型のセパラーゼを発現させた細胞と同じ上昇を示し,染色体分離の起こるまえの分裂期中期における時期尚早の活性化はみられなかった.したがって,染色体分離の起こるまえのサイクリンB1によるセパラーゼの活性の抑制は,セキュリンが存在しているかぎり重要ではないといえた.さらに,サイクリンB1と結合できない変異セパラーゼを発現させた細胞においてセキュリンをノックダウンすると,セパラーゼと結合してその活性を抑制するタンパク質は存在しなくなるが,このような状況では正常な染色体分離は阻害され,1時間以上もの長い分裂期中期をへて染色体がバラバラに散在するという現象がみられた.この細胞におけるセパラーゼの活性をバイオセンサーにより測定したところ,核膜崩壊の直後から染色体において弱い活性が検出されはじめ,そのまま上昇することなく一定のままであり,その活性は正常な染色体分離の際の約2%しかなかった.染色体におけるセパラーゼの量を調べたところ,セキュリンもサイクリンB1も結合していないセパラーゼは染色体への局在が極端に低下しており,それが一因となり染色体においては非常に弱いセパラーゼ活性しか検出されないと考えられた.セキュリンとサイクリンB1のいずれかがセパラーゼと結合している条件ではセパラーゼの染色体への局在は正常だったので,セパラーゼの活性抑制および染色体への局在は,セキュリンの存在下ではセキュリンが,セキュリンの非存在下ではサイクリンB1が,制御していると考えられた.つまり,セパラーゼにセキュリンあるいはサイクリンB1のいずれかが結合しているかぎり,セパラーゼは正常に染色体に集積し適切なタイミングで活性化するため,正常な染色体分離が起こるのである.
以上の解析により明らかにされたセパラーゼの制御機構により,これまでに報告されたいっけん矛盾する観察データがよく説明できるようになった.ここでは,サイクリンB1と結合できない変異セパラーゼの発現により染色体分離の異常は起こらないという報告18) と,染色体分離の異常が起こるという報告19) をとりあげて再検討する.
セパラーゼをコードする遺伝子の片方の対立遺伝子に対し細胞において直接に変異を導入することにより,サイクリンB1と結合できない変異セパラーゼを発現させたところ,染色体分離に異常はみられなかったことが報告された18).この細胞においてセキュリンをノックアウトしても染色体分離は正常であった.さらに,分裂期において長時間にわたり細胞周期を停止させたところ,ようやく染色体がバラバラに散在するという異常がみられた.このように,サイクリンB1と結合できない変異セパラーゼを発現させた細胞では染色体分離に異常が起こりにくいことから,セキュリンとサイクリンB1のほかにもセパラーゼを抑制する機構が存在するのではと考える研究者もいる.そもそも,なぜこの細胞では染色体分離に異常が起こりにくいのだろうか.
このサイクリンB1と結合できない変異セパラーゼを発現した細胞においては,内在性の野生型セパラーゼと変異セパラーゼは同等に発現している.さらに,この細胞にはセキュリンが存在し,野生型セパラーゼおよび変異セパラーゼのいずれにもセキュリンが結合している.したがって,セパラーゼの局在も正常であり活性化のタイミングも正常であるため,この細胞は染色体分離に異常を示さない(図5a).一方,この細胞においてセキュリンをノックアウトしても染色体分離に異常を示さないのはなぜだろうか.セキュリンをノックアウトすると変異セパラーゼと結合する抑制タンパク質は存在しなくなり,変異セパラーゼは正常には機能しなくなる.しかし,サイクリンB1は存在し野生型セパラーゼにはサイクリンB1が結合している.したがって,この細胞において野生型セパラーゼは正常に機能することができ,正常に染色体分離が起こる(図5b).では,この細胞を分裂期において長時間にわたり細胞周期を停止させると異常がみられるのはなぜだろうか.この状態では紡錘体チェックポイントによりAPC/Cの活性化が抑制されており,サイクリンB1が分解されることはなく,野生型セパラーゼの活性化は起こらない.しかし,変異セパラーゼには抑制タンパク質は結合していないため,筆者らが見い出したように,非常に弱いながらも活性化してコヒーシンを切断しており,その状態で長時間にわたり細胞周期を停止しつづけると姉妹染色分体のあいだの接着ははずれてしまう(図5c).セパラーゼの発現量と染色体への局在の制御を考慮することにより,これらすべての実験結果は説明される.
さて一方で,サイクリンB1と結合できない変異セパラーゼを一過的に過剰発現すると染色体分離に異常をきたし,通常と比べ平均で5分ほど早く染色体分離が開始することが報告された19).この結果から,染色体分離の5分ほどまえにセキュリンからサイクリンB1にセパラーゼの活性抑制がひきつがれる,と考える研究者もいる.状況としてこの実験は,筆者らのサイクリンB1と結合できない変異セパラーゼを生理的な条件に近い量で発現させセキュリンをノックダウンした実験とよく似ているが,筆者らは1時間以上の分裂期中期をへて染色体分離の異常を観察したのに対し,この報告では通常より5分ほど早い染色体分離の開始を観察している.この違いはどこから生じているのだろうか.
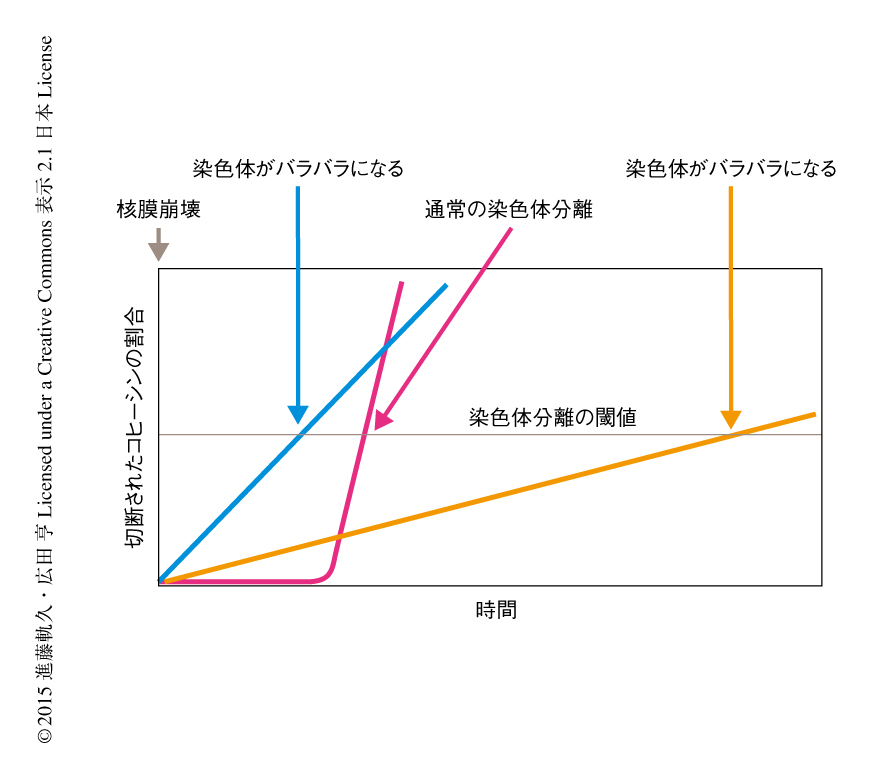
それぞれの結果を解釈するため,コヒーシンの切断の割合を経時的にプロットしたグラフを作成した(図6).染色体分離の直前に急激に活性化したセパラーゼによりコヒーシンの切断量は増加し,染色体分離の開始するときのコヒーシンの切断量が“染色体分離の閾値”と設定される.サイクリンB1と結合できない変異セパラーゼを生理的な条件に近い量で発現させセキュリンをノックダウンした実験においては,変異セパラーゼには抑制タンパク質は結合していないためつねに活性化しているが,染色体には局在できずコヒーシンの切断効率も低いためグラフの傾きは小さい.そのため,染色体分離の閾値にいたるまでの時間は長い.一方,サイクリンB1と結合できない変異セパラーゼを過剰発現させた実験においては,変異セパラーゼには抑制タンパク質は結合していないためつねに活性化しているが,染色体には局在できずコヒーシンの切断効率も低いが,変異セパラーゼの存在量に比例してコヒーシンの切断量も増加していると考えられる.変異セパラーゼの発現量を増加させてグラフの傾きを大きくすれば,通常より早いタイミングで染色体分離の閾値に到達させることができる.おそらく,この実験では,この過剰発現の効果により“5分前”の染色体分離が起こってしまったとの解釈が妥当であり,染色体分離のまえにセキュリンからサイクリンB1にセパラーゼの活性抑制がひきつがれるようなことは起こっておらず,やはり,サイクリンB1は染色体分離のまえにはセパラーゼの活性抑制に貢献していないと結論して問題ないと思われる.
セパラーゼとサイクリンB1との結合にはどのような生理学的な意義があるのだろうか.染色体分離のようすを観察すると,サイクリンB1と結合できない変異セパラーゼを発現させた細胞では,野生型のセパラーゼ発現させた細胞に比べ染色体分離ののちの紡錘体極の方向への染色体の移動の速度が遅くなっていた.さらに,抗セパラーゼ抗体を用いて免疫沈降を行ったところ,セパラーゼとサイクリンB1との結合は染色体分離ののち増加していた16).紡錘体極の方向への染色体の移動はサイクリンB1-Cdk1複合体のキナーゼ活性の低下に依存しているという報告のあること20,21),また,セパラーゼがサイクリンB1-Cdk1複合体のキナーゼ活性を抑制するというin vitroにおける解析の報告のあること22) を考慮すると,染色体分離ののちセパラーゼがサイクリンB1と結合することによりCdk1のキナーゼ活性を抑制している可能性が考えられた.そこで,染色体分離ののちの細胞抽出液においてセパラーゼと結合しているサイクリンB1-Cdk1複合体のキナーゼ活性を調べてみたところ,大幅に低下していた16).また,Cdk1の基質で染色体分離の際に脱リン酸化されることの知られている基質のリン酸化の状態を調べたところ,サイクリンB1と結合できない変異セパラーゼを発現させた細胞では高いリン酸化状態のままであった.この細胞をCdk1の阻害剤で処理すると,染色体分離ののちの紡錘体極の方向への染色体の移動の速度は正常にもどった.以上の結果から,セパラーゼは染色体分離の際に,コヒーシンの分解のみならず,サイクリンB1-Cdk1複合体のキナーゼ活性の抑制という役割も担うことにより,姉妹染色分体の接着の解離とその紡錘体極の方向への移動が順序正しく連動して起こることを保証していると考えられた.
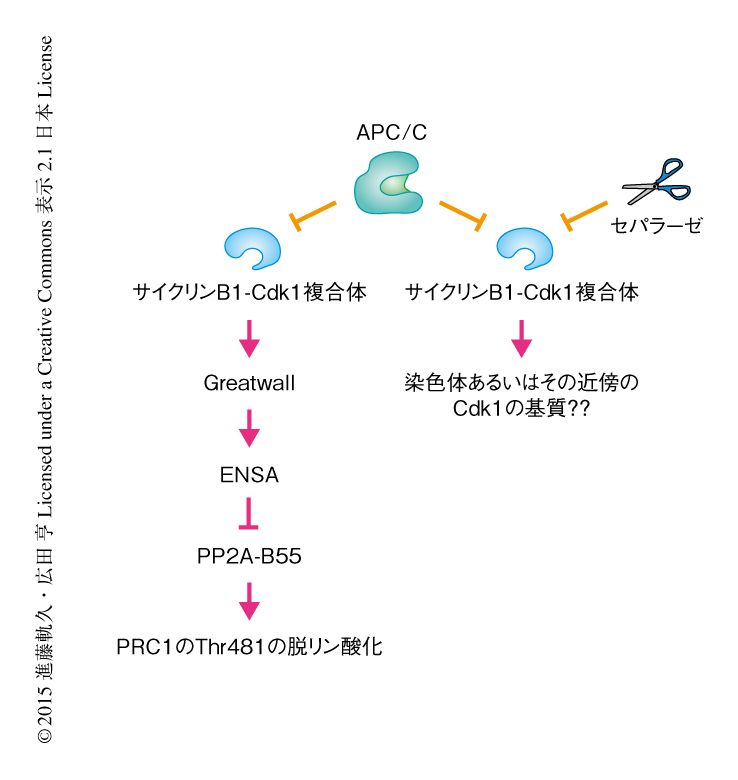
染色体分離ののちのイベントには脱リン酸化が重要なはたらきをしている.最近,哺乳類細胞において,ホスファターゼPP2A-B55を中心としたPP2A-B55/ENSA/Greatwall経路がサイクリンB1-Cdk1複合体と拮抗することにより染色体分離ののちの脱リン酸化反応を促進していることが報告された23).分裂期後期における中心紡錘体の形成に重要なPRC1のThr481の脱リン酸化がこの経路のおもな標的であることが見い出されており,分裂期後期におけるサイクリンB1-Cdk1複合体のキナーゼ活性の低下によりPRC1の脱リン酸化が促進されるとされている(図7).サイクリンB1と結合できない変異セパラーゼを発現させた細胞における紡錘体極の方向への染色体の移動の異常の背景にも,セパラーゼの変異によりサイクリンB1-Cdk1複合体のキナーゼ活性が高いままで,結果としてPRC1のThr481の脱リン酸化が遅延していることが考えられた23).しかし,染色体分離ののちの細胞抽出液の全体においてCdk1のキナーゼ活性を測定しても野生型のセパラーゼを発現させた細胞と変異セパラーゼを発現させた細胞とで大きな差はみられなかったこと,セパラーゼと結合しているサイクリンB1はその細胞抽出液におけるサイクリンB1の総量からみると20%程度であることを考えると16),PRC1のThr481の脱リン酸化への影響は限定的と思われた.セパラーゼの活性化は染色体に限局しており,その活性化したセパラーゼがサイクリンB1と結合しているという結果を考慮すると16),セパラーゼにより脱リン酸化の促進されるCdk1の基質は染色体あるいはその近傍に限局しているものと思われる(図7).染色体またはその近傍に存在するCdk1の基質の探索により,染色体分離ののちの染色体の移動の分子機構における手がかりが得られると考えられる.
ヒトの細胞における細胞分裂では,分裂期中期において赤道面に整列した染色体がいっせいに分離する瞬間が象徴的である.その生物学的な意義は今後の重要な課題であるが,こうした急峻な染色体分離を実現する背景には正のフィードバック系を基本とした制御系の存在することが予測されはじめている.それらの研究は,理論生物学や酵母をはじめとするモデル生物を用いた研究が先導している.出芽酵母における研究では,セキュリンの分解を早める正のフィードバック系の重要性が指摘された.ところが,酵母における染色体分離はその同期性や敏捷性においてヒトの細胞ほど顕著ではなく,ヒトにおける染色体分離の急峻さとセキュリンの分解速度には直接の関連がないことから,ヒトの細胞における瞬発的な染色体分離の背景はいまだ不明であるといえる.セパラーゼは,プロテアーゼとして“姉妹染色分体のあいだの接着の解除”をおえた直後にCdk1の抑制タンパク質に転じ,“紡錘体極の方向への染色体の移動の促進”をするという,染色体分離において2つの素過程を進行する酵素である.したがって,セパラーゼの活性化を瞬時に導き,それを染色体の全体に波及するしくみを明らかにしていくことにより,急峻な染色体分離の生物学的な意義が映しだされるものと期待される.
略歴:2005年 早稲田大学大学院理工学研究科 修了,同年 オーストラリアAdelaide大学 博士研究員,2008年 がん研究会がん研究所 博士研究員を経て,2013年より同 研究員.
研究テーマ:セパラーゼの活性化の機構.
抱負:ユニークでおもしろく,そして,質の高い研究をしていきたい.
広田 亨(Toru Hirota)
がん研究会がん研究所 部長.
研究室URL:http://www.jfcr.or.jp/tci/exppathol/index.html
© 2015 進藤軌久・広田 亨 Licensed under CC 表示 2.1 日本
(がん研究会がん研究所 実験病理部)
email:進藤軌久,広田 亨
領域融合レビュー, 4, e007 (2015) DOI: 10.7875/leading.author.4.e007
Norihisa Shindo & Toru Hirota: Mechanism of chromosome segregation: insights from the study on separase regulation.
要 約
遺伝情報を担う染色体は細胞分裂の過程において正確に分配されなくてはならない.そのためには,染色体の凝縮から,染色体の分離,紡錘体極の方向への染色体の移動,そして,細胞質分裂へといたる一連のイベントが順序よく適切なタイミングで起こる必要がある.とくに,染色体分離は姉妹染色分体のあいだを接着するコヒーシンの切断という不可逆的な反応をともなうため,その過程における制御の異常は染色体分配の致命的な異常にいたると考えられる.したがって,コヒーシンを切断するプロテアーゼであるセパラーゼの活性制御は,正確な染色体分離を完遂するためにきわめて重要である.このレビューでは,セパラーゼに焦点をあて,その活性を測定するバイオセンサーにより明らかにされた知見をもとに,セパラーゼの活性制御機構の諸説を再考しながら染色体分離の機構について解説する.
はじめに
細胞の遺伝情報を保持する染色体は娘細胞に正確に均等分配されなくてはならない.細胞には正確な染色体分離を保証する機構が存在しており,その機構の破綻はさまざまな疾患とも関連が深い.たとえば,がん細胞では染色体分離のエラーが頻発し,それにより生じる異数体は正常な細胞とがん細胞との大きな違いとして,100年以上もまえから知られている.さらに,減数分裂における染色体分離のエラーはダウン症をはじめとする多くの先天性疾患や流産の原因にもなりうる.正確な染色体分離を保証する機構を理解することは,これらの疾患を理解し新たな治療戦略を考えるためにも重要である.
染色体の分配を正確に完遂するためには,染色体の凝縮から,紡錘体の形成,染色体の分離,紡錘体極の方向への染色体の移動,そして,細胞質分裂にいたる分裂期の一連のイベントが正常に進行しなくてはならない(図1).これら一連のイベントは相互に連携しており,その順序やタイミングは非常に重要である.とくに,染色体分離は姉妹染色分体のあいだを接着するコヒーシンの切断という不可逆的な反応をともなうため,早すぎても遅すぎても致命的な影響をおよぼす.したがって,コヒーシンを切断するプロテアーゼであるセパラーゼの活性制御は正確な染色体分離を保証する機構の要になる.このレビューでは,まず,セパラーゼの発見と機能の解明の歴史から解説し染色体分離の機構について概観する.そのうえで,筆者らが開発したセパラーゼの活性を測定するバイオセンサーを用いた解析について紹介し,その知見をもとにセパラーゼの活性制御機構をめぐる諸説を再検討する.こうして,染色体分離を正確かつ確実に進めるためのしくみをうきぼりにしたい.
1.セパラーゼ変異体の発見からそのプロテアーゼ活性の解明まで
染色体分離の異常を示す変異体はさまざまな生物種において古くから発見されており,セパラーゼの変異体もそれらのうちのひとつとして発見された.最初のセパラーゼ変異体は,約40年前,糸状菌Aspergillus nidulansにおいて発見された.染色体分離の異常を示し分裂期において細胞周期を停止するこの変異体はbimB変異体と名づけられた1).その10年のち,こんどは分裂酵母において,染色体分離を起こさずに細胞質分裂が起こるcutとよばれる表現型を示す変異体としてcut1変異体が単離された2).さらにその2年のち,出芽酵母において染色体分離を起こさずに紡錘極体の複製が進む変異体としてESP1変異体が単離された3).そののち,これら3つの変異体それぞれの原因遺伝子が同定され,コードするタンパク質のアミノ酸配列が明らかにされるとともに,それらのC末端側の領域には高い相同性のあることがわかった4,5).この時点で,BimB,Cut1,ESP1が染色体分離の過程において重要な役割をもつことは明らかであったが,のちにセパラーゼとよばれるこのタンパク質の機能は,それから10年近くも不明のままだった.
1993年,染色体分離の開始のためにはAPC/C(anaphase promoting complex/cyclosome)の未知の基質が分解されることが必須であることが見い出された6).このAPC/Cの基質がどのようなタンパク質であるのかは明らかではなかったが(染色体に結合しているかどうかも不明だった),おそらく,姉妹染色分体のあいだを接着するタンパク質と考えられた.その数年のち,Cut1(分裂酵母のセパラーゼ)およびESP1(出芽酵母のセパラーゼ)に結合するタンパク質として,Cut2(分裂酵母のセキュリン)およびPDS1(出芽酵母のセキュリン)が同定された(図2a).Cut2とPDS1のアミノ酸配列にはほとんど相同性はなかったが,ともに分裂期中期から分裂期後期にかけAPC/Cによるユビキチン化に依存して分解され,その分解が染色体分離の開始に必須であるという興味深い特徴をもっていた7-10)(図2b).脊椎動物のセキュリンもやはり,APC/Cによるユビキチン化に依存的に分裂期中期から分裂期後期にかけて分解され,その分解が染色体分離の開始に必須であった11).このような結果から,1993年に想定されたAPC/Cの基質はセキュリンであることがわかった.そして,セキュリンが姉妹染色分体のあいだを接着する“糊”ではないかと考える,いわゆるセキュリンの“glue仮説”が提唱された.
ところが,セパラーゼに結合するセキュリンについて報告されたころ,出芽酵母においてScc1(あるいはMcd1,ほかの生物ではRad21)とよばれるタンパク質が発見された12,13).コヒーシンというタンパク質複合体のサブユニットのひとつであるScc1は,姉妹染色分体の接着に必須で,染色体分離の開始の際にAPC/Cに依存的に染色体から除去されていた(図2c).“糊”はセキュリンではなくコヒーシンだったのである.そののち,このScc1を染色体から除去するにはESP1(出芽酵母のセパラーゼ)も必要であり,さらに,PDS1(出芽酵母のセキュリン)を欠損させるとScc1がAPC/Cに非依存的に除去されるようになることが明らかにされた.したがって,APC/Cは染色体分離の際にScc1を直接的に除去しているのではなく,セキュリンの分解を介してセパラーゼが活性化し,そのセパラーゼが染色体からScc1を除去していると考えられるようになった10).そののち,過剰量のESP1を含む細胞抽出液は染色体からScc1を除去することができ,さらにこのとき,Scc1は切断されていることが明らかにされた14).この結果およびアミノ酸配列から,セパラーゼはプロテアーゼであることが予想され,2000年,ついにセパラーゼがプロテアーゼとしてScc1を切断することが示された15)(図2c).1975年のbimB変異体の発見から25年目にして,ようやくセパラーゼがプロテアーゼであり,その活性化が染色体分離の引き金になることが明らかにされたのである.
2.セパラーゼの活性化のタイミング
セパラーゼの活性化が染色体分離の引き金になることから,その活性は厳密に抑制されなくてはならないことが容易に推察される.たとえば,複製が完了した細胞の核にはクロマチン繊維とよばれる非常に長い間期染色体が存在する.このとき,DNAには複製により生じたDNAどうしのからまり(カテネーション)が存在し,このままセパラーゼがコヒーシンを切断し染色体を娘細胞に分配すると,DNAどうしが引っ張りあって切断されたり,染色体の長い腕部が反対側の娘細胞に残ってしまったりするかもしれない.このようなことをふせぐため,細胞においては染色体分離までにさまざまな前準備が行われている.まず,分裂期になると染色体は凝縮し,短い棒状の構造へと変化する(図3).このとき,細胞の種類にもよるが,長さが1万分の1になるものもある.そして,DNAのカテネーションは解消され,姉妹染色分体のあいだを接着していたコヒーシンのほとんどはセパラーゼではなくWaplとよばれるタンパク質により除去され,姉妹染色分体が解離しない程度の最小限のコヒーシンがShugoshinとよばれるタンパク質により保護され,おもにセントロメア領域に残る(図3).さらに,両極から伸びてきた微小管によりそれぞれの姉妹染色分体に一対だけ存在する動原体が捕捉され両側から引っ張られた状態になる(図3).すべての染色体がこの状態になるまでセパラーゼは活性化してはならない.
染色体が微小管により両側から引っ張られた状態になるまでを監視する機構を紡錘体チェックポイントという.紡錘体チェックポイントは微小管に捕捉されていない動原体を検出し,APC/CがセキュリンやサイクリンB1をユビキチン化するのを阻害する.すべての動原体が微小管に補足されると紡錘体チェックポイントは解除され,セキュリンやサイクリンB1がAPC/Cによるユビキチン化に依存して分解されセパラーゼは活性化する(図3).活性化したセパラーゼがコヒーシンのScc1サブユニットを切断すると,姉妹染色分体は微小管に引っ張られて両極の方向へと分配されていく.そののち,染色体分離が進行していくとともに紡錘体に大規模な形態変化が起こり,分離したのちの姉妹染色分体のあいだに微小管が逆平行に並んだ中央紡錘体とよばれる構造体が形成される.そして,中央紡錘体が形成されている部分で細胞膜がくびれはじめ細胞質分裂が起こる(図3).セパラーゼの活性化が細胞質分裂よりも遅れると,さきに述べた染色体分離をせずに細胞質分裂がはじまるcut表現型を示すことになるので,セパラーゼは紡錘体チェックポイントの解除から細胞質分裂が起こるまでのあいだいずれかのタイミングで活性化しなくてはならない.
3.セパラーゼは染色体分離の直前に急激に活性化する
セパラーゼの活性化はどのように規定されるのだろうか.セパラーゼの活性化はその抑制タンパク質であるセキュリンの量の低下により誘導されると考えられるが,分裂期におけるセキュリンの量を経時的に定量することにより,セキュリンは染色体分離の開始より10分以上もまえに分解しはじめ,緩徐にその量が低下し,そして,セキュリンが完全に消失するよりもまえに染色体分離の起こることが示されていた.しかも,セキュリンの分解開始から染色体分離までの時間も,染色体分離の際の残存するセキュリンの量も,細胞のあいだで大きなばらつきがあったため,セパラーゼの活性化のタイミングを読み取るには精度が不十分であった.また,この時期において細胞周期を同調するのは非常にむずかしく,染色体分離とセパラーゼの活性化のタイミングを生化学的に調べるのは困難であった.こうした技術的な限界から,染色体分離そのものをセパラーゼの活性化の指標とする状態が長くつづいた.
そこで筆者らは,セパラーゼの活性を可視化したいと考えそのバイオセンサーを作製した16)(新着論文レビュー でも掲載).このバイオセンサーの原理は,セパラーゼの基質の両端に2種類の異なる蛍光タンパク質をつなぎ,細胞において特定の場所に局在させ,片方の蛍光タンパク質の消失によりセパラーゼの活性を測定する,という単純なものである(図4a).細胞における局在を規定する配列として,ヒストンH2Bを使用すると染色体全体における,CENP-Bを用いるとセントロメアにおける,セパラーゼの活性を特異的に測定することができる.このバイオセンサーを用いた解析の結果,セパラーゼは染色体分離の直前に急激に活性化することが判明した(図4b).つまり,紡錘体チェックポイントが解除されると,APC/Cによるユビキチン化に依存的にセキュリンやサイクリンB1が分解されはじめるが,セパラーゼの活性の抑制はしばらくつづいており,染色体分離の直前になりセパラーゼは急激に活性化した.
4.過剰に存在するセキュリンが染色体分離までセパラーゼの活性を抑制しつづける
染色体分離の直前にセパラーゼが急激に活性化するという結果は,染色体分離が高い同期性をもって開始するという観察事実をよく説明していた.しかし,セパラーゼが活性化する時期とその抑制タンパク質であるセキュリンやサイクリンB1の分解開始の時期にずれの存在することも明らかにされた.セパラーゼの活性がその抑制タンパク質が分解されているあいだも強く抑制されつづける機構はどのようなものだろうか.分裂期の細胞抽出液における抗セパラーゼ抗体を用いた免疫沈降実験により,分裂期の細胞にはセパラーゼに対し過剰量のセキュリンの存在することが示唆された.分裂期中期から分裂期後期にかけての同調培養の系を用いて同様の免疫沈降を行ったところ,セパラーゼとは結合していないセキュリンは分裂期後期にむかいゆるやかに分解されていったが,セパラーゼと結合しているセキュリンは分裂期後期の開始まで分解されずに安定だった.同様の結果は,ゲルろ過クロマトグラフィーによる細胞抽出液の分画によっても確認された.したがって,過剰量のセキュリンがAPC/Cの活性に対する“緩衝剤”の役割をはたし,安定してセパラーゼに結合しつづける一部のセキュリンによりセパラーゼの活性の抑制が維持されていることがわかった.
この結果はセキュリンの重要性を示したが,不思議なことに,哺乳類の細胞はセキュリンがなくても問題なく生存できる.それは,哺乳類の細胞にはセキュリンのほかもうひとつのセパラーゼの抑制タンパク質としてサイクリンB1が存在するからである.
5.サイクリンB1よるセパラーゼ活性の抑制
もうひとつのセパラーゼの抑制タンパク質であるサイクリンB1は,詳細な生化学的な解析により,ヒトのセパラーゼにおいてSer1126(マウスでは,Ser1121)のリン酸化に依存して結合し,その活性を抑制することが報告された17).しかし,サイクリンB1によるセパラーゼの活性の抑制が重要になるのは,微小管の重合を阻害するノコダゾールにて処理することにより分裂期において長時間にわたり細胞周期を停止した場合など限定的な条件にかぎるという報告もあり,その生理学的な意義についてはよくわかっていなかった.
Ser1126をAlaに置換することによりサイクリンB1と結合できないようにした変異セパラーゼを用いたこれまでの解析には,セパラーゼの活性を染色体分離の有無により評価していたという点,そして,変異セパラーゼを過剰発現させることによりその効果を解析していたという点の2つの問題点があった.筆者らは,セパラーゼの活性をバイオセンサーにより評価し,さらに,変異セパラーゼについても過剰発現ではなくゲノムDNAを導入するBACトランスジーン法を用いて生理的な条件に近い発現量において解析することにした.
内在性の野生型セパラーゼをRNAi法によりノックダウンしたうえで,サイクリンB1と結合できない変異セパラーゼを発現させた細胞のセパラーゼ活性をバイオセンサーにより測定したところ,同様に野生型のセパラーゼを発現させた細胞と同じ上昇を示し,染色体分離の起こるまえの分裂期中期における時期尚早の活性化はみられなかった.したがって,染色体分離の起こるまえのサイクリンB1によるセパラーゼの活性の抑制は,セキュリンが存在しているかぎり重要ではないといえた.さらに,サイクリンB1と結合できない変異セパラーゼを発現させた細胞においてセキュリンをノックダウンすると,セパラーゼと結合してその活性を抑制するタンパク質は存在しなくなるが,このような状況では正常な染色体分離は阻害され,1時間以上もの長い分裂期中期をへて染色体がバラバラに散在するという現象がみられた.この細胞におけるセパラーゼの活性をバイオセンサーにより測定したところ,核膜崩壊の直後から染色体において弱い活性が検出されはじめ,そのまま上昇することなく一定のままであり,その活性は正常な染色体分離の際の約2%しかなかった.染色体におけるセパラーゼの量を調べたところ,セキュリンもサイクリンB1も結合していないセパラーゼは染色体への局在が極端に低下しており,それが一因となり染色体においては非常に弱いセパラーゼ活性しか検出されないと考えられた.セキュリンとサイクリンB1のいずれかがセパラーゼと結合している条件ではセパラーゼの染色体への局在は正常だったので,セパラーゼの活性抑制および染色体への局在は,セキュリンの存在下ではセキュリンが,セキュリンの非存在下ではサイクリンB1が,制御していると考えられた.つまり,セパラーゼにセキュリンあるいはサイクリンB1のいずれかが結合しているかぎり,セパラーゼは正常に染色体に集積し適切なタイミングで活性化するため,正常な染色体分離が起こるのである.
6.セパラーゼの制御機構をめぐる諸説の再検討
以上の解析により明らかにされたセパラーゼの制御機構により,これまでに報告されたいっけん矛盾する観察データがよく説明できるようになった.ここでは,サイクリンB1と結合できない変異セパラーゼの発現により染色体分離の異常は起こらないという報告18) と,染色体分離の異常が起こるという報告19) をとりあげて再検討する.
セパラーゼをコードする遺伝子の片方の対立遺伝子に対し細胞において直接に変異を導入することにより,サイクリンB1と結合できない変異セパラーゼを発現させたところ,染色体分離に異常はみられなかったことが報告された18).この細胞においてセキュリンをノックアウトしても染色体分離は正常であった.さらに,分裂期において長時間にわたり細胞周期を停止させたところ,ようやく染色体がバラバラに散在するという異常がみられた.このように,サイクリンB1と結合できない変異セパラーゼを発現させた細胞では染色体分離に異常が起こりにくいことから,セキュリンとサイクリンB1のほかにもセパラーゼを抑制する機構が存在するのではと考える研究者もいる.そもそも,なぜこの細胞では染色体分離に異常が起こりにくいのだろうか.
このサイクリンB1と結合できない変異セパラーゼを発現した細胞においては,内在性の野生型セパラーゼと変異セパラーゼは同等に発現している.さらに,この細胞にはセキュリンが存在し,野生型セパラーゼおよび変異セパラーゼのいずれにもセキュリンが結合している.したがって,セパラーゼの局在も正常であり活性化のタイミングも正常であるため,この細胞は染色体分離に異常を示さない(図5a).一方,この細胞においてセキュリンをノックアウトしても染色体分離に異常を示さないのはなぜだろうか.セキュリンをノックアウトすると変異セパラーゼと結合する抑制タンパク質は存在しなくなり,変異セパラーゼは正常には機能しなくなる.しかし,サイクリンB1は存在し野生型セパラーゼにはサイクリンB1が結合している.したがって,この細胞において野生型セパラーゼは正常に機能することができ,正常に染色体分離が起こる(図5b).では,この細胞を分裂期において長時間にわたり細胞周期を停止させると異常がみられるのはなぜだろうか.この状態では紡錘体チェックポイントによりAPC/Cの活性化が抑制されており,サイクリンB1が分解されることはなく,野生型セパラーゼの活性化は起こらない.しかし,変異セパラーゼには抑制タンパク質は結合していないため,筆者らが見い出したように,非常に弱いながらも活性化してコヒーシンを切断しており,その状態で長時間にわたり細胞周期を停止しつづけると姉妹染色分体のあいだの接着ははずれてしまう(図5c).セパラーゼの発現量と染色体への局在の制御を考慮することにより,これらすべての実験結果は説明される.
さて一方で,サイクリンB1と結合できない変異セパラーゼを一過的に過剰発現すると染色体分離に異常をきたし,通常と比べ平均で5分ほど早く染色体分離が開始することが報告された19).この結果から,染色体分離の5分ほどまえにセキュリンからサイクリンB1にセパラーゼの活性抑制がひきつがれる,と考える研究者もいる.状況としてこの実験は,筆者らのサイクリンB1と結合できない変異セパラーゼを生理的な条件に近い量で発現させセキュリンをノックダウンした実験とよく似ているが,筆者らは1時間以上の分裂期中期をへて染色体分離の異常を観察したのに対し,この報告では通常より5分ほど早い染色体分離の開始を観察している.この違いはどこから生じているのだろうか.
それぞれの結果を解釈するため,コヒーシンの切断の割合を経時的にプロットしたグラフを作成した(図6).染色体分離の直前に急激に活性化したセパラーゼによりコヒーシンの切断量は増加し,染色体分離の開始するときのコヒーシンの切断量が“染色体分離の閾値”と設定される.サイクリンB1と結合できない変異セパラーゼを生理的な条件に近い量で発現させセキュリンをノックダウンした実験においては,変異セパラーゼには抑制タンパク質は結合していないためつねに活性化しているが,染色体には局在できずコヒーシンの切断効率も低いためグラフの傾きは小さい.そのため,染色体分離の閾値にいたるまでの時間は長い.一方,サイクリンB1と結合できない変異セパラーゼを過剰発現させた実験においては,変異セパラーゼには抑制タンパク質は結合していないためつねに活性化しているが,染色体には局在できずコヒーシンの切断効率も低いが,変異セパラーゼの存在量に比例してコヒーシンの切断量も増加していると考えられる.変異セパラーゼの発現量を増加させてグラフの傾きを大きくすれば,通常より早いタイミングで染色体分離の閾値に到達させることができる.おそらく,この実験では,この過剰発現の効果により“5分前”の染色体分離が起こってしまったとの解釈が妥当であり,染色体分離のまえにセキュリンからサイクリンB1にセパラーゼの活性抑制がひきつがれるようなことは起こっておらず,やはり,サイクリンB1は染色体分離のまえにはセパラーゼの活性抑制に貢献していないと結論して問題ないと思われる.
7.染色体分離ののちにおけるセパラーゼとサイクリンB1との結合の重要性
セパラーゼとサイクリンB1との結合にはどのような生理学的な意義があるのだろうか.染色体分離のようすを観察すると,サイクリンB1と結合できない変異セパラーゼを発現させた細胞では,野生型のセパラーゼ発現させた細胞に比べ染色体分離ののちの紡錘体極の方向への染色体の移動の速度が遅くなっていた.さらに,抗セパラーゼ抗体を用いて免疫沈降を行ったところ,セパラーゼとサイクリンB1との結合は染色体分離ののち増加していた16).紡錘体極の方向への染色体の移動はサイクリンB1-Cdk1複合体のキナーゼ活性の低下に依存しているという報告のあること20,21),また,セパラーゼがサイクリンB1-Cdk1複合体のキナーゼ活性を抑制するというin vitroにおける解析の報告のあること22) を考慮すると,染色体分離ののちセパラーゼがサイクリンB1と結合することによりCdk1のキナーゼ活性を抑制している可能性が考えられた.そこで,染色体分離ののちの細胞抽出液においてセパラーゼと結合しているサイクリンB1-Cdk1複合体のキナーゼ活性を調べてみたところ,大幅に低下していた16).また,Cdk1の基質で染色体分離の際に脱リン酸化されることの知られている基質のリン酸化の状態を調べたところ,サイクリンB1と結合できない変異セパラーゼを発現させた細胞では高いリン酸化状態のままであった.この細胞をCdk1の阻害剤で処理すると,染色体分離ののちの紡錘体極の方向への染色体の移動の速度は正常にもどった.以上の結果から,セパラーゼは染色体分離の際に,コヒーシンの分解のみならず,サイクリンB1-Cdk1複合体のキナーゼ活性の抑制という役割も担うことにより,姉妹染色分体の接着の解離とその紡錘体極の方向への移動が順序正しく連動して起こることを保証していると考えられた.
染色体分離ののちのイベントには脱リン酸化が重要なはたらきをしている.最近,哺乳類細胞において,ホスファターゼPP2A-B55を中心としたPP2A-B55/ENSA/Greatwall経路がサイクリンB1-Cdk1複合体と拮抗することにより染色体分離ののちの脱リン酸化反応を促進していることが報告された23).分裂期後期における中心紡錘体の形成に重要なPRC1のThr481の脱リン酸化がこの経路のおもな標的であることが見い出されており,分裂期後期におけるサイクリンB1-Cdk1複合体のキナーゼ活性の低下によりPRC1の脱リン酸化が促進されるとされている(図7).サイクリンB1と結合できない変異セパラーゼを発現させた細胞における紡錘体極の方向への染色体の移動の異常の背景にも,セパラーゼの変異によりサイクリンB1-Cdk1複合体のキナーゼ活性が高いままで,結果としてPRC1のThr481の脱リン酸化が遅延していることが考えられた23).しかし,染色体分離ののちの細胞抽出液の全体においてCdk1のキナーゼ活性を測定しても野生型のセパラーゼを発現させた細胞と変異セパラーゼを発現させた細胞とで大きな差はみられなかったこと,セパラーゼと結合しているサイクリンB1はその細胞抽出液におけるサイクリンB1の総量からみると20%程度であることを考えると16),PRC1のThr481の脱リン酸化への影響は限定的と思われた.セパラーゼの活性化は染色体に限局しており,その活性化したセパラーゼがサイクリンB1と結合しているという結果を考慮すると16),セパラーゼにより脱リン酸化の促進されるCdk1の基質は染色体あるいはその近傍に限局しているものと思われる(図7).染色体またはその近傍に存在するCdk1の基質の探索により,染色体分離ののちの染色体の移動の分子機構における手がかりが得られると考えられる.
おわりに
ヒトの細胞における細胞分裂では,分裂期中期において赤道面に整列した染色体がいっせいに分離する瞬間が象徴的である.その生物学的な意義は今後の重要な課題であるが,こうした急峻な染色体分離を実現する背景には正のフィードバック系を基本とした制御系の存在することが予測されはじめている.それらの研究は,理論生物学や酵母をはじめとするモデル生物を用いた研究が先導している.出芽酵母における研究では,セキュリンの分解を早める正のフィードバック系の重要性が指摘された.ところが,酵母における染色体分離はその同期性や敏捷性においてヒトの細胞ほど顕著ではなく,ヒトにおける染色体分離の急峻さとセキュリンの分解速度には直接の関連がないことから,ヒトの細胞における瞬発的な染色体分離の背景はいまだ不明であるといえる.セパラーゼは,プロテアーゼとして“姉妹染色分体のあいだの接着の解除”をおえた直後にCdk1の抑制タンパク質に転じ,“紡錘体極の方向への染色体の移動の促進”をするという,染色体分離において2つの素過程を進行する酵素である.したがって,セパラーゼの活性化を瞬時に導き,それを染色体の全体に波及するしくみを明らかにしていくことにより,急峻な染色体分離の生物学的な意義が映しだされるものと期待される.
文 献
- Morris, N. R.: Mitotic mutants of Aspergillus nidulans. Genet. Res., 26, 237-254 (1975)[PubMed]
- Hirano, T., Funahashi, S., Uemura, T. et al.: Isolation and characterization of Schizosaccharomyces pombe cut mutants that block nuclear division but not cytokinesis. EMBO J., 5, 2973-2979 (1986)[PubMed]
- Baum, P., Yip, C., Goetsch, L. et al.: A yeast gene essential for regulation of spindle pole duplication. Mol. Cell. Biol., 8, 5386-5397 (1988)[PubMed]
- Uzawa, S., Samejima, I., Hirano, T. et al.: The fission yeast cut1+ gene regulates spindle pole body duplication and has homology to the budding yeast ESP1 gene. Cell, 62, 913-925 (1990)[PubMed]
- McGrew, J. T., Goetsch, L., Byers, B. et al.: Requirement for ESP1 in the nuclear division of Saccharomyces cerevisiae. Mol Biol Cell 3, 1443-1454 (1992)[PubMed]
- Holloway, S. L., Glotzer, M., King, R. W. et al.: Anaphase is initiated by proteolysis rather than by the inactivation of maturation-promoting factor. Cell, 73, 1393-1402 (1993)[PubMed]
- Funabiki, H., Kumada, K. & Yanagida, M.: Fission yeast Cut1 and Cut2 are essential for sister chromatid separation, concentrate along the metaphase spindle and form large complexes. EMBO J., 15, 6617-6628 (1996)[PubMed]
- Funabiki, H., Yamano, H., Kumada, K. et al.: Cut2 proteolysis required for sister-chromatid separation in fission yeast. Nature, 381, 438-441 (1996)[PubMed]
- Cohen-Fix, O., Peters, J. M., Kirschner, M. W. et al.: Anaphase initiation in Saccharomyces cerevisiae is controlled by the APC-dependent degradation of the anaphase inhibitor Pds1p. Genes Dev., 10, 3081-3093 (1996)[PubMed]
- Ciosk, R., Zachariae, W., Michaelis, C. et al.: An ESP1/PDS1 complex regulates loss of sister chromatid cohesion at the metaphase to anaphase transition in yeast. Cell, 93, 1067-1076 (1998)[PubMed]
- Zou, H., McGarry, T. J., Bernal, T. et al.: Identification of a vertebrate sister-chromatid separation inhibitor involved in transformation and tumorigenesis. Science, 285, 418-422 (1999)[PubMed]
- Michaelis, C., Ciosk, R. & Nasmyth, K.: Cohesins: chromosomal proteins that prevent premature separation of sister chromatids. Cell, 91, 35-45 (1997)[PubMed]
- Guacci, V., Koshland, D. & Strunnikov, A.: A direct link between sister chromatid cohesion and chromosome condensation revealed through the analysis of MCD1 in S. cerevisiae. Cell, 91, 47-57 (1997)[PubMed]
- Uhlmann, F., Lottspeich, F. & Nasmyth, K.: Sister-chromatid separation at anaphase onset is promoted by cleavage of the cohesin subunit Scc1. ature, 400, 37-42 (1999)[PubMed]
- Uhlmann, F., Wernic, D., Poupart, M. A. et al.: Cleavage of cohesin by the CD clan protease separin triggers anaphase in yeast. Cell, 103, 375-386 (2000)[PubMed]
- Shindo, N., Kumada, K. & Hirota, T.: Separase sensor reveals dual roles for separase coordinating cohesin cleavage and cdk1 inhibition. Dev. Cell, 23, 112-123 (2012)[PubMed] [新着論文レビュー]
- Stemmann, O., Zou, H., Gerber, S. A. et al.: Dual inhibition of sister chromatid separation at metaphase. Cell, 107, 715-726 (2001)[PubMed]
- Huang, X., Hatcher, R., York, J. P. et al.: Securin and separase phosphorylation act redundantly to maintain sister chromatid cohesion in mammalian cells. Mol. Biol. Cell, 16, 4725-4732 (2005)[PubMed]
- Holland, A. J. & Taylor, S. S.: Cyclin-B1-mediated inhibition of excess separase is required for timely chromosome disjunction. J. Cell Sci., 119, 3325-3336 (2006)[PubMed]
- Wolf, F., Wandke, C., Isenberg, N. et al.: Dose-dependent effects of stable cyclin B1 on progression through mitosis in human cells. EMBO J., 25, 2802-2813 (2006)[PubMed]
- Oliveira, R. A., Hamilton, R. S., Pauli, A. et al.: Cohesin cleavage and Cdk inhibition trigger formation of daughter nuclei. Nat. Cell Biol., 12, 185-192 (2010)[PubMed]
- Gorr, I. H., Boos, D. & Stemmann, O.: Mutual inhibition of separase and Cdk1 by two-step complex formation. Mol. Cell, 19, 135-141 (2005)[PubMed]
- Cundell, M. J., Bastos, R. N., Zhang, T. et al.: The BEG (PP2A-B55/ENSA/Greatwall) pathway ensures cytokinesis follows chromosome separation. Mol. Cell, 52, 393-405 (2013)[PubMed]
著者プロフィール
略歴:2005年 早稲田大学大学院理工学研究科 修了,同年 オーストラリアAdelaide大学 博士研究員,2008年 がん研究会がん研究所 博士研究員を経て,2013年より同 研究員.
研究テーマ:セパラーゼの活性化の機構.
抱負:ユニークでおもしろく,そして,質の高い研究をしていきたい.
広田 亨(Toru Hirota)
がん研究会がん研究所 部長.
研究室URL:http://www.jfcr.or.jp/tci/exppathol/index.html
© 2015 進藤軌久・広田 亨 Licensed under CC 表示 2.1 日本