交感神経系による免疫細胞の動態の制御
2015/08/19
鈴木 一博
(大阪大学免疫学フロンティア研究センター 免疫応答ダイナミクス研究室)
email:鈴木一博
領域融合レビュー, 4, e011 (2015) DOI: 10.7875/leading.author.4.e011
Kazuhiro Suzuki: Control of immune cell dynamics by the sympathetic nervous system.

神経系が免疫系に対し制御作用をもつことは古くから指摘されてきたが,その分子機構は長らく不明であった.近年,神経系からのインプットが免疫系からのアウトプットに変換される分子機構が明らかにされるにつれ,神経系による免疫系の制御の研究が注目されはじめた.最近の研究から,交感神経系が好中球あるいはリンパ球の動態をそれぞれ異なる分子機構により制御していることが明らかにされた.このレビューにおいては,交感神経系による免疫細胞の動態の制御機構を中心に,神経系による免疫系の制御に関する最新の知見について解説する.
昨今“免疫力”という言葉をよく耳にする.そのとき,多くの場合において語られるのがストレスとの関係であり,“ストレスにより免疫力が低下する”というのが巷間の定説になっている.たしかに,ストレスが免疫の機能に影響をおよぼすことは文献的にも報告されている1).しかし,このレビューの読者の多くには,信憑性をもって受け入れられないのではないかと想像する.それは,ストレスがくわわると免疫系の活動性を表わすなんらかの指標が悪化するのは事実だとしても,ストレスが免疫系に作用する分子機構について細胞レベルあるいは分子レベルでの裏づけが十分になされていないためである.
精神的あるいは肉体的なストレスや情動によりもたらされる脳の活動性の変化は全身の臓器に対しさまざまな影響をおよぼす.その主要な伝達経路のひとつが交感神経系と副交感神経系からなる自律神経系である.交感神経系と副交感神経系はいずれも,脊髄から神経節に達する節前線維と,神経節において節前線維の終末とシナプスを形成し標的となる臓器に投射する節後線維から構成される.原則的に,交感神経系の節後線維の終末からはノルアドレナリンが,副交感神経系の節後線維の終末からはアセチルコリンが放出され,その受容体を発現する細胞に作用する.しかし,のちに述べるように,リンパ器官にはノルアドレナリンを産生するアドレナリン作動性神経は投射しているが,アセチルコリンを産生するコリン作動性神経はほとんど投射していないという解剖学的な特徴がある2).したがって,交感神経系は免疫系とより直接的なインターフェイスを形成していると考えられる.今日,神経系による免疫系の制御における細胞基盤あるいは分子基盤の解明をめざす研究者が交感神経系に注目するのはこのためである.このレビューにおいては,研究の歴史的な背景をふまえながら,交感神経系による免疫系の制御機構を,おもに免疫細胞の動態の制御という切り口から解説する.
神経系による免疫系の制御の研究の歴史は,文献においては20世紀初頭にさかのぼる3).アドレナリンが単離され結晶化されたのは1901年のことであるが4,5),そののちまもなく,ヒトにアドレナリンを投与すると末梢の血液における白血球の数が変動することが報告され,アドレナリン受容体を介する刺激が免疫細胞の動態に影響をおよぼすことが示唆された6).神経系による免疫系の制御機構の存在をはじめて示したとされる研究は,じつはわが国から報告されている.1919年に発表されたその論文には,事業の失敗や家庭内の不和など社会心理的なストレスをかかえる結核患者において白血球の貪食能が低下することが記されていた7).しかし,この研究がかえりみられるようになったのは,1960年代に入り精神的なストレスが自己免疫疾患の症状に影響をおよぼすことが報告され,“psychoimmunology”(精神免疫学)の概念が提唱されてからのことであった8).1970年代には,さらに精神状態と免疫機能とを結びつける神経科学的な側面も加味して“psychoneuroimmunology”(精神神経免疫学)が概念化された9,10).しかし,分子生物学が隆盛をきわめていた時代である.多くの研究者が生命現象を分子のレベルで解き明かそうとするなか,現象の記述にとどまるこれらの学問は当時の生命科学の潮流にのることはできなかった.
しかし,1980年代に入ると,胸腺や骨髄といった1次リンパ器官およびリンパ節や脾臓といった2次リンパ器官のいずれにもアドレナリン作動性神経が投射されていることが形態学的な研究から明らかになり,交感神経系による免疫系の制御における解剖学的な根拠が示された11).とくに2次リンパ器官においては,アドレナリン作動性神経はT細胞の存在する領域を中心として分布しB細胞の集まるリンパ濾胞の内部には入り込まないという投射パターンをとることがわかった.興味深いことに,リンパ器官においてコリン作動性神経は検出されない2).さらに,同じ時代の薬理学的な研究から,ノルアドレナリンの受容体が免疫細胞の細胞膜に発現していることが示された12).アドレナリン受容体はα1,α2,β1,β2,β3の5つのサブタイプに分類されるが,免疫細胞にはβ2アドレナリン受容体がもっとも豊富に発現していることも明らかにされた.これらの知見は,交感神経系からの入力が免疫系に直接的に作用することを示唆するものであり,神経系による免疫系の制御の研究が息をふきかえす契機になった.
神経系による免疫系の制御における確固とした分子基盤が明らかにされたのは,21世紀に入ってからのことである.迷走神経は脳幹に起始して胸腹部の内臓に分布し,その知覚と機能制御をつかさどる重要な神経である.かねてから,迷走神経を刺激することによりマウスにエンドトキシンを投与した際の炎症反応が抑制されることが知られていたが13),それが脾臓のマクロファージに発現するニコチン性アセチルコリン受容体α7サブユニットに媒介されることがつきとめられた14).ニコチン性アセチルコリン受容体α7サブユニットは神経細胞においてはイオンチャネル型受容体のサブユニットとして活動電位の生成に寄与するが,マクロファージにおいては種々のシグナル伝達経路を介してNF-κBの核への移行をさまたげTNFαをはじめとする炎症性サイトカインの産生を抑制する15,16).
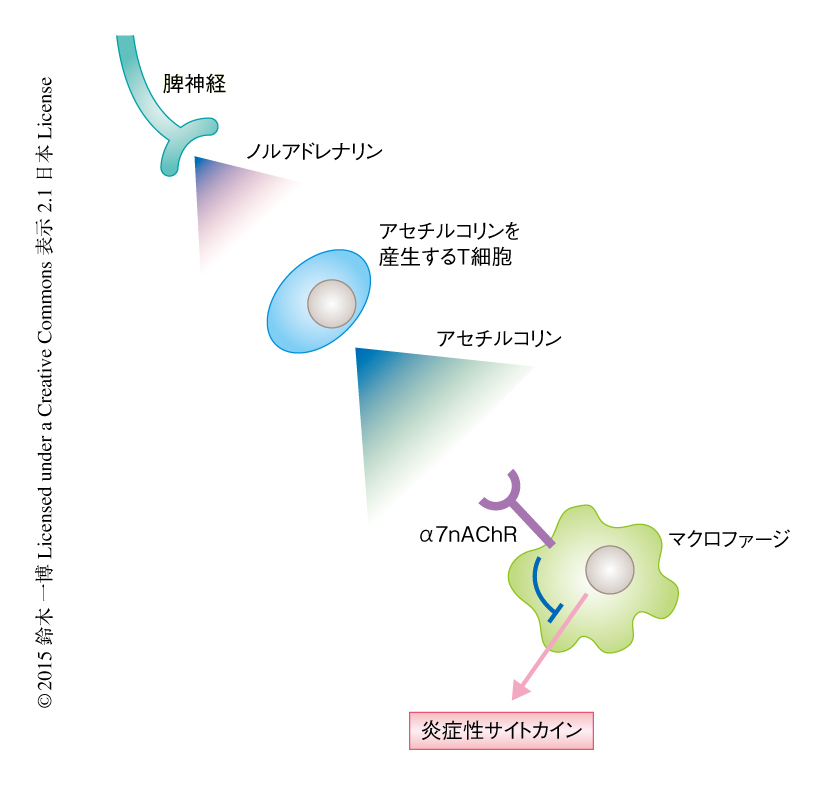
迷走神経の遠心路は原則的にコリン作動性神経により構成されるが,腹腔神経節から脾臓に投射する迷走神経の節後線維(脾神経)は例外的にアドレナリン作動性神経である.では,脾臓においてアセチルコリンはどこから供給されるのだろうか.興味深いことに,CD4陽性T細胞の一部がノルアドレナリンの刺激をうけてアセチルコリンを産生し,脾臓におけるアセチルコリンの供給源になっていることが判明した17).これらの発見から,迷走神経が炎症反応を負に制御する分子機構が明らかにされ,神経系による免疫系の制御における細胞基盤および分子基盤がはじめて示された(図1).さらに,脳幹へとむかう迷走神経の求心路(感覚神経)にToll様受容体やサイトカイン受容体が発現し,これらを刺激することにより活動電位が増強されるという知見を総合し,迷走神経の求心路と遠心路を反射弓として過剰な炎症反応の起こるのをふせぎ生体を保護するしくみが提唱され“inflammatory reflex”(炎症反射)と名づけられた15,16).
最近,神経系による炎症制御における新たな分子基盤が解明された.多発性硬化症のマウスモデルである実験的自己免疫性脳脊髄炎において,痛覚刺激あるいは抗重力筋(ヒラメ筋)からの感覚刺激が特定の脊髄分節における炎症細胞の侵入を促進することが明らかにされた18,19).その分子機構として,感覚神経からの入力が炎症部位において局所的にアドレナリン作動性神経を興奮させ,そこから放出されるノルアドレナリンがβ1アドレナリン受容体を介して血管内皮細胞からのケモカインの産生を誘導することが示された.この機序は,炎症部位において免疫細胞の侵入する門戸を形成する反射として“gateway reflex”とよばれる20).
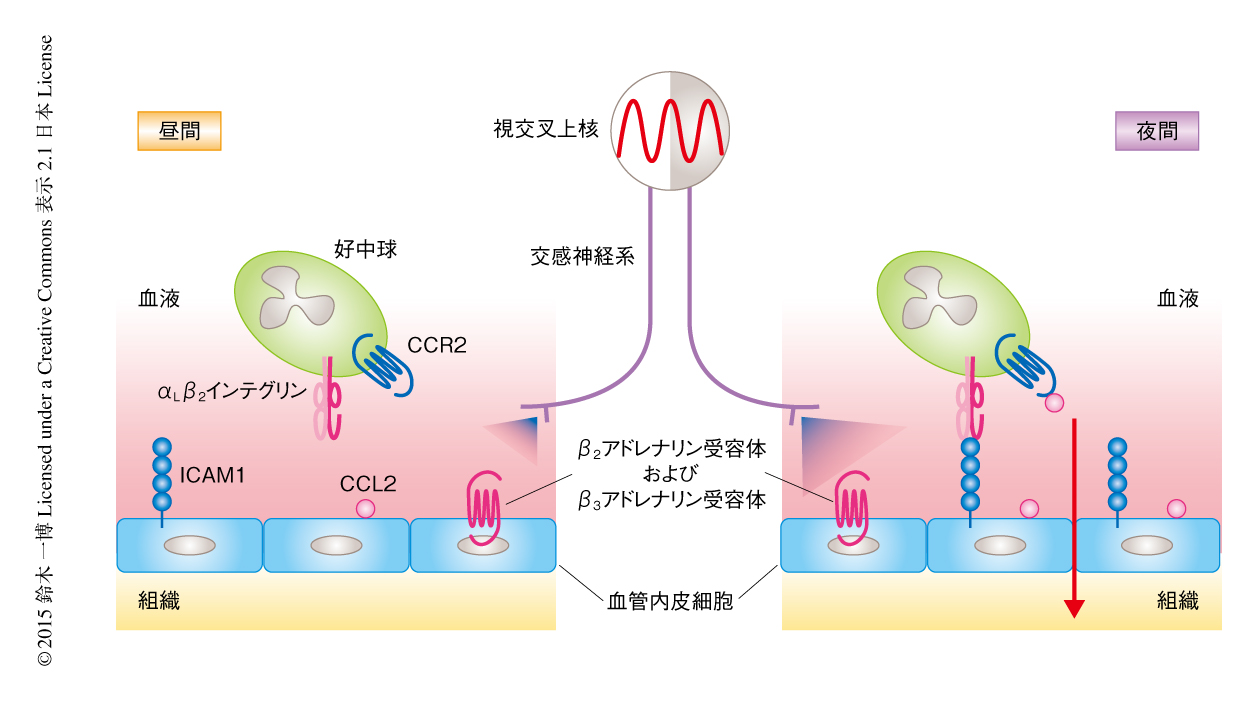
さきに述べたように,アドレナリン受容体を介する刺激が免疫細胞の動態に影響をおよぼすことは100年以上もまえから知られていたが6),その分子機構は不明であった.このような状況において,2012年,マウスでは昼間に比べ夜間に皮膚や筋肉などの末梢組織に好中球が集積するのと同期して,血液における好中球の数が減少することが報告された21,22).交感神経系の活動性は1日のうちで身体の活動性の高い時間帯に上昇し,身体の活動性の低い時間帯に低下するという概日リズムを示す.したがって,マウスのような夜行性の動物では夜間に交感神経系の活動性が高まる.好中球の動態が概日リズムを示す分子機構として,交感神経系からの入力がβ2アドレナリン受容体およびβ3アドレナリン受容体を介して組織の血管内皮細胞におけるケモカインおよび細胞接着因子の発現を誘導することにより,血液から組織への好中球の移行を促進することが明らかにされた(図2).つまり,好中球の動態の概日リズムは,好中球への直接的な作用ではなく,交感神経系が好中球をとりまく微小環境を変化させることにより形成される.
しかし,教科書的にも,急激にストレスがくわわった場合やノルアドレナリンを単回投与した場合には末梢の血液における好中球の数は増加することが知られており23),さきの知見といっけん矛盾する.急速かつ強力なノルアドレナリンの入力は,交感神経系の活動性の概日リズムにともないノルアドレナリンの入力が緩徐に変化する場合とは異なる分子機構により,好中球の動態に作用するのかもしれない.
ノルアドレナリンを投与すると,好中球の場合とは対照的に,末梢の血液におけるリンパ球の数は減少する23).筆者らは,リンパ球にβ2アドレナリン受容体が発現していることに着目し,β2アドレナリン受容体の選択的な刺激薬をマウスに投与したところ,血液のみならずリンパ液においてもリンパ球の数が急激に減少することを見い出した24).β2アドレナリン受容体ノックアウトマウスの骨髄を放射線を照射した野生型のマウスに移入して骨髄キメラマウスを作製し,血液細胞にβ2アドレナリン受容体が発現していない状況をつくりだしたところ,β2アドレナリン受容体刺激薬の作用がほとんど消失したことから,β2アドレナリン受容体刺激薬の投与による血液およびリンパ液におけるリンパ球の減少は,おもに血液細胞に発現するβ2アドレナリン受容体により媒介されることがわかった24).
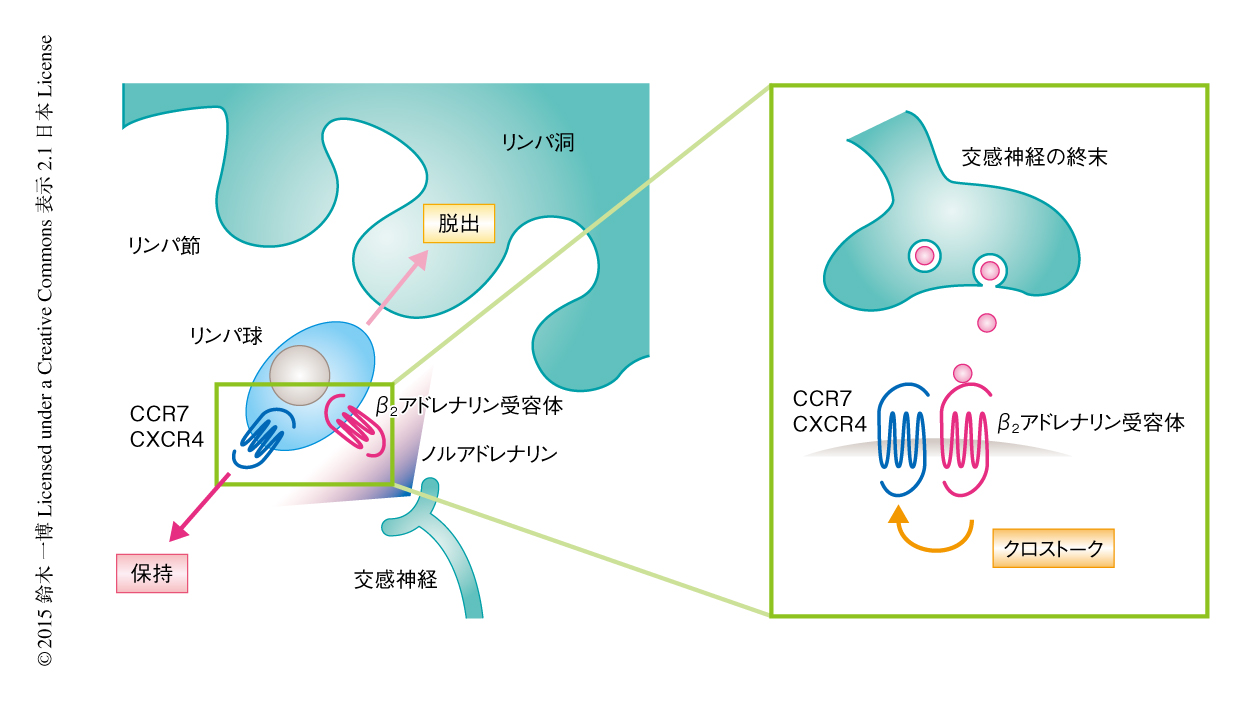
リンパ球はリンパ節からリンパ液へと脱出し,リンパ液が血液と合流するのにともない血流にのり,ふたたびリンパ節にもどる再循環というかたちで全身をめぐっている25).筆者らは,β2アドレナリン受容体刺激薬の投与によりリンパ節からのリンパ球の脱出が抑制されることをつきとめた24).このことが,血液およびリンパ液においてリンパ球の減少する原因であると考えられた.さらに,リンパ球におけるβ2アドレナリン受容体の欠損,あるいは,末梢のアドレナリン作動性神経の除去によりリンパ節からのリンパ球の脱出が亢進したことから,交感神経系からの生理的なレベルの入力が,リンパ球に発現するβ2アドレナリン受容体を介しリンパ節にリンパ球をひきとどめる役割をはたしていることがわかった24).これらのことから,交感神経系が細胞に内在する分子機構によりリンパ球の再循環を制御することで,リンパ球の動態の恒常性に寄与していることが明らかにされた(図3).このことは,交感神経系による好中球の動態の概日リズムが外在する分子機構により媒介されているのと対照的である21,22).
リンパ球におけるβ2アドレナリン受容体の活性化は,どのようにしてリンパ節からのリンパ球の脱出を抑制するのだろうか.リンパ節からのリンパ球の脱出の頻度は,リンパ節からのリンパ球の脱出を促進するスフィンゴシン1-リン酸受容体1型を介するシグナルと,リンパ節へのリンパ球の保持を促進するケモカイン受容体CCR7およびCXCR4を介するシグナルの強さのバランスにより決定される25).筆者らは,β2アドレナリン受容体の活性化にともないCCR7およびCXCR4の反応性が選択的に増強されるという,シグナル伝達系のクロストークを見い出した24).さらに,リンパ球におけるCCR7の欠損あるいはCXCR4の特異的な阻害薬によりβ2アドレナリン受容体刺激薬によるリンパ節からのリンパ球の脱出の抑制が解除されたことから,β2アドレナリン受容体の活性化にともなうリンパ球の動態の変化がCCR7およびCXCR4に依存することが確認された24).これらの知見から,β2アドレナリン受容体とCCR7およびCXCR4とのクロストークがリンパ節へのリンパ球の保持のシグナルを増強する結果,リンパ節からのリンパ球の脱出を抑制することが明らかにされた(図3).
アドレナリン受容体とケモカイン受容体はいずれもGタンパク質共役受容体であるが,異なるGタンパク質共役受容体どうしが複合体を形成し,受容体のあいだでシグナル伝達のクロストークの起こることが知られている26,27).そこで,β2アドレナリン受容体とケモカイン受容体との物理的な相互作用について検討した結果,β2アドレナリン受容体がCCR7およびCXCR4と選択的に複合体を形成することが示唆された24).筆者らは,この複合体がシグナルの増強作用の基盤になっており,いわば,神経系からのインプットを免疫系からのアウトプットに変換する分子装置として機能していると考えている.
交感神経系が免疫細胞の動態の制御に深く関与することが示されたが,その生理的な意義は明らかではない.好中球は1日のうちで身体の活動性とともに交感神経系の活動性が高まる時間帯に,血液から皮膚や筋肉など末梢組織に移行する.一方で,筆者らの研究は,交感神経系の活動性が高まるとリンパ球はリンパ節にとどまりやすくなることを示唆している.任意の抗原を特異的に認識するリンパ球の数は1個のリンパ節あたり数個から10個程度と見積もられるが,これだけ小さな細胞の集団であっても,その規模の大きさが獲得免疫応答の強さに反映されることが実験的に示されている28).身体の活動性が高まり病原体と遭遇するリスクも高まる時間帯に,病原体を直接に認識して殺傷することのできる好中球などの自然免疫を担当する細胞が病原体の侵入の門戸となる末梢組織に配置され,かつ,数少ない抗原に特異的なリンパ球が獲得免疫応答のスタートの場であるリンパ節に集積することは,効果的な免疫応答を誘導して病原体を排除するうえで有利にはたらくことが推測される.筆者らは,交感神経系により免疫細胞の動態が制御されることの意義はここにあると考えている.これは,現時点では仮説にすぎないが,今後の研究により明らかにすべき重要な課題のひとつである.
慢性的なストレスがくわわり交感神経系の活動性の高い状態が持続した場合に,獲得免疫系のうける影響をリンパ球の動態という観点から考察してみよう.交感神経系の興奮にともないリンパ節からのリンパ球の脱出が持続的に抑制されると,リンパ節のあいだでのリンパ球の循環がさまたげられるため,リンパ節におけるリンパ球の抗原特異性(レパトア)が固定され,本来は全身をくまなく監視すべきリンパ球の役割が損なわれる可能性がある.事実,健常者にスフィンゴシン1-リン酸受容体1型の機能的な阻害薬であるフィンゴリモドを投与してリンパ節からのリンパ球の脱出を持続的に抑制した状態で免疫を施した場合には,血清抗体価の上昇が鈍くなることが報告されている29).また,筆者らは,免疫を施すことによりリンパ節において生成するエフェクターT細胞に発現するβ2アドレナリン受容体が刺激されると,それらのリンパ節からの脱出が抑制され末梢組織への到達がさまたげられることを見い出している24).このことは,交感神経系が興奮した状態ではエフェクターT細胞がリンパ節から感染部位あるいは腫瘍組織へと移動できず,病原体あるいは腫瘍細胞を排除する過程に参加できないことを意味している.このように,慢性的なストレスによる交感神経系の持続的な興奮にともなうリンパ球の動態の変化は獲得免疫応答を弱める方向に作用すると推測されるが,ほかの要因も考えられる.たとえば,T細胞に対する主要な抗原提示細胞である樹状細胞に発現するβ2アドレナリン受容体を刺激することにより,抗原提示能およびサイトカイン産生能が低下することが知られており30-33),交感神経系の活動性が高い状況では樹状細胞によるT細胞の活性化が障害される可能性がある.また,ストレスによる視床下部-脳下垂体-副腎系の活性化にともない副腎皮質から分泌されるコルチゾールによる免疫抑制作用も忘れてはならない.したがって,これらを含めた複数の機序が“ストレスにより免疫力が低下する”という現象に寄与していると考えられる.
約100年にもおよぶ神経系による免疫系の制御に関する研究の歴史において,その細胞基盤あるいは分子基盤が明らかになりはじめたのはこの10年である.この間,ここに述べたいくつかの自律神経系による免疫系の制御機構が解明された.しかし,それらはいまだ各論的であり,神経系による免疫系の制御の全体像を俯瞰するレベルには達していない.それを実現するためには,自律神経系による免疫系の制御機構の解明をさらに推し進めるのはもちろんであるが,究極的には,情動や気分といった高次の脳機能がどのような分子機構により免疫機能に影響をおよぼすかを明らかにする必要があると思われる.しかし,筆者にもあてはまることであるが,現時点において,神経系による免疫系の制御の研究に取り組んでいる研究者のほとんどは免疫学をバックグラウンドにしており,自らの手で中枢神経系にまでさかのぼって解析するのは困難である.したがって,神経系による免疫系の制御機構の包括的な理解をめざすためには,神経科学を専門とする研究者と免疫学を専門とする研究者とが協同し,神経科学と免疫学の両方の見地からアプローチすることが重要であると考える.
略歴:2007年 大阪大学大学院医学系研究科 修了,米国California大学San Francisco校 博士研究員を経て,2011年より大阪大学免疫学フロンティア研究センター 特任准教授.
研究室URL:http://kazuhirosuzuki.com/
© 2015 鈴木 一博 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 免疫応答ダイナミクス研究室)
email:鈴木一博
領域融合レビュー, 4, e011 (2015) DOI: 10.7875/leading.author.4.e011
Kazuhiro Suzuki: Control of immune cell dynamics by the sympathetic nervous system.
要 約
神経系が免疫系に対し制御作用をもつことは古くから指摘されてきたが,その分子機構は長らく不明であった.近年,神経系からのインプットが免疫系からのアウトプットに変換される分子機構が明らかにされるにつれ,神経系による免疫系の制御の研究が注目されはじめた.最近の研究から,交感神経系が好中球あるいはリンパ球の動態をそれぞれ異なる分子機構により制御していることが明らかにされた.このレビューにおいては,交感神経系による免疫細胞の動態の制御機構を中心に,神経系による免疫系の制御に関する最新の知見について解説する.
はじめに
昨今“免疫力”という言葉をよく耳にする.そのとき,多くの場合において語られるのがストレスとの関係であり,“ストレスにより免疫力が低下する”というのが巷間の定説になっている.たしかに,ストレスが免疫の機能に影響をおよぼすことは文献的にも報告されている1).しかし,このレビューの読者の多くには,信憑性をもって受け入れられないのではないかと想像する.それは,ストレスがくわわると免疫系の活動性を表わすなんらかの指標が悪化するのは事実だとしても,ストレスが免疫系に作用する分子機構について細胞レベルあるいは分子レベルでの裏づけが十分になされていないためである.
精神的あるいは肉体的なストレスや情動によりもたらされる脳の活動性の変化は全身の臓器に対しさまざまな影響をおよぼす.その主要な伝達経路のひとつが交感神経系と副交感神経系からなる自律神経系である.交感神経系と副交感神経系はいずれも,脊髄から神経節に達する節前線維と,神経節において節前線維の終末とシナプスを形成し標的となる臓器に投射する節後線維から構成される.原則的に,交感神経系の節後線維の終末からはノルアドレナリンが,副交感神経系の節後線維の終末からはアセチルコリンが放出され,その受容体を発現する細胞に作用する.しかし,のちに述べるように,リンパ器官にはノルアドレナリンを産生するアドレナリン作動性神経は投射しているが,アセチルコリンを産生するコリン作動性神経はほとんど投射していないという解剖学的な特徴がある2).したがって,交感神経系は免疫系とより直接的なインターフェイスを形成していると考えられる.今日,神経系による免疫系の制御における細胞基盤あるいは分子基盤の解明をめざす研究者が交感神経系に注目するのはこのためである.このレビューにおいては,研究の歴史的な背景をふまえながら,交感神経系による免疫系の制御機構を,おもに免疫細胞の動態の制御という切り口から解説する.
1.神経系による免疫系の制御の研究史
神経系による免疫系の制御の研究の歴史は,文献においては20世紀初頭にさかのぼる3).アドレナリンが単離され結晶化されたのは1901年のことであるが4,5),そののちまもなく,ヒトにアドレナリンを投与すると末梢の血液における白血球の数が変動することが報告され,アドレナリン受容体を介する刺激が免疫細胞の動態に影響をおよぼすことが示唆された6).神経系による免疫系の制御機構の存在をはじめて示したとされる研究は,じつはわが国から報告されている.1919年に発表されたその論文には,事業の失敗や家庭内の不和など社会心理的なストレスをかかえる結核患者において白血球の貪食能が低下することが記されていた7).しかし,この研究がかえりみられるようになったのは,1960年代に入り精神的なストレスが自己免疫疾患の症状に影響をおよぼすことが報告され,“psychoimmunology”(精神免疫学)の概念が提唱されてからのことであった8).1970年代には,さらに精神状態と免疫機能とを結びつける神経科学的な側面も加味して“psychoneuroimmunology”(精神神経免疫学)が概念化された9,10).しかし,分子生物学が隆盛をきわめていた時代である.多くの研究者が生命現象を分子のレベルで解き明かそうとするなか,現象の記述にとどまるこれらの学問は当時の生命科学の潮流にのることはできなかった.
しかし,1980年代に入ると,胸腺や骨髄といった1次リンパ器官およびリンパ節や脾臓といった2次リンパ器官のいずれにもアドレナリン作動性神経が投射されていることが形態学的な研究から明らかになり,交感神経系による免疫系の制御における解剖学的な根拠が示された11).とくに2次リンパ器官においては,アドレナリン作動性神経はT細胞の存在する領域を中心として分布しB細胞の集まるリンパ濾胞の内部には入り込まないという投射パターンをとることがわかった.興味深いことに,リンパ器官においてコリン作動性神経は検出されない2).さらに,同じ時代の薬理学的な研究から,ノルアドレナリンの受容体が免疫細胞の細胞膜に発現していることが示された12).アドレナリン受容体はα1,α2,β1,β2,β3の5つのサブタイプに分類されるが,免疫細胞にはβ2アドレナリン受容体がもっとも豊富に発現していることも明らかにされた.これらの知見は,交感神経系からの入力が免疫系に直接的に作用することを示唆するものであり,神経系による免疫系の制御の研究が息をふきかえす契機になった.
2.神経系による炎症の制御における分子基盤
神経系による免疫系の制御における確固とした分子基盤が明らかにされたのは,21世紀に入ってからのことである.迷走神経は脳幹に起始して胸腹部の内臓に分布し,その知覚と機能制御をつかさどる重要な神経である.かねてから,迷走神経を刺激することによりマウスにエンドトキシンを投与した際の炎症反応が抑制されることが知られていたが13),それが脾臓のマクロファージに発現するニコチン性アセチルコリン受容体α7サブユニットに媒介されることがつきとめられた14).ニコチン性アセチルコリン受容体α7サブユニットは神経細胞においてはイオンチャネル型受容体のサブユニットとして活動電位の生成に寄与するが,マクロファージにおいては種々のシグナル伝達経路を介してNF-κBの核への移行をさまたげTNFαをはじめとする炎症性サイトカインの産生を抑制する15,16).
迷走神経の遠心路は原則的にコリン作動性神経により構成されるが,腹腔神経節から脾臓に投射する迷走神経の節後線維(脾神経)は例外的にアドレナリン作動性神経である.では,脾臓においてアセチルコリンはどこから供給されるのだろうか.興味深いことに,CD4陽性T細胞の一部がノルアドレナリンの刺激をうけてアセチルコリンを産生し,脾臓におけるアセチルコリンの供給源になっていることが判明した17).これらの発見から,迷走神経が炎症反応を負に制御する分子機構が明らかにされ,神経系による免疫系の制御における細胞基盤および分子基盤がはじめて示された(図1).さらに,脳幹へとむかう迷走神経の求心路(感覚神経)にToll様受容体やサイトカイン受容体が発現し,これらを刺激することにより活動電位が増強されるという知見を総合し,迷走神経の求心路と遠心路を反射弓として過剰な炎症反応の起こるのをふせぎ生体を保護するしくみが提唱され“inflammatory reflex”(炎症反射)と名づけられた15,16).
最近,神経系による炎症制御における新たな分子基盤が解明された.多発性硬化症のマウスモデルである実験的自己免疫性脳脊髄炎において,痛覚刺激あるいは抗重力筋(ヒラメ筋)からの感覚刺激が特定の脊髄分節における炎症細胞の侵入を促進することが明らかにされた18,19).その分子機構として,感覚神経からの入力が炎症部位において局所的にアドレナリン作動性神経を興奮させ,そこから放出されるノルアドレナリンがβ1アドレナリン受容体を介して血管内皮細胞からのケモカインの産生を誘導することが示された.この機序は,炎症部位において免疫細胞の侵入する門戸を形成する反射として“gateway reflex”とよばれる20).
3.交感神経系による好中球の動態の制御
さきに述べたように,アドレナリン受容体を介する刺激が免疫細胞の動態に影響をおよぼすことは100年以上もまえから知られていたが6),その分子機構は不明であった.このような状況において,2012年,マウスでは昼間に比べ夜間に皮膚や筋肉などの末梢組織に好中球が集積するのと同期して,血液における好中球の数が減少することが報告された21,22).交感神経系の活動性は1日のうちで身体の活動性の高い時間帯に上昇し,身体の活動性の低い時間帯に低下するという概日リズムを示す.したがって,マウスのような夜行性の動物では夜間に交感神経系の活動性が高まる.好中球の動態が概日リズムを示す分子機構として,交感神経系からの入力がβ2アドレナリン受容体およびβ3アドレナリン受容体を介して組織の血管内皮細胞におけるケモカインおよび細胞接着因子の発現を誘導することにより,血液から組織への好中球の移行を促進することが明らかにされた(図2).つまり,好中球の動態の概日リズムは,好中球への直接的な作用ではなく,交感神経系が好中球をとりまく微小環境を変化させることにより形成される.
しかし,教科書的にも,急激にストレスがくわわった場合やノルアドレナリンを単回投与した場合には末梢の血液における好中球の数は増加することが知られており23),さきの知見といっけん矛盾する.急速かつ強力なノルアドレナリンの入力は,交感神経系の活動性の概日リズムにともないノルアドレナリンの入力が緩徐に変化する場合とは異なる分子機構により,好中球の動態に作用するのかもしれない.
4.交感神経系によるリンパ球の再循環の制御
ノルアドレナリンを投与すると,好中球の場合とは対照的に,末梢の血液におけるリンパ球の数は減少する23).筆者らは,リンパ球にβ2アドレナリン受容体が発現していることに着目し,β2アドレナリン受容体の選択的な刺激薬をマウスに投与したところ,血液のみならずリンパ液においてもリンパ球の数が急激に減少することを見い出した24).β2アドレナリン受容体ノックアウトマウスの骨髄を放射線を照射した野生型のマウスに移入して骨髄キメラマウスを作製し,血液細胞にβ2アドレナリン受容体が発現していない状況をつくりだしたところ,β2アドレナリン受容体刺激薬の作用がほとんど消失したことから,β2アドレナリン受容体刺激薬の投与による血液およびリンパ液におけるリンパ球の減少は,おもに血液細胞に発現するβ2アドレナリン受容体により媒介されることがわかった24).
リンパ球はリンパ節からリンパ液へと脱出し,リンパ液が血液と合流するのにともない血流にのり,ふたたびリンパ節にもどる再循環というかたちで全身をめぐっている25).筆者らは,β2アドレナリン受容体刺激薬の投与によりリンパ節からのリンパ球の脱出が抑制されることをつきとめた24).このことが,血液およびリンパ液においてリンパ球の減少する原因であると考えられた.さらに,リンパ球におけるβ2アドレナリン受容体の欠損,あるいは,末梢のアドレナリン作動性神経の除去によりリンパ節からのリンパ球の脱出が亢進したことから,交感神経系からの生理的なレベルの入力が,リンパ球に発現するβ2アドレナリン受容体を介しリンパ節にリンパ球をひきとどめる役割をはたしていることがわかった24).これらのことから,交感神経系が細胞に内在する分子機構によりリンパ球の再循環を制御することで,リンパ球の動態の恒常性に寄与していることが明らかにされた(図3).このことは,交感神経系による好中球の動態の概日リズムが外在する分子機構により媒介されているのと対照的である21,22).
5.β2アドレナリン受容体とケモカイン受容体とのクロストーク
リンパ球におけるβ2アドレナリン受容体の活性化は,どのようにしてリンパ節からのリンパ球の脱出を抑制するのだろうか.リンパ節からのリンパ球の脱出の頻度は,リンパ節からのリンパ球の脱出を促進するスフィンゴシン1-リン酸受容体1型を介するシグナルと,リンパ節へのリンパ球の保持を促進するケモカイン受容体CCR7およびCXCR4を介するシグナルの強さのバランスにより決定される25).筆者らは,β2アドレナリン受容体の活性化にともないCCR7およびCXCR4の反応性が選択的に増強されるという,シグナル伝達系のクロストークを見い出した24).さらに,リンパ球におけるCCR7の欠損あるいはCXCR4の特異的な阻害薬によりβ2アドレナリン受容体刺激薬によるリンパ節からのリンパ球の脱出の抑制が解除されたことから,β2アドレナリン受容体の活性化にともなうリンパ球の動態の変化がCCR7およびCXCR4に依存することが確認された24).これらの知見から,β2アドレナリン受容体とCCR7およびCXCR4とのクロストークがリンパ節へのリンパ球の保持のシグナルを増強する結果,リンパ節からのリンパ球の脱出を抑制することが明らかにされた(図3).
アドレナリン受容体とケモカイン受容体はいずれもGタンパク質共役受容体であるが,異なるGタンパク質共役受容体どうしが複合体を形成し,受容体のあいだでシグナル伝達のクロストークの起こることが知られている26,27).そこで,β2アドレナリン受容体とケモカイン受容体との物理的な相互作用について検討した結果,β2アドレナリン受容体がCCR7およびCXCR4と選択的に複合体を形成することが示唆された24).筆者らは,この複合体がシグナルの増強作用の基盤になっており,いわば,神経系からのインプットを免疫系からのアウトプットに変換する分子装置として機能していると考えている.
6.交感神経系により免疫細胞の動態が制御されることの意義
交感神経系が免疫細胞の動態の制御に深く関与することが示されたが,その生理的な意義は明らかではない.好中球は1日のうちで身体の活動性とともに交感神経系の活動性が高まる時間帯に,血液から皮膚や筋肉など末梢組織に移行する.一方で,筆者らの研究は,交感神経系の活動性が高まるとリンパ球はリンパ節にとどまりやすくなることを示唆している.任意の抗原を特異的に認識するリンパ球の数は1個のリンパ節あたり数個から10個程度と見積もられるが,これだけ小さな細胞の集団であっても,その規模の大きさが獲得免疫応答の強さに反映されることが実験的に示されている28).身体の活動性が高まり病原体と遭遇するリスクも高まる時間帯に,病原体を直接に認識して殺傷することのできる好中球などの自然免疫を担当する細胞が病原体の侵入の門戸となる末梢組織に配置され,かつ,数少ない抗原に特異的なリンパ球が獲得免疫応答のスタートの場であるリンパ節に集積することは,効果的な免疫応答を誘導して病原体を排除するうえで有利にはたらくことが推測される.筆者らは,交感神経系により免疫細胞の動態が制御されることの意義はここにあると考えている.これは,現時点では仮説にすぎないが,今後の研究により明らかにすべき重要な課題のひとつである.
慢性的なストレスがくわわり交感神経系の活動性の高い状態が持続した場合に,獲得免疫系のうける影響をリンパ球の動態という観点から考察してみよう.交感神経系の興奮にともないリンパ節からのリンパ球の脱出が持続的に抑制されると,リンパ節のあいだでのリンパ球の循環がさまたげられるため,リンパ節におけるリンパ球の抗原特異性(レパトア)が固定され,本来は全身をくまなく監視すべきリンパ球の役割が損なわれる可能性がある.事実,健常者にスフィンゴシン1-リン酸受容体1型の機能的な阻害薬であるフィンゴリモドを投与してリンパ節からのリンパ球の脱出を持続的に抑制した状態で免疫を施した場合には,血清抗体価の上昇が鈍くなることが報告されている29).また,筆者らは,免疫を施すことによりリンパ節において生成するエフェクターT細胞に発現するβ2アドレナリン受容体が刺激されると,それらのリンパ節からの脱出が抑制され末梢組織への到達がさまたげられることを見い出している24).このことは,交感神経系が興奮した状態ではエフェクターT細胞がリンパ節から感染部位あるいは腫瘍組織へと移動できず,病原体あるいは腫瘍細胞を排除する過程に参加できないことを意味している.このように,慢性的なストレスによる交感神経系の持続的な興奮にともなうリンパ球の動態の変化は獲得免疫応答を弱める方向に作用すると推測されるが,ほかの要因も考えられる.たとえば,T細胞に対する主要な抗原提示細胞である樹状細胞に発現するβ2アドレナリン受容体を刺激することにより,抗原提示能およびサイトカイン産生能が低下することが知られており30-33),交感神経系の活動性が高い状況では樹状細胞によるT細胞の活性化が障害される可能性がある.また,ストレスによる視床下部-脳下垂体-副腎系の活性化にともない副腎皮質から分泌されるコルチゾールによる免疫抑制作用も忘れてはならない.したがって,これらを含めた複数の機序が“ストレスにより免疫力が低下する”という現象に寄与していると考えられる.
おわりに
約100年にもおよぶ神経系による免疫系の制御に関する研究の歴史において,その細胞基盤あるいは分子基盤が明らかになりはじめたのはこの10年である.この間,ここに述べたいくつかの自律神経系による免疫系の制御機構が解明された.しかし,それらはいまだ各論的であり,神経系による免疫系の制御の全体像を俯瞰するレベルには達していない.それを実現するためには,自律神経系による免疫系の制御機構の解明をさらに推し進めるのはもちろんであるが,究極的には,情動や気分といった高次の脳機能がどのような分子機構により免疫機能に影響をおよぼすかを明らかにする必要があると思われる.しかし,筆者にもあてはまることであるが,現時点において,神経系による免疫系の制御の研究に取り組んでいる研究者のほとんどは免疫学をバックグラウンドにしており,自らの手で中枢神経系にまでさかのぼって解析するのは困難である.したがって,神経系による免疫系の制御機構の包括的な理解をめざすためには,神経科学を専門とする研究者と免疫学を専門とする研究者とが協同し,神経科学と免疫学の両方の見地からアプローチすることが重要であると考える.
文 献
- Glaser, R. & Kiecolt-Glaser, J. K.: Stress-induced immune dysfunction: implications for health. Nat. Rev. Immunol., 5, 243-251 (2005)[PubMed]
- Nance, D. M. & Sanders, V. M.: Autonomic innervation and regulation of the immune system (1987-2007). Brain Behav. Immun., 21, 736-745 (2007)[PubMed]
- Elenkov, I. J., Wilder, R. L., Chrousos, G. P. et al.: The sympathetic nerve: an integrative interface between two supersystems: the brain and the immune system. Pharmacol. Rev., 52, 595-638 (2000)[PubMed]
- Aldrich, T.: A preliminary report on the active principle of the suprarenal gland. Am. J. Physiol., 5, 457-461 (1901)
- Takamine, J.: The isolation of the active principle of the suprarenal gland. J. Physiol., 27, 29-30 (1901)
- Loeper, M. & Crouzon, O.: L’action de l’adrenaline sur le sang. Arch. Med. Exp. Anat. Pathol., 16, 83-108 (1904)
- Ishigami, T.: The influence of psychic acts on the progress of pulmonary tuberculosis. Am. Rev. Tuberc., 2, 470-484 (1919)
- Solomon, G. F. & Moos, R. H.: Emotions, immunity, and disease: a speculative theoretical integration. Arch. Gen. Psychiatry, 11, 657-674 (1964)[PubMed]
- Ader, R. & Cohen, N.: Behaviorally conditioned immunosuppression. Psychosom. Med., 37, 333-340 (1975)[PubMed]
- Ader, R., Cohen, N. & Felten, D.: Psychoneuroimmunology: interactions between the nervous system and the immune system. Lancet, 345, 99-103 (1995)[PubMed]
- Felten, D. L., Felten, S. Y., Carlson, S. L. et al.: Noradrenergic and peptidergic innervation of lymphoid tissue. J. Immunol., 135, 755s-765s (1985)[PubMed]
- Brodde, O. -E., Engel, G., Hoyer, D. et al.: The β-adrenergic receptor in human lymphocytes: Subclassification by the use of a new radio-ligand, (±)-125 iodocyanopindolol. Life Sci., 29, 2189-2198 (1981)[PubMed]
- Borovikova, L. V., Ivanova, S., Zhang, M. et al.: Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin. Nature, 405, 458-462 (2000)[PubMed]
- Wang, H., Yu, M., Ochani, M. et al.: Nicotinic acetylcholine receptor α7 subunit is an essential regulator of inflammation. Nature, 421, 384-388 (2003)[PubMed]
- Andersson, U. & Tracey, K. J.: Reflex principles of immunological homeostasis. Annu. Rev. Immunol., 30, 313-335 (2012)[PubMed]
- Tracey, K. J.: Reflex control of immunity. Nat. Rev. Immunol., 9, 418-428 (2009)[PubMed]
- Rosas-Ballina, M., Olofsson, P. S., Ochani, M. et al.: Acetylcholine-synthesizing T cells relay neural signals in a vagus nerve circuit. Science, 334, 98-101 (2011)[PubMed]
- Arima, Y., Harada, M., Kamimura, D. et al.: Regional neural activation defines a gateway for autoreactive T cells to cross the blood-brain barrier. Cell, 148, 447-457 (2012)[PubMed]
- Arima, Y., Kamimura, D., Atsumi, T. et al.: A pain-mediated neural signal induces relapse in murine autoimmune encephalomyelitis, a multiple sclerosis model. Elife, 4, e08733 (2015)[PubMed]
- Tracey, K. J.: Immune cells exploit a neural circuit to enter the CNS. Cell, 148, 392-394 (2012)[PubMed]
- Scheiermann, C., Kunisaki, Y. & Frenette, P. S.: Circadian control of the immune system. Nat. Rev. Immunol., 13, 190-198 (2013)[PubMed]
- Scheiermann, C., Kunisaki, Y., Lucas, D. et al.: Adrenergic nerves govern circadian leukocyte recruitment to tissues. Immunity, 37, 290-301 (2012)[PubMed]
- Benschop, R. J., Rodriguez-Feuerhahn, M. & Schedlowski, M.: Catecholamine-induced leukocytosis: early observations, current research, and future directions. Brain Behav. Immun., 10, 77-91 (1996)[PubMed]
- Nakai, A., Hayano, Y., Furuta, F. et al.: Control of lymphocyte egress from lymph nodes through β2-adrenergic receptors. J. Exp. Med., 211, 2583-2598 (2014)[PubMed]
- Cyster, J. G. & Schwab, S. R.: Sphingosine-1-phosphate and lymphocyte egress from lymphoid organs. Annu. Rev. Immunol., 30, 69-94 (2012)[PubMed]
- Fribourg, M., Moreno, J. L., Holloway, T. et al.: Decoding the signaling of a GPCR heteromeric complex reveals a unifying mechanism of action of antipsychotic drugs. Cell, 147, 1011-1023 (2011)[PubMed]
- Gonzalez-Maeso, J., Ang, R. L., Yuen, T. et al.: Identification of a serotonin/glutamate receptor complex implicated in psychosis. Nature, 452, 93-97 (2008)[PubMed]
- Moon, J. J., Chu, H. H., Pepper, M. et al.: Naive CD4+ T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity, 27, 203-213 (2007)[PubMed]
- Boulton, C., Meiser, K., David, O. J. et al.: Pharmacodynamic effects of steady-state fingolimod on antibody response in healthy volunteers: a 4-week, randomized, placebo-controlled, parallel-group, multiple-dose study. J. Clin. Pharmacol., 52, 1879-1890 (2012)[PubMed]
- Grebe, K. M., Hickman, H. D., Irvine, K. R. et al.: Sympathetic nervous system control of anti-influenza CD8+ T cell responses. Proc. Natl. Acad. Sci. USA, 106, 5300-5305 (2009)[PubMed]
- Herve, J., Dubreil, L., Tardif, V. et al.: β2-Adrenoreceptor agonist inhibits antigen cross-presentation by dendritic cells. J. Immunol., 190, 3163-3171 (2013)[PubMed]
- Hu, Z., Chen, R., Cai, Z. et al.: Salmeterol attenuates the inflammatory response in asthma and decreases the pro-inflammatory cytokine secretion of dendritic cells. Cell. Mol. Immunol, 9, 267-275 (2012)[PubMed]
- Nijhuis, L. E., Olivier, B. J., Dhawan, S. et al.: Adrenergic β2 receptor activation stimulates anti-inflammatory properties of dendritic cells in vitro. PLoS One, 9, e85086 (2014)[PubMed]
著者プロフィール
略歴:2007年 大阪大学大学院医学系研究科 修了,米国California大学San Francisco校 博士研究員を経て,2011年より大阪大学免疫学フロンティア研究センター 特任准教授.
研究室URL:http://kazuhirosuzuki.com/
© 2015 鈴木 一博 Licensed under CC 表示 2.1 日本