細胞質ダイニンのモータードメインの結晶構造
2016/01/18
栗栖源嗣1・昆 隆英2
(1大阪大学蛋白質研究所 蛋白質構造生物学研究部門,2大阪大学大学院理学研究科 生物科学専攻分子細胞運動学研究室)
email:栗栖源嗣
領域融合レビュー, 5, e001 (2016) DOI: 10.7875/leading.author.5.e001
Genji Kurisu & Takahide Kon: Crystal structure of the cytoplasmic dynein motor domain.

ダイニンはATPに依存して微小管のうえを滑り運動するモータータンパク質であり,鞭毛運動および繊毛運動を駆動する軸糸ダイニンと,細胞内輸送や染色体の分離を担う細胞質ダイニンとに分類される.生体において複数のサブユニットから構成される生体超分子複合体として機能しており,モーター活性は重鎖にあるが,その重鎖だけでも500 kDaをこえる巨大なタンパク質である.その巨大さと特徴的な構造から,ダイニンの構造生物学的な研究は天然に大量に存在する軸糸ダイニンを使った電子顕微鏡による解析が先行した.細胞質ダイニンのモータードメインの組換え体を調製する系が確立されてから研究は劇的に進展し,2011年から,たてつづけにX線結晶構造が決定された.ここでは,筆者らにより決定された細胞性粘菌に由来する細胞質ダイニンのモータードメインの結晶構造を中心に,出芽酵母およびヒトに由来する細胞質ダイニンのモータードメインの結晶構造を参照しながら,細胞質ダイニンの運動機構について解説する.
ダイニンはATPに依存して微小管のうえを滑り運動するモータータンパク質であり1),鞭毛運動および繊毛運動を駆動する軸糸ダイニンと2-4),細胞内輸送や染色体の分離を担う細胞質ダイニン5,6) とに分類される.ダイニンは重鎖,中間鎖,中軽鎖,軽鎖など複数のサブユニットから構成される生体超分子複合体であり,その大きさは1000 kDaをこえる.生物学的にきわめて重要なタンパク質であるにもかかわらず巨大であるがゆえ,同じモータータンパク質であるキネシンやミオシンに比べ運動機構についての解明は遅れていた.しかしながら,細胞質ダイニンのモータードメインの組換え体を調製する系が確立されてから研究はいちじるしく進展した.このレビューにおいては,この細胞質ダイニンを中心として,最近のX線結晶構造解析について解説する.
ダイニンの運動活性はAAA+ファミリーに属する重鎖が担う7).このAAA+ファミリーには,タンパク質の分解,タンパク質複合体の解離,複製,DNAの組換えなど,非常に多岐にわたる細胞機能を担うタンパク質が含まれる8).これらAAA+タンパク質はAAA+モジュールとよばれる共通の構造ユニットをもち,通常はリング状に会合した多量体として機能する9).ダイニンの重鎖も6個のAAA+モジュールからなるリング構造をとるが10,11),ほかのAAA+タンパク質とは異なり,6個のAAA+モジュールがつながって1本のポリペプチド鎖を形成している7).
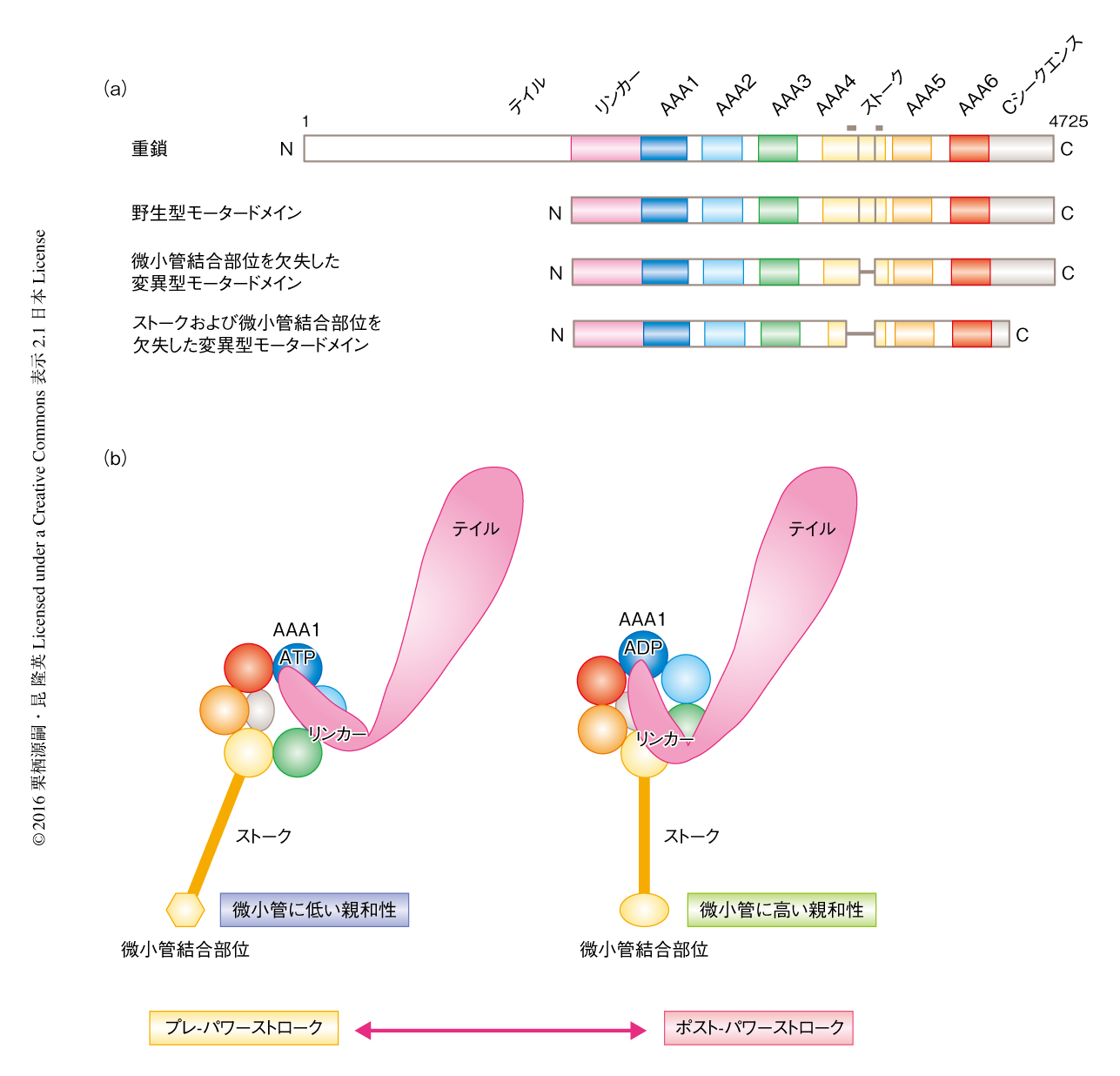
アミノ酸配列の解析および電子顕微鏡による低分解能の構造解析により,ダイニンの重鎖にはストークおよびリンカーとよばれる2つの特徴的な機能ユニットの存在することがわかっていた(図1).ストークはAAA+リングから突き出たコイルドコイル構造で,その先端部に位置する小さな球状の構造が微小管結合部位である12,13).一方,リンカーは力の発生を担う機能ユニットである.リンカーのさきにはテイルとよばれる二量体化ドメインがあり,中間鎖や軽鎖などとの結合にかかわる10,11,14)(図1a).リンカーが力の発生を担うためには,力の発生する前後に構造が変化する必要がある.また,AAA+リングから大きくはなれた位置にある微小管結合部位がAAA+リングにおけるATPの加水分解と同調して微小管に対する親和性を変化させる必要がある(図1b).しかし最近まで,高分解能での構造情報がなかったため,ダイニンの運動に必須であるこれらのしくみについて,その構造基盤は謎につつまれたままであった.
2011年,細胞質ダイニンのモータードメインの結晶構造が中程度の分解能で報告され,2次構造のレベルでその分子構造が記述された15,16).しかし,分解能が十分でないことから,ほかのモータータンパク質と比べ構造機能相関の解明は不十分な状態にあった.2012年,力を発生したのち(ポスト-パワーストローク状態)の高分解能のX線結晶構造が報告された17,18).筆者らにより,細胞性粘菌Dictyostelium discoideumに由来する細胞質ダイニンのADP結合状態の結晶構造が2.8Å分解能で,また,出芽酵母に由来する細胞質ダイニンのヌクレオチドを含まないアポ状態の結晶にADPあるいはATPアナログを浸透させた構造が3.3Å分解能で決定されたのである.2015年に3.4Å分解能で決定された,力を発生するまえ(プレ-パワーストローク状態)の,ヒトのダイニン-2のADPおよびリン酸のアナログとしてバナジン酸と結合させた状態の結晶構造とあわせ19),このレビューでは,細胞質ダイニンの運動活性および力の発生の構造基盤について解説する.
筆者らは,細胞性粘菌に由来する細胞質ダイニンの380 kDaの野生型のモータードメインと,微小管結合部位を欠失した変異型モータードメインを用いた(図2a).野生型モータードメインは微小管のない条件では基底状態のATPase活性を示すが,微小管の添加によりATPaseが活性化される.一方,微小管結合部位を欠失した変異型モータードメインは微小管と結合しないが,ATPase活性は野生型モータードメインが発揮しうる最大の活性を示し,活性化の状態に固定されている20).野生型モータードメインの結晶構造は,微小管結合部位を欠失した変異型モータードメインの構造モデルを用いた分子置換法により決定した.構造の精密化は3.8Å分解能で行い,結晶学的にも十分な精度で構造が決定された(PDB ID:3VKH,図2b).微小管結合部位を欠失した変異型モータードメインの構造決定には,TaおよびW,さらにセレノメチオニンに置換した重原子誘導体の結晶による同型置換法を適用した.その結果,N末端側の22残基,構造をとらないループ構造,欠失させた微小管結合部位のほか,約90%に相当する分子モデルを構築することができた.得られた分子モデルは2.8Å分解能で構造の精密化を行い,十分な信頼度因子をもって構造が決定された(PDB ID:3VKG,図2c).
筆者らに先行した構造決定においては,出芽酵母に由来する細胞質ダイニンのモータードメインにつきストークおよび微小管結合部位を欠失した変異体が用いられた(図2a).最初に,ヌクレオチドを含まないアポ型の結晶構造が6.0Å分解能で報告された(PDB ID:3QMZ,図2d).その初期構造は,ホモロジーモデルにより推測されたループ構造,および,実験的に決定された2次構造から構築された15).
また,昆虫細胞で発現させた組換え体としてヒトのダイニン-2のモータードメインの構造が決定された.ADPおよびリン酸のアナログとしてバナジン酸と結合させることによりプレ-パワーストローク状態へと固定されている.構造の決定には,筆者らが決定した微小管結合部位を欠失した変異型モータードメインの構造をサーチモデルとした分子置換法が用いられている.構造の精密化は3.4Å分解能で行い,十分な信頼度因子で構造が決定されている19)(PDB ID:4RH7,図2e).
出芽酵母に由来するストークおよび微小管結合部位を欠失した変異型モータードメインの結晶と,細胞性粘菌に由来する野生型モータードメインおよび微小管結合部位を欠失した変異型モータードメインの結晶は,結晶学的な非対称単位中に2分子のモータードメインを含んでいた17).機能の詳細に関係する細部の構造は個々に異なっていたものの,既報の構造はすべて全体としてはほぼ同じ構造をとっていた.したがって,以下では,非対称単位中の2分子のモータードメインのうち,もっともモデルの構築率が高く分解能のよいA分子について構造を解説する.
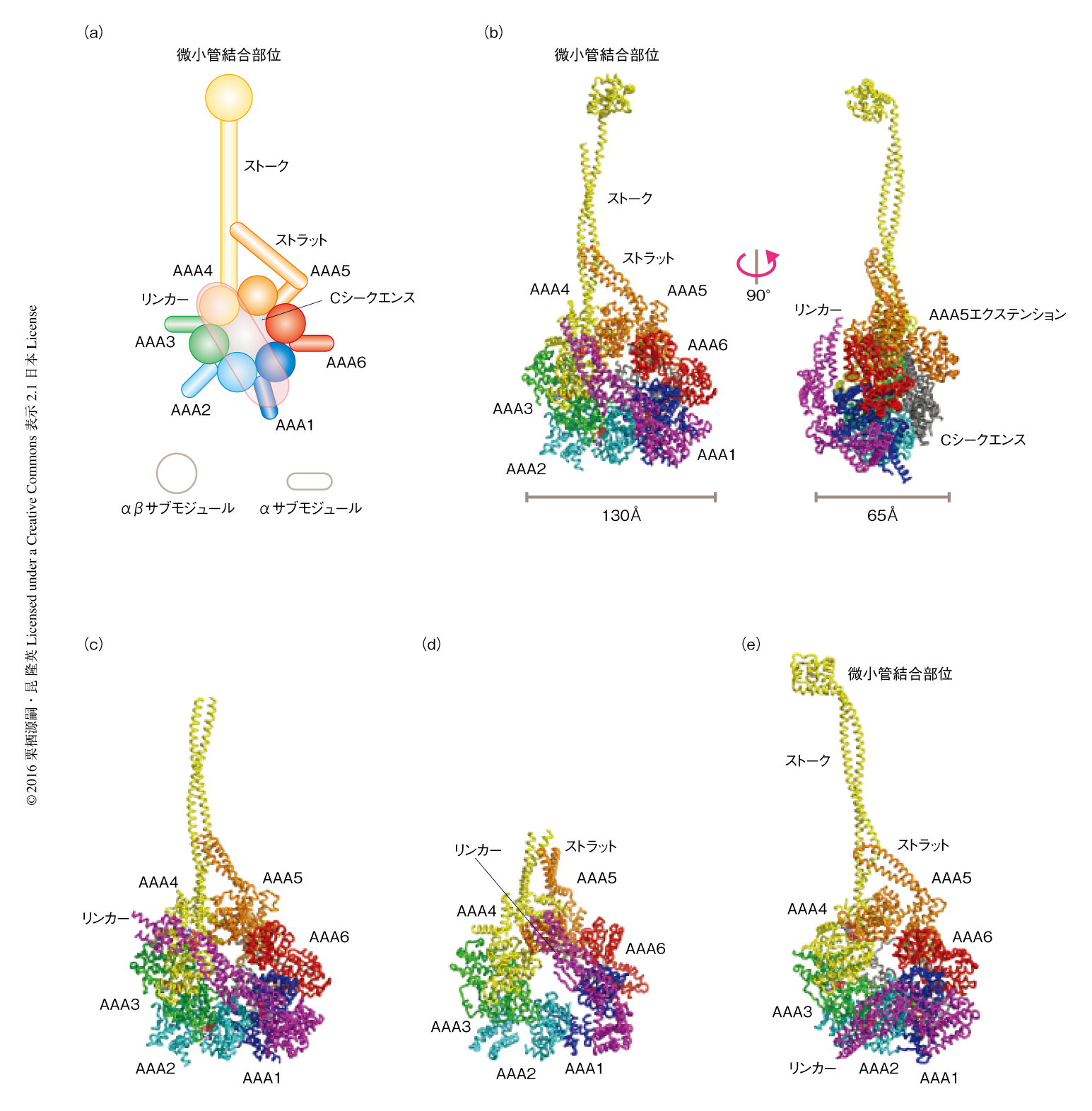
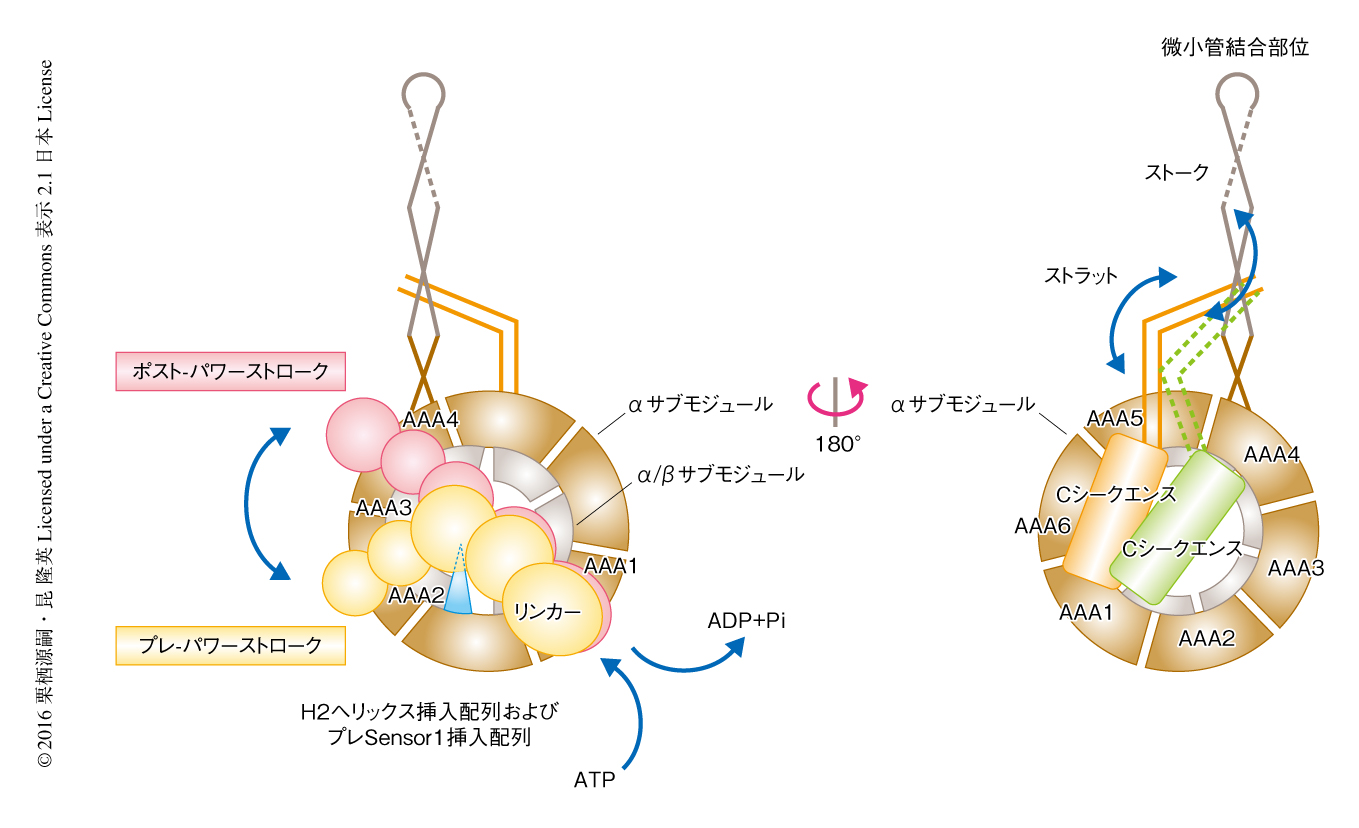
モータードメインは,中心のAAA+リング構造と,リンカー,ストークおよびストラット,Cシークエンスの3つの構造ユニットから構成されていた(図2).ATPase活性のある中心のAAA+リングは6つのAAA+モジュールAAA1~AAA6をもち,おのおののモジュールが順番にリング状に並んだ配列になっていた.AAA+リングの直径は130Å,厚さは65Å,中心には直径35Åの孔のある構造をしていた.おのおののAAA+モジュールのN末端側にはロスマンフォールドをとるα/βサブモジュールがあり,C末端側にはαサブモジュールが位置していた(図2a,図3).この2つのサブモジュールはそれぞれリング構造の表面および裏面を構成していた.AAA1からAAA4のおのおののAAA+モジュールはそれぞれユニークな挿入配列をもち,その挿入位置から,H2へリックスに挿入されているH2ヘリックス挿入配列,Walker B配列のまえに挿入されているプレWalker B挿入配列,Sensor 1配列のまえに挿入されているプレSensor 1挿入配列と名づけられた.さらに,AAA5モジュールには8本のαへリックスからなる大きな球状のドメインがあり,AAA5エクステンションと名づけられた(図2b).
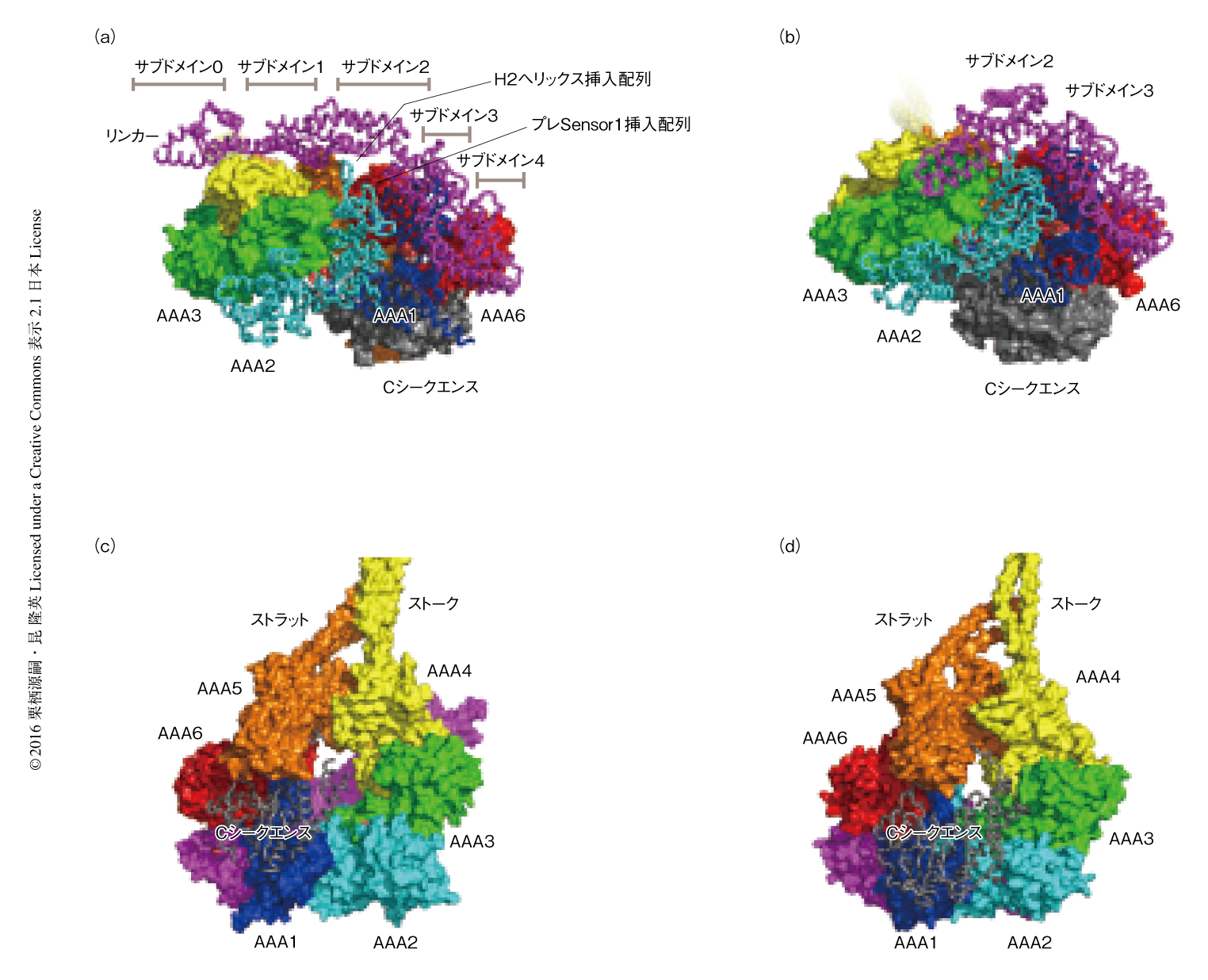
N末端側から順にAAA+リング以外の構造をみていく.1つ目は,AAA+リングの上部をAAA4からAAA1にむけて延びるリンカーである.リンカーは19本のαへリックスと8本のβストランドからなるロッド状の構造をしており,サブドメイン0~サブドメイン4の5つに分割された(図4 a, b).2つ目は,AAA4から延びた長いストークとAAA5から延びた短いストラットからなるコイルドコイル構造をとる領域である(図2 b, c, e).ストラットの存在は中程度の分解能のX線結晶構造によりはじめて明らかにされた15,16).野生型モータードメインA分子の構造モデルにおいてはストークのさきに微小管結合部位が確認されたが,野生型モータードメインB分子において微小管結合部位は確認されなかった17).B分子において微小管結合部位に相当する電子密度が同定されなかったのは,おそらく,微小管結合部位の運動性が高いためであろう.AAA+リングの裏側には6本のαへリックスと不完全なβバレル構造により構成されるCシークエンスとよばれる構造が存在した.Cシークエンスの外形は非常に平坦で,AAA1,AAA5,AAA6のαサブモジュールを裏打ちするように広がっていた(図2b,図4 c, d).ちなみに,出芽酵母に由来する細胞質ダイニンはもともと不完全なβバレル構造に相当する配列を欠失しており,Cシークエンスの構造は大きく異なっていた15).
以前に報告された中程度の分解能のX線結晶構造と比べ,全体構造は2次構造のレベルではよく一致していた.しかしながら,最近になりあいついで報告された原子レベルでの立体構造はダイニンの構造機能相関を議論するのに十分な解像度および精度をもち,ヌクレオチドとの結合やヌクレオチドの状態に依存した構造の変化がアミノ酸残基のレベルで議論された17-19).
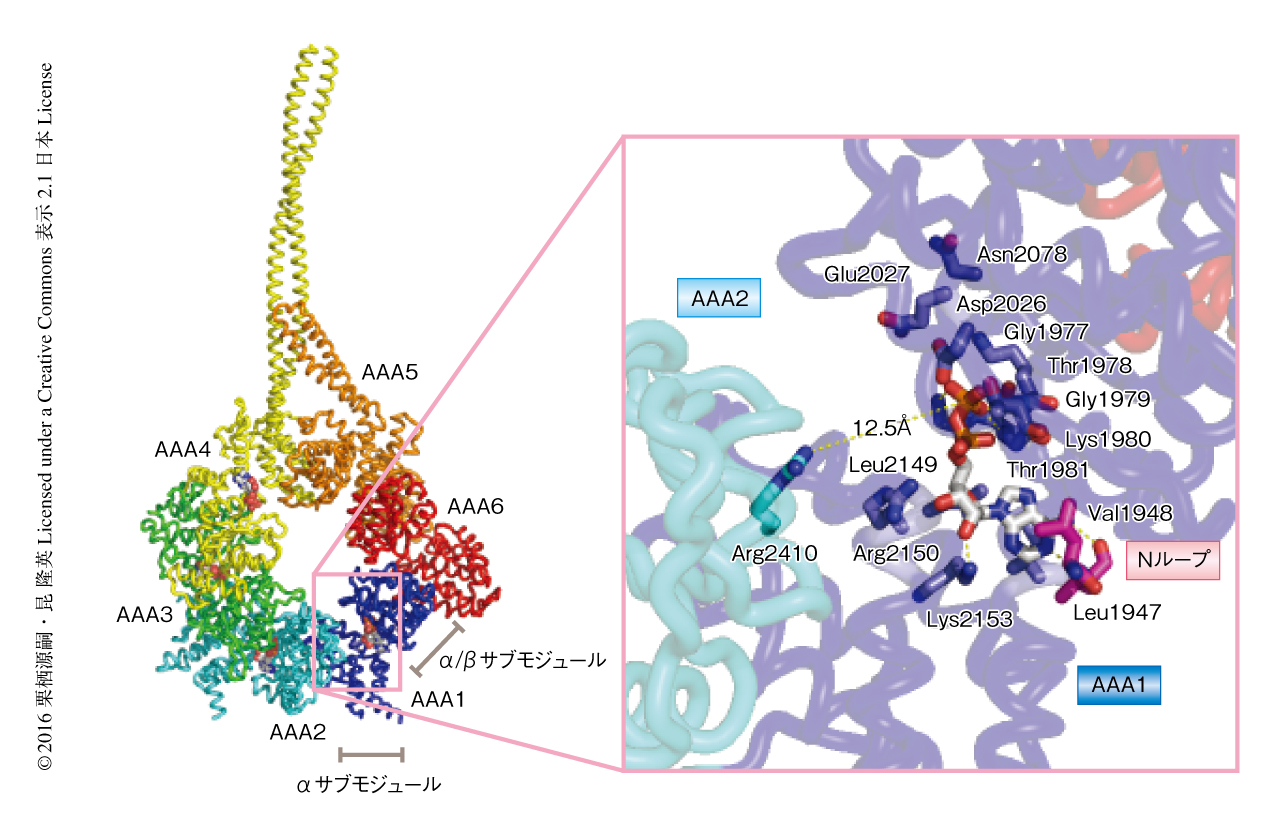
細胞性粘菌に由来する細胞質ダイニンのモータードメインには,AAA1~AAA4のおのおののAAA+モジュールに4つのADP分子が結合していた17).ヌクレオチド結合部位は,おのおののAAA+モジュールのα/βサブモジュールとαサブモジュール,および,となりのAAA+モジュールに位置するα/βサブモジュールから構成されていた(図2a,図3).この相対的な配置はほかのAAA+型ATPaseと共通であった.運動活性を担うAAA1のATPase部位に結合したADPは,そのリン酸部分がAAA1のα/βサブモジュールにあるWalker-A配列(Gly1977~Thr1981)により認識され,リボース部分はAAA1のαサブモジュールに位置するSensor-II配列(Arg2150)とその周辺の残基(Leu2149,Lys2153)により認識されていた(図3).アデニン塩基部分はAAA1のαサブモジュールに位置する疎水性残基と,リンカーとAAA1のATPase部位とをつなぐNループ(Leu1947,Val1948)により認識されていた(図3).
細胞質ダイニンはATP,GTP,CTP,TTPのすべてのヌクレオチドを加水分解することができるが,モーター活性にはATPが必須であることを考えると,Nループによるアデニン塩基部位の認識は,リンカーのはたらきとのなんらかのつながりを連想させた.AAA1モジュールのα/βサブモジュールにあるWalker-B配列(Asp2026,Glu2027)とSensor-I配列(Asn2078)は,一般にATPの加水分解に寄与するとされる.これらの配列もAAA1のATPase部位に位置していた.さらに,ATPの加水分解に必須のアルギニンフィンガー配列(Arg2410)がとなりのAAA2にあるα/βサブモジュールから延びており,距離は遠いもののADPの結合している方向に配置していた(図3).
AAA2~AAA4のヌクレオチド結合部位はAAA1とほぼ同様の構造の骨格をしていたが,AAA2のヌクレオチド結合部位だけがいろいろな意味で少し異なった状況にあった.Sensor-II配列を欠失していたこと,Walker-B配列のうちATPの加水分解に必須のGluがGly2357と置換していたこと,AAA3から延びるアルギニンフィンガー配列(Arg2806,Arg2809)が加水分解産物であるADPとすでに強固な結合を形成していたこと,である.これらのAAA2に特徴的なヌクレオチドとの結合の様式から,AAA2はADPあるいはATPと結合することはできるものの加水分解することはできないことが示唆された.AAA1,AAA3,AAA4はATPの結合および加水分解に必要なアミノ酸残基の側鎖が典型的な位置に配置されており,細胞質ダイニンは3つのATPase部位をもつことが強く示唆された.実際,これらの構造的な知見は変異体の機能解析の結果とも一致し,細胞質ダイニンのモータードメインはAAA1,AAA3,AAA4の3カ所のATPase部位をもつことが明らかにされた.
微小管結合部位を欠失した変異型モータードメインA分子のAAA+リング構造は非常に特徴的な配置をとっていた(図5).αサブモジュールはほぼ均等に疑似6回対称にて配置していたが,α/βサブモジュールは非対称に配置されており,AAA5-AAA6-AAA1から構成される半円構造とAAA2-AAA3-AAA4から構成される半円構造とに区別された.2つの半円構造どうしには直接の相互作用はなく,AAA+リングに溝を構成していた.α/βサブモジュールの非対称な配置は,出芽酵母に由来する細胞質ダイニンの中程度の分解能での結晶構造において指摘されたAAA1-AAA2とAAA5-AAA6とのあいだにのみ形成された溝とは異なる相対配置であるといえた15).
AAA1とAAA2のあいだおよびAAA4とAAA5のあいだの2つの溝にはAAA1およびAAA4のヌクレオチド結合部位が位置していた17).それぞれ,AAA2(Arg2410)から,および,AAA5(Arg3780)からのアルギニンフィンガー配列が少しはなれたADP分子のほうに配向しており,ATPの加水分解の際には近傍へ移動すると考えられた(図3).AAA1とAAA4とでATPが加水分解される場合,ATP加水分解サイクルにともない2つの溝が閉じ,結果として,アルギニンフィンガー配列はATPのγ-リン酸と結合できるのだろう.実際に,野生型モータードメインA分子のAAA+リング構造は比較的閉じた構造をとっており,アルギニンフィンガー配列とADPとの距離を縮めていた.野生型モータードメインと微小管結合部位を欠失した変異型モータードメインは同じヌクレオチド状態にて構造決定されているが,検出された構造の差違から,ほかのAAA+型ATPaseにおいてみられるようなATPaseに依存的なAAA+リングの開閉の存在が示唆された.また,ヒトのダイニン-2のADPおよびリン酸のアナログとしてバナジン酸と結合させた構造においては,AAA1とAAA2とのあいだの溝は閉じた構造となっていた19).
電子顕微鏡による低分解能での解析や10,11),蛍光共鳴エネルギー移動(fluorescence resonance energy transfer,FRET)法によるリンカーの運動性の解析から14),リンカーのスイング運動が力の発生を担うことが考えられていた.細胞質ダイニンの運動の分子機構を理解するうえで,ATPの加水分解の起こるAAA+リングとスイング運動をするリンカーとの相互作用を構造的に可視化することはきわめて重要である.ADP結合状態の構造においては,電子顕微鏡により解析された構造において確認されていたポスト-パワーストローク状態の位置にリンカーが位置していると思われた10,11).AAA+リングを表面からみた場合,リンカーはAAA1から延びてAAA2およびAAA3の内側上部をまたぎAAA4に到達していた17)(図2 b, c).しかし,リンカーとAAA+リングとの相互作用は非常に限定的で,AAA1-AAA6およびAAA2の2カ所に集約された(図4a).AAA1-AAA6との相互作用はリンカーの基部がAAA1のα/βサブモジュールにつながる部分に位置しており,リンカーのサブドメイン3およびサブドメイン4が,AAA1のα/βサブモジュールおよびαサブモジュール,AAA6のαサブモジュールにはさまれた状態にて相互作用していた.
AAA2とリンカーとの相互作用はリンカーの中央部に位置する領域にも存在した(図4a).ここでは,AAA2から延びている2つの挿入配列,H2ヘリックス挿入配列のβヘアピン構造およびプレSensor 1挿入配列のループ構造がリンカーのサブドメイン2およびサブドメイン3と相互作用していた(図4a).H2ヘリックス挿入配列は,リンカーのサブドメイン2にあるβ1構造,β2構造,H7へリックスと相互作用しており,プレSensor 1挿入配列はサブドメイン3のH13へリックスと相互作用していた.これらH2ヘリックス挿入配列およびプレSensor 1挿入配列の指状の構造がリンカーの構造をささえていることが明らかにされた.
典型的なリンカースイングモデルにおいては,力を発生したのちのポスト-パワーストローク状態では,リンカーのN末端側はAAA4あるいはAAA5と結合していなければならない.AAA1におけるATP加水分解サイクルにより構造変化が誘起され,AAA4あるいはAAA5と結合しているリンカーがはなれて,リンカーがAAA2の方向にスイング運動するというモデルである10,11,14).筆者らは,微小管結合部位を欠失した変異型モータードメインA分子の結晶構造をもとに,AAA3~AAA5とリンカーとのあいだには直接の相互作用がないことを確認し,別の機構を提唱した17).AAA2モジュールにあるH2ヘリックス挿入配列とプレSensor 1挿入配列がリンカーのスイング運動に重要な役割を担うとするものである(図5).ほかのAAA+タンパク質においては,H2ヘリックス挿入配列やプレSensor 1挿入配列が対象となるタンパク質やDNAをつかまえたり再配向させたりする相互作用部位になっている21,22).細胞質ダイニンも,リンカーの構造を変換する装置としてH2ヘリックス挿入配列およびプレSensor 1挿入配列を利用していると考察した.実際に,H2ヘリックス挿入配列やプレSensor 1挿入配列がリンカーのサブドメイン2とサブドメイン3のあいだに構造変化をひき起こせば,リンカーは折れ曲がりAAA+リングに対しスイング運動することができるだろう.サブドメイン2とサブドメイン3のあいだはH10へリックスのみでつながったリンカーのもっとも細い部分に相当し,このモデルは構造的にも強くサポートされた.
ヒトのダイニン-2のADPおよびリン酸のアナログとしてバナジン酸と結合させたプレ-パワーストローク状態の結晶構造においては(図2e,図4b),リンカーのH10へリックスが折れ曲がりリンカーがAAA2のほうをむいていた19).機能解析の結果からも,AAA1におけるATP加水分解サイクルにともないAAA1とAAA2のあいだでのAAA+リングの開閉が誘起されリンカーがスイング運動することはまちがいない14).ヒトのダイニン-2の構造の報告においては,AAA2-AAA3-AAA4の半円状に配置したα/βサブドメインがリンカーのN末端側と立体障害をひき起こすことによりリンカーがスイング運動するという機構が提唱されている19).AAA+リングの表面に位置するα/βサブドメインがリンカーのスイング運動を駆動する分子装置であるとする筆者らのモデルは,複数の結晶構造によりサポートされたと考えている.
細胞質ダイニンの運動の機構を考えるうえでもうひとつ重要なのは,距離的にはなれた機能ドメインで起こる,微小管結合部位における微小管との結合,および,AAA1におけるATPの加水分解の2つの状態の情報を,どのように分子内で伝達しているのかという点である.細胞質ダイニンのモータードメインの構造においては,ストークおよびストラットからなるコイルドコイル構造をとる領域がもっとも構造的に可変性が高い10,11).そのため,ヒトのダイニン-2の構造においてはストークおよびストラットの全長を含んで解析されてはいるものの分子モデルはポリアラニンにより構築されており19),出芽酵母に由来する細胞質ダイニンのモータードメインの構造解析においてはストークを欠失させたコンストラクトが用いられている15,18).細胞性粘菌に由来する細胞質ダイニンの微小管結合部位を欠失した変異型モータードメインA分子は,典型的な逆平行コイルドコイル構造をとるまっすぐに伸びたストークおよびストラットをもつ17).対照的に,微小管結合部位を欠失した変異型モータードメインB分子においてストークは少し倒れた位置にありやや短いコイルドコイル構造をもつ.野生型モータードメインA分子では微小管結合部位との結合領域の付近のCC2へリックスの一部が2次構造をとっておらず,微小管結合部位を欠失した変異型モータードメインと好対照をなしている17).
ストークおよびストラットのもつ構造の大きな可塑性から,微小管結合部位とAAA+リングのあいだの双方向の情報の伝達機構との相関が示唆された.現在,ストークを介した情報の伝達のしくみとして,へリックススライディングモデルが広く受け入れられている23,24).このモデルは,逆平行コイルドコイルの関係にある2本のへリックスが相対的にずれることにより,微小管結合部位とAAA+リングとのあいだで情報を伝達するというものである.細胞質ダイニンのモータードメインの構造解析からは,情報の伝達の途中でストークだけでなくストークとストラットが一体となって相対配置を変化させるモデルが提唱された.ストラットのコイルドコイル構造の先端の部分はストークの中心の部分と水素結合や疎水性相互作用により強く結合しており,その相互作用の面積は800Å2にもおよぶ(図2 b, c,図4c).この広範な相互作用から,アロステリックな情報の伝達においてストークとストラットとが一体構造として機能することが強く示唆される.
アロステリックな情報の伝達経路については,ヒトのダイニン-2のADPおよびリン酸のアナログとしてバナジン酸と結合させた構造が解析されたことにより,その分子内における構造変化が詳細に議論されるようになった.この報告においては,AAA1におけるヌクレオチドの状態の変化により,ADP結合型と比べAAA5のα/βサブモジュールとAAA6のαサブモジュールとが一体となりAAA+リングに対し回転するとしている19).筆者らは,ストークおよびストラットからAAA1までの情報の伝達経路として,AAA+リングの裏面,とくに,Cシークエンスの重要性を指摘したい.以前に,Cシークエンスの一部を欠損させた変異体がモーター活性を失うことが報告されている25).とくに,Cシークエンスの最初に位置するH1へリックスは構造においてたいへん重要であり,高分解能の構造解析によりはじめて同定されたAAA5エクステンションと一体となった球状の構造を形成していた.H1へリックスからの長いループ構造により結合したCシークエンスの残りの部分は平坦な構造をとりAAA+リングを裏打ちするように配置されていた(図4 c, d).ADP結合型の構造ではCシークエンスはAAA1,AAA5,AAA6とのみ相互作用しているのに対し(図4c),ADPおよびリン酸のアナログとしてバナジン酸と結合させた構造では,それにくわえAAA2およびAAA3のαサブモジュールと密に相互作用していた(図4d).これは,AAA5のα/βサブモジュールおよびAAA6のαサブモジュールのAAA+リングに対する回転の範囲を規定する構造的な要因なのかもしれない.これまでの構造解析と機能解析の結果を総合的に判断して,微小管結合部位とAAA1のATPase部位との情報の伝達経路として,ストークとストラットおよびAAA+リングの裏面に位置するCシークエンスが機能するというモデルを提唱する.
2012年に筆者らにより2.8Å分解能で構造解析された細胞性粘菌に由来する細胞質ダイニンのモータードメインを筆頭として,同じ年に3.3Å分解能で構造解析された出芽酵母に由来する細胞質ダイニン,2015年に3.4Å分解能で構造解析されたADPおよびリン酸のアナログとしてバナジン酸と結合させた状態のヒトのダイニン-2と,最近になり,アミノ酸残基のレベルで議論されるような細胞質ダイニンの原子構造があいついで報告された.細胞質ダイニンのモータードメインはAAA+タンパク質に共通したAAA+リング構造をもち,細胞質ダイニンに固有の機能ユニットとしてリンカー,ストークおよびストラット,CシークエンスをAAA+リングの両面に配置した非常に特徴的な構造をとっていた.複数の原子構造が明らかにされたことにより,ダイニンがどのようにして微小管のうえを移動する運動活性を獲得したのか,新しい視点が提供された.
最後に,運動活性に必須のパワーストロークとアロステリックな制御の2点にしぼり,その分子モデルを提唱する(図5).AAA+リングの表面には,ほかのAAA+タンパク質と同様のしくみにより駆動されるリンカーのスイング運動を駆動する分子装置がある.すなわち,AAA1とAAA2のあいだで起こるATPの加水分解にともなうAAA+リングの開閉が直接のひき金となり,リンカーの構造変化をひき起こす分子装置がAAA2-AAA3-AAA4の半円構造に組み込まれている.AAA+リングの裏面には,ストークおよびストラット,AAA5エクステンション,Cシークエンスの構造をとおしてAAA1と微小管結合部位とをつなぐ長距離の情報の伝達装置が配置されており,ATP加水分解サイクルにともない微小管との親和性を制御する細胞質ダイニンに固有の機能を発揮している.細胞質ダイニンのモータードメインは,AAA+型ATPaseの一般性と細胞質ダイニンに固有の機能とがうまく配置された,秀逸なモータータンパク質であるといえるだろう.
略歴:1997年 大阪大学大学院工学研究科博士課程 修了,同年 大阪大学蛋白質研究所 助手,2004年 東京大学大学院総合文化研究科 助教授を経て,2009年より大阪大学蛋白質研究所 教授.
研究テーマ:構造生物学,タンパク質結晶学.
関心事:X線結晶構造解析のできるタンパク質の大きさおよび解析の精度の限界.
昆 隆英(Takahide Kon)
略歴:2000年 東京大学大学院総合文化研究科博士課程 修了,同年 同 助手,2010年 大阪大学蛋白質研究所 准教授,2013年 法政大学生命科学部 教授を経て,2015年より大阪大学大学院理学研究科 教授.
研究テーマ:生物物理学,タンパク質科学.
関心事:タンパク質の原子構造から細胞における一方向性の過程をどこまで説明できるか.
© 2016 栗栖源嗣・昆 隆英 Licensed under CC 表示 2.1 日本
(1大阪大学蛋白質研究所 蛋白質構造生物学研究部門,2大阪大学大学院理学研究科 生物科学専攻分子細胞運動学研究室)
email:栗栖源嗣
領域融合レビュー, 5, e001 (2016) DOI: 10.7875/leading.author.5.e001
Genji Kurisu & Takahide Kon: Crystal structure of the cytoplasmic dynein motor domain.
要 約
ダイニンはATPに依存して微小管のうえを滑り運動するモータータンパク質であり,鞭毛運動および繊毛運動を駆動する軸糸ダイニンと,細胞内輸送や染色体の分離を担う細胞質ダイニンとに分類される.生体において複数のサブユニットから構成される生体超分子複合体として機能しており,モーター活性は重鎖にあるが,その重鎖だけでも500 kDaをこえる巨大なタンパク質である.その巨大さと特徴的な構造から,ダイニンの構造生物学的な研究は天然に大量に存在する軸糸ダイニンを使った電子顕微鏡による解析が先行した.細胞質ダイニンのモータードメインの組換え体を調製する系が確立されてから研究は劇的に進展し,2011年から,たてつづけにX線結晶構造が決定された.ここでは,筆者らにより決定された細胞性粘菌に由来する細胞質ダイニンのモータードメインの結晶構造を中心に,出芽酵母およびヒトに由来する細胞質ダイニンのモータードメインの結晶構造を参照しながら,細胞質ダイニンの運動機構について解説する.
はじめに
ダイニンはATPに依存して微小管のうえを滑り運動するモータータンパク質であり1),鞭毛運動および繊毛運動を駆動する軸糸ダイニンと2-4),細胞内輸送や染色体の分離を担う細胞質ダイニン5,6) とに分類される.ダイニンは重鎖,中間鎖,中軽鎖,軽鎖など複数のサブユニットから構成される生体超分子複合体であり,その大きさは1000 kDaをこえる.生物学的にきわめて重要なタンパク質であるにもかかわらず巨大であるがゆえ,同じモータータンパク質であるキネシンやミオシンに比べ運動機構についての解明は遅れていた.しかしながら,細胞質ダイニンのモータードメインの組換え体を調製する系が確立されてから研究はいちじるしく進展した.このレビューにおいては,この細胞質ダイニンを中心として,最近のX線結晶構造解析について解説する.
ダイニンの運動活性はAAA+ファミリーに属する重鎖が担う7).このAAA+ファミリーには,タンパク質の分解,タンパク質複合体の解離,複製,DNAの組換えなど,非常に多岐にわたる細胞機能を担うタンパク質が含まれる8).これらAAA+タンパク質はAAA+モジュールとよばれる共通の構造ユニットをもち,通常はリング状に会合した多量体として機能する9).ダイニンの重鎖も6個のAAA+モジュールからなるリング構造をとるが10,11),ほかのAAA+タンパク質とは異なり,6個のAAA+モジュールがつながって1本のポリペプチド鎖を形成している7).
アミノ酸配列の解析および電子顕微鏡による低分解能の構造解析により,ダイニンの重鎖にはストークおよびリンカーとよばれる2つの特徴的な機能ユニットの存在することがわかっていた(図1).ストークはAAA+リングから突き出たコイルドコイル構造で,その先端部に位置する小さな球状の構造が微小管結合部位である12,13).一方,リンカーは力の発生を担う機能ユニットである.リンカーのさきにはテイルとよばれる二量体化ドメインがあり,中間鎖や軽鎖などとの結合にかかわる10,11,14)(図1a).リンカーが力の発生を担うためには,力の発生する前後に構造が変化する必要がある.また,AAA+リングから大きくはなれた位置にある微小管結合部位がAAA+リングにおけるATPの加水分解と同調して微小管に対する親和性を変化させる必要がある(図1b).しかし最近まで,高分解能での構造情報がなかったため,ダイニンの運動に必須であるこれらのしくみについて,その構造基盤は謎につつまれたままであった.
2011年,細胞質ダイニンのモータードメインの結晶構造が中程度の分解能で報告され,2次構造のレベルでその分子構造が記述された15,16).しかし,分解能が十分でないことから,ほかのモータータンパク質と比べ構造機能相関の解明は不十分な状態にあった.2012年,力を発生したのち(ポスト-パワーストローク状態)の高分解能のX線結晶構造が報告された17,18).筆者らにより,細胞性粘菌Dictyostelium discoideumに由来する細胞質ダイニンのADP結合状態の結晶構造が2.8Å分解能で,また,出芽酵母に由来する細胞質ダイニンのヌクレオチドを含まないアポ状態の結晶にADPあるいはATPアナログを浸透させた構造が3.3Å分解能で決定されたのである.2015年に3.4Å分解能で決定された,力を発生するまえ(プレ-パワーストローク状態)の,ヒトのダイニン-2のADPおよびリン酸のアナログとしてバナジン酸と結合させた状態の結晶構造とあわせ19),このレビューでは,細胞質ダイニンの運動活性および力の発生の構造基盤について解説する.
1.細胞質ダイニンのモータードメインの全体構造
筆者らは,細胞性粘菌に由来する細胞質ダイニンの380 kDaの野生型のモータードメインと,微小管結合部位を欠失した変異型モータードメインを用いた(図2a).野生型モータードメインは微小管のない条件では基底状態のATPase活性を示すが,微小管の添加によりATPaseが活性化される.一方,微小管結合部位を欠失した変異型モータードメインは微小管と結合しないが,ATPase活性は野生型モータードメインが発揮しうる最大の活性を示し,活性化の状態に固定されている20).野生型モータードメインの結晶構造は,微小管結合部位を欠失した変異型モータードメインの構造モデルを用いた分子置換法により決定した.構造の精密化は3.8Å分解能で行い,結晶学的にも十分な精度で構造が決定された(PDB ID:3VKH,図2b).微小管結合部位を欠失した変異型モータードメインの構造決定には,TaおよびW,さらにセレノメチオニンに置換した重原子誘導体の結晶による同型置換法を適用した.その結果,N末端側の22残基,構造をとらないループ構造,欠失させた微小管結合部位のほか,約90%に相当する分子モデルを構築することができた.得られた分子モデルは2.8Å分解能で構造の精密化を行い,十分な信頼度因子をもって構造が決定された(PDB ID:3VKG,図2c).
筆者らに先行した構造決定においては,出芽酵母に由来する細胞質ダイニンのモータードメインにつきストークおよび微小管結合部位を欠失した変異体が用いられた(図2a).最初に,ヌクレオチドを含まないアポ型の結晶構造が6.0Å分解能で報告された(PDB ID:3QMZ,図2d).その初期構造は,ホモロジーモデルにより推測されたループ構造,および,実験的に決定された2次構造から構築された15).
また,昆虫細胞で発現させた組換え体としてヒトのダイニン-2のモータードメインの構造が決定された.ADPおよびリン酸のアナログとしてバナジン酸と結合させることによりプレ-パワーストローク状態へと固定されている.構造の決定には,筆者らが決定した微小管結合部位を欠失した変異型モータードメインの構造をサーチモデルとした分子置換法が用いられている.構造の精密化は3.4Å分解能で行い,十分な信頼度因子で構造が決定されている19)(PDB ID:4RH7,図2e).
出芽酵母に由来するストークおよび微小管結合部位を欠失した変異型モータードメインの結晶と,細胞性粘菌に由来する野生型モータードメインおよび微小管結合部位を欠失した変異型モータードメインの結晶は,結晶学的な非対称単位中に2分子のモータードメインを含んでいた17).機能の詳細に関係する細部の構造は個々に異なっていたものの,既報の構造はすべて全体としてはほぼ同じ構造をとっていた.したがって,以下では,非対称単位中の2分子のモータードメインのうち,もっともモデルの構築率が高く分解能のよいA分子について構造を解説する.
モータードメインは,中心のAAA+リング構造と,リンカー,ストークおよびストラット,Cシークエンスの3つの構造ユニットから構成されていた(図2).ATPase活性のある中心のAAA+リングは6つのAAA+モジュールAAA1~AAA6をもち,おのおののモジュールが順番にリング状に並んだ配列になっていた.AAA+リングの直径は130Å,厚さは65Å,中心には直径35Åの孔のある構造をしていた.おのおののAAA+モジュールのN末端側にはロスマンフォールドをとるα/βサブモジュールがあり,C末端側にはαサブモジュールが位置していた(図2a,図3).この2つのサブモジュールはそれぞれリング構造の表面および裏面を構成していた.AAA1からAAA4のおのおののAAA+モジュールはそれぞれユニークな挿入配列をもち,その挿入位置から,H2へリックスに挿入されているH2ヘリックス挿入配列,Walker B配列のまえに挿入されているプレWalker B挿入配列,Sensor 1配列のまえに挿入されているプレSensor 1挿入配列と名づけられた.さらに,AAA5モジュールには8本のαへリックスからなる大きな球状のドメインがあり,AAA5エクステンションと名づけられた(図2b).
N末端側から順にAAA+リング以外の構造をみていく.1つ目は,AAA+リングの上部をAAA4からAAA1にむけて延びるリンカーである.リンカーは19本のαへリックスと8本のβストランドからなるロッド状の構造をしており,サブドメイン0~サブドメイン4の5つに分割された(図4 a, b).2つ目は,AAA4から延びた長いストークとAAA5から延びた短いストラットからなるコイルドコイル構造をとる領域である(図2 b, c, e).ストラットの存在は中程度の分解能のX線結晶構造によりはじめて明らかにされた15,16).野生型モータードメインA分子の構造モデルにおいてはストークのさきに微小管結合部位が確認されたが,野生型モータードメインB分子において微小管結合部位は確認されなかった17).B分子において微小管結合部位に相当する電子密度が同定されなかったのは,おそらく,微小管結合部位の運動性が高いためであろう.AAA+リングの裏側には6本のαへリックスと不完全なβバレル構造により構成されるCシークエンスとよばれる構造が存在した.Cシークエンスの外形は非常に平坦で,AAA1,AAA5,AAA6のαサブモジュールを裏打ちするように広がっていた(図2b,図4 c, d).ちなみに,出芽酵母に由来する細胞質ダイニンはもともと不完全なβバレル構造に相当する配列を欠失しており,Cシークエンスの構造は大きく異なっていた15).
以前に報告された中程度の分解能のX線結晶構造と比べ,全体構造は2次構造のレベルではよく一致していた.しかしながら,最近になりあいついで報告された原子レベルでの立体構造はダイニンの構造機能相関を議論するのに十分な解像度および精度をもち,ヌクレオチドとの結合やヌクレオチドの状態に依存した構造の変化がアミノ酸残基のレベルで議論された17-19).
2.ヌクレオチド結合部位
細胞性粘菌に由来する細胞質ダイニンのモータードメインには,AAA1~AAA4のおのおののAAA+モジュールに4つのADP分子が結合していた17).ヌクレオチド結合部位は,おのおののAAA+モジュールのα/βサブモジュールとαサブモジュール,および,となりのAAA+モジュールに位置するα/βサブモジュールから構成されていた(図2a,図3).この相対的な配置はほかのAAA+型ATPaseと共通であった.運動活性を担うAAA1のATPase部位に結合したADPは,そのリン酸部分がAAA1のα/βサブモジュールにあるWalker-A配列(Gly1977~Thr1981)により認識され,リボース部分はAAA1のαサブモジュールに位置するSensor-II配列(Arg2150)とその周辺の残基(Leu2149,Lys2153)により認識されていた(図3).アデニン塩基部分はAAA1のαサブモジュールに位置する疎水性残基と,リンカーとAAA1のATPase部位とをつなぐNループ(Leu1947,Val1948)により認識されていた(図3).
細胞質ダイニンはATP,GTP,CTP,TTPのすべてのヌクレオチドを加水分解することができるが,モーター活性にはATPが必須であることを考えると,Nループによるアデニン塩基部位の認識は,リンカーのはたらきとのなんらかのつながりを連想させた.AAA1モジュールのα/βサブモジュールにあるWalker-B配列(Asp2026,Glu2027)とSensor-I配列(Asn2078)は,一般にATPの加水分解に寄与するとされる.これらの配列もAAA1のATPase部位に位置していた.さらに,ATPの加水分解に必須のアルギニンフィンガー配列(Arg2410)がとなりのAAA2にあるα/βサブモジュールから延びており,距離は遠いもののADPの結合している方向に配置していた(図3).
AAA2~AAA4のヌクレオチド結合部位はAAA1とほぼ同様の構造の骨格をしていたが,AAA2のヌクレオチド結合部位だけがいろいろな意味で少し異なった状況にあった.Sensor-II配列を欠失していたこと,Walker-B配列のうちATPの加水分解に必須のGluがGly2357と置換していたこと,AAA3から延びるアルギニンフィンガー配列(Arg2806,Arg2809)が加水分解産物であるADPとすでに強固な結合を形成していたこと,である.これらのAAA2に特徴的なヌクレオチドとの結合の様式から,AAA2はADPあるいはATPと結合することはできるものの加水分解することはできないことが示唆された.AAA1,AAA3,AAA4はATPの結合および加水分解に必要なアミノ酸残基の側鎖が典型的な位置に配置されており,細胞質ダイニンは3つのATPase部位をもつことが強く示唆された.実際,これらの構造的な知見は変異体の機能解析の結果とも一致し,細胞質ダイニンのモータードメインはAAA1,AAA3,AAA4の3カ所のATPase部位をもつことが明らかにされた.
3.AAA+リング構造の開閉
微小管結合部位を欠失した変異型モータードメインA分子のAAA+リング構造は非常に特徴的な配置をとっていた(図5).αサブモジュールはほぼ均等に疑似6回対称にて配置していたが,α/βサブモジュールは非対称に配置されており,AAA5-AAA6-AAA1から構成される半円構造とAAA2-AAA3-AAA4から構成される半円構造とに区別された.2つの半円構造どうしには直接の相互作用はなく,AAA+リングに溝を構成していた.α/βサブモジュールの非対称な配置は,出芽酵母に由来する細胞質ダイニンの中程度の分解能での結晶構造において指摘されたAAA1-AAA2とAAA5-AAA6とのあいだにのみ形成された溝とは異なる相対配置であるといえた15).
AAA1とAAA2のあいだおよびAAA4とAAA5のあいだの2つの溝にはAAA1およびAAA4のヌクレオチド結合部位が位置していた17).それぞれ,AAA2(Arg2410)から,および,AAA5(Arg3780)からのアルギニンフィンガー配列が少しはなれたADP分子のほうに配向しており,ATPの加水分解の際には近傍へ移動すると考えられた(図3).AAA1とAAA4とでATPが加水分解される場合,ATP加水分解サイクルにともない2つの溝が閉じ,結果として,アルギニンフィンガー配列はATPのγ-リン酸と結合できるのだろう.実際に,野生型モータードメインA分子のAAA+リング構造は比較的閉じた構造をとっており,アルギニンフィンガー配列とADPとの距離を縮めていた.野生型モータードメインと微小管結合部位を欠失した変異型モータードメインは同じヌクレオチド状態にて構造決定されているが,検出された構造の差違から,ほかのAAA+型ATPaseにおいてみられるようなATPaseに依存的なAAA+リングの開閉の存在が示唆された.また,ヒトのダイニン-2のADPおよびリン酸のアナログとしてバナジン酸と結合させた構造においては,AAA1とAAA2とのあいだの溝は閉じた構造となっていた19).
4.リンカーとAAA+リングとの相互作用
電子顕微鏡による低分解能での解析や10,11),蛍光共鳴エネルギー移動(fluorescence resonance energy transfer,FRET)法によるリンカーの運動性の解析から14),リンカーのスイング運動が力の発生を担うことが考えられていた.細胞質ダイニンの運動の分子機構を理解するうえで,ATPの加水分解の起こるAAA+リングとスイング運動をするリンカーとの相互作用を構造的に可視化することはきわめて重要である.ADP結合状態の構造においては,電子顕微鏡により解析された構造において確認されていたポスト-パワーストローク状態の位置にリンカーが位置していると思われた10,11).AAA+リングを表面からみた場合,リンカーはAAA1から延びてAAA2およびAAA3の内側上部をまたぎAAA4に到達していた17)(図2 b, c).しかし,リンカーとAAA+リングとの相互作用は非常に限定的で,AAA1-AAA6およびAAA2の2カ所に集約された(図4a).AAA1-AAA6との相互作用はリンカーの基部がAAA1のα/βサブモジュールにつながる部分に位置しており,リンカーのサブドメイン3およびサブドメイン4が,AAA1のα/βサブモジュールおよびαサブモジュール,AAA6のαサブモジュールにはさまれた状態にて相互作用していた.
AAA2とリンカーとの相互作用はリンカーの中央部に位置する領域にも存在した(図4a).ここでは,AAA2から延びている2つの挿入配列,H2ヘリックス挿入配列のβヘアピン構造およびプレSensor 1挿入配列のループ構造がリンカーのサブドメイン2およびサブドメイン3と相互作用していた(図4a).H2ヘリックス挿入配列は,リンカーのサブドメイン2にあるβ1構造,β2構造,H7へリックスと相互作用しており,プレSensor 1挿入配列はサブドメイン3のH13へリックスと相互作用していた.これらH2ヘリックス挿入配列およびプレSensor 1挿入配列の指状の構造がリンカーの構造をささえていることが明らかにされた.
典型的なリンカースイングモデルにおいては,力を発生したのちのポスト-パワーストローク状態では,リンカーのN末端側はAAA4あるいはAAA5と結合していなければならない.AAA1におけるATP加水分解サイクルにより構造変化が誘起され,AAA4あるいはAAA5と結合しているリンカーがはなれて,リンカーがAAA2の方向にスイング運動するというモデルである10,11,14).筆者らは,微小管結合部位を欠失した変異型モータードメインA分子の結晶構造をもとに,AAA3~AAA5とリンカーとのあいだには直接の相互作用がないことを確認し,別の機構を提唱した17).AAA2モジュールにあるH2ヘリックス挿入配列とプレSensor 1挿入配列がリンカーのスイング運動に重要な役割を担うとするものである(図5).ほかのAAA+タンパク質においては,H2ヘリックス挿入配列やプレSensor 1挿入配列が対象となるタンパク質やDNAをつかまえたり再配向させたりする相互作用部位になっている21,22).細胞質ダイニンも,リンカーの構造を変換する装置としてH2ヘリックス挿入配列およびプレSensor 1挿入配列を利用していると考察した.実際に,H2ヘリックス挿入配列やプレSensor 1挿入配列がリンカーのサブドメイン2とサブドメイン3のあいだに構造変化をひき起こせば,リンカーは折れ曲がりAAA+リングに対しスイング運動することができるだろう.サブドメイン2とサブドメイン3のあいだはH10へリックスのみでつながったリンカーのもっとも細い部分に相当し,このモデルは構造的にも強くサポートされた.
ヒトのダイニン-2のADPおよびリン酸のアナログとしてバナジン酸と結合させたプレ-パワーストローク状態の結晶構造においては(図2e,図4b),リンカーのH10へリックスが折れ曲がりリンカーがAAA2のほうをむいていた19).機能解析の結果からも,AAA1におけるATP加水分解サイクルにともないAAA1とAAA2のあいだでのAAA+リングの開閉が誘起されリンカーがスイング運動することはまちがいない14).ヒトのダイニン-2の構造の報告においては,AAA2-AAA3-AAA4の半円状に配置したα/βサブドメインがリンカーのN末端側と立体障害をひき起こすことによりリンカーがスイング運動するという機構が提唱されている19).AAA+リングの表面に位置するα/βサブドメインがリンカーのスイング運動を駆動する分子装置であるとする筆者らのモデルは,複数の結晶構造によりサポートされたと考えている.
5.アロステリックな情報の伝達経路
細胞質ダイニンの運動の機構を考えるうえでもうひとつ重要なのは,距離的にはなれた機能ドメインで起こる,微小管結合部位における微小管との結合,および,AAA1におけるATPの加水分解の2つの状態の情報を,どのように分子内で伝達しているのかという点である.細胞質ダイニンのモータードメインの構造においては,ストークおよびストラットからなるコイルドコイル構造をとる領域がもっとも構造的に可変性が高い10,11).そのため,ヒトのダイニン-2の構造においてはストークおよびストラットの全長を含んで解析されてはいるものの分子モデルはポリアラニンにより構築されており19),出芽酵母に由来する細胞質ダイニンのモータードメインの構造解析においてはストークを欠失させたコンストラクトが用いられている15,18).細胞性粘菌に由来する細胞質ダイニンの微小管結合部位を欠失した変異型モータードメインA分子は,典型的な逆平行コイルドコイル構造をとるまっすぐに伸びたストークおよびストラットをもつ17).対照的に,微小管結合部位を欠失した変異型モータードメインB分子においてストークは少し倒れた位置にありやや短いコイルドコイル構造をもつ.野生型モータードメインA分子では微小管結合部位との結合領域の付近のCC2へリックスの一部が2次構造をとっておらず,微小管結合部位を欠失した変異型モータードメインと好対照をなしている17).
ストークおよびストラットのもつ構造の大きな可塑性から,微小管結合部位とAAA+リングのあいだの双方向の情報の伝達機構との相関が示唆された.現在,ストークを介した情報の伝達のしくみとして,へリックススライディングモデルが広く受け入れられている23,24).このモデルは,逆平行コイルドコイルの関係にある2本のへリックスが相対的にずれることにより,微小管結合部位とAAA+リングとのあいだで情報を伝達するというものである.細胞質ダイニンのモータードメインの構造解析からは,情報の伝達の途中でストークだけでなくストークとストラットが一体となって相対配置を変化させるモデルが提唱された.ストラットのコイルドコイル構造の先端の部分はストークの中心の部分と水素結合や疎水性相互作用により強く結合しており,その相互作用の面積は800Å2にもおよぶ(図2 b, c,図4c).この広範な相互作用から,アロステリックな情報の伝達においてストークとストラットとが一体構造として機能することが強く示唆される.
アロステリックな情報の伝達経路については,ヒトのダイニン-2のADPおよびリン酸のアナログとしてバナジン酸と結合させた構造が解析されたことにより,その分子内における構造変化が詳細に議論されるようになった.この報告においては,AAA1におけるヌクレオチドの状態の変化により,ADP結合型と比べAAA5のα/βサブモジュールとAAA6のαサブモジュールとが一体となりAAA+リングに対し回転するとしている19).筆者らは,ストークおよびストラットからAAA1までの情報の伝達経路として,AAA+リングの裏面,とくに,Cシークエンスの重要性を指摘したい.以前に,Cシークエンスの一部を欠損させた変異体がモーター活性を失うことが報告されている25).とくに,Cシークエンスの最初に位置するH1へリックスは構造においてたいへん重要であり,高分解能の構造解析によりはじめて同定されたAAA5エクステンションと一体となった球状の構造を形成していた.H1へリックスからの長いループ構造により結合したCシークエンスの残りの部分は平坦な構造をとりAAA+リングを裏打ちするように配置されていた(図4 c, d).ADP結合型の構造ではCシークエンスはAAA1,AAA5,AAA6とのみ相互作用しているのに対し(図4c),ADPおよびリン酸のアナログとしてバナジン酸と結合させた構造では,それにくわえAAA2およびAAA3のαサブモジュールと密に相互作用していた(図4d).これは,AAA5のα/βサブモジュールおよびAAA6のαサブモジュールのAAA+リングに対する回転の範囲を規定する構造的な要因なのかもしれない.これまでの構造解析と機能解析の結果を総合的に判断して,微小管結合部位とAAA1のATPase部位との情報の伝達経路として,ストークとストラットおよびAAA+リングの裏面に位置するCシークエンスが機能するというモデルを提唱する.
おわりに
2012年に筆者らにより2.8Å分解能で構造解析された細胞性粘菌に由来する細胞質ダイニンのモータードメインを筆頭として,同じ年に3.3Å分解能で構造解析された出芽酵母に由来する細胞質ダイニン,2015年に3.4Å分解能で構造解析されたADPおよびリン酸のアナログとしてバナジン酸と結合させた状態のヒトのダイニン-2と,最近になり,アミノ酸残基のレベルで議論されるような細胞質ダイニンの原子構造があいついで報告された.細胞質ダイニンのモータードメインはAAA+タンパク質に共通したAAA+リング構造をもち,細胞質ダイニンに固有の機能ユニットとしてリンカー,ストークおよびストラット,CシークエンスをAAA+リングの両面に配置した非常に特徴的な構造をとっていた.複数の原子構造が明らかにされたことにより,ダイニンがどのようにして微小管のうえを移動する運動活性を獲得したのか,新しい視点が提供された.
最後に,運動活性に必須のパワーストロークとアロステリックな制御の2点にしぼり,その分子モデルを提唱する(図5).AAA+リングの表面には,ほかのAAA+タンパク質と同様のしくみにより駆動されるリンカーのスイング運動を駆動する分子装置がある.すなわち,AAA1とAAA2のあいだで起こるATPの加水分解にともなうAAA+リングの開閉が直接のひき金となり,リンカーの構造変化をひき起こす分子装置がAAA2-AAA3-AAA4の半円構造に組み込まれている.AAA+リングの裏面には,ストークおよびストラット,AAA5エクステンション,Cシークエンスの構造をとおしてAAA1と微小管結合部位とをつなぐ長距離の情報の伝達装置が配置されており,ATP加水分解サイクルにともない微小管との親和性を制御する細胞質ダイニンに固有の機能を発揮している.細胞質ダイニンのモータードメインは,AAA+型ATPaseの一般性と細胞質ダイニンに固有の機能とがうまく配置された,秀逸なモータータンパク質であるといえるだろう.
文 献
- Hook, P. & Vallee, R. B.: The dynein family at a glance. J. Cell Sci., 119, 4369-4371 (2006)[PubMed]
- Karki, S. & Holzbaur, E. L.: Cytoplasmic dynein and dynactin in cell division and intracellular transport. Curr. Opin. Cell Biol., 11, 45-53 (1999)[PubMed]
- Vallee, R. B., Williams, J. C., Varma, D. et al.: Dynein: an ancient motor protein involved in multiple modes of transport. J. Neurobiol., 58, 189-200 (2004)[PubMed]
- Scholey, J. M.: Intraflagellar transport motors in cilia: moving along the cell’s antenna. J. Cell Biol., 180, 23-29 (2008)[PubMed]
- Gibbons, I. R.: Cilia and flagella of eukaryotes. J. Cell Biol., 91, 107s-124s (1981)[PubMed]
- DiBella, L. M. & King, S. M.: Dynein motors of the Chlamydomonas flagellum. Int. Rev. Cytol., 210, 227-268 (2001)[PubMed]
- Neuwald, A. F., Aravind, L., Spouge, J. L. et al.: AAA+: A class of chaperone-like ATPases associated with the assembly, operation, and disassembly of protein complexes. Genome Res., 9, 27-43 (1999)[PubMed]
- Tucker, P. A. & Sallai, L.: The AAA+ superfamily: a myriad of motions. Curr. Opin. Struct. Biol., 17, 641-652 (2007)[PubMed]
- Hanson, P. I. & Whiteheart, S. W.: AAA+ proteins: have engine, will work. Nat. Rev. Mol. Cell Biol., 6, 519-529 (2005)[PubMed]
- Burgess, S. A., Walker, M. L., Sakakibara, H. et al.: Dynein structure and power stroke. Nature, 421, 715-718 (2003)[PubMed]
- Roberts, A. J., Numata, N., Walker, M. L. et al.: AAA+ ring and linker swing mechanism in the dynein motor. Cell, 136, 485-495 (2009)[PubMed]
- Gee, M. A., Heuser, J. E. & Vallee, R. B.: An extended microtubule-binding structure within the dynein motor domain. Nature, 390, 636-639 (1997)[PubMed]
- Koonce, M. P.: Identification of a microtubule-binding domain in a cytoplasmic dynein heavy chain. J. Biol. Chem., 272, 19714-19718 (1997)[PubMed]
- Kon, T., Mogami, T., Ohkura, R. et al.: ATP hydrolysis cycle-dependent tail motions in cytoplasmic dynein. Nat. Struct. Mol. Biol., 12, 513-519 (2005)[PubMed]
- Carter, A. P., Cho, C., Jin, L. et al.: Crystal structure of the dynein motor domain. Science, 331, 1159-1165 (2011)[PubMed]
- Kon, T., Sutoh, K. & Kurisu, G.: X-ray structure of a functional full-length dynein motor domain. Nat. Struct. Mol. Biol., 18, 638-642 (2011)[PubMed]
- Kon, T., Oyama, T., Shimo-Kon, R. et al.: The 2.8Å crystal structure of the dynein motor domain. Nature, 484, 345-350 (2012)[PubMed]
- Schmidt, H., Gleave, E. S. & Carter, A. P.: Insights into dynein motor domain function from a 3.3Å crystal structure. Nat. Struct. Mol. Biol., 19, 492-497 (2012)[PubMed]
- Schmidt, H., Zalyte, R., Urnavicius, L. et al.: Structure of human cytoplasmic dynein-2 primed for its power stroke. Nature, 518, 435-438 (2015)[PubMed]
- Kon, T., Nishiura, M., Ohkura, R. et al.: Distinct functions of nucleotide-binding/hydrolysis sites in the four AAA modules of cytoplasmic dynein. Biochemistry, 43, 11266-11274 (2004)[PubMed]
- Erzberger, J. P. & Berger, J. M.: Evolutionary relationships and structural mechanisms of AAA+ proteins. Annu. Rev. Biophys. Biomol. Struct., 35, 93-114 (2006)[PubMed]
- Enemark, E. J. & Joshua-Tor, L.: On helicases and other motor proteins. Curr. Opin. Struct. Biol., 18, 243-257 (2008)[PubMed]
- Gibbons, I. R., Garbarino, J. E., Tan, C. E. et al.: The affinity of the dynein microtubule-binding domain is modulated by the conformation of its coiled-coil stalk. J. Biol. Chem., 280, 23960-23965 (2005)[PubMed]
- Kon, T., Imamula, K., Roberts, A. J. et al.: Helix sliding in the stalk coiled coil of dynein couples ATPase and microtubule binding. Nat. Struct. Mol. Biol., 16, 325-333 (2009)[PubMed]
- Numata, N., Shima, T., Ohkura, R. et al.: C-sequence of the Dictyostelium cytoplasmic dynein participates in processivity modulation. FEBS Lett., 585, 1185-1190 (2011)[PubMed]
著者プロフィール
略歴:1997年 大阪大学大学院工学研究科博士課程 修了,同年 大阪大学蛋白質研究所 助手,2004年 東京大学大学院総合文化研究科 助教授を経て,2009年より大阪大学蛋白質研究所 教授.
研究テーマ:構造生物学,タンパク質結晶学.
関心事:X線結晶構造解析のできるタンパク質の大きさおよび解析の精度の限界.
昆 隆英(Takahide Kon)
略歴:2000年 東京大学大学院総合文化研究科博士課程 修了,同年 同 助手,2010年 大阪大学蛋白質研究所 准教授,2013年 法政大学生命科学部 教授を経て,2015年より大阪大学大学院理学研究科 教授.
研究テーマ:生物物理学,タンパク質科学.
関心事:タンパク質の原子構造から細胞における一方向性の過程をどこまで説明できるか.
© 2016 栗栖源嗣・昆 隆英 Licensed under CC 表示 2.1 日本