免疫反応を抑制するB細胞:制御性B細胞
2016/01/29
馬場 義裕
(大阪大学免疫学フロンティア研究センター 分化制御研究室)
email:馬場義裕
領域融合レビュー, 5, e002 (2016) DOI: 10.7875/leading.author.5.e002
Yoshihiro Baba: B cells with suppressive function in immune reaction: regulatory B cells.

B細胞は抗体を産生し液性免疫において中心的な役割をはたすことから,感染防御になくてはならないリンパ球である.また,自己免疫疾患,炎症,アレルギーにおいては発症や病態の悪化に関与することも広く知られている.しかし,これら免疫反応を亢進する作用とは逆に,免疫反応を抑制するB細胞の存在が示され,B細胞のもつ新たな機能として注目されている.このB細胞は制御性B細胞とよばれ,最近の研究の進展によりその正体が徐々に明らかにされている.このレビューにおいては,制御性B細胞の性状と免疫反応の抑制の機構,そして,病態への関与について,最近の知見をまじえ解説する.
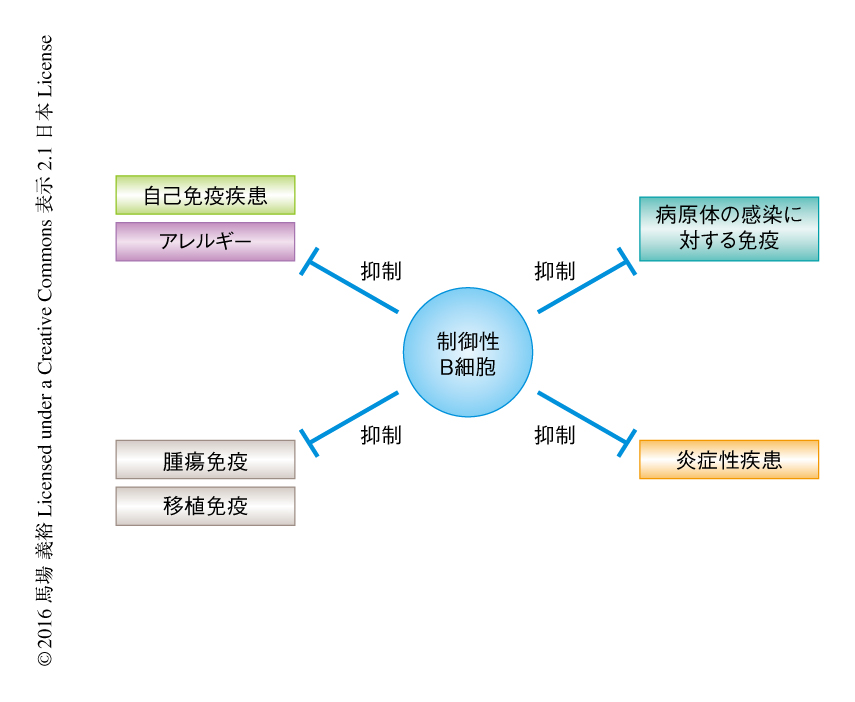
2015年でB細胞の発見からちょうど50年がたつ.抗体を産生するリンパ球として同定されたことからもわかるように,B細胞は液性免疫において中心的な役割をはたす.また,T細胞に対する抗原の提示やサイトカインの分泌により免疫反応を制御することもB細胞の重要な役目である.これらのはたらきにより,B細胞は病原体の感染に対し生体防御の一翼を担う一方で,自己免疫疾患,炎症,アレルギーの原因となったり病態を悪化させたりすることが知られている.しかし,それとは逆に,免疫反応を抑制するB細胞として制御性B細胞の存在が明らかにされ注目されている1).とくに,抗炎症性のサイトカインであるインターロイキン10を産生する制御性B細胞は,さまざまな疾患モデルマウスを用いた研究から,炎症や自己免疫疾患,さらには,感染免疫や腫瘍免疫などに対する抑制能がつぎつぎと示され,その制御の対象は多様であることが明らかにされてきた(図1).さらに,インターロイキン10以外の機序により免疫を抑制する制御性B細胞の存在も報告され,この研究領域は発展しつつある.免疫反応の抑制能はB細胞の新たな機能として重要であるばかりでなく,疾患との関連も示唆されており臨床医学の観点からも注目される.このレビューにおいては,制御性B細胞の研究のこれまでの展開および展望について解説する.
最初にB細胞による免疫反応の抑制が示唆されたのは,1974年のモルモットを使った接触性皮膚炎に関する報告である2).脾臓細胞の移入により病状が寛解することが示されたが,B細胞を除去した脾臓細胞の移入ではその作用はみられなかった.マウスにおける最初の報告は実験的自己免疫性脳脊髄炎モデルである3).B細胞を遺伝的に欠失したマウスでは野生型のマウスに比べ実験的自己免疫性脳脊髄炎の病態がいちじるしく増悪した.これらの研究から,B細胞が免疫反応に対し抑制的にもはたらくのではないかと考えられるようになった.2000年代になると,すべてのB細胞が免疫反応の抑制能を発揮するわけではなく,インターロイキン10を産生する特殊なB細胞が免疫抑制能をもつことが示され,“制御性B細胞”とよばれるようになった.のちの研究の進展により,制御性B細胞の抑制する対象は多岐にわたることが判明した.現在では,慢性大腸炎,実験的自己免疫性脳脊髄炎,コラーゲン誘導関節炎,接触性皮膚炎,アレルギー,I型糖尿病,移植片対宿主病,肥満による慢性炎症といった過剰な免疫反応による疾病や,感染免疫および腫瘍免疫を抑制すると考えられている4-10)(図1).
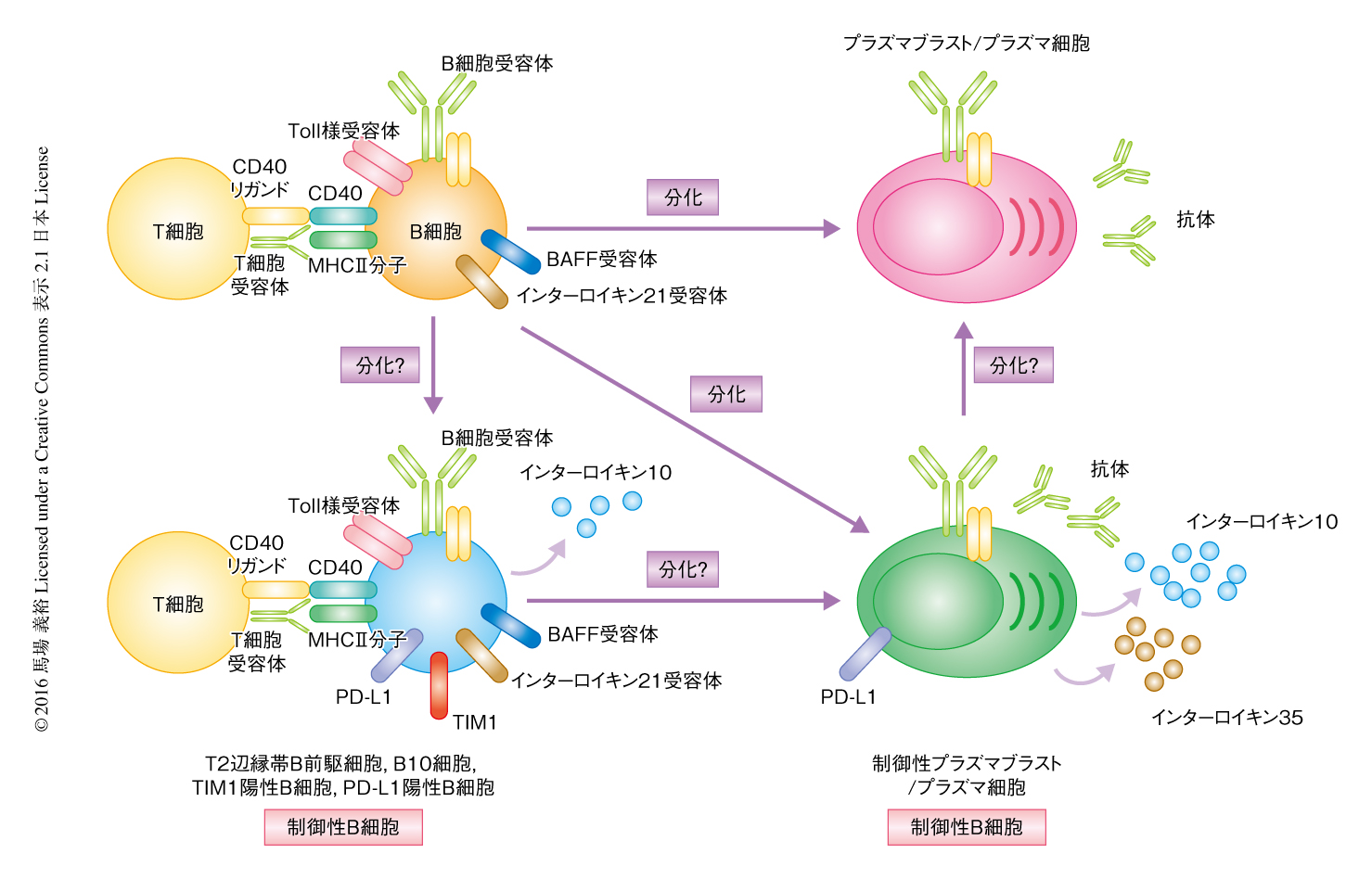
インターロイキン10が制御性B細胞による免疫反応の抑制に重要であるという報告を発端に,どのB細胞のサブセットが制御性B細胞なのかという課題に対し世界が鎬を削って挑戦してきた結果,その正体が徐々にうきぼりにされた11)(図2).はじめに報告されたのは,CD1dを高発現するB細胞であった.慢性大腸炎モデルにおいて,インターロイキン10を産生するCD1d高発現B細胞が腸間膜リンパ節において増加し炎症を抑制することが示された4).そののち,脾臓のT2辺縁帯B前駆細胞(IgM高発現CD21高発現CD23高発現)がコラーゲン誘導関節炎において12),また,B10細胞(CD5陽性CD1d高発現B細胞)が接触性皮膚炎において13),インターロイキン10産生B細胞であることが報告された.これらのB細胞にはともに辺縁帯B細胞との重複がみられた.さらに,B10細胞はB1細胞とも表現型が非常に似ていた.以前から,B1細胞がインターロイキン10を分泌することは知られており,B2細胞と区別するための指標として使われたほどである.新生仔のB1細胞が樹状細胞の機能を抑制し炎症性T細胞の分化を阻害することが示されたが,病態との関係は未解明である.また,I型膜糖タンパク質であるTIM1の発現とインターロイキン10の産生とに相関のあることも示唆された1).これらのB細胞によるインターロイキン10の産生については,B細胞をin vitroにおいて刺激したのちELISA法あるいは細胞内サイトカイン染色法により評価された.一方,レポーターマウスを用いてin vivoにおけるインターロイキン10の発現について調べると,サルモネラ菌に感染したマウスにおいては脾臓のプラズマ細胞14),実験的自己免疫性脳脊髄炎においては所属リンパ節のプラズマブラスト15) において検出された.これまでに複数の系統のインターロイキン10レポーターマウスが作製されているが,それぞれの系統において感度やmRNAの安定性が異なるため解釈には注意が必要であるものの,疾患を発症したマウスにおいてインターロイキン10産生B細胞を同定する有効な手段になると思われる.
制御性B細胞の表面タンパク質の表現型に関しては,複数の報告があるにもかかわらず共通した理解が得られているとはいいがたい.その理由として,研究に用いられている疾患モデル,インターロイキン10産生の評価系,免疫環境の違いが影響している可能性がある.また,制御性B細胞がある一定のサブセットであるとはかぎらない.さらに,インターロイキン10以外の要素により免疫反応の抑制能を発揮するB細胞についての知見も蓄積されつつある.B細胞をとりまく環境,たとえば,炎症や感染など異なる刺激,時期,局在の違いにより,さまざまな分化あるいは活性化の過程をへた制御性B細胞のサブセットが存在し多様性を示している可能性が考えられる.
自己免疫疾患モデルにおけるB細胞による免疫反応の抑制については多くの報告があるが,ここでは,比較的解析の進んでいる関節炎および脳脊髄炎について述べる.
マウスにII型コラーゲンを免疫することにより発症させることのできるコラーゲン誘導関節炎はヒトの慢性関節リウマチの疾患モデルとして使われることが多い.慢性関節リウマチはコラーゲンに対する自己抗体により発症するためB細胞は病因因子としてはたらくが,B細胞が抑制因子としても作用することが報告された.コラーゲン誘導関節炎を発症させたマウスにおいて,脾臓のT2辺縁帯B前駆細胞が主要なインターロイキン10産生B細胞であることが示された12).このサブセットはin vitroにおいてコラーゲンの刺激によりインターロイキン10を分泌し,別のマウスに移入することにより関節炎の症状を緩和することも確認された.この抑制能は強く,すでに関節炎を発症しているマウスにおいても効果がみられた.さらに,成熟B細胞の増殖および維持,プラズマ細胞の生存において重要な役割をはたすサイトカインであるBAFFの存在のもとで培養したB細胞を移入すると,インターロイキン10に依存してコラーゲン誘導関節炎の症状を抑制することも報告された16).ヒトにおいても,慢性関節リウマチの患者においてはインターロイキン10産生能をもつB細胞の数が減少していることが報告されており,病状との因果関係に関心がよせられている17).
実験的自己免疫性脳脊髄炎はマウスに神経の髄鞘を構成するタンパク質である自己抗原およびアジュバントを免疫することにより発症させることができ,その症状の類似性からヒトの多発性硬化症のモデルとして広く使われている.実験的自己免疫性脳脊髄炎を発症したマウスにおいて,抗CD20抗体の投与によりB細胞を除去すると症状は改善されるが,発症のまえにB細胞を除去すると逆に病態は重症化することが示された18).つまり,B細胞は発症のときおよび初期には免疫反応の抑制,発症ののちには免疫反応の促進が優位になることが示唆された.脾臓のB細胞の養子移入により実験的自己免疫性脳脊髄炎は抑制され,この作用にインターロイキン10の産生が必須であることが示された5,13).筆者らは,レポーターマウスを用いた実験により,in vivoにおいてインターロイキン10を発現しているB細胞のサブセットは所属リンパ節において分化の誘導されるプラズマブラストであることを見い出した15)(新着論文レビュー でも掲載).プラズマブラストはB細胞からプラズマ細胞への分化の初期の段階の細胞であると考えられており,プラズマ細胞と同様に抗体の産生能をもつが,プラズマ細胞と異なり増殖能をもち転写因子Blimp1の発現が低い.脾臓を外科的に切除したマウスにおいては実験的自己免疫性脳脊髄炎の病態に変化がないこと,リンパ節にB細胞が存在しないマウスにおいては実験的自己免疫性脳脊髄炎が悪化したことから,B細胞が免疫反応の抑制能を発揮する場所は所属リンパ節であり,インターロイキン10陽性プラズマブラストが抑制性B細胞であることが予想された.実際,プラズマ細胞の分化に必須であるBlimp1をB細胞において特異的に欠損したマウスにおいては実験的自己免疫性脳脊髄炎の増悪が認められた15).所属リンパ節のインターロイキン10産生プラズマブラストの分化は実験的自己免疫性脳脊髄炎の発症によりはじめて誘導されるため,過剰な炎症を抑制するための負のフィードバック制御機構としてはたらいている可能性が考えられる.
また,インターロイキン10以外による免疫反応の抑制機構も報告されている.抗炎症性サイトカインであるインターロイキン35を産生するプラズマ細胞が実験的自己免疫性脳脊髄炎の抑制に関与することが明らかにされた19).インターロイキン35産生B細胞は,実験的自己免疫性脳脊髄炎のほかにも,実験的自己免疫性ブドウ膜炎に対し抑制作用が認められた20).この系では,インターロイキン35はインターロイキン10産生B細胞の分化の誘導に必要であることが提唱されている.さらに,PD-L1を高発現するB細胞が濾胞性ヘルパーT細胞を抑制することにより実験的自己免疫性脳脊髄炎の病態を寛解させることが示された21).これはインターロイキン10に依存せず,さらに,このサブセットは抗CD20抗体によっても除去されない.
古くから,ヒトの多発性硬化症にB細胞の関与することが示唆されていた17).再発寛解型多発性硬化症の臨床試験において,抗CD20抗体の投与によるB細胞の除去により病変の低減および予後の改善がみられたことから,病態の増悪へのB細胞の関与が示された22).逆に,病態の改善に関与するB細胞の役割も示された.たとえば,多発性硬化症の患者に由来するB細胞はインターロイキン10の産生能が低下しており,また,多発性硬化症の再発予防薬として国内で認可されているインターフェロンβの刺激により,B細胞によるインターロイキン10の産生が増強された23).さらに,BAFFおよびAPRILを阻害する活性のあるアタシセプトの臨床試験において多発性硬化症の再発の頻度が上昇した.理由は明らかにされていないが,BAFFがインターロイキン10産生B細胞の分化を誘導するという報告もあることから24),制御性B細胞の除去による影響が関与する可能性がある.
腫瘍免疫に対しB細胞が抑制効果を示すことは,B細胞を欠損したマウスにおいて,細胞傷害性T細胞の抗腫瘍活性が強いこと,がんワクチンの効果が高いことなどから示唆されていた.B細胞欠損マウスでは,野生型のマウスに比べ,さまざまながん細胞の増殖が抑制されるが,これにはB細胞が産生するインターロイキン10の寄与の大きいことが報告された25).また,マウスにBリンパ腫を投与するとその増殖により致死となるが,抗CD20抗体の投与によりB細胞を除去するとリンパ腫の増殖は抑制され生存率も大幅に改善した26).この実験系において,CD5陽性CD1d高発現B細胞を移入するとリンパ腫が増殖するようになり致死率も上昇した.インターロイキン10を欠損したB細胞の移入ではこの効果はみられなかったことから,B細胞はインターロイキン10に依存的に腫瘍免疫を抑制すると考えられる.また,腫瘍の所属リンパ節にはB細胞が集積することが知られるが,このB細胞をマウスに移入すると腫瘍が増悪した.腫瘍抗原に特異的なB細胞が細胞性免疫を抑制することにより,がん細胞の増殖に有利な環境をつくりだしていると思われた.メラノーマの場合,その所属リンパ節には脾臓のT2辺縁帯B前駆細胞のサブセットが高頻度に検出された27).
最近,前立腺がんに浸潤するインターロイキン10を産生する制御性B細胞の新しいサブセットが同定された.このサブセットはプラズマブラストの一部と考えられ,免疫グロブリンA陽性,PD-L1陽性,インターロイキン10陽性という特徴をもつ28).マウス前立腺がんモデルに抗がん剤であるオキサリプラチンを低用量で投与しても効果はみられないが,B細胞を欠損したマウスや抗CD20抗体によりB細胞を除去したマウスにおいては,低用量のオキサリプラチンにより細胞傷害性T細胞の活性が増強しがんが排除された.オキサリプラチンの投与によりインターロイキン10陽性PD-L1陽性免疫グロブリンA陽性のB細胞のサブセットが優位にがん細胞へと浸潤し,抗腫瘍免疫を抑制することが示唆された.この腫瘍免疫の抑制にはインターロイキン10,PD-L1,免疫グロブリンAのすべての発現が必要であることが示された.また,乳がんモデルでは所属リンパ節においてTGFβを産生するCD25陽性B細胞の分化が誘導され腫瘍免疫を抑制することも報告された29).これらの結果から,腫瘍免疫の増強を目的としたB細胞の除去療法が新たながんの治療戦略としての可能性をひめることが考えられる.
B細胞の重要な役割は感染症に対する生体防御である.しかし同時に,その感染免疫を抑制するような制御性B細胞も存在する.細菌の感染として,サルモネラ菌あるいはリステリア菌のマウスへの感染モデルにおいて示された.B細胞はサルモネラ菌を排除するような免疫を誘導するが,その作用機序は抗体によるものではなく,抗原の提示によりT細胞による細胞性免疫を誘導することにあると考えられている.一方で,B細胞がサルモネラ菌に対する感染防御を抑制することが示された.サルモネラ菌に感染したマウスの脾臓においてはインターロイキン10を産生するプラズマ細胞あるいはプラズマブラストの分化が誘導された.in vitroにおけるサルモネラ菌の刺激によってもB細胞はインターロイキン10を分泌した.B細胞においてインターロイキン10を欠損させたマウスにおいては,サルモネラ菌に感染したときの好中球,ナチュラルキラー細胞,T細胞の活性が強く,サルモネラ菌の排除能がいちじるしく上昇することが示された.さらに,プラズマ細胞あるいはプラズマブラストにはインターロイキン35を産生するサブセットも存在し,サルモネラ菌の感染に対する感受性を上昇させていることも明らかにされた.また,B細胞を欠損したマウスはリステリア菌の感染に対し抵抗性を示したことから,リステリア菌の感染においてもB細胞は免疫反応を抑制している.この場合,脾臓の辺縁帯B細胞がインターロイキン10の供給源となり抑制能を発揮することが示された.
寄生虫の感染においてもB細胞は亢進および抑制を制御する.寄生虫の感染にともないみられるB細胞による免疫の制御によりアレルギーや自己免疫疾患の症状が緩和することが報告された.たとえば,住血吸虫の感染によりアレルギー性気道炎症が抑制されるが,この効果は脾臓に存在するCD1dを高発現するB細胞によるインターロイキン10の産生に依存した30).一方,寄生虫に感染したマウスの肺においても制御性B細胞の分化が誘導されたが,インターロイキン10以外の機構により炎症を抑制しているようであった.また,腸管寄生線虫を感染させたマウスの腸間膜リンパ節から単離したCD23を高発現するB細胞は,養子移入によりアレルギー性気管支炎および脳脊髄炎を抑制したが,この作用もインターロイキン10に依存しないことが示された31).B細胞が存在する場所により免疫反応の抑制作用が異なる可能性もあり,機序の解明が待たれる.
ヒトにおいても寄生虫の感染と制御性B細胞との関連がうたがわれている.多発性硬化症の患者においてはB細胞によるインターロイキン10の産生の低いことが知られているが,寄生虫の感染のみられる患者は感染していない患者に比べ,B細胞によるインターロイキン10の産生が高く,過剰な自己免疫反応が抑制される傾向にあった32).近年,わが国を含む先進国においてはアレルギーや自己免疫疾患が増加しており,その原因のひとつとして,衛生環境の改善にともなう感染リスクの低下が提唱されている.その機序は不明であるが,制御性B細胞が関与する可能性もある.
ウイルスの感染により制御性B細胞の分化が誘導されることは,マウスサイトメガロウイルスを用いた実験により確認された.ウイルスの感染によりインターロイキン10産生B細胞およびプラズマブラストが検出され,ウイルスに特異的なCD8陽性T細胞の産生が抑制された33).マウスガンマヘルペスウイルス68はマウスに経鼻感染させるとB細胞において潜伏感染することが知られ,ウイルスに由来するM2タンパク質はこの感染の成立および再活性化において重要だと考えられている.そして,再活性化においてM2タンパク質がB細胞における転写因子IRF4の発現を促進し,プラズマ細胞の分化およびインターロイキン10の産生を誘導することが示唆された34).宿主の免疫を抑制するこの作用は,マウスガンマヘルペスウイルス68の持続感染サイクルの成立のため有利にはたらいていると想像された.ヒトの感染症においては,ヒト免疫不全ウイルス35) あるいはB型肝炎ウイルス36) に感染した患者に由来する末梢血のB細胞はインターロイキン10の産生能が増強されていると報告され,制御性B細胞との関連が指摘されている.それらの病勢との因果関係はいまだ不明瞭であるが,制御性B細胞を標的にした創薬は慢性ウイルスの感染に対する生体防御の強化として有望かもしれない.
現時点では,制御性B細胞による免疫反応の抑制能の中核はインターロイキン10であると考えられている.インターロイキン10はさまざまな細胞から分泌される強力な抗炎症性サイトカインであり,その産生機構の研究が重ねられている.B細胞においては,Toll様受容体(Toll-like receptor:TLR),CD40,B細胞受容体からのシグナルが必要だと考えられている37).
TLR2およびTLR4の刺激がB細胞によるインターロイキン10の産生に重要であることが示された38).B細胞でのみTLR2およびTLR4を欠損した混合骨髄キメラマウスにおいて実験的自己免疫性脳脊髄炎の病態がいちじるしく増悪したことから,Toll様受容体はin vivoにおける免疫反応の抑制能にも重要であった.また,TLR2およびTLR4の下流タンパク質であるMyD88をB細胞において特異的に欠損させたマウスにおいても実験的自己免疫性脳脊髄炎の増悪がみられ,Toll様受容体からのシグナルの重要性が確認された.さらに,サルモネラ菌の感染モデルにおいても,TLR2およびTLR4からMyD88をへるシグナルがB細胞によるインターロイキン10の産生およびサルモネラ菌に対する免疫反応を減弱させた14).Toll様受容体からのシグナルはB細胞のプラズマ細胞への分化を惹起した.その際,IRF4およびBlimp1の発現が必須となったことから,Toll様受容体の刺激はインターロイキン10を産生する制御性プラズマブラストの分化に必要であると想像された.Blimp1ノックアウトマウスにくわえ,IRF4を欠損したB細胞においてはインターロイキン10の産生が障害されており,筆者らの研究により,B細胞に特異的なIFR4ノックアウトマウスにおいては実験的自己免疫性脳脊髄炎の症状が重症化することが明らかにされた15).さらに,IRF4は分化だけでなく,インターロイキン10遺伝子の転写にも関与することが示唆された15,34).
B細胞の表面に発現するCD40は,T細胞の表面のCD154と結合することにより活性化され,その結果,B細胞の増殖および分化が誘導される.これはT細胞に依存する免疫反応に必須の過程であるが,制御性B細胞の機能においても重要であると考えられている.B細胞に特異的なCD40欠損キメラマウスでは実験的自己免疫性脳脊髄炎が重症化し,この病態はB細胞によるインターロイキン10の産生能の低下によることが報告された5).コラーゲン誘導関節炎モデルにおいても,CD40を刺激したB細胞はインターロイキン10の産生能が亢進し,この細胞を移入することにより関節炎が抑制されることが示された12).
B細胞受容体は抗原に特異的なB細胞の応答において必須である.実験的自己免疫性脳脊髄炎を発症したマウスから単離したB細胞(自己抗原を認識するB細胞が含まれる)を別のマウスに移入すると実験的自己免疫性脳脊髄炎を抑制することができるが,免疫していないマウスから単離したB細胞ではその抑制効果は非常に弱かった39).また,抗原の認識を固定したB細胞受容体(自己抗原には反応しない)をもつB細胞は実験的自己免疫性脳脊髄炎を抑制できなかった.さらに,実験的自己免疫性脳脊髄炎をひき起こしたマウスから単離したB細胞のB細胞受容体を刺激するとインターロイキン10が分泌された5).これらの結果から,制御性B細胞の免疫反応の抑制能には抗原特異性が必要であることが示唆された.
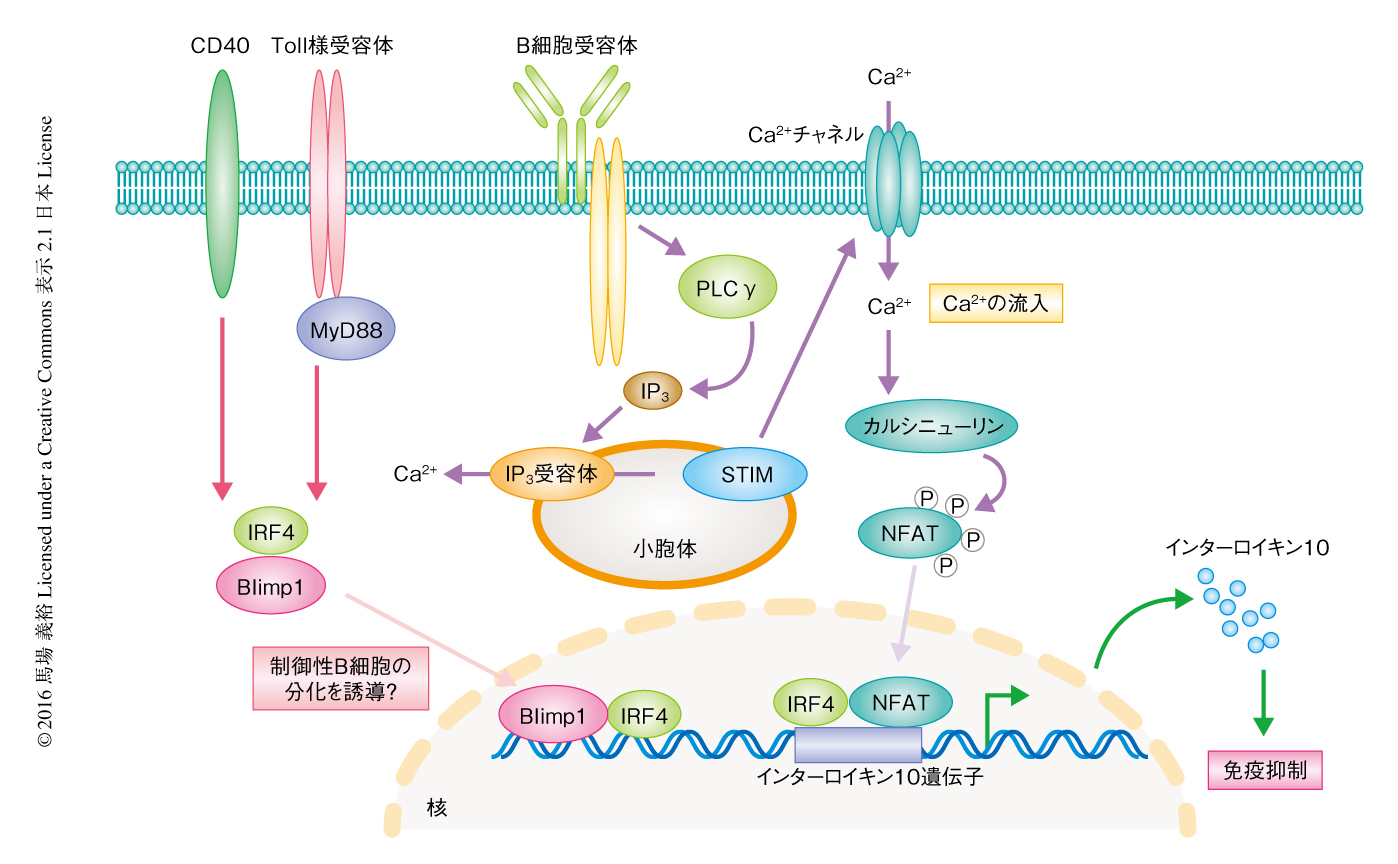
筆者らの研究より,B細胞受容体の下流においてインターロイキン10の産生に重要なのはCa2+シグナルであることが明らかにされた40)(新着論文レビュー でも掲載).B細胞受容体を刺激すると,活性化されたホスホリパーゼCγ2がイノシトール1,4,5-トリスリン酸を産生し,これが小胞体膜にあるイノシトールトリスリン酸受容体と結合することにより小胞体に貯蔵されたCa2+が細胞質へ放出される.小胞体からのCa2+の遊離は急速に起こるが少量かつ一過性であり,細胞におけるCa2+濃度の維持には細胞外からのCa2+の持続的な流入が必要である.STIMは小胞体内腔におけるCa2+の減少を感知すると,細胞膜にあるCa2+チャネルと相互作用し活性化してCa2+が流入する.この過程はストア作動性Ca2+流入とよばれる41).B細胞に特異的にSTIMを欠損したマウスにおいてはストア作動性Ca2+流入が阻害されるが,これにくわえ,インターロイキン10の分泌がいちじるしく低下した.このCa2+により活性化されたカルシニューリンおよび転写因子NFATがインターロイキン10の発現を誘導すると考えられた40)(図3).B細胞においてSTIMを特異的に欠損したマウスにおいては実験的自己免疫性脳脊髄炎が増悪し,このマウスに由来するB細胞においてはインターロイキン10の産生も阻害されていたことから,Ca2+の流入がB細胞による免疫反応の抑制能に重要であることがわかった40).
CD40シグナル,Toll様受容体シグナル,B細胞受容体シグナルはインターロイキン10の産生において重要であるが,厳密な意味では,制御性B細胞の分化に必要なのか,あるいは,インターロイキン10遺伝子の転写に必要なのか,わかっていない.これら以外にも,インターロイキン21受容体あるいはMHCクラスII分子を欠失したB細胞も実験的自己免疫性脳脊髄炎に対する抑制能を失うことが知られているが42),これらはすべてプラズマ細胞の分化に必須であることから,いまだ解明されていない制御性B細胞の分化の機構を理解する手がかりになると期待される.
B細胞は免疫反応の促進および抑制の二面性をもつことから,それらの作用のバランスや相互のフィードバック機構の破綻が疾病の病態に関与することが示唆される.このレビューでとりあげたほかにも,ヒトにおいてインターロイキン10を産生する複数のB細胞のサブセットが同定されており15,23,43),マウスにおける知見とあわせると制御性B細胞は均一なサブセットからなるとは考えにくく,このことは研究を進めるうえでの障壁のひとつとなっている.その点においても,制御性T細胞におけるFoxP3のような制御性B細胞において特異的な遺伝子,あるいは,共通して利用するシグナルが存在するのかどうかをはっきりさせることが重要だと考えられる.抑制性B細胞が多種多様であった場合には,疾患ごとに性状,機能,分子基盤を明らかにしていくことが必須であろう.そのうえで,ヒトにおいて制御性B細胞と疾患の病態との因果関係を明らかにし,B細胞の機能を標的とした臨床応用へと展開されることを期待したい.
略歴:2002年 大阪大学大学院医学系研究科博士課程 修了,同年 米国Oklahoma Medical Research Foundation博士研究員,2005年 理化学研究所免疫アレルギー科学総合研究センター 研究員を経て,2008年より大阪大学免疫学フロンティア研究センター 特任准教授.
© 2016 馬場 義裕 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 分化制御研究室)
email:馬場義裕
領域融合レビュー, 5, e002 (2016) DOI: 10.7875/leading.author.5.e002
Yoshihiro Baba: B cells with suppressive function in immune reaction: regulatory B cells.
要 約
B細胞は抗体を産生し液性免疫において中心的な役割をはたすことから,感染防御になくてはならないリンパ球である.また,自己免疫疾患,炎症,アレルギーにおいては発症や病態の悪化に関与することも広く知られている.しかし,これら免疫反応を亢進する作用とは逆に,免疫反応を抑制するB細胞の存在が示され,B細胞のもつ新たな機能として注目されている.このB細胞は制御性B細胞とよばれ,最近の研究の進展によりその正体が徐々に明らかにされている.このレビューにおいては,制御性B細胞の性状と免疫反応の抑制の機構,そして,病態への関与について,最近の知見をまじえ解説する.
はじめに
2015年でB細胞の発見からちょうど50年がたつ.抗体を産生するリンパ球として同定されたことからもわかるように,B細胞は液性免疫において中心的な役割をはたす.また,T細胞に対する抗原の提示やサイトカインの分泌により免疫反応を制御することもB細胞の重要な役目である.これらのはたらきにより,B細胞は病原体の感染に対し生体防御の一翼を担う一方で,自己免疫疾患,炎症,アレルギーの原因となったり病態を悪化させたりすることが知られている.しかし,それとは逆に,免疫反応を抑制するB細胞として制御性B細胞の存在が明らかにされ注目されている1).とくに,抗炎症性のサイトカインであるインターロイキン10を産生する制御性B細胞は,さまざまな疾患モデルマウスを用いた研究から,炎症や自己免疫疾患,さらには,感染免疫や腫瘍免疫などに対する抑制能がつぎつぎと示され,その制御の対象は多様であることが明らかにされてきた(図1).さらに,インターロイキン10以外の機序により免疫を抑制する制御性B細胞の存在も報告され,この研究領域は発展しつつある.免疫反応の抑制能はB細胞の新たな機能として重要であるばかりでなく,疾患との関連も示唆されており臨床医学の観点からも注目される.このレビューにおいては,制御性B細胞の研究のこれまでの展開および展望について解説する.
1.制御性B細胞の性状およびサブセット
最初にB細胞による免疫反応の抑制が示唆されたのは,1974年のモルモットを使った接触性皮膚炎に関する報告である2).脾臓細胞の移入により病状が寛解することが示されたが,B細胞を除去した脾臓細胞の移入ではその作用はみられなかった.マウスにおける最初の報告は実験的自己免疫性脳脊髄炎モデルである3).B細胞を遺伝的に欠失したマウスでは野生型のマウスに比べ実験的自己免疫性脳脊髄炎の病態がいちじるしく増悪した.これらの研究から,B細胞が免疫反応に対し抑制的にもはたらくのではないかと考えられるようになった.2000年代になると,すべてのB細胞が免疫反応の抑制能を発揮するわけではなく,インターロイキン10を産生する特殊なB細胞が免疫抑制能をもつことが示され,“制御性B細胞”とよばれるようになった.のちの研究の進展により,制御性B細胞の抑制する対象は多岐にわたることが判明した.現在では,慢性大腸炎,実験的自己免疫性脳脊髄炎,コラーゲン誘導関節炎,接触性皮膚炎,アレルギー,I型糖尿病,移植片対宿主病,肥満による慢性炎症といった過剰な免疫反応による疾病や,感染免疫および腫瘍免疫を抑制すると考えられている4-10)(図1).
インターロイキン10が制御性B細胞による免疫反応の抑制に重要であるという報告を発端に,どのB細胞のサブセットが制御性B細胞なのかという課題に対し世界が鎬を削って挑戦してきた結果,その正体が徐々にうきぼりにされた11)(図2).はじめに報告されたのは,CD1dを高発現するB細胞であった.慢性大腸炎モデルにおいて,インターロイキン10を産生するCD1d高発現B細胞が腸間膜リンパ節において増加し炎症を抑制することが示された4).そののち,脾臓のT2辺縁帯B前駆細胞(IgM高発現CD21高発現CD23高発現)がコラーゲン誘導関節炎において12),また,B10細胞(CD5陽性CD1d高発現B細胞)が接触性皮膚炎において13),インターロイキン10産生B細胞であることが報告された.これらのB細胞にはともに辺縁帯B細胞との重複がみられた.さらに,B10細胞はB1細胞とも表現型が非常に似ていた.以前から,B1細胞がインターロイキン10を分泌することは知られており,B2細胞と区別するための指標として使われたほどである.新生仔のB1細胞が樹状細胞の機能を抑制し炎症性T細胞の分化を阻害することが示されたが,病態との関係は未解明である.また,I型膜糖タンパク質であるTIM1の発現とインターロイキン10の産生とに相関のあることも示唆された1).これらのB細胞によるインターロイキン10の産生については,B細胞をin vitroにおいて刺激したのちELISA法あるいは細胞内サイトカイン染色法により評価された.一方,レポーターマウスを用いてin vivoにおけるインターロイキン10の発現について調べると,サルモネラ菌に感染したマウスにおいては脾臓のプラズマ細胞14),実験的自己免疫性脳脊髄炎においては所属リンパ節のプラズマブラスト15) において検出された.これまでに複数の系統のインターロイキン10レポーターマウスが作製されているが,それぞれの系統において感度やmRNAの安定性が異なるため解釈には注意が必要であるものの,疾患を発症したマウスにおいてインターロイキン10産生B細胞を同定する有効な手段になると思われる.
制御性B細胞の表面タンパク質の表現型に関しては,複数の報告があるにもかかわらず共通した理解が得られているとはいいがたい.その理由として,研究に用いられている疾患モデル,インターロイキン10産生の評価系,免疫環境の違いが影響している可能性がある.また,制御性B細胞がある一定のサブセットであるとはかぎらない.さらに,インターロイキン10以外の要素により免疫反応の抑制能を発揮するB細胞についての知見も蓄積されつつある.B細胞をとりまく環境,たとえば,炎症や感染など異なる刺激,時期,局在の違いにより,さまざまな分化あるいは活性化の過程をへた制御性B細胞のサブセットが存在し多様性を示している可能性が考えられる.
2.制御性B細胞と自己免疫疾患
自己免疫疾患モデルにおけるB細胞による免疫反応の抑制については多くの報告があるが,ここでは,比較的解析の進んでいる関節炎および脳脊髄炎について述べる.
マウスにII型コラーゲンを免疫することにより発症させることのできるコラーゲン誘導関節炎はヒトの慢性関節リウマチの疾患モデルとして使われることが多い.慢性関節リウマチはコラーゲンに対する自己抗体により発症するためB細胞は病因因子としてはたらくが,B細胞が抑制因子としても作用することが報告された.コラーゲン誘導関節炎を発症させたマウスにおいて,脾臓のT2辺縁帯B前駆細胞が主要なインターロイキン10産生B細胞であることが示された12).このサブセットはin vitroにおいてコラーゲンの刺激によりインターロイキン10を分泌し,別のマウスに移入することにより関節炎の症状を緩和することも確認された.この抑制能は強く,すでに関節炎を発症しているマウスにおいても効果がみられた.さらに,成熟B細胞の増殖および維持,プラズマ細胞の生存において重要な役割をはたすサイトカインであるBAFFの存在のもとで培養したB細胞を移入すると,インターロイキン10に依存してコラーゲン誘導関節炎の症状を抑制することも報告された16).ヒトにおいても,慢性関節リウマチの患者においてはインターロイキン10産生能をもつB細胞の数が減少していることが報告されており,病状との因果関係に関心がよせられている17).
実験的自己免疫性脳脊髄炎はマウスに神経の髄鞘を構成するタンパク質である自己抗原およびアジュバントを免疫することにより発症させることができ,その症状の類似性からヒトの多発性硬化症のモデルとして広く使われている.実験的自己免疫性脳脊髄炎を発症したマウスにおいて,抗CD20抗体の投与によりB細胞を除去すると症状は改善されるが,発症のまえにB細胞を除去すると逆に病態は重症化することが示された18).つまり,B細胞は発症のときおよび初期には免疫反応の抑制,発症ののちには免疫反応の促進が優位になることが示唆された.脾臓のB細胞の養子移入により実験的自己免疫性脳脊髄炎は抑制され,この作用にインターロイキン10の産生が必須であることが示された5,13).筆者らは,レポーターマウスを用いた実験により,in vivoにおいてインターロイキン10を発現しているB細胞のサブセットは所属リンパ節において分化の誘導されるプラズマブラストであることを見い出した15)(新着論文レビュー でも掲載).プラズマブラストはB細胞からプラズマ細胞への分化の初期の段階の細胞であると考えられており,プラズマ細胞と同様に抗体の産生能をもつが,プラズマ細胞と異なり増殖能をもち転写因子Blimp1の発現が低い.脾臓を外科的に切除したマウスにおいては実験的自己免疫性脳脊髄炎の病態に変化がないこと,リンパ節にB細胞が存在しないマウスにおいては実験的自己免疫性脳脊髄炎が悪化したことから,B細胞が免疫反応の抑制能を発揮する場所は所属リンパ節であり,インターロイキン10陽性プラズマブラストが抑制性B細胞であることが予想された.実際,プラズマ細胞の分化に必須であるBlimp1をB細胞において特異的に欠損したマウスにおいては実験的自己免疫性脳脊髄炎の増悪が認められた15).所属リンパ節のインターロイキン10産生プラズマブラストの分化は実験的自己免疫性脳脊髄炎の発症によりはじめて誘導されるため,過剰な炎症を抑制するための負のフィードバック制御機構としてはたらいている可能性が考えられる.
また,インターロイキン10以外による免疫反応の抑制機構も報告されている.抗炎症性サイトカインであるインターロイキン35を産生するプラズマ細胞が実験的自己免疫性脳脊髄炎の抑制に関与することが明らかにされた19).インターロイキン35産生B細胞は,実験的自己免疫性脳脊髄炎のほかにも,実験的自己免疫性ブドウ膜炎に対し抑制作用が認められた20).この系では,インターロイキン35はインターロイキン10産生B細胞の分化の誘導に必要であることが提唱されている.さらに,PD-L1を高発現するB細胞が濾胞性ヘルパーT細胞を抑制することにより実験的自己免疫性脳脊髄炎の病態を寛解させることが示された21).これはインターロイキン10に依存せず,さらに,このサブセットは抗CD20抗体によっても除去されない.
古くから,ヒトの多発性硬化症にB細胞の関与することが示唆されていた17).再発寛解型多発性硬化症の臨床試験において,抗CD20抗体の投与によるB細胞の除去により病変の低減および予後の改善がみられたことから,病態の増悪へのB細胞の関与が示された22).逆に,病態の改善に関与するB細胞の役割も示された.たとえば,多発性硬化症の患者に由来するB細胞はインターロイキン10の産生能が低下しており,また,多発性硬化症の再発予防薬として国内で認可されているインターフェロンβの刺激により,B細胞によるインターロイキン10の産生が増強された23).さらに,BAFFおよびAPRILを阻害する活性のあるアタシセプトの臨床試験において多発性硬化症の再発の頻度が上昇した.理由は明らかにされていないが,BAFFがインターロイキン10産生B細胞の分化を誘導するという報告もあることから24),制御性B細胞の除去による影響が関与する可能性がある.
3.制御性B細胞と腫瘍
腫瘍免疫に対しB細胞が抑制効果を示すことは,B細胞を欠損したマウスにおいて,細胞傷害性T細胞の抗腫瘍活性が強いこと,がんワクチンの効果が高いことなどから示唆されていた.B細胞欠損マウスでは,野生型のマウスに比べ,さまざまながん細胞の増殖が抑制されるが,これにはB細胞が産生するインターロイキン10の寄与の大きいことが報告された25).また,マウスにBリンパ腫を投与するとその増殖により致死となるが,抗CD20抗体の投与によりB細胞を除去するとリンパ腫の増殖は抑制され生存率も大幅に改善した26).この実験系において,CD5陽性CD1d高発現B細胞を移入するとリンパ腫が増殖するようになり致死率も上昇した.インターロイキン10を欠損したB細胞の移入ではこの効果はみられなかったことから,B細胞はインターロイキン10に依存的に腫瘍免疫を抑制すると考えられる.また,腫瘍の所属リンパ節にはB細胞が集積することが知られるが,このB細胞をマウスに移入すると腫瘍が増悪した.腫瘍抗原に特異的なB細胞が細胞性免疫を抑制することにより,がん細胞の増殖に有利な環境をつくりだしていると思われた.メラノーマの場合,その所属リンパ節には脾臓のT2辺縁帯B前駆細胞のサブセットが高頻度に検出された27).
最近,前立腺がんに浸潤するインターロイキン10を産生する制御性B細胞の新しいサブセットが同定された.このサブセットはプラズマブラストの一部と考えられ,免疫グロブリンA陽性,PD-L1陽性,インターロイキン10陽性という特徴をもつ28).マウス前立腺がんモデルに抗がん剤であるオキサリプラチンを低用量で投与しても効果はみられないが,B細胞を欠損したマウスや抗CD20抗体によりB細胞を除去したマウスにおいては,低用量のオキサリプラチンにより細胞傷害性T細胞の活性が増強しがんが排除された.オキサリプラチンの投与によりインターロイキン10陽性PD-L1陽性免疫グロブリンA陽性のB細胞のサブセットが優位にがん細胞へと浸潤し,抗腫瘍免疫を抑制することが示唆された.この腫瘍免疫の抑制にはインターロイキン10,PD-L1,免疫グロブリンAのすべての発現が必要であることが示された.また,乳がんモデルでは所属リンパ節においてTGFβを産生するCD25陽性B細胞の分化が誘導され腫瘍免疫を抑制することも報告された29).これらの結果から,腫瘍免疫の増強を目的としたB細胞の除去療法が新たながんの治療戦略としての可能性をひめることが考えられる.
4.制御性B細胞と感染症
B細胞の重要な役割は感染症に対する生体防御である.しかし同時に,その感染免疫を抑制するような制御性B細胞も存在する.細菌の感染として,サルモネラ菌あるいはリステリア菌のマウスへの感染モデルにおいて示された.B細胞はサルモネラ菌を排除するような免疫を誘導するが,その作用機序は抗体によるものではなく,抗原の提示によりT細胞による細胞性免疫を誘導することにあると考えられている.一方で,B細胞がサルモネラ菌に対する感染防御を抑制することが示された.サルモネラ菌に感染したマウスの脾臓においてはインターロイキン10を産生するプラズマ細胞あるいはプラズマブラストの分化が誘導された.in vitroにおけるサルモネラ菌の刺激によってもB細胞はインターロイキン10を分泌した.B細胞においてインターロイキン10を欠損させたマウスにおいては,サルモネラ菌に感染したときの好中球,ナチュラルキラー細胞,T細胞の活性が強く,サルモネラ菌の排除能がいちじるしく上昇することが示された.さらに,プラズマ細胞あるいはプラズマブラストにはインターロイキン35を産生するサブセットも存在し,サルモネラ菌の感染に対する感受性を上昇させていることも明らかにされた.また,B細胞を欠損したマウスはリステリア菌の感染に対し抵抗性を示したことから,リステリア菌の感染においてもB細胞は免疫反応を抑制している.この場合,脾臓の辺縁帯B細胞がインターロイキン10の供給源となり抑制能を発揮することが示された.
寄生虫の感染においてもB細胞は亢進および抑制を制御する.寄生虫の感染にともないみられるB細胞による免疫の制御によりアレルギーや自己免疫疾患の症状が緩和することが報告された.たとえば,住血吸虫の感染によりアレルギー性気道炎症が抑制されるが,この効果は脾臓に存在するCD1dを高発現するB細胞によるインターロイキン10の産生に依存した30).一方,寄生虫に感染したマウスの肺においても制御性B細胞の分化が誘導されたが,インターロイキン10以外の機構により炎症を抑制しているようであった.また,腸管寄生線虫を感染させたマウスの腸間膜リンパ節から単離したCD23を高発現するB細胞は,養子移入によりアレルギー性気管支炎および脳脊髄炎を抑制したが,この作用もインターロイキン10に依存しないことが示された31).B細胞が存在する場所により免疫反応の抑制作用が異なる可能性もあり,機序の解明が待たれる.
ヒトにおいても寄生虫の感染と制御性B細胞との関連がうたがわれている.多発性硬化症の患者においてはB細胞によるインターロイキン10の産生の低いことが知られているが,寄生虫の感染のみられる患者は感染していない患者に比べ,B細胞によるインターロイキン10の産生が高く,過剰な自己免疫反応が抑制される傾向にあった32).近年,わが国を含む先進国においてはアレルギーや自己免疫疾患が増加しており,その原因のひとつとして,衛生環境の改善にともなう感染リスクの低下が提唱されている.その機序は不明であるが,制御性B細胞が関与する可能性もある.
ウイルスの感染により制御性B細胞の分化が誘導されることは,マウスサイトメガロウイルスを用いた実験により確認された.ウイルスの感染によりインターロイキン10産生B細胞およびプラズマブラストが検出され,ウイルスに特異的なCD8陽性T細胞の産生が抑制された33).マウスガンマヘルペスウイルス68はマウスに経鼻感染させるとB細胞において潜伏感染することが知られ,ウイルスに由来するM2タンパク質はこの感染の成立および再活性化において重要だと考えられている.そして,再活性化においてM2タンパク質がB細胞における転写因子IRF4の発現を促進し,プラズマ細胞の分化およびインターロイキン10の産生を誘導することが示唆された34).宿主の免疫を抑制するこの作用は,マウスガンマヘルペスウイルス68の持続感染サイクルの成立のため有利にはたらいていると想像された.ヒトの感染症においては,ヒト免疫不全ウイルス35) あるいはB型肝炎ウイルス36) に感染した患者に由来する末梢血のB細胞はインターロイキン10の産生能が増強されていると報告され,制御性B細胞との関連が指摘されている.それらの病勢との因果関係はいまだ不明瞭であるが,制御性B細胞を標的にした創薬は慢性ウイルスの感染に対する生体防御の強化として有望かもしれない.
5.制御性B細胞によるインターロイキン10の産生の機序
現時点では,制御性B細胞による免疫反応の抑制能の中核はインターロイキン10であると考えられている.インターロイキン10はさまざまな細胞から分泌される強力な抗炎症性サイトカインであり,その産生機構の研究が重ねられている.B細胞においては,Toll様受容体(Toll-like receptor:TLR),CD40,B細胞受容体からのシグナルが必要だと考えられている37).
TLR2およびTLR4の刺激がB細胞によるインターロイキン10の産生に重要であることが示された38).B細胞でのみTLR2およびTLR4を欠損した混合骨髄キメラマウスにおいて実験的自己免疫性脳脊髄炎の病態がいちじるしく増悪したことから,Toll様受容体はin vivoにおける免疫反応の抑制能にも重要であった.また,TLR2およびTLR4の下流タンパク質であるMyD88をB細胞において特異的に欠損させたマウスにおいても実験的自己免疫性脳脊髄炎の増悪がみられ,Toll様受容体からのシグナルの重要性が確認された.さらに,サルモネラ菌の感染モデルにおいても,TLR2およびTLR4からMyD88をへるシグナルがB細胞によるインターロイキン10の産生およびサルモネラ菌に対する免疫反応を減弱させた14).Toll様受容体からのシグナルはB細胞のプラズマ細胞への分化を惹起した.その際,IRF4およびBlimp1の発現が必須となったことから,Toll様受容体の刺激はインターロイキン10を産生する制御性プラズマブラストの分化に必要であると想像された.Blimp1ノックアウトマウスにくわえ,IRF4を欠損したB細胞においてはインターロイキン10の産生が障害されており,筆者らの研究により,B細胞に特異的なIFR4ノックアウトマウスにおいては実験的自己免疫性脳脊髄炎の症状が重症化することが明らかにされた15).さらに,IRF4は分化だけでなく,インターロイキン10遺伝子の転写にも関与することが示唆された15,34).
B細胞の表面に発現するCD40は,T細胞の表面のCD154と結合することにより活性化され,その結果,B細胞の増殖および分化が誘導される.これはT細胞に依存する免疫反応に必須の過程であるが,制御性B細胞の機能においても重要であると考えられている.B細胞に特異的なCD40欠損キメラマウスでは実験的自己免疫性脳脊髄炎が重症化し,この病態はB細胞によるインターロイキン10の産生能の低下によることが報告された5).コラーゲン誘導関節炎モデルにおいても,CD40を刺激したB細胞はインターロイキン10の産生能が亢進し,この細胞を移入することにより関節炎が抑制されることが示された12).
B細胞受容体は抗原に特異的なB細胞の応答において必須である.実験的自己免疫性脳脊髄炎を発症したマウスから単離したB細胞(自己抗原を認識するB細胞が含まれる)を別のマウスに移入すると実験的自己免疫性脳脊髄炎を抑制することができるが,免疫していないマウスから単離したB細胞ではその抑制効果は非常に弱かった39).また,抗原の認識を固定したB細胞受容体(自己抗原には反応しない)をもつB細胞は実験的自己免疫性脳脊髄炎を抑制できなかった.さらに,実験的自己免疫性脳脊髄炎をひき起こしたマウスから単離したB細胞のB細胞受容体を刺激するとインターロイキン10が分泌された5).これらの結果から,制御性B細胞の免疫反応の抑制能には抗原特異性が必要であることが示唆された.
筆者らの研究より,B細胞受容体の下流においてインターロイキン10の産生に重要なのはCa2+シグナルであることが明らかにされた40)(新着論文レビュー でも掲載).B細胞受容体を刺激すると,活性化されたホスホリパーゼCγ2がイノシトール1,4,5-トリスリン酸を産生し,これが小胞体膜にあるイノシトールトリスリン酸受容体と結合することにより小胞体に貯蔵されたCa2+が細胞質へ放出される.小胞体からのCa2+の遊離は急速に起こるが少量かつ一過性であり,細胞におけるCa2+濃度の維持には細胞外からのCa2+の持続的な流入が必要である.STIMは小胞体内腔におけるCa2+の減少を感知すると,細胞膜にあるCa2+チャネルと相互作用し活性化してCa2+が流入する.この過程はストア作動性Ca2+流入とよばれる41).B細胞に特異的にSTIMを欠損したマウスにおいてはストア作動性Ca2+流入が阻害されるが,これにくわえ,インターロイキン10の分泌がいちじるしく低下した.このCa2+により活性化されたカルシニューリンおよび転写因子NFATがインターロイキン10の発現を誘導すると考えられた40)(図3).B細胞においてSTIMを特異的に欠損したマウスにおいては実験的自己免疫性脳脊髄炎が増悪し,このマウスに由来するB細胞においてはインターロイキン10の産生も阻害されていたことから,Ca2+の流入がB細胞による免疫反応の抑制能に重要であることがわかった40).
CD40シグナル,Toll様受容体シグナル,B細胞受容体シグナルはインターロイキン10の産生において重要であるが,厳密な意味では,制御性B細胞の分化に必要なのか,あるいは,インターロイキン10遺伝子の転写に必要なのか,わかっていない.これら以外にも,インターロイキン21受容体あるいはMHCクラスII分子を欠失したB細胞も実験的自己免疫性脳脊髄炎に対する抑制能を失うことが知られているが42),これらはすべてプラズマ細胞の分化に必須であることから,いまだ解明されていない制御性B細胞の分化の機構を理解する手がかりになると期待される.
おわりに
B細胞は免疫反応の促進および抑制の二面性をもつことから,それらの作用のバランスや相互のフィードバック機構の破綻が疾病の病態に関与することが示唆される.このレビューでとりあげたほかにも,ヒトにおいてインターロイキン10を産生する複数のB細胞のサブセットが同定されており15,23,43),マウスにおける知見とあわせると制御性B細胞は均一なサブセットからなるとは考えにくく,このことは研究を進めるうえでの障壁のひとつとなっている.その点においても,制御性T細胞におけるFoxP3のような制御性B細胞において特異的な遺伝子,あるいは,共通して利用するシグナルが存在するのかどうかをはっきりさせることが重要だと考えられる.抑制性B細胞が多種多様であった場合には,疾患ごとに性状,機能,分子基盤を明らかにしていくことが必須であろう.そのうえで,ヒトにおいて制御性B細胞と疾患の病態との因果関係を明らかにし,B細胞の機能を標的とした臨床応用へと展開されることを期待したい.
文 献
- Mauri, C. & Menon, M.: The expanding family of regulatory B cells. Int. Immunol., 27, 479-486 (2015)[PubMed]
- Neta, R. & Salvin, S. B.: Specific suppression of delayed hypersensitivity: the possible presence of a suppressor B cell in the regulation of delayed hypersensitivity. J. Immunol., 113, 1716-1725 (1974)[PubMed]
- Wolf, S .D., Dittel, B. N., Hardardottir, F. et al.: Experimental autoimmune encephalomyelitis induction in genetically B cell-deficient mice. J. Exp. Med., 184, 2271-2278 (1996)[PubMed]
- Mizoguchi, A., Mizoguchi, E., Takedatsu H. et al.: Chronic intestinal inflammatory condition generates IL-10-producing regulatory B cell subset characterized by CD1d upregulation. Immunity, 16, 219-230 (2002)[PubMed]
- Fillatreau, S., Sweenie, C. H., McGeachy, M. J. et al.: B cells regulate autoimmunity by provision of IL-10. Nat. Immunol., 3, 944-950 (2002)[PubMed]
- Mauri, C. & Bosma, A.: Immune regulatory function of B cells. Annu. Rev. Immunol., 30, 221-241 (2012)[PubMed]
- Nishimura, S., Manabe, I., Takaki, S. et al.: Adipose natural regulatory B cells negatively control adipose tissue inflammation. Cell Metab., 18, 759-766 (2013)[PubMed] [新着論文レビュー]
- Zhang, Y., Morgan, R., Podack, E. R. et al.: B cell regulation of anti-tumor immune response. Immunol. Res., 57, 115-124 (2013)[PubMed]
- Dalloul, A.: B-cell-mediated strategies to fight chronic allograft rejection. Front. Immunol., 4, 444 (2013)[PubMed]
- Rowe, V., Banovic, T., MacDonald, K. P. et al.: Host B cells produce IL-10 following TBI and attenuate acute GVHD after allogeneic bone marrow transplantation. Blood, 108, 2485-2492 (2006)[PubMed]
- Rosser, E. C. & Mauri, C.: Regulatory B cells: origin, phenotype, and function. Immunity, 42, 607-612 (2015)[PubMed]
- Evans, J. G., Chavez-Rueda, K. A., Eddaoudi, A. et al.: Novel suppressive function of transitional 2 B cells in experimental arthritis. J. Immunol., 178, 7868-7878 (2007)[PubMed]
- Yanaba, K., Bouaziz, J. D., Haas, K. M. et al.: A regulatory B cell subset with a unique CD1dhiCD5+ phenotype controls T cell-dependent inflammatory responses. Immunity, 28, 639-650 (2008)[PubMed]
- Neves, P., Lampropoulou, V., Calderon-Gomez, E. et al.: Signaling via the MyD88 adaptor protein in B cells suppresses protective immunity during Salmonella typhimurium infection. Immunity, 33, 777-790 (2010)[PubMed]
- Matsumoto, M., Baba, A., Yokota, T. et al.: Interleukin-10-producing plasmablasts exert regulatory function in autoimmune inflammation. Immunity, 41, 1040-1051 (2014)[PubMed] [新着論文レビュー]
- Yang, M., Deng, J., Liu, Y. et al.: IL-10-producing regulatory B10 cells ameliorate collagen-induced arthritis via suppressing Th17 cell generation. Am. J. Pathol., 180, 2375-2385 (2012)[PubMed]
- Lino, A. C., Dorner, T., Bar-Or, A. et al.: Cytokine-producing B cells: a translational view on their roles in human and mouse autoimmune diseases. Immunol. Rev., 269, 130-144 (2016)[PubMed]
- Matsushita, T., Yanaba, K., Bouaziz, J. D. et al.: Regulatory B cells inhibit EAE initiation in mice while other B cells promote disease progression. J. Clin. Invest., 118, 3420-3430 (2008)[PubMed]
- Shen, P., Roch, T., Lampropoulou, V. et al.: IL-35-producing B cells are critical regulators of immunity during autoimmune and infectious diseases. Nature, 507, 366-370 (2014)[PubMed]
- Wang, R. X., Yu, C. R., Dambuza, I. M. et al.: Interleukin-35 induces regulatory B cells that suppress autoimmune disease. Nat. Med., 20, 633-641 (2014)[PubMed]
- Khan, A. R., Hams, E., Floudas, A. et al.: PD-L1hi B cells are critical regulators of humoral immunity. Nat. Commun., 6, 5997 (2015)[PubMed]
- Hauser, S. L., Waubant, E., Arnold, D. L. et al.: B-cell depletion with rituximab in relapsing-remitting multiple sclerosis. N. Engl. J. Med., 358, 676-688 (2008)[PubMed]
- Duddy, M., Niino, M., Adatia, F. et al.: Distinct effector cytokine profiles of memory and naive human B cell subsets and implication in multiple sclerosis. J. Immunol., 178, 6092-6099 (2007)[PubMed]
- Yang, M., Sun, L., Wang, S. et al.: Novel function of B cell-activating factor in the induction of IL-10-producing regulatory B cells. J. Immunol., 184, 3321-3325 (2010)[PubMed]
- Inoue, S., Leitner, W. W., Golding, B. et al.: Inhibitory effects of B cells on antitumor immunity. Cancer Res., 66, 7741-7747 (2006)[PubMed]
- Horikawa, M., Minard-Colin, V., Matsushita, T. et al.: Regulatory B cell production of IL-10 inhibits lymphoma depletion during CD20 immunotherapy in mice. J. Clin. Invest., 121, 4268-4280 (2011)[PubMed]
- Ganti, S. N., Albershardt, T. C., Iritani, B. M. et al.: Regulatory B cells preferentially accumulate in tumor-draining lymph nodes and promote tumor growth. Sci. Rep., 5, 12255 (2015)[PubMed]
- Shalapour, S., Font-Burgada, J., Di Caro, G. et al.: Immunosuppressive plasma cells impede T-cell-dependent immunogenic chemotherapy. Nature, 521, 94-98 (2015)[PubMed]
- Olkhanud, P. B., Damdinsuren, B., Bodogai, M. et al.: Tumor-evoked regulatory B cells promote breast cancer metastasis by converting resting CD4+ T cells to T-regulatory cells. Cancer Res., 71, 3505-3515 (2011)[PubMed]
- van der Vlugt, L. E., Labuda, L. A., Ozir-Fazalalikhan, A. et al.: Schistosomes induce regulatory features in human and mouse CD1dhi B cells: inhibition of allergic inflammation by IL-10 and regulatory T cells. PLoS One, 7, e30883 (2012)[PubMed]
- Wilson, M. S., Taylor, M. D., O'Gorman, M. T. et al.: Helminth-induced CD19+CD23hi B cells modulate experimental allergic and autoimmune inflammation. Eur. J. Immunol., 40, 1682-1696 (2010)[PubMed]
- Correale, J., Farez, M. & Razzitte, G.: Helminth infections associated with multiple sclerosis induce regulatory B cells. Ann. Neurol., 64, 187-199 (2008)[PubMed]
- Madan, R., Demircik, F., Surianarayanan, S. et al.: Nonredundant roles for B cell-derived IL-10 in immune counter-regulation. J. Immunol., 183, 2312-2320 (2009)[PubMed]
- Rangaswamy, U. S. & Speck, S. H.: Murine gammaherpesvirus M2 protein induction of IRF4 via the NFAT pathway leads to IL-10 expression in B cells. PLoS Pathog., 10, e1003858 (2014)[PubMed]
- Liu, J., Zhan, W., Kim, C. J. et al.: IL-10-producing B cells are induced early in HIV-1 infection and suppress HIV-1-specific T cell responses. PLoS One, 9, e89236 (2014)[PubMed]
- Das, A., Ellis, G., Pallant, C. et al.: IL-10-producing regulatory B cells in the pathogenesis of chronic hepatitis B virus infection. J. Immunol., 189, 3925-3935 (2012)[PubMed]
- Baba, Y., Matsumoto, M. & Kurosaki, T.: Signals controlling the development and activity of regulatory B-lineage cells. Int. Immunol., 27, 487-493 (2015)[PubMed]
- Lampropoulou, V., Hoehlig, K., Roch, T. et al.: TLR-activated B cells suppress T cell-mediated autoimmunity. J. Immunol., 180, 4763-4773 (2008)[PubMed]
- Matsushita, T., Horikawa, M., Iwata, Y. et al.: Regulatory B cells (B10 cells) and regulatory T cells have independent roles in controlling experimental autoimmune encephalomyelitis initiation and late-phase immunopathogenesis. J. Immunol., 185, 2240-2252 (2010)[PubMed]
- Matsumoto, M., Fujii, Y., Baba, A. et al.: The calcium sensors STIM1 and STIM2 control B cell regulatory function through interleukin-10 production. Immunity, 34, 703-714 (2011)[PubMed] [新着論文レビュー]
- Baba, Y. & Kurosaki, T.: Impact of Ca2+ signaling on B cell function. Trends Immunol., 32, 589-594 (2011)[PubMed]
- Yoshizaki, A., Miyagaki, T., DiLillo, D. J. et al.: Regulatory B cells control T-cell autoimmunity through IL-21-dependent cognate interactions. Nature, 491, 264-268 (2012)[PubMed]
- Blair, P. A., Norena, L. Y., Flores-Borja, F. et al.: CD19+CD24hiCD38hi B cells exhibit regulatory capacity in healthy individuals but are functionally impaired in systemic lupus erythematosus patients. Immunity, 32, 129-140 (2010)[PubMed]
著者プロフィール
略歴:2002年 大阪大学大学院医学系研究科博士課程 修了,同年 米国Oklahoma Medical Research Foundation博士研究員,2005年 理化学研究所免疫アレルギー科学総合研究センター 研究員を経て,2008年より大阪大学免疫学フロンティア研究センター 特任准教授.
© 2016 馬場 義裕 Licensed under CC 表示 2.1 日本