器官のサイズを制御するHippo-YAP/TAZシグナル伝達経路
2016/04/21
宮村憲央・仁科博史
(東京医科歯科大学難治疾患研究所 発生再生生物学分野)
email:宮村憲央,仁科博史
領域融合レビュー, 5, e004 (2016) DOI: 10.7875/leading.author.5.e004
Norio Miyamura & Hiroshi Nishina: Organ size regulation by Hippo-YAP/TAZ signaling pathway.

体や器官のサイズがどのように制御されているのかはながらく不明であったが,近年,その分子実態が明らかにされつつある.体のサイズは骨形成により制御され,骨形成の制御は成長ホルモンおよびインスリン様成長因子により担われる.一方,器官のサイズは細胞の数および大きさにより制御される.近年,Hippo-YAP/TAZシグナル伝達経路が細胞の数を制御することにより,器官のサイズの制御において中心的な役割を担うことが示された.また,Hippo-YAP/TAZシグナル伝達経路はがんの発症や悪性化にも深く関与することが示されている.さらに,Hippo-YAP/TAZシグナル伝達経路は器官の3次元の構築を制御することも明らかにされつつある.このレビューでは,成長ホルモンによる体のサイズの制御機構,および,Hippo-YAP/TAZシグナル伝達経路による器官のサイズの制御機構について解説する.
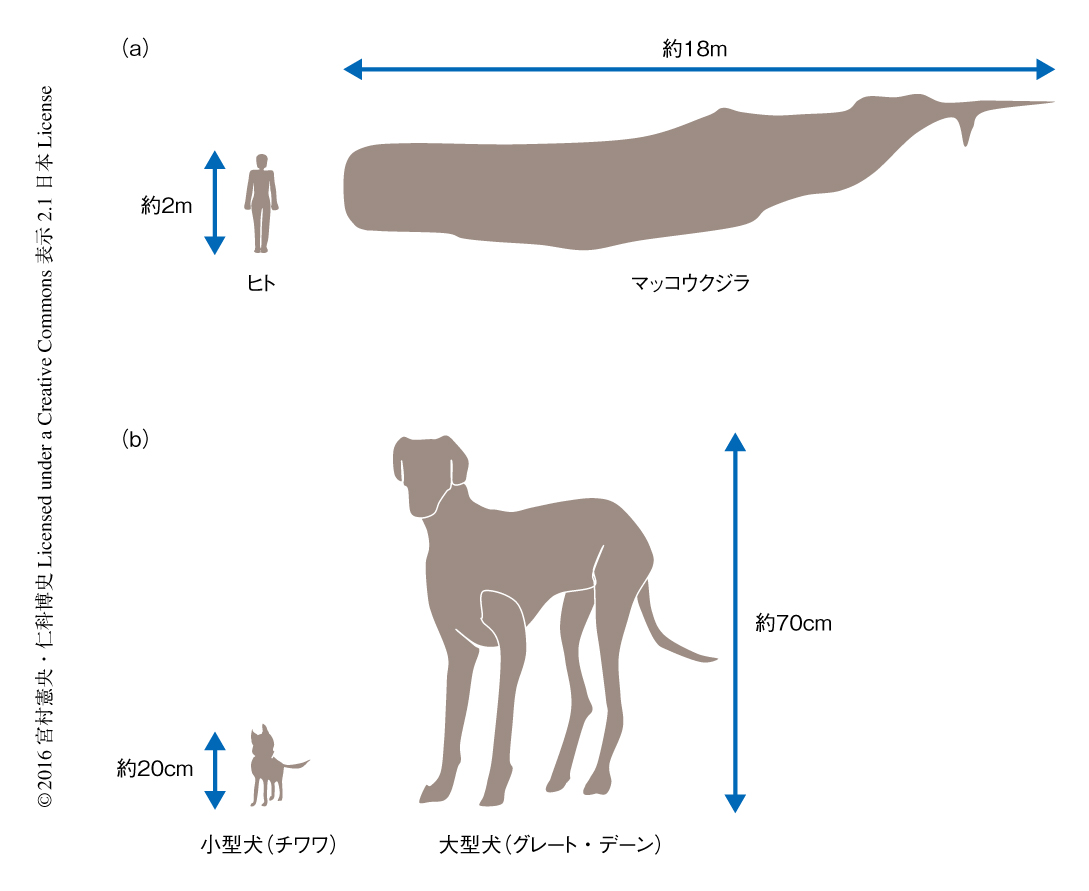
地球上には多種多様な生物が存在し,その体のサイズはさまざまである.哺乳動物では,体長が数cmのマウスから,約2 mのヒト,数十mのクジラなどが存在する(図1a).イヌでは小型犬と大型犬とで体長(体高)が数倍も異なる(図1b).こうした体のサイズの制御には,成長ホルモンおよびインスリン様成長因子による骨形成が重要な役割を担うことが示されている.また,哺乳動物の器官において,肝臓は0.033×体重0.87,心臓は0.006×体重0.98,脳は0.011×体重0.76の関係にあることが報告されている1).このように,器官のサイズが体のサイズに対し決まった割合に形成あるいは維持されるしくみの存在が示唆される.しかしながら,こうしたしくみがどのような分子機構により担われているかは不明である.一方,器官のサイズは器官を構成する細胞の数および大きさにより決定される.近年,器官のサイズを制御するシグナル伝達経路のひとつとして,細胞の数の制御を担うHippo-YAP/TAZシグナル伝達経路が同定された2).Hippo-YAP/TAZシグナル伝達経路はショウジョウバエからマウス,ヒトにまで保存されており,器官のサイズの制御において中心的な役割を担うことが示されている.また,器官のサイズの制御の破綻によりがんを発症することが示されており,Hippo-YAP/TAZシグナル伝達経路と発がんとの関連が注目されている.
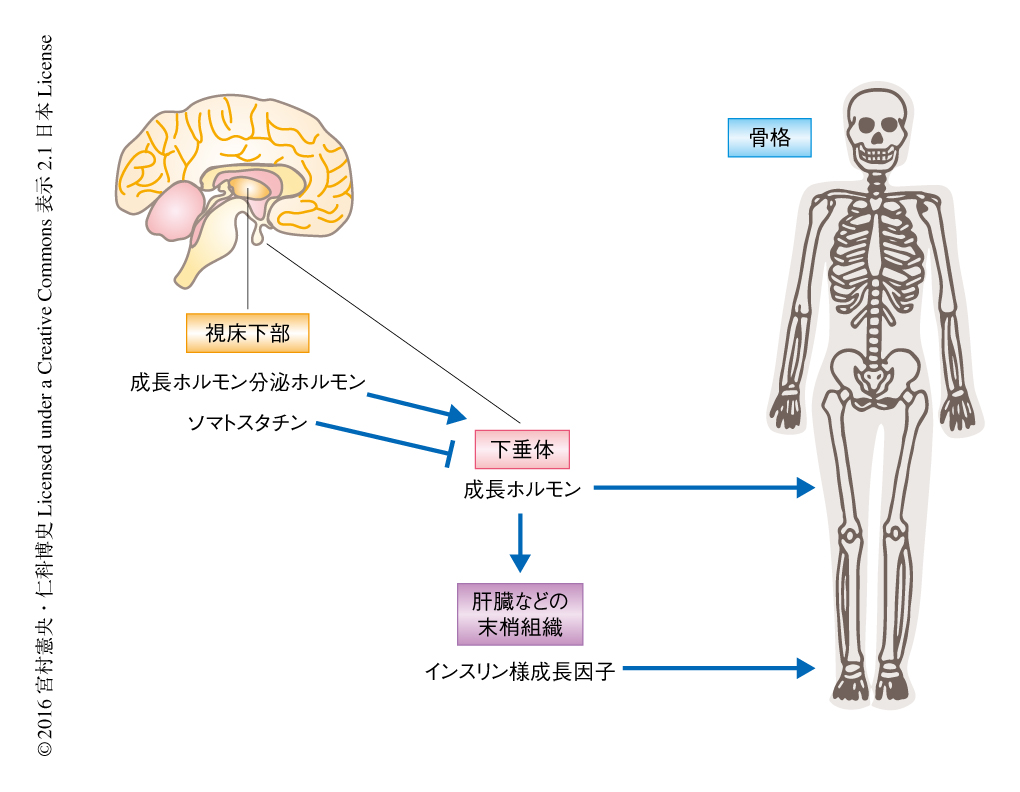
1909年,イヌの下垂体を切除することにより体のサイズが低下することが示され,成長を促進する因子が下垂体に存在することが示唆された3).1920年代には,下垂体から分泌されるタンパク質の単離および精製により,成長ホルモンが同定された(図2).成長ホルモンは視床下部から放出される2種類のホルモンによりその発現が制御される4).ひとつは成長ホルモン放出ホルモンであり,成長ホルモンの分泌を促進する.もうひとつはソマトスタチンであり,成長ホルモンの分泌を抑制する.成長ホルモンは骨端線の骨芽細胞に作用し,骨形成を促進し体長を増加させる.また,成長ホルモンの投与により血中に分泌されるタンパク質が発見され,ソマトメジンと命名された.解析の結果,ソマトメジンAおよびソマトメジンCは,それぞれ,インスリン様成長因子IIおよびインスリン様成長因子Iと同定された.インスリン様成長因子はその受容体を介してPI3K-mTORシグナル伝達経路を活性化し,間葉系幹細胞の骨芽細胞への分化を誘導し,骨形成を促進して体長を増加させる3,4).
成長ホルモンやインスリン様成長因子の体のサイズへの影響について,動物実験の例がいくつか報告されている.1982年,成長ホルモンを過剰に発現するトランスジェニックマウスが作出された5).このマウスの体重は正常の約2倍まで増加し,スーパーマウスと名づけられた.下垂体の発生にかかわるProp1遺伝子を欠損させたノックアウトマウスの体重は,成長ホルモンの発現の低下により正常の約50%まで減少した6).成長ホルモン受容体のノックアウトマウスや,インスリン様成長因子Iの肝臓に特異的なノックアウトマウスも,約50%の体重になった5).インスリン様成長因子の体のサイズへの影響は,大型犬および小型犬を用いた遺伝的な解析においても示された7).大型犬と小型犬とのあいだでインスリン様成長因子Iをコードする遺伝子に1塩基多型(single nucleotide polymorphism:SNP)が検出された.この1塩基多型により,小型犬ではインスリン様成長因子Iの分泌量は大型犬の約半分まで減少し,骨形成は低下し体長は減少した.動物の大型化は畜産の分野において関心が高い.近年,成長ホルモンを過剰に発現するトランスジェニックブタは,成長の速度の亢進および約10%の体重の増加を示すことが報告された8).
また,成長ホルモンはヒトにおいて小人症や巨人症の発症にも関与する5).小人症の一種である成長ホルモン分泌不全性低身長症は,成長ホルモンの分泌の低下による骨形成の低下を原因として発症する.巨人症は成長ホルモンの過剰な分泌により身長や四肢などに成長の異常を起こすことで発症する.これらの疾患においては,外科的な切除や薬物の投与による治療が確立されている.すでに1956年には,小人症の治療に成長ホルモンが有効であることが証明されており,60年まえから臨床に応用された長い歴史がある.近年,巨人症においてはソマトスタチン誘導体や成長ホルモン受容体の拮抗薬を投与する治療が行われている.
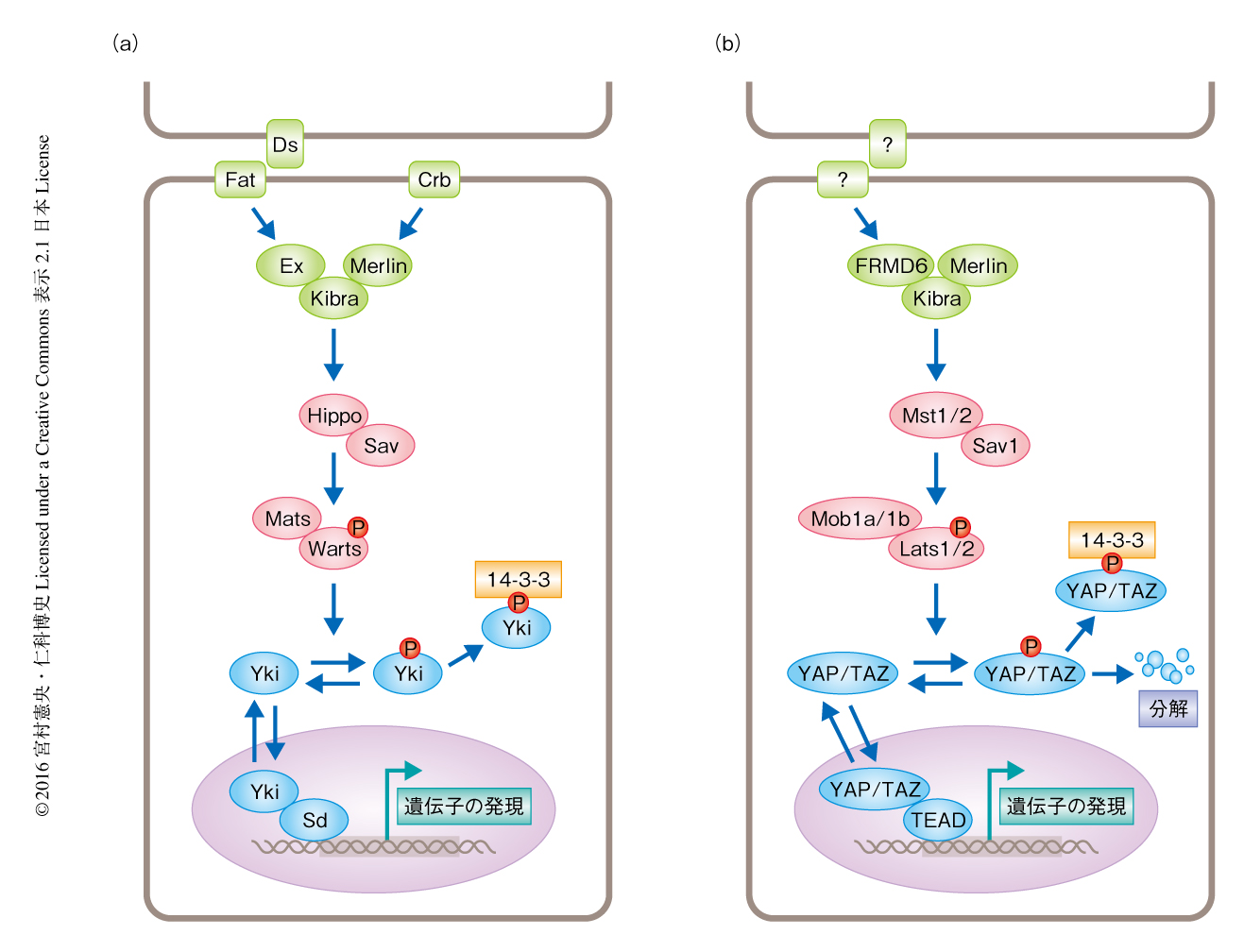
1990年代,p53遺伝子やRb遺伝子につぐ新たながん抑制遺伝子を探索するため,ショウジョウバエのモザイク解析法を用いた遺伝学的なスクリーニングが行われた9,10).その結果,Hippo遺伝子を含む複数のがん抑制遺伝子がクローニングされ,2003年,がん抑制シグナル伝達経路としてHippoシグナル伝達経路が発見された(図3a).そののち,Hippoシグナル伝達経路の標的となるタンパク質として転写共役因子であるYkiが同定され,Ykiと転写因子との複合体が細胞の増殖や細胞死に関与する遺伝子の転写を制御することが明らかにされた.ショウジョウバエの複眼や翅においてHippoシグナル伝達経路を破綻させるとYkiが活性化し,複眼の過形成や翅の肥大が観察された.のちの解析により,Hippo-Ykiシグナル伝達経路は細胞の数を制御することにより器官のサイズを制御することが示された.2007年以降,Hippo-Ykiシグナル伝達経路は哺乳動物においても高度に保存されていることが示された9)(図3b).ショウジョウバエのHippo遺伝子は哺乳動物のMst1遺伝子およびMst2遺伝子の相同遺伝子である.Warts遺伝子はLats1遺伝子およびLats2遺伝子の,Mats遺伝子はMob1a遺伝子およびMob1b遺伝子の,Yki遺伝子はYAP遺伝子およびそのパラログであるTAZ遺伝子の相同遺伝子である.
2007年,YAPをドキシサイクリンに依存して肝臓において過剰に発現するトランスジェニックマウスが作出された2,9).正常なマウスの肝臓のサイズは体重の約5%であるが,このトランスジェニックマウスの肝臓のサイズは,ドキシサイクリンの投与ののち4週間までに約5倍に増大した.興味深いことに,8週目にドキシサイクリンの投与を中止すると,中止ののち2週間までに肝臓はもとのサイズにもどった.こうした肝臓のサイズの可逆的な制御から,YAPは哺乳動物における器官のサイズの制御において中心的な役割を担うことが示唆された.また,Hippo-YAP/TAZシグナル伝達経路の構成タンパク質のノックアウトマウスについても,肝臓のサイズの増大が報告されている2,9).Mst1とMst2の肝臓に特異的なダブルノックアウトマウスの肝臓のサイズは生後2カ月で約5倍に,Mob1aとMob1bの肝臓に特異的なダブルノックアウトマウスの肝臓のサイズは生後14日で約4倍に,Sav1の肝臓に特異的なノックアウトマウスの肝臓のサイズは生後4~6カ月で約1.5倍に増大した.また,Nf2遺伝子がコードするMerlinの肝臓に特異的なノックアウトマウスの肝臓のサイズは約5倍まで増大したが,さらにYAPを欠損させることによりこの増大は抑制された.この結果から,Merlinの欠損による肝臓の増大はYAPを介し制御されることが示された.肝臓のほか,小腸,皮膚,心臓などの組織においても,Hippo-YAP/TAZシグナル伝達経路が器官のサイズを制御することが示されている2).
そのほかにも,肝臓のサイズの増大を示すトランスジェニックマウスやノックアウトマウスが報告されている.転写共役因子βカテニンのトランスジェニックマウスや,βカテニンの分解にかかわるAPCのノックアウトマウスの肝臓のサイズは2~3倍に増大した11).低分子量Gタンパク質Rasの活性型変異体のトランスジェニックマウス,および,リン酸化酵素Aktの活性型変異体のトランスジェニックマウスの肝臓のサイズは2~3倍に12,13),ホスファチジルイノシトールトリスリン酸の脱リン酸化を触媒する酵素PTENの肝臓に特異的なノックアウトマウスの肝臓のサイズは2~3倍に11),細胞接着に関与するインテグリンの関連タンパク質ILKの肝臓に特異的なノックアウトマウスの肝臓のサイズは約2.5倍に14),オートファゴソームの構成タンパク質であるAtg7のノックアウトマウスの肝臓のサイズは2~4倍に増大した15).一方,肝細胞の増殖に重要であるHGFのトランスジェニックマウス,および,細胞周期を制御するサイクリンD1のトランスジェニックマウスの肝臓のサイズの増大は,それぞれ,約1.1倍,および,約1.5倍であった11,16).興味深いことに,Wnt-βカテニンシグナル伝達経路およびAkt-mTORシグナル伝達経路は,Hippo-YAP/TAZシグナル伝達経路とクロストークすることが明らかにされつつある17,18).これらの知見から,Wnt-βカテニンシグナル伝達経路あるいはAkt-mTORシグナル伝達経路の変異による肝臓のサイズの増大は,Hippo-YAP/TAZシグナル伝達経路を介する可能性が示唆された.
さきに述べた肝臓のサイズの増大を示すマウスの多くは,がんを発症する.ドキシサイクリンに依存してYAPを過剰に発現するトランスジェニックマウスは,2カ月以上にわたりYAPの活性化が持続されると肝細胞がんを発症した2,9).Mst1とMst2の肝臓に特異的なダブルノックアウトマウスは生後3カ月で肝細胞がんを発症した2,9).Mob1aとMob1bの肝臓に特異的なダブルノックアウトマウスは生後4カ月で,Sav1の肝臓に特異的なノックアウトマウスは生後8カ月で,Merlinの肝臓に特異的なノックアウトマウスは生後6カ月で,肝細胞がんと胆管上皮細胞がんの混合がんを発症した2,9).Apcの肝臓に特異的なノックアウトマウスは生後8カ月で11),PTENの肝臓に特異的なノックアウトマウスは生後10カ月で11),Atg7のノックアウトマウスは生後7カ月で15),サイクリンD1のトランスジェニックマウスは生後17カ月で,肝細胞がんを発症した16).
ヒトのがん組織において,PTEN遺伝子やApc遺伝子の欠失が生じていることが報告されている19,20).また近年,ヒトのがん組織において,YAPやTAZの高発現や核への局在の亢進が明らかにされている9,21).さらに,このYAPやTAZの高発現や核への局在は,がんの予後の不良に相関することが示されている.たとえば,YAPは肝がんの患者の約60%,非小細胞性肺がんの患者の約60%,胃がんの患者の約30%,卵巣がんの患者の約15%,TAZは肝がんの患者の約50%で,高発現や核への局在,および,予後の不良が示されている9).しかしながら,ヒトのがん組織において,MstやLatsの発現の低下や不活性化はみられるものの,これらの遺伝子の変異はあまり生じていない9).ヒトのがん組織におけるYAPやTAZの高発現や核への局在が,どのような機構によりひき起こされているかについては不明な点が多い.
正常な細胞の特性のひとつとして,細胞どうしの接触が密になると増殖を停止する細胞接触阻害が知られている.その分子機構として,細胞の接触によりYAP/TAZが不活性化し,細胞の増殖が停止することが示されている22).また,ヒトの上皮細胞を用いた研究により,YAP/TAZの活性化の状態が細胞外基質の硬度や細胞の形態に応じ変化することが明らかにされた22).細胞が硬い細胞外基質のうえに存在する場合や,細胞が広がっていてその面積が広い場合には,YAP/TAZは核に局在して遺伝子の発現を誘導し,細胞は増殖する.一方,細胞が柔らかい細胞外基質のうえに存在する場合や,細胞が縮んでいてその面積が狭い場合には,YAP/TAZは細胞質に局在し,細胞は増殖を停止する.これらの結果から,YAP/TAZが細胞外基質からのシグナルのエフェクターとして機能し,細胞の応答を制御することが示された.細胞外基質の硬度のシグナルは細胞骨格であるアクチン線維を介してYAP/TAZに伝達されると考えられている22).アクチン線維からYAP/TAZの活性化にいたる分子機構としては,Latsに依存的な機構および非依存的な機構が報告されている.
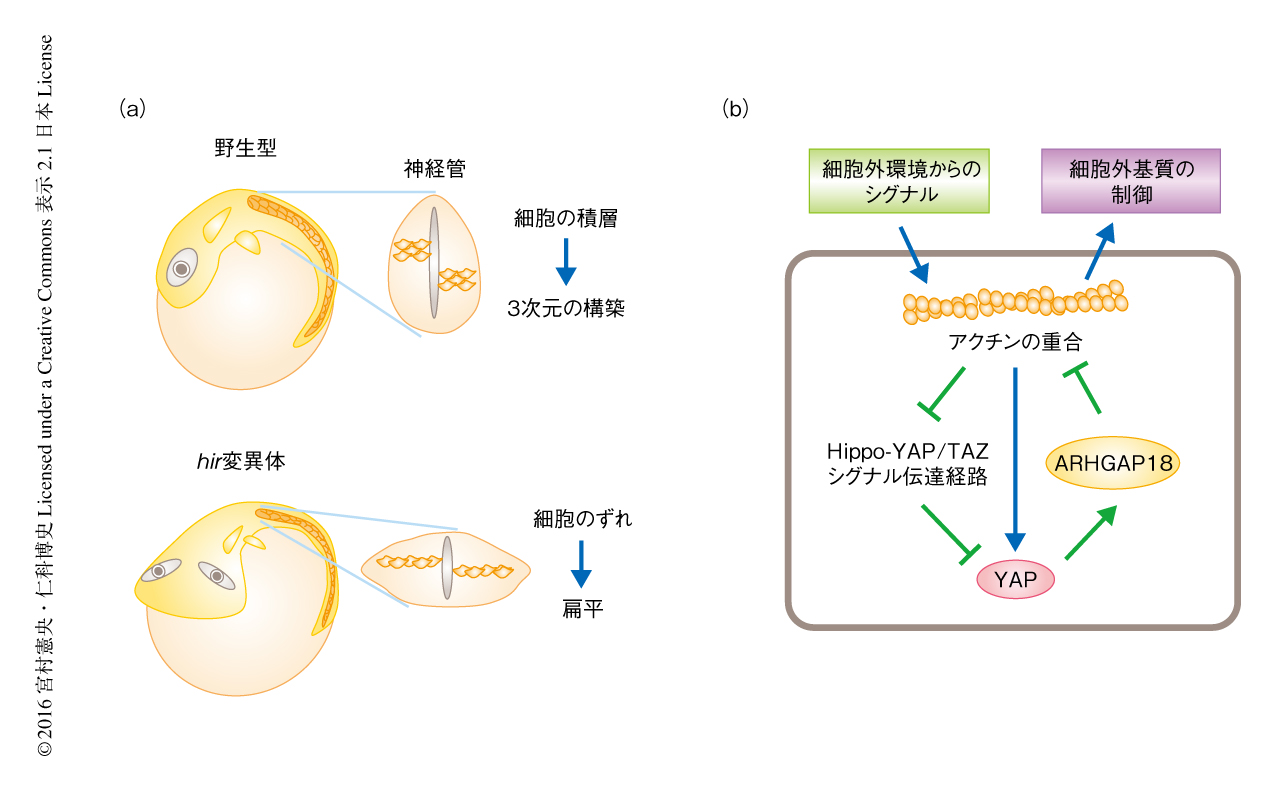
器官は3次元的な細胞の構築を必要とするが,こうした3次元の器官の構築を制御する分子機構については不明な点が多い.筆者らは,器官の形成機構に関与する新たなタンパク質を探索するため,メダカの胚を用いた大規模な変異体のスクリーニングを行った23)(新着論文レビュー でも掲載).その結果,3次元の組織の構造をとれずに体が扁平化するhirame(hir)変異体の単離に成功した(図4a).ポジショナルクローニングの結果,YAPをコードする遺伝子における変異が原因であることが判明した.張力を測定した結果,細胞張力が低下していること,アクトミオシンネットワークの活性の制御をYAPが担うことが見い出された.また,単一細胞のレベルでのタイムラプス解析から,hir変異体では細胞張力の異常により細胞が重力に抗う方向へと積み上がらず,神経管などの上皮組織が扁平化することが見い出された.さらに,YAPはアクチンの重合の制御を介してフィブロネクチンなどの細胞外基質の再編成をひき起こし,眼のレンズおよび網膜の正常な組織の配置に関与することが明らかにされた.すなわち,細胞外基質など細胞外からのシグナルはYAPの活性化をひき起こし,活性化したYAPはアクチンの重合を抑制し,細胞外基質を再編成する(図4b).こうしたYAPを介したフィードバックの機構の存在により,細胞は自らおかれた外環境を感知し適応することができると考えられる.
体のサイズおよび器官のサイズの制御を担う分子実態が明らかにされつつある.インスリン様成長因子はショウジョウバエにも保存されており,体のサイズを制御する24).体のサイズも器官のサイズも,種をこえて類似したタンパク質により制御されていることは興味深い.
器官のサイズの制御の破綻によりがんを発症することが示され,個体の維持において器官のサイズの制御が必須の役割をはたすことが明らかにされた.器官のサイズの制御を担う多数のタンパク質が報告されているが,Hippo-YAP/TAZシグナル伝達経路はその中心的な役割を担う.近年,Hippo-YAP/TAZシグナル伝達経路を標的とした,がんを含む各種の疾患の治療法の開発が注目されている25).
一方,器官のサイズが体のサイズに対し決まった割合に形成あるいは維持される機構については,いまだ不明である.この機構には,細胞外からのサイズの情報が必要と考えられる.最近,ショウジョウバエを用いた研究から,インスリン様成長因子からのシグナルはPI3KやTORの活性化を介しHippo-Ykiシグナル伝達経路とクロストークすることが示された26).インスリン様成長因子のシグナルはYkiを活性化し,細胞の数を増加させ,器官のサイズを増大させた.インスリン様成長因子とHippo-YAP/TAZシグナル伝達経路とのクロストークは,この機構を解明する鍵になる可能性がある.
略歴:2013年 東京医科歯科大学大学院生命情報科学教育部博士課程 修了,同年 東京医科歯科大学難治疾患研究所 研究員を経て,2014年 同 特任助教(現 助教).
研究テーマ:組織の構築および恒常性を維持する機構.
仁科 博史(Hiroshi Nishina)
東京医科歯科大学難治疾患研究所 教授.
研究室URL:http://www.tmd.ac.jp/mri/dbio/index.html
© 2016 宮村憲央・仁科博史 Licensed under CC 表示 2.1 日本
(東京医科歯科大学難治疾患研究所 発生再生生物学分野)
email:宮村憲央,仁科博史
領域融合レビュー, 5, e004 (2016) DOI: 10.7875/leading.author.5.e004
Norio Miyamura & Hiroshi Nishina: Organ size regulation by Hippo-YAP/TAZ signaling pathway.
要 約
体や器官のサイズがどのように制御されているのかはながらく不明であったが,近年,その分子実態が明らかにされつつある.体のサイズは骨形成により制御され,骨形成の制御は成長ホルモンおよびインスリン様成長因子により担われる.一方,器官のサイズは細胞の数および大きさにより制御される.近年,Hippo-YAP/TAZシグナル伝達経路が細胞の数を制御することにより,器官のサイズの制御において中心的な役割を担うことが示された.また,Hippo-YAP/TAZシグナル伝達経路はがんの発症や悪性化にも深く関与することが示されている.さらに,Hippo-YAP/TAZシグナル伝達経路は器官の3次元の構築を制御することも明らかにされつつある.このレビューでは,成長ホルモンによる体のサイズの制御機構,および,Hippo-YAP/TAZシグナル伝達経路による器官のサイズの制御機構について解説する.
はじめに
地球上には多種多様な生物が存在し,その体のサイズはさまざまである.哺乳動物では,体長が数cmのマウスから,約2 mのヒト,数十mのクジラなどが存在する(図1a).イヌでは小型犬と大型犬とで体長(体高)が数倍も異なる(図1b).こうした体のサイズの制御には,成長ホルモンおよびインスリン様成長因子による骨形成が重要な役割を担うことが示されている.また,哺乳動物の器官において,肝臓は0.033×体重0.87,心臓は0.006×体重0.98,脳は0.011×体重0.76の関係にあることが報告されている1).このように,器官のサイズが体のサイズに対し決まった割合に形成あるいは維持されるしくみの存在が示唆される.しかしながら,こうしたしくみがどのような分子機構により担われているかは不明である.一方,器官のサイズは器官を構成する細胞の数および大きさにより決定される.近年,器官のサイズを制御するシグナル伝達経路のひとつとして,細胞の数の制御を担うHippo-YAP/TAZシグナル伝達経路が同定された2).Hippo-YAP/TAZシグナル伝達経路はショウジョウバエからマウス,ヒトにまで保存されており,器官のサイズの制御において中心的な役割を担うことが示されている.また,器官のサイズの制御の破綻によりがんを発症することが示されており,Hippo-YAP/TAZシグナル伝達経路と発がんとの関連が注目されている.
1.体のサイズの制御
1909年,イヌの下垂体を切除することにより体のサイズが低下することが示され,成長を促進する因子が下垂体に存在することが示唆された3).1920年代には,下垂体から分泌されるタンパク質の単離および精製により,成長ホルモンが同定された(図2).成長ホルモンは視床下部から放出される2種類のホルモンによりその発現が制御される4).ひとつは成長ホルモン放出ホルモンであり,成長ホルモンの分泌を促進する.もうひとつはソマトスタチンであり,成長ホルモンの分泌を抑制する.成長ホルモンは骨端線の骨芽細胞に作用し,骨形成を促進し体長を増加させる.また,成長ホルモンの投与により血中に分泌されるタンパク質が発見され,ソマトメジンと命名された.解析の結果,ソマトメジンAおよびソマトメジンCは,それぞれ,インスリン様成長因子IIおよびインスリン様成長因子Iと同定された.インスリン様成長因子はその受容体を介してPI3K-mTORシグナル伝達経路を活性化し,間葉系幹細胞の骨芽細胞への分化を誘導し,骨形成を促進して体長を増加させる3,4).
成長ホルモンやインスリン様成長因子の体のサイズへの影響について,動物実験の例がいくつか報告されている.1982年,成長ホルモンを過剰に発現するトランスジェニックマウスが作出された5).このマウスの体重は正常の約2倍まで増加し,スーパーマウスと名づけられた.下垂体の発生にかかわるProp1遺伝子を欠損させたノックアウトマウスの体重は,成長ホルモンの発現の低下により正常の約50%まで減少した6).成長ホルモン受容体のノックアウトマウスや,インスリン様成長因子Iの肝臓に特異的なノックアウトマウスも,約50%の体重になった5).インスリン様成長因子の体のサイズへの影響は,大型犬および小型犬を用いた遺伝的な解析においても示された7).大型犬と小型犬とのあいだでインスリン様成長因子Iをコードする遺伝子に1塩基多型(single nucleotide polymorphism:SNP)が検出された.この1塩基多型により,小型犬ではインスリン様成長因子Iの分泌量は大型犬の約半分まで減少し,骨形成は低下し体長は減少した.動物の大型化は畜産の分野において関心が高い.近年,成長ホルモンを過剰に発現するトランスジェニックブタは,成長の速度の亢進および約10%の体重の増加を示すことが報告された8).
また,成長ホルモンはヒトにおいて小人症や巨人症の発症にも関与する5).小人症の一種である成長ホルモン分泌不全性低身長症は,成長ホルモンの分泌の低下による骨形成の低下を原因として発症する.巨人症は成長ホルモンの過剰な分泌により身長や四肢などに成長の異常を起こすことで発症する.これらの疾患においては,外科的な切除や薬物の投与による治療が確立されている.すでに1956年には,小人症の治療に成長ホルモンが有効であることが証明されており,60年まえから臨床に応用された長い歴史がある.近年,巨人症においてはソマトスタチン誘導体や成長ホルモン受容体の拮抗薬を投与する治療が行われている.
2.Hippo-YAP/TAZシグナル伝達経路による器官のサイズの制御
1990年代,p53遺伝子やRb遺伝子につぐ新たながん抑制遺伝子を探索するため,ショウジョウバエのモザイク解析法を用いた遺伝学的なスクリーニングが行われた9,10).その結果,Hippo遺伝子を含む複数のがん抑制遺伝子がクローニングされ,2003年,がん抑制シグナル伝達経路としてHippoシグナル伝達経路が発見された(図3a).そののち,Hippoシグナル伝達経路の標的となるタンパク質として転写共役因子であるYkiが同定され,Ykiと転写因子との複合体が細胞の増殖や細胞死に関与する遺伝子の転写を制御することが明らかにされた.ショウジョウバエの複眼や翅においてHippoシグナル伝達経路を破綻させるとYkiが活性化し,複眼の過形成や翅の肥大が観察された.のちの解析により,Hippo-Ykiシグナル伝達経路は細胞の数を制御することにより器官のサイズを制御することが示された.2007年以降,Hippo-Ykiシグナル伝達経路は哺乳動物においても高度に保存されていることが示された9)(図3b).ショウジョウバエのHippo遺伝子は哺乳動物のMst1遺伝子およびMst2遺伝子の相同遺伝子である.Warts遺伝子はLats1遺伝子およびLats2遺伝子の,Mats遺伝子はMob1a遺伝子およびMob1b遺伝子の,Yki遺伝子はYAP遺伝子およびそのパラログであるTAZ遺伝子の相同遺伝子である.
2007年,YAPをドキシサイクリンに依存して肝臓において過剰に発現するトランスジェニックマウスが作出された2,9).正常なマウスの肝臓のサイズは体重の約5%であるが,このトランスジェニックマウスの肝臓のサイズは,ドキシサイクリンの投与ののち4週間までに約5倍に増大した.興味深いことに,8週目にドキシサイクリンの投与を中止すると,中止ののち2週間までに肝臓はもとのサイズにもどった.こうした肝臓のサイズの可逆的な制御から,YAPは哺乳動物における器官のサイズの制御において中心的な役割を担うことが示唆された.また,Hippo-YAP/TAZシグナル伝達経路の構成タンパク質のノックアウトマウスについても,肝臓のサイズの増大が報告されている2,9).Mst1とMst2の肝臓に特異的なダブルノックアウトマウスの肝臓のサイズは生後2カ月で約5倍に,Mob1aとMob1bの肝臓に特異的なダブルノックアウトマウスの肝臓のサイズは生後14日で約4倍に,Sav1の肝臓に特異的なノックアウトマウスの肝臓のサイズは生後4~6カ月で約1.5倍に増大した.また,Nf2遺伝子がコードするMerlinの肝臓に特異的なノックアウトマウスの肝臓のサイズは約5倍まで増大したが,さらにYAPを欠損させることによりこの増大は抑制された.この結果から,Merlinの欠損による肝臓の増大はYAPを介し制御されることが示された.肝臓のほか,小腸,皮膚,心臓などの組織においても,Hippo-YAP/TAZシグナル伝達経路が器官のサイズを制御することが示されている2).
3.肝臓のサイズを制御するシグナル伝達経路
そのほかにも,肝臓のサイズの増大を示すトランスジェニックマウスやノックアウトマウスが報告されている.転写共役因子βカテニンのトランスジェニックマウスや,βカテニンの分解にかかわるAPCのノックアウトマウスの肝臓のサイズは2~3倍に増大した11).低分子量Gタンパク質Rasの活性型変異体のトランスジェニックマウス,および,リン酸化酵素Aktの活性型変異体のトランスジェニックマウスの肝臓のサイズは2~3倍に12,13),ホスファチジルイノシトールトリスリン酸の脱リン酸化を触媒する酵素PTENの肝臓に特異的なノックアウトマウスの肝臓のサイズは2~3倍に11),細胞接着に関与するインテグリンの関連タンパク質ILKの肝臓に特異的なノックアウトマウスの肝臓のサイズは約2.5倍に14),オートファゴソームの構成タンパク質であるAtg7のノックアウトマウスの肝臓のサイズは2~4倍に増大した15).一方,肝細胞の増殖に重要であるHGFのトランスジェニックマウス,および,細胞周期を制御するサイクリンD1のトランスジェニックマウスの肝臓のサイズの増大は,それぞれ,約1.1倍,および,約1.5倍であった11,16).興味深いことに,Wnt-βカテニンシグナル伝達経路およびAkt-mTORシグナル伝達経路は,Hippo-YAP/TAZシグナル伝達経路とクロストークすることが明らかにされつつある17,18).これらの知見から,Wnt-βカテニンシグナル伝達経路あるいはAkt-mTORシグナル伝達経路の変異による肝臓のサイズの増大は,Hippo-YAP/TAZシグナル伝達経路を介する可能性が示唆された.
4.器官のサイズの増大と発がん
さきに述べた肝臓のサイズの増大を示すマウスの多くは,がんを発症する.ドキシサイクリンに依存してYAPを過剰に発現するトランスジェニックマウスは,2カ月以上にわたりYAPの活性化が持続されると肝細胞がんを発症した2,9).Mst1とMst2の肝臓に特異的なダブルノックアウトマウスは生後3カ月で肝細胞がんを発症した2,9).Mob1aとMob1bの肝臓に特異的なダブルノックアウトマウスは生後4カ月で,Sav1の肝臓に特異的なノックアウトマウスは生後8カ月で,Merlinの肝臓に特異的なノックアウトマウスは生後6カ月で,肝細胞がんと胆管上皮細胞がんの混合がんを発症した2,9).Apcの肝臓に特異的なノックアウトマウスは生後8カ月で11),PTENの肝臓に特異的なノックアウトマウスは生後10カ月で11),Atg7のノックアウトマウスは生後7カ月で15),サイクリンD1のトランスジェニックマウスは生後17カ月で,肝細胞がんを発症した16).
ヒトのがん組織において,PTEN遺伝子やApc遺伝子の欠失が生じていることが報告されている19,20).また近年,ヒトのがん組織において,YAPやTAZの高発現や核への局在の亢進が明らかにされている9,21).さらに,このYAPやTAZの高発現や核への局在は,がんの予後の不良に相関することが示されている.たとえば,YAPは肝がんの患者の約60%,非小細胞性肺がんの患者の約60%,胃がんの患者の約30%,卵巣がんの患者の約15%,TAZは肝がんの患者の約50%で,高発現や核への局在,および,予後の不良が示されている9).しかしながら,ヒトのがん組織において,MstやLatsの発現の低下や不活性化はみられるものの,これらの遺伝子の変異はあまり生じていない9).ヒトのがん組織におけるYAPやTAZの高発現や核への局在が,どのような機構によりひき起こされているかについては不明な点が多い.
5.YAP/TAZの活性を制御する細胞外シグナル
正常な細胞の特性のひとつとして,細胞どうしの接触が密になると増殖を停止する細胞接触阻害が知られている.その分子機構として,細胞の接触によりYAP/TAZが不活性化し,細胞の増殖が停止することが示されている22).また,ヒトの上皮細胞を用いた研究により,YAP/TAZの活性化の状態が細胞外基質の硬度や細胞の形態に応じ変化することが明らかにされた22).細胞が硬い細胞外基質のうえに存在する場合や,細胞が広がっていてその面積が広い場合には,YAP/TAZは核に局在して遺伝子の発現を誘導し,細胞は増殖する.一方,細胞が柔らかい細胞外基質のうえに存在する場合や,細胞が縮んでいてその面積が狭い場合には,YAP/TAZは細胞質に局在し,細胞は増殖を停止する.これらの結果から,YAP/TAZが細胞外基質からのシグナルのエフェクターとして機能し,細胞の応答を制御することが示された.細胞外基質の硬度のシグナルは細胞骨格であるアクチン線維を介してYAP/TAZに伝達されると考えられている22).アクチン線維からYAP/TAZの活性化にいたる分子機構としては,Latsに依存的な機構および非依存的な機構が報告されている.
6.3次元の器官の構築を制御するYAP
器官は3次元的な細胞の構築を必要とするが,こうした3次元の器官の構築を制御する分子機構については不明な点が多い.筆者らは,器官の形成機構に関与する新たなタンパク質を探索するため,メダカの胚を用いた大規模な変異体のスクリーニングを行った23)(新着論文レビュー でも掲載).その結果,3次元の組織の構造をとれずに体が扁平化するhirame(hir)変異体の単離に成功した(図4a).ポジショナルクローニングの結果,YAPをコードする遺伝子における変異が原因であることが判明した.張力を測定した結果,細胞張力が低下していること,アクトミオシンネットワークの活性の制御をYAPが担うことが見い出された.また,単一細胞のレベルでのタイムラプス解析から,hir変異体では細胞張力の異常により細胞が重力に抗う方向へと積み上がらず,神経管などの上皮組織が扁平化することが見い出された.さらに,YAPはアクチンの重合の制御を介してフィブロネクチンなどの細胞外基質の再編成をひき起こし,眼のレンズおよび網膜の正常な組織の配置に関与することが明らかにされた.すなわち,細胞外基質など細胞外からのシグナルはYAPの活性化をひき起こし,活性化したYAPはアクチンの重合を抑制し,細胞外基質を再編成する(図4b).こうしたYAPを介したフィードバックの機構の存在により,細胞は自らおかれた外環境を感知し適応することができると考えられる.
おわりに
体のサイズおよび器官のサイズの制御を担う分子実態が明らかにされつつある.インスリン様成長因子はショウジョウバエにも保存されており,体のサイズを制御する24).体のサイズも器官のサイズも,種をこえて類似したタンパク質により制御されていることは興味深い.
器官のサイズの制御の破綻によりがんを発症することが示され,個体の維持において器官のサイズの制御が必須の役割をはたすことが明らかにされた.器官のサイズの制御を担う多数のタンパク質が報告されているが,Hippo-YAP/TAZシグナル伝達経路はその中心的な役割を担う.近年,Hippo-YAP/TAZシグナル伝達経路を標的とした,がんを含む各種の疾患の治療法の開発が注目されている25).
一方,器官のサイズが体のサイズに対し決まった割合に形成あるいは維持される機構については,いまだ不明である.この機構には,細胞外からのサイズの情報が必要と考えられる.最近,ショウジョウバエを用いた研究から,インスリン様成長因子からのシグナルはPI3KやTORの活性化を介しHippo-Ykiシグナル伝達経路とクロストークすることが示された26).インスリン様成長因子のシグナルはYkiを活性化し,細胞の数を増加させ,器官のサイズを増大させた.インスリン様成長因子とHippo-YAP/TAZシグナル伝達経路とのクロストークは,この機構を解明する鍵になる可能性がある.
文 献
- Calder, W. A.: Size, Function, and Life History. Harvard University Press, Boston (1984)
- Yu, F. -X., Zhao, B. & Guan, K. -L.: Hippo pathway in organ size control, tissue homeostasis, and cancer. Cell, 163, 811-828 (2015)[PubMed]
- Penzo-Mendez, A. I. & Stanger, B. Z.: Organ-size regulation in mammals. Cold Spring Harb. Perspect. Biol., 7, a019240 (2015)[PubMed]
- Kargi, A. Y. & Merriam, G. R.: Diagnosis and treatment of growth hormone deficiency in adults. Nat. Rev. Endocrinol., 9, 335-345 (2013)[PubMed]
- Kopchick, J. J., List, E. O., Kelder, B. et al.: Evaluation of growth hormone (GH) action in mice: discovery of GH receptor antagonists and clinical indications. Mol. Cell. Endocrinol., 386, 34-45 (2014)[PubMed]
- Nasonkin, I. O., Ward, R. D., Bavers, D. L. et al.: Aged PROP1 deficient dwarf mice maintain ACTH production. PLoS One, 6, e28355 (2011)[PubMed]
- Sutter, N. B., Bustamante, C. D., Chase, K. et al.: A single IGF1 allele is a major determinant of small size in dogs. Science, 316, 112-115 (2007)[PubMed]
- Ju, H., Zhang, J., Bai, L. et al.: The transgenic cloned pig population with integrated and controllable GH expression that has higher feed efficiency and meat production. Sci. Rep., 5, 10152 (2015)[PubMed]
- Harvey, K. F., Zhang, X. & Thomas, D. M.: The Hippo pathway and human cancer. Nat. Rev. Cancer, 13, 246-257 (2013)[PubMed]
- Xu, T., Wang, W., Zhang, S. et al.: Identifying tumor suppressors in genetic mosaics: the Drosophila lats gene encodes a putative protein kinase. Development, 121, 1053-1063 (1995)[PubMed]
- Newell, P., Villanueva, A., Friedman, S. L. et al.: Experimental models of hepatocellular carcinoma. J. Hepatol., 48, 858-879 (2008)[PubMed]
- Stein, T. J., Bowden, M. & Sandgren, E. P.: Minimal cooperation between mutant Hras and c-myc or TGFα in the regulation of mouse hepatocyte growth or transformation in vivo. Liver Int., 31, 1298-1305 (2011)[PubMed]
- Ono, H., Shimano, H., Katagiri, H. et al.: Hepatic Akt activation induces marked hypoglycemia, hepatomegaly, and hypertriglyceridemia with sterol regulatory element binding protein involvement. Diabetes, 52, 2905-2913 (2003)[PubMed]
- Gkretsi, V., Apte, U., Mars, W. M. et al.: Liver-specific ablation of integrin-linked kinase in mice results in abnormal histology, enhanced cell proliferation, and hepatomegaly. Hepatology, 48, 1932-1941 (2008)[PubMed]
- Schneider, J. L. & Cuervo, A. M.: Liver autophagy: much more than just taking out the trash. Nat. Rev. Gastroenterol. Hepatol., 11, 187-200 (2014)[PubMed]
- Deane, N. G., Parker, M. A., Aramandla, R. et al.: Hepatocellular carcinoma results from chronic cyclin D1 overexpression in transgenic mice. Cancer Res., 61, 5389-5395 (2001)[PubMed]
- Kim, M. & Jho, E. H.: Cross-talk between Wnt/β-catenin and Hippo signaling pathways: a brief review. BMB Rep., 47, 540-545 (2014)[PubMed]
- Tumaneng, K., Schlegelmilch, K., Russell, R. C. et al.: YAP mediates crosstalk between the Hippo and PI(3)K-TOR pathways by suppressing PTEN via miR-29. Nat. Cell Biol., 14, 1322-1329 (2012)[PubMed]
- Pez, F., Lopez, A., Kim, M. et al.: Wnt signaling and hepatocarcinogenesis: molecular targets for the development of innovative anticancer drugs. J. Hepatology, 59, 1107-1117 (2013)[PubMed]
- Michelotti, G. A., Machado, M. V. & Diehl, A. M.: NAFLD, NASH and liver cancer. Nat. Rev. Gastroenterol. Hepatol., 10, 656-665 (2013)[PubMed]
- Hayashi, H., Higashi, T., Yokoyama, N. et al.: An imbalance in TAZ and YAP expression in hepatocellular carcinoma confers cancer stem cell-like behaviors contributing to disease progression. Cancer Res., 75, 4985-4997 (2015)[PubMed]
- Dupont, S.: Role of YAP/TAZ in cell-matrix adhesion-mediated signalling and mechanotransduction. Exp. Cell Res., 343, 42-53 (2016)[PubMed]
- Porazinski, S., Wang, H., Asaoka, Y. et al.: YAP is essential for tissue tension to ensure vertebrate 3D body shape. Nature, 521, 217-221 (2015)[PubMed] [新着論文レビュー]
- Okamoto, N., Nakamori, R., Murai, T. et al.: A secreted decoy of InR antagonizes insulin/IGF signaling to restrict body growth in Drosophila. Genes Dev., 27, 87-97 (2013)[PubMed]
- Johnson, R. & Halder, G.: The two faces of Hippo: targeting the Hippo pathway for regenerative medicine and cancer treatment. Nat. Rev. Drug Discov., 13, 63-79 (2014)[PubMed]
- Strassburger, K., Tiebe, M., Pinna, F. et al.: Insulin/IGF signaling drives cell proliferation in part via Yorkie/YAP. Dev. Biol., 367, 187-196 (2012)[PubMed]
著者プロフィール
略歴:2013年 東京医科歯科大学大学院生命情報科学教育部博士課程 修了,同年 東京医科歯科大学難治疾患研究所 研究員を経て,2014年 同 特任助教(現 助教).
研究テーマ:組織の構築および恒常性を維持する機構.
仁科 博史(Hiroshi Nishina)
東京医科歯科大学難治疾患研究所 教授.
研究室URL:http://www.tmd.ac.jp/mri/dbio/index.html
© 2016 宮村憲央・仁科博史 Licensed under CC 表示 2.1 日本