植物に特徴的なタンパク質複合体による細胞分裂の制御機構
2016/05/16
伊藤正樹1・笹部美知子2・町田泰則3
(1名古屋大学大学院生命農学研究科 生命技術科学専攻分化情報制御研究分野,2弘前大学農学生命科学部 生物学科,3名古屋大学大学院理学研究科 生命理学専攻発生メカノ・セル・バイオロジーグループ)
email:伊藤正樹
領域融合レビュー, 5, e005 (2016) DOI: 10.7875/leading.author.5.e005
Masaki Ito, Michiko Sasabe & Yasunori Machida: Unique mechanisms of plant cell division regulated by multi-protein complexes.

植物の細胞は周囲に細胞壁をもつことから,植物は細胞分裂のために特有な制御機構を獲得した.とりわけ,細胞膜と細胞壁の構築が同時に起こる細胞質分裂は,細胞板の形成を含む植物に特有の過程である.筆者らは,この過程に必須である植物に固有のキネシン様タンパク質により制御されるMAPキナーゼカスケードを発見し,このカスケードは細胞質分裂装置において微小管の動きを制御することにより細胞板の形成を促進することを示した.さらに,この過程を含む植物のM期の進行にかかわる遺伝子の転写には転写因子としてR1R2R3型Mybが必須であること,R1R2R3型Mybには転写を活性化する活性化型Mybのほか抑制型Mybがあり,植物の器官の発生における細胞分裂の停止にも重要であることが見い出された.R1R2R3型MybはG1/S期の制御に重要な転写因子E2Fとともに大きなタンパク質複合体を形成しており,より広範囲な機能を担う可能性のあることもわかった.このMyb-E2F複合体の構成タンパク質には,動物において細胞周期にかかわる遺伝子の転写を負に制御するDREAM複合体の構成タンパク質と類似する複数のタンパク質が存在していたことから,植物においても,Myb-E2F複合体が細胞周期の制御において同様の機能をもつ可能性が考えられた.
細胞分裂は増殖という生命の本質的な属性の基礎であり,生物にとりもっとも重要な過程のひとつである.細胞分裂の過程は,細胞周期とよばれる制御された反応の位相をくり返すことにより,複製された染色体と細胞質成分を2つの娘細胞に分配するしくみである.このような細胞周期の分子レベルにおける研究にはおもに動物および酵母が用いられ,多くの成果が得られているが,M期における有糸分裂あるいは細胞質分裂のしくみについては不明な点が多い.植物における細胞分裂の研究も進み,DNAの複製などにかかわるG1/S期遺伝子と細胞質分裂などにかかわるG2/M期遺伝子の転写が周期的に変動すること1,2),G1/S期遺伝子の転写の制御には,動物と同様に,E2F-DPヘテロ二量体が中心的な役割を担うこと3) がわかってきた.しかし,植物の細胞は周囲を細胞壁にかこまれていることから,細胞分裂には植物に固有の過程がかかわると考えられる.また,植物の細胞は細胞壁の存在により移動できないことから,適切な器官の形成のためには細胞分裂の時空間的な制御が重要であるといわれている4).このような特徴をもつ植物における細胞周期のしくみを解明することにより,細胞分裂の機構に関しよりいっそう深い理解が得られるだけでなく,新奇な分子制御の過程が解明される可能性もある.筆者らは,植物に焦点をしぼり,細胞周期の分子制御の機構および細胞分裂と分化との関係を研究している.
筆者らは,これまでに,培養細胞を用いた研究により,G2/M期遺伝子のプロモーター領域には共通のシス配列であるMSA配列が存在すること,そして,この配列に結合する転写因子であるR1R2R3型MybによりG2/M期遺伝子の転写が制御されることを示してきた5).また,R1R2R3型Mybには,G2/M期遺伝子の転写を活性化する活性化型Mybと,逆に,G2/M期遺伝子を抑制する抑制型Mybが存在することも示された.これらの知見は,動物における細胞分裂の研究にさきがけて得られたものである.最近になり,シロイヌナズナを用いた研究により,抑制型Mybは器官の発生における細胞分裂の適切な停止に機能することがわかった6).さらに,R1R2R3型MybはG1/S期の制御に重要な転写因子E2Fと共通のタンパク質複合体に含まれることがわかり,ヒトやショウジョウバエにおいて細胞周期にかかわる遺伝子の転写制御に中心的なはたらきをする大きなタンパク質複合体であるDREAM複合体7) との機能的な類似性が考えられるようになった.一方,細胞周期においては,タンパク質の修飾や相互作用などの巧妙な転写後制御が重要であることが明らかにされてきた.筆者らは,植物に固有な細胞質分裂である細胞板の形成の分子機構について研究し,植物における細胞質分裂装置の動態およびその活性化のしくみについて明らかにした8,9).また,この過程にかかわる特徴的なメンブレントラフィックに関する研究が進み,分子レベルにおける理解が進んできた10,11).
このレビューにおいては,G2/M期遺伝子の転写の活性化および抑制のしくみについて述べ,M期の進行を実行するしくみの典型例として植物における細胞板の形成の制御機構について解説する.さらに,最近になり明らかにされた,植物におけるMyb-E2F複合体の発見について解説し,動物における類似の性質をもつDREAM複合体との関連性,また,植物の発生における細胞の増殖の抑制機構について議論する.
高度な同調培養が可能なタバコBY-2細胞を用いてM期サイクリンをコードするCYCB1遺伝子のプロモーターを詳細に解析した結果,G2/M期に特異的な転写の活性化を担うシス配列としてMSA配列が同定された12).シロイヌナズナには約180個のG2/M期遺伝子が存在するが,それらの遺伝子の多くは上流にMSA配列のモチーフが存在することから,MSA配列はG2/M期遺伝子を共通に制御するシス配列であると思われた13).このMSA配列に結合する転写因子を酵母ワンハイブリッド系によりスクリーニングした結果,タバコのMybであるNtmybA2が同定された14).CYCB1遺伝子のプロモーターに対する効果を調べた結果,NtmybA2はMSA配列に依存的に転写の活性化にはたらく転写因子であることが示された.
MSA配列に結合するR1R2R3型Mybは,植物に多く存在するR2R3型Mybとは異なり,動物の原がん遺伝子産物として知られるc-Mybとよく似たDNA結合ドメイン構造をもち,植物における祖先型のMybとみなされている5).R1R2R3型Mybは哺乳動物やショウジョウバエにおいてもG2/M期遺伝子の制御にかかわることが示されており,多細胞生物において広範囲に保存された転写制御経路を形成するものと思われる15,16).
シロイヌナズナのゲノムにはR1R2R3型Mybをコードする5個の遺伝子が存在し,そのうちMYB3R1遺伝子およびMYB3R4遺伝子はタバコの転写因子NtmybA2とよく似たアミノ酸配列をコードしていた.MYB3R1遺伝子およびMYB3R4遺伝子を同時に破壊した植物においては多くのG2/M期遺伝子の発現が低下していたことから,MYB3R1およびMYB3R4はシロイヌナズナにおいて転写の活性化にはたらく転写因子として機能し,G2/M期遺伝子を共通に制御するものと考えられた13,17).また,MYB3R4は分裂組織や増殖期の若い器官においてG2/M期の細胞に特異的に発現しており,それ自体が細胞周期において制御をうけていた.したがって,これら活性化型Mybのはたらきは,M期を実行するためのG2/M期遺伝子の発現を細胞周期の特定のタイミングにおいてオンにすることであると考えられた14,17).
活性化型Mybは細胞周期において二重のフィードバックループにより制御される.1つ目のフィードバックループは,活性化型MybがM期サイクリン依存性キナーゼの活性により直接のリン酸化をうけることである.タバコBY-2細胞においてM期サイクリンを一過的に発現すると,活性化型Mybの転写活性化能が増大した.M期サイクリンをコードする遺伝子は活性化型Mybの標的であることから,活性化型MybとM期サイクリンとのあいだには正のフィードバックループが成立する18).2つ目のフィードバックループは,活性化型Mybをコードする遺伝子の上流にMSA配列が存在し,それ自体がコードするタンパク質により転写活性化をうけることである19).このような二重のフィードバック制御はG2/M期遺伝子のバースト的な発現の上昇をひき起こし,G2期からM期への不可逆的な進入を決定づけると考えられる(図1).動物においては,このような正のフィードバックとして,サイクリン依存性キナーゼによるリン酸化をうけたホスファターゼCDC25がサイクリン依存性キナーゼを脱リン酸化し活性化するしくみが提唱されている20).活性化型Mybによるフィードバック制御は,CDC25のホモログをもたない植物が代替的に獲得したM期の開始のしくみなのかもしれない.
シロイヌナズナにおいてMYB3R1およびMYB3R4の機能が部分的に欠失した変異体では,途切れた細胞壁や多核の細胞が高頻度で出現するなど,不完全な細胞質分裂により生じる典型的な異常が観察された17).シロイヌナズナの細胞質分裂に必須な遺伝子として最初に同定されたKNOLLE遺伝子はG2/M期に特異的に発現し,細胞板の形成の際の小胞融合にかかわるSNAREタンパク質をコードする21).KNOLLE遺伝子のプロモーターは複数のMSA配列をもち,レポーターアッセイにおいてMSA配列に依存的して活性化型Mybによる転写活性化をうけた17).また,KNOLLE遺伝子の発現は活性化型Mybを部分的に欠失した植物においては低下しており,この植物においてKNOLLE遺伝子を過剰に発現させると細胞質分裂に関する表現型のほとんどが回復したことから,KNOLLE遺伝子はMYB3R1およびMYB3R4の下流において細胞質分裂の制御にはたらく鍵となる標的遺伝子である17).活性化型Mybの部分欠損変異体における遺伝子の発現を網羅的に解析した結果,MYB3R1およびMYB3R4による転写活性化の標的遺伝子には,KNOLLE遺伝子のほかにも細胞質分裂に関連する複数の遺伝子が含まれることがわかった13,17).たとえば,フラグモプラストの成長にかかわる微小管結合タンパク質MAP65,細胞板を構成する多糖の合成に関与するセルロース合成酵素類似タンパク質やエンド型β1,4グルカナーゼなどのほか,M期に特異的な多くのキネシン様タンパク質などをコードする遺伝子である.このように,活性化型Mybが標的遺伝子の転写制御を介し細胞質分裂の進行をささえるしくみが明らかにされた.
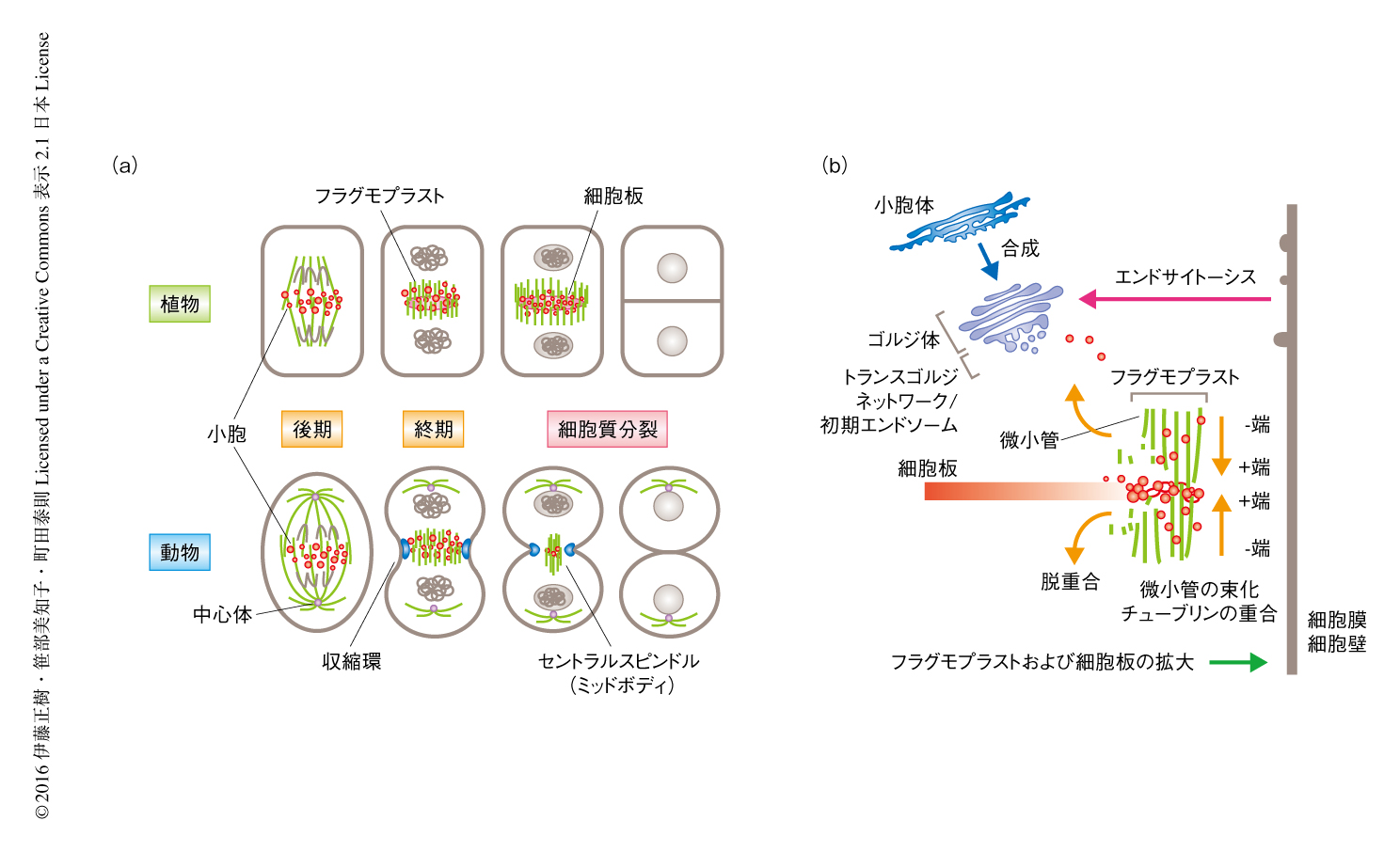
ここでは,R1R2R3型Mybの下流における事象として細胞質分裂をとりあげ,細胞板の形成に必須な転写後制御系,および,この制御におけるMyb標的遺伝子の関与について解説する.細胞質分裂は,複製された染色体と細胞質成分を2つの娘細胞に分離するM期における最後の過程である.動物の細胞質分裂は外側から内側への陥入によりひき起こされるのに対して,植物の細胞質分裂は細胞膜と細胞壁からなる細胞板が細胞の内側から外側にむかい形成されることにより起こる22-24)(図2a).このような動的な事象は,動物においては,分裂面に形成されるミオシンIIおよびアクチンフィラメントからなる収縮環と,分離した染色体のあいだに形成されるセントラルスピンドルあるいはミッドボディとよばれる細胞質分裂装置により実行される.一方,植物における細胞質分裂は,分離された染色体のあいだに形成されるフラグモプラストとよばれる細胞質分裂装置において進行する.セントラルスピンドルとフラグモプラストはいずれも極性をもつ2つの巨大な微小管束とアクチンフィラメントからなる構造体で,2つの微小管束は互いにプラス端側でむかいあう(図2b).最初,フラグモプラストは内側まで微小管がつまった構造をしているが,いったん,細胞板が形成されると細胞板をとりまくようなリング状の構造となり,細胞板の形成をともないながら遠心的に拡大し細胞壁まで到達する.細胞板の形成部位であるフラグモプラストの赤道面には,トランスゴルジネットワークあるいは初期エンドソームに由来する小胞が蓄積して融合し(図2b),融合した膜構造体において細胞壁の成分が合成されることにより細胞板の形成および拡大が進む.このように,植物の細胞質分裂は,微小管のダイナミクスを基礎とするフラグモプラストの形成と拡大,および,フラグモプラストにおける小胞の輸送と融合を基礎とする細胞板の形成,という2つの過程からなる.
フラグモプラストにおける微小管束のダイナミクスは細胞板の形成の原動力である.フラグモプラストの形成の開始のしくみは未解明であるが,フラグモプラストの拡大にはオーグミン-γチューブリン複合体による新規な微小管の形成のかかわることが明らかにされた25,26).フラグモプラストは安定な微小管束と動的で不安定な微小管により構成され,安定な微小管束からのγチューブリンを核とした新規で不安定な微小管の形成と,その束化による安定化,というくり返しによりフラグモプラストが拡大すると提唱されている(図2b).
筆者らは,タバコBY-2細胞を用いた生化学的および細胞生物学的な解析,および,シロイヌナズナを用いた分子遺伝学的な解析を組み合わせ,キネシン様タンパク質であるNACK1により活性化されるMAPキナーゼカスケードが植物の細胞質分裂において中心的な役割をはたすことを明らかにした(図3a).さらに,このカスケードはM期の進行の過程においてサイクリン依存性キナーゼとサイクリンBとの複合体により抑制的に制御されること,その下流においては微小管結合タンパク質の機能の制御をとおしフラグモプラストにおいて微小管束の不安定化がひき起こされその拡大が促進されていることが示された.この過程にかかわる遺伝子の多くはさきに述べたような転写制御をうけるが,そこから合成されたタンパク質は以下に述べるような巧妙な転写後制御をうけ細胞板の形成を達成する.
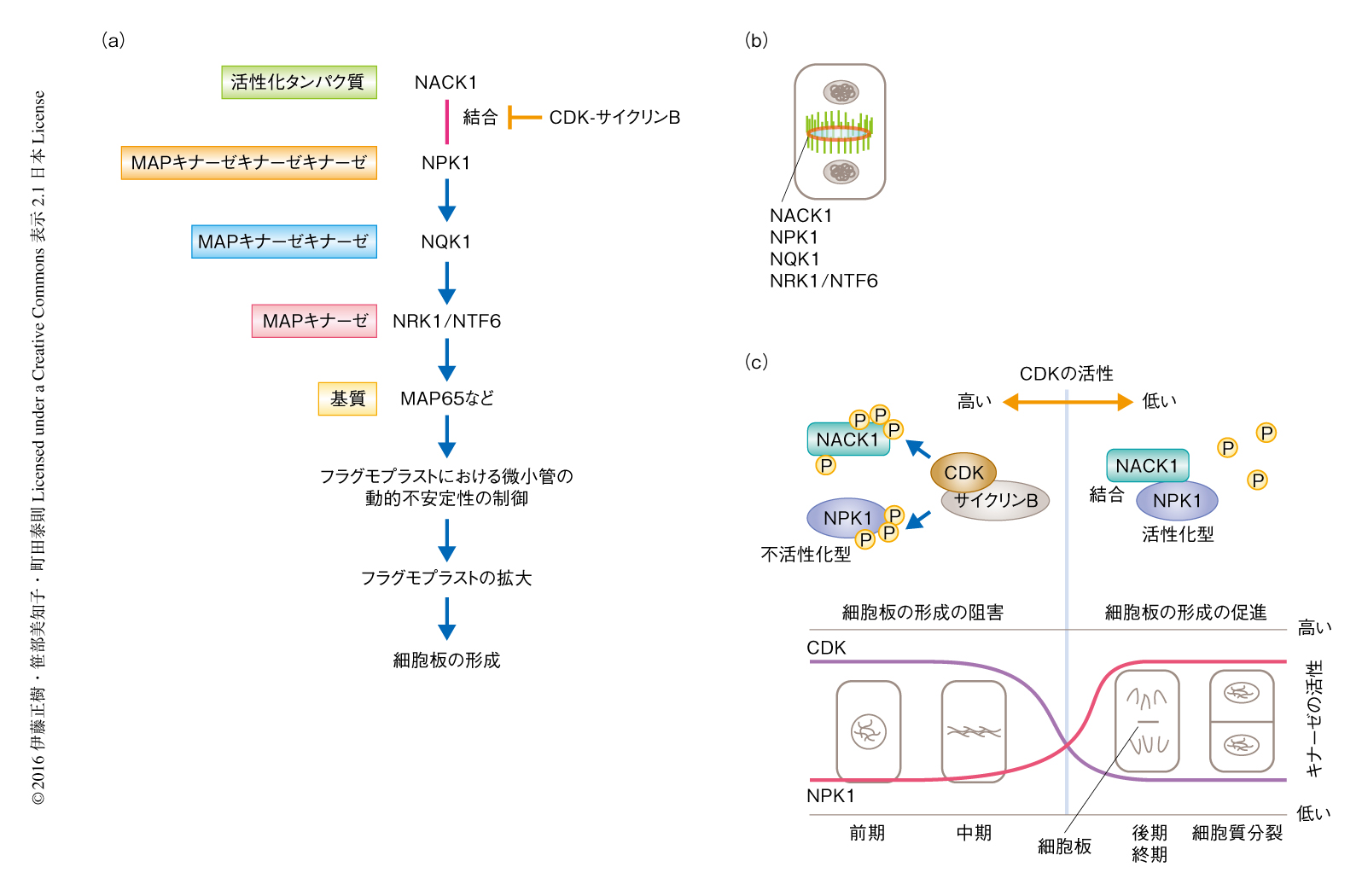
タバコにおいて,このMAPキナーゼカスケードの最上位に位置するのはMAPキナーゼキナーゼキナーゼであるNPK1であり27,28),これはNACK1との結合により活性化される29)(図3a).NPK1およびNACK1は細胞板の形成部位であるフラグモプラストの赤道面に局在する(図3b).NPK1の下流においては,MAPキナーゼキナーゼであるNQK1/NtMEK1,および,MAPキナーゼであるNRK1/NTF6が機能する(図3a).NPK1とNQK1およびNQK1とNRK1は,それぞれ,直接的に相互作用して下流のキナーゼをリン酸化し,カスケードの全体が活性化された30).これらのタンパク質はすべてフラグモプラストの赤道面に局在し,それらのドミナントネガティブ変異体を発現させると不完全な細胞板の蓄積,多核化,細胞肥大などの細胞質分裂の不全を示した.このカスケードはシロイヌナズナにおいても保存されており30-34),これらの変異体はすべて細胞質分裂の不全の表現型を示した.このように,タバコおよびシロイヌナズナにおいては類似したMAPキナーゼカスケードが細胞質分裂にかかわる.動物においても,ERK1およびERK2がセントラルスピンドルに局在し35-37),細胞質分裂の後期において機能すると考えられている38).
シロイヌナズナにおいてNACK1のホモログをコードするAtNACK1遺伝子およびAtNACK2遺伝子は,それぞれ,細胞質分裂の不全を示す変異体から同定されたHINKEL遺伝子およびTETRASPORE/STUD遺伝子と同一であった29,39,40).HINKEL/AtNACK1遺伝子およびTETRASPORE/STUD/AtNACK2遺伝子の変異体は,それぞれ,体細胞分裂の異常および花粉の形成の異常を示したが,それらの二重変異体は配偶体致死であった41).これらは重複した機能をもち,植物の細胞質分裂において必須である.NACK1はNPK1などを活性化するだけでなく,これらをフラグモプラストの赤道面にリクルートする29).このように,NACK1とNPK1の結合は細胞質分裂の鍵となる反応といえる.筆者らは,このMAPキナーゼカスケードを中心とした経路をNACK-PQR経路と命名した30)(図3a).
NACK-PQR経路の活性化はCDKサイクリン依存性キナーゼにより負に制御されている8)(図3c).NACK1はM期だけに蓄積したが,MAPキナーゼカスケードを構成するタンパク質はそれ以前から存在し,M期の前期に蓄積量が上昇する.しかし,NPK1をはじめとする3つのキナーゼの活性化はM期の中期ののちはじめて起こる29,30).M期の前期から中期にかけては,サイクリン依存性キナーゼ-サイクリンB複合体によりNACK1およびNPK1がリン酸化されそれらの結合が阻害されているからである.M期の中期ののちサイクリンBが分解されサイクリン依存性キナーゼの活性が低下すると,NACK1およびNPK1はすみやかに脱リン酸化され,互いに結合してNPK1のキナーゼ活性が活性化され,フラグモプラストの拡大および細胞板の形成が起こる8).このように,NACK-PQR経路の活性化はM期の進行の過程において厳密に制御されている.
MAPキナーゼであるNRK1の下流のタンパク質の生化学的な解析から,微小管結合タンパク質のひとつであるMAP65がNRK1によりリン酸化されることがわかった42,43).MAP65は,ヒトではPRC1,出芽酵母ではAse1とよばれ,いずれも細胞質分裂に必須でありサイクリン依存性キナーゼによるリン酸化の制御をうける44-46).MAP65は微小管を束化する活性をもつが,MAPキナーゼによるMAP65のリン酸化はin vitroにおいて微小管の束化の活性を抑制した.また,MAPキナーゼ非リン酸化変異型MAP65をタバコBY-2細胞において過剰に発現させると微小管の安定性が上昇し,フラグモプラストの拡大がいちじるしく遅延した.これらの結果は,NRK1はMAP65をリン酸化し,その束化活性を抑制することによりフラグモプラストの拡大を促進することを示していた42).
シロイヌナズナにおける細胞板の形成においては,トランスゴルジネットワークあるいは初期エンドソームに由来する小胞がかかわる(図2b).これらは同一のポストゴルジ輸送経路をへて細胞板へと輸送されるといわれている47-49).これらの小胞は細胞分裂面においてSNAREタンパク質を介して融合し,細胞板の形成にかかわる.複数のSNAREタンパク質が互いにSNAREドメインを介して相互作用し,メンブラントラフィック経路ごとに特異的な複合体を形成して機能する11).R1R2R3型Mybの標的であるKNOLLE/SYP111遺伝子は細胞板の形成に必須なSNAREタンパク質のひとつをコードする21,50).また,細胞質分裂に異常を示す変異体において原因タンパク質として同定されたKEULEは,KNOLLEと結合しSNARE複合体の形成を促進する51).最近,トランスゴルジネットワークあるいは初期エンドソームに由来するポストゴルジ輸送経路から分泌される細胞板の形成において機能する小胞の形成にかかわるタンパク質としてBIG1,BIG2,BIG3,BIG4が報告された10).このように,細胞板の形成において機能する小胞の形成から融合にかかわるタンパク質が明らかにされてきたが,フラグモプラストにそった小胞輸送のしくみや小胞の積み荷タンパク質については不明な点が多い.筆者らは,細胞板の形成にはたらくなんらかのタンパク質の輸送にNACK1がかかわる可能性について検討している52).
シロイヌナズナに存在する5個のR1R2R3型Mybには,MYB3R1およびMYB3R4のような活性化型Mybだけではなく,転写の抑制にはたらく抑制型Mybも存在することが明らかにされた6).R1R2R3型Mybをコードする遺伝子をさまざまな組合せで破壊した多重変異体を作出したところ,アミノ酸配列のよく似たMYB3R3とMYB3R5が同時に破壊されるとG2/M期遺伝子の発現が上昇した6).これらの変異はさきに述べた活性化型Mybの変異体にみられた異常を促進しないことから,これらはもっぱら抑制的にはたらく転写因子であると考えられた.G2/M期遺伝子のプロモーターの活性を抑制型Mybの変異体において調べた実験から,抑制型Mybの効果はMSA配列に依存していることがわかった.動物のMybは一般に転写を活性する転写因子であるとみなされており,現在のところ,活性化型Mybと抑制型Mybが同時に存在することが知られているのはシロイヌナズナだけである6,53).シロイヌナズナにおける抑制型Mybの遺伝子破壊株を詳細に解析した結果,以下に示すように,抑制型Mybは増殖している細胞と増殖を停止した細胞の両方において機能していることがわかった6).
増殖している細胞を多く含むシロイヌナズナの分裂組織,あるいは,発生の初期の種々の器官においては,CYCB1遺伝子はG2/M期の細胞にだけ発現するため,蛍光タンパク質により標識すると1細胞ごとのパッチ状の発現パターンを示す.しかし,抑制型Mybの変異体においてはCYCB1遺伝子が細胞周期のステージに依存せずに発現する結果,分裂組織の細胞が一様に蛍光を示すようになった.このことから,増殖している細胞における抑制型Mybの機能は,G2/M期以外の時期において転写を抑制することにより,標的遺伝子が発現する時期を細胞周期の特定のステージに限定することであると考えられた(図1).活性化型Mybあるいは抑制型Mybの変異体が示すそれぞれの表現型は,変異を組み合わせたときに相加的に現われ,互いの変異の効果を打ち消すような作用は示さない6,53).このことから,活性化型Mybと抑制型Mybは同じ細胞で同時に活性化されて競合するのではなく,活性化型Mybと抑制型Mybが細胞周期において交互に活性化するような切り替えを可能にする未知のしくみが存在すると考えられる(図1).
一方,増殖を停止した細胞における抑制型Mybのはたらきとして明らかにされたのは,分化した(あるいは,分化しつつある)細胞における転写抑制の確立およびその維持である.通常,細胞分裂を停止して最終的に分化した細胞においてはG2/M期遺伝子の発現はほとんど認められないが,抑制型Mybを欠損した変異体においてはすでに分化した(あるいは,分裂を停止して分化を起こす過程にある)細胞がG2/M期遺伝子の発現を継続してしまい,過剰な成長や異所的な細胞分裂が生じる6).この結果から,発生が進み細胞分裂を停止した細胞においては,G2/M期遺伝子の転写が活性化されないだけではなく,積極的に転写を抑制するしくみが存在していることが示される.このように,発生の進行にともなうG2/M期遺伝子の転写の抑制において抑制型Mybが主要な役割を担っており(図1),それが植物の発生の過程における時空間的な細胞分裂の制御に重要な意味をもつことが示された.また,G2/M期遺伝子の発現に対する抑制型Mybの効果は,調べたすべての器官や組織において全身的にみられたことから,植物の器官発生において一般的にかかわる細胞周期の負の制御を反映しているものと考えられる.
分裂を停止した休止状態の動物細胞において,細胞周期に関連する遺伝子の転写を抑制するタンパク質複合体の存在が明らかにされている7).構成タンパク質などに多少の違いはあるが,ヒト,ショウジョウバエ,線虫に共通に存在する大きなタンパク質複合体であり,それぞれに異なる名称がつけられているが,ここでは,総称してDREAM複合体とよぶ.ショウジョウバエにおいて生化学的に同定されたDREAM複合体の大きな特徴は,転写因子E2F(ここでは,E2F2)とMybが同じタンパク質複合体に存在することである54,55)(図4a).ヒトのDREAM複合体の場合には,MybとE2F(ここでは,B-MybとE2F4/5)が同じタンパク質複合体に同時に存在することはないが,これらは細胞周期の異なった時期に共通のコア複合体と結合し,異なる構成タンパク質をもつDREAM複合体として存在する56)(図4a).DREAM複合体の共通の機能は細胞周期に関連する遺伝子の転写を抑制することであり,Mybの役割はDREAM複合体による転写の抑制を解除することであると考えられている.ヒトのDREAM複合体は増殖を停止した休止状態の細胞において,G1/S期遺伝子およびG2/M期遺伝子の転写を抑制している57).細胞が増殖の刺激をうけS期にむかう過程において,コア複合体に存在するタンパク質がE2F4/5からB-Mybに交換され,そののち,B-Mybはフォークヘッド型転写因子FoxM1をリクルートしG2/M期遺伝子の転写を活性化する56)(図4a).
植物において,増殖を停止した組織における抑制型Mybの役割は動物のDREAM複合体におけるはたらきを想起させるものであった6,58).シロイヌナズナにおいて抑制型Mybが結合する遺伝子をクロマチン免疫沈降法により調べた結果,多くのG2/M期遺伝子と同時に,転写因子E2Fの標的となる多数の遺伝子が抑制型Mybと共沈殿するDNA断片として同定された6).この結果から,in vivoにおいて,抑制型MybとE2Fとのあいだに直接あるいは間接の相互作用があり,Myb-E2F複合体がMybおよびE2FのDNA結合領域をつうじてG2/M期遺伝子およびG1/S期遺伝子の両方に結合するのではないかと考えられた.生化学的に調べたところ,MybとE2Fは複合体を形成しており,さらに,ほかにもDREAM複合体の複数の構成タンパク質のホモログが含まれる可能性が示された6,53).一方で,植物に特有な構成タンパク質の候補として,サイクリン依存性キナーゼの一種が共免疫沈降により検出されている.また,ヒト,ショウジョウバエ,線虫において保存されているDREAM複合体の構成タンパク質であるLIN37/Mip40およびLIN52は植物にはホモログがないこと,また,ヒトにおいてDREAM複合体にリクルートされるフォークヘッド型転写因子に対応する転写因子ファミリーは植物には存在しないことなどから,植物におけるMyb-E2F複合体の構成タンパク質は,動物のDREAM複合体の構成タンパク質とはかなり異なると考えられる.
シロイヌナズナにおいて,活性化型Mybを含むMyb-E2F複合体と抑制型Mybを含むMyb-E2F複合体は,転写因子E2Fの異なる分子種を含んでいた.シロイヌナズナのE2Fには,転写の活性化にはたらくE2FAおよびE2FBと,転写の抑制にはたらくE2FCが存在する3).のちの解析の結果,抑制型MybはE2FCと,また,活性化型MybはE2FBと,それぞれ,独立のMyb-E2F複合体を形成することが予想された6,53)(図4b).シロイヌナズナのMyb-E2F複合体は器官の発生の過程において構成タンパク質を変化させているようだ.増殖している細胞を多く含む初期のステージの葉においては,抑制型MybはRBRを含むMyb-E2F複合体に存在するが,そこにE2FCは存在しない.しかし,細胞増殖を停止しつつある後期のステージにおいては,RBRだけでなくE2FCが抑制型Mybと共沈殿する6)(図4b).シロイヌナズナのMyb-E2F複合体は,ヒトのDREAM複合体のように,構成タンパク質の変化をともないながら,細胞周期や発生の過程においてそのはたらきをダイナミックに変化させているのではないかと考えられる.筆者らは,このMyb-E2F複合体のすべての構成タンパク質やその動態の全貌を明らかにすべく研究している.DREAM複合体には未解明な部分が多く残されており,Myb-E2F複合体の研究から,植物に特有の制御機構やDREAM複合体の進化的な保存性などについて新しい知見の得られることが期待される.
このレビューにおいては,最近になり明らかにされた,タンパク質複合体による植物における細胞周期の制御のしくみに関する2つの例について解説した.ひとつは,シロイヌナズナにおけるMyb-E2F複合体による転写制御である.Myb-E2F複合体の構成タンパク質や標的DNAとの結合が細胞周期や器官の発生のステージに依存してどのように変化するのか,また,構成タンパク質のあいだにはどのような機能的な相互作用があるのかなど,多くの課題が残されている.細胞周期を制御するMybおよびE2Fという2つの主要な転写因子が同じタンパク質複合体に存在することの生理的な意義などについて理解の進むことが期待される.もうひとつは,キネシン様タンパク質であるNACK1とMAPキナーゼカスケードの構成タンパク質との複合体による細胞質分裂の制御である.このタンパク質複合体は巨大な微小管の構造体であるフラグモプラストに存在し,そこで微小管の動態を制御することにより細胞板の形成を制御する.このタンパク質複合体の研究は,細胞質分裂の研究における古くからの問題である,細胞膜と細胞壁の構築および微小管の成長という高次な反応の同調化の解明につながる可能性がある.MAPキナーゼの新奇な基質やNACK1の未知の積み荷タンパク質に関する研究は,このようなしくみの理解に道を開くと期待される.一方,細胞周期においては,おのおのの過程の終了がつぎの過程の開始のシグナルになるという特徴を考えると,細胞質分裂の完了がそれにつぐG1期の開始やG0期への移行を制御する可能性もある.今回,示されたような植物の細胞周期を制御する鍵となるタンパク質複合体を中心として,細胞レベルおよび個体レベルでの研究を進めることにより,植物に特有な細胞周期および個体の形成の制御系を解明したい.
略歴:1993年 東北大学大学院理学研究科 修了,同年 名古屋大学農学部 助手,1994年 東京大学大学院理学系研究科 助手を経て,2003年より名古屋大学大学院生命農学研究科 准教授.
研究テーマ:植物の発生および成長における,細胞分裂および細胞成長の制御.
関心事:細胞の体積の拡大と分裂とを連動させて,細胞のサイズを一定に保つしくみ.
笹部 美知子(Michiko Sasabe)
弘前大学農学生命科学部 准教授.
町田 泰則(Yasunori Machida)
名古屋大学大学院理学研究科 特任教授.
© 2016 伊藤正樹・笹部美知子・町田泰則 Licensed under CC 表示 2.1 日本
(1名古屋大学大学院生命農学研究科 生命技術科学専攻分化情報制御研究分野,2弘前大学農学生命科学部 生物学科,3名古屋大学大学院理学研究科 生命理学専攻発生メカノ・セル・バイオロジーグループ)
email:伊藤正樹
領域融合レビュー, 5, e005 (2016) DOI: 10.7875/leading.author.5.e005
Masaki Ito, Michiko Sasabe & Yasunori Machida: Unique mechanisms of plant cell division regulated by multi-protein complexes.
要 約
植物の細胞は周囲に細胞壁をもつことから,植物は細胞分裂のために特有な制御機構を獲得した.とりわけ,細胞膜と細胞壁の構築が同時に起こる細胞質分裂は,細胞板の形成を含む植物に特有の過程である.筆者らは,この過程に必須である植物に固有のキネシン様タンパク質により制御されるMAPキナーゼカスケードを発見し,このカスケードは細胞質分裂装置において微小管の動きを制御することにより細胞板の形成を促進することを示した.さらに,この過程を含む植物のM期の進行にかかわる遺伝子の転写には転写因子としてR1R2R3型Mybが必須であること,R1R2R3型Mybには転写を活性化する活性化型Mybのほか抑制型Mybがあり,植物の器官の発生における細胞分裂の停止にも重要であることが見い出された.R1R2R3型MybはG1/S期の制御に重要な転写因子E2Fとともに大きなタンパク質複合体を形成しており,より広範囲な機能を担う可能性のあることもわかった.このMyb-E2F複合体の構成タンパク質には,動物において細胞周期にかかわる遺伝子の転写を負に制御するDREAM複合体の構成タンパク質と類似する複数のタンパク質が存在していたことから,植物においても,Myb-E2F複合体が細胞周期の制御において同様の機能をもつ可能性が考えられた.
はじめに
細胞分裂は増殖という生命の本質的な属性の基礎であり,生物にとりもっとも重要な過程のひとつである.細胞分裂の過程は,細胞周期とよばれる制御された反応の位相をくり返すことにより,複製された染色体と細胞質成分を2つの娘細胞に分配するしくみである.このような細胞周期の分子レベルにおける研究にはおもに動物および酵母が用いられ,多くの成果が得られているが,M期における有糸分裂あるいは細胞質分裂のしくみについては不明な点が多い.植物における細胞分裂の研究も進み,DNAの複製などにかかわるG1/S期遺伝子と細胞質分裂などにかかわるG2/M期遺伝子の転写が周期的に変動すること1,2),G1/S期遺伝子の転写の制御には,動物と同様に,E2F-DPヘテロ二量体が中心的な役割を担うこと3) がわかってきた.しかし,植物の細胞は周囲を細胞壁にかこまれていることから,細胞分裂には植物に固有の過程がかかわると考えられる.また,植物の細胞は細胞壁の存在により移動できないことから,適切な器官の形成のためには細胞分裂の時空間的な制御が重要であるといわれている4).このような特徴をもつ植物における細胞周期のしくみを解明することにより,細胞分裂の機構に関しよりいっそう深い理解が得られるだけでなく,新奇な分子制御の過程が解明される可能性もある.筆者らは,植物に焦点をしぼり,細胞周期の分子制御の機構および細胞分裂と分化との関係を研究している.
筆者らは,これまでに,培養細胞を用いた研究により,G2/M期遺伝子のプロモーター領域には共通のシス配列であるMSA配列が存在すること,そして,この配列に結合する転写因子であるR1R2R3型MybによりG2/M期遺伝子の転写が制御されることを示してきた5).また,R1R2R3型Mybには,G2/M期遺伝子の転写を活性化する活性化型Mybと,逆に,G2/M期遺伝子を抑制する抑制型Mybが存在することも示された.これらの知見は,動物における細胞分裂の研究にさきがけて得られたものである.最近になり,シロイヌナズナを用いた研究により,抑制型Mybは器官の発生における細胞分裂の適切な停止に機能することがわかった6).さらに,R1R2R3型MybはG1/S期の制御に重要な転写因子E2Fと共通のタンパク質複合体に含まれることがわかり,ヒトやショウジョウバエにおいて細胞周期にかかわる遺伝子の転写制御に中心的なはたらきをする大きなタンパク質複合体であるDREAM複合体7) との機能的な類似性が考えられるようになった.一方,細胞周期においては,タンパク質の修飾や相互作用などの巧妙な転写後制御が重要であることが明らかにされてきた.筆者らは,植物に固有な細胞質分裂である細胞板の形成の分子機構について研究し,植物における細胞質分裂装置の動態およびその活性化のしくみについて明らかにした8,9).また,この過程にかかわる特徴的なメンブレントラフィックに関する研究が進み,分子レベルにおける理解が進んできた10,11).
このレビューにおいては,G2/M期遺伝子の転写の活性化および抑制のしくみについて述べ,M期の進行を実行するしくみの典型例として植物における細胞板の形成の制御機構について解説する.さらに,最近になり明らかにされた,植物におけるMyb-E2F複合体の発見について解説し,動物における類似の性質をもつDREAM複合体との関連性,また,植物の発生における細胞の増殖の抑制機構について議論する.
1.植物の培養細胞におけるG2/M期に特異的な転写
高度な同調培養が可能なタバコBY-2細胞を用いてM期サイクリンをコードするCYCB1遺伝子のプロモーターを詳細に解析した結果,G2/M期に特異的な転写の活性化を担うシス配列としてMSA配列が同定された12).シロイヌナズナには約180個のG2/M期遺伝子が存在するが,それらの遺伝子の多くは上流にMSA配列のモチーフが存在することから,MSA配列はG2/M期遺伝子を共通に制御するシス配列であると思われた13).このMSA配列に結合する転写因子を酵母ワンハイブリッド系によりスクリーニングした結果,タバコのMybであるNtmybA2が同定された14).CYCB1遺伝子のプロモーターに対する効果を調べた結果,NtmybA2はMSA配列に依存的に転写の活性化にはたらく転写因子であることが示された.
MSA配列に結合するR1R2R3型Mybは,植物に多く存在するR2R3型Mybとは異なり,動物の原がん遺伝子産物として知られるc-Mybとよく似たDNA結合ドメイン構造をもち,植物における祖先型のMybとみなされている5).R1R2R3型Mybは哺乳動物やショウジョウバエにおいてもG2/M期遺伝子の制御にかかわることが示されており,多細胞生物において広範囲に保存された転写制御経路を形成するものと思われる15,16).
2.G2/M期遺伝子の転写を活性化するR1R2R3型Myb
シロイヌナズナのゲノムにはR1R2R3型Mybをコードする5個の遺伝子が存在し,そのうちMYB3R1遺伝子およびMYB3R4遺伝子はタバコの転写因子NtmybA2とよく似たアミノ酸配列をコードしていた.MYB3R1遺伝子およびMYB3R4遺伝子を同時に破壊した植物においては多くのG2/M期遺伝子の発現が低下していたことから,MYB3R1およびMYB3R4はシロイヌナズナにおいて転写の活性化にはたらく転写因子として機能し,G2/M期遺伝子を共通に制御するものと考えられた13,17).また,MYB3R4は分裂組織や増殖期の若い器官においてG2/M期の細胞に特異的に発現しており,それ自体が細胞周期において制御をうけていた.したがって,これら活性化型Mybのはたらきは,M期を実行するためのG2/M期遺伝子の発現を細胞周期の特定のタイミングにおいてオンにすることであると考えられた14,17).
活性化型Mybは細胞周期において二重のフィードバックループにより制御される.1つ目のフィードバックループは,活性化型MybがM期サイクリン依存性キナーゼの活性により直接のリン酸化をうけることである.タバコBY-2細胞においてM期サイクリンを一過的に発現すると,活性化型Mybの転写活性化能が増大した.M期サイクリンをコードする遺伝子は活性化型Mybの標的であることから,活性化型MybとM期サイクリンとのあいだには正のフィードバックループが成立する18).2つ目のフィードバックループは,活性化型Mybをコードする遺伝子の上流にMSA配列が存在し,それ自体がコードするタンパク質により転写活性化をうけることである19).このような二重のフィードバック制御はG2/M期遺伝子のバースト的な発現の上昇をひき起こし,G2期からM期への不可逆的な進入を決定づけると考えられる(図1).動物においては,このような正のフィードバックとして,サイクリン依存性キナーゼによるリン酸化をうけたホスファターゼCDC25がサイクリン依存性キナーゼを脱リン酸化し活性化するしくみが提唱されている20).活性化型Mybによるフィードバック制御は,CDC25のホモログをもたない植物が代替的に獲得したM期の開始のしくみなのかもしれない.
シロイヌナズナにおいてMYB3R1およびMYB3R4の機能が部分的に欠失した変異体では,途切れた細胞壁や多核の細胞が高頻度で出現するなど,不完全な細胞質分裂により生じる典型的な異常が観察された17).シロイヌナズナの細胞質分裂に必須な遺伝子として最初に同定されたKNOLLE遺伝子はG2/M期に特異的に発現し,細胞板の形成の際の小胞融合にかかわるSNAREタンパク質をコードする21).KNOLLE遺伝子のプロモーターは複数のMSA配列をもち,レポーターアッセイにおいてMSA配列に依存的して活性化型Mybによる転写活性化をうけた17).また,KNOLLE遺伝子の発現は活性化型Mybを部分的に欠失した植物においては低下しており,この植物においてKNOLLE遺伝子を過剰に発現させると細胞質分裂に関する表現型のほとんどが回復したことから,KNOLLE遺伝子はMYB3R1およびMYB3R4の下流において細胞質分裂の制御にはたらく鍵となる標的遺伝子である17).活性化型Mybの部分欠損変異体における遺伝子の発現を網羅的に解析した結果,MYB3R1およびMYB3R4による転写活性化の標的遺伝子には,KNOLLE遺伝子のほかにも細胞質分裂に関連する複数の遺伝子が含まれることがわかった13,17).たとえば,フラグモプラストの成長にかかわる微小管結合タンパク質MAP65,細胞板を構成する多糖の合成に関与するセルロース合成酵素類似タンパク質やエンド型β1,4グルカナーゼなどのほか,M期に特異的な多くのキネシン様タンパク質などをコードする遺伝子である.このように,活性化型Mybが標的遺伝子の転写制御を介し細胞質分裂の進行をささえるしくみが明らかにされた.
3.植物における細胞質分裂の制御機構
ここでは,R1R2R3型Mybの下流における事象として細胞質分裂をとりあげ,細胞板の形成に必須な転写後制御系,および,この制御におけるMyb標的遺伝子の関与について解説する.細胞質分裂は,複製された染色体と細胞質成分を2つの娘細胞に分離するM期における最後の過程である.動物の細胞質分裂は外側から内側への陥入によりひき起こされるのに対して,植物の細胞質分裂は細胞膜と細胞壁からなる細胞板が細胞の内側から外側にむかい形成されることにより起こる22-24)(図2a).このような動的な事象は,動物においては,分裂面に形成されるミオシンIIおよびアクチンフィラメントからなる収縮環と,分離した染色体のあいだに形成されるセントラルスピンドルあるいはミッドボディとよばれる細胞質分裂装置により実行される.一方,植物における細胞質分裂は,分離された染色体のあいだに形成されるフラグモプラストとよばれる細胞質分裂装置において進行する.セントラルスピンドルとフラグモプラストはいずれも極性をもつ2つの巨大な微小管束とアクチンフィラメントからなる構造体で,2つの微小管束は互いにプラス端側でむかいあう(図2b).最初,フラグモプラストは内側まで微小管がつまった構造をしているが,いったん,細胞板が形成されると細胞板をとりまくようなリング状の構造となり,細胞板の形成をともないながら遠心的に拡大し細胞壁まで到達する.細胞板の形成部位であるフラグモプラストの赤道面には,トランスゴルジネットワークあるいは初期エンドソームに由来する小胞が蓄積して融合し(図2b),融合した膜構造体において細胞壁の成分が合成されることにより細胞板の形成および拡大が進む.このように,植物の細胞質分裂は,微小管のダイナミクスを基礎とするフラグモプラストの形成と拡大,および,フラグモプラストにおける小胞の輸送と融合を基礎とする細胞板の形成,という2つの過程からなる.
フラグモプラストにおける微小管束のダイナミクスは細胞板の形成の原動力である.フラグモプラストの形成の開始のしくみは未解明であるが,フラグモプラストの拡大にはオーグミン-γチューブリン複合体による新規な微小管の形成のかかわることが明らかにされた25,26).フラグモプラストは安定な微小管束と動的で不安定な微小管により構成され,安定な微小管束からのγチューブリンを核とした新規で不安定な微小管の形成と,その束化による安定化,というくり返しによりフラグモプラストが拡大すると提唱されている(図2b).
筆者らは,タバコBY-2細胞を用いた生化学的および細胞生物学的な解析,および,シロイヌナズナを用いた分子遺伝学的な解析を組み合わせ,キネシン様タンパク質であるNACK1により活性化されるMAPキナーゼカスケードが植物の細胞質分裂において中心的な役割をはたすことを明らかにした(図3a).さらに,このカスケードはM期の進行の過程においてサイクリン依存性キナーゼとサイクリンBとの複合体により抑制的に制御されること,その下流においては微小管結合タンパク質の機能の制御をとおしフラグモプラストにおいて微小管束の不安定化がひき起こされその拡大が促進されていることが示された.この過程にかかわる遺伝子の多くはさきに述べたような転写制御をうけるが,そこから合成されたタンパク質は以下に述べるような巧妙な転写後制御をうけ細胞板の形成を達成する.
タバコにおいて,このMAPキナーゼカスケードの最上位に位置するのはMAPキナーゼキナーゼキナーゼであるNPK1であり27,28),これはNACK1との結合により活性化される29)(図3a).NPK1およびNACK1は細胞板の形成部位であるフラグモプラストの赤道面に局在する(図3b).NPK1の下流においては,MAPキナーゼキナーゼであるNQK1/NtMEK1,および,MAPキナーゼであるNRK1/NTF6が機能する(図3a).NPK1とNQK1およびNQK1とNRK1は,それぞれ,直接的に相互作用して下流のキナーゼをリン酸化し,カスケードの全体が活性化された30).これらのタンパク質はすべてフラグモプラストの赤道面に局在し,それらのドミナントネガティブ変異体を発現させると不完全な細胞板の蓄積,多核化,細胞肥大などの細胞質分裂の不全を示した.このカスケードはシロイヌナズナにおいても保存されており30-34),これらの変異体はすべて細胞質分裂の不全の表現型を示した.このように,タバコおよびシロイヌナズナにおいては類似したMAPキナーゼカスケードが細胞質分裂にかかわる.動物においても,ERK1およびERK2がセントラルスピンドルに局在し35-37),細胞質分裂の後期において機能すると考えられている38).
シロイヌナズナにおいてNACK1のホモログをコードするAtNACK1遺伝子およびAtNACK2遺伝子は,それぞれ,細胞質分裂の不全を示す変異体から同定されたHINKEL遺伝子およびTETRASPORE/STUD遺伝子と同一であった29,39,40).HINKEL/AtNACK1遺伝子およびTETRASPORE/STUD/AtNACK2遺伝子の変異体は,それぞれ,体細胞分裂の異常および花粉の形成の異常を示したが,それらの二重変異体は配偶体致死であった41).これらは重複した機能をもち,植物の細胞質分裂において必須である.NACK1はNPK1などを活性化するだけでなく,これらをフラグモプラストの赤道面にリクルートする29).このように,NACK1とNPK1の結合は細胞質分裂の鍵となる反応といえる.筆者らは,このMAPキナーゼカスケードを中心とした経路をNACK-PQR経路と命名した30)(図3a).
NACK-PQR経路の活性化はCDKサイクリン依存性キナーゼにより負に制御されている8)(図3c).NACK1はM期だけに蓄積したが,MAPキナーゼカスケードを構成するタンパク質はそれ以前から存在し,M期の前期に蓄積量が上昇する.しかし,NPK1をはじめとする3つのキナーゼの活性化はM期の中期ののちはじめて起こる29,30).M期の前期から中期にかけては,サイクリン依存性キナーゼ-サイクリンB複合体によりNACK1およびNPK1がリン酸化されそれらの結合が阻害されているからである.M期の中期ののちサイクリンBが分解されサイクリン依存性キナーゼの活性が低下すると,NACK1およびNPK1はすみやかに脱リン酸化され,互いに結合してNPK1のキナーゼ活性が活性化され,フラグモプラストの拡大および細胞板の形成が起こる8).このように,NACK-PQR経路の活性化はM期の進行の過程において厳密に制御されている.
MAPキナーゼであるNRK1の下流のタンパク質の生化学的な解析から,微小管結合タンパク質のひとつであるMAP65がNRK1によりリン酸化されることがわかった42,43).MAP65は,ヒトではPRC1,出芽酵母ではAse1とよばれ,いずれも細胞質分裂に必須でありサイクリン依存性キナーゼによるリン酸化の制御をうける44-46).MAP65は微小管を束化する活性をもつが,MAPキナーゼによるMAP65のリン酸化はin vitroにおいて微小管の束化の活性を抑制した.また,MAPキナーゼ非リン酸化変異型MAP65をタバコBY-2細胞において過剰に発現させると微小管の安定性が上昇し,フラグモプラストの拡大がいちじるしく遅延した.これらの結果は,NRK1はMAP65をリン酸化し,その束化活性を抑制することによりフラグモプラストの拡大を促進することを示していた42).
シロイヌナズナにおける細胞板の形成においては,トランスゴルジネットワークあるいは初期エンドソームに由来する小胞がかかわる(図2b).これらは同一のポストゴルジ輸送経路をへて細胞板へと輸送されるといわれている47-49).これらの小胞は細胞分裂面においてSNAREタンパク質を介して融合し,細胞板の形成にかかわる.複数のSNAREタンパク質が互いにSNAREドメインを介して相互作用し,メンブラントラフィック経路ごとに特異的な複合体を形成して機能する11).R1R2R3型Mybの標的であるKNOLLE/SYP111遺伝子は細胞板の形成に必須なSNAREタンパク質のひとつをコードする21,50).また,細胞質分裂に異常を示す変異体において原因タンパク質として同定されたKEULEは,KNOLLEと結合しSNARE複合体の形成を促進する51).最近,トランスゴルジネットワークあるいは初期エンドソームに由来するポストゴルジ輸送経路から分泌される細胞板の形成において機能する小胞の形成にかかわるタンパク質としてBIG1,BIG2,BIG3,BIG4が報告された10).このように,細胞板の形成において機能する小胞の形成から融合にかかわるタンパク質が明らかにされてきたが,フラグモプラストにそった小胞輸送のしくみや小胞の積み荷タンパク質については不明な点が多い.筆者らは,細胞板の形成にはたらくなんらかのタンパク質の輸送にNACK1がかかわる可能性について検討している52).
4.転写の抑制にはたらくR1R2R3型Mybの発見とその機能
シロイヌナズナに存在する5個のR1R2R3型Mybには,MYB3R1およびMYB3R4のような活性化型Mybだけではなく,転写の抑制にはたらく抑制型Mybも存在することが明らかにされた6).R1R2R3型Mybをコードする遺伝子をさまざまな組合せで破壊した多重変異体を作出したところ,アミノ酸配列のよく似たMYB3R3とMYB3R5が同時に破壊されるとG2/M期遺伝子の発現が上昇した6).これらの変異はさきに述べた活性化型Mybの変異体にみられた異常を促進しないことから,これらはもっぱら抑制的にはたらく転写因子であると考えられた.G2/M期遺伝子のプロモーターの活性を抑制型Mybの変異体において調べた実験から,抑制型Mybの効果はMSA配列に依存していることがわかった.動物のMybは一般に転写を活性する転写因子であるとみなされており,現在のところ,活性化型Mybと抑制型Mybが同時に存在することが知られているのはシロイヌナズナだけである6,53).シロイヌナズナにおける抑制型Mybの遺伝子破壊株を詳細に解析した結果,以下に示すように,抑制型Mybは増殖している細胞と増殖を停止した細胞の両方において機能していることがわかった6).
増殖している細胞を多く含むシロイヌナズナの分裂組織,あるいは,発生の初期の種々の器官においては,CYCB1遺伝子はG2/M期の細胞にだけ発現するため,蛍光タンパク質により標識すると1細胞ごとのパッチ状の発現パターンを示す.しかし,抑制型Mybの変異体においてはCYCB1遺伝子が細胞周期のステージに依存せずに発現する結果,分裂組織の細胞が一様に蛍光を示すようになった.このことから,増殖している細胞における抑制型Mybの機能は,G2/M期以外の時期において転写を抑制することにより,標的遺伝子が発現する時期を細胞周期の特定のステージに限定することであると考えられた(図1).活性化型Mybあるいは抑制型Mybの変異体が示すそれぞれの表現型は,変異を組み合わせたときに相加的に現われ,互いの変異の効果を打ち消すような作用は示さない6,53).このことから,活性化型Mybと抑制型Mybは同じ細胞で同時に活性化されて競合するのではなく,活性化型Mybと抑制型Mybが細胞周期において交互に活性化するような切り替えを可能にする未知のしくみが存在すると考えられる(図1).
一方,増殖を停止した細胞における抑制型Mybのはたらきとして明らかにされたのは,分化した(あるいは,分化しつつある)細胞における転写抑制の確立およびその維持である.通常,細胞分裂を停止して最終的に分化した細胞においてはG2/M期遺伝子の発現はほとんど認められないが,抑制型Mybを欠損した変異体においてはすでに分化した(あるいは,分裂を停止して分化を起こす過程にある)細胞がG2/M期遺伝子の発現を継続してしまい,過剰な成長や異所的な細胞分裂が生じる6).この結果から,発生が進み細胞分裂を停止した細胞においては,G2/M期遺伝子の転写が活性化されないだけではなく,積極的に転写を抑制するしくみが存在していることが示される.このように,発生の進行にともなうG2/M期遺伝子の転写の抑制において抑制型Mybが主要な役割を担っており(図1),それが植物の発生の過程における時空間的な細胞分裂の制御に重要な意味をもつことが示された.また,G2/M期遺伝子の発現に対する抑制型Mybの効果は,調べたすべての器官や組織において全身的にみられたことから,植物の器官発生において一般的にかかわる細胞周期の負の制御を反映しているものと考えられる.
5.シロイヌナズナにおけるMyb-E2F複合体の発見およびDREAM複合体との類似性
分裂を停止した休止状態の動物細胞において,細胞周期に関連する遺伝子の転写を抑制するタンパク質複合体の存在が明らかにされている7).構成タンパク質などに多少の違いはあるが,ヒト,ショウジョウバエ,線虫に共通に存在する大きなタンパク質複合体であり,それぞれに異なる名称がつけられているが,ここでは,総称してDREAM複合体とよぶ.ショウジョウバエにおいて生化学的に同定されたDREAM複合体の大きな特徴は,転写因子E2F(ここでは,E2F2)とMybが同じタンパク質複合体に存在することである54,55)(図4a).ヒトのDREAM複合体の場合には,MybとE2F(ここでは,B-MybとE2F4/5)が同じタンパク質複合体に同時に存在することはないが,これらは細胞周期の異なった時期に共通のコア複合体と結合し,異なる構成タンパク質をもつDREAM複合体として存在する56)(図4a).DREAM複合体の共通の機能は細胞周期に関連する遺伝子の転写を抑制することであり,Mybの役割はDREAM複合体による転写の抑制を解除することであると考えられている.ヒトのDREAM複合体は増殖を停止した休止状態の細胞において,G1/S期遺伝子およびG2/M期遺伝子の転写を抑制している57).細胞が増殖の刺激をうけS期にむかう過程において,コア複合体に存在するタンパク質がE2F4/5からB-Mybに交換され,そののち,B-Mybはフォークヘッド型転写因子FoxM1をリクルートしG2/M期遺伝子の転写を活性化する56)(図4a).
植物において,増殖を停止した組織における抑制型Mybの役割は動物のDREAM複合体におけるはたらきを想起させるものであった6,58).シロイヌナズナにおいて抑制型Mybが結合する遺伝子をクロマチン免疫沈降法により調べた結果,多くのG2/M期遺伝子と同時に,転写因子E2Fの標的となる多数の遺伝子が抑制型Mybと共沈殿するDNA断片として同定された6).この結果から,in vivoにおいて,抑制型MybとE2Fとのあいだに直接あるいは間接の相互作用があり,Myb-E2F複合体がMybおよびE2FのDNA結合領域をつうじてG2/M期遺伝子およびG1/S期遺伝子の両方に結合するのではないかと考えられた.生化学的に調べたところ,MybとE2Fは複合体を形成しており,さらに,ほかにもDREAM複合体の複数の構成タンパク質のホモログが含まれる可能性が示された6,53).一方で,植物に特有な構成タンパク質の候補として,サイクリン依存性キナーゼの一種が共免疫沈降により検出されている.また,ヒト,ショウジョウバエ,線虫において保存されているDREAM複合体の構成タンパク質であるLIN37/Mip40およびLIN52は植物にはホモログがないこと,また,ヒトにおいてDREAM複合体にリクルートされるフォークヘッド型転写因子に対応する転写因子ファミリーは植物には存在しないことなどから,植物におけるMyb-E2F複合体の構成タンパク質は,動物のDREAM複合体の構成タンパク質とはかなり異なると考えられる.
シロイヌナズナにおいて,活性化型Mybを含むMyb-E2F複合体と抑制型Mybを含むMyb-E2F複合体は,転写因子E2Fの異なる分子種を含んでいた.シロイヌナズナのE2Fには,転写の活性化にはたらくE2FAおよびE2FBと,転写の抑制にはたらくE2FCが存在する3).のちの解析の結果,抑制型MybはE2FCと,また,活性化型MybはE2FBと,それぞれ,独立のMyb-E2F複合体を形成することが予想された6,53)(図4b).シロイヌナズナのMyb-E2F複合体は器官の発生の過程において構成タンパク質を変化させているようだ.増殖している細胞を多く含む初期のステージの葉においては,抑制型MybはRBRを含むMyb-E2F複合体に存在するが,そこにE2FCは存在しない.しかし,細胞増殖を停止しつつある後期のステージにおいては,RBRだけでなくE2FCが抑制型Mybと共沈殿する6)(図4b).シロイヌナズナのMyb-E2F複合体は,ヒトのDREAM複合体のように,構成タンパク質の変化をともないながら,細胞周期や発生の過程においてそのはたらきをダイナミックに変化させているのではないかと考えられる.筆者らは,このMyb-E2F複合体のすべての構成タンパク質やその動態の全貌を明らかにすべく研究している.DREAM複合体には未解明な部分が多く残されており,Myb-E2F複合体の研究から,植物に特有の制御機構やDREAM複合体の進化的な保存性などについて新しい知見の得られることが期待される.
おわりに
このレビューにおいては,最近になり明らかにされた,タンパク質複合体による植物における細胞周期の制御のしくみに関する2つの例について解説した.ひとつは,シロイヌナズナにおけるMyb-E2F複合体による転写制御である.Myb-E2F複合体の構成タンパク質や標的DNAとの結合が細胞周期や器官の発生のステージに依存してどのように変化するのか,また,構成タンパク質のあいだにはどのような機能的な相互作用があるのかなど,多くの課題が残されている.細胞周期を制御するMybおよびE2Fという2つの主要な転写因子が同じタンパク質複合体に存在することの生理的な意義などについて理解の進むことが期待される.もうひとつは,キネシン様タンパク質であるNACK1とMAPキナーゼカスケードの構成タンパク質との複合体による細胞質分裂の制御である.このタンパク質複合体は巨大な微小管の構造体であるフラグモプラストに存在し,そこで微小管の動態を制御することにより細胞板の形成を制御する.このタンパク質複合体の研究は,細胞質分裂の研究における古くからの問題である,細胞膜と細胞壁の構築および微小管の成長という高次な反応の同調化の解明につながる可能性がある.MAPキナーゼの新奇な基質やNACK1の未知の積み荷タンパク質に関する研究は,このようなしくみの理解に道を開くと期待される.一方,細胞周期においては,おのおのの過程の終了がつぎの過程の開始のシグナルになるという特徴を考えると,細胞質分裂の完了がそれにつぐG1期の開始やG0期への移行を制御する可能性もある.今回,示されたような植物の細胞周期を制御する鍵となるタンパク質複合体を中心として,細胞レベルおよび個体レベルでの研究を進めることにより,植物に特有な細胞周期および個体の形成の制御系を解明したい.
文 献
- Whitfield, M. L., Sherlock, G., Saldanha, A. J. et al.: Identification of genes periodically expressed in the human cell cycle and their expression in tumors. Mol. Biol. Cell, 13, 1977-2000 (2002)[PubMed]
- Menges, M., de Jager, S. M., Gruissem, W. et al.: Global analysis of the core cell cycle regulators of Arabidopsis identifies novel genes, reveals multiple and highly specific profiles of expression and provides a coherent model for plant cell cycle control. Plant J., 41, 546-566 (2005)[PubMed]
- Berckmans, B. & De Veylder, L.: Transcriptional control of the cell cycle. Curr. Opin. Plant Biol., 12, 599-605 (2009)[PubMed]
- Rasmussen, C. G., Wright, A. J. & Muller, S.: The role of the cytoskeleton and associated proteins in determination of the plant cell division plane. Plant J., 75, 258-269 (2013)[PubMed]
- Ito, M.: Conservation and diversification of three-repeat Myb transcription factors in plants. J. Plant Res., 118, 61-69 (2005)[PubMed]
- Kobayashi, K., Suzuki, T., Iwata, E. et al.: Transcriptional repression by MYB3R proteins regulates plant organ growth. EMBO J., 34, 1992-2007 (2015)[PubMed]
- Sadasivam, S. & DeCaprio, J. A.: The DREAM complex: master coordinator of cell cycle-dependent gene expression. Nat. Rev. Cancer, 13, 585-595 (2013)[PubMed]
- Sasabe, M., Boudolf, V., De Veylder, L. et al.: Phosphorylation of a mitotic kinesin-like protein and a MAPKKK by cyclin-dependent kinases (CDKs) is involved in the transition to cytokinesis in plants. Proc. Natl. Acad. Sci. USA, 108, 17844-17849 (2011)[PubMed]
- Sasabe, M. & Machida, Y.: Regulation of organization and function of microtubules by the mitogen-activated protein kinase cascade during plant cytokinesis. Cytoskeleton, 69, 913-918 (2012)[PubMed]
- Richter, S., Kientz, M., Brumm, S. et al.: Delivery of endocytosed proteins to the cell-division plane requires change of pathway from recycling to secretion. Elife, 3, e02131 (2014)[PubMed]
- Muller, S. & Jurgens, G.: Plant cytokinesis: no ring, no constriction but centrifugal construction of the partitioning membrane. Semin. Cell. Dev. Biol., 53, 10-18 (2016)[PubMed]
- Ito, M., Iwase, M., Kodama, H. et al.: A novel cis-acting element in promoters of plant B-type cyclin genes activates M phase-specific transcription. Plant Cell, 10, 331-341 (1998)[PubMed]
- Haga, N., Kobayashi, K., Suzuki, T. et al.: Mutations in MYB3R1 and MYB3R4 cause pleiotropic developmental defects and preferential down-regulation of multiple G2/M-specific genes in Arabidopsis. Plant Physiol., 157, 706-717 (2011)[PubMed]
- Ito, M., Araki, S., Matsunaga, S. et al.: G2/M-phase-specific transcription during the plant cell cycle is mediated by c-Myb-like transcription factors. Plant Cell, 13, 1891-1905 (2001)[PubMed]
- Zhu, W., Giangrande, P. H. & Nevins, J. R.: E2Fs link the control of G1/S and G2/M transcription. EMBO J., 23, 4615-4626 (2004)[PubMed]
- Okada, M., Akimaru, H., Hou, D. X. et al.: Myb controls G2/M progression by inducing cyclin B expression in the Drosophila eye imaginal disc. EMBO J., 21, 675-684 (2002)[PubMed]
- Haga, N., Kato, K., Murase, M. et al.: R1R2R3-Myb proteins positively regulate cytokinesis through activation of KNOLLE transcription in Arabidopsis thaliana. Development, 134, 1101-1110 (2007)[PubMed]
- Araki, S., Ito, M. & Soyano, T.: Mitotic cyclins stimulate the activity of c-Myb-like factors for transactivation of G2/M phase-specific genes in tobacco. J. Biol. Chem., 279, 32979-32988 (2004)[PubMed]
- Kato, K., Galis, I., Suzuki, S. et al.: Preferential up-regulation of G2/M phase-specific genes by overexpression of the hyperactive form of NtmybA2 lacking its negative regulation domain in tobacco BY-2 cells. Plant Physiol., 149, 1945-1957 (2009)[PubMed]
- Pomerening, J. R., Kim, S. Y. & Ferrell, J. E. Jr.: Systems-level dissection of the cell-cycle oscillator: bypassing positive feedback produces damped oscillations. Cell, 122, 565-578 (2005)[PubMed]
- Lukowitz, W., Mayer, U. & Jurgens, G.: Cytokinesis in the Arabidopsis embryo involves the syntaxin-related KNOLLE gene product. Cell, 84, 61-71 (1996)[PubMed]
- Nishihama, R. & Machida, Y.: Expansion of the phragmoplast during plant cytokinesis: a MAPK pathway may MAP it out. Curr. Opin. Plant Biol., 4, 507-512 (2001)[PubMed]
- Jurgens, G.: Cytokinesis in higher plants. Annu. Rev. Plant. Biol., 56, 281-299 (2005)[PubMed]
- Van Damme, D., Inze, D. & Russinova, E.: Vesicle trafficking during somatic cytokinesis. Plant Physiol., 147, 1544-1552 (2008)[PubMed]
- Nakaoka, Y., Miki, T., Fujioka, R. et al.: An inducible RNA interference system in Physcomitrella patens reveals a dominant role of augmin in phragmoplast microtubule generation. Plant Cell, 24, 1478-1493 (2012)[PubMed]
- Murata, T., Sano, T., Sasabe, M. et al.: Mechanism of microtubule array expansion in the cytokinetic phragmoplast. Nat. Commun., 4, 1967 (2013)[PubMed]
- Banno, H., Hirano, K., Nakamura, T. et al.: NPK1, a tobacco gene that encodes a protein with a domain homologous to yeast BCK1, STE11, and Byr2 protein kinases. Mol. Cell. Biol., 13, 4745-4752 (1993)[PubMed]
- Nishihama, R., Ishikawa, M., Araki, S. et al.: The NPK1 mitogen-activated protein kinase kinase kinase is a regulator of cell-plate formation in plant cytokinesis. Genes Dev., 15, 352-363 (2001)[PubMed]
- Nishihama, R., Soyano, T., Ishikawa, M. et al.: Expansion of the cell plate in plant cytokinesis requires a kinesin-like protein/MAPKKK complex. Cell, 109, 87-99 (2002)[PubMed]
- Soyano, T., Nishihama, R., Morikiyo, K. et al.: NQK1/NtMEK1 is a MAPKK that acts in the NPK1 MAPKKK-mediated MAPK cascade and is required for plant cytokinesis. Genes Dev., 17, 1055-1067 (2003)[PubMed]
- Nishihama, R., Banno, H., Kawahara, E. et al.: Possible involvement of differential splicing in regulation of the activity of Arabidopsis ANP1 that is related to mitogen-activated protein kinase kinase kinases (MAPKKKs). Plant J., 12, 39-48 (1997)[PubMed]
- Krysan, P. J., Jester, P. J., Gottwald, J. R. et al.: An Arabidopsis mitogen-activated protein kinase kinase kinase gene family encodes essential positive regulators of cytokinesis. Plant Cell, 14, 1109-1120 (2002)[PubMed]
- Takahashi, Y., Soyano, T., Kosetsu, K. et al.: HINKEL kinesin, ANP MAPKKKs and MKK6/ANQ MAPKK, which phosphorylates and activates MPK4 MAPK, constitute a pathway that is required for cytokinesis in Arabidopsis thaliana. Plant Cell Physiol., 51, 1766-1776 (2010)[PubMed]
- Kosetsu, K., Matsunaga, S., Nakagami, H. et al.: The MAP kinase MPK4 is required for cytokinesis in Arabidopsis thaliana. Plant Cell, 22, 3778-3790 (2010)[PubMed]
- Shapiro, P. S., Vaisberg, E., Hunt, A. J. et al.: Activation of the MKK/ERK pathway during somatic cell mitosis: direct interactions of active ERK with kinetochores and regulation of the mitotic 3F3/2 phosphoantigen. J. Cell Biol., 142, 1533-1545 (1998)[PubMed]
- Zecevic, M., Catling, A. D., Eblen, S. T. et al.: Active MAP kinase in mitosis: localization at kinetochores and association with the motor protein CENP-E. J. Cell Biol., 142, 1547-1558 (1998)[PubMed]
- Willard, F. S. & Crouch, M. F.: MEK, ERK, and p90RSK are present on mitotic tubulin in Swiss 3T3 cells: a role for the MAP kinase pathway in regulating mitotic exit. Cell. Signal., 13, 653-664 (2001)[PubMed]
- Kasahara, K., Nakayama, Y., Nakazato, Y. et al.: Src signaling regulates completion of abscission in cytokinesis through ERK/MAPK activation at the midbody. J. Biol. Chem., 282, 5327-5339 (2007)[PubMed]
- Strompen, G., El Kasmi, F., Richter, S. et al.: The Arabidopsis HINKEL gene encodes a kinesin-related protein involved in cytokinesis and is expressed in a cell cycle-dependent manner. Curr. Biol., 12, 153-158 (2002)[PubMed]
- Yang, C. Y., Spielman, M., Coles, J. P. et al.: TETRASPORE encodes a kinesin required for male meiotic cytokinesis in Arabidopsis. Plant J., 34, 229-240 (2003)[PubMed]
- Tanaka, H., Ishikawa, M., Kitamura, S. et al.: The AtNACK1/HINKEL and STUD/TETRASPORE/AtNACK2 genes, which encode functionally redundant kinesins, are essential for cytokinesis in Arabidopsis. Genes Cells, 9, 1199-1211 (2004)[PubMed]
- Sasabe, M., Soyano, T., Takahashi, Y. et al.: Phosphorylation of NtMAP65-1 by a MAP kinase down-regulates its activity of microtubule bundling and stimulates progression of cytokinesis of tobacco cells. Genes Dev., 20, 1004-1014 (2006)[PubMed]
- Sasabe, M., Kosetsu, K., Hidaka, M. et al.: Arabidopsis thaliana MAP65-1 and MAP65-2 function redundantly with MAP65-3/PLEIADE in cytokinesis downstream of MPK4. Plant Signal. Behav., 6, 743-747 (2011)[PubMed]
- Jiang, W., Jimenez, G., Wells, N. J. et al.: PRC1: a human mitotic spindle-associated CDK substrate protein required for cytokinesis. Mol. Cell, 2, 877-885 (1998)[PubMed]
- Schuyler, S. C., Liu, J. Y. & Pellman, D.: The molecular function of Ase1p: evidence for a MAP-dependent midzone-specific spindle matrix. J. Cell Biol., 160, 517-528 (2003)[PubMed]
- Muller, S., Smertenko, A., Wagner, V. et al.: The plant microtubule-associated protein AtMAP65-3/PLE is essential for cytokinetic phragmoplast function. Curr. Biol., 14, 412-417 (2004)[PubMed]
- Reichardt, I., Stierhof, Y. D., Mayer, U. et al.: Plant cytokinesis requires de novo secretory trafficking but not endocytosis. Curr. Biol., 17, 2047-2053 (2007)[PubMed]
- Dettmer, J., Hong-Hermesdorf, A., Stierhof, Y. D. et al.: Vacuolar H+-ATPase activity is required for endocytic and secretory trafficking in Arabidopsis. Plant Cell, 18, 715-730 (2006)[PubMed]
- Viotti, C., Bubeck, J., Stierhof, Y. D. et al.: Endocytic and secretory traffic in Arabidopsis merge in the trans-Golgi network/early endosome, an independent and highly dynamic organelle. Plant Cell, 22, 1344-1357 (2010)[PubMed]
- El Kasmi, F., Krause, C., Hiller, U. et al.: SNARE complexes of different composition jointly mediate membrane fusion in Arabidopsis cytokinesis. Mol. Biol. Cell, 24, 1593-1601 (2013)[PubMed]
- Park, M., Touihri, S., Muller, I. et al.: Sec1/Munc18 protein stabilizes fusion-competent syntaxin for membrane fusion in Arabidopsis cytokinesis. Dev. Cell, 22, 989-1000 (2012)[PubMed]
- Sasabe, M., Ishibashi, N., Haruta, T. et al.: The carboxyl-terminal tail of the stalk of Arabidopsis NACK1/HINKEL kinesin is required for its localization to the cell plate formation site. J. Plant Res., 128, 327-336 (2015)[PubMed]
- Kobayashi, K., Suzuki, T., Iwata, E. et al.: MYB3Rs, plant homologs of Myb oncoproteins, control cell cycle-regulated transcription and form DREAM-like complexes. Transcription, 6, 106-111 (2015)[PubMed]
- Lewis, P. W., Beall, E. L., Fleischer, T. C. et al.: Identification of a Drosophila Myb-E2F2/RBF transcriptional repressor complex. Genes Dev., 18, 2929-2940 (2004)[PubMed]
- Korenjak, M., Taylor-Harding, B., Binne, U. K. et al.: Native E2F/RBF complexes contain Myb-interacting proteins and repress transcription of developmentally controlled E2F target genes. Cell, 119,181-193 (2004)[PubMed]
- Sadasivam, S., Duan, S. & DeCaprio, J. A.: The MuvB complex sequentially recruits B-Myb and FoxM1 to promote mitotic gene expression. Genes Dev., 26, 474-489 (2012)[PubMed]
- Litovchick, L., Sadasivam, S., Florens, L. et al.: Evolutionarily conserved multisubunit RBL2/p130 and E2F4 protein complex represses human cell cycle-dependent genes in quiescence. Mol. Cell, 26: 539-551 (2007)[PubMed]
- Fischer, M. & DeCaprio, J. A.: Does Arabidopsis thaliana DREAM of cell cycle control? EMBO J., 34, 1987-1989 (2015)[PubMed]
著者プロフィール
略歴:1993年 東北大学大学院理学研究科 修了,同年 名古屋大学農学部 助手,1994年 東京大学大学院理学系研究科 助手を経て,2003年より名古屋大学大学院生命農学研究科 准教授.
研究テーマ:植物の発生および成長における,細胞分裂および細胞成長の制御.
関心事:細胞の体積の拡大と分裂とを連動させて,細胞のサイズを一定に保つしくみ.
笹部 美知子(Michiko Sasabe)
弘前大学農学生命科学部 准教授.
町田 泰則(Yasunori Machida)
名古屋大学大学院理学研究科 特任教授.
© 2016 伊藤正樹・笹部美知子・町田泰則 Licensed under CC 表示 2.1 日本