植物における遺伝子内メチル化の進化パターン
2016/10/25
宅野 将平
(総合研究大学院大学先導科学研究科 生命共生体進化学専攻)
email:宅野将平
領域融合レビュー, 5, e009 (2016) DOI: 10.7875/leading.author.5.e009
Shohei Takuno: The evolutionary patterns of gene body methylation in plants.

高等生物のゲノムにおいてDNAの一部のシトシンはメチル化されている.これをDNAメチル化という.植物においてはCG配列のほかCHG配列およびCHH配列のシトシンにメチル化がみられる.一般に,CG配列とCHG配列およびCHH配列の両方がDNAメチル化されている場合,DNAメチル化は遺伝子やトランスポゾンの発現を抑制する方向にはたらく.一方,遺伝子の内部においては,ほぼCG配列のみにDNAメチル化がみられる.このDNAメチル化を遺伝子内メチル化とよび,植物を含む多くの生物にみられる.遺伝子内メチル化は発現を抑制せず,むしろ,発現量の多い遺伝子にみられる傾向にある.これまでの研究により遺伝子内メチル化の機能に関するいくつかの仮説が提唱されたが,とくに機能をもたないという可能性も完全には否定されていない.このレビューにおいては,筆者らおよびほかの研究グループによる植物における遺伝子内メチル化の進化学的な研究を紹介し,遺伝子内メチル化の生物学的および進化的な意義について考察する.
次世代シークエンサーの発達によりさまざまな生物の全ゲノム配列の解読が容易になった.それにともない,DNAメチル化やヒストンの修飾に代表されるエピジェネティックな修飾のゲノムの全体におけるパターンの解明も容易になった.エピジェネティックな修飾のゲノムの全体におけるパターンをゲノムに対しエピゲノムとよぶ.ゲノム進化の研究の歴史は非常に長く,進化の理論も洗練されている.しかし,エピゲノムの進化学的な研究ははじまったばかりである.このレビューでは,まずゲノムの進化の理論について解説し,この理論がエピゲノムの進化に適応できるかについて議論する.
ゲノムは生物をその生物たらしめるのに必須な遺伝情報であり,その実体はアデニン,チミン,グアニン,シトシンの4種類の塩基をもつDNAである.DNA配列には遺伝子とよばれる機能単位が存在し,それを設計図として生成されるタンパク質が生体においてさまざまな役割を担い生物をかたちづくる.ゲノムは非常に重要なものであるが,不変ではない.ゲノムは突然変異により時間とともに変化していく.これが生物の進化の原動力となる.
生物の進化を考えるとき,注目する種の1個体のみを考えるだけでは不十分であり,その種に属し,相互に交配が可能で,さらに,その後代も稔性をもつすべての個体を考慮する必要がある.この個体の集まりを集団とよび,集団レベルの進化をメンデル遺伝の法則に準じて研究する分野を集団遺伝学という1).生物は時間が経過すると寿命により死に絶えるため,有性生殖などにより次世代を形成する必要がある.集団に含まれる個体どうしが交配し,それらの後代が次世代の集団を形成する.この過程をくり返して集団は維持される.
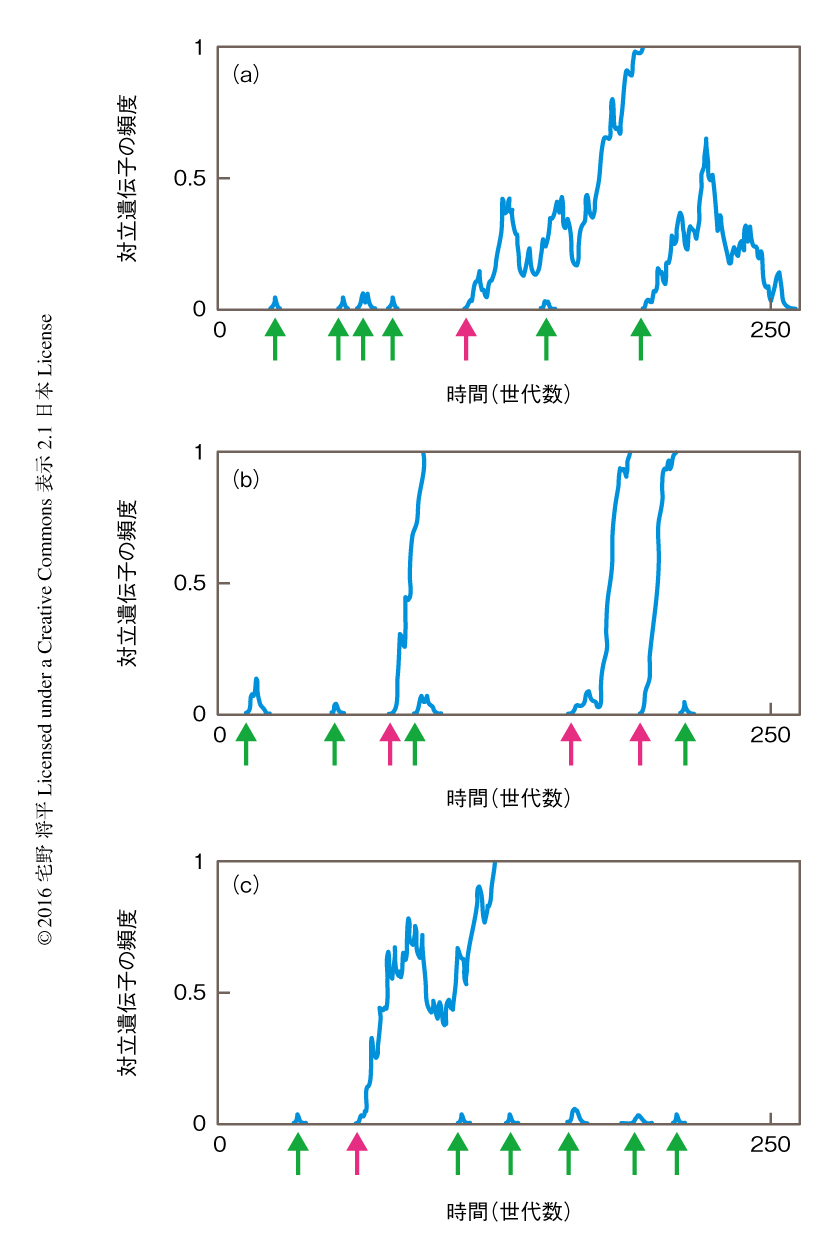
この過程において突然変異が生じる.集団遺伝学においては,この突然変異の集団における頻度(対立遺伝子の頻度)に着目する.突然変異率は非常に低いため,集団に含まれるほかの個体がすでに同じ突然変異をもつ確率は無視できるほど低い.つまり,2倍体の生物において,ある1個体は野生型と突然変異型とのヘテロ接合体になっている.集団に存在する個体の数をNとしたとき,対立遺伝子の頻度の初期値は1/2Nになる.大部分の突然変異は生物の表現型には影響しないと考えられるため,個体のあいだの交配はランダムに起こる.その結果,次世代での対立遺伝子の頻度は完全に偶然により決定する.この効果を遺伝的浮動という(図1a).大部分の突然変異は次世代には受け継がれず,いずれ集団から消失する.しかし,その頻度が偶然に上昇をつづけ,最終的に対立遺伝子の頻度が1になることがある.つまり,すべての個体がこの突然変異をホモ接合体としてもつようになる.この現象を突然変異の固定とよぶ.このように,ゲノムは遺伝的浮動という偶然の効果だけでも進化しうる.
しかし,まれに突然変異が表現型に影響をおよぼす場合がある.突然変異型が野生型に比べ生存や繁殖に有利な影響をおよぼす場合を考える.野生型と比べたときの後代の残しやすさを適応度とよび,突然変異による影響をうけた個体の適応度が野生型の適応度を上まわると,対立遺伝子の頻度は急激に上昇し固定される(図1b).この対立遺伝子の頻度を上昇させる力を正の自然選択とよぶ.しかし,有利な突然変異のすべてが集団に固定されるわけではなく,集団から消失するものも存在する.これは,正の自然選択の力が遺伝的浮動の力に負けることが往々にしてあるからである.逆に,突然変異の影響をうけた個体の適応度が野生型の適応度を下まわるとき,対立遺伝子の頻度は急激に低下する傾向にある(図1c).この力を負の自然選択とよぶ.正の自然選択の場合と同様に,遺伝的浮動の力は無視できなく,非常にまれではあるが,有害な突然変異も集団に固定されることがある.この現象は集団の大きさが小さいほどよく起こる.これは,遺伝的浮動の力は集団の大きさが小さいほど大きいからである.これらをまとめると,ゲノムは,よりよい突然変異を後代に残し,悪い突然変異を切り捨てて進化する傾向にあるが,偶然の効果も大きな役割をはたす.
ゲノムとは簡単にいうと生物に固有の設計図である.個体を構成するすべての細胞が同一のゲノムをもつ.しかし,同じ個体においても,違う組織の細胞が必要とする遺伝子のセットは異なる.たとえば,植物の葉であればどの細胞においても葉に必要な遺伝情報が発現し,花ではまた違った遺伝情報が適切に発現するようプログラムされている.つまり,個体の発生が進むごとに適切な遺伝子の発現をオンあるいはオフする必要があり,同じゲノムをもちながらDNA配列以外の情報により遺伝情報の発現は制御される.DNA配列以外の情報による遺伝子発現の制御は生命現象に深くかかわっており,このようなDNA配列の変化をともなわない,細胞分裂ののちにも継承される遺伝子発現の変化を研究する分野はエピジェネティクスとよばれる.
この遺伝子発現を制御する機構としてエピジェネティックな修飾がよく研究されている.1つ目はヒストンの修飾である.DNAはむきだしのまま細胞に存在するのではなく,ヒストンタンパク質とDNAとの複合体であるクロマチンとして存在し,さらに,それらが凝集し染色体を形成する.ヒストンは4種類のヒストンタンパク質2つずつからなる八量体を形成するが,これらヒストンに化学的な修飾が付与されることをヒストンの修飾とよぶ.たとえば,ヒストンH3の9番目のアミノ酸であるLysがメチル化されると,その周辺のクロマチンは凝集してヘテロクロマチンとなり発現は抑制される.他方,ヒストンH3の4番目のLysのメチル化は発現の活性化と強い相関をもつ.
2つ目はDNAメチル化である.このレビューにおいては,とくに真核生物におけるシトシンのメチル化に焦点をあてる.DNAのもつ4種類の塩基のうち,シトシンの六員環の5位の炭素原子にメチル基が付与される.ゲノムにおいてすべてのシトシンがメチル化されるわけではない.動物においては,基本的にシトシンのつぎにグアニンがつづくCG配列のシトシンがメチル化されうる.このCG配列のDNAメチル化をCGメチル化とよぶ.一方,植物においてはすべてのシトシンがメチル化されうるが,その配列により異なるメチル化の機構が用いられる.植物におけるDNAメチル化にはCGメチル化,CHGメチル化,CHHメチル化の3種類があり,Hはグアニン以外の塩基を示す.DNAメチル化は,ヒストンH3の9番目のLysのメチル化と同様に,発現を抑制する方向にはたらくと考えられている.
DNAメチル化は細胞分裂ののちにも継承される2).DNAは二重らせん構造をとり,センス鎖が5’-CG-3’のときアンチセンス鎖は3’-GC-5’という回文構造になる.基本的に,センス鎖のシトシンがメチル化されているとき,アンチセンス鎖のシトシンも非常に高い確率でメチル化されている.しかし,細胞分裂にともなうDNA複製の際に新たに合成される娘DNA鎖はメチル化されていない.つまり,回文構造の片方のシトシンしかメチル化されていない.これをヘミメチル化状態という.このヘミメチル化状態を認識し,娘DNA鎖のシトシンを新たにメチル化して細胞分裂ののちもCG配列のDNAメチル化を維持する機構が存在する.この機構の中核として,動物ではDNMT1,植物ではMET1というDNAメチル化酵素が同定されている.また,植物にはCMT3というクロモドメインをもつDNAメチル化酵素も存在する.CMT3はCHGメチル化の維持の中核としてはたらき,CHGメチル化とヒストンH3の9番目のLysのメチル化に相互に依存する自己強化ループにより活性を示す3).一方,CHHメチル化においては細胞分裂ごとにRNA依存型のDNAメチル化の機構がはたらく2).このような機構によりDNAメチル化は細胞分裂ののちにも維持される.
近年のDNAシークエンサーの発達により,多数の生物において全ゲノム配列が解読されている.これにともない,ゲノムの全体においてエピジェネティックな修飾がどのように分布するか解析されるようになった.このエピジェネティックな修飾のパターンをゲノムに対しエピゲノムとよぶ.さまざまな生物種や組織においてエピゲノムの解読が急速に進んでおり,同じ種の複数の個体についてエピゲノムを解読する研究も活発である.
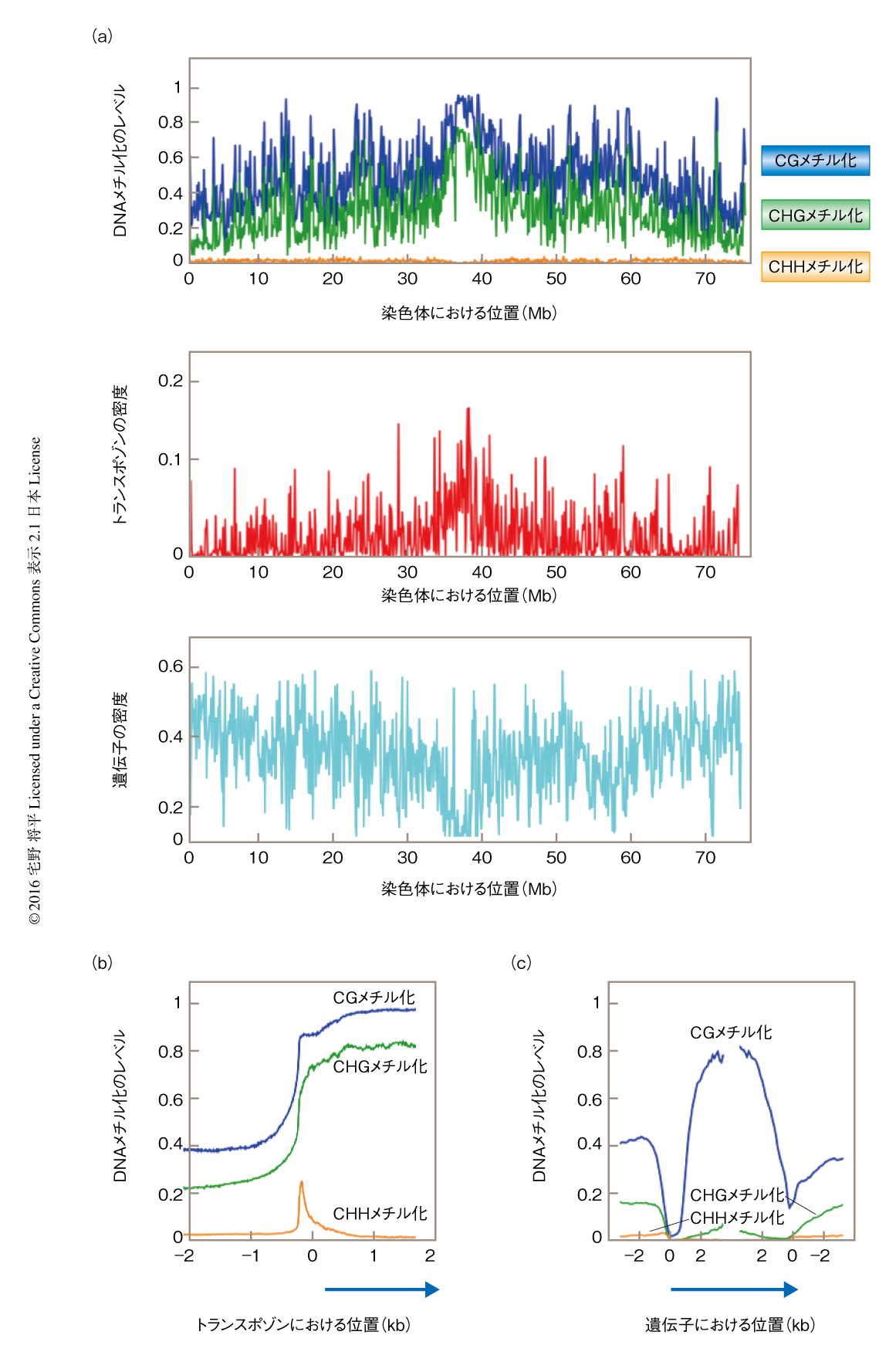
植物においてDNAメチル化はゲノムにランダムには分布しない.DNAメチル化のパターンは,ゲノムにおける遺伝子の密度およびトランスポゾンの密度と密接にリンクする.イネ科植物Brachypodium distachyonの全ゲノムにおいて,ゲノムの領域のあいだでDNAメチル化のレベル,つまり,メチル化されたシトシンの割合には大きなばらつきがある4)(図2a).DNAメチル化のレベルは,染色体におけるトランスポゾンの密度と正の相関,遺伝子の密度と負の相関を示す.トランスポゾンの内部については,CGメチル化およびCHGメチル化のレベルが際立って高い(図2b).CGメチル化およびCHGメチル化と,CHGメチル化と強い相関を示すヒストンH3の9番目のLysのメチル化がトランスポゾン領域におけるヘテロクロマチンの形成に重要であると考えられており,多くの植物においてこのパターンがみられる5).また,プロモーター領域においてはDNAメチル化のレベルが非常に低い(図2c).これは,遺伝子の発現を抑制しないためと考えられる.遺伝子コード領域については遺伝子間領域より高いレベルのCGメチル化がみられるが,CHGメチル化およびCHHメチル化のレベルは低い(図2c).
このように,エピゲノムの構成はゲノムの構成と密接に関連する.多くの植物種においても同様のパターンがみられる5-7).ここから,ゲノムに大きな変化が起こった場合,エピゲノムにも影響があると予想される.逆に,エピゲノムのパターンがゲノムの構成に影響をおよぼすこともある.メチル化されたシトシンは突然変異率が非常に高くなり,チミンに変化しやすくなる.実際,CGメチル化のみがみられる植物の遺伝子においては,CG配列の数が遺伝子のGC含量から期待されるより有意に少ない8).つまり,ゲノムの進化とエピゲノムの進化は強く関連する.
遺伝子コード領域におけるCGメチル化は遺伝子内メチル化(gene body methylation)とよばれる.一般に,ゲノムの進化を研究する際にはさまざまな種のあいだでゲノムを比較する.しかし,古くに分化した種のあいだのゲノムの比較は,遺伝子コード領域のほかでは困難である.このため,エピゲノム進化の例として遺伝子内メチル化に着目する.
遺伝子内メチル化以外のDNAメチル化は遺伝子やトランスポゾンの発現の抑制にはたらくと考えられている.しかし,遺伝子内メチル化の機能はいまだ不明である.遺伝子内メチル化のレベルは遺伝子のあいだで大きなばらつきがある5).CG配列における遺伝子内メチル化は発現量の高い遺伝子にみられる傾向にあるため,少なくとも発現の抑制にはかかわらないと思われる8,9).
これまでに,遺伝子内メチル化の機能に関してさまざまな仮説が提唱されてきた10-12).たとえば,1)遺伝子の内部におけるヒストンH2A.Zの蓄積を抑制する,2)遺伝子の内部に存在するプロモーターからの発現を抑制する,3)イントロンのスプライシングにかかわる,4)転写の効率を上げる,5)転写量のノイズを減少させる,などが提唱されている.しかし,いまのところ,どの仮説も決め手に欠ける.
実際のところ,シロイヌナズナやほかの植物において,遺伝子内メチル化はランダムに存在するわけではない8,13).さきにも述べたように,遺伝子内メチル化は発現量の高い遺伝子にみられる.仮説1)のヒストンH2A.Zは組織あるいは環境に特異的に発現する遺伝子によくみられる.実際に,発現する組織の多い遺伝子ほど遺伝子内メチル化がみられる傾向にある.もうひとつ重要な点として,遺伝子の長さがあげられる.長い遺伝子ほど遺伝子内メチル化をもつ可能性が高い傾向にある.長い遺伝子においては,仮説2)の不要なプロモーターをもつ確率が上がる.これをふせぐため,長い遺伝子には遺伝子内メチル化が存在するのかもしれない.さらに,遺伝子が長いほどエキソンの数が多いと期待され,そのような遺伝子においては,仮説3)のスプライシングの機能が重要になりうる.実際,モデル植物であるシロイヌナズナをはじめ,植物において遺伝子の長さとエキソンの数は高い正の相関を示す.つまり,遺伝子内メチル化はこれまで提唱されてきたような機能の仮説が正しい際に期待される遺伝子においてみられる傾向にあるようにみえる.
さきのどれかの仮説あるいは複数の仮説が正しい場合,遺伝子内メチル化は重要な機能をもつことになる.これがDNAメチル化ではなくDNA配列の場合には議論は簡単になる.DNA配列のある領域が非常に重要である場合,さまざまな種のあいだでこのDNA配列を比較したとき,ほかの領域より保存されていることが期待される.これは,DNA配列が変化しないのではない.DNA配列は一定の速度で変化する.しかし,この変化が個体の適応度を低下させると,この個体は後代を残しにくくなる.つまり,この変化は負の自然選択により次世代に伝わらず消失する(図1c).この結果,DNA配列を種のあいだで比較したとき,重要なDNA配列において変化は起こっていないようにみえる.
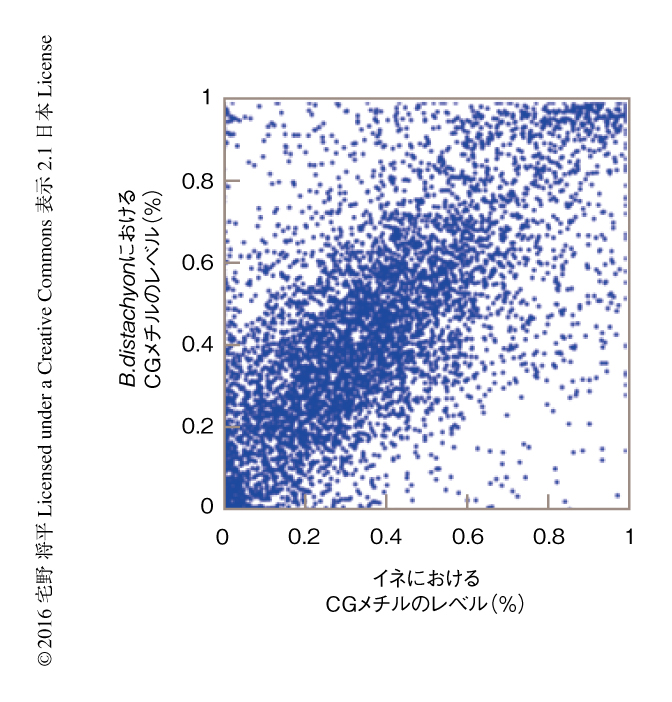
筆者らは,この理論がDNAメチル化,とくに,遺伝子内メチル化に応用できるかどうかを調べるため,イネとその近縁種であるB. distachyonの全ゲノムにおけるDNAメチル化のパターンを比較した.種のあいだで祖先を共通とする遺伝子のペアをオーソログとよぶが,イネとB. distachyonのオーソログのあいだではCGメチル化のレベルが似ており有意な正の相関を示した4)(図3).つまり,イネにおいてある遺伝子が遺伝子内メチル化をもつ場合,B. distachyonのオーソログにおいても同じレベルのDNAメチル化がみられた.このような傾向はさまざまな植物種において調べられ,アブラナ科のシロイヌナズナとArabidopsis lyrata,さらに,その近縁種のCapsella rubelleにおいてもみられた14).被子植物,裸子植物,シダ植物をみた場合にも同様の傾向がみられ,最長で4億年のスパンで遺伝子内メチル化は保存されていることが示された5).これらのことから,遺伝子内メチル化は重要である可能性が示唆された.
しかし,現在,もっとも確からしいとされる遺伝子内メチル化の機能の仮説は,遺伝子のヘテロクロマチン化を抑制した副産物であるというものである3).シロイヌナズナにおいては数千の遺伝子がヘテロクロマチン化の標的になる.つまり,CGメチル化,CHGメチル化,ヒストンH3の9番目のLysのメチル化が蓄積し,それらの遺伝子の発現が抑制される.このヘテロクロマチン化にはCHGメチル化の維持にかかわるCMT3が重要であると考えられている.しかし,シロイヌナズナに存在するIBM1はヘテロクロマチン化の標的となる遺伝子からCHGメチル化およびヒストンH3の9番目のLysのメチル化を除去し,遺伝子のヘテロクロマチン化をふせぎ正常な発現を促進する.この結果,遺伝子の内部にはCGメチル化のみが残存する.つまり,シロイヌナズナにおいて遺伝子内メチル化はとくに機能をもたない可能性が高い.
これを支持する結果として,遺伝子内メチル化をもたないシロイヌナズナの近縁種が発見された15).アブラナ科植物であるEutrema salsugineumおよびConringia planisiliquaにおいて,ゲノムからCMT3遺伝子が消失していた.これにともない,おそらく遺伝子がヘテロクロマチン化されなくなり,その副産物である遺伝子の内部のCGメチル化も存在しなくなったと予想される.
この結果は,遺伝子内メチル化が進化的に高度に保存されており重要であるという結果と矛盾するようにみえる.しかし,さきに述べたように,進化の過程においてはごくまれに生存や繁殖に不利な影響をもたらす突然変異が固定されることがある(図1c).これは,種内における突然変異の頻度の動態は偶然による効果が大きいためであり,集団の大きさが小さいほどこの偶然の効果がはたらきやすくなる.つまり,負の自然選択により突然変異の頻度は低下する方向にむかおうとするが,偶然に頻度が上昇し集団に固定される確率はゼロではない.E. salsugineumとC. planisiliquaにおいてCMT3遺伝子および遺伝子内メチル化が消失しているという結果からいえることは,遺伝子内メチル化は生存には必ずしも必須ではない,ということである.
個体のあいだにみられるDNAメチル化のレベルの異なる領域をDMR(differentially methylated region,メチル化可変領域)という.このDMRはせいぜい数百bpと遺伝子の全長と比べ非常に短く,遺伝子の内部に多く存在する.シロイヌナズナの100個体以上の全ゲノム配列および全ゲノムにおけるDNAメチル化のパターンを解析した結果16,17),DMRはCGメチル化のレベルの高い個体において遺伝子の発現量を少し高くする方向にはたらく傾向にあった.つまり,遺伝子内メチル化の機能の有無はともかく,その変化が遺伝子発現になんらかの影響をおよぼすことは確からしい.また,DMRによる遺伝子発現の上昇がスウェーデン北部のシロイヌナズナの集団,つまり,寒い地域への適応に関与する可能性が示唆された17).この結果から,DNA配列の変化だけでなく,DNAメチル化の変化にも正の自然選択がはたらく可能性が示される.
シロイヌナズナの個体のあいだにみられる変異は,70万年から100万年のあいだに蓄積されたものである.この進化を考えるうえでは非常に短い期間に,数百bpという短い領域においてDNAメチル化のレベルの違いが蓄積された.一方で,種のあいだで遺伝子内メチル化のレベルを比較したときには保存されている傾向にあったことから,DMRのような小さな変化は結局は消失すると予想される.しかし,もっと長い進化の時間を考えたとき,小さな変化の蓄積により遺伝子内メチル化のレベルが大きく変化する可能性は否定できないだろう.
これらをまとめると,遺伝子内メチル化は植物の生存に必須ではない.しかし,遺伝子内メチル化のレベルの変化は遺伝子の発現に大なり小なり影響をおよぼしうる.DNA配列の変化と比べて,DNAメチル化の変化が遺伝子の発現におよぼす影響は小さいことがシロイヌナズナにおいて示されている18).しかし,長期にわたる進化を考えたとき,遺伝子内メチル化の変化の蓄積は遺伝子の発現および個体の適応度に影響する可能性がある.
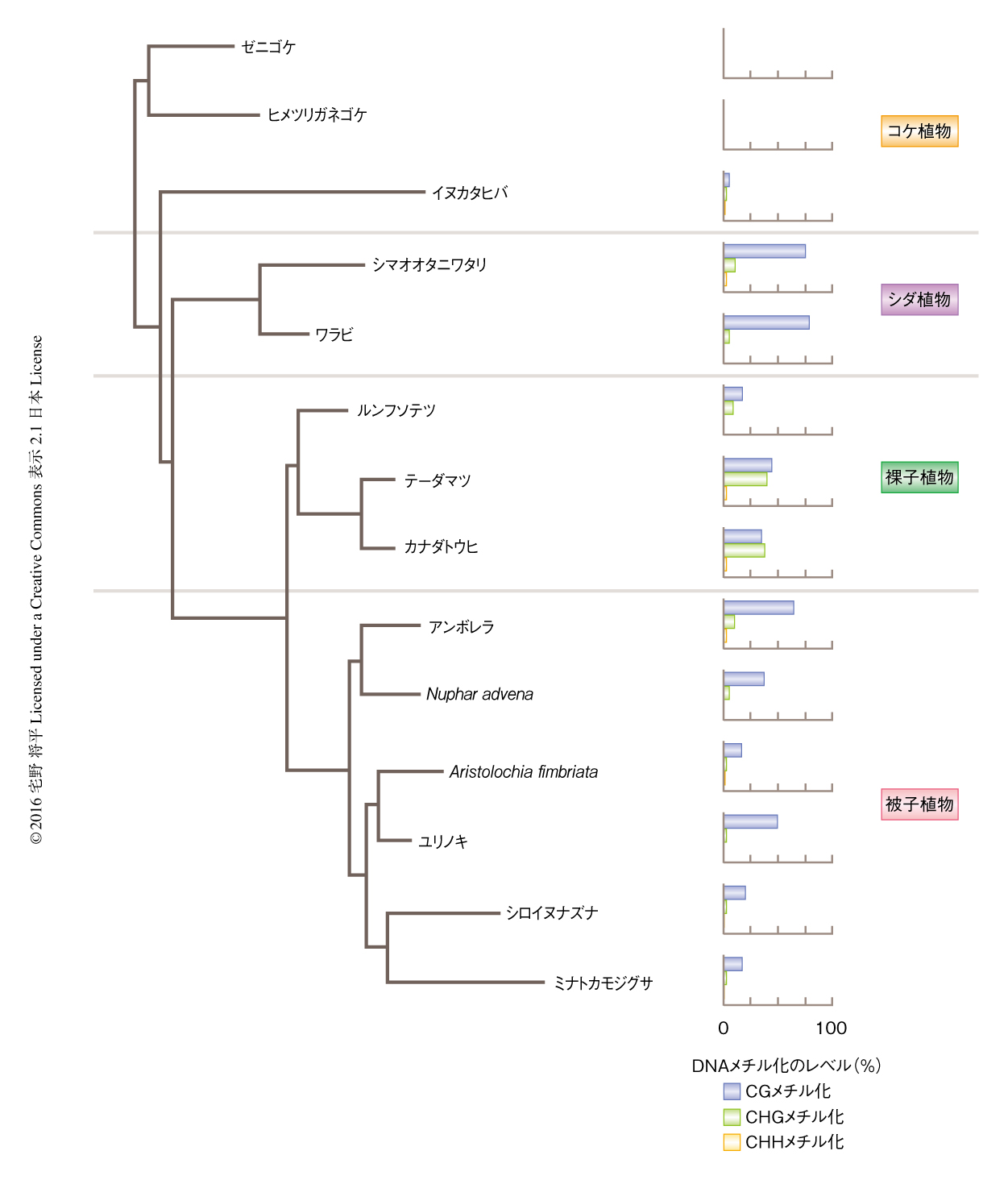
遺伝子内メチル化はさまざまな生物に存在し,脊椎動物,無脊椎動物,植物にみられる9).一方,先行研究において,陸上植物のコケ植物において遺伝子内メチル化はみられなかった7).筆者らは,陸上植物の歴史において遺伝子内メチル化がどのように進化してきたかを明らかにするため,公開されている5種の陸上植物の全ゲノムにおけるDNAメチル化のデータ,および,新たに得た9種の陸上植物におけるDNAメチル化のデータを解析した5).このデータは,コケ植物3種,シダ植物2種,裸子植物3種,被子植物6種を含む(図4).いくつかの種においては全ゲノム配列が解読されていなかったためESTのデータを用いた.このため,エキソンにおけるDNAメチル化のパターンに焦点をあてた.
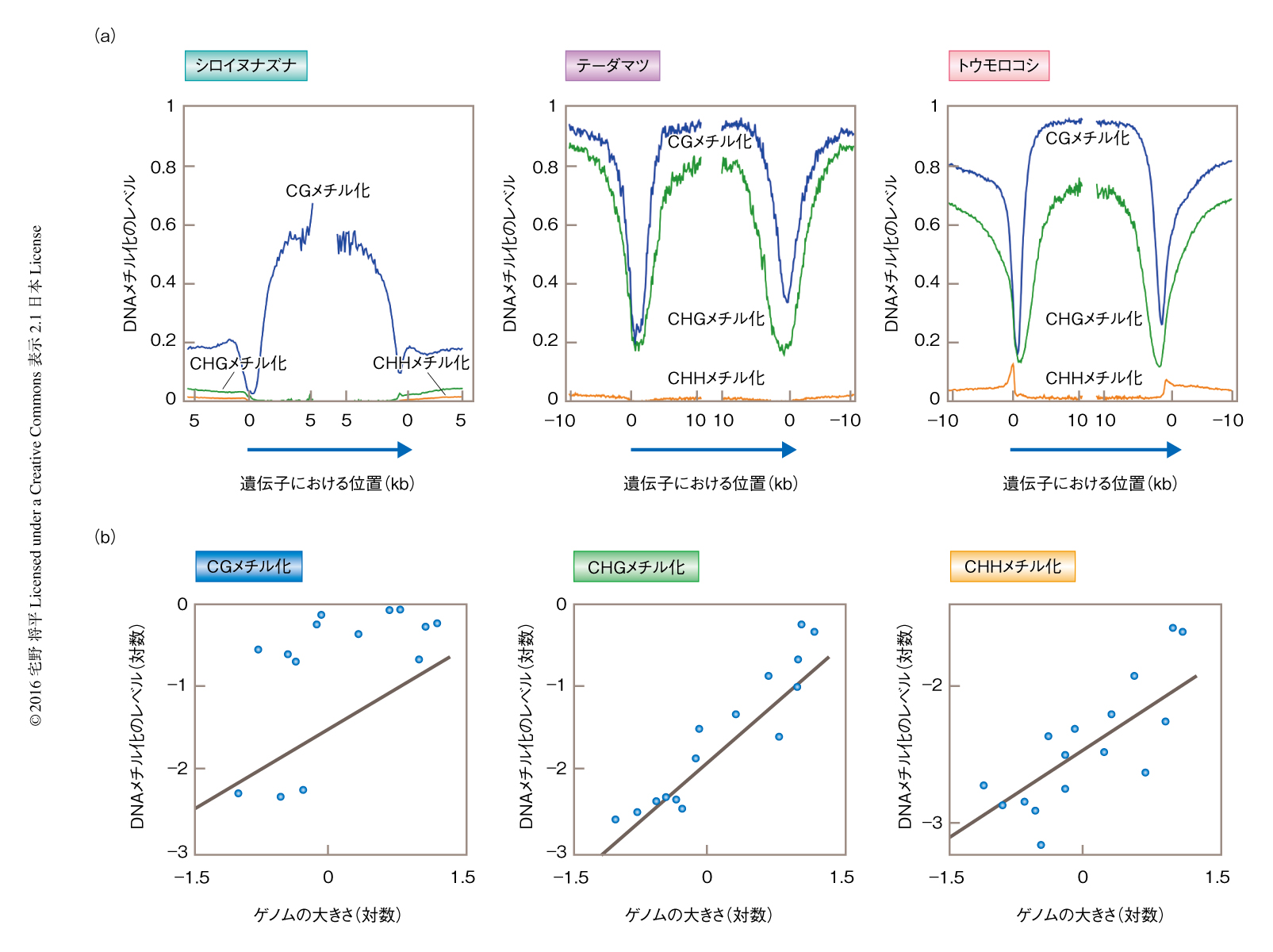
おのおのの陸上植物のエキソンにおけるDNAメチル化の平均のレベルには大きなばらつきがあった(図4).コケ類においてはCGメチル化,CHGメチル化,CHHメチル化のすべてが非常に低い値を示した.一方,シダ植物は高いCGメチル化のレベルを示した.裸子植物も高いCGメチル化のレベルを示したが,同様に,高いCHGメチル化もみられ,シロイヌナズナの結果とは大きく異なった.被子植物においては,CGメチル化のレベルにはばらつきはあったものの,CHGメチル化およびCHHメチル化のレベルは低い傾向にあった.さらに,全ゲノム配列が解読されている種について,遺伝子周辺DNAメチル化のパターンを調べたところ.プロモーター領域においてDNAメチル化が大幅に減少する点と,遺伝子の中央部にいくほどDNAメチル化のレベルが高くなる点は共通であった(図5a).しかし,いくつか相違点もあった.CGメチル化のレベルの絶対値は種により大きく異なった.さらに,テーダマツでは遺伝子の内部において高いCHGメチル化がみられた.この傾向は裸子植物に特異的というわけではなく,トウモロコシにおいても共通していた(図5a).
どのような要因が遺伝子の内部におけるDNAメチル化のレベルを決定するのか調べた5).植物においてゲノムの大きさには非常に大きなばらつきがあり,ゲノムが大きい種においてはトランスポゾンなどの反復配列が大部分をしめる19).トランスポゾン領域は基本的にヘテロクロマチン化され,DNAメチル化のレベルも非常に高い.このため,ゲノムが大きい種ほどDNAメチル化のレベルが高く,遺伝子の内部においても副産物的にDNAメチル化のレベルが上昇していると予想した.この仮説を検証するため,14種の陸上植物の遺伝子からトランスポゾンと類似性のあるものと偽遺伝子らしきものを取り除き,遺伝子内メチル化のレベルとゲノムの大きさとの関係を解析した.その結果,CGメチル化およびCHGメチル化において有意な正の相関が検出され,仮説は支持された(図5b).とくに,CHGメチル化とゲノムの大きさとの相関がもっとも高く,ゲノムが増加した副産物としてCHGメチル化も上昇したと考えられた.この結果は,植物においてゲノムが進化すると,エピゲノムもそれに付随して進化することを示した一例といえる.
エピゲノムの進化の研究ははじまったばかりである.現在,植物においてはシロイヌナズナの研究がもっとも進んでおり,ほかの種のデータも蓄積しつつある.しかし,エピゲノムの進化の一般則を知るには,より多くのゲノムおよびエピゲノムのデータが必要になる.ゲノムの進化の基礎は集団遺伝学にあることはこのレビューの冒頭において述べた.同様に,さまざまな種のエピゲノムの多型データの解析はエピゲノムの進化の法則の解明および進化の理論の構築に重要であり,今後の発展に期待したい.
略歴:2008年 東北大学大学院農学研究科博士課程 修了,同年 総合研究大学院大学先導科学研究科 博士研究員,2010年 米国California大学Irvine校 博士研究員,2012年 米国California大学Davis校 博士研究員を経て,2013年より総合研究大学院大学先導科学研究科 助教.
研究テーマ:生物進化学を専門とする.とくに,遺伝学をベースにしたゲノム進化学,集団遺伝学の手法を用い,あらゆる生物を対象として研究を進めてきた.さらに,エピジェネティクスを進化の理論に取り込み,新たな進化モデルの構築をめざしている.
研究室URL:https://sites.google.com/site/shoheitakunoj/home
© 2016 宅野 将平 Licensed under CC 表示 2.1 日本
(総合研究大学院大学先導科学研究科 生命共生体進化学専攻)
email:宅野将平
領域融合レビュー, 5, e009 (2016) DOI: 10.7875/leading.author.5.e009
Shohei Takuno: The evolutionary patterns of gene body methylation in plants.
要 約
高等生物のゲノムにおいてDNAの一部のシトシンはメチル化されている.これをDNAメチル化という.植物においてはCG配列のほかCHG配列およびCHH配列のシトシンにメチル化がみられる.一般に,CG配列とCHG配列およびCHH配列の両方がDNAメチル化されている場合,DNAメチル化は遺伝子やトランスポゾンの発現を抑制する方向にはたらく.一方,遺伝子の内部においては,ほぼCG配列のみにDNAメチル化がみられる.このDNAメチル化を遺伝子内メチル化とよび,植物を含む多くの生物にみられる.遺伝子内メチル化は発現を抑制せず,むしろ,発現量の多い遺伝子にみられる傾向にある.これまでの研究により遺伝子内メチル化の機能に関するいくつかの仮説が提唱されたが,とくに機能をもたないという可能性も完全には否定されていない.このレビューにおいては,筆者らおよびほかの研究グループによる植物における遺伝子内メチル化の進化学的な研究を紹介し,遺伝子内メチル化の生物学的および進化的な意義について考察する.
はじめに
次世代シークエンサーの発達によりさまざまな生物の全ゲノム配列の解読が容易になった.それにともない,DNAメチル化やヒストンの修飾に代表されるエピジェネティックな修飾のゲノムの全体におけるパターンの解明も容易になった.エピジェネティックな修飾のゲノムの全体におけるパターンをゲノムに対しエピゲノムとよぶ.ゲノム進化の研究の歴史は非常に長く,進化の理論も洗練されている.しかし,エピゲノムの進化学的な研究ははじまったばかりである.このレビューでは,まずゲノムの進化の理論について解説し,この理論がエピゲノムの進化に適応できるかについて議論する.
1.ゲノム進化の理論
ゲノムは生物をその生物たらしめるのに必須な遺伝情報であり,その実体はアデニン,チミン,グアニン,シトシンの4種類の塩基をもつDNAである.DNA配列には遺伝子とよばれる機能単位が存在し,それを設計図として生成されるタンパク質が生体においてさまざまな役割を担い生物をかたちづくる.ゲノムは非常に重要なものであるが,不変ではない.ゲノムは突然変異により時間とともに変化していく.これが生物の進化の原動力となる.
生物の進化を考えるとき,注目する種の1個体のみを考えるだけでは不十分であり,その種に属し,相互に交配が可能で,さらに,その後代も稔性をもつすべての個体を考慮する必要がある.この個体の集まりを集団とよび,集団レベルの進化をメンデル遺伝の法則に準じて研究する分野を集団遺伝学という1).生物は時間が経過すると寿命により死に絶えるため,有性生殖などにより次世代を形成する必要がある.集団に含まれる個体どうしが交配し,それらの後代が次世代の集団を形成する.この過程をくり返して集団は維持される.
この過程において突然変異が生じる.集団遺伝学においては,この突然変異の集団における頻度(対立遺伝子の頻度)に着目する.突然変異率は非常に低いため,集団に含まれるほかの個体がすでに同じ突然変異をもつ確率は無視できるほど低い.つまり,2倍体の生物において,ある1個体は野生型と突然変異型とのヘテロ接合体になっている.集団に存在する個体の数をNとしたとき,対立遺伝子の頻度の初期値は1/2Nになる.大部分の突然変異は生物の表現型には影響しないと考えられるため,個体のあいだの交配はランダムに起こる.その結果,次世代での対立遺伝子の頻度は完全に偶然により決定する.この効果を遺伝的浮動という(図1a).大部分の突然変異は次世代には受け継がれず,いずれ集団から消失する.しかし,その頻度が偶然に上昇をつづけ,最終的に対立遺伝子の頻度が1になることがある.つまり,すべての個体がこの突然変異をホモ接合体としてもつようになる.この現象を突然変異の固定とよぶ.このように,ゲノムは遺伝的浮動という偶然の効果だけでも進化しうる.
しかし,まれに突然変異が表現型に影響をおよぼす場合がある.突然変異型が野生型に比べ生存や繁殖に有利な影響をおよぼす場合を考える.野生型と比べたときの後代の残しやすさを適応度とよび,突然変異による影響をうけた個体の適応度が野生型の適応度を上まわると,対立遺伝子の頻度は急激に上昇し固定される(図1b).この対立遺伝子の頻度を上昇させる力を正の自然選択とよぶ.しかし,有利な突然変異のすべてが集団に固定されるわけではなく,集団から消失するものも存在する.これは,正の自然選択の力が遺伝的浮動の力に負けることが往々にしてあるからである.逆に,突然変異の影響をうけた個体の適応度が野生型の適応度を下まわるとき,対立遺伝子の頻度は急激に低下する傾向にある(図1c).この力を負の自然選択とよぶ.正の自然選択の場合と同様に,遺伝的浮動の力は無視できなく,非常にまれではあるが,有害な突然変異も集団に固定されることがある.この現象は集団の大きさが小さいほどよく起こる.これは,遺伝的浮動の力は集団の大きさが小さいほど大きいからである.これらをまとめると,ゲノムは,よりよい突然変異を後代に残し,悪い突然変異を切り捨てて進化する傾向にあるが,偶然の効果も大きな役割をはたす.
2.エピジェネティクスの基礎
ゲノムとは簡単にいうと生物に固有の設計図である.個体を構成するすべての細胞が同一のゲノムをもつ.しかし,同じ個体においても,違う組織の細胞が必要とする遺伝子のセットは異なる.たとえば,植物の葉であればどの細胞においても葉に必要な遺伝情報が発現し,花ではまた違った遺伝情報が適切に発現するようプログラムされている.つまり,個体の発生が進むごとに適切な遺伝子の発現をオンあるいはオフする必要があり,同じゲノムをもちながらDNA配列以外の情報により遺伝情報の発現は制御される.DNA配列以外の情報による遺伝子発現の制御は生命現象に深くかかわっており,このようなDNA配列の変化をともなわない,細胞分裂ののちにも継承される遺伝子発現の変化を研究する分野はエピジェネティクスとよばれる.
この遺伝子発現を制御する機構としてエピジェネティックな修飾がよく研究されている.1つ目はヒストンの修飾である.DNAはむきだしのまま細胞に存在するのではなく,ヒストンタンパク質とDNAとの複合体であるクロマチンとして存在し,さらに,それらが凝集し染色体を形成する.ヒストンは4種類のヒストンタンパク質2つずつからなる八量体を形成するが,これらヒストンに化学的な修飾が付与されることをヒストンの修飾とよぶ.たとえば,ヒストンH3の9番目のアミノ酸であるLysがメチル化されると,その周辺のクロマチンは凝集してヘテロクロマチンとなり発現は抑制される.他方,ヒストンH3の4番目のLysのメチル化は発現の活性化と強い相関をもつ.
2つ目はDNAメチル化である.このレビューにおいては,とくに真核生物におけるシトシンのメチル化に焦点をあてる.DNAのもつ4種類の塩基のうち,シトシンの六員環の5位の炭素原子にメチル基が付与される.ゲノムにおいてすべてのシトシンがメチル化されるわけではない.動物においては,基本的にシトシンのつぎにグアニンがつづくCG配列のシトシンがメチル化されうる.このCG配列のDNAメチル化をCGメチル化とよぶ.一方,植物においてはすべてのシトシンがメチル化されうるが,その配列により異なるメチル化の機構が用いられる.植物におけるDNAメチル化にはCGメチル化,CHGメチル化,CHHメチル化の3種類があり,Hはグアニン以外の塩基を示す.DNAメチル化は,ヒストンH3の9番目のLysのメチル化と同様に,発現を抑制する方向にはたらくと考えられている.
DNAメチル化は細胞分裂ののちにも継承される2).DNAは二重らせん構造をとり,センス鎖が5’-CG-3’のときアンチセンス鎖は3’-GC-5’という回文構造になる.基本的に,センス鎖のシトシンがメチル化されているとき,アンチセンス鎖のシトシンも非常に高い確率でメチル化されている.しかし,細胞分裂にともなうDNA複製の際に新たに合成される娘DNA鎖はメチル化されていない.つまり,回文構造の片方のシトシンしかメチル化されていない.これをヘミメチル化状態という.このヘミメチル化状態を認識し,娘DNA鎖のシトシンを新たにメチル化して細胞分裂ののちもCG配列のDNAメチル化を維持する機構が存在する.この機構の中核として,動物ではDNMT1,植物ではMET1というDNAメチル化酵素が同定されている.また,植物にはCMT3というクロモドメインをもつDNAメチル化酵素も存在する.CMT3はCHGメチル化の維持の中核としてはたらき,CHGメチル化とヒストンH3の9番目のLysのメチル化に相互に依存する自己強化ループにより活性を示す3).一方,CHHメチル化においては細胞分裂ごとにRNA依存型のDNAメチル化の機構がはたらく2).このような機構によりDNAメチル化は細胞分裂ののちにも維持される.
3.ゲノムとエピゲノムの関係
近年のDNAシークエンサーの発達により,多数の生物において全ゲノム配列が解読されている.これにともない,ゲノムの全体においてエピジェネティックな修飾がどのように分布するか解析されるようになった.このエピジェネティックな修飾のパターンをゲノムに対しエピゲノムとよぶ.さまざまな生物種や組織においてエピゲノムの解読が急速に進んでおり,同じ種の複数の個体についてエピゲノムを解読する研究も活発である.
植物においてDNAメチル化はゲノムにランダムには分布しない.DNAメチル化のパターンは,ゲノムにおける遺伝子の密度およびトランスポゾンの密度と密接にリンクする.イネ科植物Brachypodium distachyonの全ゲノムにおいて,ゲノムの領域のあいだでDNAメチル化のレベル,つまり,メチル化されたシトシンの割合には大きなばらつきがある4)(図2a).DNAメチル化のレベルは,染色体におけるトランスポゾンの密度と正の相関,遺伝子の密度と負の相関を示す.トランスポゾンの内部については,CGメチル化およびCHGメチル化のレベルが際立って高い(図2b).CGメチル化およびCHGメチル化と,CHGメチル化と強い相関を示すヒストンH3の9番目のLysのメチル化がトランスポゾン領域におけるヘテロクロマチンの形成に重要であると考えられており,多くの植物においてこのパターンがみられる5).また,プロモーター領域においてはDNAメチル化のレベルが非常に低い(図2c).これは,遺伝子の発現を抑制しないためと考えられる.遺伝子コード領域については遺伝子間領域より高いレベルのCGメチル化がみられるが,CHGメチル化およびCHHメチル化のレベルは低い(図2c).
このように,エピゲノムの構成はゲノムの構成と密接に関連する.多くの植物種においても同様のパターンがみられる5-7).ここから,ゲノムに大きな変化が起こった場合,エピゲノムにも影響があると予想される.逆に,エピゲノムのパターンがゲノムの構成に影響をおよぼすこともある.メチル化されたシトシンは突然変異率が非常に高くなり,チミンに変化しやすくなる.実際,CGメチル化のみがみられる植物の遺伝子においては,CG配列の数が遺伝子のGC含量から期待されるより有意に少ない8).つまり,ゲノムの進化とエピゲノムの進化は強く関連する.
4.植物における遺伝子内メチル化をもつ遺伝子の特徴
遺伝子コード領域におけるCGメチル化は遺伝子内メチル化(gene body methylation)とよばれる.一般に,ゲノムの進化を研究する際にはさまざまな種のあいだでゲノムを比較する.しかし,古くに分化した種のあいだのゲノムの比較は,遺伝子コード領域のほかでは困難である.このため,エピゲノム進化の例として遺伝子内メチル化に着目する.
遺伝子内メチル化以外のDNAメチル化は遺伝子やトランスポゾンの発現の抑制にはたらくと考えられている.しかし,遺伝子内メチル化の機能はいまだ不明である.遺伝子内メチル化のレベルは遺伝子のあいだで大きなばらつきがある5).CG配列における遺伝子内メチル化は発現量の高い遺伝子にみられる傾向にあるため,少なくとも発現の抑制にはかかわらないと思われる8,9).
これまでに,遺伝子内メチル化の機能に関してさまざまな仮説が提唱されてきた10-12).たとえば,1)遺伝子の内部におけるヒストンH2A.Zの蓄積を抑制する,2)遺伝子の内部に存在するプロモーターからの発現を抑制する,3)イントロンのスプライシングにかかわる,4)転写の効率を上げる,5)転写量のノイズを減少させる,などが提唱されている.しかし,いまのところ,どの仮説も決め手に欠ける.
実際のところ,シロイヌナズナやほかの植物において,遺伝子内メチル化はランダムに存在するわけではない8,13).さきにも述べたように,遺伝子内メチル化は発現量の高い遺伝子にみられる.仮説1)のヒストンH2A.Zは組織あるいは環境に特異的に発現する遺伝子によくみられる.実際に,発現する組織の多い遺伝子ほど遺伝子内メチル化がみられる傾向にある.もうひとつ重要な点として,遺伝子の長さがあげられる.長い遺伝子ほど遺伝子内メチル化をもつ可能性が高い傾向にある.長い遺伝子においては,仮説2)の不要なプロモーターをもつ確率が上がる.これをふせぐため,長い遺伝子には遺伝子内メチル化が存在するのかもしれない.さらに,遺伝子が長いほどエキソンの数が多いと期待され,そのような遺伝子においては,仮説3)のスプライシングの機能が重要になりうる.実際,モデル植物であるシロイヌナズナをはじめ,植物において遺伝子の長さとエキソンの数は高い正の相関を示す.つまり,遺伝子内メチル化はこれまで提唱されてきたような機能の仮説が正しい際に期待される遺伝子においてみられる傾向にあるようにみえる.
5.遺伝子内メチル化の進化的な保存性
さきのどれかの仮説あるいは複数の仮説が正しい場合,遺伝子内メチル化は重要な機能をもつことになる.これがDNAメチル化ではなくDNA配列の場合には議論は簡単になる.DNA配列のある領域が非常に重要である場合,さまざまな種のあいだでこのDNA配列を比較したとき,ほかの領域より保存されていることが期待される.これは,DNA配列が変化しないのではない.DNA配列は一定の速度で変化する.しかし,この変化が個体の適応度を低下させると,この個体は後代を残しにくくなる.つまり,この変化は負の自然選択により次世代に伝わらず消失する(図1c).この結果,DNA配列を種のあいだで比較したとき,重要なDNA配列において変化は起こっていないようにみえる.
筆者らは,この理論がDNAメチル化,とくに,遺伝子内メチル化に応用できるかどうかを調べるため,イネとその近縁種であるB. distachyonの全ゲノムにおけるDNAメチル化のパターンを比較した.種のあいだで祖先を共通とする遺伝子のペアをオーソログとよぶが,イネとB. distachyonのオーソログのあいだではCGメチル化のレベルが似ており有意な正の相関を示した4)(図3).つまり,イネにおいてある遺伝子が遺伝子内メチル化をもつ場合,B. distachyonのオーソログにおいても同じレベルのDNAメチル化がみられた.このような傾向はさまざまな植物種において調べられ,アブラナ科のシロイヌナズナとArabidopsis lyrata,さらに,その近縁種のCapsella rubelleにおいてもみられた14).被子植物,裸子植物,シダ植物をみた場合にも同様の傾向がみられ,最長で4億年のスパンで遺伝子内メチル化は保存されていることが示された5).これらのことから,遺伝子内メチル化は重要である可能性が示唆された.
6.被子植物における遺伝子内メチル化の進化パターン
しかし,現在,もっとも確からしいとされる遺伝子内メチル化の機能の仮説は,遺伝子のヘテロクロマチン化を抑制した副産物であるというものである3).シロイヌナズナにおいては数千の遺伝子がヘテロクロマチン化の標的になる.つまり,CGメチル化,CHGメチル化,ヒストンH3の9番目のLysのメチル化が蓄積し,それらの遺伝子の発現が抑制される.このヘテロクロマチン化にはCHGメチル化の維持にかかわるCMT3が重要であると考えられている.しかし,シロイヌナズナに存在するIBM1はヘテロクロマチン化の標的となる遺伝子からCHGメチル化およびヒストンH3の9番目のLysのメチル化を除去し,遺伝子のヘテロクロマチン化をふせぎ正常な発現を促進する.この結果,遺伝子の内部にはCGメチル化のみが残存する.つまり,シロイヌナズナにおいて遺伝子内メチル化はとくに機能をもたない可能性が高い.
これを支持する結果として,遺伝子内メチル化をもたないシロイヌナズナの近縁種が発見された15).アブラナ科植物であるEutrema salsugineumおよびConringia planisiliquaにおいて,ゲノムからCMT3遺伝子が消失していた.これにともない,おそらく遺伝子がヘテロクロマチン化されなくなり,その副産物である遺伝子の内部のCGメチル化も存在しなくなったと予想される.
この結果は,遺伝子内メチル化が進化的に高度に保存されており重要であるという結果と矛盾するようにみえる.しかし,さきに述べたように,進化の過程においてはごくまれに生存や繁殖に不利な影響をもたらす突然変異が固定されることがある(図1c).これは,種内における突然変異の頻度の動態は偶然による効果が大きいためであり,集団の大きさが小さいほどこの偶然の効果がはたらきやすくなる.つまり,負の自然選択により突然変異の頻度は低下する方向にむかおうとするが,偶然に頻度が上昇し集団に固定される確率はゼロではない.E. salsugineumとC. planisiliquaにおいてCMT3遺伝子および遺伝子内メチル化が消失しているという結果からいえることは,遺伝子内メチル化は生存には必ずしも必須ではない,ということである.
個体のあいだにみられるDNAメチル化のレベルの異なる領域をDMR(differentially methylated region,メチル化可変領域)という.このDMRはせいぜい数百bpと遺伝子の全長と比べ非常に短く,遺伝子の内部に多く存在する.シロイヌナズナの100個体以上の全ゲノム配列および全ゲノムにおけるDNAメチル化のパターンを解析した結果16,17),DMRはCGメチル化のレベルの高い個体において遺伝子の発現量を少し高くする方向にはたらく傾向にあった.つまり,遺伝子内メチル化の機能の有無はともかく,その変化が遺伝子発現になんらかの影響をおよぼすことは確からしい.また,DMRによる遺伝子発現の上昇がスウェーデン北部のシロイヌナズナの集団,つまり,寒い地域への適応に関与する可能性が示唆された17).この結果から,DNA配列の変化だけでなく,DNAメチル化の変化にも正の自然選択がはたらく可能性が示される.
シロイヌナズナの個体のあいだにみられる変異は,70万年から100万年のあいだに蓄積されたものである.この進化を考えるうえでは非常に短い期間に,数百bpという短い領域においてDNAメチル化のレベルの違いが蓄積された.一方で,種のあいだで遺伝子内メチル化のレベルを比較したときには保存されている傾向にあったことから,DMRのような小さな変化は結局は消失すると予想される.しかし,もっと長い進化の時間を考えたとき,小さな変化の蓄積により遺伝子内メチル化のレベルが大きく変化する可能性は否定できないだろう.
これらをまとめると,遺伝子内メチル化は植物の生存に必須ではない.しかし,遺伝子内メチル化のレベルの変化は遺伝子の発現に大なり小なり影響をおよぼしうる.DNA配列の変化と比べて,DNAメチル化の変化が遺伝子の発現におよぼす影響は小さいことがシロイヌナズナにおいて示されている18).しかし,長期にわたる進化を考えたとき,遺伝子内メチル化の変化の蓄積は遺伝子の発現および個体の適応度に影響する可能性がある.
7.陸上植物における遺伝子内メチル化の進化パターン
遺伝子内メチル化はさまざまな生物に存在し,脊椎動物,無脊椎動物,植物にみられる9).一方,先行研究において,陸上植物のコケ植物において遺伝子内メチル化はみられなかった7).筆者らは,陸上植物の歴史において遺伝子内メチル化がどのように進化してきたかを明らかにするため,公開されている5種の陸上植物の全ゲノムにおけるDNAメチル化のデータ,および,新たに得た9種の陸上植物におけるDNAメチル化のデータを解析した5).このデータは,コケ植物3種,シダ植物2種,裸子植物3種,被子植物6種を含む(図4).いくつかの種においては全ゲノム配列が解読されていなかったためESTのデータを用いた.このため,エキソンにおけるDNAメチル化のパターンに焦点をあてた.
おのおのの陸上植物のエキソンにおけるDNAメチル化の平均のレベルには大きなばらつきがあった(図4).コケ類においてはCGメチル化,CHGメチル化,CHHメチル化のすべてが非常に低い値を示した.一方,シダ植物は高いCGメチル化のレベルを示した.裸子植物も高いCGメチル化のレベルを示したが,同様に,高いCHGメチル化もみられ,シロイヌナズナの結果とは大きく異なった.被子植物においては,CGメチル化のレベルにはばらつきはあったものの,CHGメチル化およびCHHメチル化のレベルは低い傾向にあった.さらに,全ゲノム配列が解読されている種について,遺伝子周辺DNAメチル化のパターンを調べたところ.プロモーター領域においてDNAメチル化が大幅に減少する点と,遺伝子の中央部にいくほどDNAメチル化のレベルが高くなる点は共通であった(図5a).しかし,いくつか相違点もあった.CGメチル化のレベルの絶対値は種により大きく異なった.さらに,テーダマツでは遺伝子の内部において高いCHGメチル化がみられた.この傾向は裸子植物に特異的というわけではなく,トウモロコシにおいても共通していた(図5a).
どのような要因が遺伝子の内部におけるDNAメチル化のレベルを決定するのか調べた5).植物においてゲノムの大きさには非常に大きなばらつきがあり,ゲノムが大きい種においてはトランスポゾンなどの反復配列が大部分をしめる19).トランスポゾン領域は基本的にヘテロクロマチン化され,DNAメチル化のレベルも非常に高い.このため,ゲノムが大きい種ほどDNAメチル化のレベルが高く,遺伝子の内部においても副産物的にDNAメチル化のレベルが上昇していると予想した.この仮説を検証するため,14種の陸上植物の遺伝子からトランスポゾンと類似性のあるものと偽遺伝子らしきものを取り除き,遺伝子内メチル化のレベルとゲノムの大きさとの関係を解析した.その結果,CGメチル化およびCHGメチル化において有意な正の相関が検出され,仮説は支持された(図5b).とくに,CHGメチル化とゲノムの大きさとの相関がもっとも高く,ゲノムが増加した副産物としてCHGメチル化も上昇したと考えられた.この結果は,植物においてゲノムが進化すると,エピゲノムもそれに付随して進化することを示した一例といえる.
おわりに
エピゲノムの進化の研究ははじまったばかりである.現在,植物においてはシロイヌナズナの研究がもっとも進んでおり,ほかの種のデータも蓄積しつつある.しかし,エピゲノムの進化の一般則を知るには,より多くのゲノムおよびエピゲノムのデータが必要になる.ゲノムの進化の基礎は集団遺伝学にあることはこのレビューの冒頭において述べた.同様に,さまざまな種のエピゲノムの多型データの解析はエピゲノムの進化の法則の解明および進化の理論の構築に重要であり,今後の発展に期待したい.
文 献
- Crow, J. F. & Kimura, M.: An Introduction to Population Genetics Theory. Harper & Row, New York (1970)
- Matzke, M. A. & Mosher, R. A.: RNA-directed DNA methylation: an epigenetic pathway of increasing complexity. Nat. Rev. Genet., 15, 394-408 (2014)[PubMed]
- Saze, H. & Kakutani, T.: Differentiation of epigenetic modifications between transposons and genes. Curr. Opin. Plant Biol., 14, 81-87 (2011)[PubMed]
- Takuno, S. & Gaut, B. S.: Gene body methylation is conserved between plant orthologs and is of evolutionary consequence. Proc. Natl. Acad. Sci. USA, 110, 1797-1802 (2013)[PubMed]
- Takuno, S., Ran, J. H. & Gaut, B. S.: Evolutionary patterns of genic DNA methylation vary across land plants. Nat. Plants, 2, 15222 (2016)[PubMed]
- Feng, S., Cokus, S. J., Zhang, X. et al.: Conservation and divergence of methylation patterning in plants and animals. Proc. Natl. Acad. Sci. USA, 107, 8689-8694 (2010)[PubMed]
- Zemach, A., McDaniel, I. E., Silva, P. et al.: Genome-wide evolutionary analysis of eukaryotic DNA methylation. Science, 328, 916-919 (2010)[PubMed]
- Takuno, S. & Gaut, B. S.: Body-methylated genes in Arabidopsis thaliana are functionally important and evolve slowly. Mol. Biol. Evol., 29, 219-227 (2012)[PubMed]
- Zemach, A. & Zilberman, D.: Evolution of eukaryotic DNA methylation and the pursuit of safer sex. Curr. Biol., 20, R780-R785 (2010)[PubMed]
- Jones, P. A.: Functions of DNA methylation: islands, start sites, gene bodies and beyond. Nat. Rev. Genet., 13, 484-492 (2012)[PubMed]
- Kim, M. Y. & Zilberman, D.: DNA methylation as a system of plant genomic immunity. Trends Plant Sci., 19, 320-326 (2014)[PubMed]
- To, T. K., Saze, H. & Kakutani, T.: DNA methylation within transcribed regions. Plant Physiol., 168, 1219-1225 (2015)[PubMed]
- Niederhuth, C. E., Bewick, A. J., Ji, L. et al.: Widespread natural variation of DNA methylation within angiosperms. Genome Biol., 17, 194 (2016)[PubMed]
- Seymour, D. K., Koenig, D., Hagmann, J. et al.: Evolution of DNA methylation patterns in the Brassicaceae is driven by differences in genome organization. PLoS Genet., 10, e1004785 (2014)[PubMed]
- Bewick, A. J., Ji, L., Niederhuth, C. E. et al.: On the origin and evolutionary consequences of gene body DNA methylation. Proc. Natl. Acad. Sci. USA, 113, 9111-9116 (2016)[PubMed]
- Schmitz, R. J., Schultz, M. D., Urich, M. A. et al.: Patterns of population epigenomic diversity. Nature, 495, 193-198 (2013)[PubMed]
- Dubin, M. J., Zhang, P., Meng, D. et al.: DNA methylation in Arabidopsis has a genetic basis and shows evidence of local adaptation. Elife, 4, e05255 (2015)[PubMed]
- Meng, D., Dubin, M., Zhang, P. et al.: Limited contribution of DNA methylation variation to expression regulation in Arabidopsis thaliana. PLoS Genet., 12, e1006141 (2016)[PubMed]
- Tenaillon, M. I., Hollister, J. D. & Gaut, B. S.: A triptych of the evolution of plant transposable elements. Trends Plant Sci., 15, 471-478 (2010)[PubMed]
参考図書
木村資生: 生物進化を考える. 岩波書店 (1988)
太田朋子: 分子進化のほぼ中立説: 偶然と淘汰の進化モデル. 講談社 (2009)
田嶋正二 (編): エピジェネティクス: その分子機構から高次生命機能まで. 化学同人 (2013)
著者プロフィール
略歴:2008年 東北大学大学院農学研究科博士課程 修了,同年 総合研究大学院大学先導科学研究科 博士研究員,2010年 米国California大学Irvine校 博士研究員,2012年 米国California大学Davis校 博士研究員を経て,2013年より総合研究大学院大学先導科学研究科 助教.
研究テーマ:生物進化学を専門とする.とくに,遺伝学をベースにしたゲノム進化学,集団遺伝学の手法を用い,あらゆる生物を対象として研究を進めてきた.さらに,エピジェネティクスを進化の理論に取り込み,新たな進化モデルの構築をめざしている.
研究室URL:https://sites.google.com/site/shoheitakunoj/home
© 2016 宅野 将平 Licensed under CC 表示 2.1 日本