アクチンを介した神経情報伝達の新たな制御機構
2016/11/15
佐藤 真1・八木秀司2
(1大阪大学大学院連合小児発達学研究科 分子生物遺伝学研究領域,2兵庫医科大学 解剖学講座細胞生物学部門)
email:佐藤 真
領域融合レビュー, 5, e011 (2016) DOI: 10.7875/leading.author.5.e011
Makoto Sato & Hideshi Yagi: Filip acts as a novel meta-regulator for actin binding proteins, Filamin A and myosin II, and controls neurotransmission.

細胞の形態や運動を担う細胞骨格の主要な構成タンパク質であるアクチンは,100種を大きくこえるアクチン結合タンパク質により制御をうけ,細胞を単位とする生命活動の基盤を担う.統合失調症との関連が報告されているタンパク質Filipは,脳の形成期においてアクチン結合タンパク質であるFilamin Aと結合しニューロンの移動や形態の制御にあずかる.一方,成体においては,Filipは同じくアクチン結合タンパク質であるミオシンIIと強く結合し,とくに興奮性シナプスを構成するスパインの形態にかかわり,神経情報伝達を制御する.脳においてアクチン結合タンパク質をメタ制御するシステムの存在が推定されるが,Filipはそのひとつとしてはたらいている可能性が考えられる.
ヒトの脳は進化の極みだという.しかしながら,この見方は生物学的には正確でない.ヒトの脳にも下等な生物と進化的に類似する部分があるし,実際に,本能と知性は異なる神経回路にもとづきはたらく.脳は進化のたびに古い部分に新たな機能を担う部分がくわわって発達し今日にいたったのである.では,新たな機能を担う部分とはどこか? その代表的な部位のひとつが大脳皮質であろう.大脳皮質は大脳の表面の厚さがわずか数mmのニューロンが密に集積したところであり,ニューロンの大きさや密度の異なる6層の構造からなる.大脳をリンゴにたとえると,赤い皮の部分に相当するのが大脳皮質である.現在でも,大脳皮質を構成するニューロンの種類は完全には確定されておらず,その機能の解明は道なかばである.一方,大脳皮質の形成の過程は特徴的であり,そのおおよその枠組みもわかってきた.すなわち,大脳皮質の大部分をしめる興奮性のニューロンの多くは大脳皮質の外,深部の脳室の周囲において産生され,大脳皮質へと法線の方向に移動して層を構築する.
最近のゲノム研究の進歩により,統合失調症や自閉スペクトラム症などの精神疾患をもたらす原因遺伝子および発症関連遺伝子が多く報告されているが,それらの病像は類似する.これは,多くのタンパク質のかかわるなんらかの共通の事象があり,かかわる遺伝子のいずれかがはたらかないと同様の障害が生じると考えるとうまく説明される.最近になり,統合失調症にかかわる遺伝子の多くが神経の形成に関連するとの報告がなされている1,2).では,多くのタンパク質がかかわり同じような障害が起こることがありうるのか? ありうるとすれば,それは神経の形成におけるどのような出来事なのか? 筆者らは,その出来事のひとつをニューロンの移動にもとめ研究を進めてきた.
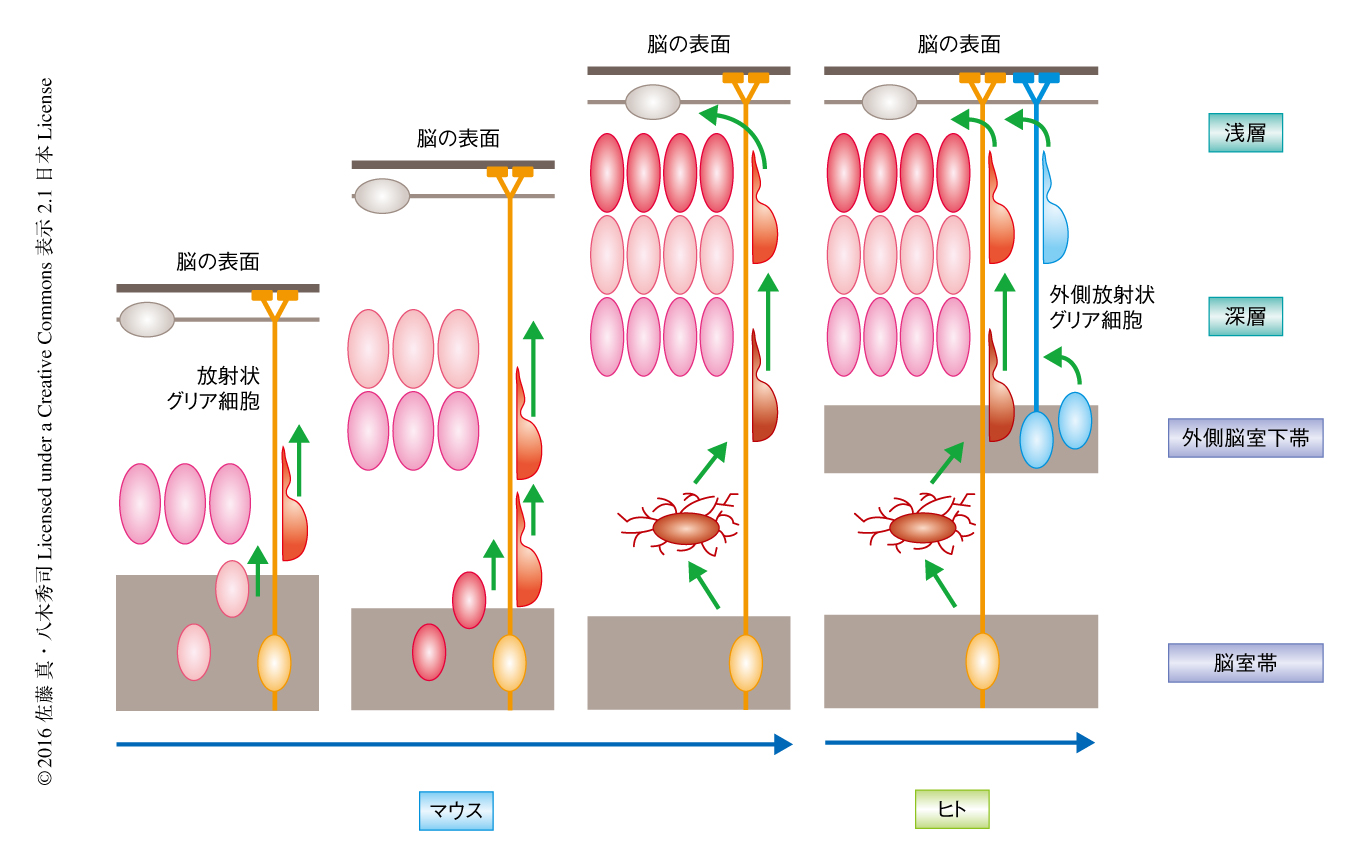
大脳皮質の約7~8割をしめるグルタミン酸を神経伝達物質とする興奮性のニューロンは,胎生期に大脳皮質の下最深部の脳室帯において産生され,そこから法線の方向,すなわち,表層にむかい,そこで大脳皮質を構築する.このニューロンの移動を放射状移動(radial migration)とよぶ.放射状移動においては,細胞体が脳室帯にあり神経突起を脳の表面へと伸ばす放射状グリア細胞が重要な役割を担う.脳室帯をはなれたニューロンはしばらく移動したのち,放射状グリア細胞からの突起に乗るかたちで,いわば,その神経突起をレールとして使い法線の方向に移動する.ちなみに,ヒトにおいては大脳皮質の第2層および第3層(浅層)のニューロンの多いことが進化における大きな特徴である.げっ歯類においては大脳の最深部のみに放射状グリア細胞が存在するが,ヒトにおいてはニューロンの移動の途中にあたる外側脳室下帯にも外側放射状グリア細胞とよばれる放射状グリア細胞が存在し,とくに大脳皮質の形成の後期において,外側脳室下帯において産生されたニューロンが外側放射状グリア細胞からの突起をレールとした移動をへて大脳皮質の浅層のニューロンになる3)(図1).
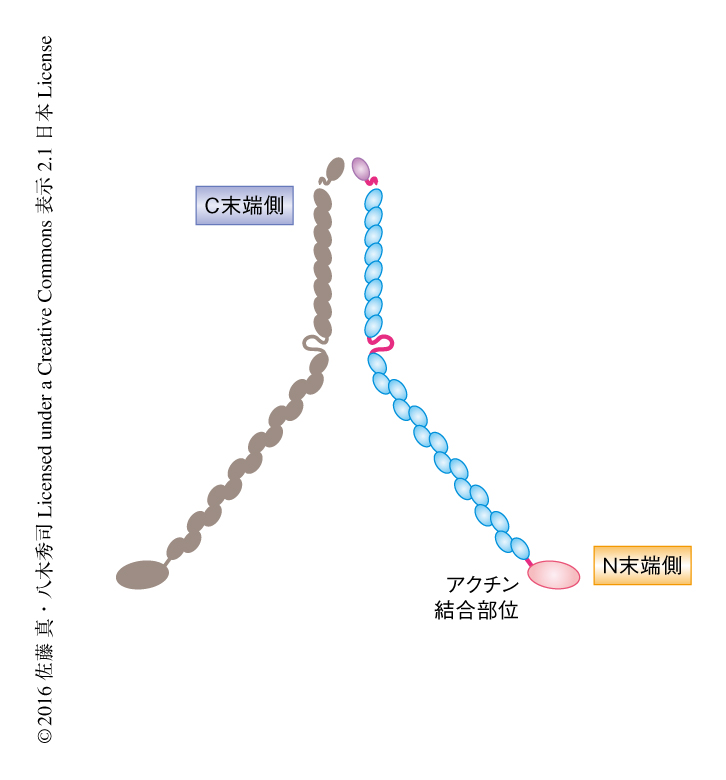
放射状移動の障害による疾患として脳室周囲結節性異所性灰白質があり,通例は女性に発症することが知られる.これはいわゆる二重皮質疾患のひとつであり,通常の大脳皮質にくわえニューロンのかたまりが大脳の深部の脳室の周囲に認められることが特徴である.このニューロンのかたまりは,本来は脳室の周囲から脳の表面にむけ移動すべきニューロンが移動できずに集積したものと考えられる.そして,この疾患においてはFilamin Aの変異が報告されている4).Filamin AはX染色体にコードされるアクチン結合タンパク質である(図2).女性においては,2本のX染色体のうち細胞ごとにいずれかが不活性化され一方がはたらく.2本のX染色体のうち,変異をもつFilamin AをコードするX染色体のはたらく約半数のニューロンが脳室の周囲の脳室帯から移動しなかったとすると,この病理像がうまく説明される.そして,この疾患はFilamin Aがニューロンの移動に欠かすことのできないタンパク質である証左と考えられる.
Filamin Aはタンパク質分解酵素のひとつであるカルパインにより分解されるが,この分解はFilamin Aの機能の制御において重要である.筆者らは,Filamin Aと結合しカルパインによるFilamin Aの分解を促進するタンパク質,すなわち,ニューロンにおいてFilamin Aの量を制御しニューロンの移動および移動の途中の形態を制御するタンパク質として,ラットにおいてFilipを同定した5,6).また,マウスにおいてFilipをノックアウトすると,大脳皮質の第2層および第3層の特定のニューロンの配置に異常が認められた7).なお,ヒトにおけるオーソログがFilip1として報告されている.
ラットにおいてFilamin Aをノックアウトするとニューロンの移動に障害が認められるが8),マウスにおいてはニューロンの移動に関してヒトと同様な異常は認められないと報告されている9).Filamin Aの変異による表現型は多岐にわたり,支持組織,泌尿生殖器系の組織,顔貌の異常などが知られるが10),ニューロンの移動を除けば,Filamin Aノックアウトマウスの表現型とヒトの患者の表現型は類似するという.では,なぜ中枢神経系において,ヒトおよびラットとマウスとのあいだで表現型が異なるのだろうか.その理由として,Filamin Aに対し補足的に機能するファミリータンパク質であるFilamin BおよびFilamin Cの種のあいだにおける発現の様式の違いや,ヒトにおいて認められる外側脳室下帯において産生されるニューロンがラットとマウスでは異なる可能性,さらには,このニューロンにおけるFilamin Aのはたらきの重要性の違いなどが想定される.ただし,それらはいずれも確定したものではない.なお筆者らは,Filipノックアウトマウスにおいてみのがされがちな特定のニューロンの集団の大脳皮質における配置の変異を観察しており7),いっけんすると判別しにくい同様の変化がFilamin Aノックアウトマウスの脳においても生じている可能性は否定できないと考えている.
脳の形成期とは異なり,成熟にともないFilamin Aの脳における発現量は大きく減少する11).成体の脳においては,血管内皮細胞を除きFilamin Aの発現量は胎生期に比べわずかとされる.成体のニューロンにおいてFilamin Aの発現が認められたとの報告はあるものの,神経伝達の場であるスパイン(棘突起)における発現は明確には認められない12).一方で,Filipは成体においても発現が認められる.そこで筆者らは,Filipは成体においてFilamin A以外のタンパク質を介し機能すると想定し,Filipと結合するタンパク質を探索した.その結果,同じアクチン結合タンパク質であるミオシンIIbが同定された11).
ここで,アクチン線維およびその結合タンパク質について簡単にまとめておく.アクチン線維は細胞の形態や細胞における分子動態の制御の主要な担い手であり,微小管および中間径フィラメントとともに細胞骨格を構成する.神経系においては,神経伝達の場であるシナプス,とくに,後シナプス側であるスパインの形態や受容体の動態にかかわり,脳の形成の際にはニューロンの移動やそののちの神経回路の形成において欠かすことのできない役割を担う13).細胞においては,アクチン線維はさまざまな形状をとりはたらく.たとえば,線維が平行に何本も集まった束化アクチン線維は,上皮細胞においては微絨毛の骨格を構成し,移動する細胞においてはその前面にみられる糸状仮足を裏打ちする.一方,線維どうしが網目状になった場合には,アクチン線維は細胞の移動に重要な葉状仮足の裏打ち構造としてその役割をはたす.これらの形状の変化は,アクチン線維に結合する,いわゆるアクチン結合タンパク質によりもたらされる.160種以上のアクチン結合タンパク質が知られており,アクチンの重合および脱重合にかかわるタンパク質,アクチン線維の分枝にかかわるタンパク質,アクチン線維の束化にかかわるタンパク質,アクチン線維の架橋にかかわるタンパク質,アクチン線維と膜タンパク質との結合にかかわるタンパク質,アクチン線維の安定化にかかわるタンパク質,アクチン線維と微小管との結合にかかわるタンパク質など,多岐にわたる14).
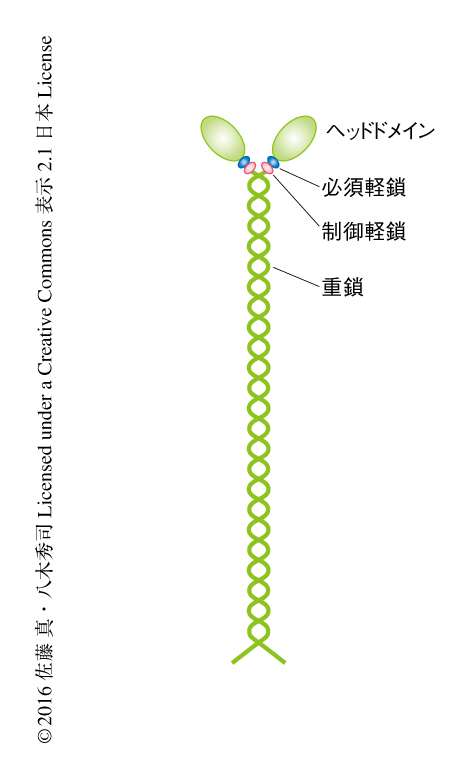
もっともよく知られたアクチン結合タンパク質はミオシンであろう.ミオシンは骨格筋細胞においてアクチン線維と協同し筋収縮をひき起こす.一般に,ミオシンのN末端側にはアクチンと結合しATPの加水分解活性をもつヘッドドメインがある15).ATPの加水分解によりエネルギーを得て,ミオシンはアクチン線維のうえを移動する.ミオシンには13種をこえる分子種が存在するが16),機能の解析の進んでいる横紋筋の筋原線維を構成するミオシンはミオシンIIに属する.ミオシンIIは重鎖,制御軽鎖,必須軽鎖がそれぞれ2本ずつ,合計6つのサブユニットが重合した六量体としてはたらく(図3).さらに,この六量体は相互に重合してミオシン線維を形成する.非筋肉細胞にもミオシンIIが認められ,筋肉型のミオシンIIからなるミオシン線維と同様に非筋肉型のミオシンからなるミオシン線維にもその両端にヘッドドメインが存在する.そして,両端それぞれでアクチン線維と結合し,ATP加水分解により両端に結合したアクチン線維どうしを近づけることができる.この作用により,非筋肉型のミオシンIIは細胞のさまざまな活動に応じて細胞の形態を制御する17).
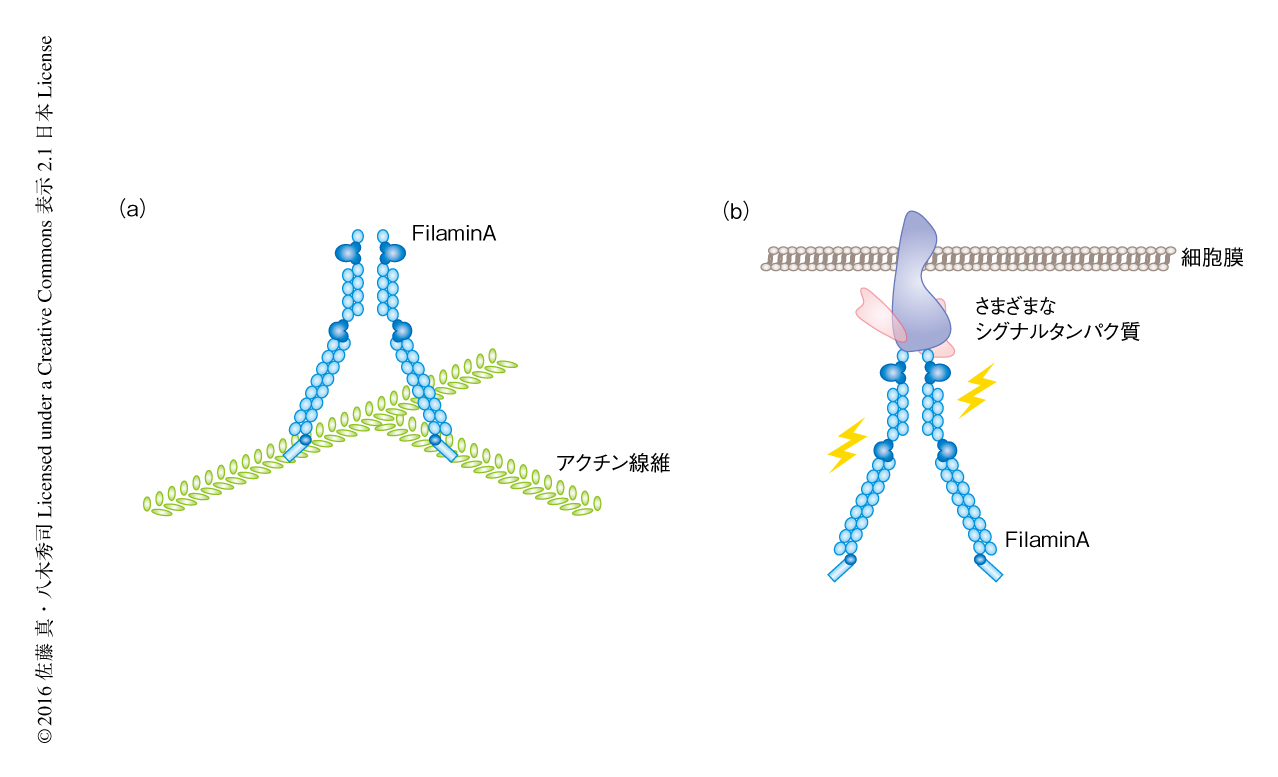
ミオシンとならび長く研究されているアクチン結合タンパク質であるFilamin Aはアクチン線維どうしの架橋にかかわる(図4a).Filamin AはそのN末端側でアクチン線維と結合し,二量体を形成することによりアクチン線維を架橋する18).この架橋により,アクチン線維は網目状の構造をとりゲル状になる.このゲル状の構造は細胞が移動する際に形成される葉状仮足の内部においてしばしば認められ,細胞の移動において重要な機能をはたす.また,Filamin Aにはさまざまな細胞内シグナル伝達にかかわるタンパク質が結合することが知られており,足場タンパク質としてもはたらく10)(図4b).
小脳において非筋肉型のミオシンIIは顆粒細胞の移動にかかわるという19).ただし,大脳皮質におけるニューロンの移動における意義については明確ではない.大脳皮質にしわが乏しくなる滑脳症の多くは放射状移動の障害のためとされ,半数以上の例がLis1遺伝子の変異による.Lis1は中心体の位置および核の位置の制御をつうじてニューロンの移動に異常をひき起こすが20),最近の研究において,Lis1はアクチンおよびミオシンの制御にも関与することが明らかにされている21).Lis1遺伝子の変異のヘテロ接合体マウスにおいては小脳におけるニューロンの移動に異常が認められ,そのニューロンにおいてアクチンおよびミオシンの制御にかかわる低分子GTPase,とくにRhoAが減少している21).一般に,RhoAは非筋肉型のミオシンIIを活性化し,細胞に形態の変化をひき起こし細胞の移動に関与する22).ただし,ミオシンIIbのノックアウトマウスにおいては小脳の低形成および特定の神経核の位置の異常のほかには脳において大きな異常は認められない23).このことから,非筋肉型のミオシンIIを介するニューロンの移動の機構はすべてのニューロンに共通するものではない可能性が示される.
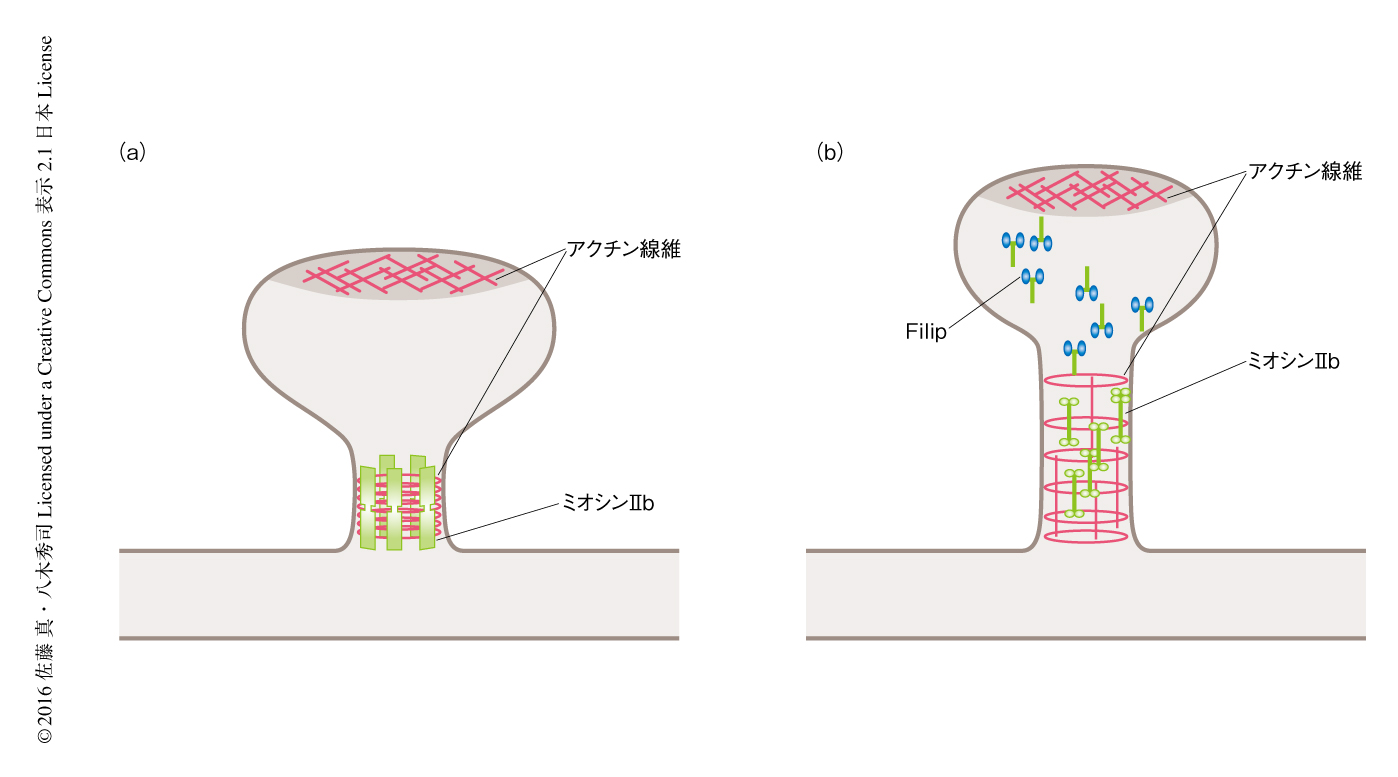
成体においてミオシンIIbは神経伝達において重要な役割をはたす.細胞における記憶の基盤のひとつとされる長期増強においては,後シナプス部位であるスパインのシナプス側の面にある受容体の数の変化にくわえ,スパインそのものの形態の変化がその基盤とされるが,この形態の変化はミオシンIIbによるところが大きい24-26).成熟したスパインはその上部の体積が大きくマッシュルーム様の形態を示し,ミオシンIIbはその基部に多く局在する27).ミオシンIIbのはたらきを抑制するとスパインの形態は細長く糸状突起様になる.ミオシンIIbの活性度の変化により,おそらくはアクチン線維もかかわり,形態が変化すると考えられる.
FilipはミオシンIIbに対し量および機能の2つの面で抑制的にはたらく11).Filipをもたない培養細胞にFilipを発現させるとミオシンIIbの量が減少した.さらに,同じくFilipをもたない海馬のニューロンにFilipを発現させると,スパインの基部においてミオシンIIbが減少し,また,ミオシンIIbの局在が明瞭に認められるスパインの数が減少した.FilipはFilamin Aに対してはCa2+依存性プロテアーゼを活性化させその分解を促進させたが5),ミオシンIIbに対しても類似した機構により作用する可能性が考えられる(図5).
一方,ミオシンIIbの重鎖におけるFilipとの結合部位について検討したところ,N末端側のアクチン結合部位およびATPase活性ドメインの近傍にあった11).Filipとの結合によるミオシンIIbのATPase活性の直接の変化は測定されていないが,その結合部位からATPase活性に対するなんらかの作用が想定されること,そして,元来はFilipを発現しない海馬のニューロンにFilipを発現させた際のスパインの形態の変化と,ATPase活性の阻害によりミオシンIIの阻害剤としてはたらくブレビスタチンを投与した際のスパインの形態の変化がよく類似したことより11),FilipがミオシンIIbに対しATPase活性を阻害し作用する可能性は高いと考えられる.なお,ミオシンにおいてATPase活性を阻害するとアクチンとの結合が障害される.同時に,FilipはミオシンIIbのアクチン結合部位の近傍と結合するため,立体障害によりアクチンとミオシンIIbの結合が阻害される可能性も考えられる.
脳においてFilipの発現は限局的である.前脳においては大脳皮質,なかでも梨状葉皮質,さらには扁桃体などの辺縁系の関連部位および腹側線条体に明瞭な発現が認められる.ただし,海馬に発現は認められない11).この事実から,スパインを構成するタンパク質の組成は均一ではないこと,そのため,スパインの性質は脳の部位ごとに異なることが示唆される.
Filipはスパインの形態のみならずスパインへのNMDA受容体の局在にかかわる11).Filipを発現させた海馬のニューロンにおいては,スパインにおけるNMDA受容体の局在が減少する.この現象を担う機構の詳細は明らかにされていないが,樹状突起とスパインをつなぐスパインの基部が一定の役割を担う可能性が想定される.そして,Filipのノックアウトマウスにおいて脳における神経伝達を観察したところ大きく変化していた11).
一方,Filipは統合失調症の患者の前頭葉においてその発現の動態が大きく変化しており,統合失調症との関連が強く示唆されている1).そして,Filipのみならず,ニューロンの移動にかかわる一連のタンパク質が統合失調症に関与するとも報告されている1).これは,統合失調症の発症もしくは罹患への脆弱性の真の原因が脳の形成あるいは発達の段階にあるとの考え2) を裏づけるとも考えられるが,同時に,Filipに代表されるように細胞骨格の制御にかかわるタンパク質は,たんにニューロンの移動にかかわるのみならず,スパインにおける細胞骨格の制御およびそこでの神経伝達と密接に関係する.それゆえ,脳の形成とスパインにおける神経伝達を完全に独立した事象として扱うことには無理があり,一方のみに成因をもとめることはやや簡易化がすぎるといえよう.
話はやや飛躍するが,筋肉の走行がかたちの変化と密接に関係する組織のひとつに瞳孔がある.瞳孔散大筋は瞳孔のまわりを直行して(法線の方向に)走り,瞳孔括約筋は瞳孔のまわりをなぞるように(接線の方向に)走る.この異なる走行ゆえに,同じ筋肉の収縮であっても光量などに応じ瞳孔を拡げたり閉じたりすることが可能になる.筆者らは,同様のしくみをスパインの基部についても想定できるのでないかと考えている.実際に,アクチン線維およびミオシン線維のスパインの基部における走行を検討すると,大きく分けて2種類の様式があるようである.すなわち,基部からシナプス側の面に,いわば縦方向に伸びる線維と,基部を輪状に走る線維である.これらの機能的な意義は異なることが想定されるが,じつは明確にはなっていない.今後,線維の走行ごとにいかに制御がされているか,とくに,Filipと2種類の様式の線維との連関については興味深い.
Filipは生体の発達段階に応じ,いわば結合パートナーを代えてはたらく.すなわち,Filamin Aを介しニューロンの移動や形態の制御に,ミオシンIIbを介しスパインの形態および神経伝達の制御にかかわる.従来,アクチン結合タンパク質をその上位で統合するしくみについては明確には概念化されていなかったが,今後,Filipをはじめとするタンパク質を手がかりとして,細胞骨格の制御のカスケードが明確に理解されるようになることを期待している.同時に,結合パートナーの選択には,単にパートナーの発現量の多寡のみならず精緻な制御機構の存在する可能性は高いと想定され,今後の解明を期待している.
略歴:1991年 大阪大学大学院医学研究科博士課程 修了,同年 大阪大学医学部 助手,1994年 大阪市立大学医学部 助教授,1998年 福井医科大学 教授を経て,2013年より大阪大学大学院連合小児発達学研究科 教授.
研究テーマ:大脳皮質の形成における分子機構および細胞機構,神経の発達における分子機構および細胞機構.
抱負:ニューロコンピューターの世界から,実際の脳を研究の対象とする医学の領域へとシフトしました.想像をはるかにこえるしくみではたらく脳の謎を,この手で少しでも解き明かすべく研究に勤しんでいます.あわせて,得られた知見をベッドサイドへと応用できる日のくることを願っています.
研究室URL:http://www.anat2.med.osaka-u.ac.jp/
八木 秀司(Hideshi Yagi)
略歴:1998年 大阪大学大学院医学研究科博士課程 修了,同年 福井医科大学 助手,2009年 同 准教授,2011年 兵庫医科大学 准教授を経て,2015年より 同 教授.
研究テーマ:神経系において細胞の形態を制御する機構.
抱負:神経系における細胞の形態と機能の関係について,今後,解明していきたい.
研究室URL:http://www.hyo-med.ac.jp/faculty/course/anatomy1.html
© 2016 佐藤 真・八木秀司 Licensed under CC 表示 2.1 日本
(1大阪大学大学院連合小児発達学研究科 分子生物遺伝学研究領域,2兵庫医科大学 解剖学講座細胞生物学部門)
email:佐藤 真
領域融合レビュー, 5, e011 (2016) DOI: 10.7875/leading.author.5.e011
Makoto Sato & Hideshi Yagi: Filip acts as a novel meta-regulator for actin binding proteins, Filamin A and myosin II, and controls neurotransmission.
要 約
細胞の形態や運動を担う細胞骨格の主要な構成タンパク質であるアクチンは,100種を大きくこえるアクチン結合タンパク質により制御をうけ,細胞を単位とする生命活動の基盤を担う.統合失調症との関連が報告されているタンパク質Filipは,脳の形成期においてアクチン結合タンパク質であるFilamin Aと結合しニューロンの移動や形態の制御にあずかる.一方,成体においては,Filipは同じくアクチン結合タンパク質であるミオシンIIと強く結合し,とくに興奮性シナプスを構成するスパインの形態にかかわり,神経情報伝達を制御する.脳においてアクチン結合タンパク質をメタ制御するシステムの存在が推定されるが,Filipはそのひとつとしてはたらいている可能性が考えられる.
はじめに
ヒトの脳は進化の極みだという.しかしながら,この見方は生物学的には正確でない.ヒトの脳にも下等な生物と進化的に類似する部分があるし,実際に,本能と知性は異なる神経回路にもとづきはたらく.脳は進化のたびに古い部分に新たな機能を担う部分がくわわって発達し今日にいたったのである.では,新たな機能を担う部分とはどこか? その代表的な部位のひとつが大脳皮質であろう.大脳皮質は大脳の表面の厚さがわずか数mmのニューロンが密に集積したところであり,ニューロンの大きさや密度の異なる6層の構造からなる.大脳をリンゴにたとえると,赤い皮の部分に相当するのが大脳皮質である.現在でも,大脳皮質を構成するニューロンの種類は完全には確定されておらず,その機能の解明は道なかばである.一方,大脳皮質の形成の過程は特徴的であり,そのおおよその枠組みもわかってきた.すなわち,大脳皮質の大部分をしめる興奮性のニューロンの多くは大脳皮質の外,深部の脳室の周囲において産生され,大脳皮質へと法線の方向に移動して層を構築する.
最近のゲノム研究の進歩により,統合失調症や自閉スペクトラム症などの精神疾患をもたらす原因遺伝子および発症関連遺伝子が多く報告されているが,それらの病像は類似する.これは,多くのタンパク質のかかわるなんらかの共通の事象があり,かかわる遺伝子のいずれかがはたらかないと同様の障害が生じると考えるとうまく説明される.最近になり,統合失調症にかかわる遺伝子の多くが神経の形成に関連するとの報告がなされている1,2).では,多くのタンパク質がかかわり同じような障害が起こることがありうるのか? ありうるとすれば,それは神経の形成におけるどのような出来事なのか? 筆者らは,その出来事のひとつをニューロンの移動にもとめ研究を進めてきた.
1.法線の方向へのニューロンの移動
大脳皮質の約7~8割をしめるグルタミン酸を神経伝達物質とする興奮性のニューロンは,胎生期に大脳皮質の下最深部の脳室帯において産生され,そこから法線の方向,すなわち,表層にむかい,そこで大脳皮質を構築する.このニューロンの移動を放射状移動(radial migration)とよぶ.放射状移動においては,細胞体が脳室帯にあり神経突起を脳の表面へと伸ばす放射状グリア細胞が重要な役割を担う.脳室帯をはなれたニューロンはしばらく移動したのち,放射状グリア細胞からの突起に乗るかたちで,いわば,その神経突起をレールとして使い法線の方向に移動する.ちなみに,ヒトにおいては大脳皮質の第2層および第3層(浅層)のニューロンの多いことが進化における大きな特徴である.げっ歯類においては大脳の最深部のみに放射状グリア細胞が存在するが,ヒトにおいてはニューロンの移動の途中にあたる外側脳室下帯にも外側放射状グリア細胞とよばれる放射状グリア細胞が存在し,とくに大脳皮質の形成の後期において,外側脳室下帯において産生されたニューロンが外側放射状グリア細胞からの突起をレールとした移動をへて大脳皮質の浅層のニューロンになる3)(図1).
2.放射状移動とFilamin AおよびFilip
放射状移動の障害による疾患として脳室周囲結節性異所性灰白質があり,通例は女性に発症することが知られる.これはいわゆる二重皮質疾患のひとつであり,通常の大脳皮質にくわえニューロンのかたまりが大脳の深部の脳室の周囲に認められることが特徴である.このニューロンのかたまりは,本来は脳室の周囲から脳の表面にむけ移動すべきニューロンが移動できずに集積したものと考えられる.そして,この疾患においてはFilamin Aの変異が報告されている4).Filamin AはX染色体にコードされるアクチン結合タンパク質である(図2).女性においては,2本のX染色体のうち細胞ごとにいずれかが不活性化され一方がはたらく.2本のX染色体のうち,変異をもつFilamin AをコードするX染色体のはたらく約半数のニューロンが脳室の周囲の脳室帯から移動しなかったとすると,この病理像がうまく説明される.そして,この疾患はFilamin Aがニューロンの移動に欠かすことのできないタンパク質である証左と考えられる.
Filamin Aはタンパク質分解酵素のひとつであるカルパインにより分解されるが,この分解はFilamin Aの機能の制御において重要である.筆者らは,Filamin Aと結合しカルパインによるFilamin Aの分解を促進するタンパク質,すなわち,ニューロンにおいてFilamin Aの量を制御しニューロンの移動および移動の途中の形態を制御するタンパク質として,ラットにおいてFilipを同定した5,6).また,マウスにおいてFilipをノックアウトすると,大脳皮質の第2層および第3層の特定のニューロンの配置に異常が認められた7).なお,ヒトにおけるオーソログがFilip1として報告されている.
ラットにおいてFilamin Aをノックアウトするとニューロンの移動に障害が認められるが8),マウスにおいてはニューロンの移動に関してヒトと同様な異常は認められないと報告されている9).Filamin Aの変異による表現型は多岐にわたり,支持組織,泌尿生殖器系の組織,顔貌の異常などが知られるが10),ニューロンの移動を除けば,Filamin Aノックアウトマウスの表現型とヒトの患者の表現型は類似するという.では,なぜ中枢神経系において,ヒトおよびラットとマウスとのあいだで表現型が異なるのだろうか.その理由として,Filamin Aに対し補足的に機能するファミリータンパク質であるFilamin BおよびFilamin Cの種のあいだにおける発現の様式の違いや,ヒトにおいて認められる外側脳室下帯において産生されるニューロンがラットとマウスでは異なる可能性,さらには,このニューロンにおけるFilamin Aのはたらきの重要性の違いなどが想定される.ただし,それらはいずれも確定したものではない.なお筆者らは,Filipノックアウトマウスにおいてみのがされがちな特定のニューロンの集団の大脳皮質における配置の変異を観察しており7),いっけんすると判別しにくい同様の変化がFilamin Aノックアウトマウスの脳においても生じている可能性は否定できないと考えている.
3.Filip結合タンパク質としてのミオシンIIb
脳の形成期とは異なり,成熟にともないFilamin Aの脳における発現量は大きく減少する11).成体の脳においては,血管内皮細胞を除きFilamin Aの発現量は胎生期に比べわずかとされる.成体のニューロンにおいてFilamin Aの発現が認められたとの報告はあるものの,神経伝達の場であるスパイン(棘突起)における発現は明確には認められない12).一方で,Filipは成体においても発現が認められる.そこで筆者らは,Filipは成体においてFilamin A以外のタンパク質を介し機能すると想定し,Filipと結合するタンパク質を探索した.その結果,同じアクチン結合タンパク質であるミオシンIIbが同定された11).
4.アクチン線維およびその結合タンパク質
ここで,アクチン線維およびその結合タンパク質について簡単にまとめておく.アクチン線維は細胞の形態や細胞における分子動態の制御の主要な担い手であり,微小管および中間径フィラメントとともに細胞骨格を構成する.神経系においては,神経伝達の場であるシナプス,とくに,後シナプス側であるスパインの形態や受容体の動態にかかわり,脳の形成の際にはニューロンの移動やそののちの神経回路の形成において欠かすことのできない役割を担う13).細胞においては,アクチン線維はさまざまな形状をとりはたらく.たとえば,線維が平行に何本も集まった束化アクチン線維は,上皮細胞においては微絨毛の骨格を構成し,移動する細胞においてはその前面にみられる糸状仮足を裏打ちする.一方,線維どうしが網目状になった場合には,アクチン線維は細胞の移動に重要な葉状仮足の裏打ち構造としてその役割をはたす.これらの形状の変化は,アクチン線維に結合する,いわゆるアクチン結合タンパク質によりもたらされる.160種以上のアクチン結合タンパク質が知られており,アクチンの重合および脱重合にかかわるタンパク質,アクチン線維の分枝にかかわるタンパク質,アクチン線維の束化にかかわるタンパク質,アクチン線維の架橋にかかわるタンパク質,アクチン線維と膜タンパク質との結合にかかわるタンパク質,アクチン線維の安定化にかかわるタンパク質,アクチン線維と微小管との結合にかかわるタンパク質など,多岐にわたる14).
もっともよく知られたアクチン結合タンパク質はミオシンであろう.ミオシンは骨格筋細胞においてアクチン線維と協同し筋収縮をひき起こす.一般に,ミオシンのN末端側にはアクチンと結合しATPの加水分解活性をもつヘッドドメインがある15).ATPの加水分解によりエネルギーを得て,ミオシンはアクチン線維のうえを移動する.ミオシンには13種をこえる分子種が存在するが16),機能の解析の進んでいる横紋筋の筋原線維を構成するミオシンはミオシンIIに属する.ミオシンIIは重鎖,制御軽鎖,必須軽鎖がそれぞれ2本ずつ,合計6つのサブユニットが重合した六量体としてはたらく(図3).さらに,この六量体は相互に重合してミオシン線維を形成する.非筋肉細胞にもミオシンIIが認められ,筋肉型のミオシンIIからなるミオシン線維と同様に非筋肉型のミオシンからなるミオシン線維にもその両端にヘッドドメインが存在する.そして,両端それぞれでアクチン線維と結合し,ATP加水分解により両端に結合したアクチン線維どうしを近づけることができる.この作用により,非筋肉型のミオシンIIは細胞のさまざまな活動に応じて細胞の形態を制御する17).
ミオシンとならび長く研究されているアクチン結合タンパク質であるFilamin Aはアクチン線維どうしの架橋にかかわる(図4a).Filamin AはそのN末端側でアクチン線維と結合し,二量体を形成することによりアクチン線維を架橋する18).この架橋により,アクチン線維は網目状の構造をとりゲル状になる.このゲル状の構造は細胞が移動する際に形成される葉状仮足の内部においてしばしば認められ,細胞の移動において重要な機能をはたす.また,Filamin Aにはさまざまな細胞内シグナル伝達にかかわるタンパク質が結合することが知られており,足場タンパク質としてもはたらく10)(図4b).
5.ミオシンIIbとニューロンの移動および神経伝達
小脳において非筋肉型のミオシンIIは顆粒細胞の移動にかかわるという19).ただし,大脳皮質におけるニューロンの移動における意義については明確ではない.大脳皮質にしわが乏しくなる滑脳症の多くは放射状移動の障害のためとされ,半数以上の例がLis1遺伝子の変異による.Lis1は中心体の位置および核の位置の制御をつうじてニューロンの移動に異常をひき起こすが20),最近の研究において,Lis1はアクチンおよびミオシンの制御にも関与することが明らかにされている21).Lis1遺伝子の変異のヘテロ接合体マウスにおいては小脳におけるニューロンの移動に異常が認められ,そのニューロンにおいてアクチンおよびミオシンの制御にかかわる低分子GTPase,とくにRhoAが減少している21).一般に,RhoAは非筋肉型のミオシンIIを活性化し,細胞に形態の変化をひき起こし細胞の移動に関与する22).ただし,ミオシンIIbのノックアウトマウスにおいては小脳の低形成および特定の神経核の位置の異常のほかには脳において大きな異常は認められない23).このことから,非筋肉型のミオシンIIを介するニューロンの移動の機構はすべてのニューロンに共通するものではない可能性が示される.
成体においてミオシンIIbは神経伝達において重要な役割をはたす.細胞における記憶の基盤のひとつとされる長期増強においては,後シナプス部位であるスパインのシナプス側の面にある受容体の数の変化にくわえ,スパインそのものの形態の変化がその基盤とされるが,この形態の変化はミオシンIIbによるところが大きい24-26).成熟したスパインはその上部の体積が大きくマッシュルーム様の形態を示し,ミオシンIIbはその基部に多く局在する27).ミオシンIIbのはたらきを抑制するとスパインの形態は細長く糸状突起様になる.ミオシンIIbの活性度の変化により,おそらくはアクチン線維もかかわり,形態が変化すると考えられる.
6.スパインにおけるFilipおよびミオシンIIb
FilipはミオシンIIbに対し量および機能の2つの面で抑制的にはたらく11).Filipをもたない培養細胞にFilipを発現させるとミオシンIIbの量が減少した.さらに,同じくFilipをもたない海馬のニューロンにFilipを発現させると,スパインの基部においてミオシンIIbが減少し,また,ミオシンIIbの局在が明瞭に認められるスパインの数が減少した.FilipはFilamin Aに対してはCa2+依存性プロテアーゼを活性化させその分解を促進させたが5),ミオシンIIbに対しても類似した機構により作用する可能性が考えられる(図5).
一方,ミオシンIIbの重鎖におけるFilipとの結合部位について検討したところ,N末端側のアクチン結合部位およびATPase活性ドメインの近傍にあった11).Filipとの結合によるミオシンIIbのATPase活性の直接の変化は測定されていないが,その結合部位からATPase活性に対するなんらかの作用が想定されること,そして,元来はFilipを発現しない海馬のニューロンにFilipを発現させた際のスパインの形態の変化と,ATPase活性の阻害によりミオシンIIの阻害剤としてはたらくブレビスタチンを投与した際のスパインの形態の変化がよく類似したことより11),FilipがミオシンIIbに対しATPase活性を阻害し作用する可能性は高いと考えられる.なお,ミオシンにおいてATPase活性を阻害するとアクチンとの結合が障害される.同時に,FilipはミオシンIIbのアクチン結合部位の近傍と結合するため,立体障害によりアクチンとミオシンIIbの結合が阻害される可能性も考えられる.
脳においてFilipの発現は限局的である.前脳においては大脳皮質,なかでも梨状葉皮質,さらには扁桃体などの辺縁系の関連部位および腹側線条体に明瞭な発現が認められる.ただし,海馬に発現は認められない11).この事実から,スパインを構成するタンパク質の組成は均一ではないこと,そのため,スパインの性質は脳の部位ごとに異なることが示唆される.
7.Filipと神経伝達および疾病との関連
Filipはスパインの形態のみならずスパインへのNMDA受容体の局在にかかわる11).Filipを発現させた海馬のニューロンにおいては,スパインにおけるNMDA受容体の局在が減少する.この現象を担う機構の詳細は明らかにされていないが,樹状突起とスパインをつなぐスパインの基部が一定の役割を担う可能性が想定される.そして,Filipのノックアウトマウスにおいて脳における神経伝達を観察したところ大きく変化していた11).
一方,Filipは統合失調症の患者の前頭葉においてその発現の動態が大きく変化しており,統合失調症との関連が強く示唆されている1).そして,Filipのみならず,ニューロンの移動にかかわる一連のタンパク質が統合失調症に関与するとも報告されている1).これは,統合失調症の発症もしくは罹患への脆弱性の真の原因が脳の形成あるいは発達の段階にあるとの考え2) を裏づけるとも考えられるが,同時に,Filipに代表されるように細胞骨格の制御にかかわるタンパク質は,たんにニューロンの移動にかかわるのみならず,スパインにおける細胞骨格の制御およびそこでの神経伝達と密接に関係する.それゆえ,脳の形成とスパインにおける神経伝達を完全に独立した事象として扱うことには無理があり,一方のみに成因をもとめることはやや簡易化がすぎるといえよう.
おわりに
話はやや飛躍するが,筋肉の走行がかたちの変化と密接に関係する組織のひとつに瞳孔がある.瞳孔散大筋は瞳孔のまわりを直行して(法線の方向に)走り,瞳孔括約筋は瞳孔のまわりをなぞるように(接線の方向に)走る.この異なる走行ゆえに,同じ筋肉の収縮であっても光量などに応じ瞳孔を拡げたり閉じたりすることが可能になる.筆者らは,同様のしくみをスパインの基部についても想定できるのでないかと考えている.実際に,アクチン線維およびミオシン線維のスパインの基部における走行を検討すると,大きく分けて2種類の様式があるようである.すなわち,基部からシナプス側の面に,いわば縦方向に伸びる線維と,基部を輪状に走る線維である.これらの機能的な意義は異なることが想定されるが,じつは明確にはなっていない.今後,線維の走行ごとにいかに制御がされているか,とくに,Filipと2種類の様式の線維との連関については興味深い.
Filipは生体の発達段階に応じ,いわば結合パートナーを代えてはたらく.すなわち,Filamin Aを介しニューロンの移動や形態の制御に,ミオシンIIbを介しスパインの形態および神経伝達の制御にかかわる.従来,アクチン結合タンパク質をその上位で統合するしくみについては明確には概念化されていなかったが,今後,Filipをはじめとするタンパク質を手がかりとして,細胞骨格の制御のカスケードが明確に理解されるようになることを期待している.同時に,結合パートナーの選択には,単にパートナーの発現量の多寡のみならず精緻な制御機構の存在する可能性は高いと想定され,今後の解明を期待している.
文 献
- Gulsuner, S., Walsh, T., Watts, A. C. et al.: Spatial and temporal mapping of de novo mutations in schizophrenia to a fetal prefrontal cortical network. Cell, 154, 518-529 (2013)[PubMed]
- Walsh, T., McClellan, J. M., McCarthy, S. E. et al.: Rare structural variants disrupt multiple genes in neurodevelopmental pathways in schizophrenia. Science, 320, 539-543 (2008)[PubMed]
- Hansen, D. V., Lui, J. H., Parker, P. R. et al.: Neurogenic radial glia in the outer subventricular zone of human neocortex. Nature, 464, 554-561 (2010)[PubMed]
- Fox, J. W., Lamperti, E. D., Eksioglu, Y. Z. et al.: Mutations in filamin 1 prevent migration of cerebral cortical neurons in human periventricular heterotopia. Neuron, 21, 1315-1325 (1998)[PubMed]
- Nagano, T., Yoneda, T., Hatanaka, Y. et al.: Filamin A-interacting protein (FILIP) regulates cortical cell migration out of the ventricular zone. Nat. Cell Biol., 4, 495-501 (2002)[PubMed]
- Nagano, T., Morikubo, S. & Sato, M.: Filamin A and FILIP (filamin A-interacting protein) regulate cell polarity and motility in neocortical subventricular and intermediate zones during radial migration. J. Neurosci., 24, 9648-9657 (2004)[PubMed]
- Yagi, H., Oka, Y., Komada, M. et al.: Filamin A interacting protein plays a role in proper positioning of callosal projection neurons in the cortex. Neurosci. Lett., 612, 18-24 (2016)[PubMed]
- Carabalona, A., Beguin, S., Pallesi-Pocachard, E. et al.: A glial origin for periventricular nodular heterotopia caused by impaired expression of Filamin-A. Hum. Mol. Genet., 21, 1004-1017 (2012)[PubMed]
- Feng, Y., Chen, M. H., Moskowitz, I. P. et al.: Filamin A (FLNA) is required for cell-cell contact in vascular development and cardiac morphogenesis. Proc. Natl. Acad. Sci. USA, 103, 19836-19841 (2006)[PubMed]
- Feng, Y. & Walsh, C. A.: The many faces of filamin: a versatile molecular scaffold for cell motility and signalling. Nat. Cell Biol., 6, 1034-1038 (2004)[PubMed]
- Yagi, H., Nagano, T., Xie, M. J. et al.: Filamin A-interacting protein (FILIP) is a region-specific modulator of myosin 2b and controls spine morphology and NMDA receptor accumulation. Sci. Rep., 4, 6353 (2014)[PubMed]
- Noam, Y., Phan, L., McClelland, S. et al.: Distinct regional and subcellular localization of the actin-binding protein filamin A in the mature rat brain. J. Comp. Neurol., 520, 3013-3034 (2012)[PubMed]
- Luo, L.: Actin cytoskeleton regulation in neuronal morphogenesis and structural plasticity. Annu. Rev. Cell Dev. Biol., 18, 601-635 (2002)[PubMed]
- dos Remedios, C. G., Chhabra, D., Kekic, M. et al.: Actin binding proteins: regulation of cytoskeletal microfilaments. Physiol. Rev., 83, 433-473 (2003)[PubMed]
- Sellers, J. R.: Myosins: a diverse superfamily. Biochim. Biophys. Acta, 1496, 3-22 (2000)[PubMed]
- Foth, B. J., Goedecke, M. C. & Soldati, D.: New insights into myosin evolution and classification. Proc. Natl. Acad. Sci. USA, 103, 3681-3686 (2006)[PubMed]
- Vicente-Manzanares, M., Ma, X., Adelstein. R. S. et al.: Non-muscle myosin II takes centre stage in cell adhesion and migration. Nat. Rev. Mol. Cell Biol., 10, 778-790 (2009)[PubMed]
- van der Flier, A. & Sonnenberg, A.: Structural and functional aspects of filamins. Biochim. Biophys. Acta, 1538, 99-117 (2001)[PubMed]
- Solecki, D. J., Trivedi, N., Govek, E. E. et al.: Myosin II motors and F-actin dynamics drive the coordinated movement of the centrosome and soma during CNS glial-guided neuronal migration. Neuron, 63, 63-80 (2009)[PubMed]
- Tsai, J. W., Bremner, K. H. & Vallee, R. B.: Dual subcellular roles for LIS1 and dynein in radial neuronal migration in live brain tissue. Nat. Neurosci., 10, 970-979 (2007)[PubMed]
- Sudarov, A., Gooden, F., Tseng, D. et al.: Lis1 controls dynamics of neuronal filopodia and spines to impact synaptogenesis and social behaviour. EMBO Mol. Med., 5, 591-607 (2013)[PubMed]
- Kolega, J.: Asymmetric distribution of myosin IIB in migrating endothelial cells is regulated by a rho-dependent kinase and contributes to tail retraction. Mol. Biol. Cell, 14, 4745-4757 (2003)[PubMed]
- Ma, X., Kawamoto, S., Hara, Y. et al.: A point mutation in the motor domain of nonmuscle myosin II-B impairs migration of distinct groups of neurons. Mol. Biol. Cell, 15, 2568-2579 (2004)[PubMed]
- Ryu, J., Liu, L., Wong, T. P. et al.: A critical role for myosin IIb in dendritic spine morphology and synaptic function. Neuron, 49, 175-182 (2006)[PubMed]
- Rex, C. S., Gavin, C. F., Rubio, M. D. et al.: Myosin IIb regulates actin dynamics during synaptic plasticity and memory formation. Neuron, 67, 603-617 (2010)[PubMed]
- Hodges, J. L., Newell-Litwa, K., Asmussen, H. et al.: Myosin IIb activity and phosphorylation status determines dendritic spine and post-synaptic density morphology. PLoS One, 6, e24149 (2011)[PubMed]
- Hotulainen, P. & Hoogenraad, C. C.: Actin in dendritic spines: connecting dynamics to function. J. Cell Biol., 189, 619-629 (2010)[PubMed]
著者プロフィール
略歴:1991年 大阪大学大学院医学研究科博士課程 修了,同年 大阪大学医学部 助手,1994年 大阪市立大学医学部 助教授,1998年 福井医科大学 教授を経て,2013年より大阪大学大学院連合小児発達学研究科 教授.
研究テーマ:大脳皮質の形成における分子機構および細胞機構,神経の発達における分子機構および細胞機構.
抱負:ニューロコンピューターの世界から,実際の脳を研究の対象とする医学の領域へとシフトしました.想像をはるかにこえるしくみではたらく脳の謎を,この手で少しでも解き明かすべく研究に勤しんでいます.あわせて,得られた知見をベッドサイドへと応用できる日のくることを願っています.
研究室URL:http://www.anat2.med.osaka-u.ac.jp/
八木 秀司(Hideshi Yagi)
略歴:1998年 大阪大学大学院医学研究科博士課程 修了,同年 福井医科大学 助手,2009年 同 准教授,2011年 兵庫医科大学 准教授を経て,2015年より 同 教授.
研究テーマ:神経系において細胞の形態を制御する機構.
抱負:神経系における細胞の形態と機能の関係について,今後,解明していきたい.
研究室URL:http://www.hyo-med.ac.jp/faculty/course/anatomy1.html
© 2016 佐藤 真・八木秀司 Licensed under CC 表示 2.1 日本