植物における概日リズムの組織特異性および組織間での時間情報の伝達
2017/03/14
遠藤 求
(京都大学大学院生命科学研究科 統合生命科学専攻分子代謝制御学分野)
email:遠藤 求
領域融合レビュー, 6, e001 (2017) DOI: 10.7875/leading.author.6.e001
Motomu Endo: Tissue-specificity and inter-tissue signaling of circadian rhythms in plants.

植物を含め,ほとんどの生物は概日時計をもつ.ショウジョウバエ,マウス,ヒトなどの研究から,多細胞生物では組織ごとに概日時計の機能の異なることが明らかにされている.筆者らの研究を含む最近の研究から,植物もまた組織特異的に概日時計の機能を分担していることが分子レベルで明らかにされた.多細胞生物としておのおのの細胞が協調的にふるまうことを可能にするには,個々の細胞のもつ時間情報を共有すること,すなわち,器官間,組織間,細胞間での時間情報のやりとりが不可欠である.このレビューでは,植物の組織ごとに異なる概日時計について解説するとともに,おのおのの組織がどのように時間情報を共有するのか考察する.
多くの生物は時間を測るしくみを備えており,遺伝子の発現や行動など生命活動のあらゆる階層における周期的な応答を制御する.このような時間を測るしくみは生物時計とよばれており,これまでに,さまざまな種類の生物時計の存在が知られている.体節の形成にかかわる分節時計や睡眠の周期など数十分~数時間のリズムを除けば,生物時計のほとんどは太陽,月,地球がつくりだす自然界にみられる周期的な現象に対応する.たとえば,1日に2回ある満潮と干潮に応じた概潮汐時計(約12.4時間),1日の明暗周期に応じた概日時計(約24時間),月の満ち欠けに応じた概月時計(約1カ月),地球の公転による季節の変化に応じた概年時計(約1年)などである.
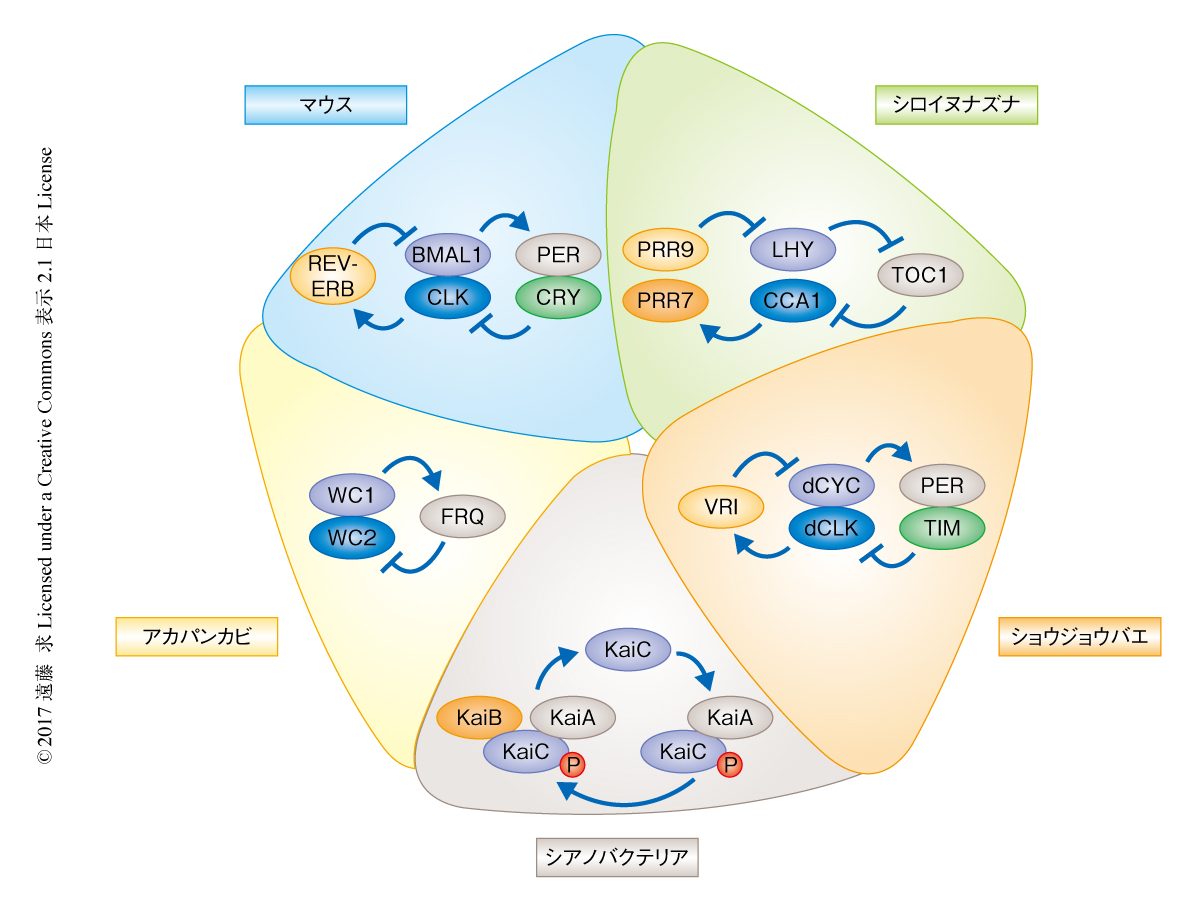
こうした生物時計のうち,概日時計は,連続明条件などの一定の環境においてリズムが継続する“自由継続性”,光などの外部の環境からの刺激により位相が変化し同調する“位相応答性”,生理的な温度の範囲においては周期がそれほど変化しない“温度補償性”の3つの特徴により規定される.これらを指標として,ショウジョウバエにおいては概日時計の変異体のスクリーニングが早くからはじめられ,1984年には活動のリズムに異常をもつ変異体の原因遺伝子がクローニングされperiod(per)遺伝子と命名された.そののち,アカパンカビのfrq遺伝子,ショウジョウバエのtim遺伝子,マウスのClock遺伝子やBmal1遺伝子など,時計遺伝子がつぎつぎと同定された.現在では,シアノバクテリア,カビ,昆虫,鳥類,哺乳類,植物など多種多様な生物において多数の時計遺伝子が同定されている.こうして同定された時計遺伝子を比較すると,哺乳類,鳥類,昆虫のあいだにはおおむね共通した時計遺伝子が存在する一方,これらとシアノバクテリア,カビ,植物の時計遺伝子のあいだには相同性がまったくみられない(図1).こうしたことから,現在では,概日時計は進化の過程で複数回にわたり独立に獲得されたと考えられている.
このように,概日時計の起源は同じではないと考えられるにもかかわらず,シアノバクテリアを除き,動物および植物を含む多くの生物においては遺伝子の発現を介した多数のフィードバックループを用いることにより概日リズムを生み出す.すなわち,時計遺伝子から産生された時計タンパク質が時間的な遅れをともない時計遺伝子の転写を制御することにより,遺伝子の発現の周期的な振動が生み出されている.こうしたことから,動物と植物の概日時計の構成因子に類似性はないが,基本的なシステムは本質的に類似するとみなされる1)(図1).実際,ある生物において提唱されたコンセプトがほかの生物においても適用されることは,概日時計の研究においてしばしばみられる.
つまり,概日時計の研究においては,分子レベルあるいは細胞レベルにおいて個々の時計遺伝子の機能やフィードバックループについて解明するだけでなく,それらの総体としての概日時計のシステムを組織レベルあるいは器官レベルにおいて理解し,最終的には,個体レベルにおいてそのシステムを解明する必要がある.これまでの還元的アプローチにくわえ,より包括的な理解をめざすアプローチを組み入れることは,個々の生物種における概日時計のシステムを明らかにするだけでなく,“生命にとって時間とは何か”という究極の問いに答えるうえで非常に重要である.
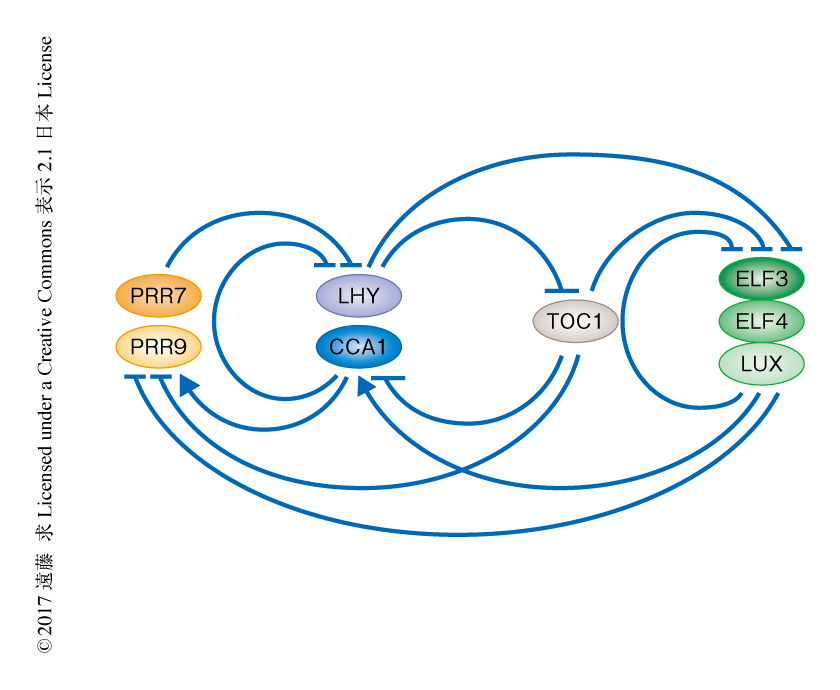
現在まで,植物の概日時計に関連するとして報告された遺伝子として数十個が知られており,いまも増加しつづけている.モデル植物であるシロイヌナズナにおいてとくに重要な時計遺伝子として,LHY遺伝子,CCA1遺伝子,TOC1遺伝子を含むPRR遺伝子ファミリー,ELF遺伝子ファミリー,LUX遺伝子など,十数個があげられる2).これらの遺伝子はほとんどが転写因子あるいは転写因子と複合体を形成するタンパク質をコードしており,ほかの時計遺伝子のプロモーターと結合することにより転写のオンオフを制御する.シロイヌナズナにおいては,これらの時計遺伝子が複雑にからみあい多数のフィードバックループを形成する(図2).
これらのフィードバックループのなかでも,とくにTOC1とLHYあるいはCCA1から構成されるフィードバックループはコアループとよばれている.シロイヌナズナでおいては,朝方に発現のピークをもつLHYおよびCCA1と夕方に発現のピークをもつTOC1とは互いに転写を抑制する関係にあり,基部陸上植物であるゼニゴケや単細胞の植物プランクトンであるプラシノ藻オストレオコッカス(Ostreococcus tauri)にもTOC1とLHYあるいはCCA1から構成されるフィードバックループが存在すると報告されている3,4).しかし,緑色植物において必ずしもすべての時計遺伝子が保存されているわけではなく,ヒメツリガネゴケにTOC1遺伝子のオルソログは存在せず,クラミドモナスでは一部の時計遺伝子にしか相同性がみられないなどシロイヌナズナとは異なる概日時計システムをもつことも知られている.
とはいえ,LHYあるいはCCA1とTOC1から構成されるフィードバックループはほとんどの陸上植物に保存されており,植物における概日時計システムの根幹をなす.そのため,シロイヌナズナやオストレオコッカスにおいてCCA1を過剰に発現させると概日リズムが失われる.こうした実験を含めたさまざまな分子生物学的な解析や,ChIP-seq法などによる時計遺伝子に制御される標的の網羅的な探索などから,植物における概日時計システムの全体像はかなり解明が進んだ.しかし,こうした研究の多くは植物の葉全体もしくは植物の個体全体を用いたものであることから,あくまでも植物における平均的な概日時計システムの描像であることに注意する必要がある.
多細胞化は細胞の機能に分化をもたらし,複雑な制御を可能にした.そのため,遺伝子の発現のかなりの部分を担う概日時計システムが細胞ごと,組織ごと,器官ごとに少しずつ異なる機能をもつことは想像にかたくない.実際,動物においてはショウジョウバエ,マウス,ヒトなどを用いた研究から,生体における概日時計システムはどの部位においても同じというわけではなく,少なくとも器官レベルあるいは組織レベルで異なることが明らかにされている.たとえば,マウスにおいては視交叉上核が大部分の概日リズムの中枢であることが示されており,肝臓など末梢の器官の概日時計を制御する5).視交叉上核と末梢の器官とで概日時計の制御をうける遺伝子の種類や発現のパターンを比較すると,それぞれのあいだにはほとんどオーバーラップはなく,共通する遺伝子についても振動の位相が異なるなど概日リズムのパターンはまったく異なる.また,マウスの概日時計の主要な構成要素のひとつであるCLOCKの欠損変異体が遺伝子の発現パターンにあたえる影響は組織ごとに異なる6).CLOCKはRev-erbα遺伝子やPer1遺伝子といった別の時計遺伝子の発現を制御する.しかし,CLOCKの変異はPer1遺伝子の発現に対し,視交叉上核においては発現量を減少させやや低振幅にする程度であるが,肝臓においては逆に発現量を増加させ高振幅になると同時に発現ピークの位相も変化させる.さらに,CLOCK遺伝子の変異はRev-erbα遺伝子の発現に対し,視交叉上核においてはやや低振幅にする程度であるが,肝臓においては振幅を劇的に低下させリズムをほとんど消失させる.このような違いは,Rev-erbαの結合部位が組織特異的であることから説明されるかもしれない7).このように,ある時計遺伝子を欠失させたときの影響が組織ごとあるいは時計遺伝子ごとに異なることから,哺乳類においては視交叉上核の概日時計と肝臓の概日時計は共通の時計遺伝子から構成されるものの異なる特性をもつと考えられる.
中枢時計である視交叉上核の概日時計において生じたリズムは神経性および体液性のシグナルを介して末梢の器官に存在する概日時計を制御することが知られている5).そのため,視交叉上核を切除した動物には概日リズムがほとんどみられなくなる.このように,視交叉上核は個体レベルでの概日リズムを考えるうえで,おのおのの組織の概日時計システムのネットワークにおいてきわめて重要な中枢であることがわかる.では,植物にはそのような中枢は存在するのだろうか.また,存在するとすればどの組織なのだろうか.
植物には,動物の脳に相当するような明確な中枢はもちろん存在しない.しかし,植物においても動物にみられるような組織ごとに異なる概日リズムが存在することは,2000年にはすでに示唆されていた.その当時は解析の技術が未発達であったことや概日時計のフィードバックループの全体像が未解明であったこともあり,具体的にどの器官あるいはどの組織で何が起こっているかについてはよくわからないままであった.そののち,分子レベルでの解析が進み,概日時計の変異体の単離やその時計遺伝子の機能の解析が進展したものの,概日時計の組織特異性の研究はほとんど進まなかった.
2008年になり,根と地上部の概日時計システムは異なることが示された8).地上部にみられるLHYあるいはCCA1によるTOC1遺伝子の発現の抑制は,根においては起こっておらず,その結果,連続明条件において根のTOC1遺伝子の概日リズムの振幅や周期は地上部とは異なり,地上部と根では概日時計システムの構成が異なることが示唆された.根端分裂組織の近傍や側根原基において概日時計のリセットが起こっているという報告もあることから9,10),ここでみられた根の概日リズムは,性質の異なる複数のタイプの細胞の総和として測定されたものであるかもしれない.あるいは,地上部と根とでは概日時計の光刺激の入力に対する応答性が異なるとの報告のあることから11),このことにより地上部と根とで異なる概日時計の特性の生じる可能性もある.いずれにせよ,地上部と根の概日時計システムが異なるという事実は,これまで,個体レベルでの解析が主であった植物の概日時計の研究に一石を投じるものであり,植物における概日時計の組織特異性の研究はふたたび注目されはじめた.
地上部と根という器官レベルでの違いだけでなく,のちに述べるように,組織レベルおよび細胞レベルでの概日時計システムの違いも報告されている.このように,器官レベル,組織レベル,細胞レベルで遺伝子の発現を測定することにより組織ごとに異なる概日リズムをもつことが示されつつある一方,こうした組織ごとに特徴的な概日時計システムがどのような生理応答と結びついているかについて明らかにされた例はまだ少ない.
植物の表皮(気孔)は,単離のむずかしさや個体全体に対する細胞数の少なさから概日時計に関する知見は多くないものの,顕微鏡による観察が容易であることから古くから研究されてきた.
タバコの細胞質におけるCa2+濃度の変化は概日リズムを示し,気孔,気孔以外の表皮細胞,葉柄でそれぞれ異なる位相を示す12).さらに,シロイヌナズナの葉の孔辺細胞においても葉肉や周囲の表皮とは異なるCCA1遺伝子の概日リズムがみられ,CCA1遺伝子の転写抑制因子をコードすることが知られている時計遺伝子であるCHE遺伝子の発現は,葉肉細胞ではみられるのに対し孔辺細胞ではほとんどみられない13).このように,葉肉と表皮,さらに,気孔以外の表皮と気孔とでは概日時計システムの特性が異なることが明らかにされた.では,表皮の概日時計はどういった生理応答にかかわるのだろうか.その特性に関する最初のヒントは,CAT3遺伝子とCAB2遺伝子の環境刺激に対する応答性の違いから得られた14).CAB2遺伝子は光合成に関連する遺伝子であり,おもに葉肉に発現する.一方,CAT3遺伝子は葉肉と表皮の両方に発現するが,表皮のほうが高発現する.光と温度それぞれの環境刺激を同位相および逆位相であたえ,どちらの環境刺激により強く影響をうけるか調べたところ,CAT3遺伝子の概日リズムは光よりも温度により強く制御された一方,CAB2遺伝子の概日リズムは温度よりも光により制御されることが示された.このことから,少なくとも表皮の概日時計と葉肉の概日時計は環境刺激に対する応答性が異なり,表皮の概日時計は温度により強く影響をうけることが示唆された.
すでに述べたように,CCA1を過剰に発現させると概日リズムの形成は阻害される.筆者らは,このことを利用し表皮に特異的なプロモーターを用いてCCA1を過剰発現させることにより表皮における概日リズムの形成を阻害した15).その結果,温度に依存的な胚軸の伸長に異常がみられたが,ほかの組織において概日リズムの形成を阻害しても胚軸の伸長に異常はみられなかった.このことから,表皮の概日時計を介した温度シグナル伝達経路の存在が確認された.そののち,光受容体として知られているphyBが温度の受容体でもあることが報告された16,17).どの組織のphyBが温度の受容に重要であるかは明らかにされていないものの,重力屈性にともなう胚軸の伸長には表皮のphyBが重要であること18),概日時計はphyBと相互作用する転写因子をコードするPIF4遺伝子や下流のオーキシン生合成関連遺伝子の発現の制御をつうじて胚軸の伸長を制御すること15),胚軸の伸長には表皮における局所的なオーキシン代謝が重要な役割をはたすこと19) などから考えると,表皮の概日時計は温度受容体と協調的に機能することにより胚軸の伸長を制御すると考えられる.こうした知見は,古典的な生理学実験により提唱されていた,胚軸の伸長には表皮組織の伸長の制御が重要であるという仮説20) を裏づけるものとなった.
維管束もまた表皮と同様に単離がむずかしく細胞数の少ない組織であるが,光周性花成の制御の場として,維管束における概日時計の重要性は早くから予想されていた.
現在,主流となっている季節に応じた花芽の形成(光周性花成)のモデルにおいては,概日時計により制御される花成関連遺伝子であるCO遺伝子と光シグナルの両方が存在することにより花成が促進される.COやその下流において光周性花成の直接の引き金となるフロリゲンとよばれるホルモンをコードするFT遺伝子は葉の維管束篩部伴細胞において発現する.さらに,光シグナルについても,日長(季節)の受容体として知られているcry2や,その下流において機能するCOP1やSPAといったタンパク質も維管束において特異的に機能することが明らかにされていた21-23).cry2からの入力は直接および概日時計を介してCOやFTへと出力されることから,維管束の概日時計が光周性花成に重要であると考えられていた.また,時計遺伝子の多くはすべての組織において発現するが,PRR3遺伝子およびPRR9遺伝子はおもに維管束において発現することがGUSレポーターアッセイにより示されている24).筆者らによる組織特異的なマイクロアレイ解析からは,ELF4遺伝子が維管束において高発現することが明らかにされた25)(新着論文レビュー でも掲載).このように,時計遺伝子の発現パターンがほかの組織とは異なることからも,維管束の概日時計システムはほかの組織とは異なると考えられていた.
そこで筆者らは,単離した維管束を用いて,連続明条件においてTOC1遺伝子の発現を測定した.葉全体(葉肉)におけるTOC1遺伝子の概日リズムの振幅は時間とともに低下し1週間後にはほとんどみられなくなったのに対し,維管束におけるTOC1遺伝子の概日リズムの振幅は1週間後においても明確に観察され,維管束の概日時計は葉肉の概日時計より頑健であることが示された.さらに,維管束に特異的なプロモーターを用いてCCA1を過剰発現させることにより,維管束篩部伴細胞における概日リズムの形成を阻害した.その結果,維管束だけでなく,隣接する葉肉細胞における概日リズムの形成も阻害されたことから,維管束の概日時計は葉肉の概日時計に対し支配的であることが見い出された.維管束において概日リズムを阻害した系統では予想どおり日長に依存的な花成に異常がみられた一方,葉肉あるいは表皮において概日リズムの形成を阻害した系統では花成の時期に異常はみられなかった15).さらに,維管束木部あるいは維管束形成層に特異的なプロモーターを用いて木部あるいは形成層において概日リズムの形成を阻害した系統についても解析したが,これらは野生型と同様の光周性花成を示し花成の時期に異常はみられなかった.こうしたことから,維管束の概日時計は日長に依存的に花成を制御することが示された.
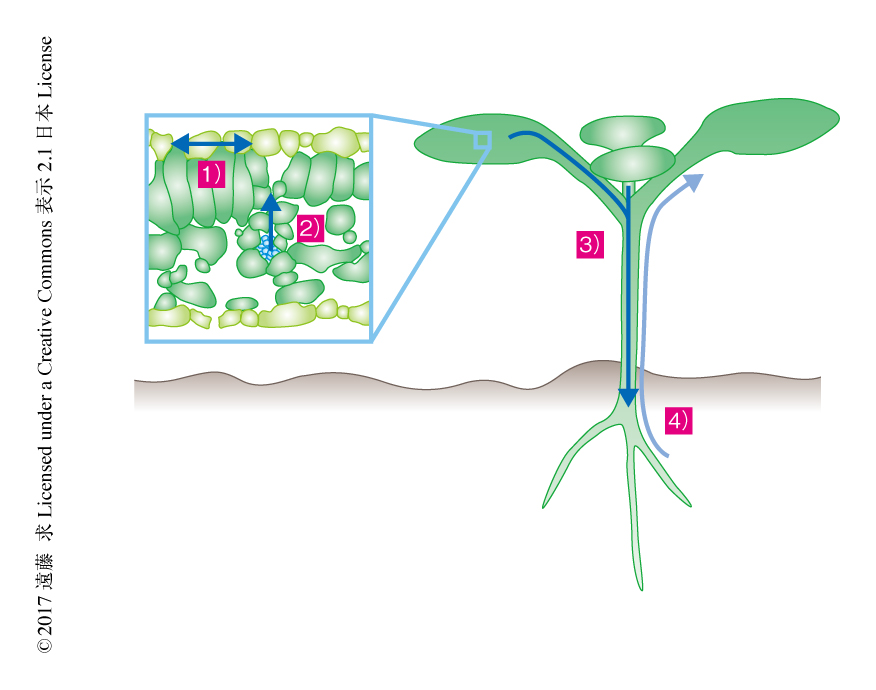
ここまでみてきたように,脳をもたない植物には,それぞれの生理応答に対応した組織特異的な概日時計システムが存在し,それらうまく組み合わせることにより適切な制御がされると考えられる.それでは,おのおのの組織の概日時計は互いにどのように制御されるのだろうか.これについて明確な答はないが,細胞どうしをつなぐ原形質連絡や器官および組織をつなぐよう張りめぐらされている維管束網をつうじ,時間情報を個体レベルで統合するのではないかと考えられている.植物における細胞間,組織間,器官間での時間情報の伝達という現象はすでにいくつか報告されており,それらについて紹介する(図3).
複数の研究グループから,シロイヌナズナの葉においてCCA1遺伝子の概日リズムが波のように細胞間を伝播する現象が報告されている26,27).ウキクサにおいてもごく近傍の細胞のあいだでは概日リズムが同調していることが1細胞レベルの解析から明らかにされている28).こうした結果は,細胞間で時間情報がやりとりされていることを示唆するものの,細胞間の概日リズムの同調は非常に弱いこともあり,何がどういうしくみで時間情報を伝達するのかについては明らかにされておらず,概日リズムの細胞間の同調の生物学的な意義についても今後の課題である.また,近距離の時間情報の伝達の例としては,さきに述べた維管束の概日時計による葉肉の概日時計の制御などもあげられる.
器官間の長距離の時間情報の伝達として,地上部の概日時計による根の概日時計の制御が報告されている8,29)(文献29) は新着論文レビュー でも掲載).根の概日リズムと地上部の概日リズムをそれぞれ測定した結果,根の概日リズムは地上部の概日リズムと同調していることが示された.地上部に光合成の阻害剤を投与するとこの同調はみられなくなり,糖の添加により回復したことから,篩管のスクロースあるいはその誘導体など光合成に関連したシグナル伝達物質が地上部と根の概日時計の同調に重要だろうと考えられている.逆の,根から地上部への時間情報の伝達についてはほとんど研究されていないが,オオムギにおいては根にあたえた浸透圧ストレスにより地上部における時計遺伝子の発現が変化するという報告のあることから30),道管を介したアブシジン酸による時間情報の伝達の機構があるかもしれないと考えられている.維管束を介した長距離の時間情報の伝達に関しても研究ははじまったばかりであり,どのように長距離の時間情報が伝達されるのか,また,植物にとりそうした時間情報の共有がどれくらい重要かは,今後,明らかにされるべき課題である.
以上のように,植物の概日時計には組織特異的な機能の分担が存在し,これが植物の柔軟な生き方をささえていると考えられる.そして,こうした知見は組織レベルでの解析をつうじてはじめて明らかにされた.移動のできない植物ではあるが,その内部では複雑な時空間制御がなされている.概日時計は遺伝子の発現のかなりの部分にかかわることから,概日時計の研究にかぎらず,高い時空間分解能で対象を明らかにし,明らかにされた知見を再構成して理解するという流れは,今後,ますます加速するだろう.現在では,生物の機能の最小単位である1細胞のレベルでの解析も可能になっており,組織特異性とはまた違った細胞のタイプの特異性のようなものが明らかにされると期待している.さらに,ひとつの細胞のなかでも核と葉緑体とでは異なる概日リズムをもつ可能性が示唆されており,概日時計システムの特異性はオルガネラのレベルにまで還元されるかもしれない31).こうした還元主義的なアプローチにくわえ,細胞間あるいは組織間で時間情報をやりとりするしくみを解明する全体主義的なアプローチについても,今後の発展に期待したい.概日時計を構成する要素の研究については一定のめどがたちつつあるいま,個々の要素を統合しより高次のレベルで概日時計システムを理解する必要があるだろう.
略歴:2007年 京都大学大学院理学研究科博士課程 修了,同年 同 博士研究員,2008年 米国California大学San Diego校 博士研究員,2009年 京都大学大学院生命科学研究科 助教を経て,2015年より同 准教授.2011年より科学技術振興機構 さきがけ研究者 兼任.
研究テーマ:植物の環境応答.時間生物学.
© 2017 遠藤 求 Licensed under CC 表示 2.1 日本
(京都大学大学院生命科学研究科 統合生命科学専攻分子代謝制御学分野)
email:遠藤 求
領域融合レビュー, 6, e001 (2017) DOI: 10.7875/leading.author.6.e001
Motomu Endo: Tissue-specificity and inter-tissue signaling of circadian rhythms in plants.
要 約
植物を含め,ほとんどの生物は概日時計をもつ.ショウジョウバエ,マウス,ヒトなどの研究から,多細胞生物では組織ごとに概日時計の機能の異なることが明らかにされている.筆者らの研究を含む最近の研究から,植物もまた組織特異的に概日時計の機能を分担していることが分子レベルで明らかにされた.多細胞生物としておのおのの細胞が協調的にふるまうことを可能にするには,個々の細胞のもつ時間情報を共有すること,すなわち,器官間,組織間,細胞間での時間情報のやりとりが不可欠である.このレビューでは,植物の組織ごとに異なる概日時計について解説するとともに,おのおのの組織がどのように時間情報を共有するのか考察する.
はじめに
多くの生物は時間を測るしくみを備えており,遺伝子の発現や行動など生命活動のあらゆる階層における周期的な応答を制御する.このような時間を測るしくみは生物時計とよばれており,これまでに,さまざまな種類の生物時計の存在が知られている.体節の形成にかかわる分節時計や睡眠の周期など数十分~数時間のリズムを除けば,生物時計のほとんどは太陽,月,地球がつくりだす自然界にみられる周期的な現象に対応する.たとえば,1日に2回ある満潮と干潮に応じた概潮汐時計(約12.4時間),1日の明暗周期に応じた概日時計(約24時間),月の満ち欠けに応じた概月時計(約1カ月),地球の公転による季節の変化に応じた概年時計(約1年)などである.
こうした生物時計のうち,概日時計は,連続明条件などの一定の環境においてリズムが継続する“自由継続性”,光などの外部の環境からの刺激により位相が変化し同調する“位相応答性”,生理的な温度の範囲においては周期がそれほど変化しない“温度補償性”の3つの特徴により規定される.これらを指標として,ショウジョウバエにおいては概日時計の変異体のスクリーニングが早くからはじめられ,1984年には活動のリズムに異常をもつ変異体の原因遺伝子がクローニングされperiod(per)遺伝子と命名された.そののち,アカパンカビのfrq遺伝子,ショウジョウバエのtim遺伝子,マウスのClock遺伝子やBmal1遺伝子など,時計遺伝子がつぎつぎと同定された.現在では,シアノバクテリア,カビ,昆虫,鳥類,哺乳類,植物など多種多様な生物において多数の時計遺伝子が同定されている.こうして同定された時計遺伝子を比較すると,哺乳類,鳥類,昆虫のあいだにはおおむね共通した時計遺伝子が存在する一方,これらとシアノバクテリア,カビ,植物の時計遺伝子のあいだには相同性がまったくみられない(図1).こうしたことから,現在では,概日時計は進化の過程で複数回にわたり独立に獲得されたと考えられている.
このように,概日時計の起源は同じではないと考えられるにもかかわらず,シアノバクテリアを除き,動物および植物を含む多くの生物においては遺伝子の発現を介した多数のフィードバックループを用いることにより概日リズムを生み出す.すなわち,時計遺伝子から産生された時計タンパク質が時間的な遅れをともない時計遺伝子の転写を制御することにより,遺伝子の発現の周期的な振動が生み出されている.こうしたことから,動物と植物の概日時計の構成因子に類似性はないが,基本的なシステムは本質的に類似するとみなされる1)(図1).実際,ある生物において提唱されたコンセプトがほかの生物においても適用されることは,概日時計の研究においてしばしばみられる.
つまり,概日時計の研究においては,分子レベルあるいは細胞レベルにおいて個々の時計遺伝子の機能やフィードバックループについて解明するだけでなく,それらの総体としての概日時計のシステムを組織レベルあるいは器官レベルにおいて理解し,最終的には,個体レベルにおいてそのシステムを解明する必要がある.これまでの還元的アプローチにくわえ,より包括的な理解をめざすアプローチを組み入れることは,個々の生物種における概日時計のシステムを明らかにするだけでなく,“生命にとって時間とは何か”という究極の問いに答えるうえで非常に重要である.
1.植物における概日時計
現在まで,植物の概日時計に関連するとして報告された遺伝子として数十個が知られており,いまも増加しつづけている.モデル植物であるシロイヌナズナにおいてとくに重要な時計遺伝子として,LHY遺伝子,CCA1遺伝子,TOC1遺伝子を含むPRR遺伝子ファミリー,ELF遺伝子ファミリー,LUX遺伝子など,十数個があげられる2).これらの遺伝子はほとんどが転写因子あるいは転写因子と複合体を形成するタンパク質をコードしており,ほかの時計遺伝子のプロモーターと結合することにより転写のオンオフを制御する.シロイヌナズナにおいては,これらの時計遺伝子が複雑にからみあい多数のフィードバックループを形成する(図2).
これらのフィードバックループのなかでも,とくにTOC1とLHYあるいはCCA1から構成されるフィードバックループはコアループとよばれている.シロイヌナズナでおいては,朝方に発現のピークをもつLHYおよびCCA1と夕方に発現のピークをもつTOC1とは互いに転写を抑制する関係にあり,基部陸上植物であるゼニゴケや単細胞の植物プランクトンであるプラシノ藻オストレオコッカス(Ostreococcus tauri)にもTOC1とLHYあるいはCCA1から構成されるフィードバックループが存在すると報告されている3,4).しかし,緑色植物において必ずしもすべての時計遺伝子が保存されているわけではなく,ヒメツリガネゴケにTOC1遺伝子のオルソログは存在せず,クラミドモナスでは一部の時計遺伝子にしか相同性がみられないなどシロイヌナズナとは異なる概日時計システムをもつことも知られている.
とはいえ,LHYあるいはCCA1とTOC1から構成されるフィードバックループはほとんどの陸上植物に保存されており,植物における概日時計システムの根幹をなす.そのため,シロイヌナズナやオストレオコッカスにおいてCCA1を過剰に発現させると概日リズムが失われる.こうした実験を含めたさまざまな分子生物学的な解析や,ChIP-seq法などによる時計遺伝子に制御される標的の網羅的な探索などから,植物における概日時計システムの全体像はかなり解明が進んだ.しかし,こうした研究の多くは植物の葉全体もしくは植物の個体全体を用いたものであることから,あくまでも植物における平均的な概日時計システムの描像であることに注意する必要がある.
2.多細胞生物における概日時計のネットワーク
多細胞化は細胞の機能に分化をもたらし,複雑な制御を可能にした.そのため,遺伝子の発現のかなりの部分を担う概日時計システムが細胞ごと,組織ごと,器官ごとに少しずつ異なる機能をもつことは想像にかたくない.実際,動物においてはショウジョウバエ,マウス,ヒトなどを用いた研究から,生体における概日時計システムはどの部位においても同じというわけではなく,少なくとも器官レベルあるいは組織レベルで異なることが明らかにされている.たとえば,マウスにおいては視交叉上核が大部分の概日リズムの中枢であることが示されており,肝臓など末梢の器官の概日時計を制御する5).視交叉上核と末梢の器官とで概日時計の制御をうける遺伝子の種類や発現のパターンを比較すると,それぞれのあいだにはほとんどオーバーラップはなく,共通する遺伝子についても振動の位相が異なるなど概日リズムのパターンはまったく異なる.また,マウスの概日時計の主要な構成要素のひとつであるCLOCKの欠損変異体が遺伝子の発現パターンにあたえる影響は組織ごとに異なる6).CLOCKはRev-erbα遺伝子やPer1遺伝子といった別の時計遺伝子の発現を制御する.しかし,CLOCKの変異はPer1遺伝子の発現に対し,視交叉上核においては発現量を減少させやや低振幅にする程度であるが,肝臓においては逆に発現量を増加させ高振幅になると同時に発現ピークの位相も変化させる.さらに,CLOCK遺伝子の変異はRev-erbα遺伝子の発現に対し,視交叉上核においてはやや低振幅にする程度であるが,肝臓においては振幅を劇的に低下させリズムをほとんど消失させる.このような違いは,Rev-erbαの結合部位が組織特異的であることから説明されるかもしれない7).このように,ある時計遺伝子を欠失させたときの影響が組織ごとあるいは時計遺伝子ごとに異なることから,哺乳類においては視交叉上核の概日時計と肝臓の概日時計は共通の時計遺伝子から構成されるものの異なる特性をもつと考えられる.
中枢時計である視交叉上核の概日時計において生じたリズムは神経性および体液性のシグナルを介して末梢の器官に存在する概日時計を制御することが知られている5).そのため,視交叉上核を切除した動物には概日リズムがほとんどみられなくなる.このように,視交叉上核は個体レベルでの概日リズムを考えるうえで,おのおのの組織の概日時計システムのネットワークにおいてきわめて重要な中枢であることがわかる.では,植物にはそのような中枢は存在するのだろうか.また,存在するとすればどの組織なのだろうか.
3.植物における概日時計の組織特異性
植物には,動物の脳に相当するような明確な中枢はもちろん存在しない.しかし,植物においても動物にみられるような組織ごとに異なる概日リズムが存在することは,2000年にはすでに示唆されていた.その当時は解析の技術が未発達であったことや概日時計のフィードバックループの全体像が未解明であったこともあり,具体的にどの器官あるいはどの組織で何が起こっているかについてはよくわからないままであった.そののち,分子レベルでの解析が進み,概日時計の変異体の単離やその時計遺伝子の機能の解析が進展したものの,概日時計の組織特異性の研究はほとんど進まなかった.
2008年になり,根と地上部の概日時計システムは異なることが示された8).地上部にみられるLHYあるいはCCA1によるTOC1遺伝子の発現の抑制は,根においては起こっておらず,その結果,連続明条件において根のTOC1遺伝子の概日リズムの振幅や周期は地上部とは異なり,地上部と根では概日時計システムの構成が異なることが示唆された.根端分裂組織の近傍や側根原基において概日時計のリセットが起こっているという報告もあることから9,10),ここでみられた根の概日リズムは,性質の異なる複数のタイプの細胞の総和として測定されたものであるかもしれない.あるいは,地上部と根とでは概日時計の光刺激の入力に対する応答性が異なるとの報告のあることから11),このことにより地上部と根とで異なる概日時計の特性の生じる可能性もある.いずれにせよ,地上部と根の概日時計システムが異なるという事実は,これまで,個体レベルでの解析が主であった植物の概日時計の研究に一石を投じるものであり,植物における概日時計の組織特異性の研究はふたたび注目されはじめた.
地上部と根という器官レベルでの違いだけでなく,のちに述べるように,組織レベルおよび細胞レベルでの概日時計システムの違いも報告されている.このように,器官レベル,組織レベル,細胞レベルで遺伝子の発現を測定することにより組織ごとに異なる概日リズムをもつことが示されつつある一方,こうした組織ごとに特徴的な概日時計システムがどのような生理応答と結びついているかについて明らかにされた例はまだ少ない.
4.表皮の概日時計と温度の受容
植物の表皮(気孔)は,単離のむずかしさや個体全体に対する細胞数の少なさから概日時計に関する知見は多くないものの,顕微鏡による観察が容易であることから古くから研究されてきた.
タバコの細胞質におけるCa2+濃度の変化は概日リズムを示し,気孔,気孔以外の表皮細胞,葉柄でそれぞれ異なる位相を示す12).さらに,シロイヌナズナの葉の孔辺細胞においても葉肉や周囲の表皮とは異なるCCA1遺伝子の概日リズムがみられ,CCA1遺伝子の転写抑制因子をコードすることが知られている時計遺伝子であるCHE遺伝子の発現は,葉肉細胞ではみられるのに対し孔辺細胞ではほとんどみられない13).このように,葉肉と表皮,さらに,気孔以外の表皮と気孔とでは概日時計システムの特性が異なることが明らかにされた.では,表皮の概日時計はどういった生理応答にかかわるのだろうか.その特性に関する最初のヒントは,CAT3遺伝子とCAB2遺伝子の環境刺激に対する応答性の違いから得られた14).CAB2遺伝子は光合成に関連する遺伝子であり,おもに葉肉に発現する.一方,CAT3遺伝子は葉肉と表皮の両方に発現するが,表皮のほうが高発現する.光と温度それぞれの環境刺激を同位相および逆位相であたえ,どちらの環境刺激により強く影響をうけるか調べたところ,CAT3遺伝子の概日リズムは光よりも温度により強く制御された一方,CAB2遺伝子の概日リズムは温度よりも光により制御されることが示された.このことから,少なくとも表皮の概日時計と葉肉の概日時計は環境刺激に対する応答性が異なり,表皮の概日時計は温度により強く影響をうけることが示唆された.
すでに述べたように,CCA1を過剰に発現させると概日リズムの形成は阻害される.筆者らは,このことを利用し表皮に特異的なプロモーターを用いてCCA1を過剰発現させることにより表皮における概日リズムの形成を阻害した15).その結果,温度に依存的な胚軸の伸長に異常がみられたが,ほかの組織において概日リズムの形成を阻害しても胚軸の伸長に異常はみられなかった.このことから,表皮の概日時計を介した温度シグナル伝達経路の存在が確認された.そののち,光受容体として知られているphyBが温度の受容体でもあることが報告された16,17).どの組織のphyBが温度の受容に重要であるかは明らかにされていないものの,重力屈性にともなう胚軸の伸長には表皮のphyBが重要であること18),概日時計はphyBと相互作用する転写因子をコードするPIF4遺伝子や下流のオーキシン生合成関連遺伝子の発現の制御をつうじて胚軸の伸長を制御すること15),胚軸の伸長には表皮における局所的なオーキシン代謝が重要な役割をはたすこと19) などから考えると,表皮の概日時計は温度受容体と協調的に機能することにより胚軸の伸長を制御すると考えられる.こうした知見は,古典的な生理学実験により提唱されていた,胚軸の伸長には表皮組織の伸長の制御が重要であるという仮説20) を裏づけるものとなった.
5.維管束の概日時計と光周性花成の制御
維管束もまた表皮と同様に単離がむずかしく細胞数の少ない組織であるが,光周性花成の制御の場として,維管束における概日時計の重要性は早くから予想されていた.
現在,主流となっている季節に応じた花芽の形成(光周性花成)のモデルにおいては,概日時計により制御される花成関連遺伝子であるCO遺伝子と光シグナルの両方が存在することにより花成が促進される.COやその下流において光周性花成の直接の引き金となるフロリゲンとよばれるホルモンをコードするFT遺伝子は葉の維管束篩部伴細胞において発現する.さらに,光シグナルについても,日長(季節)の受容体として知られているcry2や,その下流において機能するCOP1やSPAといったタンパク質も維管束において特異的に機能することが明らかにされていた21-23).cry2からの入力は直接および概日時計を介してCOやFTへと出力されることから,維管束の概日時計が光周性花成に重要であると考えられていた.また,時計遺伝子の多くはすべての組織において発現するが,PRR3遺伝子およびPRR9遺伝子はおもに維管束において発現することがGUSレポーターアッセイにより示されている24).筆者らによる組織特異的なマイクロアレイ解析からは,ELF4遺伝子が維管束において高発現することが明らかにされた25)(新着論文レビュー でも掲載).このように,時計遺伝子の発現パターンがほかの組織とは異なることからも,維管束の概日時計システムはほかの組織とは異なると考えられていた.
そこで筆者らは,単離した維管束を用いて,連続明条件においてTOC1遺伝子の発現を測定した.葉全体(葉肉)におけるTOC1遺伝子の概日リズムの振幅は時間とともに低下し1週間後にはほとんどみられなくなったのに対し,維管束におけるTOC1遺伝子の概日リズムの振幅は1週間後においても明確に観察され,維管束の概日時計は葉肉の概日時計より頑健であることが示された.さらに,維管束に特異的なプロモーターを用いてCCA1を過剰発現させることにより,維管束篩部伴細胞における概日リズムの形成を阻害した.その結果,維管束だけでなく,隣接する葉肉細胞における概日リズムの形成も阻害されたことから,維管束の概日時計は葉肉の概日時計に対し支配的であることが見い出された.維管束において概日リズムを阻害した系統では予想どおり日長に依存的な花成に異常がみられた一方,葉肉あるいは表皮において概日リズムの形成を阻害した系統では花成の時期に異常はみられなかった15).さらに,維管束木部あるいは維管束形成層に特異的なプロモーターを用いて木部あるいは形成層において概日リズムの形成を阻害した系統についても解析したが,これらは野生型と同様の光周性花成を示し花成の時期に異常はみられなかった.こうしたことから,維管束の概日時計は日長に依存的に花成を制御することが示された.
6.時間情報の伝達
ここまでみてきたように,脳をもたない植物には,それぞれの生理応答に対応した組織特異的な概日時計システムが存在し,それらうまく組み合わせることにより適切な制御がされると考えられる.それでは,おのおのの組織の概日時計は互いにどのように制御されるのだろうか.これについて明確な答はないが,細胞どうしをつなぐ原形質連絡や器官および組織をつなぐよう張りめぐらされている維管束網をつうじ,時間情報を個体レベルで統合するのではないかと考えられている.植物における細胞間,組織間,器官間での時間情報の伝達という現象はすでにいくつか報告されており,それらについて紹介する(図3).
複数の研究グループから,シロイヌナズナの葉においてCCA1遺伝子の概日リズムが波のように細胞間を伝播する現象が報告されている26,27).ウキクサにおいてもごく近傍の細胞のあいだでは概日リズムが同調していることが1細胞レベルの解析から明らかにされている28).こうした結果は,細胞間で時間情報がやりとりされていることを示唆するものの,細胞間の概日リズムの同調は非常に弱いこともあり,何がどういうしくみで時間情報を伝達するのかについては明らかにされておらず,概日リズムの細胞間の同調の生物学的な意義についても今後の課題である.また,近距離の時間情報の伝達の例としては,さきに述べた維管束の概日時計による葉肉の概日時計の制御などもあげられる.
器官間の長距離の時間情報の伝達として,地上部の概日時計による根の概日時計の制御が報告されている8,29)(文献29) は新着論文レビュー でも掲載).根の概日リズムと地上部の概日リズムをそれぞれ測定した結果,根の概日リズムは地上部の概日リズムと同調していることが示された.地上部に光合成の阻害剤を投与するとこの同調はみられなくなり,糖の添加により回復したことから,篩管のスクロースあるいはその誘導体など光合成に関連したシグナル伝達物質が地上部と根の概日時計の同調に重要だろうと考えられている.逆の,根から地上部への時間情報の伝達についてはほとんど研究されていないが,オオムギにおいては根にあたえた浸透圧ストレスにより地上部における時計遺伝子の発現が変化するという報告のあることから30),道管を介したアブシジン酸による時間情報の伝達の機構があるかもしれないと考えられている.維管束を介した長距離の時間情報の伝達に関しても研究ははじまったばかりであり,どのように長距離の時間情報が伝達されるのか,また,植物にとりそうした時間情報の共有がどれくらい重要かは,今後,明らかにされるべき課題である.
おわりに
以上のように,植物の概日時計には組織特異的な機能の分担が存在し,これが植物の柔軟な生き方をささえていると考えられる.そして,こうした知見は組織レベルでの解析をつうじてはじめて明らかにされた.移動のできない植物ではあるが,その内部では複雑な時空間制御がなされている.概日時計は遺伝子の発現のかなりの部分にかかわることから,概日時計の研究にかぎらず,高い時空間分解能で対象を明らかにし,明らかにされた知見を再構成して理解するという流れは,今後,ますます加速するだろう.現在では,生物の機能の最小単位である1細胞のレベルでの解析も可能になっており,組織特異性とはまた違った細胞のタイプの特異性のようなものが明らかにされると期待している.さらに,ひとつの細胞のなかでも核と葉緑体とでは異なる概日リズムをもつ可能性が示唆されており,概日時計システムの特異性はオルガネラのレベルにまで還元されるかもしれない31).こうした還元主義的なアプローチにくわえ,細胞間あるいは組織間で時間情報をやりとりするしくみを解明する全体主義的なアプローチについても,今後の発展に期待したい.概日時計を構成する要素の研究については一定のめどがたちつつあるいま,個々の要素を統合しより高次のレベルで概日時計システムを理解する必要があるだろう.
文 献
- Doherty, C. J. & Kay, S. A.: Circadian control of global gene expression patterns. Annu. Rev. Genet., 44, 419-444 (2010)[PubMed]
- Sanchez, S. E. & Kay, S. A.: The plant circadian clock: from a simple timekeeper to a complex developmental manager. Cold Spring Harb. Perspect. Biol., 8, a027748 (2016)[PubMed]
- Kubota, A., Kita, S., Ishizaki, K. et al.: Co-option of a photoperiodic growth-phase transition system during land plant evolution. Nat. Commun., 5, 3668 (2014)[PubMed]
- Corellou, F., Schwartz, C., Motta, J. P. et al.: Clocks in the green lineage: comparative functional analysis of the circadian architecture of the picoeukaryote Ostreococcus. Plant Cell, 21, 3436-3449 (2009)[PubMed]
- Mohawk, J. A., Green, C. B. & Takahashi, J. S.: Central and peripheral circadian clocks in mammals. Annu. Rev. Neurosci., 35, 445-462 (2012)[PubMed]
- Debruyne, J. P., Noton, E., Lambert, C. M. et al.: A clock shock: mouse CLOCK is not required for circadian oscillator function. Neuron, 50, 465-477 (2006)[PubMed]
- Zhang, Y., Fang, B., Emmett, M. J. et al.: Discrete functions of nuclear receptor Rev-erbα couple metabolism to the clock. Science, 348, 1488-1492 (2015)[PubMed]
- James, A. B., Monreal, J. A. & Nimmo, G. A.: The circadian clock in Arabidopsis roots is a simplified slave version of the clock in shoots. Science, 322, 1832-1835 (2008)[PubMed]
- Voss, U., Wilson, M. H., Kenobi, K. et al.: The circadian clock rephases during lateral root organ initiation in Arabidopsis thaliana. Nat. Commun., 6, 7641 (2015)[PubMed]
- Fukuda, H., Ukai, K. & Oyama, T.: Self-arrangement of cellular circadian rhythms through phase-resetting in plant roots. Phys. Rev. E Stat. Nonlin. Soft Matter Phys., 86, 041917 (2012)[PubMed]
- Bordage, S., Sullivan, S., Laird, J. et al.: Organ specificity in the plant circadian system is explained by different light inputs to the shoot and root clocks. New Phytol., 212, 136-149 (2016)[PubMed]
- Wood, N. T., Haley, A., Viry-Moussaid, M. et al.: The calcium rhythms of different cell types oscillate with different circadian phases. Plant Physiol., 125, 787-796 (2001)[PubMed]
- Yakir, E., Hassidim, M. & Melamed-Book, N.: Cell autonomous and cell-type specific circadian rhythms in Arabidopsis. Plant J., 68, 520-531 (2011)[PubMed]
- Michael, T. P., Salome, P. A. & McClung, C. R.: Two Arabidopsis circadian oscillators can be distinguished by differential temperature sensitivity. Proc. Natl. Acad. Sci. USA, 100, 6878-6883 (2003)[PubMed]
- Shimizu, H., Katakaya, K., Koto, T. et al.: Decentralized circadian clocks process thermal and photoperiodic cues in specific tissues. Nat. Plants, 1, 15163 (2015)[PubMed]
- Jung, J. H., Domijan, M. & Klose, C.: Phytochromes function as thermosensors in Arabidopsis. Science, 354, 886-889 (2016)[PubMed]
- Legris, M., Klose, C., Burgie, E. S. et al.: Phytochrome B integrates light and temperature signals in Arabidopsis. Science, 354, 897-900 (2016)[PubMed]
- Kim, J., Song, K., Park, E. et al.: Epidermal phytochrome B inhibits hypocotyl negative gravitropism non-cell-autonomously. Plant Cell, 28, 2770-2785 (2016)[PubMed]
- Zheng, Z., Guo, Y., Novak, O. et al.: Local auxin metabolism regulates environment-induced hypocotyl elongation. Nat. Plants, 2, 16025 (2016)[PubMed]
- Kutschera, U. & Niklas, K. J.: The epidermal-growth-control theory of stem elongation: an old and a new perspective. J. Plant Physiol., 164, 1395-409 (2007)[PubMed]
- Endo, M., Mochizuki, N., Suzuki, T. et al.: CRYPTOCHROME2 in vascular bundles regulates flowering in Arabidopsis. Plant Cell, 19, 84-93 (2007)[PubMed]
- Jang, S., Marchal, V., Panigrahi, K. C. S. et al.: Arabidopsis COP1 shapes the temporal pattern of CO accumulation conferring a photoperiodic flowering response. EMBO J., 27, 1277-1288 (2008)[PubMed]
- Ranjan, A., Fiene, G., Fackendahl, P. et al.: The Arabidopsis repressor of light signaling SPA1 acts in the phloem to regulate seedling de-etiolation, leaf expansion and flowering time. Development, 138, 1851-1862 (2011)[PubMed]
- Para, A., Farre, E. M., Imaizumi, T. et al.: PRR3 is a vascular regulator of TOC1 stability in the Arabidopsis circadian clock. Plant Cell, 19, 3462-3473 (2007)[PubMed]
- Endo, M., Shimizu, H., Nohales, M. A. et al.: Tissue-specific clocks in Arabidopsis show asymmetric coupling. Nature, 515, 419-422 (2014)[PubMed] [新着論文レビュー]
- Fukuda, H., Nakamichi, N., Hisatsune, M. et al.: Synchronization of plant circadian oscillators with a phase delay effect of the vein network. Phys. Rev. Lett., 99, 098102 (2007)[PubMed]
- Wenden, B., Toner, D. L. K., Hodge, S. K. et al.: Spontaneous spatiotemporal waves of gene expression from biological clocks in the leaf. Proc. Natl. Acad. Sci. USA, 109, 6757-6762 (2012)[PubMed]
- Muranaka, T., Kubota, S. & Oyama, T.: A single-cell bioluminescence imaging system for monitoring cellular gene expression in a plant body. Plant Cell Physiol., 54, 2085-2093 (2013)[PubMed]
- Takahashi, N., Hirata, Y., Aihara, K. et al.: A hierarchical multi-oscillator network orchestrates the Arabidopsis circadian system. Cell, 163, 148-159 (2015)[PubMed] [新着論文レビュー]
- Habte, E., Muller, L. M., Shtaya, M. et al.: Osmotic stress at the barley root affects expression of circadian clock genes in the shoot. Plant Cell Environ., 37, 1321-1327 (2014)[PubMed]
- Johnson, C. H., Knight, M. R. & Kondo, T.: Circadian oscillations of cytosolic and chloroplastic free calcium in plants. Science, 269, 1863-1865 (1995)[PubMed]
著者プロフィール
略歴:2007年 京都大学大学院理学研究科博士課程 修了,同年 同 博士研究員,2008年 米国California大学San Diego校 博士研究員,2009年 京都大学大学院生命科学研究科 助教を経て,2015年より同 准教授.2011年より科学技術振興機構 さきがけ研究者 兼任.
研究テーマ:植物の環境応答.時間生物学.
© 2017 遠藤 求 Licensed under CC 表示 2.1 日本