大脳皮質の層構造の形成におけるニューロンの移動およびその意義
2017/07/11
仲嶋 一範
(慶應義塾大学医学部 解剖学教室)
email:仲嶋一範
領域融合レビュー, 6, e004 (2017) DOI: 10.7875/leading.author.6.e004
Kazunori Nakajima: Neuronal migration during layer formation in the cerebral cortex.

大脳皮質の多層からなる層構造は,脳室の近くにおいて産生された興奮性ニューロンが脳の表面へとつぎつぎと移動することにより形成される.新しく産生されたニューロンはさきに産生されたニューロンを追い越し辺縁帯の直下にて移動をおえるため,層構造は“inside-out”様式をもって形成される.この層構造の形成においては辺縁帯に局在するCajal-Retzius細胞から分泌されるReelinが重要な役割をはたし,Reelinが欠損すると層構造は全体として逆転してしまう.これまで,Reelinはたんに移動してきたニューロンを停止させるシグナルタンパク質であると考えられがちであったが,それでは説明のつかない現象がつぎつぎにみつかってきた.近年の研究においては,Reelinは移動の終点の近くにおいてニューロンの移動様式の変換を促進すること,細胞骨格を制御すること,さらに,そののちにニューロンを集合させる機能をもつことなどが明らかにされた.また,最近,産生されたばかりのニューロンはサブタイプの決定において可塑性をもつことが明らかにされ,ニューロンの移動により適切に配置された場所において特殊な細胞外環境に曝露されることにより,その場所に応じた特異的なサブタイプに分化するよう制御されるしくみの存在が示された.
脳においてニューロンは一般にランダムに散在するわけではなく,共通の特徴をもつニューロンが集合してグループをつくり局在する.すなわち,大脳皮質や小脳皮質などのニューロンは脳の表面の近くに層構造を形成し,脳幹などでは神経核とよばれるニューロンの集団を脳の深部につくる.これらのニューロンは,哺乳類においては一般に最終的に配置される部位とは異なる場所にて産生され,そののち移動して,遠く離れた部位において層構造や神経核の構造を形成する.脳の発生過程においてこの構造が乱れると,さまざまな精神神経疾患の発症リスクが高まる可能性が指摘されている1).
なぜ哺乳類の脳のニューロンは産生された部位から移動してから構造を形成するのだろうか? 近年の研究により,脳という組織を構築するうえでニューロンが活発に移動することの意義が垣間みえてきた.ニューロンの移動という過程により細胞のあいだの関係をリセットし,適切な制御のもとニューロンのあいだの新しい関係を構築することを可能にするという点が,その意義のひとつと考えられる.また,ニューロンを移動させることにより特殊な細胞外環境に曝露させ,コンテキストに依存的な成熟を可能にするという意義もあると考えられる.
以下においては,まず,発生期の大脳皮質においてニューロンの移動により層構造が形成される過程について解説する.つづいて,最近,ニューロンの移動はおのおのの層に特異的なサブタイプに適切に分化するうえでも重要な役割をもつことが明らかにされてきたので,それについての知見を紹介する.なお,このレビューにおいては簡単のため“大脳皮質”とよぶが,実際には多くの研究はマウスの“大脳新皮質”で行われ得られてきた知見である.
大脳皮質のニューロンには,大きく分けて興奮性ニューロンと抑制性ニューロンの2種類が存在する.興奮性ニューロンは大脳皮質の脳室の近くにおいて産生され,脳の表面にむかって放射状に(法線の方向に)移動するのに対し,抑制性ニューロンは大脳皮質の外(腹側終脳あるいは間脳の一部)において産生され,脳の表面に平行に(接線の方向に)移動して大脳皮質に進入する.それらの移動様式の詳細については最近のいくつかの総説において詳述されているので2-4),ここでは概要のみを解説する.
完成した大脳(新)皮質は脳の表面に平行な6つの層(第I層~第VI層)からなる層構造をもつ.おのおのの層はそれぞれに含まれる代表的なニューロンの形態や軸索投射の様式により特徴づけられ5),たとえば,第IV層はおもに視床から大脳皮質への入力をうける比較的小さな星状のニューロンから構成され,第II層/第III層は大脳皮質の領野のあいだを連絡する錐体細胞がおもな構成ニューロンである.大脳皮質において処理された情報は,第V層や第VI層から大脳皮質の外(脊髄,脳幹,視床など)へと出力される.大脳皮質のおのおのの領野がそれぞれ特有の機能をもつことに対応して,たとえば,1次運動野では第V層が厚いが1次視覚野では第IV層が厚いなど,おのおのの層の相対的な厚さ(ニューロンの数)は領野により大きく異なる.
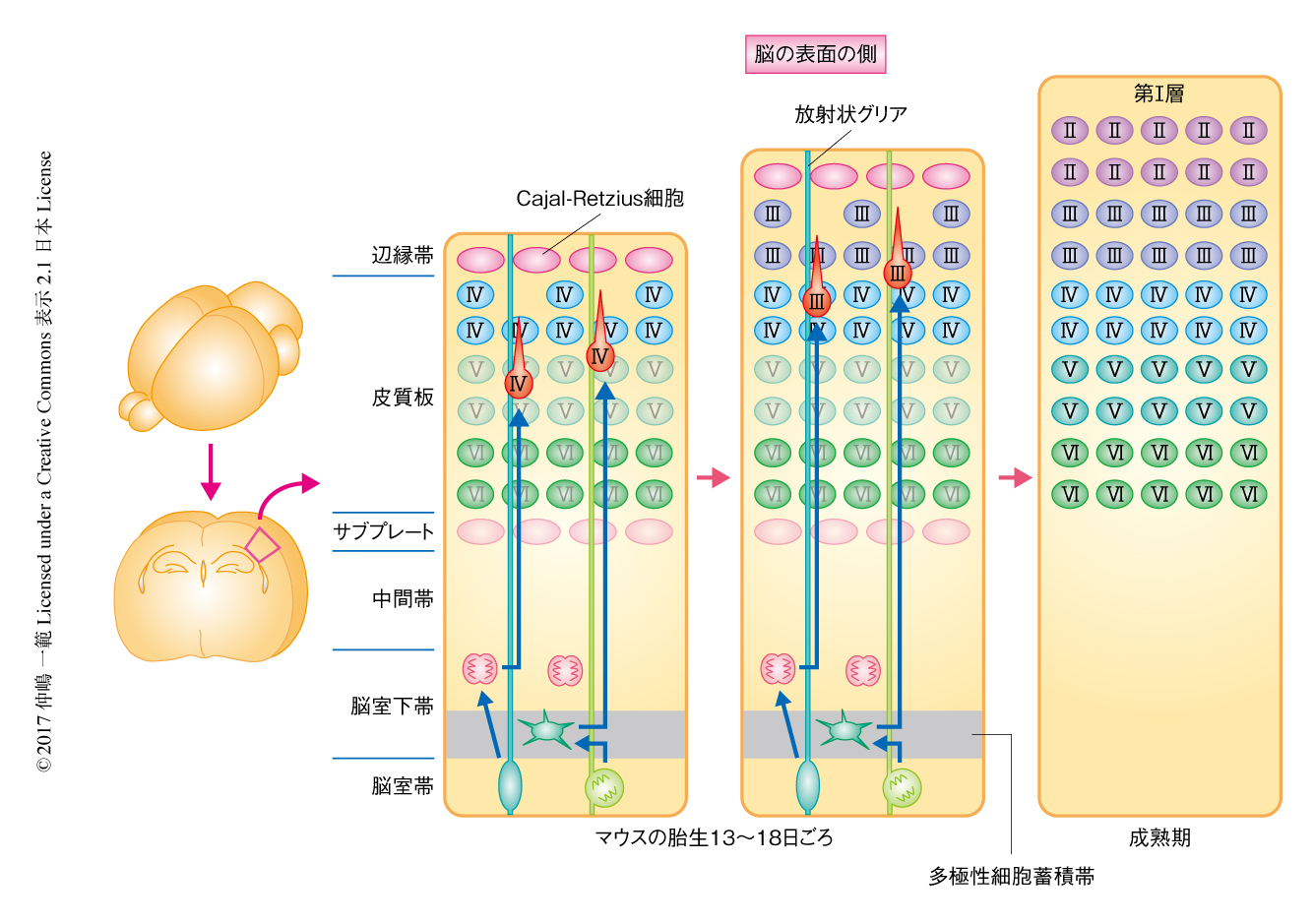
発生期の大脳皮質においては,脳室に面した脳室帯に放射状グリアとよばれる神経幹細胞がならんでおり,それらは脳の表面にとどく長い突起を伸ばしている.ニューロンはこの放射状グリアから直接的あるいは間接的に産生される2,6)(図1).“直接的”に産生されるという意味は,放射状グリアの分裂により生じた娘細胞がそのままニューロンに分化するということである.それらはまず,多極性の形態をとって多くの細い突起を周囲に伸縮しながら脳室帯の直上で一時的に滞留(多極性細胞蓄積帯)したのち,形態を双極性に変化させて脳の表面へとむかう.移動したニューロンは放射状グリアの突起(放射状線維)と接着し,それを足場として移動する(ロコモーションとよばれる移動様式).放射状グリアから産生された娘細胞には分裂能をもったまま脳室帯から離れる細胞もあり,それらの多くは脳室帯に隣接した脳室下帯とよばれる部位において分裂してニューロンを産生する.これが“間接的”なニューロンの産生である.脳室下帯の深部と多極性細胞蓄積帯は重なっている7).
放射状線維にそってロコモーションにより移動してきたニューロンは,その先導突起の先端が脳の表面の直下の辺縁帯(将来の第I層)に到達すると移動様式を変化させる.すなわち,先導突起の先端を辺縁帯に到達させたまま突起を短縮し,細胞体が放射状線維から離れて一気に辺縁帯の直下まで引き上げられ移動をおえると考えられている.この過程はターミナルトランスロケーションとよばれる8)(図2a).将来の第II層~第VI層を構成する興奮性ニューロンはこの過程をつぎつぎにくり返すため,結果として,ニューロンは産生された順に辺縁帯の直下において脳の表面の側に積み上がっていく(“inside-out”様式)(図1).すなわち,おのおのの層を構成するニューロンは神経幹細胞(神経前駆細胞)の分裂によりニューロンとして産生された時期がかなり共通する.この将来の第II層~第VI層のニューロンが配置される部位は発生期においては皮質板とよばれる.
辺縁帯にはいくつかの種類のニューロンが局在するが,その代表的なものがCajal-Retzius細胞とよばれるニューロンである(図1,図2a).Cajal-Retzius細胞はReelinというタンパク質を細胞外に分泌し,“inside-out”様式での層構造の形成の過程を制御する9).Cajal-Retzius細胞は出生ののち早期に消失するといわれており,発生期にのみ一過的に存在する重要なニューロンである.Cajal-Retzius細胞は大脳皮質のニューロンのなかではもっとも初期に産生されるニューロンのひとつであるが,直下の脳室帯に由来するのではなく,大脳皮質の外で産生され脳の表面に平行に移動して大脳皮質に進入する10).
同じくもっとも初期に産生されるニューロンにサブプレートとよばれるニューロンがあり,皮質板のさらに深部に局在する(図1).サブプレートは視床から投射された線維が将来の第IV層のニューロンにとどくまえの一時的な標的になる重要なニューロンであるが,やはり出生ののち早期にほとんどが消失する.残った少数のサブプレートは第VIb層を構成して神経回路ネットワークの一翼を担うが,Cajal-Retzius細胞とならんで大脳皮質の発生に重要な役割を担うニューロンのほとんどが層構造の形成が完了したのち消失することは興味深い.
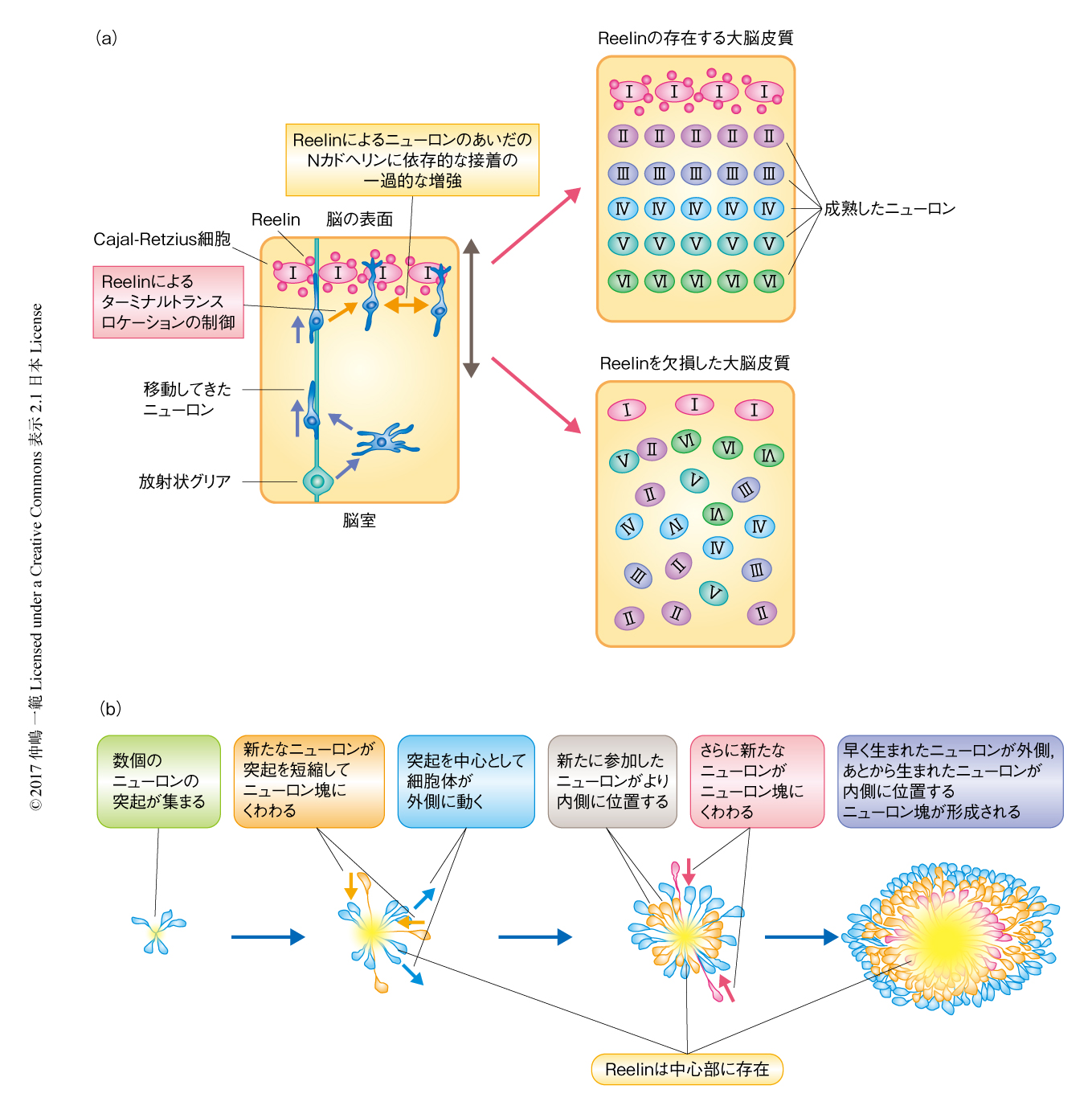
大脳皮質における“inside-out”様式でのニューロンの配置の機構が明らかにされるにあたっては,その過程が破綻した自然発症の突然変異マウスであるreelerマウスの解析が重要な役割を担った.reelerマウスの大脳皮質の層構造は大きく乱れており,全体として逆転する(“outside-in”)という特徴を示すことから(図2a),古くから注目されていた(ただし,実際に典型的な“outside-in”様式がみられるのは大脳皮質の後部のみであり,大脳皮質の前部においては層構造が不明瞭になるといったほうが正確かと思われる).reelerマウスにおいては移動してきたニューロンや移動の足場である放射状グリア線維に異常があると考えるのが古典的な考え方であったが,1995年,その原因遺伝子であるreelin遺伝子が同定され考え方が一変した.reelin遺伝子をおもに発現するニューロンは移動してきたニューロンでも放射状グリアでもなく,辺縁帯のCajal-Retzius細胞であったためである9,11)(図2a).Cajal-Retzius細胞は移動のまさに突き当たりの終点に存在するニューロンであったことから,Reelinは移動してきたニューロンに対する移動停止のシグナルタンパク質であると考えられるようになった.
たしかに,脳の表面にむかって移動してきたニューロンがReelinにふれると停止すると考えれば,“inside-out”様式でのニューロンの配置は理解しやすい.そこでさらに,移動の途中において異所的にReelinを強制発現させる実験が行われた.Reelinが移動停止のシグナルタンパク質であるなら,Reelinにふれて移動を停止したニューロンが渋滞することが期待された.ところが,結果は予想とは異なっていた.移動してきたニューロンはたんに渋滞するのではなく,多くのニューロンを巻き込んできれいな丸い凝集塊を形成したのである12)(図2b).凝集塊の表面はなめらかで,ニューロンは移動能をもって左右に相互の位置を調整しながら集合したとしか考えられなかった.しかも,凝集塊の中心近くからは細胞体が排除され,異所的に発現したReelinがそこに濃縮して局在した.細胞体が排除されたその中心の部分には,集合してきたニューロンの先導突起のみが進入し,それらは樹状突起として成熟していった.すなわち,辺縁帯とよく似た領域が凝集塊の中心部分に形成されたのである.さらに,移動してきたニューロンはこの凝集塊において“inside-out”様式で配置されていた.すなわち,あとからきたニューロンはさきにきていたニューロンを乗り越えて凝集塊の中心のReelin陽性領域に面した位置で移動をおえるという過程がくり返されることにより凝集塊は大きくなることが判明した(図2b).辺縁帯のように,移動してきたニューロンの細胞体が進入しない領域が形成されること,また,その直下(周囲)において“inside-out”様式でニューロンを配置するうえで,髄膜,放射状グリアの先端部,Cajal-Retzius細胞などの脳の表面の近くの構造物は不要であり,Reelinというタンパク質さえあれば“inside-out”様式は再現されることが示された.
異所的に発現したReelinに対し移動してきたニューロンが反応して凝集塊を形成することがわかったが,Reelinの本来の発現部位である辺縁帯の直下において移動してきたニューロンは凝集塊を形成するのだろうか? あらためて脳の切片を観察したところ,たしかに辺縁帯の直下,すなわち,皮質板のもっとも表層の部分に未成熟のニューロンが数十μmの幅で密集した領域が存在することがわかり,原皮質帯(primitive cortical zone:PCZ)と命名された13).
Reelin陽性領域(辺縁帯)には移動してきたニューロンの先導突起は進入できるのになぜ細胞体は進入できないのか,移動してきたニューロンはReelinにふれるとどのようなしくみで凝集塊を形成するのか,さきにきていたニューロンが高密度に凝集した領域をあとからきたニューロンはなぜ容易に通過できるのか,など,今後,解明すべき重要な点がいくつかあるが,異所性の強制発現実験の結果はReelinの生物学的な機能を考えるうえで示唆に富むものと考えられる.
さて,Reelinが単純な移動停止のシグナルではないとして,では,何をしているのであろうか? 移動の途中においてReelinを強制発現させるとニューロンが凝集塊を形成したことから,ニューロンどうしの接着を増強する可能性が考えられた.ただし,異所性の強制発現の実験からは,ニューロンのあいだの接着を増強したという可能性のほか,Reelinにふれたニューロンが周囲の細胞外環境から反発されるように変化して(水の中の油のように)凝集塊を形成したという可能性が否定できない.そこで,胎生期のreelerマウスの大脳皮質のニューロンを分散培養してReelinを添加するという実験が行われた.その結果,たしかにニューロンが凝集塊を形成することが確認され,Reelinはニューロンのあいだの接着を促進する機能をもつことがわかった(図2a).この凝集塊の形成はNカドヘリンを介しており,Nカドヘリンに対するニューロンの接着力がReelinにより増強することは原子間力顕微鏡により直接的に証明された14).この増強は一過的なものであり,しばらくするとReelinを添加するまえのレベルにもどった.接着力の増強が一過的である理由は不明であるが,人為的に増強を持続させるとニューロンの最終的な配置は乱れた.もしかしたら,さきにきていたニューロンが凝集したあいだをあとからきたニューロンが通過できる現象と関係するのかもしれない.
では,そもそも辺縁帯の直下においてわざわざニューロンを一過的に凝集させることにはどのような意義があるのか? 現時点では不明であるが,細胞体どうしが原皮質帯において高密度に接着して凝集すること自体になんらかの生理学的な意義があると想像される.移動してきたニューロンは移動を終了する前後にほぼ丸1日という長時間にわたり原皮質帯にとどまるが,そのあいだに何が起こっているのだろうか?
“ほぼ丸1日”原皮質帯にとどまるということは,さきにきていたニューロンとあとからきたニューロンが原皮質帯において混在することを意味する.それらが別の層に配置されるように,原皮質帯においてニューロンが選別される可能性も想像される.
じつは,少なくとも一部のニューロンに関しては,最終的に配置されるべき層ごとに選別されるよう,移動の途中においてすでに運命づけされていることが,過去の培養実験により示されている.具体的には,辺縁帯の直下に到達するまえの移動しているニューロンを単一の細胞にまで分散したのち,旋回するチューブのなかで懸濁したまま培養する実験が行われた.その培養においては,しだいにひとつの大きな凝集塊が形成されてくるが,その内部の構造を調べた結果,第IV層に配置されるべきニューロンは,それよりさきに産生されたニューロンといっしょに培養した場合も,あるいは,それよりあとに産生されたニューロンといっしょに培養した場合も,いずれも凝集塊の中心近くに選別されて局在した15).このような選別の過程が原皮質帯において起こっている可能性は,今後,検証する価値があると思われる.いずれにしても,新しく産生され移動してきたニューロンのあいだの関係をReelinの制御のもとで適切に構築していくうえで,辺縁帯の直下の原皮質帯という場所は特別な役割をもつと考えられる.
Reelinがニューロンの凝集をひき起こすことは明らかであるが,一方,最近の研究により,ニューロンの移動そのものもReelinにより制御されることがわかってきた.
ロコモーションにより移動してきたニューロンは,最後にターミナルトランスロケーションとよばれる移動様式に変化して移動をおえる.このロコモーションからターミナルトランスロケーションへの移動様式の変換も,じつはReelinによりひき起こされることがわかってきた(図2a).この変換にはReelinの下流においてインテグリンが活性化されることが引き金として必要で16)(新着論文レビュー でも掲載),さらに,Nカドヘリンおよびネクチン-アファディン系も関与する17).コフィリンを介したアクチン細胞骨格系によるニューロンの移動の制御についても報告されている18).ターミナルトランスロケーションによる移動の距離はわずか数十μmであり,皮質壁の全体の厚さ,すなわち,ニューロンが移動する距離の全体からするとわずかであるが,このターミナルトランスロケーションの過程を阻害すると“inside-out”様式でのニューロンの配置は完全に乱れ,さきに産生されたニューロンとあとから産生されたニューロンとが混在して局在するようになった13).このことから,移動の距離としてはわずかであるが,ターミナルトランスロケーションの過程が皮質層の形成において非常に重要なものであることが示唆される.
さて,大脳皮質のおのおのの層にはそれぞれ特徴的なサブタイプのニューロンが局在する.すなわち,個々のニューロンの線維の連絡様式を含む形態や発現するマーカー遺伝子など,おのおのの層ごとに共通する特徴が知られている5).脳室の近くにおいてニューロンとして産生された時期に依存した“inside-out”様式での最終的な配置のパターンをかんがみると,ニューロンとして産生されるタイミングとそれらが最終的に分化するサブタイプとには相関がある.そのため,脳室の近くに存在する神経幹細胞(神経前駆細胞)は,発生が進むにつれしだいにその分化能を変化させ,つぎつぎに異なるサブタイプのニューロン(そののち,さらにグリア細胞)を産生するというわかりやすい考え方が一般に受け入れられてきた19)(図3a).実際に,神経幹細胞(神経前駆細胞)の分化能がしだいに変化する過程を担う細胞に内在性の機構や,それに影響をおよぼす細胞外のシグナルが同定されつつある20,21).
一方,それぞれのサブタイプのニューロンに特異的に発現しマーカーとしても使われるタンパク質はその多くが転写因子であるが,そのなかにはサブタイプの決定そのものの制御にかかわるものが多く含まれることがわかってきた22,23)(たとえば,Tbr1,Fezf2,Ctip2,Satb2,Otx1,Brn1/2,Sox5,CoupTFI,Rorbなど).ところが,これらのなかで神経幹細胞(神経前駆細胞)の段階において発現しはじめるものはごく一部(Brn1/2,Fezf2,Otx1など)にすぎず,ほかはニューロンになってから発現しはじめる.この事実は,神経幹細胞(神経前駆細胞)それ自体が時間に依存的に分化能を変化させるという仮説(図3a)とは必ずしも矛盾しないが,少なくとも,積極的に支持するものではない.逆に,最終的に分裂をおえてニューロンとして分化したのち,あるいは,移動を終了したのちにサブタイプの決定の過程の少なくとも一部が起こっている可能性を想像させる(図3b).
関連するもうひとつの重要な知見として,ニューロンとして誕生してからも,生後の早期までであればサブタイプを人為的に転換しうることが発見された24,25).具体的には,深層のニューロンの分化制御因子であるFezf2を幼若期において浅層のニューロンに強制発現すると,それらは深層のニューロンのサブタイプへと転換した.幼若期のニューロンのサブタイプの決定におけるこの可塑性の発見は,大脳皮質における層構造の形成の過程の理解に大きなインパクトをあたえた.
ニューロンが少なくとも幼若期にはサブタイプの決定に可塑性をもつということにはどのような意義があるのだろうか.そのヒントのひとつは,意外な実験から得られた.特定のニューロンの集団が“層”として集合する機構を明らかにすることを目的として,特定の層に特異的に発現する細胞表面タンパク質が探索された結果,Pcdh20というカドヘリンスーパーファミリーに属するタンパク質が第IV層に特異的に,しかも,ニューロンの移動が終了したのちに発現することが見い出された26).そこで,将来は第IV層に配置されるべきニューロンが正しく第IV層に集合する過程が乱れることを期待してPcdh20を阻害したところ,それらはたんに分散するだけでなく,多くが第II層/第III層に異常に配置された.それらは第IV層のニューロンのマーカーを発現せず,第II層/第III層のニューロンのマーカーを発現した.マーカーだけではなく,軸索の投射様式や細胞の形態なども第II層/第III層のニューロンに特徴的なサブタイプに転換してしまっていた.この結果だけではPcdh20そのものがサブタイプの決定を直接に制御する可能性が否定できないが,ニューロンの移動の過程それ自体に必要な細胞骨格に関連するタンパク質を阻害するなど,Pcdh20とは無関係な別の複数の方法により,本来は第IV層に配置されるべきニューロンを人為的に第II層/第III層に異所的に配置させる実験においても,同様のサブタイプの転換が生じることが確認された.以上の結果は,第IV層のニューロンとして正しく分化するためには,ニューロンが第IV層という場(細胞外環境)に適切に配置されることがきわめて重要であることを物語る26).
本来は第IV層のニューロンとして分化すべきニューロンを正しく分化させるために必要な,第IV層に特異的な(第II層第/III層には存在せず第IV層にのみ存在するという意味での)細胞外環境の実体は何であろうか? 現時点ではまだ分子的な実体は不明であるが,視床から第IV層に進入する軸索が重要な役割を担う可能性が考えられる26).詳細については,今後の研究に期待したい.
以上のように,ニューロンの移動は,ニューロンを適切な場に配置させ特定の層に特異的な細胞外環境に曝露させることにより,特定のサブタイプへの分化を促進するためにも重要な意義をもつことがわかってきた.
哺乳類の発生期の脳において,新しく産生されたニューロンはなぜ長い距離を移動するのか? とくに下等動物にはさほど移動しない種も多くあることを考えると,そこには神経回路を複雑化していくうえで重要ななんらかの進化的な意義がかくれている可能性が考えられる.逆にいうなら,なぜ大脳皮質の神経幹細胞(神経前駆細胞)はその大部分が脳室の近くに局在し,幹細胞(前駆細胞)のまま脳の表面にむけて長い距離を移動していかないのだろうか? 高等動物の大脳皮質は領野が発達しその数が増加したことが特徴のひとつであるが,もしかしたら,そのことと関係がある可能性も想定される.脳回(脳のしわ)が脳の表面の側にのみ形成され,脳室の側には形成されないことにも関係する可能性がある.いろいろ想像をたくましくすると,何か本質的に重要なことがまだみえていない気がしてくる.個々のニューロンの挙動をミクロの目で観察し,シグナルへの反応を追跡して理解するという,これまでの通常の手法とは根本的に異なるアプローチが,その本質の理解には必要なのかもしれない.
略歴:1994年 大阪大学大学院医学研究科 修了,1995年 理化学研究所ライフサイエンス筑波研究センター 研究員,1998年 東京慈恵会医科大学 講師,2001年 同 助教授を経て,2002年より慶應義塾大学医学部 教授.
研究テーマ:大脳皮質の発生および分化の機構.
関心事:大きなゆらぎを許容しつつコアになる機能をロバストに維持できる,脳という不思議なシステムが個体や世代をこえて再現性よく発生するしくみを理解したい.
研究室URL:http://plaza.umin.ac.jp/~Nakajima/
© 2017 仲嶋 一範 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 解剖学教室)
email:仲嶋一範
領域融合レビュー, 6, e004 (2017) DOI: 10.7875/leading.author.6.e004
Kazunori Nakajima: Neuronal migration during layer formation in the cerebral cortex.
要 約
大脳皮質の多層からなる層構造は,脳室の近くにおいて産生された興奮性ニューロンが脳の表面へとつぎつぎと移動することにより形成される.新しく産生されたニューロンはさきに産生されたニューロンを追い越し辺縁帯の直下にて移動をおえるため,層構造は“inside-out”様式をもって形成される.この層構造の形成においては辺縁帯に局在するCajal-Retzius細胞から分泌されるReelinが重要な役割をはたし,Reelinが欠損すると層構造は全体として逆転してしまう.これまで,Reelinはたんに移動してきたニューロンを停止させるシグナルタンパク質であると考えられがちであったが,それでは説明のつかない現象がつぎつぎにみつかってきた.近年の研究においては,Reelinは移動の終点の近くにおいてニューロンの移動様式の変換を促進すること,細胞骨格を制御すること,さらに,そののちにニューロンを集合させる機能をもつことなどが明らかにされた.また,最近,産生されたばかりのニューロンはサブタイプの決定において可塑性をもつことが明らかにされ,ニューロンの移動により適切に配置された場所において特殊な細胞外環境に曝露されることにより,その場所に応じた特異的なサブタイプに分化するよう制御されるしくみの存在が示された.
はじめに
脳においてニューロンは一般にランダムに散在するわけではなく,共通の特徴をもつニューロンが集合してグループをつくり局在する.すなわち,大脳皮質や小脳皮質などのニューロンは脳の表面の近くに層構造を形成し,脳幹などでは神経核とよばれるニューロンの集団を脳の深部につくる.これらのニューロンは,哺乳類においては一般に最終的に配置される部位とは異なる場所にて産生され,そののち移動して,遠く離れた部位において層構造や神経核の構造を形成する.脳の発生過程においてこの構造が乱れると,さまざまな精神神経疾患の発症リスクが高まる可能性が指摘されている1).
なぜ哺乳類の脳のニューロンは産生された部位から移動してから構造を形成するのだろうか? 近年の研究により,脳という組織を構築するうえでニューロンが活発に移動することの意義が垣間みえてきた.ニューロンの移動という過程により細胞のあいだの関係をリセットし,適切な制御のもとニューロンのあいだの新しい関係を構築することを可能にするという点が,その意義のひとつと考えられる.また,ニューロンを移動させることにより特殊な細胞外環境に曝露させ,コンテキストに依存的な成熟を可能にするという意義もあると考えられる.
以下においては,まず,発生期の大脳皮質においてニューロンの移動により層構造が形成される過程について解説する.つづいて,最近,ニューロンの移動はおのおのの層に特異的なサブタイプに適切に分化するうえでも重要な役割をもつことが明らかにされてきたので,それについての知見を紹介する.なお,このレビューにおいては簡単のため“大脳皮質”とよぶが,実際には多くの研究はマウスの“大脳新皮質”で行われ得られてきた知見である.
1.大脳皮質の発生期におけるニューロンの移動および“inside-out”様式での層構造の形成
大脳皮質のニューロンには,大きく分けて興奮性ニューロンと抑制性ニューロンの2種類が存在する.興奮性ニューロンは大脳皮質の脳室の近くにおいて産生され,脳の表面にむかって放射状に(法線の方向に)移動するのに対し,抑制性ニューロンは大脳皮質の外(腹側終脳あるいは間脳の一部)において産生され,脳の表面に平行に(接線の方向に)移動して大脳皮質に進入する.それらの移動様式の詳細については最近のいくつかの総説において詳述されているので2-4),ここでは概要のみを解説する.
完成した大脳(新)皮質は脳の表面に平行な6つの層(第I層~第VI層)からなる層構造をもつ.おのおのの層はそれぞれに含まれる代表的なニューロンの形態や軸索投射の様式により特徴づけられ5),たとえば,第IV層はおもに視床から大脳皮質への入力をうける比較的小さな星状のニューロンから構成され,第II層/第III層は大脳皮質の領野のあいだを連絡する錐体細胞がおもな構成ニューロンである.大脳皮質において処理された情報は,第V層や第VI層から大脳皮質の外(脊髄,脳幹,視床など)へと出力される.大脳皮質のおのおのの領野がそれぞれ特有の機能をもつことに対応して,たとえば,1次運動野では第V層が厚いが1次視覚野では第IV層が厚いなど,おのおのの層の相対的な厚さ(ニューロンの数)は領野により大きく異なる.
発生期の大脳皮質においては,脳室に面した脳室帯に放射状グリアとよばれる神経幹細胞がならんでおり,それらは脳の表面にとどく長い突起を伸ばしている.ニューロンはこの放射状グリアから直接的あるいは間接的に産生される2,6)(図1).“直接的”に産生されるという意味は,放射状グリアの分裂により生じた娘細胞がそのままニューロンに分化するということである.それらはまず,多極性の形態をとって多くの細い突起を周囲に伸縮しながら脳室帯の直上で一時的に滞留(多極性細胞蓄積帯)したのち,形態を双極性に変化させて脳の表面へとむかう.移動したニューロンは放射状グリアの突起(放射状線維)と接着し,それを足場として移動する(ロコモーションとよばれる移動様式).放射状グリアから産生された娘細胞には分裂能をもったまま脳室帯から離れる細胞もあり,それらの多くは脳室帯に隣接した脳室下帯とよばれる部位において分裂してニューロンを産生する.これが“間接的”なニューロンの産生である.脳室下帯の深部と多極性細胞蓄積帯は重なっている7).
放射状線維にそってロコモーションにより移動してきたニューロンは,その先導突起の先端が脳の表面の直下の辺縁帯(将来の第I層)に到達すると移動様式を変化させる.すなわち,先導突起の先端を辺縁帯に到達させたまま突起を短縮し,細胞体が放射状線維から離れて一気に辺縁帯の直下まで引き上げられ移動をおえると考えられている.この過程はターミナルトランスロケーションとよばれる8)(図2a).将来の第II層~第VI層を構成する興奮性ニューロンはこの過程をつぎつぎにくり返すため,結果として,ニューロンは産生された順に辺縁帯の直下において脳の表面の側に積み上がっていく(“inside-out”様式)(図1).すなわち,おのおのの層を構成するニューロンは神経幹細胞(神経前駆細胞)の分裂によりニューロンとして産生された時期がかなり共通する.この将来の第II層~第VI層のニューロンが配置される部位は発生期においては皮質板とよばれる.
辺縁帯にはいくつかの種類のニューロンが局在するが,その代表的なものがCajal-Retzius細胞とよばれるニューロンである(図1,図2a).Cajal-Retzius細胞はReelinというタンパク質を細胞外に分泌し,“inside-out”様式での層構造の形成の過程を制御する9).Cajal-Retzius細胞は出生ののち早期に消失するといわれており,発生期にのみ一過的に存在する重要なニューロンである.Cajal-Retzius細胞は大脳皮質のニューロンのなかではもっとも初期に産生されるニューロンのひとつであるが,直下の脳室帯に由来するのではなく,大脳皮質の外で産生され脳の表面に平行に移動して大脳皮質に進入する10).
同じくもっとも初期に産生されるニューロンにサブプレートとよばれるニューロンがあり,皮質板のさらに深部に局在する(図1).サブプレートは視床から投射された線維が将来の第IV層のニューロンにとどくまえの一時的な標的になる重要なニューロンであるが,やはり出生ののち早期にほとんどが消失する.残った少数のサブプレートは第VIb層を構成して神経回路ネットワークの一翼を担うが,Cajal-Retzius細胞とならんで大脳皮質の発生に重要な役割を担うニューロンのほとんどが層構造の形成が完了したのち消失することは興味深い.
2.移動してきたニューロンの辺縁帯の直下における集合および選別
大脳皮質における“inside-out”様式でのニューロンの配置の機構が明らかにされるにあたっては,その過程が破綻した自然発症の突然変異マウスであるreelerマウスの解析が重要な役割を担った.reelerマウスの大脳皮質の層構造は大きく乱れており,全体として逆転する(“outside-in”)という特徴を示すことから(図2a),古くから注目されていた(ただし,実際に典型的な“outside-in”様式がみられるのは大脳皮質の後部のみであり,大脳皮質の前部においては層構造が不明瞭になるといったほうが正確かと思われる).reelerマウスにおいては移動してきたニューロンや移動の足場である放射状グリア線維に異常があると考えるのが古典的な考え方であったが,1995年,その原因遺伝子であるreelin遺伝子が同定され考え方が一変した.reelin遺伝子をおもに発現するニューロンは移動してきたニューロンでも放射状グリアでもなく,辺縁帯のCajal-Retzius細胞であったためである9,11)(図2a).Cajal-Retzius細胞は移動のまさに突き当たりの終点に存在するニューロンであったことから,Reelinは移動してきたニューロンに対する移動停止のシグナルタンパク質であると考えられるようになった.
たしかに,脳の表面にむかって移動してきたニューロンがReelinにふれると停止すると考えれば,“inside-out”様式でのニューロンの配置は理解しやすい.そこでさらに,移動の途中において異所的にReelinを強制発現させる実験が行われた.Reelinが移動停止のシグナルタンパク質であるなら,Reelinにふれて移動を停止したニューロンが渋滞することが期待された.ところが,結果は予想とは異なっていた.移動してきたニューロンはたんに渋滞するのではなく,多くのニューロンを巻き込んできれいな丸い凝集塊を形成したのである12)(図2b).凝集塊の表面はなめらかで,ニューロンは移動能をもって左右に相互の位置を調整しながら集合したとしか考えられなかった.しかも,凝集塊の中心近くからは細胞体が排除され,異所的に発現したReelinがそこに濃縮して局在した.細胞体が排除されたその中心の部分には,集合してきたニューロンの先導突起のみが進入し,それらは樹状突起として成熟していった.すなわち,辺縁帯とよく似た領域が凝集塊の中心部分に形成されたのである.さらに,移動してきたニューロンはこの凝集塊において“inside-out”様式で配置されていた.すなわち,あとからきたニューロンはさきにきていたニューロンを乗り越えて凝集塊の中心のReelin陽性領域に面した位置で移動をおえるという過程がくり返されることにより凝集塊は大きくなることが判明した(図2b).辺縁帯のように,移動してきたニューロンの細胞体が進入しない領域が形成されること,また,その直下(周囲)において“inside-out”様式でニューロンを配置するうえで,髄膜,放射状グリアの先端部,Cajal-Retzius細胞などの脳の表面の近くの構造物は不要であり,Reelinというタンパク質さえあれば“inside-out”様式は再現されることが示された.
異所的に発現したReelinに対し移動してきたニューロンが反応して凝集塊を形成することがわかったが,Reelinの本来の発現部位である辺縁帯の直下において移動してきたニューロンは凝集塊を形成するのだろうか? あらためて脳の切片を観察したところ,たしかに辺縁帯の直下,すなわち,皮質板のもっとも表層の部分に未成熟のニューロンが数十μmの幅で密集した領域が存在することがわかり,原皮質帯(primitive cortical zone:PCZ)と命名された13).
Reelin陽性領域(辺縁帯)には移動してきたニューロンの先導突起は進入できるのになぜ細胞体は進入できないのか,移動してきたニューロンはReelinにふれるとどのようなしくみで凝集塊を形成するのか,さきにきていたニューロンが高密度に凝集した領域をあとからきたニューロンはなぜ容易に通過できるのか,など,今後,解明すべき重要な点がいくつかあるが,異所性の強制発現実験の結果はReelinの生物学的な機能を考えるうえで示唆に富むものと考えられる.
さて,Reelinが単純な移動停止のシグナルではないとして,では,何をしているのであろうか? 移動の途中においてReelinを強制発現させるとニューロンが凝集塊を形成したことから,ニューロンどうしの接着を増強する可能性が考えられた.ただし,異所性の強制発現の実験からは,ニューロンのあいだの接着を増強したという可能性のほか,Reelinにふれたニューロンが周囲の細胞外環境から反発されるように変化して(水の中の油のように)凝集塊を形成したという可能性が否定できない.そこで,胎生期のreelerマウスの大脳皮質のニューロンを分散培養してReelinを添加するという実験が行われた.その結果,たしかにニューロンが凝集塊を形成することが確認され,Reelinはニューロンのあいだの接着を促進する機能をもつことがわかった(図2a).この凝集塊の形成はNカドヘリンを介しており,Nカドヘリンに対するニューロンの接着力がReelinにより増強することは原子間力顕微鏡により直接的に証明された14).この増強は一過的なものであり,しばらくするとReelinを添加するまえのレベルにもどった.接着力の増強が一過的である理由は不明であるが,人為的に増強を持続させるとニューロンの最終的な配置は乱れた.もしかしたら,さきにきていたニューロンが凝集したあいだをあとからきたニューロンが通過できる現象と関係するのかもしれない.
では,そもそも辺縁帯の直下においてわざわざニューロンを一過的に凝集させることにはどのような意義があるのか? 現時点では不明であるが,細胞体どうしが原皮質帯において高密度に接着して凝集すること自体になんらかの生理学的な意義があると想像される.移動してきたニューロンは移動を終了する前後にほぼ丸1日という長時間にわたり原皮質帯にとどまるが,そのあいだに何が起こっているのだろうか?
“ほぼ丸1日”原皮質帯にとどまるということは,さきにきていたニューロンとあとからきたニューロンが原皮質帯において混在することを意味する.それらが別の層に配置されるように,原皮質帯においてニューロンが選別される可能性も想像される.
じつは,少なくとも一部のニューロンに関しては,最終的に配置されるべき層ごとに選別されるよう,移動の途中においてすでに運命づけされていることが,過去の培養実験により示されている.具体的には,辺縁帯の直下に到達するまえの移動しているニューロンを単一の細胞にまで分散したのち,旋回するチューブのなかで懸濁したまま培養する実験が行われた.その培養においては,しだいにひとつの大きな凝集塊が形成されてくるが,その内部の構造を調べた結果,第IV層に配置されるべきニューロンは,それよりさきに産生されたニューロンといっしょに培養した場合も,あるいは,それよりあとに産生されたニューロンといっしょに培養した場合も,いずれも凝集塊の中心近くに選別されて局在した15).このような選別の過程が原皮質帯において起こっている可能性は,今後,検証する価値があると思われる.いずれにしても,新しく産生され移動してきたニューロンのあいだの関係をReelinの制御のもとで適切に構築していくうえで,辺縁帯の直下の原皮質帯という場所は特別な役割をもつと考えられる.
3.ニューロンの移動もReelinにより制御される
Reelinがニューロンの凝集をひき起こすことは明らかであるが,一方,最近の研究により,ニューロンの移動そのものもReelinにより制御されることがわかってきた.
ロコモーションにより移動してきたニューロンは,最後にターミナルトランスロケーションとよばれる移動様式に変化して移動をおえる.このロコモーションからターミナルトランスロケーションへの移動様式の変換も,じつはReelinによりひき起こされることがわかってきた(図2a).この変換にはReelinの下流においてインテグリンが活性化されることが引き金として必要で16)(新着論文レビュー でも掲載),さらに,Nカドヘリンおよびネクチン-アファディン系も関与する17).コフィリンを介したアクチン細胞骨格系によるニューロンの移動の制御についても報告されている18).ターミナルトランスロケーションによる移動の距離はわずか数十μmであり,皮質壁の全体の厚さ,すなわち,ニューロンが移動する距離の全体からするとわずかであるが,このターミナルトランスロケーションの過程を阻害すると“inside-out”様式でのニューロンの配置は完全に乱れ,さきに産生されたニューロンとあとから産生されたニューロンとが混在して局在するようになった13).このことから,移動の距離としてはわずかであるが,ターミナルトランスロケーションの過程が皮質層の形成において非常に重要なものであることが示唆される.
4.ニューロンの特異的なサブタイプへの分化における細胞移動の意義
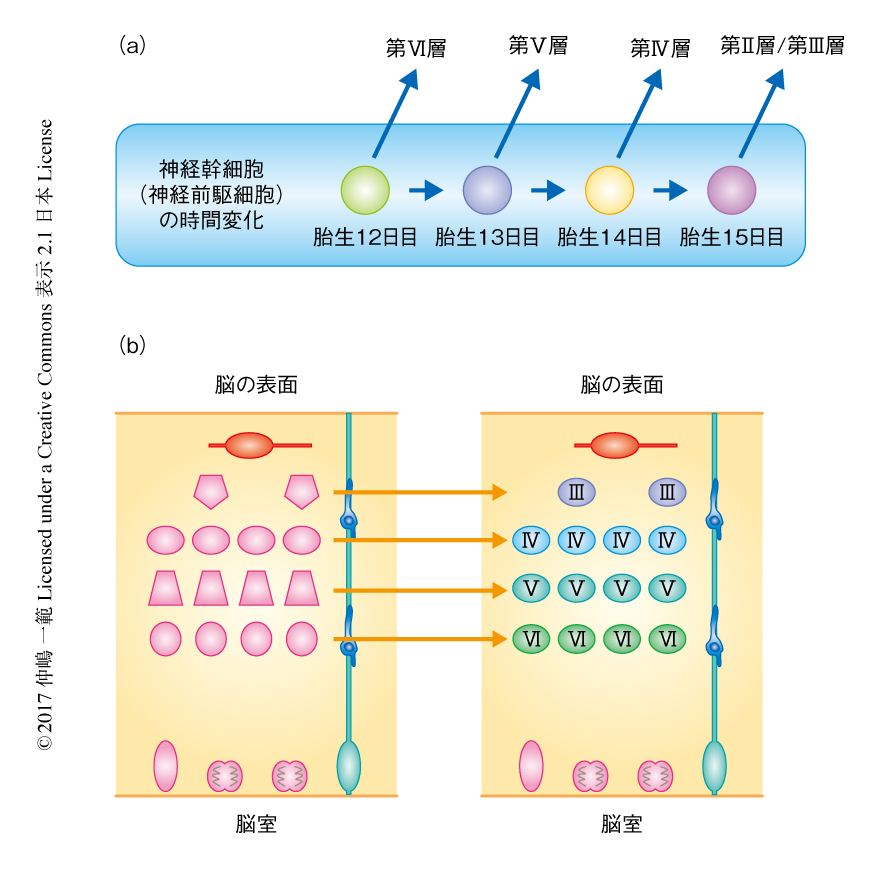
さて,大脳皮質のおのおのの層にはそれぞれ特徴的なサブタイプのニューロンが局在する.すなわち,個々のニューロンの線維の連絡様式を含む形態や発現するマーカー遺伝子など,おのおのの層ごとに共通する特徴が知られている5).脳室の近くにおいてニューロンとして産生された時期に依存した“inside-out”様式での最終的な配置のパターンをかんがみると,ニューロンとして産生されるタイミングとそれらが最終的に分化するサブタイプとには相関がある.そのため,脳室の近くに存在する神経幹細胞(神経前駆細胞)は,発生が進むにつれしだいにその分化能を変化させ,つぎつぎに異なるサブタイプのニューロン(そののち,さらにグリア細胞)を産生するというわかりやすい考え方が一般に受け入れられてきた19)(図3a).実際に,神経幹細胞(神経前駆細胞)の分化能がしだいに変化する過程を担う細胞に内在性の機構や,それに影響をおよぼす細胞外のシグナルが同定されつつある20,21).
一方,それぞれのサブタイプのニューロンに特異的に発現しマーカーとしても使われるタンパク質はその多くが転写因子であるが,そのなかにはサブタイプの決定そのものの制御にかかわるものが多く含まれることがわかってきた22,23)(たとえば,Tbr1,Fezf2,Ctip2,Satb2,Otx1,Brn1/2,Sox5,CoupTFI,Rorbなど).ところが,これらのなかで神経幹細胞(神経前駆細胞)の段階において発現しはじめるものはごく一部(Brn1/2,Fezf2,Otx1など)にすぎず,ほかはニューロンになってから発現しはじめる.この事実は,神経幹細胞(神経前駆細胞)それ自体が時間に依存的に分化能を変化させるという仮説(図3a)とは必ずしも矛盾しないが,少なくとも,積極的に支持するものではない.逆に,最終的に分裂をおえてニューロンとして分化したのち,あるいは,移動を終了したのちにサブタイプの決定の過程の少なくとも一部が起こっている可能性を想像させる(図3b).
関連するもうひとつの重要な知見として,ニューロンとして誕生してからも,生後の早期までであればサブタイプを人為的に転換しうることが発見された24,25).具体的には,深層のニューロンの分化制御因子であるFezf2を幼若期において浅層のニューロンに強制発現すると,それらは深層のニューロンのサブタイプへと転換した.幼若期のニューロンのサブタイプの決定におけるこの可塑性の発見は,大脳皮質における層構造の形成の過程の理解に大きなインパクトをあたえた.
ニューロンが少なくとも幼若期にはサブタイプの決定に可塑性をもつということにはどのような意義があるのだろうか.そのヒントのひとつは,意外な実験から得られた.特定のニューロンの集団が“層”として集合する機構を明らかにすることを目的として,特定の層に特異的に発現する細胞表面タンパク質が探索された結果,Pcdh20というカドヘリンスーパーファミリーに属するタンパク質が第IV層に特異的に,しかも,ニューロンの移動が終了したのちに発現することが見い出された26).そこで,将来は第IV層に配置されるべきニューロンが正しく第IV層に集合する過程が乱れることを期待してPcdh20を阻害したところ,それらはたんに分散するだけでなく,多くが第II層/第III層に異常に配置された.それらは第IV層のニューロンのマーカーを発現せず,第II層/第III層のニューロンのマーカーを発現した.マーカーだけではなく,軸索の投射様式や細胞の形態なども第II層/第III層のニューロンに特徴的なサブタイプに転換してしまっていた.この結果だけではPcdh20そのものがサブタイプの決定を直接に制御する可能性が否定できないが,ニューロンの移動の過程それ自体に必要な細胞骨格に関連するタンパク質を阻害するなど,Pcdh20とは無関係な別の複数の方法により,本来は第IV層に配置されるべきニューロンを人為的に第II層/第III層に異所的に配置させる実験においても,同様のサブタイプの転換が生じることが確認された.以上の結果は,第IV層のニューロンとして正しく分化するためには,ニューロンが第IV層という場(細胞外環境)に適切に配置されることがきわめて重要であることを物語る26).
本来は第IV層のニューロンとして分化すべきニューロンを正しく分化させるために必要な,第IV層に特異的な(第II層第/III層には存在せず第IV層にのみ存在するという意味での)細胞外環境の実体は何であろうか? 現時点ではまだ分子的な実体は不明であるが,視床から第IV層に進入する軸索が重要な役割を担う可能性が考えられる26).詳細については,今後の研究に期待したい.
以上のように,ニューロンの移動は,ニューロンを適切な場に配置させ特定の層に特異的な細胞外環境に曝露させることにより,特定のサブタイプへの分化を促進するためにも重要な意義をもつことがわかってきた.
おわりに
哺乳類の発生期の脳において,新しく産生されたニューロンはなぜ長い距離を移動するのか? とくに下等動物にはさほど移動しない種も多くあることを考えると,そこには神経回路を複雑化していくうえで重要ななんらかの進化的な意義がかくれている可能性が考えられる.逆にいうなら,なぜ大脳皮質の神経幹細胞(神経前駆細胞)はその大部分が脳室の近くに局在し,幹細胞(前駆細胞)のまま脳の表面にむけて長い距離を移動していかないのだろうか? 高等動物の大脳皮質は領野が発達しその数が増加したことが特徴のひとつであるが,もしかしたら,そのことと関係がある可能性も想定される.脳回(脳のしわ)が脳の表面の側にのみ形成され,脳室の側には形成されないことにも関係する可能性がある.いろいろ想像をたくましくすると,何か本質的に重要なことがまだみえていない気がしてくる.個々のニューロンの挙動をミクロの目で観察し,シグナルへの反応を追跡して理解するという,これまでの通常の手法とは根本的に異なるアプローチが,その本質の理解には必要なのかもしれない.
文 献
- Ishii, K., Kubo, K. I. & Nakajima, K.: Reelin and neuropsychiatric disorders. Front. Cell. Neurosci., 10, 229 (2016)[PubMed]
- Sekine, K., Tabata, H. & Nakajima, K.: Cell polarity and initiation of migration. in Comprehensive Developmental Neuroscience: Cellular Migration and Formation of Neuronal Connections (Rubenstein, J. & Rakic, P. eds.), pp. 231-244, Academic Press, San Diego (2013)
- 仲嶋一範: ニューロンの移動と層および神経核の形成. 脳の発生学:ニューロンの誕生・分化・回路形成 (宮田卓樹, 山本亘彦 編), pp. 53-71, 化学同人 (2013)
- 村上富士夫: 脳における神経細胞移動とその制御機構. 生化学, 88, 161-170 (2016)
- Lodato, S. & Arlotta, P.: Generating neuronal diversity in the mammalian cerebral cortex. Annu. Rev. Cell Dev. Biol., 31, 699-720 (2015)[PubMed]
- 仲嶋一範: 発生期大脳皮質における移動神経細胞のダイナミクス. ブレインサイエンス・レビュー2009 (伊藤正男, 川合述史 編), pp. 207-232, クバプロ (2009)
- Tabata, H., Yoshinaga, S. & Nakajima, K.: Cytoarchitecture of mouse and human subventricular zone in developing cerebral neocortex. Exp. Brain Res., 216, 161-168 (2012)[PubMed]
- Nadarajah, B., Brunstrom, J. E., Grutzendler, J. et al.: Two modes of radial migration in early development of the cerebral cortex. Nat. Neurosci., 4, 143-150 (2001)[PubMed]
- 仲嶋一範: 大脳新皮質の層形成過程におけるリーリンの役割. BRAIN and NERVE, 68, 931-937 (2016)
- Nakajima, K.: Control of tangential/non-radial migration of neurons in the developing cerebral cortex. Neurochem. Int., 51, 121-131 (2007)[PubMed]
- Sekine, K., Kubo, K. & Nakajima, K.: How does Reelin control neuronal migration and layer formation in the developing mammalian neocortex? Neurosci. Res., 86, 50-58 (2014)[PubMed]
- Kubo, K., Honda, T., Tomita, K. et al.: Ectopic Reelin induces neuronal aggregation with a normal birthdate-dependent "inside-out" alignment in the developing neocortex. J. Neurosci., 30, 10953-10966 (2010)[PubMed]
- Sekine, K., Honda, T., Kawauchi, T. et al.: The outermost region of the developing cortical plate is crucial for both the switch of the radial migration mode and the Dab1-dependent "inside-out" lamination in the neocortex. J. Neurosci., 31, 9426-9439 (2011)[PubMed]
- Matsunaga, Y., Noda, M., Murakawa, H. et al.: Reelin transiently promotes N-cadherin-dependent neuronal adhesion during mouse cortical development. Proc. Natl. Acad. Sci. USA, 114, 2048-2053 (2017)[PubMed]
- Ajioka, I. & Nakajima, K.: Birth-date-dependent segregation of the mouse cerebral cortical neurons in reaggregation cultures. Eur. J. Neurosci., 22, 331-342 (2005)[PubMed]
- Sekine, K., Kawauchi, T., Kubo, K. et al.: Reelin controls neuronal positioning by promoting cell-matrix adhesion via inside-out activation of integrin α5β1. Neuron, 76, 353-369 (2012)[PubMed] [新着論文レビュー]
- Gil-Sanz, C., Franco, S. J., Martinez-Garay, I. et al.: Cajal-Retzius cells instruct neuronal migration by coincidence signaling between secreted and contact-dependent guidance cues. Neuron, 79, 461-477 (2013)[PubMed]
- Chai, X., Zhao, S., Fan, L. et al.: Reelin and cofilin cooperate during the migration of cortical neurons: a quantitative morphological analysis. Development, 143, 1029-1040 (2016)[PubMed]
- Dehay, C. & Kennedy, H.: Cell-cycle control and cortical development. Nat. Rev. Neurosci., 8, 438-450 (2007)[PubMed]
- 坂井星辰, 岸 雄介: 分化細胞からのシグナル伝達による神経系前駆細胞の分化運命制御. 生体の科学, 68, 9-13 (2017)
- 當麻憲一, 花嶋かりな: 大脳皮質層ニューロンの分化と統合メ力ニズム. 生体の科学, 68, 19-23 (2017)
- 大石康二, 仲嶋一範: 大脳皮質層形成における未成熟ニューロンのサフタイプ決定機構. 生体の科学, 68, 14-18 (2017)
- Oishi, K., Aramaki, M. & Nakajima, K.: Mutually repressive interaction between Brn1/2 and Rorb contributes to the establishment of neocortical layer 2/3 and layer 4. Proc. Natl. Acad. Sci. USA, 113, 3371-3376 (2016)[PubMed]
- Rouaux, C. & Arlotta, P.: Direct lineage reprogramming of post-mitotic callosal neurons into corticofugal neurons in vivo. Nat. Cell Biol., 15, 214-221 (2013)[PubMed]
- De la Rossa, A., Bellone, C., Golding, B. et al.: In vivo reprogramming of circuit connectivity in postmitotic neocortical neurons. Nat. Neurosci., 16, 193-200 (2013)[PubMed]
- Oishi, K., Nakagawa, N., Tachikawa, K. et al.: Identity of neocortical layer 4 neurons is specified through correct positioning into the cortex. Elife, 5, e10907 (2016)[PubMed]
著者プロフィール
略歴:1994年 大阪大学大学院医学研究科 修了,1995年 理化学研究所ライフサイエンス筑波研究センター 研究員,1998年 東京慈恵会医科大学 講師,2001年 同 助教授を経て,2002年より慶應義塾大学医学部 教授.
研究テーマ:大脳皮質の発生および分化の機構.
関心事:大きなゆらぎを許容しつつコアになる機能をロバストに維持できる,脳という不思議なシステムが個体や世代をこえて再現性よく発生するしくみを理解したい.
研究室URL:http://plaza.umin.ac.jp/~Nakajima/
© 2017 仲嶋 一範 Licensed under CC 表示 2.1 日本