がんに対するキメラ抗原受容体発現T細胞療法の最前線
2017/07/12
保仙 直毅
(大阪大学大学院医学系研究科 癌幹細胞制御学講座)
email:保仙直毅
領域融合レビュー, 6, e005 (2017) DOI: 10.7875/leading.author.6.e005
Naoki Hosen: Recent advances in chimeric antigen receptor T cell therapy against cancer.

筆者らは,がん幹細胞の抗原の同定,そして,それに対するモノクローナル抗体療法の開発を大きな目標として研究してきた.近年,モノクローナル抗体を応用した新たながん免疫療法として注目されているのが,キメラ抗原受容体発現T細胞による治療法である.キメラ抗原受容体発現T細胞は,がんに特異的な抗体の抗原認識部位,補助刺激受容体,CD3ζ鎖を融合して作製したキメラ抗原受容体をT細胞に発現させたものである.キメラ抗原受容体発現T細胞はがんに特異的な抗原を認識して活性化し,がん細胞を傷害するのみならず,体内において大量に増殖する.つまり,抗体医薬の高い特異性と,細胞療法の強い細胞傷害活性および増殖活性をあわせもつ非常に強力な治療法である.すでにCD19を標的としたキメラ抗原受容体発現T細胞は臨床においてその有効性が十分に示されており,強い副作用についても解決されつつある.今後,さまざまながんに対する治療法のひとつになりうると考えられ,精力的に研究が進められている.
がん免疫療法は従来の抗がん剤とは作用機序が異なり,静止期にあるがん幹細胞をも傷害できる可能性が高い.なかでも,モノクローナル抗体を用いた抗体療法はその特異性の高さと強い抗がん活性により,すでにがんの治療の中心のひとつになっている.以前より,筆者らは,がん幹細胞に特異的に発現する細胞表面抗原を同定し,それを標的とした抗体療法を開発することを目標に研究を進めてきた.これまでに,急性骨髄性白血病の幹細胞の抗原としてCD96,多発性骨髄腫の前駆細胞を含む骨髄腫クローンの全体に発現する抗原としてCD48が同定され,とくにCD48に対する抗体は製剤化が進み,現在,抗体-薬物複合体のかたちで治験が開始されようとしている.さらに,近年では,抗体療法とT細胞療法の両方の特徴をあわせもつ“キメラ抗原受容体発現T細胞”(chimeric antigen receptor T cell,CAR T細胞)による治療法の開発が進んでいる.このレビューにおいては,これまでの筆者らによる研究の流れを紹介し,さらに,キメラ抗原受容体発現T細胞療法の現況および今後の課題について解説する.
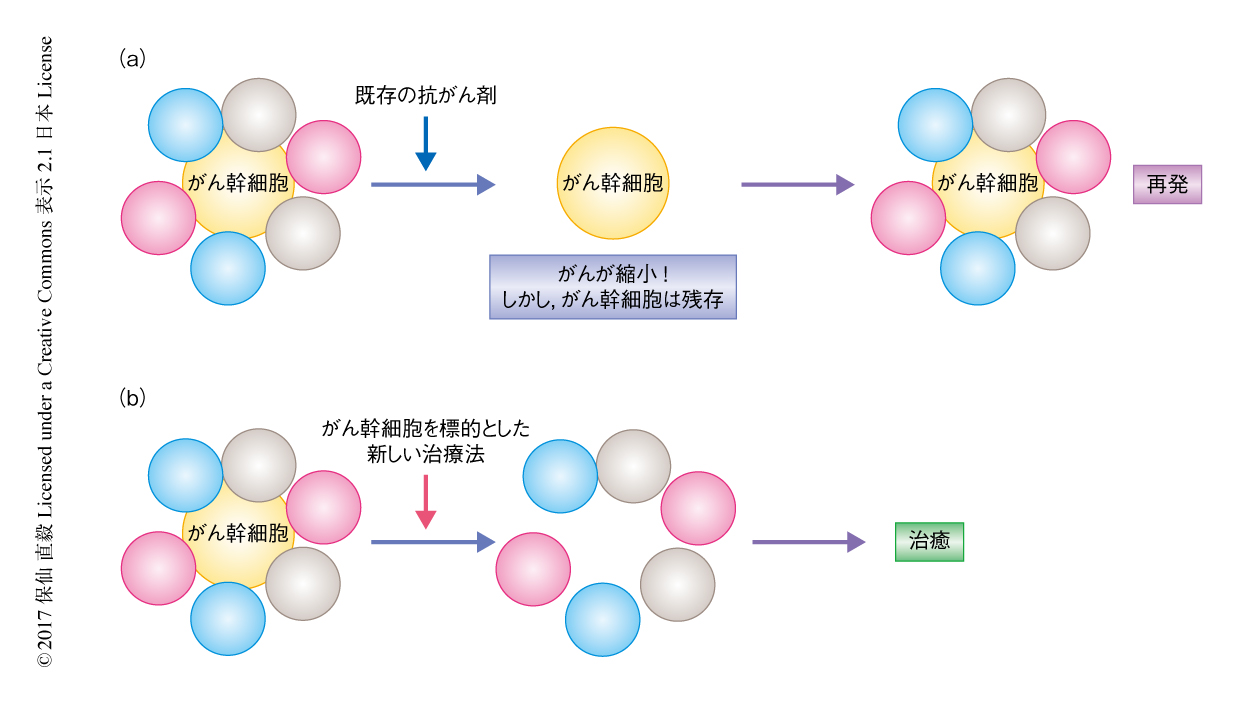
がん幹細胞とは,正常な幹細胞と同様に自己複製能と(多)分化能とをあわせもつがん細胞である.がん幹細胞という概念は古くから存在していたが,1990年代半ば以降,免疫不全マウスを用いた異種移植実験系の進歩にともない研究の対象および創薬における標的となった(図1).1997年,急性骨髄性白血病において,免疫不全マウスに生着し白血病を再構築しうる白血病の幹細胞が正常な造血幹細胞と同じCD34陽性CD38陰性画分に存在すると報告された1).つまり,CD34陽性CD38陰性の白血病の幹細胞こそが急性骨髄性白血病の源であり,それを排除しないかぎり白血病は治癒しないと考えられるようになって,そののち,さまざまながんにおいてつぎつぎとがん幹細胞が同定された.固形がんのがん幹細胞を免疫不全マウスへの生着により定義することについてはいまだ多くの議論があり,その意義は定まっていないが,がんの根治をめざすための概念としてがん幹細胞を標的とした治療法が開発されるべきであることは疑うまでもない.
既存の治療薬により排除できないがん幹細胞を根絶するための戦略として,抗体療法はきわめて有望である(図2).実際,抗CD20抗体(リツキシマブ)をはじめとするモノクローナル抗体は悪性の血液がんの治癒率の向上に大きく貢献した.白血病幹細胞に対する標的抗原の同定はさかんに進められ,CD47,Tim3 2),M-CSFR 3),CLL-1,CD123,CD44などさまざまな候補があげられて,実用化にむけ開発が進んでいる.筆者らも,CD96が白血病の幹細胞に特異的な抗原であることを見い出した4).
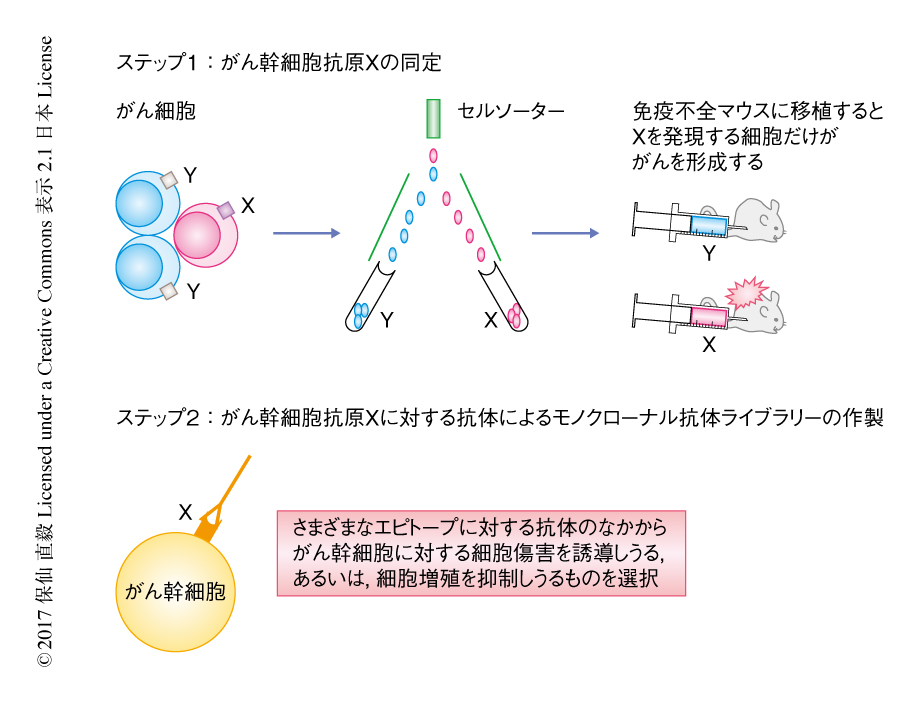
ひきつづいて,筆者らは,多発性骨髄腫におけるがん幹細胞の研究を開始し,免疫不全マウスにおいて骨髄腫を再構築する能力をもつ骨髄腫細胞の前駆細胞は骨髄腫形質細胞のなかに存在することを明らかにした.一方,以前から報告されているように,CD19陽性のB細胞の画分には骨髄腫細胞の前駆細胞となる細胞が存在することも確かである.そこで,CD19陽性のB細胞および骨髄腫形質細胞のすべてと結合しこれらを排除するような抗体を作製できれば骨髄腫クローンの排除が達成されると考え,骨髄腫の患者に由来する骨髄の検体を用いてそのような標的を探索した.その結果,CD19陽性のB細胞および骨髄腫形質細胞のほぼすべてに高発現するが,CD34陽性CD38陰性の造血幹細胞にはまったく発現しない細胞表面抗原としてCD48が見い出された.CD48の発現レベルは細胞1個あたり105のオーダーと非常に高く,これはCD20やCD52に匹敵し抗体に依存性の細胞性の細胞傷害や補体に依存性の細胞傷害をひき起こすには十分であった.抗ヒトCD48モノクローナル抗体を作製し,そのうちIgG2aアイソタイプをもつクローン1B4を用いて異種移植モデルにおいて抗骨髄腫活性を検討したところ,非常に高いがん抑制効果が証明された.現在,臨床応用を進めつつある.
そののち,よりがんに対する特異性の高い抗原をもとめて研究をつづけた.具体的には,骨髄腫細胞に特異的な翻訳後修飾あるいは立体構造を認識する抗体を探索した.その結果,有望な抗原を手に入れつつある.しかし問題は,がんに特異的である点はよいが,がん細胞における抗原の密度がそれほど高くないという点であった.その当時,登場してきたのがキメラ抗原受容体発現T細胞である.キメラ抗原受容体発現T細胞を用いれば抗原の密度の低いものも標的とすることが可能で,現在,キメラ抗原受容体発現T細胞を用いた骨髄腫の治療法の開発に力をそそいでいる.
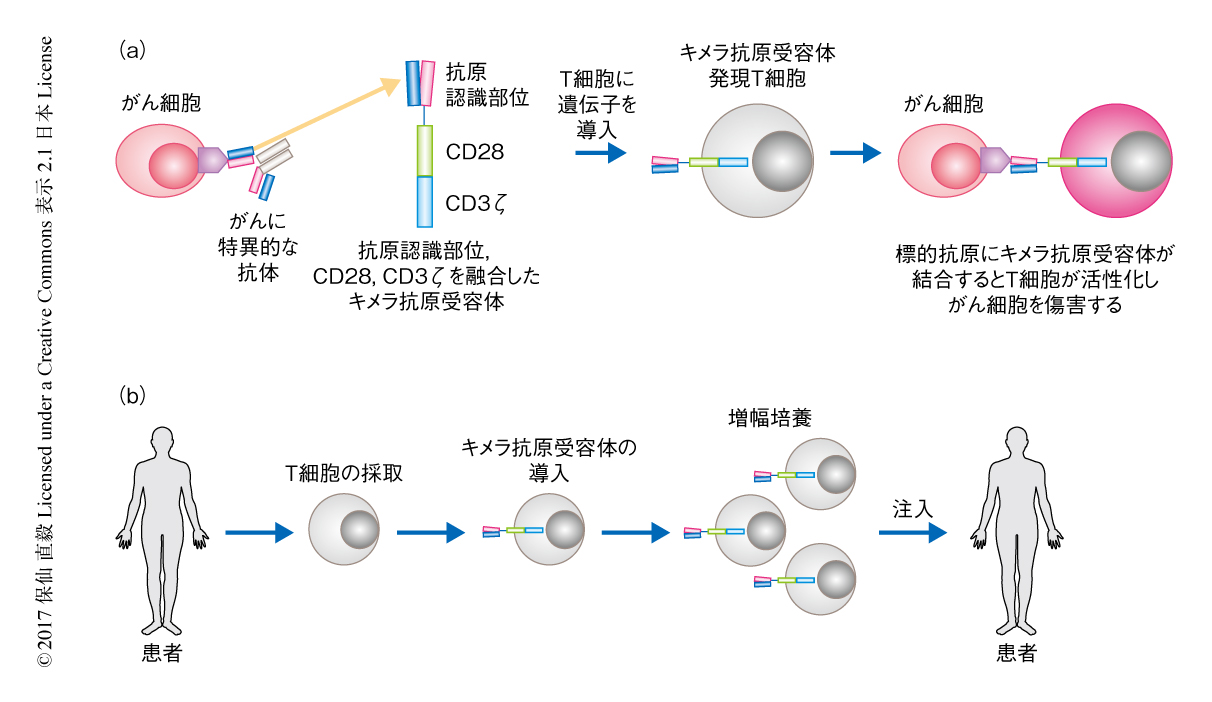
キメラ抗原受容体発現T細胞療法は,CD19を標的としたキメラ抗原受容体発現T細胞のリンパ性白血病に対する驚異的な効果が報告されて以降,世界中で注目をあびている新しいがん免疫療法である.がんに特異的な抗原に対するモノクローナル抗体があれば,その抗原認識部位を遺伝子クローニングし,補助刺激受容体およびCD3ζ鎖との融合タンパク質としてキメラ抗原受容体を作製することが可能である.それをT細胞に導入し発現させたものがキメラ抗原受容体発現T細胞で,がんに特異的な抗原を認識することにより活性化し,がん細胞を傷害する(図3).
B細胞に由来する血液がんに対するCD19を標的としたキメラ抗原受容体発現T細胞療の臨床試験において非常に高い完全寛解率が報告され5-7),2017年には,米国食品医薬品局による承認がみこまれている.その高い有効性の裏返しとして頻度の高い有害事象が懸念されていたが,支持療法の発達などにより安全に施行の可能な治療法になりつつある.いまのところ,血液がんのみでしか有効性は認められていないが,今後,固形がんへの応用が進むと一気にがん治療法のメインストリームになる可能性をもつ.
キメラ抗原受容体発現T細胞療法の革新的な点は,生きた細胞を治療に用いる点である.抗体や低分子化合物とは異なり,T細胞は患者の体内において爆発的に増殖させることができるため,いままでの医薬品にはみられなかったような破壊力をもつ治療が可能になる.一方で,その威力を適切に制御することが課題になる.CD19はがん化したB細胞だけでなく正常なB細胞にも発現する.にもかかわらず,CD19を標的としたキメラ抗原受容体発現T細胞療法は可能である.なぜなら,正常なB細胞の喪失による免疫不全は,免疫グロブリンを大量に投与することにより補正されうるからである.
その成功にもかかわらず,CD19を標的としたキメラ抗原受容体発現T細胞療法にはいくつかの問題が残っている.頻度の高い重篤な有害事象としてはサイトカイン放出症候群および神経症状がある.サイトカイン放出症候群はいわばキメラ抗原受容体発現T細胞の“効き過ぎ”により起こる高サイトカイン血症であるが,これに対しては抗インターロイキン6受容体抗体の使用によりかなりの対応が可能になった.また,慢性リンパ性白血病は急性リンパ性白血病に比べると寛解率が低く,なんらかの改善が必要と考えられている.ひとつのアプローチは,キメラ抗原受容体発現T細胞療法を,イブルチニブを用いるような分子標的療法,あるいは,PD-1拮抗薬を用いるようなチェックポイント阻害療法と組み合わせることである.さらに,キメラ抗原受容体発現T細胞療法に対する耐性の機序も明らかにされた.ひとつは,投与されたキメラ抗原受容体発現T細胞の消失である.キメラ抗原受容体発現T細胞の早期の消失は,多くの場合,導入された遺伝子に対する宿主免疫に起因する.もうひとつの重要な耐性の機序は,抗原の喪失,すなわち,白血病細胞がCD19の発現を失うことによる免疫の回避であり,10~20%の急性リンパ性白血病の患者においてみられる.さらに極端な場合には,リンパ性白血病から骨髄性白血病への系統転換によりがんの逃避が生じることもある.
さらに大きな課題は,腺がんや肉腫などの固形がんを効果的かつ安全に治療するためのキメラ抗原受容体発現T細胞療法の開発である.固形がんにおける最初のキメラ抗原受容体発現T細胞療法は,卵巣がん,神経芽細胞腫,腎臓がんをもつ患者において,葉酸受容体1αおよびCD171を標的とするキメラ抗原受容体発現T細胞により施行されたが,有効性は示されなかった8).転移性の腎細胞がんの患者に対するカルボニックアンヒドラーゼIXを標的としたキメラ抗原受容体発現T細胞療法の臨床試験においては,肝臓への重篤な毒性があったにもかかわらず,客観的な抗がん応答はなかった9).また,2つの研究グループにより,受容体チロシンキナーゼErbB-2を標的とするキメラ抗原受容体発現T細胞療法の臨床試験が報告されている.CD28および4-1BBからなる第3世代の補助刺激受容体をもつ高用量のキメラ抗原受容体発現T細胞受容体を用いた試験では,患者はサイトカイン放出症候群および正常にErbB-2を発現する臓器に対する毒性により死亡した10).しかし,第2世代の補助刺激受容体をもつ低用量かつ低親和性のキメラ抗原受容体発現T細胞を用いた試験は,臨床的に有益な抗がん効果の証拠とともに安全に完了したので11),今後,さらなる発展が期待される.
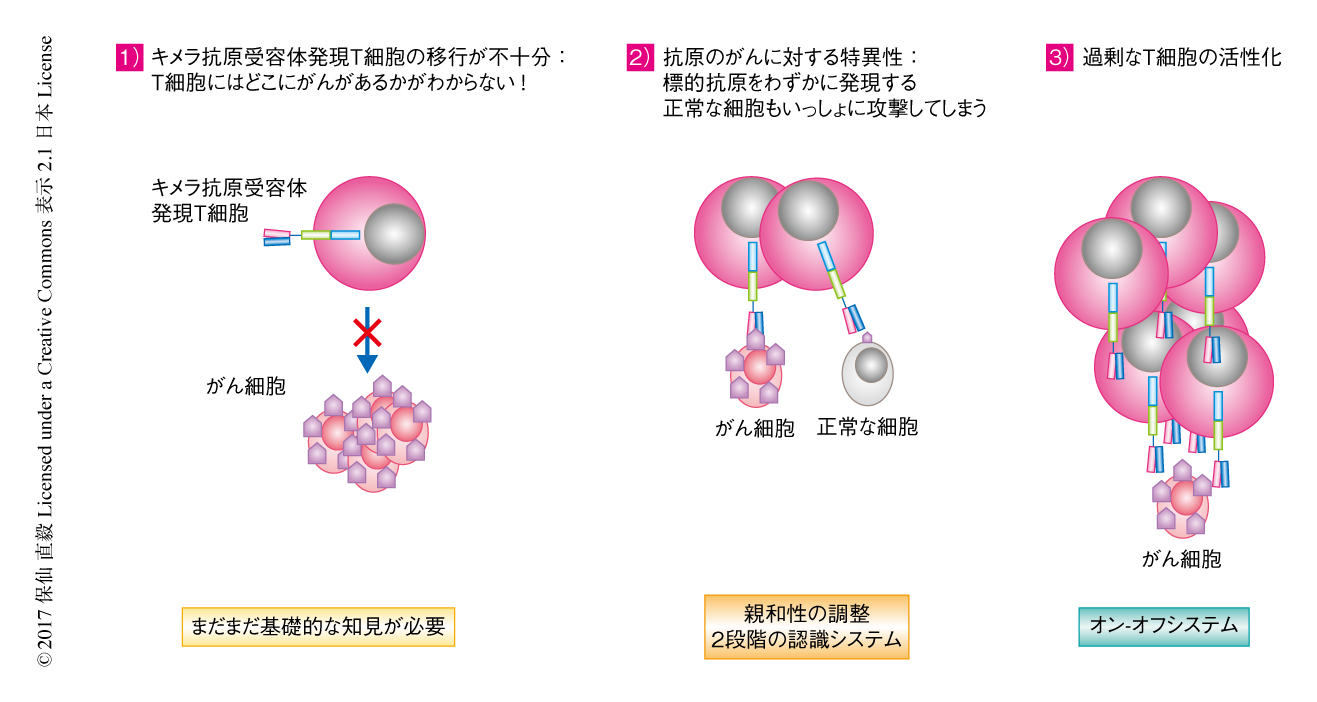
キメラ抗原受容体発現T細胞療法にはまだまだ解決すべき課題があり,世界中がその解決にむけ研究を進めている.以下に,問題点およびその解決にむけた成果について解説する(図4)
1)T細胞の移行:いうまでもなく,T細胞療法の成功のためにはT細胞ががん細胞の部位に効率的に移行することが重要である.T細胞の移行は血液がんの治療においてはあまり大きな問題ではないが,固形がんの治療においてはきわめて重要である.いくつかのがん組織は線維組織にかこまれT細胞が浸潤しにくいと考えられている.また,がん細胞がT細胞の浸潤を媒介するのに役立つケモカインシグナル伝達を抑制することも報告されている.チェックポイント阻害剤などの免疫療法に応答しない多くの患者において,しばしばがん組織へのT細胞の浸潤の不足のあることは明らかである.キメラ抗原受容体発現T細胞へのケモカイン受容体の導入により同種のケモカインを産生するがん組織への移行が改善されたとする研究もあるが12),T細胞の移行を改善するためのより一般化された方法はいまだになく,基礎免疫学の知見の集積とその応用が望まれる.
2)抗原のがんに対する特異性:キメラ抗原受容体を開発するうえでもっとも重要なポイントは,がん細胞と正常な細胞とを完全に区別できる標的を見い出すことである.しかし,実際のところ,これまでに試験されている標的抗原のすべては正常な細胞においても発現のみられるものばかりである.その場合,交差反応により傷害される組織が生体における恒常性の維持に必須かどうかで標的となりうるかどうかが決まる.たとえば,CD19を標的としたキメラ抗原受容体発現T細胞の場合,CD19を発現する正常なB細胞の死滅をもたらすが,それ自体は生命をおびやかすものではないので許容される.しかしながら,失われても問題のない組織とはそうそうないもので,それがキメラ抗原受容体発現T細胞の標的抗原の同定を困難にしている.がんにより特異的な抗原としては,当然,がんのもつ変異に由来する抗原が理論的に有望である.その代表的なものがグリオブラストーマにおいて多くみられるEGFRvIIIであり,実際,抗体療法およびキメラ抗原受容体発現T細胞療法の開発が進んでいる.しかし,EGFRvIIIは特殊な例である.近年のがんゲノム解析の進歩により明らかにされたように,がん細胞のもつ変異は患者により大きく異なり,また,ひとりの患者のがんのなかにも大きな多様性があるため,多くのがん患者に適用の可能ながんに特異的な変異抗原の同定はきわめてむずかしいだろう.最近,がんに特異的に生じる糖鎖修飾の異常により形成される抗原Tn-Muc1を標的とする治療法が報告された13).このアプローチはMuc1を発現する多くのがんに適用が可能で,今後の展開が期待される.がんに対する特異性を高める別の方法として,キメラ抗原受容体発現T細胞を活性化するために2種以上の抗原の組合せを用いる技術がある.そのひとつの戦略は2つの別々のキメラ抗原受容体を発現させるもので,一方の受容体がCD3ζ鎖をもち,もう一方が補助刺激受容体であるというものである14).つまり,両方の受容体に対する抗原が存在するときのみT細胞の活性化が起こるというしくみである.さらに,新しい試みとして,第1の受容体の活性化が第2の受容体の発現を誘導し,第2の受容体が抗原を認識したときのみT細胞が活性化するというしくみも開発されている15,16).さらに,T細胞の交差反応を回避する方法として,正常な細胞に発現する抗原に遭遇したときに活性化を無効にする阻害性キメラ抗原受容体が開発されている17).阻害性キメラ抗原受容体の細胞内ドメインはT細胞受容体に由来するドメインに代わりPD-1およびCTLA-4のような免疫抑制性の受容体からのシグナルを伝達するドメインをもつ.キメラ抗原受容体および阻害性キメラ抗原受容体の両方を発現するT細胞がキメラ抗原受容体に対する抗原のみを発現する正常な細胞に遭遇するとT細胞は活性化されるが,キメラ抗原受容体に対する抗原および阻害性キメラ抗原受容体に対する抗原の両方を発現するがん細胞に遭遇すると,阻害性キメラ抗原受容体からのシグナルがキメラ抗原受容体からのシグナルを弱めT細胞の活性化を抑制する.
3)親和性の調整されたキメラ抗原受容体:がんにしか発現していない抗原はきわめてまれである一方,正常な組織に比べがん組織において異常に高発現している抗原はかなりある.たとえば,HER2がその代表的なものである.そのような抗原に対するキメラ抗原受容体発現T細胞療法を可能にするのが,キメラ抗原受容体の親和性の調整である.ほとんどのキメラ抗原受容体は,抗HER2抗体であるトラスヅマブ(ハーセプチン)のような高親和性の治療抗体に基づいて構築される.しかし,そのような高親和性のキメラ抗原受容体は,正常な組織に発現するHER2も認識して攻撃してしまう.そこで,キメラ抗原受容体の親和性を調整することにより,がん細胞は攻撃するが正常な細胞は攻撃しない理想的なキメラ抗原受容体の作製が試みられている18).
4)キメラ抗原受容体発現T細胞の制御:これまで,ほぼすべてのキメラ抗原受容体発現T細胞療法の臨床試験において重大な副作用がみられた.今後,固形がんへの応用にむけ,さらに活性の高いキメラ抗原受容体の開発が考えられ,有害な副作用の可能性は高まる.したがって,T細胞の活性の強さおよびその持続性を制御することが重要視される.ひとつの方法は自殺遺伝子の導入である.iCasp9遺伝子とよばれる自殺遺伝子の有効性は,造血幹細胞の移植をうけている患者の移植片対宿主病の治療において臨床的に立証されている19).iCasp9は低分子化合物の投与により二量体化して活性化カスパーゼ9となりアポトーシスを誘導する.つまり,重篤な副作用の生じたときにこの低分子化合物を投与すればキメラ抗原受容体発現T細胞は排除される.逆に,必要なときだけキメラ抗原受容体をオンにする方法も開発されている.たとえば,CD3ζ鎖と補助刺激受容体とが別個のポリペプチドにあり,それらが低分子化合物の投与により会合し刺激が伝達するようになるというシステムである20).あるいは,がんに特異的な抗体をがん細胞に結合させておいて,Fc受容体ドメインを認識するキメラ抗原受容体によりそのがん細胞を攻撃するというアダプター介在型のキメラ抗原受容体も報告されている21).アダプターはFc受容体にかぎらずさまざまなものが使用可能である22,23).別の試みとして,キメラ抗原受容体発現T細胞にフィードバック機構をもたせるというものがある.たとえば,インターロイキン6はサイトカイン放出症候群の主要なマーカーであり,キメラ抗原受容体が効き過ぎを反映する.そこで,過剰なインターロイキン6を感知してキメラ抗原受容体の活性を抑制するシステムを構築することができれば,キメラ抗原受容体の過剰な活性化による副作用をふせげると考えられる.
5)キメラ抗原受容体発現T細胞の強化:キメラ抗原受容体発現T細胞の有効性を向上させるために明白なひとつの戦略は,がん免疫がはたらきやすくなるような機能をもつタンパク質をキメラ抗原受容体発現T細胞それ自体に発現させることである.たとえば,インターロイキン12を発現するキメラ抗原受容体発現T細胞の有効性が報告されている24).インターロイキン12はもっとも強力な抗がん作用をもつサイトカインのひとつであり,自然免疫細胞および獲得免疫細胞に対し多面的な作用を介してがん微小環境を再構築する.同じようなアイディアとして,インターロイキン18やHVEM(herpes virus entry mediator)を分泌するキメラ抗原受容体発現T細胞が報告されている25).最近では,細胞傷害能よりもむしろ,がん微小環境を改善するための薬剤の“運び屋”としての機能を重視したキメラ抗原受容体発現T細胞の報告もある.たとえば,キメラ抗原受容体からの刺激に応答してインターロイキン12,炎症促進性のサイトカイン,抗チェックポイント抗体,二重特異性抗体などを産生させたり,自然免疫系を刺激するフラジェリンなどのタンパク質を産生させたりするようなシステムである26).このシステムを用いることにより,がんの局所でのみ,これらのがん免疫を促進するタンパク質を発現させることができるので,全身への影響を最小限に抑えることが可能である.
6)さまざまな補助刺激受容体の利用:これまで臨床応用されているキメラ抗原受容体発現T細胞においては,補助刺激受容体としてCD28あるいは4-1BBが用いられ,いずれもCD19を標的としたキメラ抗原受容体発現T細胞療法において良好な成績を残している.CD28あるいは4-1BBの違いについてはさまざまに検討されている.寛解の導入の迅速性はCD28のほうがよいと思われるが,4-1BBのほうが長期間にわたり体内に残存すると考えられる.したがって,CD28をもつキメラ抗原受容体は寛解の誘導のため,あるいは,移植までのつなぎの治療法に用いるのがよいかもしれない.一方,4-1BBをもつキメラ抗原受容体は最終的な治療法に用いて長期間の免疫の監視が期待できるかもしれない.CD28および4-1BBにくわえ,CD27,OX40,GITR,ICOSを含む,ほかの多くの補助刺激受容体も試みられている.
7)T細胞の疲弊の回避および疲弊からの回復:慢性的な抗原の曝露および炎症において,T細胞は機能的にエフェクター活性を発現できなくなり,T細胞の疲弊とよばれる状態になる27).多くのがん患者において,とくにがんの局所においては,がんに特異的なT細胞が疲弊の状態にある28).疲弊の状態の顕著な特徴は,T細胞が最終的に増殖能を失うことである29).この問題に対処するために明白な方法は,抗PD-1阻害剤,抗PD-L1阻害剤,抗CTLA-4阻害剤のような抗チェックポイント抗体を併用することである.別の戦略としては,キメラ抗原受容体発現T細胞に操作をくわえ疲弊しにくいT細胞をつくることが考えられている.もっとも直接的な方法として考えられるのは,ゲノム編集によりT細胞からPD-1受容体を除去してPD-L1に媒介される抑制に応答しないようにすることであり,すでにいくつかの報告がある30).このように,ゲノム編集を用いたT細胞の改変は技術のめざましい発展にともないどんどん容易になりつつある31).
8)T細胞の代謝:近年,T細胞の分化や機能の発現において,その代謝が重要であることが明らかにされている.がんは栄養の枯渇によりT細胞の代謝に影響をあたえがん免疫を阻害する32).がん微小環境においては,がん細胞とT細胞とのあいだでグルコースに利用につき競合が起こりT細胞の機能が抑制される33).また,死んだがん細胞から放出されたK+によりがん微小環境におけるK+のレベルは血流より5~10倍も高くなり,これはT細胞の活性を強力に阻害する34).このように,特定の栄養素の利用可能性の低下や代謝廃棄物の蓄積とが協調してがん微小環境を変化させT細胞の機能に悪影響をおよぼす.また,キメラ抗原受容体のもつ補助刺激受容体の違いによるT細胞の代謝への影響についても報告があり,CD28をもつキメラ抗原受容体発現T細胞は好気性の解糖を増強し,4-1BBをもつキメラ抗原受容体発現T細胞はミトコンドリアの生合成を増強し脂肪酸の酸化を増加させる35).これらの知見をもとに,細胞代謝の制御を介してT細胞の機能を制御することにより,より有効なキメラ抗原受容体発現T細胞療法が可能になると考えられる.
キメラ抗原受容体発現T細胞療法の高い有効性は疑うべくもなく,今後,さまざまながんにおいて適切な抗原が同定され,また,さきに述べたような問題が解決されるにつれてがん治療のメインストリームになる可能性がある.わが国もその開発の流れに乗り遅れることなく進んでいく必要がある.
略歴:2002年 大阪大学大学院医学系研究科 修了,2003年 米国Stanford大学 ポスドクを経て,2007年より大阪大学大学院医学系研究科 准教授.
研究テーマ:がん幹細胞,がん免疫療法.
© 2017 保仙 直毅 Licensed under CC 表示 2.1 日本
(大阪大学大学院医学系研究科 癌幹細胞制御学講座)
email:保仙直毅
領域融合レビュー, 6, e005 (2017) DOI: 10.7875/leading.author.6.e005
Naoki Hosen: Recent advances in chimeric antigen receptor T cell therapy against cancer.
要 約
筆者らは,がん幹細胞の抗原の同定,そして,それに対するモノクローナル抗体療法の開発を大きな目標として研究してきた.近年,モノクローナル抗体を応用した新たながん免疫療法として注目されているのが,キメラ抗原受容体発現T細胞による治療法である.キメラ抗原受容体発現T細胞は,がんに特異的な抗体の抗原認識部位,補助刺激受容体,CD3ζ鎖を融合して作製したキメラ抗原受容体をT細胞に発現させたものである.キメラ抗原受容体発現T細胞はがんに特異的な抗原を認識して活性化し,がん細胞を傷害するのみならず,体内において大量に増殖する.つまり,抗体医薬の高い特異性と,細胞療法の強い細胞傷害活性および増殖活性をあわせもつ非常に強力な治療法である.すでにCD19を標的としたキメラ抗原受容体発現T細胞は臨床においてその有効性が十分に示されており,強い副作用についても解決されつつある.今後,さまざまながんに対する治療法のひとつになりうると考えられ,精力的に研究が進められている.
はじめに
がん免疫療法は従来の抗がん剤とは作用機序が異なり,静止期にあるがん幹細胞をも傷害できる可能性が高い.なかでも,モノクローナル抗体を用いた抗体療法はその特異性の高さと強い抗がん活性により,すでにがんの治療の中心のひとつになっている.以前より,筆者らは,がん幹細胞に特異的に発現する細胞表面抗原を同定し,それを標的とした抗体療法を開発することを目標に研究を進めてきた.これまでに,急性骨髄性白血病の幹細胞の抗原としてCD96,多発性骨髄腫の前駆細胞を含む骨髄腫クローンの全体に発現する抗原としてCD48が同定され,とくにCD48に対する抗体は製剤化が進み,現在,抗体-薬物複合体のかたちで治験が開始されようとしている.さらに,近年では,抗体療法とT細胞療法の両方の特徴をあわせもつ“キメラ抗原受容体発現T細胞”(chimeric antigen receptor T cell,CAR T細胞)による治療法の開発が進んでいる.このレビューにおいては,これまでの筆者らによる研究の流れを紹介し,さらに,キメラ抗原受容体発現T細胞療法の現況および今後の課題について解説する.
1.がん幹細胞を標的とした抗体療法の開発からキメラ抗原受容体発現T細胞へ
がん幹細胞とは,正常な幹細胞と同様に自己複製能と(多)分化能とをあわせもつがん細胞である.がん幹細胞という概念は古くから存在していたが,1990年代半ば以降,免疫不全マウスを用いた異種移植実験系の進歩にともない研究の対象および創薬における標的となった(図1).1997年,急性骨髄性白血病において,免疫不全マウスに生着し白血病を再構築しうる白血病の幹細胞が正常な造血幹細胞と同じCD34陽性CD38陰性画分に存在すると報告された1).つまり,CD34陽性CD38陰性の白血病の幹細胞こそが急性骨髄性白血病の源であり,それを排除しないかぎり白血病は治癒しないと考えられるようになって,そののち,さまざまながんにおいてつぎつぎとがん幹細胞が同定された.固形がんのがん幹細胞を免疫不全マウスへの生着により定義することについてはいまだ多くの議論があり,その意義は定まっていないが,がんの根治をめざすための概念としてがん幹細胞を標的とした治療法が開発されるべきであることは疑うまでもない.
既存の治療薬により排除できないがん幹細胞を根絶するための戦略として,抗体療法はきわめて有望である(図2).実際,抗CD20抗体(リツキシマブ)をはじめとするモノクローナル抗体は悪性の血液がんの治癒率の向上に大きく貢献した.白血病幹細胞に対する標的抗原の同定はさかんに進められ,CD47,Tim3 2),M-CSFR 3),CLL-1,CD123,CD44などさまざまな候補があげられて,実用化にむけ開発が進んでいる.筆者らも,CD96が白血病の幹細胞に特異的な抗原であることを見い出した4).
ひきつづいて,筆者らは,多発性骨髄腫におけるがん幹細胞の研究を開始し,免疫不全マウスにおいて骨髄腫を再構築する能力をもつ骨髄腫細胞の前駆細胞は骨髄腫形質細胞のなかに存在することを明らかにした.一方,以前から報告されているように,CD19陽性のB細胞の画分には骨髄腫細胞の前駆細胞となる細胞が存在することも確かである.そこで,CD19陽性のB細胞および骨髄腫形質細胞のすべてと結合しこれらを排除するような抗体を作製できれば骨髄腫クローンの排除が達成されると考え,骨髄腫の患者に由来する骨髄の検体を用いてそのような標的を探索した.その結果,CD19陽性のB細胞および骨髄腫形質細胞のほぼすべてに高発現するが,CD34陽性CD38陰性の造血幹細胞にはまったく発現しない細胞表面抗原としてCD48が見い出された.CD48の発現レベルは細胞1個あたり105のオーダーと非常に高く,これはCD20やCD52に匹敵し抗体に依存性の細胞性の細胞傷害や補体に依存性の細胞傷害をひき起こすには十分であった.抗ヒトCD48モノクローナル抗体を作製し,そのうちIgG2aアイソタイプをもつクローン1B4を用いて異種移植モデルにおいて抗骨髄腫活性を検討したところ,非常に高いがん抑制効果が証明された.現在,臨床応用を進めつつある.
そののち,よりがんに対する特異性の高い抗原をもとめて研究をつづけた.具体的には,骨髄腫細胞に特異的な翻訳後修飾あるいは立体構造を認識する抗体を探索した.その結果,有望な抗原を手に入れつつある.しかし問題は,がんに特異的である点はよいが,がん細胞における抗原の密度がそれほど高くないという点であった.その当時,登場してきたのがキメラ抗原受容体発現T細胞である.キメラ抗原受容体発現T細胞を用いれば抗原の密度の低いものも標的とすることが可能で,現在,キメラ抗原受容体発現T細胞を用いた骨髄腫の治療法の開発に力をそそいでいる.
2.キメラ抗原受容体発現T細胞療法の現状
キメラ抗原受容体発現T細胞療法は,CD19を標的としたキメラ抗原受容体発現T細胞のリンパ性白血病に対する驚異的な効果が報告されて以降,世界中で注目をあびている新しいがん免疫療法である.がんに特異的な抗原に対するモノクローナル抗体があれば,その抗原認識部位を遺伝子クローニングし,補助刺激受容体およびCD3ζ鎖との融合タンパク質としてキメラ抗原受容体を作製することが可能である.それをT細胞に導入し発現させたものがキメラ抗原受容体発現T細胞で,がんに特異的な抗原を認識することにより活性化し,がん細胞を傷害する(図3).
B細胞に由来する血液がんに対するCD19を標的としたキメラ抗原受容体発現T細胞療の臨床試験において非常に高い完全寛解率が報告され5-7),2017年には,米国食品医薬品局による承認がみこまれている.その高い有効性の裏返しとして頻度の高い有害事象が懸念されていたが,支持療法の発達などにより安全に施行の可能な治療法になりつつある.いまのところ,血液がんのみでしか有効性は認められていないが,今後,固形がんへの応用が進むと一気にがん治療法のメインストリームになる可能性をもつ.
キメラ抗原受容体発現T細胞療法の革新的な点は,生きた細胞を治療に用いる点である.抗体や低分子化合物とは異なり,T細胞は患者の体内において爆発的に増殖させることができるため,いままでの医薬品にはみられなかったような破壊力をもつ治療が可能になる.一方で,その威力を適切に制御することが課題になる.CD19はがん化したB細胞だけでなく正常なB細胞にも発現する.にもかかわらず,CD19を標的としたキメラ抗原受容体発現T細胞療法は可能である.なぜなら,正常なB細胞の喪失による免疫不全は,免疫グロブリンを大量に投与することにより補正されうるからである.
その成功にもかかわらず,CD19を標的としたキメラ抗原受容体発現T細胞療法にはいくつかの問題が残っている.頻度の高い重篤な有害事象としてはサイトカイン放出症候群および神経症状がある.サイトカイン放出症候群はいわばキメラ抗原受容体発現T細胞の“効き過ぎ”により起こる高サイトカイン血症であるが,これに対しては抗インターロイキン6受容体抗体の使用によりかなりの対応が可能になった.また,慢性リンパ性白血病は急性リンパ性白血病に比べると寛解率が低く,なんらかの改善が必要と考えられている.ひとつのアプローチは,キメラ抗原受容体発現T細胞療法を,イブルチニブを用いるような分子標的療法,あるいは,PD-1拮抗薬を用いるようなチェックポイント阻害療法と組み合わせることである.さらに,キメラ抗原受容体発現T細胞療法に対する耐性の機序も明らかにされた.ひとつは,投与されたキメラ抗原受容体発現T細胞の消失である.キメラ抗原受容体発現T細胞の早期の消失は,多くの場合,導入された遺伝子に対する宿主免疫に起因する.もうひとつの重要な耐性の機序は,抗原の喪失,すなわち,白血病細胞がCD19の発現を失うことによる免疫の回避であり,10~20%の急性リンパ性白血病の患者においてみられる.さらに極端な場合には,リンパ性白血病から骨髄性白血病への系統転換によりがんの逃避が生じることもある.
さらに大きな課題は,腺がんや肉腫などの固形がんを効果的かつ安全に治療するためのキメラ抗原受容体発現T細胞療法の開発である.固形がんにおける最初のキメラ抗原受容体発現T細胞療法は,卵巣がん,神経芽細胞腫,腎臓がんをもつ患者において,葉酸受容体1αおよびCD171を標的とするキメラ抗原受容体発現T細胞により施行されたが,有効性は示されなかった8).転移性の腎細胞がんの患者に対するカルボニックアンヒドラーゼIXを標的としたキメラ抗原受容体発現T細胞療法の臨床試験においては,肝臓への重篤な毒性があったにもかかわらず,客観的な抗がん応答はなかった9).また,2つの研究グループにより,受容体チロシンキナーゼErbB-2を標的とするキメラ抗原受容体発現T細胞療法の臨床試験が報告されている.CD28および4-1BBからなる第3世代の補助刺激受容体をもつ高用量のキメラ抗原受容体発現T細胞受容体を用いた試験では,患者はサイトカイン放出症候群および正常にErbB-2を発現する臓器に対する毒性により死亡した10).しかし,第2世代の補助刺激受容体をもつ低用量かつ低親和性のキメラ抗原受容体発現T細胞を用いた試験は,臨床的に有益な抗がん効果の証拠とともに安全に完了したので11),今後,さらなる発展が期待される.
3.より有効かつ安全なキメラ抗原受容体発現T細胞療法の開発へむけて
キメラ抗原受容体発現T細胞療法にはまだまだ解決すべき課題があり,世界中がその解決にむけ研究を進めている.以下に,問題点およびその解決にむけた成果について解説する(図4)
1)T細胞の移行:いうまでもなく,T細胞療法の成功のためにはT細胞ががん細胞の部位に効率的に移行することが重要である.T細胞の移行は血液がんの治療においてはあまり大きな問題ではないが,固形がんの治療においてはきわめて重要である.いくつかのがん組織は線維組織にかこまれT細胞が浸潤しにくいと考えられている.また,がん細胞がT細胞の浸潤を媒介するのに役立つケモカインシグナル伝達を抑制することも報告されている.チェックポイント阻害剤などの免疫療法に応答しない多くの患者において,しばしばがん組織へのT細胞の浸潤の不足のあることは明らかである.キメラ抗原受容体発現T細胞へのケモカイン受容体の導入により同種のケモカインを産生するがん組織への移行が改善されたとする研究もあるが12),T細胞の移行を改善するためのより一般化された方法はいまだになく,基礎免疫学の知見の集積とその応用が望まれる.
2)抗原のがんに対する特異性:キメラ抗原受容体を開発するうえでもっとも重要なポイントは,がん細胞と正常な細胞とを完全に区別できる標的を見い出すことである.しかし,実際のところ,これまでに試験されている標的抗原のすべては正常な細胞においても発現のみられるものばかりである.その場合,交差反応により傷害される組織が生体における恒常性の維持に必須かどうかで標的となりうるかどうかが決まる.たとえば,CD19を標的としたキメラ抗原受容体発現T細胞の場合,CD19を発現する正常なB細胞の死滅をもたらすが,それ自体は生命をおびやかすものではないので許容される.しかしながら,失われても問題のない組織とはそうそうないもので,それがキメラ抗原受容体発現T細胞の標的抗原の同定を困難にしている.がんにより特異的な抗原としては,当然,がんのもつ変異に由来する抗原が理論的に有望である.その代表的なものがグリオブラストーマにおいて多くみられるEGFRvIIIであり,実際,抗体療法およびキメラ抗原受容体発現T細胞療法の開発が進んでいる.しかし,EGFRvIIIは特殊な例である.近年のがんゲノム解析の進歩により明らかにされたように,がん細胞のもつ変異は患者により大きく異なり,また,ひとりの患者のがんのなかにも大きな多様性があるため,多くのがん患者に適用の可能ながんに特異的な変異抗原の同定はきわめてむずかしいだろう.最近,がんに特異的に生じる糖鎖修飾の異常により形成される抗原Tn-Muc1を標的とする治療法が報告された13).このアプローチはMuc1を発現する多くのがんに適用が可能で,今後の展開が期待される.がんに対する特異性を高める別の方法として,キメラ抗原受容体発現T細胞を活性化するために2種以上の抗原の組合せを用いる技術がある.そのひとつの戦略は2つの別々のキメラ抗原受容体を発現させるもので,一方の受容体がCD3ζ鎖をもち,もう一方が補助刺激受容体であるというものである14).つまり,両方の受容体に対する抗原が存在するときのみT細胞の活性化が起こるというしくみである.さらに,新しい試みとして,第1の受容体の活性化が第2の受容体の発現を誘導し,第2の受容体が抗原を認識したときのみT細胞が活性化するというしくみも開発されている15,16).さらに,T細胞の交差反応を回避する方法として,正常な細胞に発現する抗原に遭遇したときに活性化を無効にする阻害性キメラ抗原受容体が開発されている17).阻害性キメラ抗原受容体の細胞内ドメインはT細胞受容体に由来するドメインに代わりPD-1およびCTLA-4のような免疫抑制性の受容体からのシグナルを伝達するドメインをもつ.キメラ抗原受容体および阻害性キメラ抗原受容体の両方を発現するT細胞がキメラ抗原受容体に対する抗原のみを発現する正常な細胞に遭遇するとT細胞は活性化されるが,キメラ抗原受容体に対する抗原および阻害性キメラ抗原受容体に対する抗原の両方を発現するがん細胞に遭遇すると,阻害性キメラ抗原受容体からのシグナルがキメラ抗原受容体からのシグナルを弱めT細胞の活性化を抑制する.
3)親和性の調整されたキメラ抗原受容体:がんにしか発現していない抗原はきわめてまれである一方,正常な組織に比べがん組織において異常に高発現している抗原はかなりある.たとえば,HER2がその代表的なものである.そのような抗原に対するキメラ抗原受容体発現T細胞療法を可能にするのが,キメラ抗原受容体の親和性の調整である.ほとんどのキメラ抗原受容体は,抗HER2抗体であるトラスヅマブ(ハーセプチン)のような高親和性の治療抗体に基づいて構築される.しかし,そのような高親和性のキメラ抗原受容体は,正常な組織に発現するHER2も認識して攻撃してしまう.そこで,キメラ抗原受容体の親和性を調整することにより,がん細胞は攻撃するが正常な細胞は攻撃しない理想的なキメラ抗原受容体の作製が試みられている18).
4)キメラ抗原受容体発現T細胞の制御:これまで,ほぼすべてのキメラ抗原受容体発現T細胞療法の臨床試験において重大な副作用がみられた.今後,固形がんへの応用にむけ,さらに活性の高いキメラ抗原受容体の開発が考えられ,有害な副作用の可能性は高まる.したがって,T細胞の活性の強さおよびその持続性を制御することが重要視される.ひとつの方法は自殺遺伝子の導入である.iCasp9遺伝子とよばれる自殺遺伝子の有効性は,造血幹細胞の移植をうけている患者の移植片対宿主病の治療において臨床的に立証されている19).iCasp9は低分子化合物の投与により二量体化して活性化カスパーゼ9となりアポトーシスを誘導する.つまり,重篤な副作用の生じたときにこの低分子化合物を投与すればキメラ抗原受容体発現T細胞は排除される.逆に,必要なときだけキメラ抗原受容体をオンにする方法も開発されている.たとえば,CD3ζ鎖と補助刺激受容体とが別個のポリペプチドにあり,それらが低分子化合物の投与により会合し刺激が伝達するようになるというシステムである20).あるいは,がんに特異的な抗体をがん細胞に結合させておいて,Fc受容体ドメインを認識するキメラ抗原受容体によりそのがん細胞を攻撃するというアダプター介在型のキメラ抗原受容体も報告されている21).アダプターはFc受容体にかぎらずさまざまなものが使用可能である22,23).別の試みとして,キメラ抗原受容体発現T細胞にフィードバック機構をもたせるというものがある.たとえば,インターロイキン6はサイトカイン放出症候群の主要なマーカーであり,キメラ抗原受容体が効き過ぎを反映する.そこで,過剰なインターロイキン6を感知してキメラ抗原受容体の活性を抑制するシステムを構築することができれば,キメラ抗原受容体の過剰な活性化による副作用をふせげると考えられる.
5)キメラ抗原受容体発現T細胞の強化:キメラ抗原受容体発現T細胞の有効性を向上させるために明白なひとつの戦略は,がん免疫がはたらきやすくなるような機能をもつタンパク質をキメラ抗原受容体発現T細胞それ自体に発現させることである.たとえば,インターロイキン12を発現するキメラ抗原受容体発現T細胞の有効性が報告されている24).インターロイキン12はもっとも強力な抗がん作用をもつサイトカインのひとつであり,自然免疫細胞および獲得免疫細胞に対し多面的な作用を介してがん微小環境を再構築する.同じようなアイディアとして,インターロイキン18やHVEM(herpes virus entry mediator)を分泌するキメラ抗原受容体発現T細胞が報告されている25).最近では,細胞傷害能よりもむしろ,がん微小環境を改善するための薬剤の“運び屋”としての機能を重視したキメラ抗原受容体発現T細胞の報告もある.たとえば,キメラ抗原受容体からの刺激に応答してインターロイキン12,炎症促進性のサイトカイン,抗チェックポイント抗体,二重特異性抗体などを産生させたり,自然免疫系を刺激するフラジェリンなどのタンパク質を産生させたりするようなシステムである26).このシステムを用いることにより,がんの局所でのみ,これらのがん免疫を促進するタンパク質を発現させることができるので,全身への影響を最小限に抑えることが可能である.
6)さまざまな補助刺激受容体の利用:これまで臨床応用されているキメラ抗原受容体発現T細胞においては,補助刺激受容体としてCD28あるいは4-1BBが用いられ,いずれもCD19を標的としたキメラ抗原受容体発現T細胞療法において良好な成績を残している.CD28あるいは4-1BBの違いについてはさまざまに検討されている.寛解の導入の迅速性はCD28のほうがよいと思われるが,4-1BBのほうが長期間にわたり体内に残存すると考えられる.したがって,CD28をもつキメラ抗原受容体は寛解の誘導のため,あるいは,移植までのつなぎの治療法に用いるのがよいかもしれない.一方,4-1BBをもつキメラ抗原受容体は最終的な治療法に用いて長期間の免疫の監視が期待できるかもしれない.CD28および4-1BBにくわえ,CD27,OX40,GITR,ICOSを含む,ほかの多くの補助刺激受容体も試みられている.
7)T細胞の疲弊の回避および疲弊からの回復:慢性的な抗原の曝露および炎症において,T細胞は機能的にエフェクター活性を発現できなくなり,T細胞の疲弊とよばれる状態になる27).多くのがん患者において,とくにがんの局所においては,がんに特異的なT細胞が疲弊の状態にある28).疲弊の状態の顕著な特徴は,T細胞が最終的に増殖能を失うことである29).この問題に対処するために明白な方法は,抗PD-1阻害剤,抗PD-L1阻害剤,抗CTLA-4阻害剤のような抗チェックポイント抗体を併用することである.別の戦略としては,キメラ抗原受容体発現T細胞に操作をくわえ疲弊しにくいT細胞をつくることが考えられている.もっとも直接的な方法として考えられるのは,ゲノム編集によりT細胞からPD-1受容体を除去してPD-L1に媒介される抑制に応答しないようにすることであり,すでにいくつかの報告がある30).このように,ゲノム編集を用いたT細胞の改変は技術のめざましい発展にともないどんどん容易になりつつある31).
8)T細胞の代謝:近年,T細胞の分化や機能の発現において,その代謝が重要であることが明らかにされている.がんは栄養の枯渇によりT細胞の代謝に影響をあたえがん免疫を阻害する32).がん微小環境においては,がん細胞とT細胞とのあいだでグルコースに利用につき競合が起こりT細胞の機能が抑制される33).また,死んだがん細胞から放出されたK+によりがん微小環境におけるK+のレベルは血流より5~10倍も高くなり,これはT細胞の活性を強力に阻害する34).このように,特定の栄養素の利用可能性の低下や代謝廃棄物の蓄積とが協調してがん微小環境を変化させT細胞の機能に悪影響をおよぼす.また,キメラ抗原受容体のもつ補助刺激受容体の違いによるT細胞の代謝への影響についても報告があり,CD28をもつキメラ抗原受容体発現T細胞は好気性の解糖を増強し,4-1BBをもつキメラ抗原受容体発現T細胞はミトコンドリアの生合成を増強し脂肪酸の酸化を増加させる35).これらの知見をもとに,細胞代謝の制御を介してT細胞の機能を制御することにより,より有効なキメラ抗原受容体発現T細胞療法が可能になると考えられる.
おわりに
キメラ抗原受容体発現T細胞療法の高い有効性は疑うべくもなく,今後,さまざまながんにおいて適切な抗原が同定され,また,さきに述べたような問題が解決されるにつれてがん治療のメインストリームになる可能性がある.わが国もその開発の流れに乗り遅れることなく進んでいく必要がある.
文 献
- Bonnet, D. & Dick, J. E.: Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med., 3, 730-737 (1997)[PubMed]
- Kikushige, Y., Shima, T., Takayanagi, S. et al.: TIM-3 is a promising target to selectively kill acute myeloid leukemia stem cells. Cell Stem Cell, 7, 708-717 (2010)[PubMed] [新着論文レビュー]
- Aikawa, Y., Katsumoto, T., Zhang, P. et al.: PU.1-mediated upregulation of CSF1R is crucial for leukemia stem cell potential induced by MOZ-TIF2. Nat. Med., 16, 580-585 (2010)[PubMed]
- Hosen, N., Park, C. Y., Tatsumi, N. et al.: CD96 is a leukemic stem cell-specific marker in human acute myeloid leukemia. Proc. Natl. Acad. Sci. USA, 104, 11008-11013 (2007)[PubMed]
- Brentjens, R. J., Davila, M. L., Riviere, I. et al.: CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia. Sci. Transl. Med., 5, 177ra138 (2013)[PubMed]
- Maude, S. L., Frey, N., Shaw, P. A. et al.: Chimeric antigen receptor T cells for sustained remissions in leukemia. N. Engl. J. Med., 371, 1507-1517 (2014)[PubMed]
- Kalos, M., Levine, B. L., Porter, D. L. et al.: T cells with chimeric antigen receptors have potent antitumor effects and can establish memory in patients with advanced leukemia. Sci. Transl. Med., 3, 95ra73 (2011)[PubMed]
- Kershaw, M. H., Westwood, J. A., Parker, L. L. et al.: A phase I study on adoptive immunotherapy using gene-modified T cells for ovarian cancer. Clin. Cancer Res., 12, 6106-6115 (2006)[PubMed]
- Lamers, C. H., Sleijfer, S., Vulto, A. G. et al.: Treatment of metastatic renal cell carcinoma with autologous T-lymphocytes genetically retargeted against carbonic anhydrase IX: first clinical experience. J. Clin. Oncol., 24, e20-e22 (2006)[PubMed]
- Morgan, R. A., Yang, J. C., Kitano, M. et al.: Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2. Mol. Ther., 18, 843-851 (2010)[PubMed]
- Ahmed, N., Brawley, V. S., Hegde, M. et al.: Human epidermal growth factor receptor 2 (HER2) -specific chimeric antigen receptor-modified T cells for the immunotherapy of HER2-positive sarcoma. J. Clin. Oncol., 33, 1688-1696 (2015)[PubMed]
- Di Stasi, A., De Angelis, B., Rooney, C. M. et al.: T lymphocytes coexpressing CCR4 and a chimeric antigen receptor targeting CD30 have improved homing and antitumor activity in a Hodgkin tumor model. Blood, 113, 6392-6402 (2009)[PubMed]
- Posey, A. D. Jr., Schwab, R. D., Boesteanu, A. C. et al.: Engineered CAR T cells targeting the cancer-associated Tn-glycoform of the membrane mucin MUC1 control adenocarcinoma. Immunity, 44, 1444-1454 (2016)[PubMed]
- Kloss, C. C., Condomines, M., Cartellieri, M. et al.: Combinatorial antigen recognition with balanced signaling promotes selective tumor eradication by engineered T cells. Nat. Biotechnol., 31, 71-75 (2013)[PubMed]
- Roybal, K. T., Rupp, L. J., Morsut, L. et al.: Precision tumor recognition by T cells with combinatorial antigen-sensing circuits. Cell, 164, 770-779 (2016)[PubMed]
- Morsut, L., Roybal, K. T., Xiong, X. et al.: Engineering customized cell sensing and response behaviors using synthetic Notch receptors. Cell, 164, 780-791 (2016)[PubMed]
- Fedorov, V. D., Themeli, M. & Sadelain, M.: PD-1- and CTLA-4-based inhibitory chimeric antigen receptors (iCARs) divert off-target immunotherapy responses. Sci. Transl. Med., 5, 215ra172 (2013)[PubMed]
- Liu, X., Jiang, S., Fang, C. et al.: Affinity-tuned ErbB2 or EGFR chimeric antigen receptor T cells exhibit an increased therapeutic index against tumors in mice. Cancer Res., 75, 3596-3607 (2015)[PubMed]
- Di Stasi, A., Tey, S. K., Dotti, G. et al.: Inducible apoptosis as a safety switch for adoptive cell therapy. N. Engl. J. Med., 365, 1673-1683 (2011)[PubMed]
- Wu, C. Y., Roybal, K. T., Puchner, E. M. et al.: Remote control of therapeutic T cells through a small molecule-gated chimeric receptor. Science, 350, aab4077 (2015)[PubMed]
- Kudo, K., Imai, C., Lorenzini, P. et al.: T lymphocytes expressing a CD16 signaling receptor exert antibody-dependent cancer cell killing. Cancer Res., 74, 93-103 (2014)[PubMed]
- Ma, J. S., Kim, J. Y., Kazane, S. A. et al.: Versatile strategy for controlling the specificity and activity of engineered T cells. Proc. Natl. Acad. Sci. USA, 113, E450-E458 (2016)[PubMed]
- Rodgers, D. T., Mazagova, M., Hampton, E. N. et al.: Switch-mediated activation and retargeting of CAR-T cells for B-cell malignancies. Proc. Natl. Acad. Sci. USA, 113, E459-E468 (2016)[PubMed]
- Kerkar, S. P., Muranski, P., Kaiser, A. et al.: Tumor-specific CD8+ T cells expressing interleukin-12 eradicate established cancers in lymphodepleted hosts. Cancer Res., 70, 6725-6734 (2010)[PubMed]
- Boice, M., Salloum, D., Mourcin, F. et al.: Loss of the HVEM tumor suppressor in lymphoma and restoration by modified CAR-T cells. Cell, 167, 405-418.e13 (2016)[PubMed]
- Roybal, K. T., Williams, J. Z., Morsut, L. et al.: Engineering T cells with customized therapeutic response programs using synthetic Notch receptors. Cell, 167, 419-432.e16 (2016)[PubMed]
- Wherry, E. J.: T cell exhaustion. Nat. Immunol., 12, 492-499 (2011)[PubMed]
- Schietinger, A. & Greenberg, P. D.: Tolerance and exhaustion: defining mechanisms of T cell dysfunction. Trends Immunol., 35, 51-60 (2014)[PubMed]
- Im, S. J., Williams, J. Z., Morsut, L. et al.: Defining CD8+ T cells that provide the proliferative burst after PD-1 therapy. Nature, 537, 417-421 (2016)[PubMed]
- Ren, J., Liu, X., Fang, C. et al.: Multiplex genome editing to generate universal CAR T cells resistant to PD1 inhibition. Clin. Cancer Res., 23, 2255-2266 (2017)[PubMed]
- Schumann, K., Lin, S., Boyer, E. et al.: Generation of knock-in primary human T cells using Cas9 ribonucleoproteins. Proc. Natl. Acad. Sci. USA, 112, 10437-10442 (2015)[PubMed]
- Joyce, J. A. & Fearon, D. T.: T cell exclusion, immune privilege, and the tumor microenvironment. Science, 348, 74-80 (2015)[PubMed]
- Chang, C. H., Qiu, J., O'Sullivan, D. et al.: Metabolic competition in the tumor microenvironment is a driver of cancer progression. Cell, 162, 1229-1241 (2015)[PubMed]
- Eil, R., Vodnala, S. K., Clever, D. et al.: Ionic immune suppression within the tumour microenvironment limits T cell effector function. Nature, 537, 539-543 (2016)[PubMed]
- Kawalekar, O. U., O'Connor, R. S., Fraietta, J. A. et al.: Distinct signaling of coreceptors regulates specific metabolism pathways and impacts memory development in CAR T cells. Immunity, 44, 380-390 (2016)[PubMed]
著者プロフィール
略歴:2002年 大阪大学大学院医学系研究科 修了,2003年 米国Stanford大学 ポスドクを経て,2007年より大阪大学大学院医学系研究科 准教授.
研究テーマ:がん幹細胞,がん免疫療法.
© 2017 保仙 直毅 Licensed under CC 表示 2.1 日本