脳の機能とミクログリア
2017/09/22
和氣弘明1・堀内 浩2・宮本愛喜子1・鍋倉淳一2
(1神戸大学大学院医学研究科 システム生理学分野,2生理学研究所 生体恒常性発達研究部門)
email:和氣弘明
領域融合レビュー, 6, e007 (2017) DOI: 10.7875/leading.author.6.e007
Hiroaki Wake, Hiroshi Horiuchi, Akiko Miyamoto & Junichi Nabekura: Microglia for brain functions.

脳の機能は電気的な活動により担われる.しかしながら,電気的な活動を担うニューロンは脳の約20%をしめるにすぎず,残りの約80%はグリア細胞とよばれる細胞によりしめられる.グリア細胞は神経回路の活動の恒常性を担うことから,近年,着目されている.グリア細胞の一種であり,中枢神経系において唯一の免疫細胞であるミクログリアは,病態や障害において形態を大きく変化させ,活性化型のミクログリアへと変化することが知られている.これまでは活性化型のミクログリアの病態や障害における役割について重要な研究が多くなされてきたが,技術的な問題からミクログリアの生理的な機能については不明な点が多いままであった.近年の光学技術の発達により生体におけるイメージングが可能になり,ミクログリアの生理的な機能が明らかにされるとともに,その機能の喪失によりひき起こされる疾患が注目されるようになってきた.このレビューにおいては,ミクログリアの生理的な機能について解説するとともに,ミクログリアの生理的な機能の喪失により生じうる疾患について議論する.
生体は外界の環境の異物に対し防御反応を示し,免疫応答を惹起させ機能を維持する.免疫応答は外部からの異物を排除するはたらきをもつ一方,抗原に対し過剰な免疫応答を起こすことによりアレルギー反応を惹起し,また,自己に対し免疫応答を起こすことにより自己免疫疾患をひき起こす.慢性的な免疫応答およびそれによる慢性炎症はがんや代謝性の疾患などさまざまな病態に関与することが知られている.脳も例外ではなく,精神疾患の基礎的な病態として慢性炎症の存在が示唆されている.
中枢神経系においてニューロンがしめるのは約20%にすぎず,ほかに3種類のグリア細胞が存在し残りの約80%をしめるといわれている(図1).そのうち,オリゴデンドロサイトおよびアストロサイトは外胚葉に由来する.オリゴデンドロサイトは髄鞘の形成を担い,神経の伝導速度を制御する.アストロサイトは神経伝達の制御および血液脳関門の形成により脳の環境を保持する役割をもつ.一方,中胚葉に由来するミクログリアは中枢神経系における唯一の免疫細胞である.
これまで,ミクログリアの由来についてはながらく議論されてきたが1),近年,Runx1を用いた細胞系譜の解析により胎生7.5日の卵黄嚢に存在する前駆細胞に由来することが明らかにされ,さらに,心拍の減少により血液の循環が不十分になるNa+-Ca2+交換輸送体1のノックアウトマウスにおいて脳におけるミクログリアの数が減少したことから,胎生8.5~10日に形成される循環器系を介して脳に浸潤することが示された2).
ミクログリアは生涯をつうじて非常に活発に動くことが知られている3).神経毒の投与により神経活動を抑制するとミクログリアの突起の運動性が減少したことから,ミクログリアの動きは神経活動に依存的である.過剰な神経活動に対し,ミクログリアが直接的にその軸索に接触し膜電位を抑制することにより神経の保護に寄与することが示され,ミクログリアの突起の誘引はニューロンの体積に依存性のアニオンチャネルを介したATPの放出に依存することがわかった4).また,ケージドグルタミン酸を遊離させることによりニューロンに神経活動を起こすとミクログリアの突起が神経活動を起こしたニューロンに近づくが,pannexin-1の阻害剤であるプロベネシドの投与によりミクログリアの突起の伸長は抑制される.ATPの受容体であるP2受容体の阻害剤であるアピラーゼやスラミンの投与によりミクログリアの突起の伸長は阻害されることから,神経活動に依存的してpannexin-1ヘミチャネルから放出されるATPが重要であると考えられる5).さらに,ミクログリアの突起はレーザーによる損傷部位に集積し,これはATPの受容体であるP2Y12の阻害により抑制されることからP2Y12に依存的であることが明らかにされた6,7).傷害の際だけでなく,正常な状態においてもミクログリアは5分間ほどの短い時間だけシナプスと接触していることが2光子顕微鏡を用いた生体イメージングにより明らかにされた.また,同様の手法を用いて梗塞の周囲の領域におけるミクログリアとシナプスの接触を観察したところ,ミクログリアがシナプス前部の構造であるブートンに接触し,接触によりブートンが消失するようすが観察され,ミクログリアがシナプスを除去すると報告されている.梗塞の周囲の領域においては損傷した神経回路の機能を代償するため神経回路が再編成されることが知られていることから,ミクログリアは神経回路の再編成にも関与すると考えられる8).このようなミクログリアの動きにより,発達期および成熟期においてニューロンおよびシナプスの数は制御され,神経回路の形成さらにその活動が制御される.
発達の早期においてニューロンはその大部分が失われることが知られている.ニューロンはアポトーシスにより適切な数を維持し神経回路が形成される.卵黄嚢に由来するミクログリアは活性化した形態となり中枢神経系に侵入し,その定着地を模索するため活発に動くと同時に,活性酸素を用いて神経幹細胞に能動的にアポトーシスをひき起こし,これを貪食により除去する9).このことによりニューロンの数の制御に関与することが小脳や大脳皮質など複数の領域において知られ,さらに,領域ごとに特異性をもつことが知られている9,10).このように,ミクログリアは細胞の周囲の環境を整えることにより,神経回路が形成されるときの恒常性の維持を担う.さらに,海馬においては成体になってからもニューロンが新生することが知られているが,ここでも多くのニューロンがアポトーシスを起こす.このアポトーシスを起こしたニューロンの除去もミクログリアが担うことが明らかにされている11).
シナプスはニューロンのあいだを伝達する部位であり,複数のニューロンによると考えられる情報処理において非常に重要な部位である.ミクログリアはこのシナプスと特異的に相互作用することが知られている.1900年代に,シナプスストリッピングという現象が報告された.これは,顔面神経を切断した際に顔面神経節の細胞体の部分において,細胞体と細胞体にシナプスを形成するシナプス前終末とのあいだにミクログリアが入り込んでシナプス伝達を阻害するというものである12).同様の現象は,熱処理したBCG菌を大脳皮質に注入すると錐体細胞に対しても生じることが明らかにされており,中枢神経系においてもシナプスストリッピングの生じることがわかっている13).また,細胞体の周囲には抑制性のシナプスが多く形成されているが,シナプスストリッピングにより抑制性のシナプスが減少しニューロンの興奮性が上昇することにより,アポトーシスを阻害するBcl-1や神経の保護作用をもつBDNFなどが増加すると報告されており,ミクログリアが神経の保護にはたらくことが考えられる14).
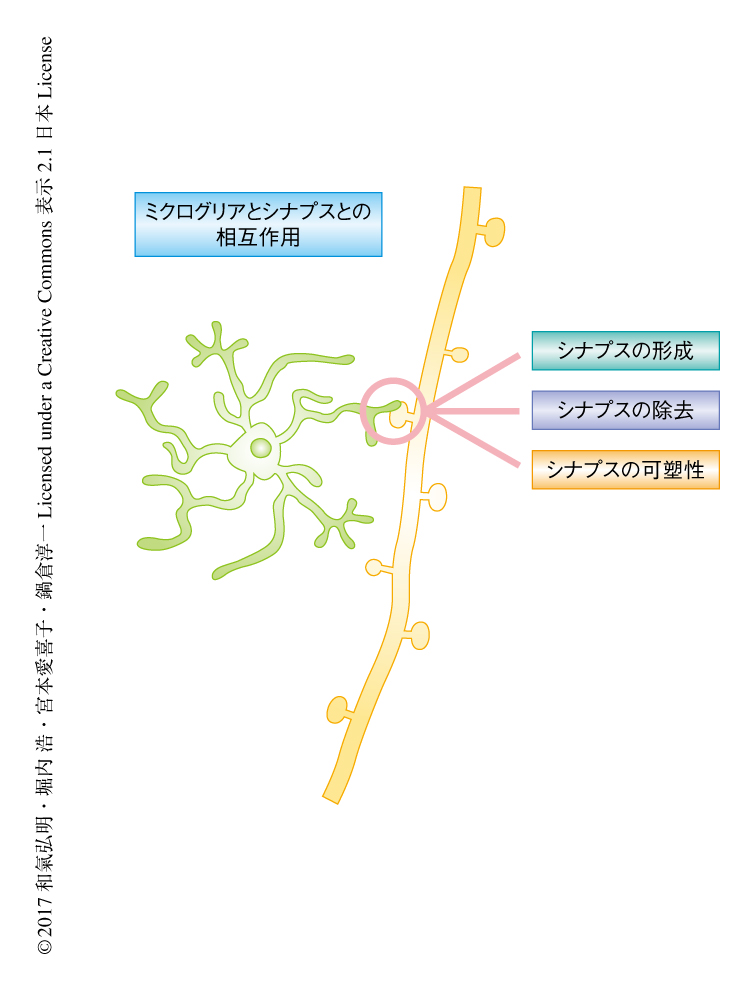
シナプスは発達期の早期において過剰に形成され,環境および感覚に依存して除去されることが知られている.このような過程により正常な神経回路は精緻化され,脳において適切な情報処理がなされる.中枢神経系に定着したミクログリアは突起を伸ばし形態を非活性型に変化させ,シナプスの形成および除去の過程に関与することが明らかにされた(図2).これまでの培養細胞を用いた研究により,単離培養した海馬のニューロンにおいてミクログリアから産生されるインターロイキン10によりシナプスの形成がひき起こされることが明らかにされている15).
また,2光子顕微鏡を用いた生体イメージングにより,生体においても成熟期にミクログリアがシナプスの形成に関与することが明らかにされた.運動学習の際に大脳皮質の運動野においてシナプスの可塑的な変化,すなわち,シナプスの形成および消失が促進されることが知られている.このシナプスの形成が,ミクログリアを遺伝的に除去したマウスでは減少することが明らかにされた.さらに,ミクログリアに特異的にBDNFの発現を阻害すると,同様にシナプスの形成が阻害され運動学習が障害されたことから,ミクログリアは運動学習の際にシナプスの形成を促進することにより運動学習に必要なシナプスの可塑的な変化をひき起こすことが明らかにされた16)(図2).このようなシナプスの形成への寄与は,成熟期のみならず発達期においても起こる.ミクログリアは発達期の早期の特定の時期において活性化した形態を示す.この時期において,ミクログリアは樹状突起と接触することにより未熟なスパインとして定義されるフィロポディアの形成を促進することが示された.これは時期に特異的であり,その時期の以降ではミクログリアと樹状突起との接触により有意なフィロポディアの形成は起こらない.さらに,テトラサイクリンに依存してミクログリアを時期に特異的に除去できる系を用い,ミクログリアをこの時期に特異的に除去したところ,成熟期におけるスパインの数の減少や微小興奮性シナプス後電流の頻度の低下が認められたことから,機能的なシナプスも減少していることが明らかにされた.このミクログリアを除去したマウスにおいて大脳における層構造のあいだの結合を電気生理学的に検証したところ,ミクログリアが未熟なスパインの形成を促進する時期において,神経回路が形成されるとされる第4層から第2層/第3層への機能的な結合が低下する.すなわち,発達期においてミクログリアはシナプスの形成を促進し,特異的な神経回路の形成に寄与することが明らかにされた17).
神経回路の形成の過程においては,発達期の初期に過剰なシナプスが形成されたのち,未熟なシナプスが除去される一方,必要なシナプスが強化されることにより適切な神経回路が形成される18).このようなシナプスの除去の過程は神経活動に依存的に起こることが知られている.これまで,眼球から網膜神経節細胞の投射をうける視床の外側膝状体に着目した研究がなされ,生後5~7日に起こるシナプスの刈り込みにミクログリアが関与することが示された.網膜神経節細胞においてはシナプスが刈り込まれることにより網膜神経節細胞と同側にある眼球からの入力が減少し対側にある眼球からの入力が優位になる眼優位性が形成される.このとき,同側の眼球および対側の眼球に異なる色の色素を投与し,網膜神経節細胞の軸索における神経前終末の色によりどちらからの投射であるか識別できるようにした結果,シナプスが刈り込まれる生後5~7日において,それぞれの色素を含むシナプス終末が網膜神経節細胞のミクログリアに取り込まれているのが観察された.また,ミクログリアを免疫染色により標識し電子顕微鏡を用いて観察すると,ミクログリアの内部にシナプス構造が取り込まれているようすがみられることから,網膜神経節細胞のシナプス終末がミクログリアにより貪食されることが考えられた.シナプスの除去の過程において神経活動の弱いシナプスが除去されることが明らかにされている18).そのため,シナプスの刈り込みは同側の眼球からの入力が相対的に弱いことにより生じると考えられる.そこで,対側の眼球に色素とともに神経活動を抑制するテトロドトキシンを投与し,対側の網膜神経節細胞の神経活動を抑制したマウスの網膜神経節細胞においてミクログリアを観察すると,対側の眼球から投射している軸索終末がミクログリアに多く取り込まれていたことから,発達期におけるミクログリアによるシナプスの除去も神経活動に依存的に生じることが明らかにされた19).同様の現象は視床だけでなく,ちょうどシナプスの刈り込みの時期にあたる生後3~4週目のマウスの大脳皮質視覚野や生後の発達期の海馬においても観察されていることから,ミクログリアのシナプスに対する普遍的な相互作用のひとつであると考えられる.
このようなミクログリアによるシナプスの除去の分子機構として,補体系のC3およびC1qの関与が示唆されている.補体は全身において侵入してきた病原体に対する最初の生体防御機構を担っており,排除すべき病原体に補体が結合することによりオプソニン化が起こりマクロファージなどによる貪食作用をうけやすくなる.また,その作用は外来の病原体に対してだけでなく,アポトーシスした自身の細胞や老廃物に対しても生じることが知られている.実際に標的に結合する補体であるC3が産生される過程としては,古典的な経路,副経路,レクチン経路の3つが知られているが,古典的な経路においてC3が産生される際にカスケードの開始物質となるのがC1qである.生後5日のマウスにおいて網膜神経節細胞にはC1qが多く発現しており,ミクログリアに発現するC3の受容体であるCR3のノックアウトマウスにおいてミクログリアによるシナプス前終末の取り込みが減少することから,これらのタンパク質がミクログリアによるシナプスの除去に関与することが示唆されている19).さらに,網膜に存在するアストロサイトから放出されるTGFβが網膜神経節細胞におけるC1qの発現を促進することも報告されており,ミクログリア,ニューロン,アストロサイトといった複数の細胞種が協調して機能することにより神経回路が適切に形成されていることが明らかにされてきている.また,中枢神経系においてはミクログリアに特異的に発現する受容体CX3CR1もシナプスの除去の過程に関与することが示されている.CX3CR1を欠損したマウスにおいてはミクログリアの内部にみられる貪食されたシナプスが減少し,シナプスの除去の過程における減少率も低下することが明らかにされた.またこのほか,P2Y12がシナプスの除去に関与することも示唆されている20,21).
ミクログリアはシナプスの可塑的な変化にも関与することが知られている.ミクログリアに特異的なBDNFを欠損するとシナプスの構造的な可塑性が障害され,学習が阻害されることが明らかにされた16).このことから,ミクログリアが運動学習などのシナプスの可塑的な変化を要する脳の高次機能に必須であることが示唆される.
さらに,膜糖タンパク質であるCD200の欠損により自然免疫にかかわるToll様受容体TLR2およびTLR4の発現が上昇し,リポ多糖に対するTNFαの産生が増大したことから,CD200-CD200受容体経路がミクログリアの生理的な状態を維持することが示された22).さらに,CD200を欠損した海馬スライスにおいて長期増強は低下しており,TNFαの投与による長期増強の低下と類似していた.また,リポ多糖の投与によりCD200の欠損による長期増強の低下は敏感になることがわかった22).したがって,CD200-CD200受容体経路はミクログリアの神経の可塑性にも寄与すると考えられる.
一方,低濃度のリポ多糖の投与によりToll様受容体経路を介して微小興奮性シナプス後電流は増強される.PU.1を欠損したマウスにおいてはミクログリアが欠損し,この微小興奮性シナプス後電流の増強が阻害されることから,ミクログリアがToll様受容体経路を介した微小興奮性シナプス後電流の増強に必要であることが明らかにされた23).さらに,末梢炎症モデルの海馬急性スライスにおいてはシナプス伝達が増強する一方で,長期増強および長期抑圧はともに阻害される24).このシナプス伝達の増強はGluN2BおよびGluA2の低下と相関し,GluA2の欠損,AMPA受容体の阻害,ミノサイクリンによる炎症の抑制により回復することが示された.このように,ミクログリアの活性化によりシナプスの可塑性が低下することが示されている.
ミクログリアに特異的に発現する受容体CX3CR1を欠損したマウスにおいてはシナプスの可塑性が抑制され,それにともない海馬に依存的な認知機能が低下することが明らかにされた25).CX3CR1のリガンドであるCX3CL1の刺激によりインターロイキン1βの産生がひき起こされ,エイコサノイドを放出することによりシナプス前終末からの神経伝達物質の放出が促進される26).
一方で,抑制性のシナプスに対するミクログリアの機能については不明な点が多い.末梢神経を損傷した際には,脊髄におけるミクログリアからのBDNFの放出を介しK+-Cl-共輸送体の機能を低下させ,侵害受容ニューロンのシナプスにおけるGABAA受容体を介したCl-の外向き電流が誘発され,これにより興奮性が上昇し痛覚過敏が惹起される27).3次元電子顕微鏡を用いた報告においては,活性化したミクログリアが抑制性のニューロンの前終末を取り除くことが明らかにされている14).電気生理学的な実験により,この抑制性のシナプスの脱抑制が皮質ニューロンの同期発火を増加させることが明らかにされた.神経活動の増加はカルモジュリン依存性プロテインキナーゼIVの活性化およびCREBのリン酸化をひき起こし,抗アポトーシスタンパク質および栄養因子の発現を誘導して,損傷をうけたニューロンのアポトーシスを抑制した.さらに,刺激されたミクログリアからはプロスタグランジンE2が産生され,グリシン作動性シナプスの神経活動に依存した可塑性の制御を介して,抑制性のシナプスの機能の制御を担うことが明らかにされている28)
自閉症関連疾患においては,興奮性と抑制性のバランスの異常と,社会行動性の欠如およびコミュニケーション障害との相関が指摘されている.自閉症関連疾患の患者の脳においては未熟なスパインの密度の上昇が知られている29).さらに,異常なシナプス構造も認められている30).発達期の早期において過剰に形成されたシナプスが刈り込まれるが,自閉症関連疾患のような神経発達障害においてはシナプスの刈り込みが正常に起こらない結果,シナプスの密度が過剰になることが関連すると考えられている.これまで,Cx3cr1を欠損したマウスにおいて,発達の過程におけるミクログリアによるシナプスの貪食の障害が報告されているが20),さらに,シナプスの機能の異常および社会的な行動の異常がひき起こされることが示された31)(図3a).さらに,自閉症関連疾患の患者において機能が低下すると考えられている前帯状皮質および小脳においてミクログリアが活性化していることがわかっている32).また,自閉症関連疾患の患者の背外側前頭前皮質において13人のうち9人にミクログリアの活性化が認められ,白質では細胞体の体積が増加し,灰白質では細胞の密度が上昇していた33).さらに,自閉症関連疾患の患者の背外側前頭前皮質においてはミクログリアがニューロンの近くに配置されており,ミクログリアの突起がニューロンをとりかこむようすが観察されている34).つまり,自閉症関連疾患の患者において機能の低下が示唆される領域にはミクログリアの活性化やシナプスの密度の上昇が生じることが示され,ミクログリアの活性化と病態との関連が示唆されている.また,自閉症関連疾患の患者においては領域のあいだの結合の脆弱性が指摘されているが31),ミクログリアによるシナプスの除去の過程と領域のあいだの結合との関連が示唆されている19,20,31).
Rett症候群は自閉症様の症状をきたす神経発達障害であり,X染色体にコードされるMecp2遺伝子の変異によりひき起こされる35),これまで,Mecp2はニューロンのみならず,アストロサイト,ミクログリア,オリゴデンドロサイトにも発現することがわかっている.MeCP2を欠損したミクログリアがニューロンおよびシナプスに対し毒性を発揮することは明らかにされているものの36),生体におけるミクログリアに特異的なMecp2の欠損の影響については一致した見解が得られていない37,38).新たな知見として,Rett症候群の最終ステージにおいて,ミクログリアは前シナプスを過剰に取り込むことにより病態の形成に寄与することがあらためて示された.さらに,ミクログリアに特異的なMecp2の機能獲得型の変異あるいは機能欠損型の変異は,ミクログリアによる過剰な貪食,シナプスの減少,行動の異常にはあまり影響しないことが確認された39).したがって,ミクログリアはRett症候群の最終ステージにおいて機能する可能性が示された.
アルツハイマー型の認知機能障害については,その初期におけるシナプスの機能の喪失が指摘されている40).これまで,ミクログリアのひき起こす脳における慢性的な炎症が神経毒性による器質的な疾患をひき起こすと考えられてきた.一方,抗炎症薬が有効でないことや,代表的な抗炎症性サイトカインであるインターロイキン10がむしろ症状を悪化させると報告されていることなどから41),慢性的な炎症を抑制するだけでは病態の改善にはつながらないことが明らかにされてきた.アミロイドβタンパク質の除去にはミクログリアによる貪食が重要であるとされる一方,ミクログリアを除去したマウスにおいてもアミロイドβタンパク質には顕著な変化が認められないことから,ミクログリアによるアミロイドβタンパク質の貪食については議論がつづいている42).このようなミクログリアの2面性が病態に関与し,その進行にかかわることが理解されるようになってきた.発達期においてミクログリアがC1qに標識された未熟なシナプスを除去することにより適切な神経回路を形成することが示されているが19),アルツハイマー病のモデルマウスにおいてプラークを形成する以前のシナプスにC1qが増加していることが示され,アミロイドβタンパク質のオリゴマーがC1qを増加させることが明らかにされた.さらに,アミロイドβタンパク質のオリゴマーの投与による急性モデルにおいて,ミクログリアがC3受容体を介しシナプスを除去することが示された43).さらに,ミクログリアのC3受容体は脳脊髄液におけるアミロイドβタンパク質の除去を制御することも明らかにされた44).また,C3の欠損がアミロイド前駆体タンパク質あるいはプレセニリン1による神経変性に対し保護的に機能することが示された45).これらの事実から,発達期におけるミクログリアによるシナプスの除去の機構がアルツハイマー型認知機能障害において異常になり,必要なシナプスを除去することにより病態がひき起こされることが示唆された(図3b).アルツハイマー病のモデルマウスにおいては,ミクログリアにおけるTDP43の欠損がアミロイドβタンパク質を減少させる一方,同時に,劇的なシナプスの減少を示すことがわかった46)(図3b).また,前頭側頭型認知症の患者に認められるprogranulinの欠損がリソソームの欠損および補体の過剰な産生をひき起こし,ミクログリアによる選択的なシナプスの刈り込みの異常および行動の異常をおこし,この病態においては補体の活性化を抑制することにより行動の異常が改善することが明らかにされた47).
トリパノソーマの感染による睡眠障害モデルにおいて,ミクログリアが活性化していることが免疫組織的な手法により明らかにされている48).急性あるいは慢性的な睡眠の剥奪は炎症反応を惹起する.ヒトおよび哺乳類において,睡眠の剥奪により血中の白血球の数は増加し,インターロイキン1β,インターロイキン6,TNFαといった炎症性サイトカインの増加がひき起こされ,血液脳関門の透過性が亢進する49).近年,ミクログリアには概日リズムの存在することが示されており,夜間のほうが昼と比較して突起の長さや数が多く形態が異なることが知られている50).そのため,概日リズムによってミクログリアの機能が異なる可能性が示唆される.さらに,睡眠の剥奪がシナプスの貪食を促進するという結果が得られ,慢性的な睡眠の不足は炎症性タンパク質の発現の上昇をともなわない形態的なミクログリアの活性化をひき起こすことが示されている51).
全身性エリテマトーデスは自己免疫疾患のひとつで,若年の女性に好発し,全身性の炎症性臓器障害を起こす.発熱,疲労感,体重の減少,多臓器病変といった全身性の症状や,皮膚粘膜,腎症状,新血管症状といった部分的な症状のほか,中枢神経の症状として痙攣,髄膜炎,精神疾患が共通してみられる.抗NMDA受容体抗体,抗リボソームP抗体,抗リン脂質抗体などの自己抗体の産生や補体に依存性のアポトーシスが認められ,中枢神経の症状との関与が指摘されているが,明確な機構は解明されていない52).中枢神経の症状は初期に診断されること,中枢神経の症状は自己免疫が消失した状態においても変わりなく生じることが報告されており53),末梢組織における免疫の状態が精神症状を規定する可能性が注目されている.すなわち,全身性エリテマトーデスのモデルマウスであるMRL/lprの骨髄キメラマウスを作製すると,全身性の自己免疫がほぼ消失した一方,中枢神経の症状は生じたままであった53).したがって,このモデルマウスにおける中枢神経の症状はいったん生じると不可逆的なものであるのか,あるいは,独立したものであることが示唆される.全身性エリテマトーデスの患者から採取した血清がミクログリアの細胞株であるBV2細胞を活性化させることが明らかにされている54).中枢神経の症状を呈する全身性エリテマトーデスのモデルマウスにおいて生じる中枢神経の症状およびシナプスの消失は,I型インターフェロンシグナルの阻害により抑制された55).さらに,I型インターフェロンによるミクログリアの活性化によりニューロンあるいはシナプスに関連する物質が貪食されることが明らかにされた(図3c).
遺伝子の発現の網羅的な解析から,ミクログリアにおける遺伝子の発現には領域に特異的な多様性の存在することが報告された56).さらに,領域ごとにミクログリアのターンオーバー率が異なっており,休止状態のミクログリアはランダムに自己複製するのに対し,病態の際には特定のミクログリアがクローナルに増殖することが示された.また,増殖ののちにはアポトーシスおよびほかの領域への拡散によりミクログリアは減少し正常な状態にもどることも示された57).ミクログリアの形態は脳の領域において異なることが知られており,ミクログリアの多様性にはこのような起源の違いがかかわるのかもしれない.ミクログリアの性質には性差のあることも示されており58),性別により発症率や重症度に差異の認められる疾患においてはミクログリアの性差がかかわる可能性が考えられる.ミクログリアは発達期の早期から脳に存在するため,ミクログリアの異常は神経回路の形成や,自閉症に代表される神経発達障害などに関与する可能性がある.
略歴:2007年 名古屋市立大学大学院医学研究科 修了,同年 生理学研究所 研究員,2009年 米国NIH National Institute of Child Health and Human Development研究員,2012年 基礎生物学研究所 助教,2014年 生理学研究所 准教授を経て,2016年より神戸大学大学院医学研究科 教授.
研究テーマ:神経回路およびグリア細胞の生体におけるイメージング.
抱負:科学の真実に近づくような研究をしていきたい.
研究室URL:http://www.med.kobe-u.ac.jp/nature/index.html
堀内 浩(Hiroshi Horiuchi)
生理学研究所 研究員.
宮本 愛喜子(Akiko Miyamoto)
神戸大学大学院医学研究科 特命助教.
鍋倉 淳一(Junichi Nabekura)
生理学研究所 教授.
© 2017 和氣弘明・堀内 浩・宮本愛喜子・鍋倉淳一 Licensed under CC 表示 2.1 日本
(1神戸大学大学院医学研究科 システム生理学分野,2生理学研究所 生体恒常性発達研究部門)
email:和氣弘明
領域融合レビュー, 6, e007 (2017) DOI: 10.7875/leading.author.6.e007
Hiroaki Wake, Hiroshi Horiuchi, Akiko Miyamoto & Junichi Nabekura: Microglia for brain functions.
要 約
脳の機能は電気的な活動により担われる.しかしながら,電気的な活動を担うニューロンは脳の約20%をしめるにすぎず,残りの約80%はグリア細胞とよばれる細胞によりしめられる.グリア細胞は神経回路の活動の恒常性を担うことから,近年,着目されている.グリア細胞の一種であり,中枢神経系において唯一の免疫細胞であるミクログリアは,病態や障害において形態を大きく変化させ,活性化型のミクログリアへと変化することが知られている.これまでは活性化型のミクログリアの病態や障害における役割について重要な研究が多くなされてきたが,技術的な問題からミクログリアの生理的な機能については不明な点が多いままであった.近年の光学技術の発達により生体におけるイメージングが可能になり,ミクログリアの生理的な機能が明らかにされるとともに,その機能の喪失によりひき起こされる疾患が注目されるようになってきた.このレビューにおいては,ミクログリアの生理的な機能について解説するとともに,ミクログリアの生理的な機能の喪失により生じうる疾患について議論する.
はじめに
生体は外界の環境の異物に対し防御反応を示し,免疫応答を惹起させ機能を維持する.免疫応答は外部からの異物を排除するはたらきをもつ一方,抗原に対し過剰な免疫応答を起こすことによりアレルギー反応を惹起し,また,自己に対し免疫応答を起こすことにより自己免疫疾患をひき起こす.慢性的な免疫応答およびそれによる慢性炎症はがんや代謝性の疾患などさまざまな病態に関与することが知られている.脳も例外ではなく,精神疾患の基礎的な病態として慢性炎症の存在が示唆されている.
中枢神経系においてニューロンがしめるのは約20%にすぎず,ほかに3種類のグリア細胞が存在し残りの約80%をしめるといわれている(図1).そのうち,オリゴデンドロサイトおよびアストロサイトは外胚葉に由来する.オリゴデンドロサイトは髄鞘の形成を担い,神経の伝導速度を制御する.アストロサイトは神経伝達の制御および血液脳関門の形成により脳の環境を保持する役割をもつ.一方,中胚葉に由来するミクログリアは中枢神経系における唯一の免疫細胞である.
1.ミクログリアの性質
これまで,ミクログリアの由来についてはながらく議論されてきたが1),近年,Runx1を用いた細胞系譜の解析により胎生7.5日の卵黄嚢に存在する前駆細胞に由来することが明らかにされ,さらに,心拍の減少により血液の循環が不十分になるNa+-Ca2+交換輸送体1のノックアウトマウスにおいて脳におけるミクログリアの数が減少したことから,胎生8.5~10日に形成される循環器系を介して脳に浸潤することが示された2).
ミクログリアは生涯をつうじて非常に活発に動くことが知られている3).神経毒の投与により神経活動を抑制するとミクログリアの突起の運動性が減少したことから,ミクログリアの動きは神経活動に依存的である.過剰な神経活動に対し,ミクログリアが直接的にその軸索に接触し膜電位を抑制することにより神経の保護に寄与することが示され,ミクログリアの突起の誘引はニューロンの体積に依存性のアニオンチャネルを介したATPの放出に依存することがわかった4).また,ケージドグルタミン酸を遊離させることによりニューロンに神経活動を起こすとミクログリアの突起が神経活動を起こしたニューロンに近づくが,pannexin-1の阻害剤であるプロベネシドの投与によりミクログリアの突起の伸長は抑制される.ATPの受容体であるP2受容体の阻害剤であるアピラーゼやスラミンの投与によりミクログリアの突起の伸長は阻害されることから,神経活動に依存的してpannexin-1ヘミチャネルから放出されるATPが重要であると考えられる5).さらに,ミクログリアの突起はレーザーによる損傷部位に集積し,これはATPの受容体であるP2Y12の阻害により抑制されることからP2Y12に依存的であることが明らかにされた6,7).傷害の際だけでなく,正常な状態においてもミクログリアは5分間ほどの短い時間だけシナプスと接触していることが2光子顕微鏡を用いた生体イメージングにより明らかにされた.また,同様の手法を用いて梗塞の周囲の領域におけるミクログリアとシナプスの接触を観察したところ,ミクログリアがシナプス前部の構造であるブートンに接触し,接触によりブートンが消失するようすが観察され,ミクログリアがシナプスを除去すると報告されている.梗塞の周囲の領域においては損傷した神経回路の機能を代償するため神経回路が再編成されることが知られていることから,ミクログリアは神経回路の再編成にも関与すると考えられる8).このようなミクログリアの動きにより,発達期および成熟期においてニューロンおよびシナプスの数は制御され,神経回路の形成さらにその活動が制御される.
2.ミクログリアによるニューロンの数の制御
発達の早期においてニューロンはその大部分が失われることが知られている.ニューロンはアポトーシスにより適切な数を維持し神経回路が形成される.卵黄嚢に由来するミクログリアは活性化した形態となり中枢神経系に侵入し,その定着地を模索するため活発に動くと同時に,活性酸素を用いて神経幹細胞に能動的にアポトーシスをひき起こし,これを貪食により除去する9).このことによりニューロンの数の制御に関与することが小脳や大脳皮質など複数の領域において知られ,さらに,領域ごとに特異性をもつことが知られている9,10).このように,ミクログリアは細胞の周囲の環境を整えることにより,神経回路が形成されるときの恒常性の維持を担う.さらに,海馬においては成体になってからもニューロンが新生することが知られているが,ここでも多くのニューロンがアポトーシスを起こす.このアポトーシスを起こしたニューロンの除去もミクログリアが担うことが明らかにされている11).
3.ミクログリアのシナプスへの関与
シナプスはニューロンのあいだを伝達する部位であり,複数のニューロンによると考えられる情報処理において非常に重要な部位である.ミクログリアはこのシナプスと特異的に相互作用することが知られている.1900年代に,シナプスストリッピングという現象が報告された.これは,顔面神経を切断した際に顔面神経節の細胞体の部分において,細胞体と細胞体にシナプスを形成するシナプス前終末とのあいだにミクログリアが入り込んでシナプス伝達を阻害するというものである12).同様の現象は,熱処理したBCG菌を大脳皮質に注入すると錐体細胞に対しても生じることが明らかにされており,中枢神経系においてもシナプスストリッピングの生じることがわかっている13).また,細胞体の周囲には抑制性のシナプスが多く形成されているが,シナプスストリッピングにより抑制性のシナプスが減少しニューロンの興奮性が上昇することにより,アポトーシスを阻害するBcl-1や神経の保護作用をもつBDNFなどが増加すると報告されており,ミクログリアが神経の保護にはたらくことが考えられる14).
シナプスは発達期の早期において過剰に形成され,環境および感覚に依存して除去されることが知られている.このような過程により正常な神経回路は精緻化され,脳において適切な情報処理がなされる.中枢神経系に定着したミクログリアは突起を伸ばし形態を非活性型に変化させ,シナプスの形成および除去の過程に関与することが明らかにされた(図2).これまでの培養細胞を用いた研究により,単離培養した海馬のニューロンにおいてミクログリアから産生されるインターロイキン10によりシナプスの形成がひき起こされることが明らかにされている15).
また,2光子顕微鏡を用いた生体イメージングにより,生体においても成熟期にミクログリアがシナプスの形成に関与することが明らかにされた.運動学習の際に大脳皮質の運動野においてシナプスの可塑的な変化,すなわち,シナプスの形成および消失が促進されることが知られている.このシナプスの形成が,ミクログリアを遺伝的に除去したマウスでは減少することが明らかにされた.さらに,ミクログリアに特異的にBDNFの発現を阻害すると,同様にシナプスの形成が阻害され運動学習が障害されたことから,ミクログリアは運動学習の際にシナプスの形成を促進することにより運動学習に必要なシナプスの可塑的な変化をひき起こすことが明らかにされた16)(図2).このようなシナプスの形成への寄与は,成熟期のみならず発達期においても起こる.ミクログリアは発達期の早期の特定の時期において活性化した形態を示す.この時期において,ミクログリアは樹状突起と接触することにより未熟なスパインとして定義されるフィロポディアの形成を促進することが示された.これは時期に特異的であり,その時期の以降ではミクログリアと樹状突起との接触により有意なフィロポディアの形成は起こらない.さらに,テトラサイクリンに依存してミクログリアを時期に特異的に除去できる系を用い,ミクログリアをこの時期に特異的に除去したところ,成熟期におけるスパインの数の減少や微小興奮性シナプス後電流の頻度の低下が認められたことから,機能的なシナプスも減少していることが明らかにされた.このミクログリアを除去したマウスにおいて大脳における層構造のあいだの結合を電気生理学的に検証したところ,ミクログリアが未熟なスパインの形成を促進する時期において,神経回路が形成されるとされる第4層から第2層/第3層への機能的な結合が低下する.すなわち,発達期においてミクログリアはシナプスの形成を促進し,特異的な神経回路の形成に寄与することが明らかにされた17).
神経回路の形成の過程においては,発達期の初期に過剰なシナプスが形成されたのち,未熟なシナプスが除去される一方,必要なシナプスが強化されることにより適切な神経回路が形成される18).このようなシナプスの除去の過程は神経活動に依存的に起こることが知られている.これまで,眼球から網膜神経節細胞の投射をうける視床の外側膝状体に着目した研究がなされ,生後5~7日に起こるシナプスの刈り込みにミクログリアが関与することが示された.網膜神経節細胞においてはシナプスが刈り込まれることにより網膜神経節細胞と同側にある眼球からの入力が減少し対側にある眼球からの入力が優位になる眼優位性が形成される.このとき,同側の眼球および対側の眼球に異なる色の色素を投与し,網膜神経節細胞の軸索における神経前終末の色によりどちらからの投射であるか識別できるようにした結果,シナプスが刈り込まれる生後5~7日において,それぞれの色素を含むシナプス終末が網膜神経節細胞のミクログリアに取り込まれているのが観察された.また,ミクログリアを免疫染色により標識し電子顕微鏡を用いて観察すると,ミクログリアの内部にシナプス構造が取り込まれているようすがみられることから,網膜神経節細胞のシナプス終末がミクログリアにより貪食されることが考えられた.シナプスの除去の過程において神経活動の弱いシナプスが除去されることが明らかにされている18).そのため,シナプスの刈り込みは同側の眼球からの入力が相対的に弱いことにより生じると考えられる.そこで,対側の眼球に色素とともに神経活動を抑制するテトロドトキシンを投与し,対側の網膜神経節細胞の神経活動を抑制したマウスの網膜神経節細胞においてミクログリアを観察すると,対側の眼球から投射している軸索終末がミクログリアに多く取り込まれていたことから,発達期におけるミクログリアによるシナプスの除去も神経活動に依存的に生じることが明らかにされた19).同様の現象は視床だけでなく,ちょうどシナプスの刈り込みの時期にあたる生後3~4週目のマウスの大脳皮質視覚野や生後の発達期の海馬においても観察されていることから,ミクログリアのシナプスに対する普遍的な相互作用のひとつであると考えられる.
このようなミクログリアによるシナプスの除去の分子機構として,補体系のC3およびC1qの関与が示唆されている.補体は全身において侵入してきた病原体に対する最初の生体防御機構を担っており,排除すべき病原体に補体が結合することによりオプソニン化が起こりマクロファージなどによる貪食作用をうけやすくなる.また,その作用は外来の病原体に対してだけでなく,アポトーシスした自身の細胞や老廃物に対しても生じることが知られている.実際に標的に結合する補体であるC3が産生される過程としては,古典的な経路,副経路,レクチン経路の3つが知られているが,古典的な経路においてC3が産生される際にカスケードの開始物質となるのがC1qである.生後5日のマウスにおいて網膜神経節細胞にはC1qが多く発現しており,ミクログリアに発現するC3の受容体であるCR3のノックアウトマウスにおいてミクログリアによるシナプス前終末の取り込みが減少することから,これらのタンパク質がミクログリアによるシナプスの除去に関与することが示唆されている19).さらに,網膜に存在するアストロサイトから放出されるTGFβが網膜神経節細胞におけるC1qの発現を促進することも報告されており,ミクログリア,ニューロン,アストロサイトといった複数の細胞種が協調して機能することにより神経回路が適切に形成されていることが明らかにされてきている.また,中枢神経系においてはミクログリアに特異的に発現する受容体CX3CR1もシナプスの除去の過程に関与することが示されている.CX3CR1を欠損したマウスにおいてはミクログリアの内部にみられる貪食されたシナプスが減少し,シナプスの除去の過程における減少率も低下することが明らかにされた.またこのほか,P2Y12がシナプスの除去に関与することも示唆されている20,21).
ミクログリアはシナプスの可塑的な変化にも関与することが知られている.ミクログリアに特異的なBDNFを欠損するとシナプスの構造的な可塑性が障害され,学習が阻害されることが明らかにされた16).このことから,ミクログリアが運動学習などのシナプスの可塑的な変化を要する脳の高次機能に必須であることが示唆される.
さらに,膜糖タンパク質であるCD200の欠損により自然免疫にかかわるToll様受容体TLR2およびTLR4の発現が上昇し,リポ多糖に対するTNFαの産生が増大したことから,CD200-CD200受容体経路がミクログリアの生理的な状態を維持することが示された22).さらに,CD200を欠損した海馬スライスにおいて長期増強は低下しており,TNFαの投与による長期増強の低下と類似していた.また,リポ多糖の投与によりCD200の欠損による長期増強の低下は敏感になることがわかった22).したがって,CD200-CD200受容体経路はミクログリアの神経の可塑性にも寄与すると考えられる.
一方,低濃度のリポ多糖の投与によりToll様受容体経路を介して微小興奮性シナプス後電流は増強される.PU.1を欠損したマウスにおいてはミクログリアが欠損し,この微小興奮性シナプス後電流の増強が阻害されることから,ミクログリアがToll様受容体経路を介した微小興奮性シナプス後電流の増強に必要であることが明らかにされた23).さらに,末梢炎症モデルの海馬急性スライスにおいてはシナプス伝達が増強する一方で,長期増強および長期抑圧はともに阻害される24).このシナプス伝達の増強はGluN2BおよびGluA2の低下と相関し,GluA2の欠損,AMPA受容体の阻害,ミノサイクリンによる炎症の抑制により回復することが示された.このように,ミクログリアの活性化によりシナプスの可塑性が低下することが示されている.
ミクログリアに特異的に発現する受容体CX3CR1を欠損したマウスにおいてはシナプスの可塑性が抑制され,それにともない海馬に依存的な認知機能が低下することが明らかにされた25).CX3CR1のリガンドであるCX3CL1の刺激によりインターロイキン1βの産生がひき起こされ,エイコサノイドを放出することによりシナプス前終末からの神経伝達物質の放出が促進される26).
一方で,抑制性のシナプスに対するミクログリアの機能については不明な点が多い.末梢神経を損傷した際には,脊髄におけるミクログリアからのBDNFの放出を介しK+-Cl-共輸送体の機能を低下させ,侵害受容ニューロンのシナプスにおけるGABAA受容体を介したCl-の外向き電流が誘発され,これにより興奮性が上昇し痛覚過敏が惹起される27).3次元電子顕微鏡を用いた報告においては,活性化したミクログリアが抑制性のニューロンの前終末を取り除くことが明らかにされている14).電気生理学的な実験により,この抑制性のシナプスの脱抑制が皮質ニューロンの同期発火を増加させることが明らかにされた.神経活動の増加はカルモジュリン依存性プロテインキナーゼIVの活性化およびCREBのリン酸化をひき起こし,抗アポトーシスタンパク質および栄養因子の発現を誘導して,損傷をうけたニューロンのアポトーシスを抑制した.さらに,刺激されたミクログリアからはプロスタグランジンE2が産生され,グリシン作動性シナプスの神経活動に依存した可塑性の制御を介して,抑制性のシナプスの機能の制御を担うことが明らかにされている28)
4.ミクログリアと病態
自閉症関連疾患においては,興奮性と抑制性のバランスの異常と,社会行動性の欠如およびコミュニケーション障害との相関が指摘されている.自閉症関連疾患の患者の脳においては未熟なスパインの密度の上昇が知られている29).さらに,異常なシナプス構造も認められている30).発達期の早期において過剰に形成されたシナプスが刈り込まれるが,自閉症関連疾患のような神経発達障害においてはシナプスの刈り込みが正常に起こらない結果,シナプスの密度が過剰になることが関連すると考えられている.これまで,Cx3cr1を欠損したマウスにおいて,発達の過程におけるミクログリアによるシナプスの貪食の障害が報告されているが20),さらに,シナプスの機能の異常および社会的な行動の異常がひき起こされることが示された31)(図3a).さらに,自閉症関連疾患の患者において機能が低下すると考えられている前帯状皮質および小脳においてミクログリアが活性化していることがわかっている32).また,自閉症関連疾患の患者の背外側前頭前皮質において13人のうち9人にミクログリアの活性化が認められ,白質では細胞体の体積が増加し,灰白質では細胞の密度が上昇していた33).さらに,自閉症関連疾患の患者の背外側前頭前皮質においてはミクログリアがニューロンの近くに配置されており,ミクログリアの突起がニューロンをとりかこむようすが観察されている34).つまり,自閉症関連疾患の患者において機能の低下が示唆される領域にはミクログリアの活性化やシナプスの密度の上昇が生じることが示され,ミクログリアの活性化と病態との関連が示唆されている.また,自閉症関連疾患の患者においては領域のあいだの結合の脆弱性が指摘されているが31),ミクログリアによるシナプスの除去の過程と領域のあいだの結合との関連が示唆されている19,20,31).
Rett症候群は自閉症様の症状をきたす神経発達障害であり,X染色体にコードされるMecp2遺伝子の変異によりひき起こされる35),これまで,Mecp2はニューロンのみならず,アストロサイト,ミクログリア,オリゴデンドロサイトにも発現することがわかっている.MeCP2を欠損したミクログリアがニューロンおよびシナプスに対し毒性を発揮することは明らかにされているものの36),生体におけるミクログリアに特異的なMecp2の欠損の影響については一致した見解が得られていない37,38).新たな知見として,Rett症候群の最終ステージにおいて,ミクログリアは前シナプスを過剰に取り込むことにより病態の形成に寄与することがあらためて示された.さらに,ミクログリアに特異的なMecp2の機能獲得型の変異あるいは機能欠損型の変異は,ミクログリアによる過剰な貪食,シナプスの減少,行動の異常にはあまり影響しないことが確認された39).したがって,ミクログリアはRett症候群の最終ステージにおいて機能する可能性が示された.
アルツハイマー型の認知機能障害については,その初期におけるシナプスの機能の喪失が指摘されている40).これまで,ミクログリアのひき起こす脳における慢性的な炎症が神経毒性による器質的な疾患をひき起こすと考えられてきた.一方,抗炎症薬が有効でないことや,代表的な抗炎症性サイトカインであるインターロイキン10がむしろ症状を悪化させると報告されていることなどから41),慢性的な炎症を抑制するだけでは病態の改善にはつながらないことが明らかにされてきた.アミロイドβタンパク質の除去にはミクログリアによる貪食が重要であるとされる一方,ミクログリアを除去したマウスにおいてもアミロイドβタンパク質には顕著な変化が認められないことから,ミクログリアによるアミロイドβタンパク質の貪食については議論がつづいている42).このようなミクログリアの2面性が病態に関与し,その進行にかかわることが理解されるようになってきた.発達期においてミクログリアがC1qに標識された未熟なシナプスを除去することにより適切な神経回路を形成することが示されているが19),アルツハイマー病のモデルマウスにおいてプラークを形成する以前のシナプスにC1qが増加していることが示され,アミロイドβタンパク質のオリゴマーがC1qを増加させることが明らかにされた.さらに,アミロイドβタンパク質のオリゴマーの投与による急性モデルにおいて,ミクログリアがC3受容体を介しシナプスを除去することが示された43).さらに,ミクログリアのC3受容体は脳脊髄液におけるアミロイドβタンパク質の除去を制御することも明らかにされた44).また,C3の欠損がアミロイド前駆体タンパク質あるいはプレセニリン1による神経変性に対し保護的に機能することが示された45).これらの事実から,発達期におけるミクログリアによるシナプスの除去の機構がアルツハイマー型認知機能障害において異常になり,必要なシナプスを除去することにより病態がひき起こされることが示唆された(図3b).アルツハイマー病のモデルマウスにおいては,ミクログリアにおけるTDP43の欠損がアミロイドβタンパク質を減少させる一方,同時に,劇的なシナプスの減少を示すことがわかった46)(図3b).また,前頭側頭型認知症の患者に認められるprogranulinの欠損がリソソームの欠損および補体の過剰な産生をひき起こし,ミクログリアによる選択的なシナプスの刈り込みの異常および行動の異常をおこし,この病態においては補体の活性化を抑制することにより行動の異常が改善することが明らかにされた47).
トリパノソーマの感染による睡眠障害モデルにおいて,ミクログリアが活性化していることが免疫組織的な手法により明らかにされている48).急性あるいは慢性的な睡眠の剥奪は炎症反応を惹起する.ヒトおよび哺乳類において,睡眠の剥奪により血中の白血球の数は増加し,インターロイキン1β,インターロイキン6,TNFαといった炎症性サイトカインの増加がひき起こされ,血液脳関門の透過性が亢進する49).近年,ミクログリアには概日リズムの存在することが示されており,夜間のほうが昼と比較して突起の長さや数が多く形態が異なることが知られている50).そのため,概日リズムによってミクログリアの機能が異なる可能性が示唆される.さらに,睡眠の剥奪がシナプスの貪食を促進するという結果が得られ,慢性的な睡眠の不足は炎症性タンパク質の発現の上昇をともなわない形態的なミクログリアの活性化をひき起こすことが示されている51).
全身性エリテマトーデスは自己免疫疾患のひとつで,若年の女性に好発し,全身性の炎症性臓器障害を起こす.発熱,疲労感,体重の減少,多臓器病変といった全身性の症状や,皮膚粘膜,腎症状,新血管症状といった部分的な症状のほか,中枢神経の症状として痙攣,髄膜炎,精神疾患が共通してみられる.抗NMDA受容体抗体,抗リボソームP抗体,抗リン脂質抗体などの自己抗体の産生や補体に依存性のアポトーシスが認められ,中枢神経の症状との関与が指摘されているが,明確な機構は解明されていない52).中枢神経の症状は初期に診断されること,中枢神経の症状は自己免疫が消失した状態においても変わりなく生じることが報告されており53),末梢組織における免疫の状態が精神症状を規定する可能性が注目されている.すなわち,全身性エリテマトーデスのモデルマウスであるMRL/lprの骨髄キメラマウスを作製すると,全身性の自己免疫がほぼ消失した一方,中枢神経の症状は生じたままであった53).したがって,このモデルマウスにおける中枢神経の症状はいったん生じると不可逆的なものであるのか,あるいは,独立したものであることが示唆される.全身性エリテマトーデスの患者から採取した血清がミクログリアの細胞株であるBV2細胞を活性化させることが明らかにされている54).中枢神経の症状を呈する全身性エリテマトーデスのモデルマウスにおいて生じる中枢神経の症状およびシナプスの消失は,I型インターフェロンシグナルの阻害により抑制された55).さらに,I型インターフェロンによるミクログリアの活性化によりニューロンあるいはシナプスに関連する物質が貪食されることが明らかにされた(図3c).
おわりに
遺伝子の発現の網羅的な解析から,ミクログリアにおける遺伝子の発現には領域に特異的な多様性の存在することが報告された56).さらに,領域ごとにミクログリアのターンオーバー率が異なっており,休止状態のミクログリアはランダムに自己複製するのに対し,病態の際には特定のミクログリアがクローナルに増殖することが示された.また,増殖ののちにはアポトーシスおよびほかの領域への拡散によりミクログリアは減少し正常な状態にもどることも示された57).ミクログリアの形態は脳の領域において異なることが知られており,ミクログリアの多様性にはこのような起源の違いがかかわるのかもしれない.ミクログリアの性質には性差のあることも示されており58),性別により発症率や重症度に差異の認められる疾患においてはミクログリアの性差がかかわる可能性が考えられる.ミクログリアは発達期の早期から脳に存在するため,ミクログリアの異常は神経回路の形成や,自閉症に代表される神経発達障害などに関与する可能性がある.
文 献
- Ransohoff, R. M. & Perry, V. H.: Microglial physiology: unique stimuli, specialized responses. Annu. Rev. Immunol., 27, 119-145 (2009)[PubMed]
- Ginhoux, F., Greter, M., Leboeuf, M. et al.: Fate mapping analysis reveals that adult microglia derive from primitive macrophages. Science, 330, 841-845 (2010)[PubMed]
- Nimmerjahn, A., Kirchhoff, F, & Helmchen, F.: Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science, 308, 1314-1318 (2005)[PubMed]
- Kato, G., Inada, H., Wake, H. et al.: Microglial contact prevents excess depolarization and rescues neurons from excitotoxicity. eNeuro, 3, 16 (2016)[PubMed]
- Li, Y., Du, X. F., Liu, C. S. et al.: Reciprocal regulation between resting microglial dynamics and neuronal activity in vivo. Dev. Cell, 23, 1189-1202 (2012)[PubMed]
- Davalos, D., Grutzendler, J., Yang, G. et al.: ATP mediates rapid microglial response to local brain injury in vivo. Nat. Neurosci., 8, 752-758 (2005)[PubMed]
- Haynes, S. E., Hollopeter, G., Yang, G. et al.: The P2Y12 receptor regulates microglial activation by extracellular nucleotides. Nat. Neurosci., 9, 1512-1519 (2006)[PubMed]
- Wake, H., Moorhouse, A. J., Jinno, S. et al.: Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals. J. Neurosci., 29, 3974-3980 (2009)[PubMed]
- Marin-Teva, J. L., Dusart, I., Colin, C. et al.: Microglia promote the death of developing Purkinje cells. Neuron, 41, 535-547 (2004)[PubMed]
- Cunningham, C. L., Martinez-Cerdeno. V., & Noctor. S. C.: Microglia regulate the number of neural precursor cells in the developing cerebral cortex. J. Neurosci., 33, 4216-4233 (2013)[PubMed]
- Sierra, A., Encinas, J. M., Deudero, J. J. et al.: Microglia shape adult hippocampal neurogenesis through apoptosis-coupled phagocytosis. Cell Stem Cell, 7, 483-495 (2010)[PubMed]
- Blinzinger, K. & Kreutzberg, G.: Displacement of synaptic terminals from regenerating motoneurons by microglial cells. Z. Zellforsch. Mikrosk. Anat., 85, 145-157 (1968)[PubMed]
- Trapp, B. D., Wujek, J. R., Criste, G. A. et al.: Evidence for synaptic stripping by cortical microglia. Glia, 55, 360-368 (2007)[PubMed]
- Chen, Z., Jalabi, W., Hu, W. et al.: Microglial displacement of inhibitory synapses provides neuroprotection in the adult brain. Nat. Commun., 5, 4486 (2014)[PubMed]
- Lim, S. H., Park, E., You, B. et al.: Neuronal synapse formation induced by microglia and interleukin 10. PLoS One, 8, e81218 (2013)[PubMed]
- Parkhurst, C. N., Yang, G., Ninan, I. et al.: Microglia promote learning-dependent synapse formation through brain-derived neurotrophic factor. Cell, 155, 1596-1609 (2013)[PubMed]
- Miyamoto, A., Wake, H., Ishikawa, A. W. et al.: Microglia contact induces synapse formation in developing somatosensory cortex. Nat. Commun., 7, 12540 (2016)[PubMed]
- Lichtman, J. W. & Colman, H.: Synapse elimination and indelible memory. Neuron, 25, 269-278 (2000)[PubMed]
- Schafer, D. P., Lehrman, E. K., Kautzman, A. G. et al.: Microglia sculpt postnatal neural circuits in an activity and complement-dependent manner. Neuron, 74, 691-705 (2012)[PubMed]
- Paolicelli, R. C., Bolasco, G., Pagani, F. et al.: Synaptic pruning by microglia is necessary for normal brain development. Science, 333, 1456-1458 (2011)[PubMed]
- Sipe, G. O., Lowery, R. L., Tremblay, M. E. et al.: Microglial P2Y12 is necessary for synaptic plasticity in mouse visual cortex. Nat. Commun., 7, 10905 (2016)[PubMed]
- Costello, D. A., Lyons, A., Denieffe, S. et al.: Long term potentiation is impaired in membrane glycoprotein CD200-deficient mice: a role for Toll-like receptor activation. J. Biol. Chem., 286, 34722-34732 (2011)[PubMed]
- Pascual, O., Ben Achour, S., Rostaing, P. et al.: Microglia activation triggers astrocyte-mediated modulation of excitatory neurotransmission. Proc. Natl. Acad. Sci. USA, 109, E197-E205 (2012)[PubMed]
- Riazi, K., Galic, M. A., Kentner, A. C. et al.: Microglia-dependent alteration of glutamatergic synaptic transmission and plasticity in the hippocampus during peripheral inflammation. J. Neurosci., 35, 4942-4952 (2015)[PubMed]
- Rogers, J. T., Morganti, J. M., Bachstetter, A. D. et al.: CX3CR1 deficiency leads to impairment of hippocampal cognitive function and synaptic plasticity. J. Neurosci., 31, 16241-16250 (2011)[PubMed]
- Clark, A. K., Gruber-Schoffnegger, D., Drdla-Schutting, R. et al.: Selective activation of microglia facilitates synaptic strength. J. Neurosci., 35, 4552-4570 (2015)[PubMed]
- Coull, J. A., Beggs, S., Boudreau, D. et al.: BDNF from microglia causes the shift in neuronal anion gradient underlying neuropathic pain. Nature, 438, 1017-1021 (2005)[PubMed]
- Cantaut-Belarif, Y., Antri, M., Pizzarelli, R. et al.: Microglia control the glycinergic but not the GABAergic synapses via prostaglandin E2 in the spinal cord. J. Cell Biol., 216, 2979-2989 (2017)[PubMed]
- Hutsler, J. J. & Zhang, H.: Increased dendritic spine densities on cortical projection neurons in autism spectrum disorders. Brain Res., 1309, 83-94 (2010)[PubMed]
- Zoghbi, H. Y. & Bear, M. F.: Synaptic dysfunction in neurodevelopmental disorders associated with autism and intellectual disabilities. Cold Spring Harb. Perspect. Biol., 4, a009886 (2012)[PubMed]
- Zhan, Y., Paolicelli, R. C., Sforazzini, F. et al.: Deficient neuron-microglia signaling results in impaired functional brain connectivity and social behavior. Nat. Neurosci., 17, 400-406 (2014)[PubMed]
- Suzuki, K., Sugihara, G., Ouchi, Y. et al.: Microglial activation in young adults with autism spectrum disorder. JAMA Psychiatry, 70, 49-58 (2013)[PubMed]
- Morgan, J. T., Chana, G., Pardo, C. A. et al.: Microglial activation and increased microglial density observed in the dorsolateral prefrontal cortex in autism. Biol. Psychiatry, 68, 368-376 (2010)[PubMed]
- Morgan, J. T., Chana, G., Abramson, I. et al.: Abnormal microglial-neuronal spatial organization in the dorsolateral prefrontal cortex in autism. Brain Res., 1456, 72-81 (2012)[PubMed]
- Amir, R. E., Van den Veyver, I. B., Wan, M. et al.: Rett syndrome is caused by mutations in X-linked MECP2, encoding methyl-CpG-binding protein 2. Nat. Genet., 23, 185-188 (1999)[PubMed]
- Maezawa, I. & Jin, L. W.: Rett syndrome microglia damage dendrites and synapses by the elevated release of glutamate. J. Neurosci.,30, 5346-5356 (2010)[PubMed]
- Derecki, N. C., Cronk, J. C., Lu, Z. et al.: Wild-type microglia arrest pathology in a mouse model of Rett syndrome. Nature, 484, 105-109 (2012)[PubMed]
- Wang, J., Wegener, J. E., Huang, T. W. et al.: Wild-type microglia do not reverse pathology in mouse models of Rett syndrome. Nature, 521, E1-E4 (2015)[PubMed]
- Schafer, D. P., Heller, C. T., Gunner, G. et al.: Microglia contribute to circuit defects in Mecp2 null mice independent of microglia-specific loss of Mecp2 expression. Elife, 5, e15224 (2016)[PubMed]
- Scheff, S. W., Neltner, J. H. & Nelson, P. T.: Is synaptic loss a unique hallmark of Alzheimer's disease? Biochem, Pharmacol., 88, 517-528 (2014)[PubMed]
- Guillot-Sestier, M. V., Doty, K. R., Gate, D. et al.: Il10 deficiency rebalances innate immunity to mitigate Alzheimer-like pathology. Neuron, 85, 534-548 (2015)[PubMed]
- Grathwohl, S. A., Kalin, R. E., Bolmont, T. et al.: Formation and maintenance of Alzheimer's disease β-amyloid plaques in the absence of microglia. Nat. Neurosci., 12, 1361-1363 (2009)[PubMed]
- Hong, S., Beja-Glasser, V. F., Nfonoyim, B. M. et al.: Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science, 352, 712-716 (2016)[PubMed]
- Czirr, E., Castello, N. A., Mosher, K. I. et al.: Microglial complement receptor 3 regulates brain Aβ levels through secreted proteolytic activity. J. Exp. Med., 214, 1081-1092 (2017)[PubMed]
- Shi, Q., Chowdhury, S., Ma, R. et al.: Complement C3 deficiency protects against neurodegeneration in aged plaque-rich APP/PS1 mice. Sci. Transl. Med., 9, eaaf6295 (2017)[PubMed]
- Paolicelli, R. C., Jawaid, A., Henstridge, C. M. et al.: TDP-43 depletion in microglia promotes amyloid clearance but also induces synapse loss. Neuron, 95, 297-308.e6 (2017)[PubMed]
- Lui, H., Zhang, J., Makinson, S. R. et al.: Progranulin deficiency promotes circuit-specific synaptic pruning by microglia via complement activation. Cell, 165, 921-935 (2016)[PubMed]
- Chianella, S., Semprevivo, M., Peng, Z. C. et al.: Microglia activation in a model of sleep disorder: an immunohistochemical study in the rat brain during Trypanosoma brucei infection. Brain Res., 832, 54-62 (1999)[PubMed]
- Hurtado-Alvarado, G., Pavon, L., Castillo-Garcia, S. A. et al.: Sleep loss as a factor to induce cellular and molecular inflammatory variations. Clin. Dev. Immunol., 2013, 801341 (2013)[PubMed]
- Hayashi, Y., Koyanagi, S., Kusunose, N. et al.: The intrinsic microglial molecular clock controls synaptic strength via the circadian expression of cathepsin S. Sci. Rep., 3, 2744 (2013)[PubMed]
- Bellesi, M., de Vivo, L., Chini, M. et al.: Sleep loss promotes astrocytic phagocytosis and microglial activation in mouse cerebral cortex. J. Neurosci., 737, 5263-5273 (2017)[PubMed]
- Dema, B. & Charles, N.: Autoantibodies in SLE: specificities, isotypes and receptors. Antibodies, 5, 2 (2016)
- Stock, A. D., Wen, J., Doerner, J. et al.: Neuropsychiatric systemic lupus erythematosus persists despite attenuation of systemic disease in MRL/lpr mice. J. neuroinflammation, 12, 205 (2015)[PubMed]
- Wang, J., Yang, C., Zhao, Q. et al.: Microglia activation induced by serum of SLE patients. J. Neuroimmunol., 310, 135-142 (2017)[PubMed]
- Bialas, A. R., Presumey, J., Das, A. et al.: Microglia-dependent synapse loss in type I interferon-mediated lupus. Nature, 546, 539-543 (2017)[PubMed]
- Grabert, K., Michoel, T., Karavolos, M. H. et al.: Microglial brain region-dependent diversity and selective regional sensitivities to aging. Nat. Neurosci., 19, 504-516 (2016)[PubMed]
- Tay, T. L., Mai, D., Dautzenberg, J. et al.: A new fate mapping system reveals context-dependent random or clonal expansion of microglia. Nat. Neurosci., 20, 793-803 (2017)[PubMed]
- Lenz, K. M. & McCarthy, M. M.: A starring role for microglia in brain sex differences. Neuroscientist, 21, 306-321 (2015)[PubMed]
著者プロフィール
略歴:2007年 名古屋市立大学大学院医学研究科 修了,同年 生理学研究所 研究員,2009年 米国NIH National Institute of Child Health and Human Development研究員,2012年 基礎生物学研究所 助教,2014年 生理学研究所 准教授を経て,2016年より神戸大学大学院医学研究科 教授.
研究テーマ:神経回路およびグリア細胞の生体におけるイメージング.
抱負:科学の真実に近づくような研究をしていきたい.
研究室URL:http://www.med.kobe-u.ac.jp/nature/index.html
堀内 浩(Hiroshi Horiuchi)
生理学研究所 研究員.
宮本 愛喜子(Akiko Miyamoto)
神戸大学大学院医学研究科 特命助教.
鍋倉 淳一(Junichi Nabekura)
生理学研究所 教授.
© 2017 和氣弘明・堀内 浩・宮本愛喜子・鍋倉淳一 Licensed under CC 表示 2.1 日本