細胞競合の分子機構とその生理的な意義
2017/12/21
谷口喜一郎・井垣達吏
(京都大学大学院生命科学研究科 高次生命科学専攻システム機能学分野)
email:井垣達吏
領域融合レビュー, 6, e008 (2017) DOI: 10.7875/leading.author.6.e008
Kiichiro Taniguchi & Tatsushi Igaki: Mechanisms and physiological roles of cell competition.

組織において適応度の異なる2種類の細胞が近接すると,適応度のより高い細胞が生き残り,より低い細胞が排除される.この現象は1975年にショウジョウバエの翅原基において発見され“細胞競合”と名づけられた.そののち,さまざまな状況あるいは生物種において細胞競合の起こることが報告され,生体において恒常性を維持する重要な細胞間のコミュニケーションとして注目されるようになった.細胞競合は大きくMinute/Myc型とがん抑制型に分けられる.Minute/Myc型の細胞競合においては,適応度の高い細胞による適応度の低い細胞の貪食,Flower-Azotシグナル伝達経路による細胞の認識および細胞死の誘導,自然免疫シグナルによる細胞死の誘導の関与が明らかにされた.また,がん抑制型の細胞競合においては,TNF-JNKシグナル伝達経路による貪食,細胞の排除,細胞死の誘導,Sas-Ptp10Dシグナルによる適応度の高い細胞と適応度の低い細胞との境界面における制御が明らかにされた.ショウジョウバエの遺伝学を中心として進展してきた細胞競合の研究は,哺乳類のモデルにおける細胞競合の発見ともあいまって,ここ数年で大きな広がりをみせつつある.細胞競合の生理的な意義についてはながらく不明であったが,最近の研究により,胚の発生や組織における恒常性の維持,がんの制御など,さまざまな局面において重要な役割をはたす可能性が示されつつある.細胞競合の全容の解明は,多細胞生物の生命システムをささえる偶発的かつ確率論的な細胞間の相互作用の意義を理解し,多細胞からなるコミュニティの成立の原理にせまるとともに,そのしくみを利用した新たな医療の開発につながると期待される.
多細胞生物における恒常性の維持において,細胞死と細胞の増殖との協調的な制御は不可欠である.たとえば,組織において傷害をうけたあるいは異常を起こした細胞が細胞死を起こすと,周辺の細胞の増殖が厳密に制御されて組織における恒常性が維持される.細胞競合は適者生存の原理をつうじこのような細胞間のコミュニケーションを介した組織における恒常性の維持に寄与すると考えられる.近年,ショウジョウバエにおいて発見された細胞競合が哺乳類にも存在することが明らかにされ,細胞競合は多細胞生物において広く保存された機構であると考えられるようになった.このレビューにおいては,これまで明らかにされたショウジョウバエにおける細胞競合およびその制御機構について解説するとともに,哺乳類のモデルにおける細胞競合との類似点および相違点についてものべる.また,胚の発生,組織における恒常性の維持,がんの制御などにおいて役割をはたすと考えられる細胞競合の生理的な意義についても解説する.
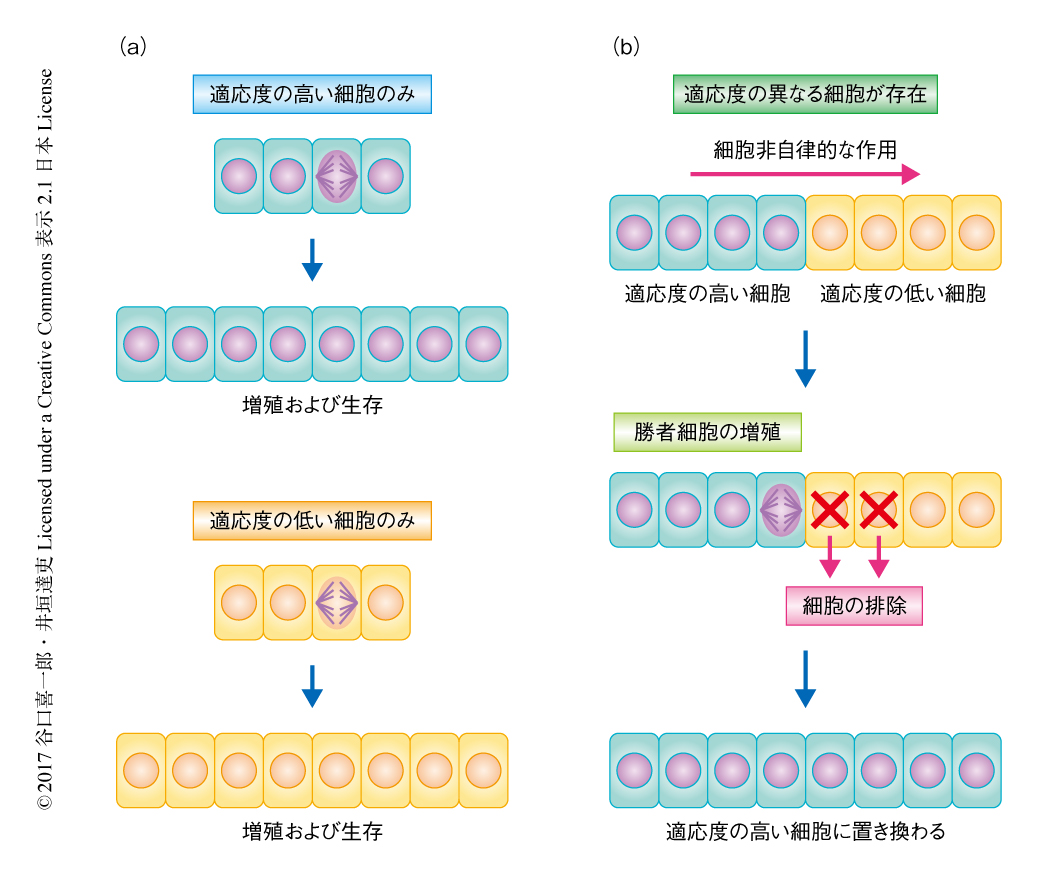
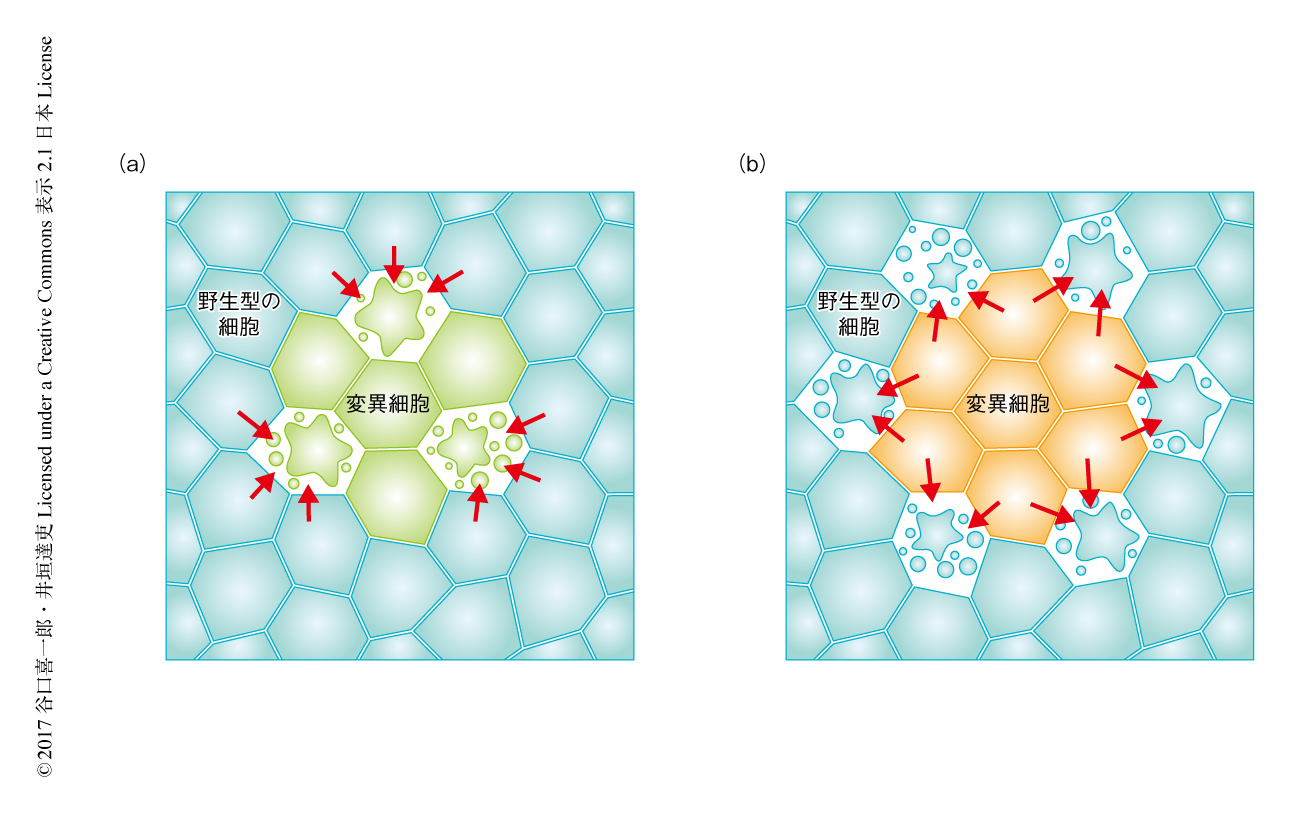
細胞競合(cell competition)は,状態の異なる2種類の細胞が近接した状況において数個の細胞のあいだの相互作用により起こる細胞の排除として定義づけられる.たとえば,成長している組織において,適応度の高い細胞と低い細胞とが近接すると,適応度の低い細胞が敗者細胞として組織から排除されるとともに適応度の高い細胞が勝者細胞として増殖し,結果的に敗者細胞が勝者細胞に置き換えられる.重要な点は,勝者細胞および敗者細胞のいずれも単独では生存および増殖が可能であることである(図1).細胞競合は野生型の細胞にかこまれた変異細胞が排除される現象として発見されたが,ある種の変異細胞は“超競合者”(super-competitor)となり近接する野生型の細胞を排除することも見い出された(図2).さらにそののち,さまざまな変異が細胞競合をひき起こすことが明らかにされた.
細胞競合は,1975年,ショウジョウバエのリボソームタンパク質遺伝子の変異体を用いた実験において見い出された1).リボソームタンパク質遺伝子はハプロ不全によりMinute表現型とよばれる個体の発生の遅延および感覚毛の微細化をひき起こし,それらの変異体はMinute変異体と総称される.ショウジョウバエのMinute変異体は生存および生殖が可能である.ところが,発生期の翅においてMinute変異細胞と野生型の細胞とがモザイク状に共存するとMinute変異細胞のみが排除され,最終的に野生型の細胞のみからなる翅がつくられることが示された.
この細胞競合の発見から30年後,細胞競合におけるMinute変異細胞の排除の実態が野生型の細胞との境界面におけるアポトーシスであることがわかり,細胞間の相互作用を介した細胞の排除が実質的に明らかにされた2).これらの観察から,適応度の異なる細胞どうしが近接した際,適応度の高い細胞は生き残り,適応度の低い細胞は排除されるという細胞競合の基本的な概念が確立された.
Minute変異細胞による細胞競合が発見されたのち,さまざまな変異あるいは細胞の変化により細胞競合がひき起こされることが報告された.現在,細胞競合としてコンセンサスが得られているものは,Minute/Myc型の細胞競合,がん抑制型の細胞競合,そのほかの細胞競合,に大別される.これらの細胞競合について,ショウジョウバエにおける研究により見い出された知見を解説する.
Minute/Myc型の細胞競合:Minute変異体における細胞競合の発見から約30年後,ショウジョウバエの翅原基において細胞競合をひき起こす第2の因子が見い出された.すなわち,がん遺伝子であるMyc遺伝子を高発現する細胞は超競合者となり,周辺の野生型の細胞を細胞死により排除することが報告された3,4).Minute変異はタンパク質の合成を低下させ,Myc遺伝子の高発現はタンパク質の合成を亢進することから,このMyc型の細胞競合もMinute型の細胞競合と同様にタンパク質の合成能の相対差により起こる可能性がある.実際に,これらの細胞競合の分子機構には高い共通性がみられる.細胞競合をひき起こす変異の多くはMinute変異あるいはMyc遺伝子と機能的に相互作用することが示され,これら2つの細胞競合は細胞の適応度を理解するのにもっともシンプルかつベースになるモデルであるといえる.
がん抑制型の細胞競合:さまざまながん関連遺伝子の変異細胞が細胞競合において敗者細胞となり組織から排除される現象が知られている.ショウジョウバエの上皮性の悪性腫瘍の代表的なモデルであるscrib変異体やdlg変異体を用いた解析により,頂底極性の崩壊した細胞が細胞競合において敗者細胞となり排除されることが明らかにされた5,6).同様に,がん遺伝子であるSrc遺伝子を抑制するCsk遺伝子の変異細胞や,がん抑制遺伝子であり細胞における膜輸送に関与するTSG101遺伝子,Rab5遺伝子,Vps25遺伝子,avalanche/Syx7遺伝子の変異細胞も,野生型の細胞にかこまれると細胞競合において敗者細胞になる.これらの事実から,細胞競合は生体に内在するがんの抑制機構として機能することが示唆される.一方で,頂底極性タンパク質をコードするcrumbs遺伝子の変異細胞は超競合者としてふるまうと報告された.
そのほかの細胞競合:現時点において,Minute/Myc型あるいはがん抑制型のいずれにも分類されない細胞競合が存在する.がんの抑制経路であるHippoシグナル伝達経路にかかわるexpanded遺伝子,fat遺伝子,salvador遺伝子,hippo遺伝子,warts遺伝子,mats遺伝子の変異細胞が超競合者になることが示された7).ここで,Hippoシグナルの下流において抑制される転写因子YorkieはMyc遺伝子の転写を誘導することが示され8),HippoシグナルはMyc型の細胞競合により超競合を起こす可能性が考えられる.また,増殖シグナルであるWgシグナルの細胞間での強度差がMyc遺伝子に非依存的に細胞競合をひき起こすことが示された9).このWgシグナルによりひき起こされる細胞競合においては,勝者細胞において高く発現する分泌タンパク質Notumが敗者細胞のアポトーシスを誘導する9).さらに,同じく増殖シグナルであるJAK-STATシグナルの細胞間での強度差が細胞競合をひき起こすことも示された10).このJAK-STATシグナルによりひき起こされる細胞競合は,Minute/Myc型の細胞競合と同様に,hid遺伝子に依存的な敗者細胞のアポトーシスを誘導するものの,その機構はMyc遺伝子およびWgシグナルには非依存的であることが示された10).一方,mahjong遺伝子の変異細胞が細胞競合の敗者としてふるまうことが示された11).Mahjongはがん抑制タンパク質としてはたらく頂底極性タンパク質Lglの下流の制御タンパク質であり,やはり,がん抑制タンパク質としての一面をもつ.しかし,mahjong変異細胞は極性の崩壊を起こさず,がん抑制型の細胞競合とは異なる現象であるといえる11).有糸分裂サイクル(G1期,S期,G2期,M期)から核内倍加サイクル(G期,S期)へと転換する卵濾胞細胞を用いた実験により,細胞競合によるmahjong変異細胞の排除は分裂を停止した細胞においても起こることが示された12).この分裂を停止した細胞の細胞競合は,Minute変異によっても起こる12).また,数理モデルにおいて,物理的な作用が細胞競合をひき起こしうることが示され,機械的な競合(mechanical competition)の概念が提唱された13).ショウジョウバエの背板の発生をモデルにした実験により,細胞が過密したときに増殖率の差により生じる機械的な刺激が低増殖の細胞にアポトーシスを誘導するという機械的な競合の実例が示された14).
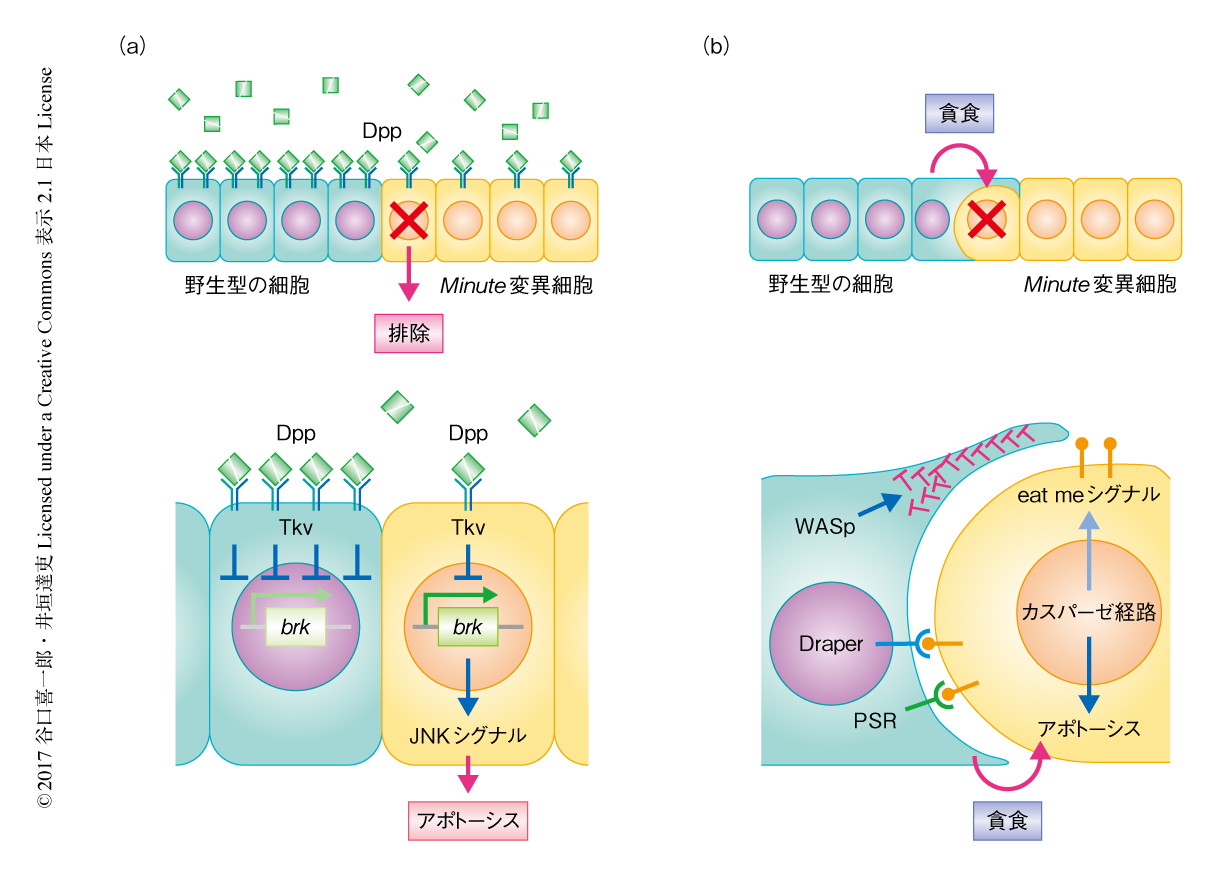
2002年,細胞競合によるMinute変異細胞の細胞死の誘導が生存因子の捕捉の不全によるという“Dpp捕捉モデル”が提唱された.すなわち,Minute変異細胞においてはエンドサイトーシスの低下によりDppシグナルが低下し,これによりDppシグナルにより抑制されるBrkの発現が上昇する.BrkはJNKシグナルを活性化することによりアポトーシスを誘導する.これらの観察から,Minute変異細胞においては野生型の細胞と比べ相対的にDppの取り込みが不足することによりアポトーシスが誘導され組織から排除されるというモデルが提唱された2)(図3a).しかし2007年,別の研究グループにより,Dppシグナルを上昇させる変異が必ずしもMinute変異細胞のアポトーシスを抑制しないことからDpp捕捉モデルに疑問を呈された7).さらに,野生型の細胞が近接するMinute変異細胞を貪食することにより排除するという“貪食モデル”が提唱され,細胞どうしの直接的な接触の重要性が提示された15)(図3b).実際に,貪食に関与するPSR遺伝子,Draper遺伝子,WASp遺伝子が敗者細胞の排除に必要であることが示された15).
Myc型の細胞競合の制御機構については“Flower-Azot制御モデル”および“自然免疫シグナル制御モデル”が提唱されている.2つのモデルとも,Myc型の細胞競合の制御機構はMinute型の細胞競合にも適用が可能であることを示す一方,勝者細胞と敗者細胞との直接的な接触が細胞の排除に必要かどうかという点で2つのモデルは異なる.また,実際の細胞競合において,それぞれの制御機構がどのくらい寄与するかについては,現在,明確なコンセンサスは得られていない.
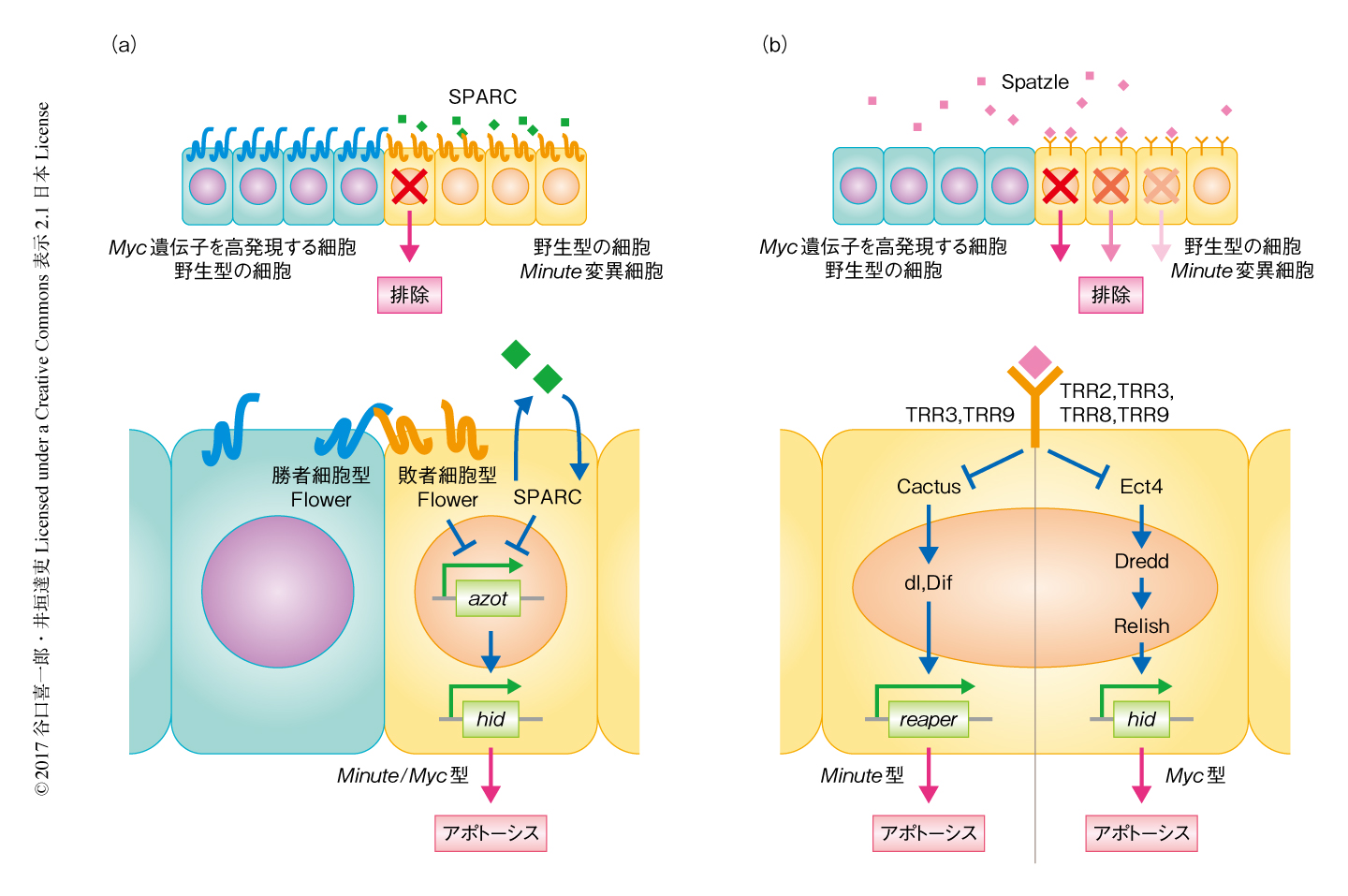
Flower-Azot制御モデル:Myc遺伝子の高発現により超競合をひき起こしたショウジョウバエの翅原基において遺伝子発現のプロファイルを解析することにより,flower遺伝子,SPARC遺伝子,azot遺伝子という細胞競合を制御する3つの遺伝子が同定された16-18).一連の遺伝学的な解析により,Myc遺伝子を高発現する細胞と野生型の細胞との直接的な接触により,野生型の細胞においてFlower-Azotシグナル伝達経路が活性化されるというモデルが提唱された(図4a).膜貫通タンパク質をコードするflower遺伝子は選択的スプライシングにより3種類のアイソフォームを産生する.そのうちひとつは勝者細胞,残り2つは敗者細胞において産生されたことから,Flowerは勝者細胞と敗者細胞を標識するタンパク質であると考えられた17).敗者細胞型のFlowerを産生する細胞は,勝者細胞型のFlowerを産生する細胞との直接的な接触を介してazot遺伝子の発現を誘導する.Azotはアポトーシス誘導遺伝子であるhid遺伝子の発現を誘導することにより敗者細胞の排除をひき起こす16).一方,敗者細胞においては基底膜を構成する分泌タンパク質SPARCの発現が誘導される18).SPARCは,Azotによるアポトーシスの誘導に対し抑制的にはたらくことにより,一時的に適応度が低下しただけの細胞が不必要に排除されるのを抑制するとされる.Flower-Azotシグナル伝達経路による勝者細胞と敗者細胞の標識および細胞死の誘導は,Minute型の細胞競合においても同様に機能することが示された.
自然免疫シグナル制御モデル:勝者細胞からはなれて存在する敗者細胞においてもアポトーシスが起こる点に注目し,細胞競合の制御における液性因子の重要性が提唱された19).そののち,サイトカインSpatzleおよびToll関連受容体(Toll-related receptor:TRR)による自然免疫シグナルを介して敗者細胞が排除されるという新たなモデルが提唱された20)(図4b).Myc遺伝子の高発現による超競合における自然免疫シグナルの関与が調べられ,グラム陰性細菌に対する応答経路であるImdシグナル伝達経路の構成タンパク質であるPGRP-LC,FADD,Ect4,Dredd,Casper,Relishがこの細胞競合に必要であることが示された.敗者細胞になる野生型の細胞において,サイトカインSpatzleがTRR2,TRR3,TRR8,TRR9と結合してこれらのシグナル伝達経路を活性化し,これにより転写因子Relishが活性化されてhid遺伝子の転写が誘導されアポトーシスが起こる.Minute型の細胞競合においては,敗者細胞になるMinute変異細胞においてTRR3およびTRR9を介して真菌に対する応答経路であるTollシグナル伝達経路が活性化し,その下流の構成タンパク質であるCactus,dl,Difを介してアポトーシス誘導タンパク質Reaperの発現が誘導されアポトーシスが起こる.敗者細胞においてTRR2,TRR8,TRR9の発現が誘導されることが示され,これが細胞競合のトリガーになる可能性が考えられる.
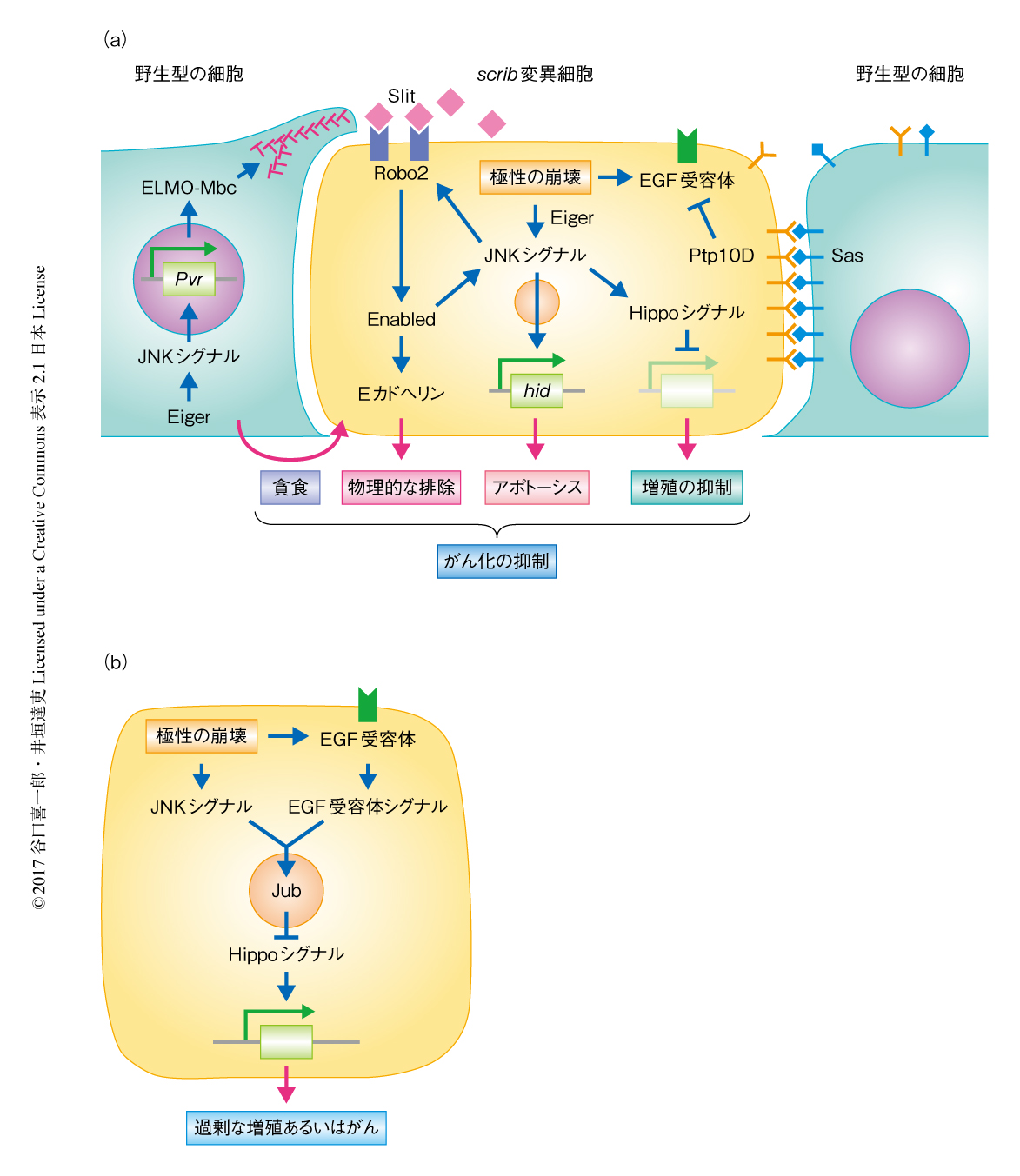
がんのほとんどは上皮に由来し,その進行および悪性化には,頂底極性や細胞接着など上皮性の喪失が密接に関与する.一方で,scrib変異やdlg変異などにより極性の崩壊を起こした細胞は正常な細胞にかこまれると細胞競合において敗者細胞になり上皮組織から排除される.筆者らの研究グループによる,scrib変異細胞の排除にかかわる遺伝子の大規模な遺伝学的なスクリーニングにより,その分子機構の大部分が明らかにされた21-23)(文献22) は 新着論文レビュー でも掲載,文献23) は 新着論文レビュー でも掲載).すなわち,極性の崩壊によりひき起こされるがん抑制型の細胞競合は,勝者細胞による貪食,敗者細胞の物理的な排除,敗者細胞の増殖の抑制および細胞死の誘導,の3つの過程が同時に進行することにより駆動されると考えられる.いずれの過程においても,Eiger/TNF-JNKシグナル伝達経路が中心的な役割をはたす.
勝者細胞による貪食:scrib変異細胞により細胞競合がひき起こされると,scrib変異細胞およびそれに隣接する野生型の細胞においてJNKシグナルが活性化する24).具体的には,極性が崩壊した細胞とそれに隣接する細胞においてエンドサイトーシス活性が上昇し,これにより細胞膜に存在するショウジョウバエにおけるTNFのホモログであるEigerがエンドソームに移行することによりエンドソームにおいて下流のJNKシグナルが活性化する5).scrib変異細胞におけるJNKシグナルの活性化はアポトーシスを亢進する.一方,周辺の野生型の細胞におけるJNKシグナルの活性化は隣接するscrib変異細胞の貪食を亢進することによりその排除を促進する22)(図5a).具体的には,野生型の細胞において活性化したJNKシグナルはPvrの発現を誘導し,これが貪食のシグナルを伝達するELMO-Mbcシグナル伝達経路を活性化することによりアクチン細胞骨格の再編成が起こり,scrib変異細胞は貪食により排除される.
敗者細胞の物理的な排除:極性の崩壊した細胞のふるまいのひとつとして,上皮層の頂端側あるいは基底側への離脱が知られている.ショウジョウバエの遺伝学的なスクリーニングにより,scrib変異細胞におけるJNKシグナルはアポトーシスの誘導のみならず敗者細胞の物理的な排除にも関与することが示された21)(図5a).すなわち,JNKシグナルは神経軸索の投射の制御に関与するSlit,Robo2,Enabledの発現を誘導し,これによりscrib変異細胞においてSlit-Robo2シグナルが活性化してその下流の標的であるEnabledが活性化される.Enabledはアクチン制御タンパク質のひとつであり,アドヘレンスジャンクションを構成するEカドヘリンの分解や細胞の運動性の促進によりscrib変異細胞の上皮層からの物理的な排除を促進する.Robo2-Enabledシグナル伝達経路はJNKシグナルを活性化することも確認され,細胞の排除にかかわる一連のシグナルは正のフィードバック制御を形成すると考えられる.
敗者細胞の増殖の抑制および細胞死の誘導:極性の崩壊によりひき起こされる細胞競合においては,勝者細胞と敗者細胞との認識は2つの細胞表面の膜タンパク質SasおよびPtp10Dにより制御されることが示された23)(図5a).SasおよびPtp10Dは,Slit,Robo2,Enabledと同様に神経軸索の投射の制御に関与し,Sasがリガンドとして,Ptp10Dが受容体として機能する.SasおよびPtp10Dは上皮細胞ではともに細胞の頂端側に局在し,隣接する細胞にむけ側面に提示されることはない.しかし,組織において極性が崩壊したscrib変異細胞が出現すると,scrib変異細胞と野生型の細胞との境界面において,野生型の細胞からはSas,scrib変異細胞からはPtp10Dが細胞の側面に提示され,敗者細胞においてSas-Ptp10Dシグナルがトランスに活性化される.Sas-Ptp10Dシグナルによる増殖の抑制を理解するには,極性の崩壊した細胞におけるがんの形成機構を理解する必要がある(図5b).上皮細胞における極性の崩壊は,JNKシグナルにくわえEGF受容体シグナルの活性化をひき起こす.JNKシグナルとEGF受容体シグナルは協調的に機能することによりJubを活性化する.Jubの活性化はアクチンの再編成を介してHippoシグナルを抑制し,結果として,細胞の過剰な増殖あるいはがん化をひき起こす25).一方で,Sas-Ptp10Dシグナルの存在下では,Sasにより極性の崩壊した細胞において活性化したPtp10DがEGF受容体をおそらく直接的に脱リン酸化することによりそのシグナルを抑制する.これにより,JNKシグナルがアポトーシスの誘導シグナルとして機能するようになる.同時に,JNKシグナルがHippoシグナルに対し促進的にはたらくことにより細胞の増殖が抑制される.Sas-Ptp10Dシグナルは,Minute変異,Myc遺伝子の高発現,Hippoシグナルの低下による細胞競合には関与しないことから,Minute/Myc型の細胞競合とがん抑制型の細胞競合では制御機構が大きく異なると考えられる.
ショウジョウバエにおいて見い出された細胞競合と同様の競合的な細胞の排除が哺乳類のモデルにおいても観察されるようになり,細胞競合が広く保存された細胞間のコミュニケーションであると考えられるようになった.
イヌの上皮性の培養細胞であるMDCK細胞を用いて,がん遺伝子であるRas遺伝子あるいはSrc遺伝子が活性化した細胞が正常な細胞にかこまれると,単層培養から排除されることが見い出された26,27).このとき,勝者細胞になる野生型の細胞においては,アクチン束化タンパク質FilaminがRas遺伝子あるいはSrc遺伝子が活性化した細胞との境界面に集積し,Vimentinの束化を促進することにより細胞の排除がひき起こされる28).一方で,敗者細胞になるRas遺伝子あるいはSrc遺伝子が活性化した細胞においては,アクチン束化タンパク質であるEPLINが集合することによりII型ミオシンやプロテインキナーゼAが活性化され,上皮組織からの離脱が促進される29).EPLINはPDK4を介してミトコンドリアの傷害および解糖系の亢進をひき起こす30)(新着論文レビュー でも掲載).PDK4によるミトコンドリアの傷害が敗者細胞の排除に必要であったことから,細胞における代謝が細胞競合において重要な機能をもつ可能性が示された.
肝臓の疾患のモデルであるDPPIV変異マウスの肝臓に野生型の胎仔の肝幹細胞を移植すると,移植した細胞の増殖および近接するDPPIV変異細胞のアポトーシスにより肝臓は野生型の細胞に置き換わっていくことが見い出され,細胞競合を介した組織の再構築の可能性が示された31).また,マウスの皮膚組織における毛包に注目し,がん原性の変異細胞が野生型の細胞から排除されることが見い出された32).毛包は成長期と退行期をくり返すという特徴的な代謝システムをもつが,変異細胞は退行期において組織から除去される.この細胞の排除は周辺の野生型の細胞の存在に依存して起こることから,細胞競合である可能性が高い.
Minute/Myc型の細胞競合は哺乳類の個体においても見い出された.キメラマウスを用いた実験系において,ショウジョウバエと同様にリボソームタンパク質遺伝子の変異細胞が発生の過程において細胞競合により個体から排除されることが示された33).また,マウスの初期胚のエピブラストがMyc型の細胞競合により選別されることが示された34,35).マウスの胚における細胞競合に貪食が関与することも示され,ショウジョウバエにおける細胞競合との類似性がうかがえる.一方,scrib変異による細胞競合も哺乳類の細胞において見い出された.scrib遺伝子をノックダウンしたMDCK細胞が正常なMDCK細胞にかこまれると敗者細胞となり排除されることが示された36).このscrib変異によりひき起こされるMDCK細胞の排除は,JNKではなくp38 MAPKを介して起こる.別の研究グループは,このscrib変異細胞の除去が機械的な競合であるとしている37).このように,細胞競合における細胞の排除の機構はショウジョウバエと哺乳類とで必ずしも共通していない.一方で,mahjong遺伝子をノックダウンしたMDCK細胞については,ショウジョウバエと同様の機構でアポトーシスにより排除されることが示された11).
Hippoシグナル伝達経路を介した細胞競合も哺乳類のモデルにおいて報告された.マウスの培養細胞であるNIH3T3細胞を用いて,Hippoシグナル伝達経路を介した超競合が示された38).哺乳類においてHippoシグナルの下流にて抑制されるYapは,転写因子Teadと結合して標的になる遺伝子の転写を誘導する.このTeadの活性レベルの相対差がNIH3T3細胞の細胞競合をひき起こし,Teadの活性が高いと勝者細胞,Teadの活性が低いと敗者細胞になることが示された.また,TeadがMyc遺伝子の発現を誘導することも示され,哺乳類におけるHippo-Mycシグナル伝達経路を介した超競合の存在が示唆された.一方で,別の研究グループにより,MDCK細胞においてはYapの活性化した細胞が細胞競合において敗者細胞になることが示された39).非上皮細胞と上皮細胞とではHippoシグナル伝達経路に変異をもつ細胞のふるまいが異なるのかもしれない.
細胞競合による細胞の集団の品質管理は,脆弱な細胞や病変した細胞の組織からの排除を可能にすると考えられる.しかし,細胞競合が実際に生体システムの維持において機能することを直接的に示した報告は少ない.これは,これまで細胞競合の機構を欠失した個体を解析することが困難であったことを考えれば当然のことかもしれない.しかしながら,細胞競合を駆動する細胞間のコミュニケーションにはたらくタンパク質が同定されたことにより,その生理的な意義の解析が可能になってきた.細胞競合の生理的な機能として,がんの抑制,傷害をうけた細胞の排除,個体における発生の制御について解説する.
がんの抑制:Minute/Myc型の細胞競合およびがん抑制型の細胞競合とも,がんの制御との密接な関係が予想される.一方で,実際に細胞競合ががんの発生あるいは進展に寄与するという証拠はまだほとんどない.そのなかでも,ヒトのがん組織において抗SPARC抗体を用いて敗者細胞を標識することにより細胞競合の有無が調べられ,実際に,膵管腺がんと比較して野生型の細胞がSPARCを高く発現することが示された40).がんの病変におけるSPARCの発現の変動については過去にも複数の報告があり,がんの進展と細胞競合との関係性が示唆される.また,マウスにおけるflower遺伝子のホモログであるmflower遺伝子を欠損したマウスが作製され,誘導性の皮膚パピローマの増殖が抑制されることが示された41).これらの結果から,がん細胞が超競合者になることで組織において拡大する可能性が示された.一方,ヒトにおけるPtp10DのホモログであるPTPRJはがん抑制タンパク質として機能することが知られている42).PTPRJはショウジョウバエのPtp10Dと同様にEGF受容体に対する抑制能をもつことがわかっており,ヒトのがんにおいてもショウジョウバエと同様の細胞競合を介したがんの抑制の起こる可能性がある.しかし,SPARC,mFlower,PTPRJによるがんの制御が細胞競合を介したものであるかどうかについてはまだ十分に調べられていない.哺乳類のモデルにおけるがんと細胞競合の関係性については,さらなる解析が必要である.
傷害をうけた細胞の排除:細胞競合の性質をかんがみれば,細胞競合による細胞の集団の品質管理が組織の健常性の維持に貢献する可能性は高い.しかし,細胞競合と組織における恒常性との因果関係について示した報告はまだ少ない.Azotの解析をつうじて,細胞競合が傷害をうけた細胞の排除に関与することが提唱された16).ショウジョウバエの翅は幼虫期の後期に顕著に成長するが,この時期に紫外線の照射により細胞を傷害するストレスをあたえても翅の形成に異常は生じない.しかし,azot変異体の翅は紫外線の照射により顕著な異常を示す.これらの結果から,翅の形成に異常を生じさせるような傷害をうけた細胞は内在性の細胞競合により排除されることが示唆される.実際に,azot変異体における翅の異常は,azot遺伝子のエンハンサーに依存してアポトーシスを誘導することによりレスキューされる.また,Azotによるアポトーシスの誘導が個体の寿命を伸ばすことも示され,組織の恒常性の維持における細胞競合の重要性が提示された.
個体における発生の制御:個体の発生の過程において細胞の数を制御する手段として,いったん細胞を過剰に産生したのち不要な細胞を取り除くことはめずらしくはない.細胞競合はこのような過程において不要な細胞の除去や優良な細胞の選択に関与する可能性が示された.Flower-Azotシグナル伝達経路を介した細胞競合がショウジョウバエにおける複眼の発生の過程において生じる不要な視神経を除去することが報告された16,43).以前から,複眼の形成の過程においては辺縁部のニューロンがアポトーシスを起こすことが知られていたが,この細胞の排除は敗者細胞型のFlowerにより不要な細胞が敗者細胞として標識されることにより起こることが示された.一方,Myc型の細胞競合がマウスの初期の発生において優良なエピブラストの選別に寄与することが報告された34,35).胚発生の初期の幹細胞プールにおいて細胞競合により優良な細胞が選別されるというこの報告は,からだづくりの根本に細胞競合が存在することを示し,大きなインパクトをあたえた.
細胞競合の発見から40年,ようやくこの現象の分子実態の理解が進んできた.Flower-Azotシグナル伝達経路およびSas-Ptp10Dシグナルによる勝者細胞と敗者細胞のコミュニケーションの機構がみえてきたことにより,細胞競合をつかさどる経路の存在が明確なものになった.しかし一方で,Minute/Myc型の細胞競合の制御機構については,いまだコンセンサスが得られるにいたっていない.細胞競合を駆動する細胞の適応度の決定機構および細胞の排除の機構を理解するうえで,Minute/Myc型の細胞競合の全容の解明は必須である.一方,がん抑制型の細胞競合の制御にかかわるタンパク質として,神経軸索の投射の制御に関与するタンパク質が多く同定されたことは興味深い.神経軸索の投射の制御は,異なる細胞の認識とそれに応じた細胞の挙動を可能にするすぐれた制御系であり,細胞競合の制御とも共通する点が多い.一方で,すべての細胞競合がFlower-Azotシグナル伝達経路あるいはSas-Ptp10Dシグナルにより説明されるわけではなく,その全容は依然として多くの謎につつまれている.近年,さまざまなタイプの細胞競合が見い出されたことにより,細胞競合のトリガーになる因子や制御機構は多様であることもわかってきた.一方で,それら多様な細胞競合はいっけん類似した細胞の挙動を示すものの,じつはまったく異なる生体応答をみている可能性もある.今後,多様な細胞競合に通底する基本原理を見い出すことにより,真の意味で細胞競合が理解されるようになると思われる.
ショウジョウバエにおいて見い出されたMinute/Myc型の細胞競合およびがん抑制型の細胞競合が哺乳類にも存在し,その制御機構にも類似点が多いという事実は重要である.今後,細胞競合の研究から得られた知見を,がんをはじめとしたさまざまな疾患の理解やその治療法の開発に応用することが可能になるかもしれない.また,細胞競合は不良な細胞を優良な細胞に置き換えることが可能なシステムであり,その応用により再生医療や骨髄移植などさまざまな医療への貢献が期待される.一方,細胞競合の生理的な意義の解明により,細胞間のコミュニケーションを介した個体の発生あるいは生体の維持の機構の根本的な理解,さらには,多細胞からなるコミュニティが成立する原理にせまることができるかもしれない.細胞競合が個体における発生のイベントに関与するという事実は重要な意味をもつ.すなわち,個体の発生は単に発生プログラムにそった連続的な遺伝子制御のみで成立するのではなく,細胞競合を介した偶発的かつ確率論的な細胞間の相互作用および細胞運命の制御を要求することを示唆する.
略歴:2008年 東京理科大学大学院基礎工学研究科博士課程 修了,同年 東京理科大学基礎工学部 博士研究員,2009年 学習院大学理学部 助教を経て,2017年より京都大学大学院生命科学研究科 特定助教.
研究テーマ:個体の発生および維持におけるがん抑制型の細胞競合の生理的な役割.
抱負:細胞競合の理解をつうじて,組織の維持における細胞間のコミュニケーションの本質をとらえたい.
井垣 達吏(Tatsushi Igaki)
京都大学大学院生命科学研究科 教授.
研究室URL:https://www.lif.kyoto-u.ac.jp/genetics/
© 2017 谷口喜一郎・井垣達吏 Licensed under CC 表示 2.1 日本
(京都大学大学院生命科学研究科 高次生命科学専攻システム機能学分野)
email:井垣達吏
領域融合レビュー, 6, e008 (2017) DOI: 10.7875/leading.author.6.e008
Kiichiro Taniguchi & Tatsushi Igaki: Mechanisms and physiological roles of cell competition.
要 約
組織において適応度の異なる2種類の細胞が近接すると,適応度のより高い細胞が生き残り,より低い細胞が排除される.この現象は1975年にショウジョウバエの翅原基において発見され“細胞競合”と名づけられた.そののち,さまざまな状況あるいは生物種において細胞競合の起こることが報告され,生体において恒常性を維持する重要な細胞間のコミュニケーションとして注目されるようになった.細胞競合は大きくMinute/Myc型とがん抑制型に分けられる.Minute/Myc型の細胞競合においては,適応度の高い細胞による適応度の低い細胞の貪食,Flower-Azotシグナル伝達経路による細胞の認識および細胞死の誘導,自然免疫シグナルによる細胞死の誘導の関与が明らかにされた.また,がん抑制型の細胞競合においては,TNF-JNKシグナル伝達経路による貪食,細胞の排除,細胞死の誘導,Sas-Ptp10Dシグナルによる適応度の高い細胞と適応度の低い細胞との境界面における制御が明らかにされた.ショウジョウバエの遺伝学を中心として進展してきた細胞競合の研究は,哺乳類のモデルにおける細胞競合の発見ともあいまって,ここ数年で大きな広がりをみせつつある.細胞競合の生理的な意義についてはながらく不明であったが,最近の研究により,胚の発生や組織における恒常性の維持,がんの制御など,さまざまな局面において重要な役割をはたす可能性が示されつつある.細胞競合の全容の解明は,多細胞生物の生命システムをささえる偶発的かつ確率論的な細胞間の相互作用の意義を理解し,多細胞からなるコミュニティの成立の原理にせまるとともに,そのしくみを利用した新たな医療の開発につながると期待される.
はじめに
多細胞生物における恒常性の維持において,細胞死と細胞の増殖との協調的な制御は不可欠である.たとえば,組織において傷害をうけたあるいは異常を起こした細胞が細胞死を起こすと,周辺の細胞の増殖が厳密に制御されて組織における恒常性が維持される.細胞競合は適者生存の原理をつうじこのような細胞間のコミュニケーションを介した組織における恒常性の維持に寄与すると考えられる.近年,ショウジョウバエにおいて発見された細胞競合が哺乳類にも存在することが明らかにされ,細胞競合は多細胞生物において広く保存された機構であると考えられるようになった.このレビューにおいては,これまで明らかにされたショウジョウバエにおける細胞競合およびその制御機構について解説するとともに,哺乳類のモデルにおける細胞競合との類似点および相違点についてものべる.また,胚の発生,組織における恒常性の維持,がんの制御などにおいて役割をはたすと考えられる細胞競合の生理的な意義についても解説する.
1.細胞競合とは
細胞競合(cell competition)は,状態の異なる2種類の細胞が近接した状況において数個の細胞のあいだの相互作用により起こる細胞の排除として定義づけられる.たとえば,成長している組織において,適応度の高い細胞と低い細胞とが近接すると,適応度の低い細胞が敗者細胞として組織から排除されるとともに適応度の高い細胞が勝者細胞として増殖し,結果的に敗者細胞が勝者細胞に置き換えられる.重要な点は,勝者細胞および敗者細胞のいずれも単独では生存および増殖が可能であることである(図1).細胞競合は野生型の細胞にかこまれた変異細胞が排除される現象として発見されたが,ある種の変異細胞は“超競合者”(super-competitor)となり近接する野生型の細胞を排除することも見い出された(図2).さらにそののち,さまざまな変異が細胞競合をひき起こすことが明らかにされた.
2.細胞競合の発見
細胞競合は,1975年,ショウジョウバエのリボソームタンパク質遺伝子の変異体を用いた実験において見い出された1).リボソームタンパク質遺伝子はハプロ不全によりMinute表現型とよばれる個体の発生の遅延および感覚毛の微細化をひき起こし,それらの変異体はMinute変異体と総称される.ショウジョウバエのMinute変異体は生存および生殖が可能である.ところが,発生期の翅においてMinute変異細胞と野生型の細胞とがモザイク状に共存するとMinute変異細胞のみが排除され,最終的に野生型の細胞のみからなる翅がつくられることが示された.
この細胞競合の発見から30年後,細胞競合におけるMinute変異細胞の排除の実態が野生型の細胞との境界面におけるアポトーシスであることがわかり,細胞間の相互作用を介した細胞の排除が実質的に明らかにされた2).これらの観察から,適応度の異なる細胞どうしが近接した際,適応度の高い細胞は生き残り,適応度の低い細胞は排除されるという細胞競合の基本的な概念が確立された.
3.細胞競合の分類
Minute変異細胞による細胞競合が発見されたのち,さまざまな変異あるいは細胞の変化により細胞競合がひき起こされることが報告された.現在,細胞競合としてコンセンサスが得られているものは,Minute/Myc型の細胞競合,がん抑制型の細胞競合,そのほかの細胞競合,に大別される.これらの細胞競合について,ショウジョウバエにおける研究により見い出された知見を解説する.
Minute/Myc型の細胞競合:Minute変異体における細胞競合の発見から約30年後,ショウジョウバエの翅原基において細胞競合をひき起こす第2の因子が見い出された.すなわち,がん遺伝子であるMyc遺伝子を高発現する細胞は超競合者となり,周辺の野生型の細胞を細胞死により排除することが報告された3,4).Minute変異はタンパク質の合成を低下させ,Myc遺伝子の高発現はタンパク質の合成を亢進することから,このMyc型の細胞競合もMinute型の細胞競合と同様にタンパク質の合成能の相対差により起こる可能性がある.実際に,これらの細胞競合の分子機構には高い共通性がみられる.細胞競合をひき起こす変異の多くはMinute変異あるいはMyc遺伝子と機能的に相互作用することが示され,これら2つの細胞競合は細胞の適応度を理解するのにもっともシンプルかつベースになるモデルであるといえる.
がん抑制型の細胞競合:さまざまながん関連遺伝子の変異細胞が細胞競合において敗者細胞となり組織から排除される現象が知られている.ショウジョウバエの上皮性の悪性腫瘍の代表的なモデルであるscrib変異体やdlg変異体を用いた解析により,頂底極性の崩壊した細胞が細胞競合において敗者細胞となり排除されることが明らかにされた5,6).同様に,がん遺伝子であるSrc遺伝子を抑制するCsk遺伝子の変異細胞や,がん抑制遺伝子であり細胞における膜輸送に関与するTSG101遺伝子,Rab5遺伝子,Vps25遺伝子,avalanche/Syx7遺伝子の変異細胞も,野生型の細胞にかこまれると細胞競合において敗者細胞になる.これらの事実から,細胞競合は生体に内在するがんの抑制機構として機能することが示唆される.一方で,頂底極性タンパク質をコードするcrumbs遺伝子の変異細胞は超競合者としてふるまうと報告された.
そのほかの細胞競合:現時点において,Minute/Myc型あるいはがん抑制型のいずれにも分類されない細胞競合が存在する.がんの抑制経路であるHippoシグナル伝達経路にかかわるexpanded遺伝子,fat遺伝子,salvador遺伝子,hippo遺伝子,warts遺伝子,mats遺伝子の変異細胞が超競合者になることが示された7).ここで,Hippoシグナルの下流において抑制される転写因子YorkieはMyc遺伝子の転写を誘導することが示され8),HippoシグナルはMyc型の細胞競合により超競合を起こす可能性が考えられる.また,増殖シグナルであるWgシグナルの細胞間での強度差がMyc遺伝子に非依存的に細胞競合をひき起こすことが示された9).このWgシグナルによりひき起こされる細胞競合においては,勝者細胞において高く発現する分泌タンパク質Notumが敗者細胞のアポトーシスを誘導する9).さらに,同じく増殖シグナルであるJAK-STATシグナルの細胞間での強度差が細胞競合をひき起こすことも示された10).このJAK-STATシグナルによりひき起こされる細胞競合は,Minute/Myc型の細胞競合と同様に,hid遺伝子に依存的な敗者細胞のアポトーシスを誘導するものの,その機構はMyc遺伝子およびWgシグナルには非依存的であることが示された10).一方,mahjong遺伝子の変異細胞が細胞競合の敗者としてふるまうことが示された11).Mahjongはがん抑制タンパク質としてはたらく頂底極性タンパク質Lglの下流の制御タンパク質であり,やはり,がん抑制タンパク質としての一面をもつ.しかし,mahjong変異細胞は極性の崩壊を起こさず,がん抑制型の細胞競合とは異なる現象であるといえる11).有糸分裂サイクル(G1期,S期,G2期,M期)から核内倍加サイクル(G期,S期)へと転換する卵濾胞細胞を用いた実験により,細胞競合によるmahjong変異細胞の排除は分裂を停止した細胞においても起こることが示された12).この分裂を停止した細胞の細胞競合は,Minute変異によっても起こる12).また,数理モデルにおいて,物理的な作用が細胞競合をひき起こしうることが示され,機械的な競合(mechanical competition)の概念が提唱された13).ショウジョウバエの背板の発生をモデルにした実験により,細胞が過密したときに増殖率の差により生じる機械的な刺激が低増殖の細胞にアポトーシスを誘導するという機械的な競合の実例が示された14).
4.Minute/Myc型の細胞競合の制御機構
2002年,細胞競合によるMinute変異細胞の細胞死の誘導が生存因子の捕捉の不全によるという“Dpp捕捉モデル”が提唱された.すなわち,Minute変異細胞においてはエンドサイトーシスの低下によりDppシグナルが低下し,これによりDppシグナルにより抑制されるBrkの発現が上昇する.BrkはJNKシグナルを活性化することによりアポトーシスを誘導する.これらの観察から,Minute変異細胞においては野生型の細胞と比べ相対的にDppの取り込みが不足することによりアポトーシスが誘導され組織から排除されるというモデルが提唱された2)(図3a).しかし2007年,別の研究グループにより,Dppシグナルを上昇させる変異が必ずしもMinute変異細胞のアポトーシスを抑制しないことからDpp捕捉モデルに疑問を呈された7).さらに,野生型の細胞が近接するMinute変異細胞を貪食することにより排除するという“貪食モデル”が提唱され,細胞どうしの直接的な接触の重要性が提示された15)(図3b).実際に,貪食に関与するPSR遺伝子,Draper遺伝子,WASp遺伝子が敗者細胞の排除に必要であることが示された15).
Myc型の細胞競合の制御機構については“Flower-Azot制御モデル”および“自然免疫シグナル制御モデル”が提唱されている.2つのモデルとも,Myc型の細胞競合の制御機構はMinute型の細胞競合にも適用が可能であることを示す一方,勝者細胞と敗者細胞との直接的な接触が細胞の排除に必要かどうかという点で2つのモデルは異なる.また,実際の細胞競合において,それぞれの制御機構がどのくらい寄与するかについては,現在,明確なコンセンサスは得られていない.
Flower-Azot制御モデル:Myc遺伝子の高発現により超競合をひき起こしたショウジョウバエの翅原基において遺伝子発現のプロファイルを解析することにより,flower遺伝子,SPARC遺伝子,azot遺伝子という細胞競合を制御する3つの遺伝子が同定された16-18).一連の遺伝学的な解析により,Myc遺伝子を高発現する細胞と野生型の細胞との直接的な接触により,野生型の細胞においてFlower-Azotシグナル伝達経路が活性化されるというモデルが提唱された(図4a).膜貫通タンパク質をコードするflower遺伝子は選択的スプライシングにより3種類のアイソフォームを産生する.そのうちひとつは勝者細胞,残り2つは敗者細胞において産生されたことから,Flowerは勝者細胞と敗者細胞を標識するタンパク質であると考えられた17).敗者細胞型のFlowerを産生する細胞は,勝者細胞型のFlowerを産生する細胞との直接的な接触を介してazot遺伝子の発現を誘導する.Azotはアポトーシス誘導遺伝子であるhid遺伝子の発現を誘導することにより敗者細胞の排除をひき起こす16).一方,敗者細胞においては基底膜を構成する分泌タンパク質SPARCの発現が誘導される18).SPARCは,Azotによるアポトーシスの誘導に対し抑制的にはたらくことにより,一時的に適応度が低下しただけの細胞が不必要に排除されるのを抑制するとされる.Flower-Azotシグナル伝達経路による勝者細胞と敗者細胞の標識および細胞死の誘導は,Minute型の細胞競合においても同様に機能することが示された.
自然免疫シグナル制御モデル:勝者細胞からはなれて存在する敗者細胞においてもアポトーシスが起こる点に注目し,細胞競合の制御における液性因子の重要性が提唱された19).そののち,サイトカインSpatzleおよびToll関連受容体(Toll-related receptor:TRR)による自然免疫シグナルを介して敗者細胞が排除されるという新たなモデルが提唱された20)(図4b).Myc遺伝子の高発現による超競合における自然免疫シグナルの関与が調べられ,グラム陰性細菌に対する応答経路であるImdシグナル伝達経路の構成タンパク質であるPGRP-LC,FADD,Ect4,Dredd,Casper,Relishがこの細胞競合に必要であることが示された.敗者細胞になる野生型の細胞において,サイトカインSpatzleがTRR2,TRR3,TRR8,TRR9と結合してこれらのシグナル伝達経路を活性化し,これにより転写因子Relishが活性化されてhid遺伝子の転写が誘導されアポトーシスが起こる.Minute型の細胞競合においては,敗者細胞になるMinute変異細胞においてTRR3およびTRR9を介して真菌に対する応答経路であるTollシグナル伝達経路が活性化し,その下流の構成タンパク質であるCactus,dl,Difを介してアポトーシス誘導タンパク質Reaperの発現が誘導されアポトーシスが起こる.敗者細胞においてTRR2,TRR8,TRR9の発現が誘導されることが示され,これが細胞競合のトリガーになる可能性が考えられる.
5.がん抑制型の細胞競合の制御機構
がんのほとんどは上皮に由来し,その進行および悪性化には,頂底極性や細胞接着など上皮性の喪失が密接に関与する.一方で,scrib変異やdlg変異などにより極性の崩壊を起こした細胞は正常な細胞にかこまれると細胞競合において敗者細胞になり上皮組織から排除される.筆者らの研究グループによる,scrib変異細胞の排除にかかわる遺伝子の大規模な遺伝学的なスクリーニングにより,その分子機構の大部分が明らかにされた21-23)(文献22) は 新着論文レビュー でも掲載,文献23) は 新着論文レビュー でも掲載).すなわち,極性の崩壊によりひき起こされるがん抑制型の細胞競合は,勝者細胞による貪食,敗者細胞の物理的な排除,敗者細胞の増殖の抑制および細胞死の誘導,の3つの過程が同時に進行することにより駆動されると考えられる.いずれの過程においても,Eiger/TNF-JNKシグナル伝達経路が中心的な役割をはたす.
勝者細胞による貪食:scrib変異細胞により細胞競合がひき起こされると,scrib変異細胞およびそれに隣接する野生型の細胞においてJNKシグナルが活性化する24).具体的には,極性が崩壊した細胞とそれに隣接する細胞においてエンドサイトーシス活性が上昇し,これにより細胞膜に存在するショウジョウバエにおけるTNFのホモログであるEigerがエンドソームに移行することによりエンドソームにおいて下流のJNKシグナルが活性化する5).scrib変異細胞におけるJNKシグナルの活性化はアポトーシスを亢進する.一方,周辺の野生型の細胞におけるJNKシグナルの活性化は隣接するscrib変異細胞の貪食を亢進することによりその排除を促進する22)(図5a).具体的には,野生型の細胞において活性化したJNKシグナルはPvrの発現を誘導し,これが貪食のシグナルを伝達するELMO-Mbcシグナル伝達経路を活性化することによりアクチン細胞骨格の再編成が起こり,scrib変異細胞は貪食により排除される.
敗者細胞の物理的な排除:極性の崩壊した細胞のふるまいのひとつとして,上皮層の頂端側あるいは基底側への離脱が知られている.ショウジョウバエの遺伝学的なスクリーニングにより,scrib変異細胞におけるJNKシグナルはアポトーシスの誘導のみならず敗者細胞の物理的な排除にも関与することが示された21)(図5a).すなわち,JNKシグナルは神経軸索の投射の制御に関与するSlit,Robo2,Enabledの発現を誘導し,これによりscrib変異細胞においてSlit-Robo2シグナルが活性化してその下流の標的であるEnabledが活性化される.Enabledはアクチン制御タンパク質のひとつであり,アドヘレンスジャンクションを構成するEカドヘリンの分解や細胞の運動性の促進によりscrib変異細胞の上皮層からの物理的な排除を促進する.Robo2-Enabledシグナル伝達経路はJNKシグナルを活性化することも確認され,細胞の排除にかかわる一連のシグナルは正のフィードバック制御を形成すると考えられる.
敗者細胞の増殖の抑制および細胞死の誘導:極性の崩壊によりひき起こされる細胞競合においては,勝者細胞と敗者細胞との認識は2つの細胞表面の膜タンパク質SasおよびPtp10Dにより制御されることが示された23)(図5a).SasおよびPtp10Dは,Slit,Robo2,Enabledと同様に神経軸索の投射の制御に関与し,Sasがリガンドとして,Ptp10Dが受容体として機能する.SasおよびPtp10Dは上皮細胞ではともに細胞の頂端側に局在し,隣接する細胞にむけ側面に提示されることはない.しかし,組織において極性が崩壊したscrib変異細胞が出現すると,scrib変異細胞と野生型の細胞との境界面において,野生型の細胞からはSas,scrib変異細胞からはPtp10Dが細胞の側面に提示され,敗者細胞においてSas-Ptp10Dシグナルがトランスに活性化される.Sas-Ptp10Dシグナルによる増殖の抑制を理解するには,極性の崩壊した細胞におけるがんの形成機構を理解する必要がある(図5b).上皮細胞における極性の崩壊は,JNKシグナルにくわえEGF受容体シグナルの活性化をひき起こす.JNKシグナルとEGF受容体シグナルは協調的に機能することによりJubを活性化する.Jubの活性化はアクチンの再編成を介してHippoシグナルを抑制し,結果として,細胞の過剰な増殖あるいはがん化をひき起こす25).一方で,Sas-Ptp10Dシグナルの存在下では,Sasにより極性の崩壊した細胞において活性化したPtp10DがEGF受容体をおそらく直接的に脱リン酸化することによりそのシグナルを抑制する.これにより,JNKシグナルがアポトーシスの誘導シグナルとして機能するようになる.同時に,JNKシグナルがHippoシグナルに対し促進的にはたらくことにより細胞の増殖が抑制される.Sas-Ptp10Dシグナルは,Minute変異,Myc遺伝子の高発現,Hippoシグナルの低下による細胞競合には関与しないことから,Minute/Myc型の細胞競合とがん抑制型の細胞競合では制御機構が大きく異なると考えられる.
6.哺乳類における細胞競合
ショウジョウバエにおいて見い出された細胞競合と同様の競合的な細胞の排除が哺乳類のモデルにおいても観察されるようになり,細胞競合が広く保存された細胞間のコミュニケーションであると考えられるようになった.
イヌの上皮性の培養細胞であるMDCK細胞を用いて,がん遺伝子であるRas遺伝子あるいはSrc遺伝子が活性化した細胞が正常な細胞にかこまれると,単層培養から排除されることが見い出された26,27).このとき,勝者細胞になる野生型の細胞においては,アクチン束化タンパク質FilaminがRas遺伝子あるいはSrc遺伝子が活性化した細胞との境界面に集積し,Vimentinの束化を促進することにより細胞の排除がひき起こされる28).一方で,敗者細胞になるRas遺伝子あるいはSrc遺伝子が活性化した細胞においては,アクチン束化タンパク質であるEPLINが集合することによりII型ミオシンやプロテインキナーゼAが活性化され,上皮組織からの離脱が促進される29).EPLINはPDK4を介してミトコンドリアの傷害および解糖系の亢進をひき起こす30)(新着論文レビュー でも掲載).PDK4によるミトコンドリアの傷害が敗者細胞の排除に必要であったことから,細胞における代謝が細胞競合において重要な機能をもつ可能性が示された.
肝臓の疾患のモデルであるDPPIV変異マウスの肝臓に野生型の胎仔の肝幹細胞を移植すると,移植した細胞の増殖および近接するDPPIV変異細胞のアポトーシスにより肝臓は野生型の細胞に置き換わっていくことが見い出され,細胞競合を介した組織の再構築の可能性が示された31).また,マウスの皮膚組織における毛包に注目し,がん原性の変異細胞が野生型の細胞から排除されることが見い出された32).毛包は成長期と退行期をくり返すという特徴的な代謝システムをもつが,変異細胞は退行期において組織から除去される.この細胞の排除は周辺の野生型の細胞の存在に依存して起こることから,細胞競合である可能性が高い.
Minute/Myc型の細胞競合は哺乳類の個体においても見い出された.キメラマウスを用いた実験系において,ショウジョウバエと同様にリボソームタンパク質遺伝子の変異細胞が発生の過程において細胞競合により個体から排除されることが示された33).また,マウスの初期胚のエピブラストがMyc型の細胞競合により選別されることが示された34,35).マウスの胚における細胞競合に貪食が関与することも示され,ショウジョウバエにおける細胞競合との類似性がうかがえる.一方,scrib変異による細胞競合も哺乳類の細胞において見い出された.scrib遺伝子をノックダウンしたMDCK細胞が正常なMDCK細胞にかこまれると敗者細胞となり排除されることが示された36).このscrib変異によりひき起こされるMDCK細胞の排除は,JNKではなくp38 MAPKを介して起こる.別の研究グループは,このscrib変異細胞の除去が機械的な競合であるとしている37).このように,細胞競合における細胞の排除の機構はショウジョウバエと哺乳類とで必ずしも共通していない.一方で,mahjong遺伝子をノックダウンしたMDCK細胞については,ショウジョウバエと同様の機構でアポトーシスにより排除されることが示された11).
Hippoシグナル伝達経路を介した細胞競合も哺乳類のモデルにおいて報告された.マウスの培養細胞であるNIH3T3細胞を用いて,Hippoシグナル伝達経路を介した超競合が示された38).哺乳類においてHippoシグナルの下流にて抑制されるYapは,転写因子Teadと結合して標的になる遺伝子の転写を誘導する.このTeadの活性レベルの相対差がNIH3T3細胞の細胞競合をひき起こし,Teadの活性が高いと勝者細胞,Teadの活性が低いと敗者細胞になることが示された.また,TeadがMyc遺伝子の発現を誘導することも示され,哺乳類におけるHippo-Mycシグナル伝達経路を介した超競合の存在が示唆された.一方で,別の研究グループにより,MDCK細胞においてはYapの活性化した細胞が細胞競合において敗者細胞になることが示された39).非上皮細胞と上皮細胞とではHippoシグナル伝達経路に変異をもつ細胞のふるまいが異なるのかもしれない.
7.細胞競合の生理的な意義
細胞競合による細胞の集団の品質管理は,脆弱な細胞や病変した細胞の組織からの排除を可能にすると考えられる.しかし,細胞競合が実際に生体システムの維持において機能することを直接的に示した報告は少ない.これは,これまで細胞競合の機構を欠失した個体を解析することが困難であったことを考えれば当然のことかもしれない.しかしながら,細胞競合を駆動する細胞間のコミュニケーションにはたらくタンパク質が同定されたことにより,その生理的な意義の解析が可能になってきた.細胞競合の生理的な機能として,がんの抑制,傷害をうけた細胞の排除,個体における発生の制御について解説する.
がんの抑制:Minute/Myc型の細胞競合およびがん抑制型の細胞競合とも,がんの制御との密接な関係が予想される.一方で,実際に細胞競合ががんの発生あるいは進展に寄与するという証拠はまだほとんどない.そのなかでも,ヒトのがん組織において抗SPARC抗体を用いて敗者細胞を標識することにより細胞競合の有無が調べられ,実際に,膵管腺がんと比較して野生型の細胞がSPARCを高く発現することが示された40).がんの病変におけるSPARCの発現の変動については過去にも複数の報告があり,がんの進展と細胞競合との関係性が示唆される.また,マウスにおけるflower遺伝子のホモログであるmflower遺伝子を欠損したマウスが作製され,誘導性の皮膚パピローマの増殖が抑制されることが示された41).これらの結果から,がん細胞が超競合者になることで組織において拡大する可能性が示された.一方,ヒトにおけるPtp10DのホモログであるPTPRJはがん抑制タンパク質として機能することが知られている42).PTPRJはショウジョウバエのPtp10Dと同様にEGF受容体に対する抑制能をもつことがわかっており,ヒトのがんにおいてもショウジョウバエと同様の細胞競合を介したがんの抑制の起こる可能性がある.しかし,SPARC,mFlower,PTPRJによるがんの制御が細胞競合を介したものであるかどうかについてはまだ十分に調べられていない.哺乳類のモデルにおけるがんと細胞競合の関係性については,さらなる解析が必要である.
傷害をうけた細胞の排除:細胞競合の性質をかんがみれば,細胞競合による細胞の集団の品質管理が組織の健常性の維持に貢献する可能性は高い.しかし,細胞競合と組織における恒常性との因果関係について示した報告はまだ少ない.Azotの解析をつうじて,細胞競合が傷害をうけた細胞の排除に関与することが提唱された16).ショウジョウバエの翅は幼虫期の後期に顕著に成長するが,この時期に紫外線の照射により細胞を傷害するストレスをあたえても翅の形成に異常は生じない.しかし,azot変異体の翅は紫外線の照射により顕著な異常を示す.これらの結果から,翅の形成に異常を生じさせるような傷害をうけた細胞は内在性の細胞競合により排除されることが示唆される.実際に,azot変異体における翅の異常は,azot遺伝子のエンハンサーに依存してアポトーシスを誘導することによりレスキューされる.また,Azotによるアポトーシスの誘導が個体の寿命を伸ばすことも示され,組織の恒常性の維持における細胞競合の重要性が提示された.
個体における発生の制御:個体の発生の過程において細胞の数を制御する手段として,いったん細胞を過剰に産生したのち不要な細胞を取り除くことはめずらしくはない.細胞競合はこのような過程において不要な細胞の除去や優良な細胞の選択に関与する可能性が示された.Flower-Azotシグナル伝達経路を介した細胞競合がショウジョウバエにおける複眼の発生の過程において生じる不要な視神経を除去することが報告された16,43).以前から,複眼の形成の過程においては辺縁部のニューロンがアポトーシスを起こすことが知られていたが,この細胞の排除は敗者細胞型のFlowerにより不要な細胞が敗者細胞として標識されることにより起こることが示された.一方,Myc型の細胞競合がマウスの初期の発生において優良なエピブラストの選別に寄与することが報告された34,35).胚発生の初期の幹細胞プールにおいて細胞競合により優良な細胞が選別されるというこの報告は,からだづくりの根本に細胞競合が存在することを示し,大きなインパクトをあたえた.
おわりに
細胞競合の発見から40年,ようやくこの現象の分子実態の理解が進んできた.Flower-Azotシグナル伝達経路およびSas-Ptp10Dシグナルによる勝者細胞と敗者細胞のコミュニケーションの機構がみえてきたことにより,細胞競合をつかさどる経路の存在が明確なものになった.しかし一方で,Minute/Myc型の細胞競合の制御機構については,いまだコンセンサスが得られるにいたっていない.細胞競合を駆動する細胞の適応度の決定機構および細胞の排除の機構を理解するうえで,Minute/Myc型の細胞競合の全容の解明は必須である.一方,がん抑制型の細胞競合の制御にかかわるタンパク質として,神経軸索の投射の制御に関与するタンパク質が多く同定されたことは興味深い.神経軸索の投射の制御は,異なる細胞の認識とそれに応じた細胞の挙動を可能にするすぐれた制御系であり,細胞競合の制御とも共通する点が多い.一方で,すべての細胞競合がFlower-Azotシグナル伝達経路あるいはSas-Ptp10Dシグナルにより説明されるわけではなく,その全容は依然として多くの謎につつまれている.近年,さまざまなタイプの細胞競合が見い出されたことにより,細胞競合のトリガーになる因子や制御機構は多様であることもわかってきた.一方で,それら多様な細胞競合はいっけん類似した細胞の挙動を示すものの,じつはまったく異なる生体応答をみている可能性もある.今後,多様な細胞競合に通底する基本原理を見い出すことにより,真の意味で細胞競合が理解されるようになると思われる.
ショウジョウバエにおいて見い出されたMinute/Myc型の細胞競合およびがん抑制型の細胞競合が哺乳類にも存在し,その制御機構にも類似点が多いという事実は重要である.今後,細胞競合の研究から得られた知見を,がんをはじめとしたさまざまな疾患の理解やその治療法の開発に応用することが可能になるかもしれない.また,細胞競合は不良な細胞を優良な細胞に置き換えることが可能なシステムであり,その応用により再生医療や骨髄移植などさまざまな医療への貢献が期待される.一方,細胞競合の生理的な意義の解明により,細胞間のコミュニケーションを介した個体の発生あるいは生体の維持の機構の根本的な理解,さらには,多細胞からなるコミュニティが成立する原理にせまることができるかもしれない.細胞競合が個体における発生のイベントに関与するという事実は重要な意味をもつ.すなわち,個体の発生は単に発生プログラムにそった連続的な遺伝子制御のみで成立するのではなく,細胞競合を介した偶発的かつ確率論的な細胞間の相互作用および細胞運命の制御を要求することを示唆する.
文 献
- Morata, G. & Ripoll, P.: Minutes: mutants of drosophila autonomously affecting cell division rate. Dev. Biol., 42, 211-221 (1975)[PubMed]
- Moreno, E., Basler, K. & Morata, G.: Cells compete for decapentaplegic survival factor to prevent apoptosis in Drosophila wing development. Nature, 416, 755-759 (2002)[PubMed]
- Moreno, E. & Basler, K.: dMyc transforms cells into super-competitors. Cell, 117, 117-129 (2004)[PubMed]
- de la Cova, C., Abril, M., Bellosta, P. et al.: Drosophila Myc regulates organ size by inducing cell competition. Cell, 117, 107-116 (2004)[PubMed]
- Igaki, T., Pastor-Pareja, J. C., Aonuma, H. et al.: Intrinsic tumor suppression and epithelial maintenance by endocytic activation of Eiger/TNF signaling in Drosophila. Dev. Cell, 16, 458-465 (2009)[PubMed]
- Brumby, A. M. & Richardson, H. E.: scribble mutants cooperate with oncogenic Ras or Notch to cause neoplastic overgrowth in Drosophila. EMBO J., 22, 5769-5779 (2003)[PubMed]
- Tyler, D. M., Li, W., Zhuo, N. et al.: Genes affecting cell competition in Drosophila. Genetics, 175, 643-657 (2007)[PubMed]
- Neto-Silva, R. M., de Beco, S., Johnston, L. A.: Evidence for a growth-stabilizing regulatory feedback mechanism between Myc and Yorkie, the Drosophila homolog of Yap. Dev. Cell, 19, 507-520 (2010)[PubMed]
- Vincent, J. P., Kolahgar, G., Gagliardi, M. et al.: Steep differences in wingless signaling trigger Myc-independent competitive cell interactions. Dev. Cell, 21, 366-374 (2011)[PubMed]
- Rodrigues, A. B., Zoranovic, T., Ayala-Camargo, A. et al.: Activated STAT regulates growth and induces competitive interactions independently of Myc, Yorkie, Wingless and ribosome biogenesis. Development, 139, 4051-4061 (2012)[PubMed]
- Tamori, Y., Bialucha, C. U., Tian, A. G. et al.: Involvement of Lgl and Mahjong/VprBP in cell competition. PLoS Biol., 8, e1000422 (2010)[PubMed]
- Tamori, Y. & Deng, W. M.: Tissue repair through cell competition and compensatory cellular hypertrophy in postmitotic epithelia. Dev. Cell, 25, 350-363 (2013)[PubMed]
- Shraiman, B. I.: Mechanical feedback as a possible regulator of tissue growth. Proc. Natl. Acad. Sci. USA, 102, 3318-3323 (2005)[PubMed]
- Levayer, R., Dupont, C., Moreno, E.: Tissue crowding induces caspase-dependent competition for space. Curr. Biol., 26, 670-677 (2016)[PubMed]
- Li, W. & Baker, N. E.: Engulfment is required for cell competition. Cell, 129, 1215-1225 (2007)[PubMed]
- Merino, M. M., Rhiner, C., Lopez-Gay, J. M. et al.: Elimination of unfit cells maintains tissue health and prolongs lifespan. Cell, 160, 461-476 (2015)[PubMed]
- Rhiner, C., Lopez-Gay. J. M., Soldini. D. et al.: Flower forms an extracellular code that reveals the fitness of a cell to its neighbors in Drosophila. Dev. Cell, 18, 985-998 (2010)[PubMed]
- Portela, M., Casas-Tinto, S., Rhiner, C. et al.: Drosophila SPARC is a self-protective signal expressed by loser cells during cell competition. Dev. Cell, 19, 562-573 (2010)[PubMed]
- Senoo-Matsuda, N. & Johnston, L. A.: Soluble factors mediate competitive and cooperative interactions between cells expressing different levels of Drosophila Myc. Proc. Natl. Acad. Sci. USA, 104, 18543-18548 (2007)[PubMed]
- Meyer, S. N., Amoyel, M., Bergantinos, C. et al.: An ancient defense system eliminates unfit cells from developing tissues during cell competition. Science, 346, 1258236 (2014)[PubMed]
- Vaughen, J. & Igaki, T.: Slit-Robo repulsive signaling extrudes tumorigenic cells from epithelia. Dev. Cell, 39, 683-695 (2016)[PubMed]
- Ohsawa, S., Sugimura, K., Takino, K. et al.: Elimination of oncogenic neighbors by JNK-mediated engulfment in Drosophila. Dev. Cell, 20, 315-328 (2011)[PubMed] [新着論文レビュー]
- Yamamoto, M., Ohsawa, S., Kunimasa, K. et al.: The ligand Sas and its receptor PTP10D drive tumour-suppressive cell competition. Nature, 542, 246-250 (2017)[PubMed] [新着論文レビュー]
- Igaki, T., Pagliarini, R. A. & Xu, T.: Loss of cell polarity drives tumor growth and invasion through JNK activation in Drosophila. Curr. Biol., 16, 1139-1146 (2006)[PubMed]
- Enomoto, M., Kizawa, D., Ohsawa, S. et al.: JNK signaling is converted from anti- to pro-tumor pathway by Ras-mediated switch of Warts activity. Dev. Biol., 403, 162-171 (2015)[PubMed]
- Hogan, C., Dupre-Crochet, S., Norman, M. et al.: Characterization of the interface between normal and transformed epithelial cells. Nat. Cell Biol., 11, 460-467 (2009)[PubMed]
- Kajita, M., Hogan, C., Harris, A. R. et al.: Interaction with surrounding normal epithelial cells influences signalling pathways and behaviour of Src-transformed cells. J. Cell Sci., 123, 171-180 (2010)[PubMed]
- Kajita, M., Sugimura, K., Ohoka, A. et al.: Filamin acts as a key regulator in epithelial defence against transformed cells. Nat. Commun., 5, 4428 (2014)[PubMed]
- Ohoka, A., Kajita, M., Ikenouchi, J. et al.: EPLIN is a crucial regulator for extrusion of RasV12-transformed cells. J. Cell Sci., 128, 781-789 (2015)[PubMed]
- Kon, S., Ishibashi, K., Katoh, H. et al.: Cell competition with normal epithelial cells promotes apical extrusion of transformed cells through metabolic changes. Nat. Cell Biol., 19, 530-541 (2017)[PubMed] [新着論文レビュー]
- Oertel, M., Menthena, A., Dabeva, M. D. et al.: Cell competition leads to a high level of normal liver reconstitution by transplanted fetal liver stem/progenitor cells. Gastroenterology, 130, 507-520 (2006)[PubMed]
- Brown, S., Pineda, C. M., Xin, T. et al.: Correction of aberrant growth preserves tissue homeostasis. Nature, 548, 334-337 (2017)[PubMed]
- Oliver, E. R., Saunders, T. L., Tarle, S. A. et al.: Ribosomal protein L24 defect in belly spot and tail (Bst), a mouse Minute. Development, 131, 3907-3920 (2004)[PubMed]
- Claveria, C., Giovinazzo, G., Sierra, R. et al.: Myc-driven endogenous cell competition in the early mammalian embryo. Nature, 500, 39-44 (2013)[PubMed]
- Sancho, M., Di-Gregorio, A., George, N. et al.: Competitive interactions eliminate unfit embryonic stem cells at the onset of differentiation. Dev. Cell, 26, 19-30 (2013)[PubMed]
- Norman, M., Wisniewska, K. A., Lawrenson, K. et al.: Loss of Scribble causes cell competition in mammalian cells. J. Cell Sci., 125, 59-66 (2012)[PubMed]
- Wagstaff, L., Goschorska, M., Kozyrska, K. et al.: Mechanical cell competition kills cells via induction of lethal p53 levels. Nat. Commun., 7, 11373 (2016)[PubMed]
- Mamada, H., Sato, T., Ota, M. et al.: Cell competition in mouse NIH3T3 embryonic fibroblasts is controlled by the activity of Tead family proteins and Myc. J. Cell Sci., 128, 790-803 (2015)[PubMed]
- Chiba, T., Ishihara, E., Miyamura, N. et al.: MDCK cells expressing constitutively active Yes-associated protein (YAP) undergo apical extrusion depending on neighboring cell status. Sci. Rep., 6, 28383 (2016)[PubMed]
- Petrova, E., Soldini, D. & Moreno, E.: The expression of SPARC in human tumors is consistent with its role during cell competition. Commun. Integr. Biol., 4, 171-174 (2011)[PubMed]
- Petrova, E., Lopez-Gay, J. M., Rhiner, C.: Flower-deficient mice have reduced susceptibility to skin papilloma formation. Dis. Model Mech., 5, 553-561 (2012)[PubMed]
- Hendriks, W. J. & Pulido, R.: Protein tyrosine phosphatase variants in human hereditary disorders and disease susceptibilities. Biochim. Biophys. Acta, 1832, 1673-1696 (2013)[PubMed]
- Merino, M. M., Rhiner, C., Portela, M. et al.: "Fitness fingerprints" mediate physiological culling of unwanted neurons in Drosophila. Curr. Biol., 23, 1300-1309 (2013)[PubMed]
著者プロフィール
略歴:2008年 東京理科大学大学院基礎工学研究科博士課程 修了,同年 東京理科大学基礎工学部 博士研究員,2009年 学習院大学理学部 助教を経て,2017年より京都大学大学院生命科学研究科 特定助教.
研究テーマ:個体の発生および維持におけるがん抑制型の細胞競合の生理的な役割.
抱負:細胞競合の理解をつうじて,組織の維持における細胞間のコミュニケーションの本質をとらえたい.
井垣 達吏(Tatsushi Igaki)
京都大学大学院生命科学研究科 教授.
研究室URL:https://www.lif.kyoto-u.ac.jp/genetics/
© 2017 谷口喜一郎・井垣達吏 Licensed under CC 表示 2.1 日本