植物における遺伝子とトランスポゾンとの相互作用と環境への適応
2018/01/18
佐瀬 英俊
(沖縄科学技術大学院大学 植物エピジェネティクスユニット)
email:佐瀬英俊
領域融合レビュー, 7, e001 (2018) DOI: 10.7875/leading.author.7.e001
Hidetoshi Saze: Transposon-driven environmental adaptation in plants.

植物のゲノムはトランスポゾンにより形成されたくり返し配列を多く含む.これまで,遺伝子あるいはその近傍に挿入されたトランスポゾンは,遺伝子の破壊や発現の抑制など個体の生存に悪い影響をおよぼすと考えられてきた.しかし,近年,ゲノムにおけるトランスポゾンの存在様式が詳細に解析され,種によっては,活発に転写されているゲノム領域に多くのトランスポゾンが存在し,近傍の遺伝子の構造の変化や発現の制御をつうじて個体の環境への適応に大きな役割をはたすことが明らかにされつつある.このレビューにおいては,植物における遺伝子とトランスポゾンとの相互作用の分子機構について最近の知見を解説し,さらに,気温の変化や病原体に対する応答などをつうじた環境への適応に対する貢献の可能性について考察する.
植物は固着性の生活様式をとるため,つねに外界の環境の変化にさらされている.植物の生育に影響をおよぼす環境要因としては,日周の変動,光の強度,高温あるいは低温などの気温の変化,病原体の感染,物理的な傷害,土壌の塩濃度や栄養などがあげられるが,植物はこうした環境の変化に対しさまざまに応答し環境に適応している.一般に,環境への適応の過程においては,転写因子をコードする遺伝子を中心に転写の活性化が起こり,さらにそれらの転写因子が下流のさまざまな遺伝子の転写を活性化することにより生理的な応答につながる.この遺伝子発現の制御において重要なはたらきをするのが,エピジェネティック修飾とよばれるクロマチンの化学修飾である.近年の解析技術の進歩により,環境への適応の一環としてエピジェネティックな情報にダイナミックな変化がひき起こされることが明らかにされつつある.
植物のゲノムにおけるエピジェネティック修飾のもうひとつの大きな役割は,トランスポゾン(転移因子)とよばれるゲノムに寄生するDNA配列の転写を抑制することである.これまで,遺伝子あるいはその近傍に挿入されたトランスポゾンは遺伝子の破壊や発現の抑制など個体の生存に悪い影響をおよぼす厄介者と考えられてきた.しかし,近年の大規模なゲノムプロジェクトおよびエピゲノムプロジェクトによりゲノムにおけるトランスポゾンの存在様式が詳細に解析され,種によっては,活発に転写されている遺伝子あるいはその近傍に多くのトランスポゾンが存在することが明らかにされつつある.トランスポゾンは転移したさきのDNA配列を破壊することからエピジェネティックな機構により抑制されているが,このトランスポゾンの遺伝子あるいはその近傍への挿入が,遺伝子の配列あるいは構造の変化,および,遺伝子の転写の制御という2つのレベルにおいて植物の環境への適応に寄与するという知見が蓄積されつつある.
このレビューにおいては,遺伝子とトランスポゾンとの相互作用の分子機構について,とくに,大規模なゲノムプロジェクトおよびエピゲノムプロジェクトが完了したシロイヌナズナを中心として近年の知見を解説し,さらに,エピジェネティックな情報が気温の変化や病原体に対する応答などをつうじた植物の環境への適応に対し貢献する可能性について考察する.
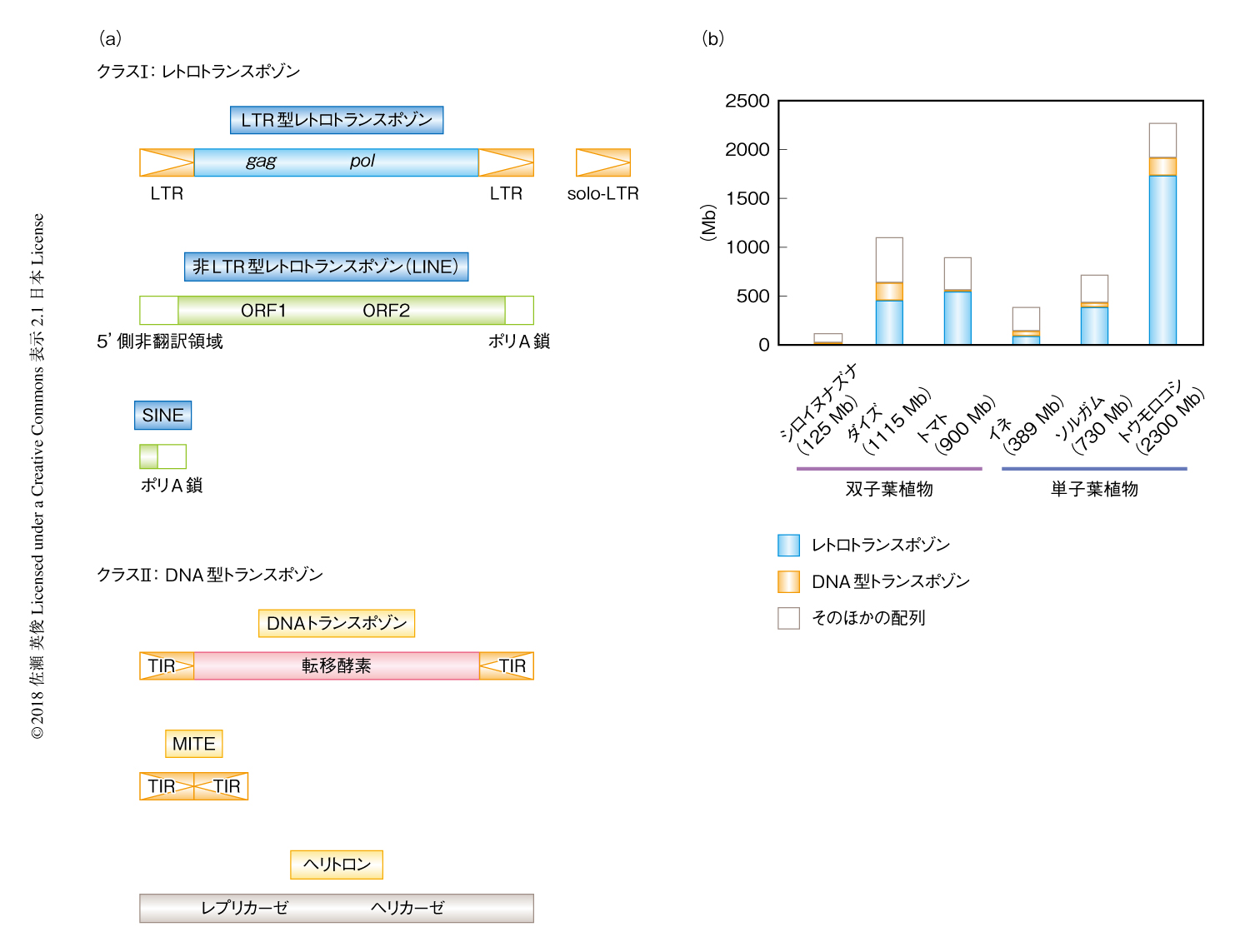
植物のゲノムは,その遺伝子の数と比較してゲノムのサイズに大きな多様性があり,また,ゲノムのサイズはトランスポゾンのしめる割合と強い相関があって1,2),とくに,レトロトランスポゾンとよばれる逆転写を介してコピーを増幅するトランスポゾンはゲノムにしめる割合が高い(図1).トランスポゾンは挿入されたDNA配列を中断することにより遺伝子を破壊したり,相同なコピーのあいだでの偶発的な相同組換えをひき起こしたりするため,ゲノムの構造の維持において重大な脅威となる.そのため,トランスポゾンは細胞のもつ転写の抑制機構の標的になっている.この抑制機構の中心になるのが,幅広い種において保存されている,RNAi,DNAメチル化,ヒストンの脱アセチル化,ヒストンH3のLys9のメチル化などのエピジェネティック修飾である.基本的に,こうした転写を抑制するエピジェネティック修飾は,RNAポリメラーゼなどの転写装置がアクセスしづらいようクロマチンの状態を変化させ,ヘテロクロマチンとよばれる転写が抑制される状態を,DNA複製をへて長期間にわたり維持するよう機能する.直接には遺伝子に挿入されていないトランスポゾンでも,DNAメチル化など転写を抑制するエピジェネティック修飾がトランスポゾンの領域をこえて数百bpからときに数kbも広がるため3),トランスポゾンの挿入は結果として近傍の遺伝子の転写を抑制し遺伝子の正常な機能を阻害すると考えられている.そのため,一般に,トランスポゾンは重要な遺伝子の多い染色体の腕部からは排除され,逆に,組換え率が低く遺伝子の少ない領域,とくに,セントロメアの近傍のペリセントロメア領域に蓄積する傾向がある.最近のシロイヌナズナの集団のゲノム解析において,遺伝子の近傍にも多くのトランスポゾンがみつかっているが,多くの場合,集団において挿入の多型がみられることから3),こうした遺伝子の近傍に挿入されたトランスポゾンは,比較的最近に転移したものであり集団に固定されてはいないと思われる.こうした孤発的な転移をひき起こした若いトランスポゾンのほとんどは,遺伝的浮動の結果,あるいは,近傍の遺伝子の機能を阻害することにより,結果的に個体の適応度を低下させ,中長期的には集団から排除されると思われる.
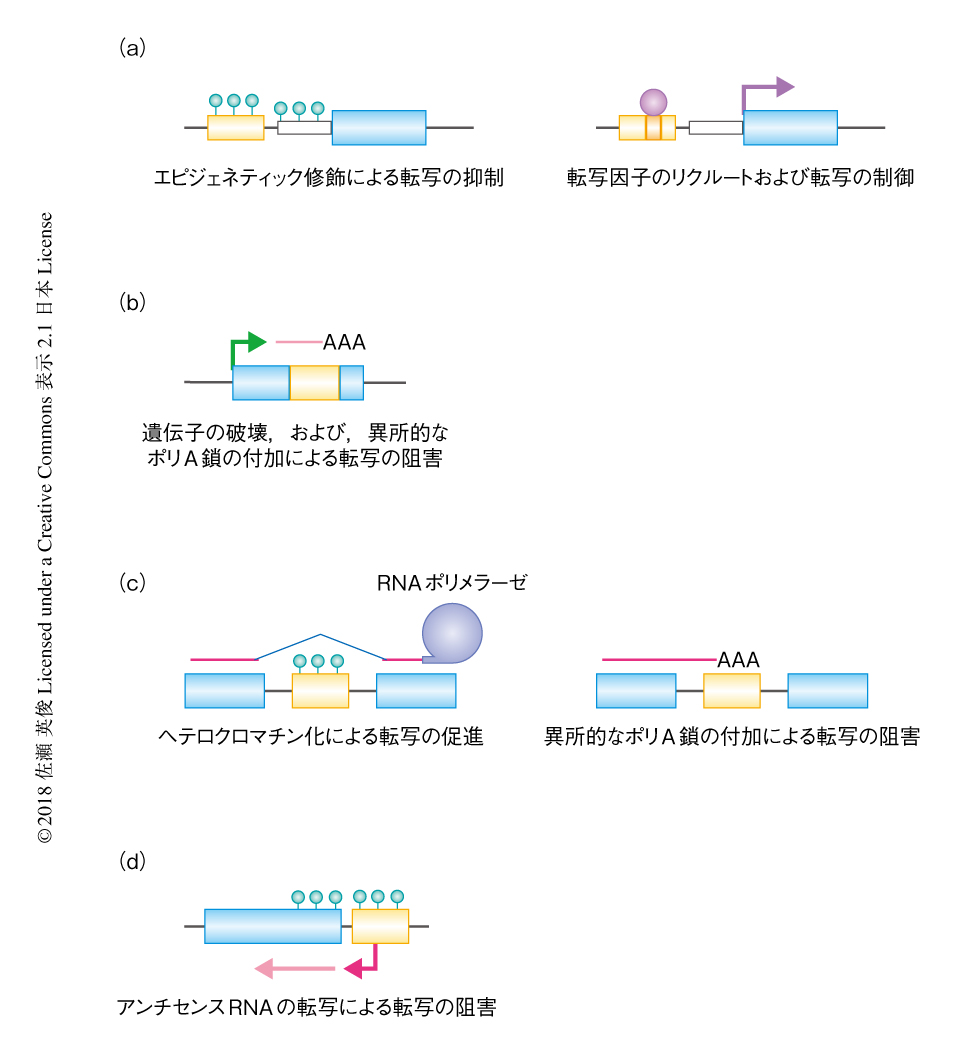
遺伝子領域にトランスポゾンが挿入された場合,プロモーター領域,エキソン,イントロンなど,挿入された部位がどの領域によるかで遺伝子の機能への影響は大きく変わると考えられる(図2).トランスポゾンがプロモーター領域に挿入された場合,ヘテロクロマチン化の標的になることにより下流の遺伝子の転写は抑制されることが多いと考えられているが4),逆に,下流の遺伝子の転写が活性化される例も多くみつかっている3,5,6).一方,トランスポゾンがエキソンに挿入されると遺伝子が破壊され遺伝子の機能に大きな障害が起こる.これには,DNA配列の物理的な中断にくわえ,転写装置の通過の阻害,スプライシングの誤り,トランスポゾンに内在するプロモーターによるアンチセンスRNAの産生などによる遺伝子発現の阻害といった現象が含まれ,遺伝子の発現に負の影響をひき起こす.一方で,活発に転写されている遺伝子領域において,イントロン,5’側非翻訳領域,3’側非翻訳領域に大量のトランスポゾンが存在することも知られている.モデル植物としてトランスポゾンやエピジェネティックな機構がよく調べられているシロイヌナズナの場合,トランスポゾンの全体のおよそ3%は遺伝子領域に存在するが,そのほとんどはイントロンにある7).ゲノムの60~80%がトランスポゾンからなるといわれるトウモロコシの場合,1 kb以上の長さをもつトランスポゾンが10%以上の遺伝子のイントロンにみつかっている8).一方,裸子植物のオウシュウトウヒ(Picea abies)は,シロイヌナズナの100倍以上の20 Gbという巨大なゲノムをもつが,シロイヌナズナと同じ程度の数の遺伝子およびエキソン長をもつ一方,イントロンは植物のゲノムのなかでとりわけ長い.これは,過去数千万年にわたりイントロンへレトロトランスポゾンが蓄積しこれが排除されなかったためと考えられている9).
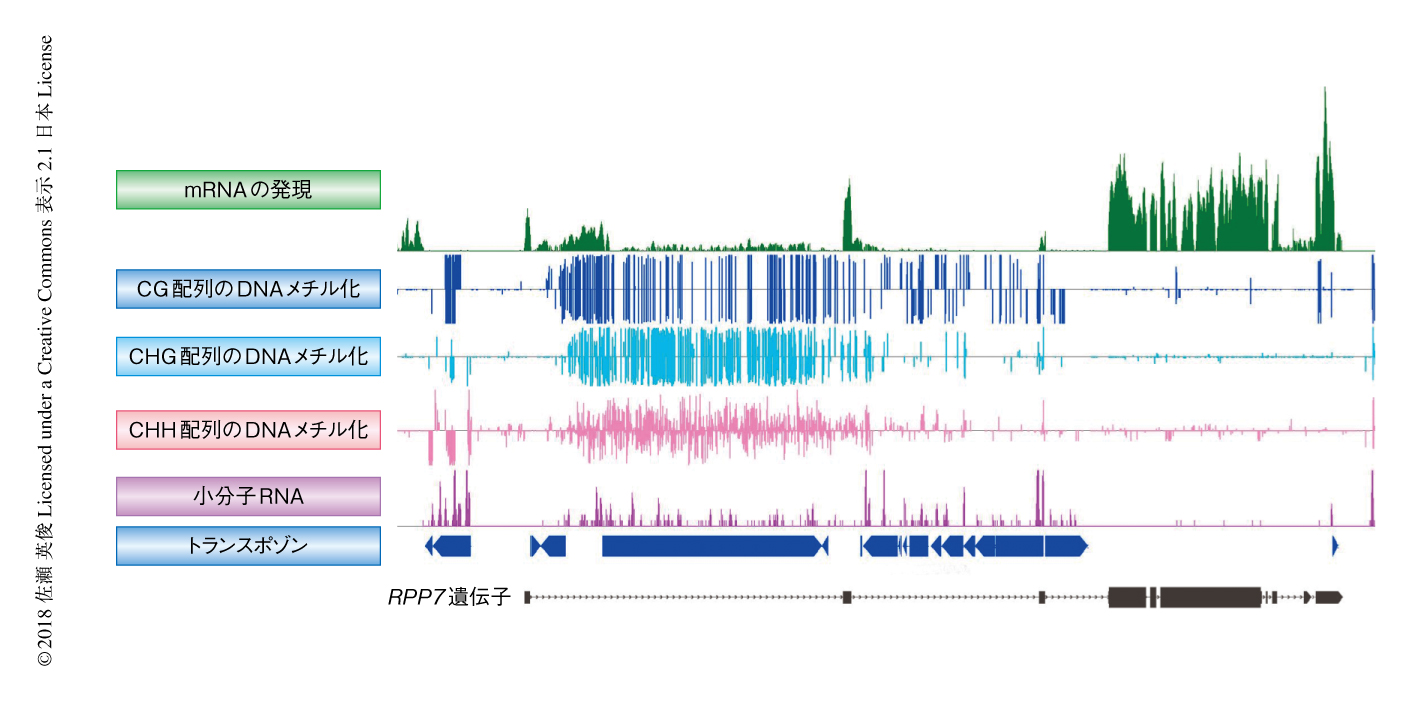
活発に転写されている遺伝子領域に存在するトランスポゾンも,遺伝子間領域のトランスポゾンと同様に,ヘテロクロマチン化の標的になり転写が抑制された状態が維持されていることが,シロイヌナズナやトウモロコシなどで確認されている(図3).さらには,イントロンにトランスポゾンが挿入された遺伝子は,挿入のない遺伝子と比較して同じ程度の発現を示すことが多く,植物のゲノムにおいて,イントロンに存在するトランスポゾンを認識し安定した遺伝子の発現を維持する機構が示唆されている7).こうしたイントロンに存在するトランスポゾンについては,スプライシングによりmRNAからは除去されるため遺伝子の機能への影響は比較的少ないと考えられるが,一般に,遺伝子間領域に存在するトランスポゾンと比較して,遺伝子領域に存在するトランスポゾンは欠失などによりその長さは短いため,トランスポゾンそれ自体に対する負の選択圧が存在すると考えられる.一方,以下にのべるように,プロモーター領域,非翻訳領域,イントロンにおいて,遺伝子に対するなんらかの機能をもつことによりトランスポゾンが進化的に維持されている可能性もある.
植物をとりまく環境ストレスには,温度の変化,乾燥,塩濃度の変化などの無生物的なストレスと,病原体の感染などの生物的なストレスとがある.近年のシロイヌナズナ1001ゲノムプロジェクトにおいては,1000以上の野生系統についてゲノム,DNAメチル化,遺伝子の発現が解析され10),ゲノムおよびエピゲノムが集団においてもっとも多様化している領域として,耐病性遺伝子クラスターが同定された10).植物における病原体に対する免疫機構のひとつとして,エフェクター誘導免疫(effector-triggered immunity:ETI)が知られている.この過程において,細胞に侵入した病原体に由来する分子を直接的あるいは間接的に認識するのが耐病性遺伝子であり,種によってはゲノムに1000コピー以上も維持されている.また,多くの植物のゲノムにおいては,耐病性遺伝子の大半はクラスターを形成している.耐病性遺伝子クラスターを形成する遺伝子は細菌,ウイルス,線虫,昆虫,糸状菌などさまざまな病原体を認識するため,多様化し進化の速い領域として知られている11).エフェクター誘導免疫により病原体の感染が認識されると,細胞死などの生理的な反応がひき起こされ個体における感染の広がりをふせぐ.耐病性遺伝子クラスターの多様化に大きな影響をおよぼしていると考えられるのが,挿入された多数のトランスポゾンである.以前から,耐病性遺伝子クラスターにはトランスポゾンの多いことが指摘されており,トランスポゾンの相同配列のあいだの組換えや不均等な乗換えにより,耐病性遺伝子クラスターにおいては重複や欠失が急速な進行していると考えられている.こうした耐病性遺伝子クラスターにおける種内での進化的な多様化は,一方で,さまざまな病原体との軍拡競争の結果とも考えられ,耐病性遺伝子クラスターにトランスポゾンが蓄積することが,植物における耐病性の獲得をつうじた環境への適応に中心的な貢献をしている可能性が高い.
トランスポゾンの挿入による遺伝子の構造の物理的な変化にくわえ,トランスポゾンの転写の活性化が近傍の遺伝子の機能に影響をおよぼすことにより植物の環境への適応に貢献する可能性がある.遺伝子の近傍,とくにプロモーター領域にトランスポゾンが挿入された場合,トランスポゾンが下流の遺伝子の制御配列としての機能,とくに環境ストレスに応じた遺伝子の発現を制御するはたらきを獲得することが多い5)(図2a).たとえば,病原体の感染,傷害,低温あるいは高温,ホルモンの処理,培養細胞化などにより,植物においてトランスポゾンそれ自体の転写が活性化し,同時に,近傍の遺伝子の発現を制御することは,タバコやイネなどの研究において以前から多くの報告がある5).イネにおいてはMITEとよばれるDNA型トランスポゾン(図1a)が新規に挿入されたさきの遺伝子のストレスに対する応答性を変化させることが知られている12).トランスポゾンが近傍の遺伝子のはたらきを環境ストレスに応じて制御する分子機構のひとつとして,トランスポゾンが環境ストレスにより活性化される転写因子の結合配列をコードし,転写因子を直接にリクルートする例が知られている(図2a).
さきにのべたシロイヌナズナの種内におけるトランスポゾンの多型の解析から,COPIA78(ONSEN としても知られる)とよばれるLTR型レトロトランスポゾンをもつ系統において,コピー数と生息地の年間気温とのあいだに高い相関があることが示された3).COPIA78は温度感受性のトランスポゾンで高温において活性化する.ただし,実験室の環境条件では,COPIA78は野生型のシロイヌナズナにおいて転写の活性化はみられるが,RNA依存性DNAメチル化機構とよばれる遺伝子サイレンシング機構が機能しない遺伝的な背景にしないと別の遺伝子座への転移は観察されない13).自然環境における高温の条件のほか,どのような条件においてCOPIA78の転移はひき起こされるのかという点にくわえ,この高温によるCOPIA78の転写の活性化および転移がシロイヌナズナの環境への適応に対しどのように影響をおよぼすのか興味深い.このCOPIA78の場合も,LTR配列に熱ショック因子とよばれる熱により発現の誘導されるタンパク質の結合配列をコードしており14),高温の環境においてこのトランスポゾンのみならずの近傍の遺伝子の転写を活性化する可能性がある.頻繁に高温にさらされる地域に生息するシロイヌナズナの集団においてはCOPIA78が活性化し,なんらかの機構によりCOPIA78が転移し挿入されることにより,たとえば,高温に対する応答性が高まるなど近傍の遺伝子の機能が変化し,結果として,COPIA78の挿入が個体の生存に有利に機能し,周囲の環境において子孫を増やしてきたことが考えられる.
シロイヌナズナの種内におけるトランスポゾンの多型の研究からは,とくにトランスポゾンの挿入の多い遺伝子として,耐病性遺伝子とならんで,花成の制御に重要なはたらきをもつFLC遺伝子が同定されている3).とくに,FLC遺伝子のプロモーター領域およびイントロンにCOPIA78を含むレトロトランスポゾンの挿入をもつ複数の系統が同定されている.FLC遺伝子は花成を抑制する機能をもつため,FLC遺伝子の阻害は開花の促進につながる.FLC遺伝子は開花を制御する重要な遺伝子としてこれまで研究が進んでおり,イントロンにその発現の抑制を制御する配列が存在することが知られている.一定の低温期間,いわゆる春化をへることにより,この制御配列をコアとして転写を抑制するエピジェネティック修飾であるヒストンH3のLys27のメチル化がFLC遺伝子の全体に広がる.FLC遺伝子の発現の抑制により下流の遺伝子の発現が活性化し,栄養成長から生殖成長への相転換がひき起こされる.ただし,トランスポゾンの挿入がみつかった系統において,トランスポゾンのもつ配列がさきにのべた熱ショック因子のような特定の転写因子をリクルートし,FLC遺伝子およびその近傍の遺伝子の発現を制御することにより環境への適応に貢献しているのかどうかは,いまのところ不明である.少なくとも,トランスポゾンの挿入のあった系統においては総じてFLC遺伝子の発現は低下しており開花が促進されていたことから,基本的に,同定されたトランスポゾンの挿入はFLC遺伝子の発現を抑制する方向にはたらいていると考えられる.こうしたトランスポゾンの挿入がFLC遺伝子の種内における多型として存在する理由として,氷河期以降の環境の温暖化のなかで,開花の促進がシロイヌナズナの集団の生存に有利にはたらいてきた可能性が考えられる.
トランスポゾンの挿入それ自体が制御配列として近傍の遺伝子の構造および発現に影響をおよぼすのと同時に,トランスポゾンのエピジェネティック修飾の変化もまた,遺伝子の発現および植物の環境への適応に大きく影響する.ただし,そのエピジェネティックな制御を介した遺伝子とトランスポゾンとの相互作用は単純ではない.一般に,プロモーター領域に挿入されたトランスポゾンにおけるDNAメチル化の上昇は下流の遺伝子の転写に抑制的にはたらき,逆に,DNAメチル化が低下することにより下流の遺伝子の発現は活性化するが,たとえば,コムギの開花に関与するVRN1遺伝子はイントロンに多くのトランスポゾンが挿入されており,低温処理による春化をへるとイントロンに存在するトランスポゾンのDNAメチル化が上昇しVRN1遺伝子の転写は活性化される15).このDNAメチル化は次世代ではリセットされる.この現象は,イントロンにおいてヘテロクロマチン化が亢進することにより,トランスポゾンの挿入されたイントロンにおいてスプライシングの効率が上昇するという分子機構により説明されるかもしれない7,16)(図2c).同様に,イントロンに存在するトランスポゾンのヘテロクロマチン化の維持が転写および耐病性において重要であることが,シロイヌナズナの耐病性遺伝子のひとつであるRPP7遺伝子(図3)においても示されている17).
これとは別に,シロイヌナズナにおいては病原性をもつPseudomonas属細菌の感染にともない,耐病性遺伝子の近傍の領域を含めゲノムにおけるトランスポゾンのDNAメチル化のパターンが変化し,高メチル化される領域と低メチル化される領域が検出されるようになる18,19).RNA依存性DNAメチル化経路を構成するタンパク質や維持性DNAメチル化酵素MET1の変異体は病原性細菌に対し野生型に比べ高い耐病性を示すようになることから,細菌に感染した際,DNAメチル化を低下させることにより耐病性遺伝子の発現を活性化して感染に応答する経路が存在すると考えられる.DNAメチル化の積極的な低下にはDNA脱メチル化酵素も関与する.DNAメチル化をより低下させれば野生型よりさらに強い耐病性をひき起こせるにもかかわらず,耐病性遺伝子クラスターなどにおいて高いDNAメチル化が維持される背景として,耐病性遺伝子のコピーをゲノムに多く保持するコストと,植物の環境への適応とのあいだとのトレードオフの存在が示唆される20).植物にとり,多数かつ多様な耐病性遺伝子のコピーをゲノムにかかえたほうがより多くの病原体に対応できる一方で,かつてはよく遭遇したが環境の変化により遭遇する可能性がかなり低くなった病原体に対する耐病性遺伝子をゲノムに維持し発現させるには一定のリソースを割く必要がある.そのコストを下げるための戦略のひとつとしてエピジェネティック修飾を利用し,ふだんは耐病性遺伝子を抑制の状態で維持し,病原体の感染に応じてエピジェネティック修飾を変化させて活性化させたほうが,低いコストで多くのコピーをゲノムに維持できるだろう.実際に,ユビキチンリガーゼ複合体の構成タンパク質のひとつであるFボックスタンパク質をコードする遺伝子は,植物のゲノムにおいて多数のコピーが維持されており,シロイヌナズナのゲノムには900個ほどがコードされているが,耐病性遺伝子と同様のエピジェネティックな抑制による低コスト化により,ゲノムにおいてコピーの多様性が維持されていることが示唆されている21).
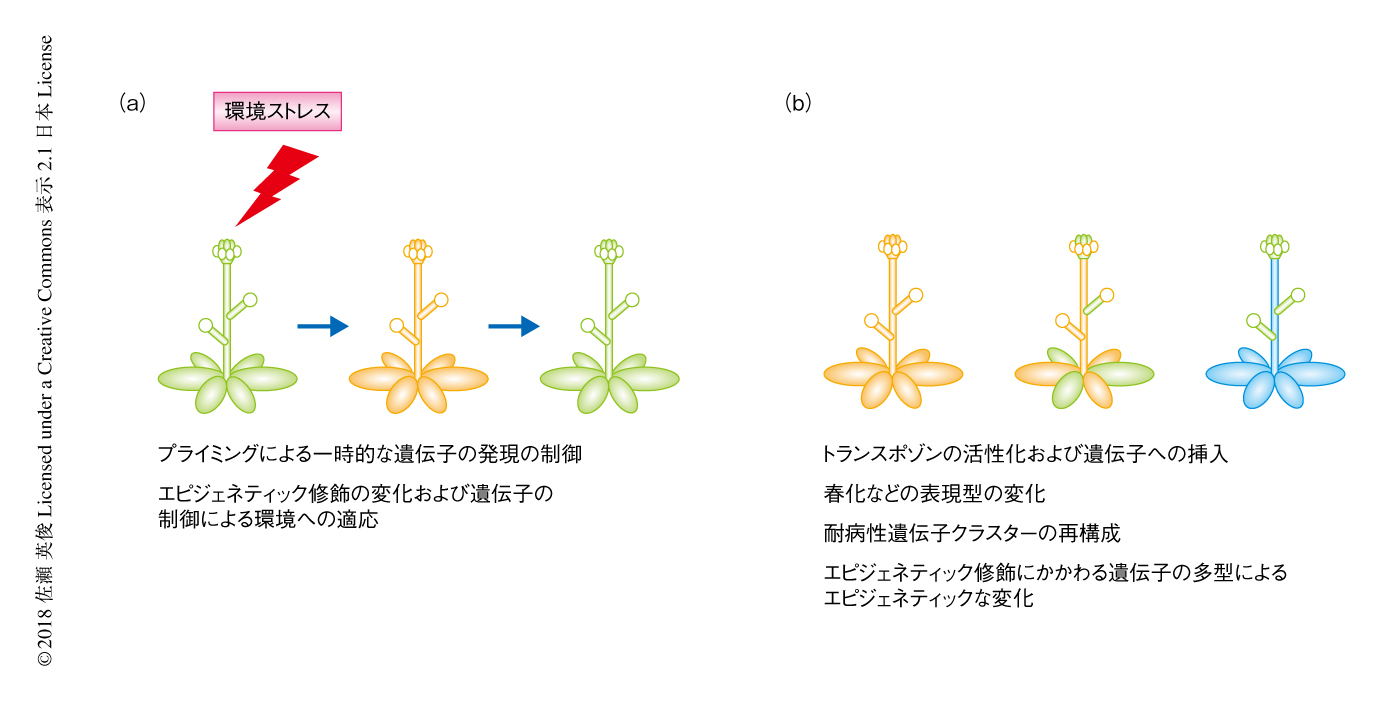
一方,植物が生育する環境において頻繁に遭遇し感染する病原体に対し,特定の耐病性遺伝子の活性化を含む防御応答を準備しておくことは植物の生存において重要である.いちど病原体に感染した植物の個体はつぎの感染に対し個体の全体において耐病性が強くなる全身獲得抵抗性とよばれる応答が知られており,その際,2回目の感染においては耐病性遺伝子の発現が早く強力に誘導されうる状態が維持されるプライミングという現象が知られている22)(図4).いちどプライミングが起こると,遺伝子領域にヒストンH3のLys4のメチル化など転写の活性化のためのエピジェネティック修飾が蓄積するが,遺伝子の発現は抑制されたままの状態が維持される.この現象を,エピジェネティック修飾を介したストレス記憶と解釈することもある.この記憶がどのくらい維持されるのかはさまざまであるだが,数日間からときに世代をこえて伝達されるとする報告もある22).ある研究においては,感染をうけた植物の次世代においては対照と比較して感染に耐病性を示し,植物ホルモンの一種であるサリチル酸により活性化する耐病性遺伝子のプロモーター領域に転写を活性化するエピジェネティック修飾であるヒストンH3のLys9のアセチル化が蓄積していた23).病原体に対する応答の世代をこえた記憶は,DNA脱メチル化酵素やRNA依存性DNAメチル化経路の変異体においてはみられなくなるという報告もある24).
当初,プライミングという現象は病原体の感染に対する植物の免疫記憶をさすものであったが,のちに,非生物的なストレスに対する応答の変化にも使用されるようになった.現在までに,熱,乾燥,塩濃度などにおいてストレス記憶の存在が報告されているが,これらの多くは数日間という短い期間で消失するため,植物の個体における長期的な環境への適応に寄与するのかどうか,いまだ不明な点も多い22).最近のシロイヌナズナにおけるストレス記憶の研究においては,塩濃度のストレスにより変化したトランスポゾンのDNAメチル化が,アンチセンス方向の非コードRNAを発現させることにより近傍の遺伝子の発現を低下させ(図2d),さらに,その状態が雌性配偶子を介して次世代に伝達されるという報告がなされた25).しかしながら,ストレス記憶の世代をこえた伝達と植物の環境への適応に関しては,その実験系も含め,結論に慎重な意見も多い22).
シロイヌナズナ1001ゲノムプロジェクトからは,ゲノムワイドなトランスポゾンのエピジェネティックな状態に影響する遺伝子,とくに,DNAメチル化酵素遺伝子などエピジェネティック修飾に関連する遺伝子の集団における多型も複数みつかっている10).以前の研究において,ゲノムにおいてDNAメチル化がいちじるしく低い系統の原因となる遺伝子として,哺乳類まで保存されるVIM1遺伝子が同定されたが26),そのほか,系統に特異的にゲノムワイドなDNAメチル化の状態に影響する遺伝子として,RNAサイレンシングに機能するAGO1遺伝子やAGO9遺伝子,とくにトランスポゾンの非CGメチル化に機能するDNAメチル化酵素をコードするCMT2遺伝子などが見い出された3).それらにくわえ,ゲノムにおけるトランスポゾンのコピー数の多様性に寄与する遺伝子として,機能未知のDNAメチル化酵素様のタンパク質をコードするMET2遺伝子も報告されている.以前の研究において,スウェーデンで採取されたシロイヌナズナの集団においては高温の条件においてトランスポゾンのDNAメチル化が上昇すること,集団におけるDNAメチル化の多様性にCMT2遺伝子が大きく寄与することが報告された27).別の報告では,CMT2遺伝子の多型による機能の低下がシロイヌナズナに高温に対する耐性をもたらすことが示唆されている28).集団における多型によるDNAメチル化の集団におけるこれらの遺伝子の多様性が,シロイヌナズナの環境への適応にどのくらい寄与しているのか,今後のさらなる研究を待ちたい.
トウモロコシの遺伝学的な研究からトランスポゾンを見い出したMcClintockがトランスポゾンを“controlling element”と位置づけ遺伝子の制御配列としての役割を予見して以降29),多くの研究がそれを裏づける証左を報告している.近年のゲノムワイドな解析技術の発展により,これまで,個別な事例として報告されてきたトランスポゾンによる遺伝子発現の制御のはたらきをゲノムの総体として解析し,トランスポゾンの存在様式および集団の環境への適応に対する貢献を理解することが可能になってきた.技術的な障壁が低くなることにより,これまでの実験室におけるモデル植物を中心とした研究から,より自然環境に近い状態で植物を研究が可能となりつつあり,今後,植物とトランスポゾンとのさらなる関係が明らかにされることを期待したい.
略歴:2003年 スイスBasel大学にて博士号取得,同年 国立遺伝学研究所 博士研究員,2008年 同 助教を経て,2011年より沖縄科学技術大学院大学 准教授.
研究テーマ:植物における遺伝子とトランスポゾンとの相互作用およびエピジェネティックな制御.
研究室URL:https://groups.oist.jp/ja/peu
© 2018 佐瀬 英俊 Licensed under CC 表示 2.1 日本
(沖縄科学技術大学院大学 植物エピジェネティクスユニット)
email:佐瀬英俊
領域融合レビュー, 7, e001 (2018) DOI: 10.7875/leading.author.7.e001
Hidetoshi Saze: Transposon-driven environmental adaptation in plants.
要 約
植物のゲノムはトランスポゾンにより形成されたくり返し配列を多く含む.これまで,遺伝子あるいはその近傍に挿入されたトランスポゾンは,遺伝子の破壊や発現の抑制など個体の生存に悪い影響をおよぼすと考えられてきた.しかし,近年,ゲノムにおけるトランスポゾンの存在様式が詳細に解析され,種によっては,活発に転写されているゲノム領域に多くのトランスポゾンが存在し,近傍の遺伝子の構造の変化や発現の制御をつうじて個体の環境への適応に大きな役割をはたすことが明らかにされつつある.このレビューにおいては,植物における遺伝子とトランスポゾンとの相互作用の分子機構について最近の知見を解説し,さらに,気温の変化や病原体に対する応答などをつうじた環境への適応に対する貢献の可能性について考察する.
はじめに
植物は固着性の生活様式をとるため,つねに外界の環境の変化にさらされている.植物の生育に影響をおよぼす環境要因としては,日周の変動,光の強度,高温あるいは低温などの気温の変化,病原体の感染,物理的な傷害,土壌の塩濃度や栄養などがあげられるが,植物はこうした環境の変化に対しさまざまに応答し環境に適応している.一般に,環境への適応の過程においては,転写因子をコードする遺伝子を中心に転写の活性化が起こり,さらにそれらの転写因子が下流のさまざまな遺伝子の転写を活性化することにより生理的な応答につながる.この遺伝子発現の制御において重要なはたらきをするのが,エピジェネティック修飾とよばれるクロマチンの化学修飾である.近年の解析技術の進歩により,環境への適応の一環としてエピジェネティックな情報にダイナミックな変化がひき起こされることが明らかにされつつある.
植物のゲノムにおけるエピジェネティック修飾のもうひとつの大きな役割は,トランスポゾン(転移因子)とよばれるゲノムに寄生するDNA配列の転写を抑制することである.これまで,遺伝子あるいはその近傍に挿入されたトランスポゾンは遺伝子の破壊や発現の抑制など個体の生存に悪い影響をおよぼす厄介者と考えられてきた.しかし,近年の大規模なゲノムプロジェクトおよびエピゲノムプロジェクトによりゲノムにおけるトランスポゾンの存在様式が詳細に解析され,種によっては,活発に転写されている遺伝子あるいはその近傍に多くのトランスポゾンが存在することが明らかにされつつある.トランスポゾンは転移したさきのDNA配列を破壊することからエピジェネティックな機構により抑制されているが,このトランスポゾンの遺伝子あるいはその近傍への挿入が,遺伝子の配列あるいは構造の変化,および,遺伝子の転写の制御という2つのレベルにおいて植物の環境への適応に寄与するという知見が蓄積されつつある.
このレビューにおいては,遺伝子とトランスポゾンとの相互作用の分子機構について,とくに,大規模なゲノムプロジェクトおよびエピゲノムプロジェクトが完了したシロイヌナズナを中心として近年の知見を解説し,さらに,エピジェネティックな情報が気温の変化や病原体に対する応答などをつうじた植物の環境への適応に対し貢献する可能性について考察する.
1.植物におけるゲノムの構造とトランスポゾン
植物のゲノムは,その遺伝子の数と比較してゲノムのサイズに大きな多様性があり,また,ゲノムのサイズはトランスポゾンのしめる割合と強い相関があって1,2),とくに,レトロトランスポゾンとよばれる逆転写を介してコピーを増幅するトランスポゾンはゲノムにしめる割合が高い(図1).トランスポゾンは挿入されたDNA配列を中断することにより遺伝子を破壊したり,相同なコピーのあいだでの偶発的な相同組換えをひき起こしたりするため,ゲノムの構造の維持において重大な脅威となる.そのため,トランスポゾンは細胞のもつ転写の抑制機構の標的になっている.この抑制機構の中心になるのが,幅広い種において保存されている,RNAi,DNAメチル化,ヒストンの脱アセチル化,ヒストンH3のLys9のメチル化などのエピジェネティック修飾である.基本的に,こうした転写を抑制するエピジェネティック修飾は,RNAポリメラーゼなどの転写装置がアクセスしづらいようクロマチンの状態を変化させ,ヘテロクロマチンとよばれる転写が抑制される状態を,DNA複製をへて長期間にわたり維持するよう機能する.直接には遺伝子に挿入されていないトランスポゾンでも,DNAメチル化など転写を抑制するエピジェネティック修飾がトランスポゾンの領域をこえて数百bpからときに数kbも広がるため3),トランスポゾンの挿入は結果として近傍の遺伝子の転写を抑制し遺伝子の正常な機能を阻害すると考えられている.そのため,一般に,トランスポゾンは重要な遺伝子の多い染色体の腕部からは排除され,逆に,組換え率が低く遺伝子の少ない領域,とくに,セントロメアの近傍のペリセントロメア領域に蓄積する傾向がある.最近のシロイヌナズナの集団のゲノム解析において,遺伝子の近傍にも多くのトランスポゾンがみつかっているが,多くの場合,集団において挿入の多型がみられることから3),こうした遺伝子の近傍に挿入されたトランスポゾンは,比較的最近に転移したものであり集団に固定されてはいないと思われる.こうした孤発的な転移をひき起こした若いトランスポゾンのほとんどは,遺伝的浮動の結果,あるいは,近傍の遺伝子の機能を阻害することにより,結果的に個体の適応度を低下させ,中長期的には集団から排除されると思われる.
遺伝子領域にトランスポゾンが挿入された場合,プロモーター領域,エキソン,イントロンなど,挿入された部位がどの領域によるかで遺伝子の機能への影響は大きく変わると考えられる(図2).トランスポゾンがプロモーター領域に挿入された場合,ヘテロクロマチン化の標的になることにより下流の遺伝子の転写は抑制されることが多いと考えられているが4),逆に,下流の遺伝子の転写が活性化される例も多くみつかっている3,5,6).一方,トランスポゾンがエキソンに挿入されると遺伝子が破壊され遺伝子の機能に大きな障害が起こる.これには,DNA配列の物理的な中断にくわえ,転写装置の通過の阻害,スプライシングの誤り,トランスポゾンに内在するプロモーターによるアンチセンスRNAの産生などによる遺伝子発現の阻害といった現象が含まれ,遺伝子の発現に負の影響をひき起こす.一方で,活発に転写されている遺伝子領域において,イントロン,5’側非翻訳領域,3’側非翻訳領域に大量のトランスポゾンが存在することも知られている.モデル植物としてトランスポゾンやエピジェネティックな機構がよく調べられているシロイヌナズナの場合,トランスポゾンの全体のおよそ3%は遺伝子領域に存在するが,そのほとんどはイントロンにある7).ゲノムの60~80%がトランスポゾンからなるといわれるトウモロコシの場合,1 kb以上の長さをもつトランスポゾンが10%以上の遺伝子のイントロンにみつかっている8).一方,裸子植物のオウシュウトウヒ(Picea abies)は,シロイヌナズナの100倍以上の20 Gbという巨大なゲノムをもつが,シロイヌナズナと同じ程度の数の遺伝子およびエキソン長をもつ一方,イントロンは植物のゲノムのなかでとりわけ長い.これは,過去数千万年にわたりイントロンへレトロトランスポゾンが蓄積しこれが排除されなかったためと考えられている9).
活発に転写されている遺伝子領域に存在するトランスポゾンも,遺伝子間領域のトランスポゾンと同様に,ヘテロクロマチン化の標的になり転写が抑制された状態が維持されていることが,シロイヌナズナやトウモロコシなどで確認されている(図3).さらには,イントロンにトランスポゾンが挿入された遺伝子は,挿入のない遺伝子と比較して同じ程度の発現を示すことが多く,植物のゲノムにおいて,イントロンに存在するトランスポゾンを認識し安定した遺伝子の発現を維持する機構が示唆されている7).こうしたイントロンに存在するトランスポゾンについては,スプライシングによりmRNAからは除去されるため遺伝子の機能への影響は比較的少ないと考えられるが,一般に,遺伝子間領域に存在するトランスポゾンと比較して,遺伝子領域に存在するトランスポゾンは欠失などによりその長さは短いため,トランスポゾンそれ自体に対する負の選択圧が存在すると考えられる.一方,以下にのべるように,プロモーター領域,非翻訳領域,イントロンにおいて,遺伝子に対するなんらかの機能をもつことによりトランスポゾンが進化的に維持されている可能性もある.
2.トランスポゾンのひき起こす遺伝子の構造の変化による環境への適応
植物をとりまく環境ストレスには,温度の変化,乾燥,塩濃度の変化などの無生物的なストレスと,病原体の感染などの生物的なストレスとがある.近年のシロイヌナズナ1001ゲノムプロジェクトにおいては,1000以上の野生系統についてゲノム,DNAメチル化,遺伝子の発現が解析され10),ゲノムおよびエピゲノムが集団においてもっとも多様化している領域として,耐病性遺伝子クラスターが同定された10).植物における病原体に対する免疫機構のひとつとして,エフェクター誘導免疫(effector-triggered immunity:ETI)が知られている.この過程において,細胞に侵入した病原体に由来する分子を直接的あるいは間接的に認識するのが耐病性遺伝子であり,種によってはゲノムに1000コピー以上も維持されている.また,多くの植物のゲノムにおいては,耐病性遺伝子の大半はクラスターを形成している.耐病性遺伝子クラスターを形成する遺伝子は細菌,ウイルス,線虫,昆虫,糸状菌などさまざまな病原体を認識するため,多様化し進化の速い領域として知られている11).エフェクター誘導免疫により病原体の感染が認識されると,細胞死などの生理的な反応がひき起こされ個体における感染の広がりをふせぐ.耐病性遺伝子クラスターの多様化に大きな影響をおよぼしていると考えられるのが,挿入された多数のトランスポゾンである.以前から,耐病性遺伝子クラスターにはトランスポゾンの多いことが指摘されており,トランスポゾンの相同配列のあいだの組換えや不均等な乗換えにより,耐病性遺伝子クラスターにおいては重複や欠失が急速な進行していると考えられている.こうした耐病性遺伝子クラスターにおける種内での進化的な多様化は,一方で,さまざまな病原体との軍拡競争の結果とも考えられ,耐病性遺伝子クラスターにトランスポゾンが蓄積することが,植物における耐病性の獲得をつうじた環境への適応に中心的な貢献をしている可能性が高い.
3.トランスポゾンによる遺伝子の発現の制御および環境への適応
トランスポゾンの挿入による遺伝子の構造の物理的な変化にくわえ,トランスポゾンの転写の活性化が近傍の遺伝子の機能に影響をおよぼすことにより植物の環境への適応に貢献する可能性がある.遺伝子の近傍,とくにプロモーター領域にトランスポゾンが挿入された場合,トランスポゾンが下流の遺伝子の制御配列としての機能,とくに環境ストレスに応じた遺伝子の発現を制御するはたらきを獲得することが多い5)(図2a).たとえば,病原体の感染,傷害,低温あるいは高温,ホルモンの処理,培養細胞化などにより,植物においてトランスポゾンそれ自体の転写が活性化し,同時に,近傍の遺伝子の発現を制御することは,タバコやイネなどの研究において以前から多くの報告がある5).イネにおいてはMITEとよばれるDNA型トランスポゾン(図1a)が新規に挿入されたさきの遺伝子のストレスに対する応答性を変化させることが知られている12).トランスポゾンが近傍の遺伝子のはたらきを環境ストレスに応じて制御する分子機構のひとつとして,トランスポゾンが環境ストレスにより活性化される転写因子の結合配列をコードし,転写因子を直接にリクルートする例が知られている(図2a).
さきにのべたシロイヌナズナの種内におけるトランスポゾンの多型の解析から,COPIA78(ONSEN としても知られる)とよばれるLTR型レトロトランスポゾンをもつ系統において,コピー数と生息地の年間気温とのあいだに高い相関があることが示された3).COPIA78は温度感受性のトランスポゾンで高温において活性化する.ただし,実験室の環境条件では,COPIA78は野生型のシロイヌナズナにおいて転写の活性化はみられるが,RNA依存性DNAメチル化機構とよばれる遺伝子サイレンシング機構が機能しない遺伝的な背景にしないと別の遺伝子座への転移は観察されない13).自然環境における高温の条件のほか,どのような条件においてCOPIA78の転移はひき起こされるのかという点にくわえ,この高温によるCOPIA78の転写の活性化および転移がシロイヌナズナの環境への適応に対しどのように影響をおよぼすのか興味深い.このCOPIA78の場合も,LTR配列に熱ショック因子とよばれる熱により発現の誘導されるタンパク質の結合配列をコードしており14),高温の環境においてこのトランスポゾンのみならずの近傍の遺伝子の転写を活性化する可能性がある.頻繁に高温にさらされる地域に生息するシロイヌナズナの集団においてはCOPIA78が活性化し,なんらかの機構によりCOPIA78が転移し挿入されることにより,たとえば,高温に対する応答性が高まるなど近傍の遺伝子の機能が変化し,結果として,COPIA78の挿入が個体の生存に有利に機能し,周囲の環境において子孫を増やしてきたことが考えられる.
シロイヌナズナの種内におけるトランスポゾンの多型の研究からは,とくにトランスポゾンの挿入の多い遺伝子として,耐病性遺伝子とならんで,花成の制御に重要なはたらきをもつFLC遺伝子が同定されている3).とくに,FLC遺伝子のプロモーター領域およびイントロンにCOPIA78を含むレトロトランスポゾンの挿入をもつ複数の系統が同定されている.FLC遺伝子は花成を抑制する機能をもつため,FLC遺伝子の阻害は開花の促進につながる.FLC遺伝子は開花を制御する重要な遺伝子としてこれまで研究が進んでおり,イントロンにその発現の抑制を制御する配列が存在することが知られている.一定の低温期間,いわゆる春化をへることにより,この制御配列をコアとして転写を抑制するエピジェネティック修飾であるヒストンH3のLys27のメチル化がFLC遺伝子の全体に広がる.FLC遺伝子の発現の抑制により下流の遺伝子の発現が活性化し,栄養成長から生殖成長への相転換がひき起こされる.ただし,トランスポゾンの挿入がみつかった系統において,トランスポゾンのもつ配列がさきにのべた熱ショック因子のような特定の転写因子をリクルートし,FLC遺伝子およびその近傍の遺伝子の発現を制御することにより環境への適応に貢献しているのかどうかは,いまのところ不明である.少なくとも,トランスポゾンの挿入のあった系統においては総じてFLC遺伝子の発現は低下しており開花が促進されていたことから,基本的に,同定されたトランスポゾンの挿入はFLC遺伝子の発現を抑制する方向にはたらいていると考えられる.こうしたトランスポゾンの挿入がFLC遺伝子の種内における多型として存在する理由として,氷河期以降の環境の温暖化のなかで,開花の促進がシロイヌナズナの集団の生存に有利にはたらいてきた可能性が考えられる.
4.トランスポゾンのエピジェネティックな制御による植物の環境への適応
トランスポゾンの挿入それ自体が制御配列として近傍の遺伝子の構造および発現に影響をおよぼすのと同時に,トランスポゾンのエピジェネティック修飾の変化もまた,遺伝子の発現および植物の環境への適応に大きく影響する.ただし,そのエピジェネティックな制御を介した遺伝子とトランスポゾンとの相互作用は単純ではない.一般に,プロモーター領域に挿入されたトランスポゾンにおけるDNAメチル化の上昇は下流の遺伝子の転写に抑制的にはたらき,逆に,DNAメチル化が低下することにより下流の遺伝子の発現は活性化するが,たとえば,コムギの開花に関与するVRN1遺伝子はイントロンに多くのトランスポゾンが挿入されており,低温処理による春化をへるとイントロンに存在するトランスポゾンのDNAメチル化が上昇しVRN1遺伝子の転写は活性化される15).このDNAメチル化は次世代ではリセットされる.この現象は,イントロンにおいてヘテロクロマチン化が亢進することにより,トランスポゾンの挿入されたイントロンにおいてスプライシングの効率が上昇するという分子機構により説明されるかもしれない7,16)(図2c).同様に,イントロンに存在するトランスポゾンのヘテロクロマチン化の維持が転写および耐病性において重要であることが,シロイヌナズナの耐病性遺伝子のひとつであるRPP7遺伝子(図3)においても示されている17).
これとは別に,シロイヌナズナにおいては病原性をもつPseudomonas属細菌の感染にともない,耐病性遺伝子の近傍の領域を含めゲノムにおけるトランスポゾンのDNAメチル化のパターンが変化し,高メチル化される領域と低メチル化される領域が検出されるようになる18,19).RNA依存性DNAメチル化経路を構成するタンパク質や維持性DNAメチル化酵素MET1の変異体は病原性細菌に対し野生型に比べ高い耐病性を示すようになることから,細菌に感染した際,DNAメチル化を低下させることにより耐病性遺伝子の発現を活性化して感染に応答する経路が存在すると考えられる.DNAメチル化の積極的な低下にはDNA脱メチル化酵素も関与する.DNAメチル化をより低下させれば野生型よりさらに強い耐病性をひき起こせるにもかかわらず,耐病性遺伝子クラスターなどにおいて高いDNAメチル化が維持される背景として,耐病性遺伝子のコピーをゲノムに多く保持するコストと,植物の環境への適応とのあいだとのトレードオフの存在が示唆される20).植物にとり,多数かつ多様な耐病性遺伝子のコピーをゲノムにかかえたほうがより多くの病原体に対応できる一方で,かつてはよく遭遇したが環境の変化により遭遇する可能性がかなり低くなった病原体に対する耐病性遺伝子をゲノムに維持し発現させるには一定のリソースを割く必要がある.そのコストを下げるための戦略のひとつとしてエピジェネティック修飾を利用し,ふだんは耐病性遺伝子を抑制の状態で維持し,病原体の感染に応じてエピジェネティック修飾を変化させて活性化させたほうが,低いコストで多くのコピーをゲノムに維持できるだろう.実際に,ユビキチンリガーゼ複合体の構成タンパク質のひとつであるFボックスタンパク質をコードする遺伝子は,植物のゲノムにおいて多数のコピーが維持されており,シロイヌナズナのゲノムには900個ほどがコードされているが,耐病性遺伝子と同様のエピジェネティックな抑制による低コスト化により,ゲノムにおいてコピーの多様性が維持されていることが示唆されている21).
一方,植物が生育する環境において頻繁に遭遇し感染する病原体に対し,特定の耐病性遺伝子の活性化を含む防御応答を準備しておくことは植物の生存において重要である.いちど病原体に感染した植物の個体はつぎの感染に対し個体の全体において耐病性が強くなる全身獲得抵抗性とよばれる応答が知られており,その際,2回目の感染においては耐病性遺伝子の発現が早く強力に誘導されうる状態が維持されるプライミングという現象が知られている22)(図4).いちどプライミングが起こると,遺伝子領域にヒストンH3のLys4のメチル化など転写の活性化のためのエピジェネティック修飾が蓄積するが,遺伝子の発現は抑制されたままの状態が維持される.この現象を,エピジェネティック修飾を介したストレス記憶と解釈することもある.この記憶がどのくらい維持されるのかはさまざまであるだが,数日間からときに世代をこえて伝達されるとする報告もある22).ある研究においては,感染をうけた植物の次世代においては対照と比較して感染に耐病性を示し,植物ホルモンの一種であるサリチル酸により活性化する耐病性遺伝子のプロモーター領域に転写を活性化するエピジェネティック修飾であるヒストンH3のLys9のアセチル化が蓄積していた23).病原体に対する応答の世代をこえた記憶は,DNA脱メチル化酵素やRNA依存性DNAメチル化経路の変異体においてはみられなくなるという報告もある24).
当初,プライミングという現象は病原体の感染に対する植物の免疫記憶をさすものであったが,のちに,非生物的なストレスに対する応答の変化にも使用されるようになった.現在までに,熱,乾燥,塩濃度などにおいてストレス記憶の存在が報告されているが,これらの多くは数日間という短い期間で消失するため,植物の個体における長期的な環境への適応に寄与するのかどうか,いまだ不明な点も多い22).最近のシロイヌナズナにおけるストレス記憶の研究においては,塩濃度のストレスにより変化したトランスポゾンのDNAメチル化が,アンチセンス方向の非コードRNAを発現させることにより近傍の遺伝子の発現を低下させ(図2d),さらに,その状態が雌性配偶子を介して次世代に伝達されるという報告がなされた25).しかしながら,ストレス記憶の世代をこえた伝達と植物の環境への適応に関しては,その実験系も含め,結論に慎重な意見も多い22).
5.ゲノムワイドなエピジェネティック修飾の変化と環境への適応
シロイヌナズナ1001ゲノムプロジェクトからは,ゲノムワイドなトランスポゾンのエピジェネティックな状態に影響する遺伝子,とくに,DNAメチル化酵素遺伝子などエピジェネティック修飾に関連する遺伝子の集団における多型も複数みつかっている10).以前の研究において,ゲノムにおいてDNAメチル化がいちじるしく低い系統の原因となる遺伝子として,哺乳類まで保存されるVIM1遺伝子が同定されたが26),そのほか,系統に特異的にゲノムワイドなDNAメチル化の状態に影響する遺伝子として,RNAサイレンシングに機能するAGO1遺伝子やAGO9遺伝子,とくにトランスポゾンの非CGメチル化に機能するDNAメチル化酵素をコードするCMT2遺伝子などが見い出された3).それらにくわえ,ゲノムにおけるトランスポゾンのコピー数の多様性に寄与する遺伝子として,機能未知のDNAメチル化酵素様のタンパク質をコードするMET2遺伝子も報告されている.以前の研究において,スウェーデンで採取されたシロイヌナズナの集団においては高温の条件においてトランスポゾンのDNAメチル化が上昇すること,集団におけるDNAメチル化の多様性にCMT2遺伝子が大きく寄与することが報告された27).別の報告では,CMT2遺伝子の多型による機能の低下がシロイヌナズナに高温に対する耐性をもたらすことが示唆されている28).集団における多型によるDNAメチル化の集団におけるこれらの遺伝子の多様性が,シロイヌナズナの環境への適応にどのくらい寄与しているのか,今後のさらなる研究を待ちたい.
おわりに
トウモロコシの遺伝学的な研究からトランスポゾンを見い出したMcClintockがトランスポゾンを“controlling element”と位置づけ遺伝子の制御配列としての役割を予見して以降29),多くの研究がそれを裏づける証左を報告している.近年のゲノムワイドな解析技術の発展により,これまで,個別な事例として報告されてきたトランスポゾンによる遺伝子発現の制御のはたらきをゲノムの総体として解析し,トランスポゾンの存在様式および集団の環境への適応に対する貢献を理解することが可能になってきた.技術的な障壁が低くなることにより,これまでの実験室におけるモデル植物を中心とした研究から,より自然環境に近い状態で植物を研究が可能となりつつあり,今後,植物とトランスポゾンとのさらなる関係が明らかにされることを期待したい.
文 献
- Tenaillon, M. I., Hollister, J. D. & Gaut, B. S.: A triptych of the evolution of plant transposable elements. Trends Plant Sci., 15, 471-478 (2010)[PubMed]
- Oliver, K. R., McComb, J. A. & Greene, W. K.: Transposable elements: powerful contributors to angiosperm evolution and diversity. Genome Biol. Evol., 5, 1886-1901 (2013)[PubMed]
- Quadrana, L., Bortolini Silveira, A., Mayhew, G. F. et al.: The Arabidopsis thaliana mobilome and its impact at the species level. Elife, 5, e15716 (2016)[PubMed]
- Hollister, J. D. & Gaut, B. S.: Epigenetic silencing of transposable elements: a trade-off between reduced transposition and deleterious effects on neighboring gene expression. Genome Res., 19, 1419-1428 (2009)[PubMed]
- Lisch, D.: How important are transposons for plant evolution? Nat. Rev. Genet., 14, 49-61 (2013)[PubMed]
- Stuart, T., Eichten, S. R., Cahn, J. et al.: Population scale mapping of transposable element diversity reveals links to gene regulation and epigenomic variation. Elife, 5, e20777 (2016)[PubMed]
- Le, T. N., Miyazaki, Y., Takuno, S. et al.: Epigenetic regulation of intragenic transposable elements impacts gene transcription in Arabidopsis thaliana. Nucleic Acids Res., 43, 3911-3921 (2015)[PubMed]
- West, P. T., Li, Q., Ji, L. et al.: Genomic distribution of H3K9me2 and DNA methylation in a maize genome. PLoS One, 9, e105267 (2014)[PubMed]
- Nystedt, B., Street, N. R., Wetterbom, A. et al.: The Norway spruce genome sequence and conifer genome evolution. Nature, 497, 579-584 (2013)[PubMed]
- Kawakatsu, T., Huang, S. C., Jupe, F. et al.: Epigenomic diversity in a global collection of Arabidopsis thaliana accessions. Cell, 166, 492-505 (2016)[PubMed]
- Meyers, B. C., Kaushik, S. & Nandety, R. S.: Evolving disease resistance genes. Curr. Opin. Plant Biol., 8, 129-134 (2005)[PubMed]
- Naito, K., Zhang, F., Tsukiyama, T. et al.: Unexpected consequences of a sudden and massive transposon amplification on rice gene expression. Nature, 461, 1130-1134 (2009)[PubMed]
- Ito, H., Gaubert, H., Bucher, E. et al.: An siRNA pathway prevents transgenerational retrotransposition in plants subjected to stress. Nature, 472, 115-119 (2011)[PubMed]
- Pietzenuk, B., Markus, C., Gaubert, H. et al.: Recurrent evolution of heat-responsiveness in Brassicaceae COPIA elements. Genome Biol., 17, 209 (2016)[PubMed]
- Khan, A. R., Enjalbert, J., Marsollier, A. C. et al.: Vernalization treatment induces site-specific DNA hypermethylation at the VERNALIZATION-A1 (VRN-A1) locus in hexaploid winter wheat. BMC Plant Biol., 13, 209 (2013)[PubMed]
- Osabe, K., Harukawa, Y., Miura, S. et al.: Epigenetic regulation of intronic transgenes in Arabidopsis. Sci. Rep., 7, 45166 (2017)[PubMed]
- Tsuchiya, T. & Eulgem, T.: An alternative polyadenylation mechanism coopted to the Arabidopsis RPP7 gene through intronic retrotransposon domestication. Proc. Natl. Acad. Sci. USA, 110, E3535-E3543 (2013)[PubMed]
- Dowen, R. H., Pelizzola, M., Schmitz, R. J. et al.: Widespread dynamic DNA methylation in response to biotic stress. Proc. Natl. Acad. Sci. USA, 109, E2183-E2191 (2012)[PubMed]
- Yu, A., Lepere, G., Jay, F. et al.: Dynamics and biological relevance of DNA demethylation in Arabidopsis antibacterial defense. Proc. Natl. Acad. Sci. USA, 110, 2389-2394 (2013)[PubMed]
- Tian, D., Traw, M. B., Chen, J. Q. et al.: Fitness costs of R-gene-mediated resistance in Arabidopsis thaliana. Nature, 423, 74-77 (2003)[PubMed]
- Hua, Z., Pool, J. E., Schmitz, R. J. et al.: Epigenomic programming contributes to the genomic drift evolution of the F-Box protein superfamily in Arabidopsis. Proc. Natl. Acad. Sci. USA, 110, 16927-16932 (2013)[PubMed]
- Lamke, J. & Baurle, I.: Epigenetic and chromatin-based mechanisms in environmental stress adaptation and stress memory in plants. Genome Biol., 18, 124 (2017)[PubMed]
- Luna, E., Bruce, T. J. A., Roberts, M. R. et al.: Next-generation systemic acquired resistance. Plant Physiol., 158, 844-853 (2012)[PubMed]
- Lopez Sanchez, A., Stassen, J. H. M., Furci, L. et al.: The role of DNA (de)methylation in immune responsiveness of Arabidopsis. Plant J., 88, 361-374 (2016)[PubMed]
- Wibowo, A., Becker, C., Marconi, G. et al.: Hyperosmotic stress memory in Arabidopsis is mediated by distinct epigenetically labile sites in the genome and is restricted in the male germline by DNA glycosylase activity. Elife, 5, e13546 (2016)[PubMed]
- Woo, H. R., Pontes, O., Pikaard, C. S. et al.: VIM1, a methylcytosine-binding protein required for centromeric heterochromatinization. Genes Dev., 21, 267-277 (2007)[PubMed]
- Dubin, M. J., Zhang, P., Meng, D. et al.: DNA methylation in Arabidopsis has a genetic basis and shows evidence of local adaptation. Elife, 4, e05255 (2015)[PubMed]
- Shen, X., De Jonge, J., Forsberg, S. K. et al.: Natural CMT2 variation is associated with genome-wide methylation changes and temperature seasonality. PLoS Genet., 10, e1004842 (2014)[PubMed]
- McClintock, B.: The significance of responses of the genome to challenge. Science, 226, 792-801 (1984)[PubMed]
著者プロフィール
略歴:2003年 スイスBasel大学にて博士号取得,同年 国立遺伝学研究所 博士研究員,2008年 同 助教を経て,2011年より沖縄科学技術大学院大学 准教授.
研究テーマ:植物における遺伝子とトランスポゾンとの相互作用およびエピジェネティックな制御.
研究室URL:https://groups.oist.jp/ja/peu
© 2018 佐瀬 英俊 Licensed under CC 表示 2.1 日本