がん免疫療法における獲得耐性
2018/05/22
小山 正平
(大阪大学大学院医学系研究科 呼吸器・免疫内科学)
email:小山正平
領域融合レビュー, 7, e004 (2018) DOI: 10.7875/leading.author.7.e004
Shohei Koyama: Adaptive and acquired resistance to cancer immunotherapies.

2012年に各種の固形がんに対する抗PD-1抗体および抗PD-L1抗体の有効性が報告されて以来,わが国においても,悪性黒色腫や肺がんをはじめとしたさまざまながんに対し免疫チェックポイント阻害薬によるがん免疫療法が標準的な治療法のひとつとして用いられるようになった.実際に免疫チェックポイント阻害薬により治療される患者の増加にともない,これらのがん免疫療法に対しもともと奏功の得られない症例だけでなく,当初は奏功が得られていたにもかかわらず腫瘍が再増大する症例の存在が明らかにされた.しかしながら,これらがん免疫療法に対する耐性がどのような機序により生じるのかについてはいまだ不明な点が多い.筆者らは,非小細胞肺がんに対する抗PD-1抗体によるがん免疫療法において長期の治療ののち耐性が生じた症例の解析から,T細胞におけるPD-1以外の免疫チェックポイントタンパク質の発現の上昇にともないT細胞が抑制される代償的な機序について明らかにした.このレビューにおいては,おもに抗PD-1抗体によるがん免疫療法において生じる耐性,とくに獲得耐性に焦点をあて,その原因となる腫瘍細胞の因子および宿主の免疫細胞の因子の両方の側面から,その機序について解説する.
2000年代初頭からのヒトにおけるがんのゲノム解析の進歩により,特定の遺伝子に生じた変異によるシグナルの異常な活性化を特異的に抑制するような治療薬の開発が進み,キナーゼ阻害薬として各種の悪性腫瘍に対し有効性を示すことが明らかにされ,ゲノム医療による最初のブレイクスルーとなった.肺がんは組織学的に神経内分泌細胞に由来する小細胞がんとそれ以外の非小細胞肺がんとに分類されるが,非小細胞肺がん,なかでも,もっとも頻度の高い腺がんにおいてEGFR遺伝子,ALK遺伝子,ROS1遺伝子といったがん遺伝子にて特定の部位の変異や遺伝子どうしの融合などからシグナルの異常な活性化が生じることが明らかにされた.これらの遺伝子変異は肺がんの増殖におけるキープレーヤーとして機能することからドライバー変異とよばれるが,それぞれの遺伝子変異によるシグナルの異常な活性化を特異的に阻害するキナーゼ阻害薬が開発された.これらの特徴的な遺伝子変異をもつ患者においては,それまでもっとも治療の効果が高いとされてきた抗がん剤併用療法と比較して,これらのキナーゼ阻害薬が非常に高い奏功率をもたらすことが示され,ドライバー変異をもつ肺がんの患者の予後を飛躍的に改善することに成功した1).
その一方,新たな課題として,病原微生物が抗生物質の長期にわたる使用により耐性を獲得するのと同じように,肺がん細胞もドライバー変異を標的としたキナーゼ阻害薬に対し多くは半年から1年で耐性を獲得することが明らかにされた.おもにゲノム解析にもとづく研究により,耐性の機序の一部は2次的な遺伝子変異の獲得という一定のパターンを示すこともわかった2).耐性の獲得という課題はあるものの,キナーゼ阻害薬はドライバー変異をもつ患者に対し非常に高い有効性を示すことから,現在では,肺がんの治療において非常に大きな役割を担っている.しかし,特定のドライバー変異をもたない患者に対する有効性は乏しく,このような患者に対しても,これまでの標準的な抗がん剤による治療を凌駕するような新たな治療法の開発が望まれていた.そこに登場したのが,免疫チェックポイント阻害薬に代表されるがん免疫療法である3,4).
わが国において,非小細胞肺がんに対し最初に使用が可能になった免疫チェックポイント阻害薬が抗PD-1抗体である.その治療の効果は,ドライバー変異をもつ患者よりむしろもたない患者において高く,のちの研究により,その理由は腫瘍における遺伝子変異の量(tumor mutation burden:TMB)によることが明らかにされ,ドライバー変異をもつ患者に比べ,ドライバー変異をもたない患者においては遺伝子変異の量がより多いことがおもに関与した5,6).遺伝子変異の量には喫煙が大きく寄与しており,喫煙歴の差がそのまま遺伝子変異の量および抗PD-1抗体による奏功率の差に影響する可能性が示され5),喫煙者に効きやすい治療であることが示された.そののち,喫煙や遺伝子変異の量のほかにも,抗PD-1抗体に対する感受性あるいは非感受性にかかわるさまざまな因子が報告された.
免疫チェックポイント阻害薬に関するもうひとつの特徴として,治療が奏功した場合,その治療の効果が抗がん剤やキナーゼ阻害薬よりも長期にわたり持続することがある7).一方,がん免疫療法により長期にわたり治療された症例の蓄積にともない,筆者らを含む複数の研究グループにより,比較的長期にわたり奏功していたにもかかわらず,キナーゼ阻害薬において認められるような耐性の獲得が免疫チェックポイント阻害薬においても少なからず生じうることが明らかにされた.これまでのゲノム研究の進歩にもとづくキナーゼ阻害薬の開発およびその耐性の獲得の機序の解明といった背景から,がん免疫療法における耐性の獲得の機序についても腫瘍細胞のゲノム解析からのアプローチが進められたが,これまでの治療法とは異なり,がん免疫療法の標的は宿主の免疫細胞であるため,免疫細胞の状態を時間の経過で追跡することも耐性の獲得の機序の解明には重要であることが示唆された.
以上のような背景から,このレビューにおいては,おもに非小細胞肺がんに対する抗PD-1抗体によるがん免疫療法における耐性の獲得の機序に焦点をあて,最近,明らかにされた知見について解説する.
なお,がん免疫療法については,杉山大介・西川博嘉, 領域融合レビュー, 4, e005 (2015) も参照されたい.
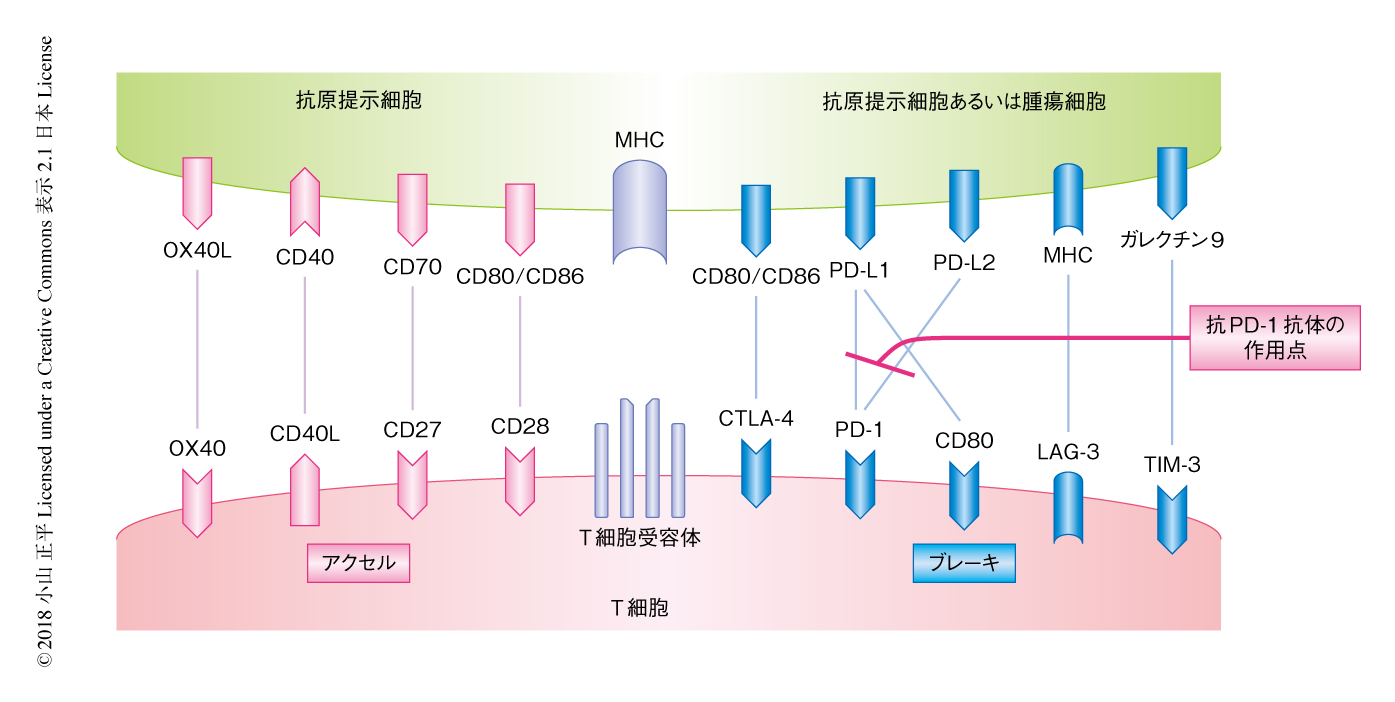
腫瘍細胞の破壊に機能し,また,免疫チェックポイント阻害薬の標的になるキープレーヤーがT細胞である.T細胞は,本来は生体には存在せず腫瘍細胞のみに出現した異常な非自己タンパク質を特異的に認識し,活性化して標的となる腫瘍細胞を破壊する.その過程で最初に必要となるのが,異常なタンパク質の情報を伝達する側の細胞膜にある主要組織適合遺伝子複合体(major histocompatibility complex:MHC)と,T細胞にある受容体との相互作用である.実際に,生体のあらゆる細胞がMHCを発現することにより異常なタンパク質の情報を伝達する能力をもつが,その伝達のエキスパートである細胞が樹状細胞やマクロファージなどの抗原提示細胞である.抗原提示細胞は異常なタンパク質の情報を分解しペプチドの断片としてT細胞に伝達すると同時に,T細胞にあるCD28を刺激するCD80やCD86といったタンパク質を発現し,情報を伝達したT細胞を活性化する.これらは共刺激タンパク質とよばれ,T細胞に活性化にアクセルをかける作用をもつ.一方,T細胞には活性化をちょうどよく停止するようブレーキをかける作用をもつタンパク質も同時に発現する.これらのT細胞を活性化もしくは抑制するタンパク質を総称して免疫チェックポイントタンパク質とよぶ(図1).
腫瘍において問題になるのが,抗原提示細胞や腫瘍細胞がT細胞の活性化を抑制する免疫チェックポイントタンパク質に必要以上に作用することにより,T細胞による腫瘍細胞の破壊が十分にできなくことである.この過剰なブレーキを遮断するのが免疫チェックポイント阻害薬で,とくに,抗PD-1抗体は抗原提示細胞や腫瘍細胞に発現したPD-L1あるいはPD-L2とT細胞における活性化の抑制に中心的な存在であるPD-1との相互作用を遮断し,T細胞の活性化が抑制されないようにする作用をもつ.
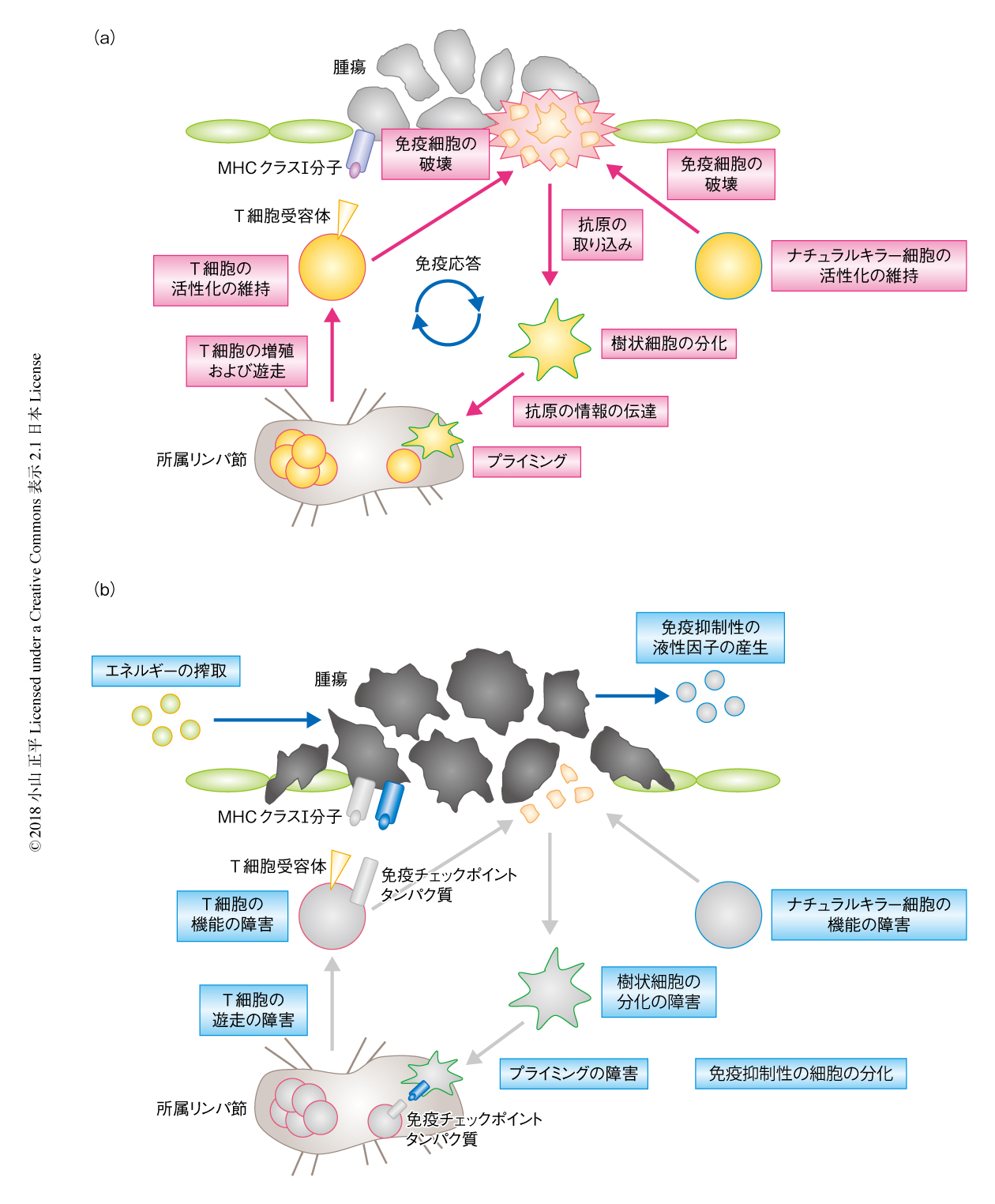
腫瘍細胞が増殖する過程においてはさまざまな遺伝子変異が蓄積する.変異によりもともと宿主には存在しないタンパク質が生じた場合は,免疫細胞,なかでもナチュラルキラー細胞など自然免疫系の免疫細胞に認識され破壊されると考えられる.その腫瘍細胞の破壊から得られた非自己としての抗原の情報は,おもに樹状細胞により取り込まれ,抗腫瘍細胞の発進基地となるリンパ節へと伝達される.リンパ節においては非自己の抗原に関する情報は樹状細胞からT細胞へと伝達され,その抗原を特異的に破壊できるようなT細胞が増殖し腫瘍へと攻め込んでいく.最終的に,腫瘍細胞と対峙したT細胞は腫瘍のもつ抗原の情報を認識し破壊する(図2a).このような免疫応答は,当初,腫瘍が小さいときにはうまく機能すると想定されるが,腫瘍細胞が徐々に増殖し,免疫を抑制するような液性因子の分泌,免疫抑制性の細胞の分化,エネルギーの搾取など,免疫を回避するさまざまな機構を獲得することにより,正常な免疫応答が破綻するという過程が想定される8)(図2b)
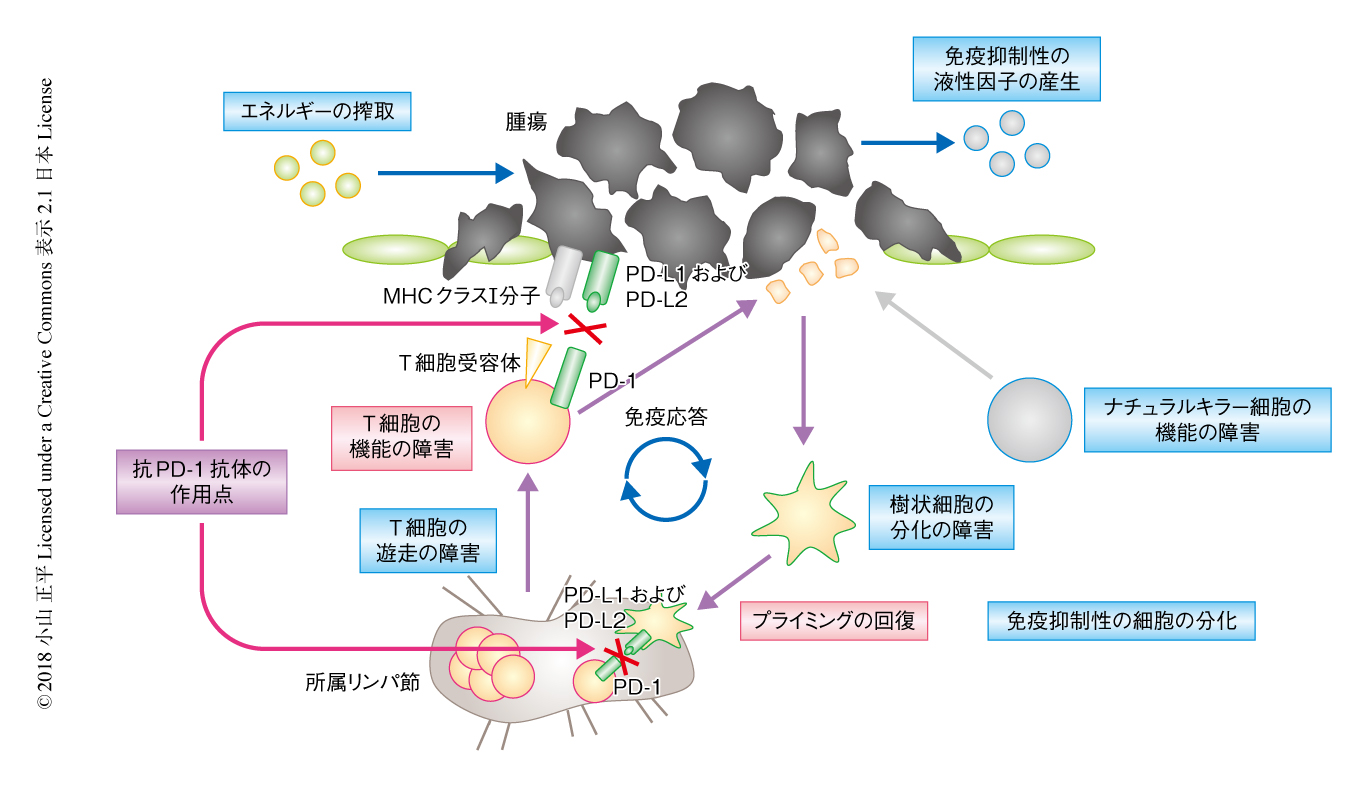
この免疫応答を構成する複数の過程において,T細胞の活性化を抑制する免疫チェックポイントタンパク質のうち,とくにPD-1とPD-L1あるいはPD-L2との相互作用を遮断することが免疫応答の機能の回復の根幹としてはたらくことが明らかにされた(図3).免疫チェックポイント阻害薬は大規模な臨床試験において有効性が示された最初のがん免疫療法ではあるものの,非小細胞肺がんに対しては全体の20~30%に効果が認められるのみであることから,免疫応答を構成する抗PD-1抗体の作用点のほかにも焦点をあてる必要がある.つまり,免疫チェックポイント阻害薬が効果を示さない免疫応答の回避の機構の部分が優位に機能しているようながん微小環境においては,抗PD-1抗体の単独による治療により効果を得るのはむずかしく,このような背景が初期耐性に関与する可能性が考えられる.
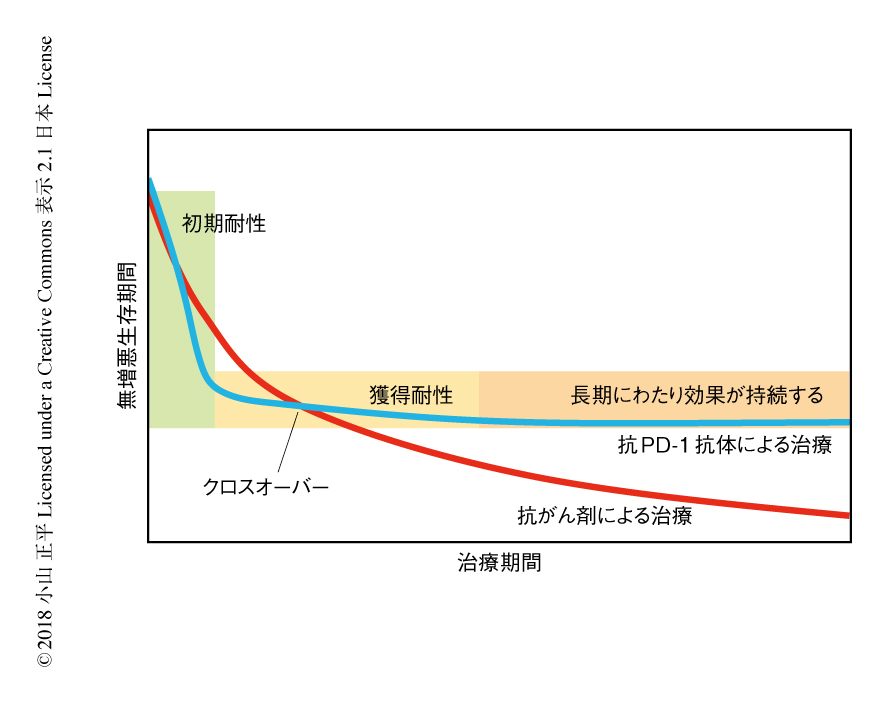
非小細胞肺がんに対する2次治療としての抗PD-1抗体の単独による治療は,臨床試験においては標準的な抗がん剤による治療と比較してより高い有効性が示されているものの,腫瘍がもとの大きさよりも大きくならない状態が維持される無増悪生存期間において,クロスオーバーという特徴的な生存曲線を示すケースも報告されている9)(図4).つまり,一部にがん免疫療法にまったく効果のない患者が存在し,一方で,抗がん剤による治療においては作用が弱くてもより満遍なく効果が現われるため,初期の段階では効果が逆転することがある.これは,最初にがん免疫療法を選択した患者は,抗がん剤による治療を選択した場合と比較して不利益をこうむることのある可能性を示しており,このような背景から,がん免疫療法に対する感受性あるいは非感受性をあらかじめみきわめられるようなバイオマーカーの必要性が強調された.これまで,複数の研究グループにより,がん免疫療法に感受性の高い患者を抽出するためのバイオマーカーとして,腫瘍細胞におけるPD-L1の発現10),腫瘍における遺伝子変異の量6),がん微小環境に遊走してくるリンパ球11),などの有用性が示されてきた.たとえば,PD-L1が高く発現し腫瘍における遺伝子変異の量が大きい非小細胞肺がんの患者に限定すると,抗PD-1抗体による奏功率が約75%まで上昇することが示された5).これらバイオマーカーの値がいずれも低い腫瘍に関しては,免疫細胞の抗腫瘍活性そのものが低い状況,つまり,もともと抗PD-1抗体に対し感受性を示さない初期耐性に関与することが示された.
これまで,腫瘍細胞の全エキソンシークエンスにもとづき腫瘍における遺伝子変異の量がプロファイリングされていたが5),最近の研究および臨床試験から,そのなかでも抗PD-1抗体に対する感受性にかかわる遺伝子を限定することが可能になり,ある特定の遺伝子変異に焦点をあてて抗PD-1抗体に対する感受性を予測することが可能になった12).その感受性遺伝子にはEGFR遺伝子やSKT11遺伝子などが含まれ,筆者らは,Stk11遺伝子の欠損型変異をもつKras肺がんモデルマウスを用いた解析により,がん免疫療法における感受性の低下の原因として,腫瘍へのリンパ球の遊走の低下,および,PD-L1の発現の低下が関与することを示した13).それ以外にも,宿主の免疫細胞の因子としてHLAクラスIの遺伝子型14) や腸内細菌のプロファイル15) が初期耐性に関与することや,腫瘍細胞の因子として腫瘍の線維化16) が感受性に関係することがあいついで明らかにされた.
一方で,初期には治療の効果を示していたにもかかわらず,同じ部位や別の組織に腫瘍の再増大を生じるケースも少なからずみられるようになった.このような治療の効果の消失の機序は獲得耐性と定義され,腫瘍細胞および宿主の免疫細胞においてある程度の時間をかけて生じる適応性の変化と,腫瘍細胞が新たな遺伝子変異を獲得してがん免疫療法に対しまったく感受性を示さなくなる変化の2種類に分けてとらえることができる17).これら抗PD-1抗体に対する獲得耐性は,長期の使用例の増加にもとづき実際の臨床においてもしばしば経験されるようになってきた.
抗PD-1抗体の長期の使用例が増加するなかで,当初は腫瘍細胞に対し抗PD-1抗体が効果を示したにもかかわらず,のちに腫瘍が再増大してくる症例がしばしば経験されるようになった.治療前および再増大時の腫瘍組織を採取し遺伝子プロファイルを比較することにより,腫瘍細胞が新たな遺伝子変異を獲得することにより抗PD-1抗体に対し耐性を獲得することが提唱された18).この研究においては,皮膚がんの患者のうち抗PD-1抗体が途中で効かなくなった症例において,抗PD-1抗体の使用前および獲得耐性が出現したのちの同一の部位の腫瘍組織を遺伝学的に比較し,JAK1/JAK2-STAT1シグナル伝達系あるいはβ2ミクログロブリンに新たに変異が生じた症例が提示された.これらの遺伝子変異により,腫瘍細胞においてもっとも大きく変化するのは抗原提示能である.非自己を認識した宿主の免疫応答により,とくにT細胞において産生されるインターフェロンγは,抗腫瘍活性の発現において中心的な役割をはたすだけでなく,腫瘍細胞におけるPD-L1やMHCクラスI分子の発現の誘導においても大きな原動力となる.抗PD-1抗体によりPD-L1により抑制されなくなったT細胞はインターフェロンγを産生する.通常は,この機構により標的となる腫瘍細胞において抗原提示を促進させより抗腫瘍効果が発揮しやすい環境が整えられるが,獲得耐性をひき起こすような遺伝子の変異をともなう腫瘍細胞においてはインターフェロンγからのシグナル伝達系がまったく機能しなくなることにより,腫瘍細胞それ自体の抗原提示能が障害され,T細胞が腫瘍細胞を認識できなくなる.また,さらなる解析の結果,抗PD-1抗体による治療のまえから,このようなインターフェロンγに関連するシグナル伝達系における遺伝子変異をde novo変異としてもつ腫瘍がまれに存在し,このような場合は抗PD-1抗体に対し初期耐性を示す19).また,同様の獲得耐性の機序は肺がんの患者においても観察された20).以上のように,獲得耐性の機序を解析することは,新たな初期耐性の機序を理解することにもつながることが示された.このようながんに対してはどのような治療が優先されるべきか,今後の重要な検討課題である.
抗PD-1抗体による治療の作用点は宿主のT細胞であり,腫瘍細胞だけでなく,宿主の免疫細胞の側の要因でも耐性の生じる可能性が示唆された.筆者らは,腫瘍による獲得耐性が報告される以前に,T細胞における内因性の因子の変化により抗PD-1抗体による治療の効果が失われ腫瘍が再増大する症例について報告した21).T細胞の表面には複数の免疫チェックポイントタンパク質が存在し,活性化したT細胞においてはPD-1のほかにもCTLA-4,TIM-3,LAG3などが発現することが知られている.肺がんモデルマウスにおいて,当初,抗PD-1抗体に感受性を示した腫瘍が再増大してくる現象に着目し,治療していない腫瘍のT細胞と獲得耐性を示した腫瘍のT細胞とを比較したところ,PD-1のほかの複数の免疫チェックポイントタンパク質の発現が有意に上昇していた.とくにTIM-3の発現が上昇しており,獲得耐性が生じた時点で抗TIM-3抗体の併用を開始すると,一時的にではあるがふたたび治療の効果が認められた21).このように,抗PD-1抗体の長期の使用により,治療前には不活性化あるいは細胞死を起こしていたT細胞がより長く生存し,その一部はより活性化あるいはより疲弊した状態で検出されたことから,さまざまな免疫チェックポイントタンパク質の発現は亢進する.PD-1のほかの免疫チェックポイントタンパク質のリガンドはがん微小環境においては一般的に検出されるものが多いため,抗PD-1抗体が結合したT細胞においてもそれらにより容易に抑制されることが推測された.
このように,腫瘍細胞とは独立してT細胞のプロファイルが徐々に変化することによりPD-1の阻害の効果が減弱する過程が獲得耐性に寄与していたことから,このような獲得耐性を適応性の耐性と名づけた17,21).長期にわたる抗PD-1抗体の使用ののちに再発した患者2例より心嚢水および胸水を回収し,それらに存在するT細胞を確認したところ,抗PD-1抗体がまだ結合しているT細胞にTIM-3が高く発現していた.また,TIM-3のリガンドとして知られているガレクチン9の体腔液における濃度は,抗PD-1抗体により治療されていない患者の胸水と比較して顕著に高くなっていた.ガレクチン9もPD-L1やMHCクラスI分子と同様にインターフェロンγシグナル伝達系により発現が誘導されることが知られており22),活性化したT細胞のもつブレーキ系そのものががん免疫療法においては獲得耐性に寄与する可能性が示唆された.筆者らの研究につづき,このようなT細胞の内因性の獲得耐性の機序がより多くの症例において示されている20).
非小細胞肺がんをはじめとするさまざまながんに対し抗PD-1抗体を代表とする免疫チェックポイント阻害薬の有効性が報告され,とくに長期にわたる使用例の増加にともない,今後,耐性の獲得に遭遇するケースがますます多くなると予測される.従来型の抗がん剤やキナーゼ阻害薬と同様に,がん免疫療法においてもしばらく治療をしているうちに,いわゆる獲得耐性が生じる.さらに,獲得耐性としては,腫瘍細胞が新たな遺伝子変異を獲得する機序と,宿主の免疫細胞がPD-1のほかの免疫チェックポイントタンパク質の発現の上昇により抑制される機序が報告されている.獲得耐性にかかわる機序はほかにも存在する可能性がある.がん免疫療法の特性として,腫瘍細胞の遺伝子変異だけに着目するのではなく,免疫応答を構成する宿主のさまざまな免疫細胞に着目する必要があるだろう.このようながん免疫療法における耐性の獲得の機序を理解し克服することにより,より治療効果の高いがん免疫療法の開発がもとめられる.
略歴:2009年 東北大学大学院医学系研究科博士課程 修了,2010年 米国Dana-Farber Cancer Institute研究員,2015年 大阪大学免疫学フロンティア研究センター 特任助教を経て,2018年より大阪大学大学院医学系研究科 助教.
研究テーマ:肺がんの微小環境,がん免疫療法,気道免疫.
© 2018 小山 正平 Licensed under CC 表示 2.1 日本
(大阪大学大学院医学系研究科 呼吸器・免疫内科学)
email:小山正平
領域融合レビュー, 7, e004 (2018) DOI: 10.7875/leading.author.7.e004
Shohei Koyama: Adaptive and acquired resistance to cancer immunotherapies.
要 約
2012年に各種の固形がんに対する抗PD-1抗体および抗PD-L1抗体の有効性が報告されて以来,わが国においても,悪性黒色腫や肺がんをはじめとしたさまざまながんに対し免疫チェックポイント阻害薬によるがん免疫療法が標準的な治療法のひとつとして用いられるようになった.実際に免疫チェックポイント阻害薬により治療される患者の増加にともない,これらのがん免疫療法に対しもともと奏功の得られない症例だけでなく,当初は奏功が得られていたにもかかわらず腫瘍が再増大する症例の存在が明らかにされた.しかしながら,これらがん免疫療法に対する耐性がどのような機序により生じるのかについてはいまだ不明な点が多い.筆者らは,非小細胞肺がんに対する抗PD-1抗体によるがん免疫療法において長期の治療ののち耐性が生じた症例の解析から,T細胞におけるPD-1以外の免疫チェックポイントタンパク質の発現の上昇にともないT細胞が抑制される代償的な機序について明らかにした.このレビューにおいては,おもに抗PD-1抗体によるがん免疫療法において生じる耐性,とくに獲得耐性に焦点をあて,その原因となる腫瘍細胞の因子および宿主の免疫細胞の因子の両方の側面から,その機序について解説する.
はじめに
2000年代初頭からのヒトにおけるがんのゲノム解析の進歩により,特定の遺伝子に生じた変異によるシグナルの異常な活性化を特異的に抑制するような治療薬の開発が進み,キナーゼ阻害薬として各種の悪性腫瘍に対し有効性を示すことが明らかにされ,ゲノム医療による最初のブレイクスルーとなった.肺がんは組織学的に神経内分泌細胞に由来する小細胞がんとそれ以外の非小細胞肺がんとに分類されるが,非小細胞肺がん,なかでも,もっとも頻度の高い腺がんにおいてEGFR遺伝子,ALK遺伝子,ROS1遺伝子といったがん遺伝子にて特定の部位の変異や遺伝子どうしの融合などからシグナルの異常な活性化が生じることが明らかにされた.これらの遺伝子変異は肺がんの増殖におけるキープレーヤーとして機能することからドライバー変異とよばれるが,それぞれの遺伝子変異によるシグナルの異常な活性化を特異的に阻害するキナーゼ阻害薬が開発された.これらの特徴的な遺伝子変異をもつ患者においては,それまでもっとも治療の効果が高いとされてきた抗がん剤併用療法と比較して,これらのキナーゼ阻害薬が非常に高い奏功率をもたらすことが示され,ドライバー変異をもつ肺がんの患者の予後を飛躍的に改善することに成功した1).
その一方,新たな課題として,病原微生物が抗生物質の長期にわたる使用により耐性を獲得するのと同じように,肺がん細胞もドライバー変異を標的としたキナーゼ阻害薬に対し多くは半年から1年で耐性を獲得することが明らかにされた.おもにゲノム解析にもとづく研究により,耐性の機序の一部は2次的な遺伝子変異の獲得という一定のパターンを示すこともわかった2).耐性の獲得という課題はあるものの,キナーゼ阻害薬はドライバー変異をもつ患者に対し非常に高い有効性を示すことから,現在では,肺がんの治療において非常に大きな役割を担っている.しかし,特定のドライバー変異をもたない患者に対する有効性は乏しく,このような患者に対しても,これまでの標準的な抗がん剤による治療を凌駕するような新たな治療法の開発が望まれていた.そこに登場したのが,免疫チェックポイント阻害薬に代表されるがん免疫療法である3,4).
わが国において,非小細胞肺がんに対し最初に使用が可能になった免疫チェックポイント阻害薬が抗PD-1抗体である.その治療の効果は,ドライバー変異をもつ患者よりむしろもたない患者において高く,のちの研究により,その理由は腫瘍における遺伝子変異の量(tumor mutation burden:TMB)によることが明らかにされ,ドライバー変異をもつ患者に比べ,ドライバー変異をもたない患者においては遺伝子変異の量がより多いことがおもに関与した5,6).遺伝子変異の量には喫煙が大きく寄与しており,喫煙歴の差がそのまま遺伝子変異の量および抗PD-1抗体による奏功率の差に影響する可能性が示され5),喫煙者に効きやすい治療であることが示された.そののち,喫煙や遺伝子変異の量のほかにも,抗PD-1抗体に対する感受性あるいは非感受性にかかわるさまざまな因子が報告された.
免疫チェックポイント阻害薬に関するもうひとつの特徴として,治療が奏功した場合,その治療の効果が抗がん剤やキナーゼ阻害薬よりも長期にわたり持続することがある7).一方,がん免疫療法により長期にわたり治療された症例の蓄積にともない,筆者らを含む複数の研究グループにより,比較的長期にわたり奏功していたにもかかわらず,キナーゼ阻害薬において認められるような耐性の獲得が免疫チェックポイント阻害薬においても少なからず生じうることが明らかにされた.これまでのゲノム研究の進歩にもとづくキナーゼ阻害薬の開発およびその耐性の獲得の機序の解明といった背景から,がん免疫療法における耐性の獲得の機序についても腫瘍細胞のゲノム解析からのアプローチが進められたが,これまでの治療法とは異なり,がん免疫療法の標的は宿主の免疫細胞であるため,免疫細胞の状態を時間の経過で追跡することも耐性の獲得の機序の解明には重要であることが示唆された.
以上のような背景から,このレビューにおいては,おもに非小細胞肺がんに対する抗PD-1抗体によるがん免疫療法における耐性の獲得の機序に焦点をあて,最近,明らかにされた知見について解説する.
なお,がん免疫療法については,杉山大介・西川博嘉, 領域融合レビュー, 4, e005 (2015) も参照されたい.
1.免疫チェックポイントタンパク質およびその阻害
腫瘍細胞の破壊に機能し,また,免疫チェックポイント阻害薬の標的になるキープレーヤーがT細胞である.T細胞は,本来は生体には存在せず腫瘍細胞のみに出現した異常な非自己タンパク質を特異的に認識し,活性化して標的となる腫瘍細胞を破壊する.その過程で最初に必要となるのが,異常なタンパク質の情報を伝達する側の細胞膜にある主要組織適合遺伝子複合体(major histocompatibility complex:MHC)と,T細胞にある受容体との相互作用である.実際に,生体のあらゆる細胞がMHCを発現することにより異常なタンパク質の情報を伝達する能力をもつが,その伝達のエキスパートである細胞が樹状細胞やマクロファージなどの抗原提示細胞である.抗原提示細胞は異常なタンパク質の情報を分解しペプチドの断片としてT細胞に伝達すると同時に,T細胞にあるCD28を刺激するCD80やCD86といったタンパク質を発現し,情報を伝達したT細胞を活性化する.これらは共刺激タンパク質とよばれ,T細胞に活性化にアクセルをかける作用をもつ.一方,T細胞には活性化をちょうどよく停止するようブレーキをかける作用をもつタンパク質も同時に発現する.これらのT細胞を活性化もしくは抑制するタンパク質を総称して免疫チェックポイントタンパク質とよぶ(図1).
腫瘍において問題になるのが,抗原提示細胞や腫瘍細胞がT細胞の活性化を抑制する免疫チェックポイントタンパク質に必要以上に作用することにより,T細胞による腫瘍細胞の破壊が十分にできなくことである.この過剰なブレーキを遮断するのが免疫チェックポイント阻害薬で,とくに,抗PD-1抗体は抗原提示細胞や腫瘍細胞に発現したPD-L1あるいはPD-L2とT細胞における活性化の抑制に中心的な存在であるPD-1との相互作用を遮断し,T細胞の活性化が抑制されないようにする作用をもつ.
2.がん微小環境における宿主の免疫細胞による監視と腫瘍細胞による免疫の回避
腫瘍細胞が増殖する過程においてはさまざまな遺伝子変異が蓄積する.変異によりもともと宿主には存在しないタンパク質が生じた場合は,免疫細胞,なかでもナチュラルキラー細胞など自然免疫系の免疫細胞に認識され破壊されると考えられる.その腫瘍細胞の破壊から得られた非自己としての抗原の情報は,おもに樹状細胞により取り込まれ,抗腫瘍細胞の発進基地となるリンパ節へと伝達される.リンパ節においては非自己の抗原に関する情報は樹状細胞からT細胞へと伝達され,その抗原を特異的に破壊できるようなT細胞が増殖し腫瘍へと攻め込んでいく.最終的に,腫瘍細胞と対峙したT細胞は腫瘍のもつ抗原の情報を認識し破壊する(図2a).このような免疫応答は,当初,腫瘍が小さいときにはうまく機能すると想定されるが,腫瘍細胞が徐々に増殖し,免疫を抑制するような液性因子の分泌,免疫抑制性の細胞の分化,エネルギーの搾取など,免疫を回避するさまざまな機構を獲得することにより,正常な免疫応答が破綻するという過程が想定される8)(図2b)
この免疫応答を構成する複数の過程において,T細胞の活性化を抑制する免疫チェックポイントタンパク質のうち,とくにPD-1とPD-L1あるいはPD-L2との相互作用を遮断することが免疫応答の機能の回復の根幹としてはたらくことが明らかにされた(図3).免疫チェックポイント阻害薬は大規模な臨床試験において有効性が示された最初のがん免疫療法ではあるものの,非小細胞肺がんに対しては全体の20~30%に効果が認められるのみであることから,免疫応答を構成する抗PD-1抗体の作用点のほかにも焦点をあてる必要がある.つまり,免疫チェックポイント阻害薬が効果を示さない免疫応答の回避の機構の部分が優位に機能しているようながん微小環境においては,抗PD-1抗体の単独による治療により効果を得るのはむずかしく,このような背景が初期耐性に関与する可能性が考えられる.
3.抗PD-1抗体あるいは抗PD-L1抗体による治療に対する初期耐性および獲得耐性
非小細胞肺がんに対する2次治療としての抗PD-1抗体の単独による治療は,臨床試験においては標準的な抗がん剤による治療と比較してより高い有効性が示されているものの,腫瘍がもとの大きさよりも大きくならない状態が維持される無増悪生存期間において,クロスオーバーという特徴的な生存曲線を示すケースも報告されている9)(図4).つまり,一部にがん免疫療法にまったく効果のない患者が存在し,一方で,抗がん剤による治療においては作用が弱くてもより満遍なく効果が現われるため,初期の段階では効果が逆転することがある.これは,最初にがん免疫療法を選択した患者は,抗がん剤による治療を選択した場合と比較して不利益をこうむることのある可能性を示しており,このような背景から,がん免疫療法に対する感受性あるいは非感受性をあらかじめみきわめられるようなバイオマーカーの必要性が強調された.これまで,複数の研究グループにより,がん免疫療法に感受性の高い患者を抽出するためのバイオマーカーとして,腫瘍細胞におけるPD-L1の発現10),腫瘍における遺伝子変異の量6),がん微小環境に遊走してくるリンパ球11),などの有用性が示されてきた.たとえば,PD-L1が高く発現し腫瘍における遺伝子変異の量が大きい非小細胞肺がんの患者に限定すると,抗PD-1抗体による奏功率が約75%まで上昇することが示された5).これらバイオマーカーの値がいずれも低い腫瘍に関しては,免疫細胞の抗腫瘍活性そのものが低い状況,つまり,もともと抗PD-1抗体に対し感受性を示さない初期耐性に関与することが示された.
これまで,腫瘍細胞の全エキソンシークエンスにもとづき腫瘍における遺伝子変異の量がプロファイリングされていたが5),最近の研究および臨床試験から,そのなかでも抗PD-1抗体に対する感受性にかかわる遺伝子を限定することが可能になり,ある特定の遺伝子変異に焦点をあてて抗PD-1抗体に対する感受性を予測することが可能になった12).その感受性遺伝子にはEGFR遺伝子やSKT11遺伝子などが含まれ,筆者らは,Stk11遺伝子の欠損型変異をもつKras肺がんモデルマウスを用いた解析により,がん免疫療法における感受性の低下の原因として,腫瘍へのリンパ球の遊走の低下,および,PD-L1の発現の低下が関与することを示した13).それ以外にも,宿主の免疫細胞の因子としてHLAクラスIの遺伝子型14) や腸内細菌のプロファイル15) が初期耐性に関与することや,腫瘍細胞の因子として腫瘍の線維化16) が感受性に関係することがあいついで明らかにされた.
一方で,初期には治療の効果を示していたにもかかわらず,同じ部位や別の組織に腫瘍の再増大を生じるケースも少なからずみられるようになった.このような治療の効果の消失の機序は獲得耐性と定義され,腫瘍細胞および宿主の免疫細胞においてある程度の時間をかけて生じる適応性の変化と,腫瘍細胞が新たな遺伝子変異を獲得してがん免疫療法に対しまったく感受性を示さなくなる変化の2種類に分けてとらえることができる17).これら抗PD-1抗体に対する獲得耐性は,長期の使用例の増加にもとづき実際の臨床においてもしばしば経験されるようになってきた.
4.腫瘍細胞における遺伝子変異の獲得にともなう獲得耐性
抗PD-1抗体の長期の使用例が増加するなかで,当初は腫瘍細胞に対し抗PD-1抗体が効果を示したにもかかわらず,のちに腫瘍が再増大してくる症例がしばしば経験されるようになった.治療前および再増大時の腫瘍組織を採取し遺伝子プロファイルを比較することにより,腫瘍細胞が新たな遺伝子変異を獲得することにより抗PD-1抗体に対し耐性を獲得することが提唱された18).この研究においては,皮膚がんの患者のうち抗PD-1抗体が途中で効かなくなった症例において,抗PD-1抗体の使用前および獲得耐性が出現したのちの同一の部位の腫瘍組織を遺伝学的に比較し,JAK1/JAK2-STAT1シグナル伝達系あるいはβ2ミクログロブリンに新たに変異が生じた症例が提示された.これらの遺伝子変異により,腫瘍細胞においてもっとも大きく変化するのは抗原提示能である.非自己を認識した宿主の免疫応答により,とくにT細胞において産生されるインターフェロンγは,抗腫瘍活性の発現において中心的な役割をはたすだけでなく,腫瘍細胞におけるPD-L1やMHCクラスI分子の発現の誘導においても大きな原動力となる.抗PD-1抗体によりPD-L1により抑制されなくなったT細胞はインターフェロンγを産生する.通常は,この機構により標的となる腫瘍細胞において抗原提示を促進させより抗腫瘍効果が発揮しやすい環境が整えられるが,獲得耐性をひき起こすような遺伝子の変異をともなう腫瘍細胞においてはインターフェロンγからのシグナル伝達系がまったく機能しなくなることにより,腫瘍細胞それ自体の抗原提示能が障害され,T細胞が腫瘍細胞を認識できなくなる.また,さらなる解析の結果,抗PD-1抗体による治療のまえから,このようなインターフェロンγに関連するシグナル伝達系における遺伝子変異をde novo変異としてもつ腫瘍がまれに存在し,このような場合は抗PD-1抗体に対し初期耐性を示す19).また,同様の獲得耐性の機序は肺がんの患者においても観察された20).以上のように,獲得耐性の機序を解析することは,新たな初期耐性の機序を理解することにもつながることが示された.このようながんに対してはどのような治療が優先されるべきか,今後の重要な検討課題である.
5.免疫細胞の変化にともなう獲得耐性
抗PD-1抗体による治療の作用点は宿主のT細胞であり,腫瘍細胞だけでなく,宿主の免疫細胞の側の要因でも耐性の生じる可能性が示唆された.筆者らは,腫瘍による獲得耐性が報告される以前に,T細胞における内因性の因子の変化により抗PD-1抗体による治療の効果が失われ腫瘍が再増大する症例について報告した21).T細胞の表面には複数の免疫チェックポイントタンパク質が存在し,活性化したT細胞においてはPD-1のほかにもCTLA-4,TIM-3,LAG3などが発現することが知られている.肺がんモデルマウスにおいて,当初,抗PD-1抗体に感受性を示した腫瘍が再増大してくる現象に着目し,治療していない腫瘍のT細胞と獲得耐性を示した腫瘍のT細胞とを比較したところ,PD-1のほかの複数の免疫チェックポイントタンパク質の発現が有意に上昇していた.とくにTIM-3の発現が上昇しており,獲得耐性が生じた時点で抗TIM-3抗体の併用を開始すると,一時的にではあるがふたたび治療の効果が認められた21).このように,抗PD-1抗体の長期の使用により,治療前には不活性化あるいは細胞死を起こしていたT細胞がより長く生存し,その一部はより活性化あるいはより疲弊した状態で検出されたことから,さまざまな免疫チェックポイントタンパク質の発現は亢進する.PD-1のほかの免疫チェックポイントタンパク質のリガンドはがん微小環境においては一般的に検出されるものが多いため,抗PD-1抗体が結合したT細胞においてもそれらにより容易に抑制されることが推測された.
このように,腫瘍細胞とは独立してT細胞のプロファイルが徐々に変化することによりPD-1の阻害の効果が減弱する過程が獲得耐性に寄与していたことから,このような獲得耐性を適応性の耐性と名づけた17,21).長期にわたる抗PD-1抗体の使用ののちに再発した患者2例より心嚢水および胸水を回収し,それらに存在するT細胞を確認したところ,抗PD-1抗体がまだ結合しているT細胞にTIM-3が高く発現していた.また,TIM-3のリガンドとして知られているガレクチン9の体腔液における濃度は,抗PD-1抗体により治療されていない患者の胸水と比較して顕著に高くなっていた.ガレクチン9もPD-L1やMHCクラスI分子と同様にインターフェロンγシグナル伝達系により発現が誘導されることが知られており22),活性化したT細胞のもつブレーキ系そのものががん免疫療法においては獲得耐性に寄与する可能性が示唆された.筆者らの研究につづき,このようなT細胞の内因性の獲得耐性の機序がより多くの症例において示されている20).
おわりに
非小細胞肺がんをはじめとするさまざまながんに対し抗PD-1抗体を代表とする免疫チェックポイント阻害薬の有効性が報告され,とくに長期にわたる使用例の増加にともない,今後,耐性の獲得に遭遇するケースがますます多くなると予測される.従来型の抗がん剤やキナーゼ阻害薬と同様に,がん免疫療法においてもしばらく治療をしているうちに,いわゆる獲得耐性が生じる.さらに,獲得耐性としては,腫瘍細胞が新たな遺伝子変異を獲得する機序と,宿主の免疫細胞がPD-1のほかの免疫チェックポイントタンパク質の発現の上昇により抑制される機序が報告されている.獲得耐性にかかわる機序はほかにも存在する可能性がある.がん免疫療法の特性として,腫瘍細胞の遺伝子変異だけに着目するのではなく,免疫応答を構成する宿主のさまざまな免疫細胞に着目する必要があるだろう.このようながん免疫療法における耐性の獲得の機序を理解し克服することにより,より治療効果の高いがん免疫療法の開発がもとめられる.
文 献
- Pao, W. & Chmielecki, J.: Rational, biologically based treatment of EGFR-mutant non-small-cell lung cancer. Nat. Rev. Cancer, 10, 760-774 (2010)[PubMed]
- Piotrowska, Z. & Sequist. L. V.: Treatment of EGFR-mutant lung cancers after progression in patients receiving first-line EGFR tyrosine kinase inhibitors. JAMA Oncol., 2, 948-954 (2016)[PubMed]
- Brahmer, J. R., Tykodi, S. S., Chow, L. Q. et al.: Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N. Engl. J. Med., 366, 2455-2465 (2012)[PubMed]
- Topalian, S. L., Hodi, F. S., Brahmer, J. R. et al.: Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N. Engl. J. Med., 366, 2443-2454 (2012)[PubMed]
- Carbone, D. P., Reck, M., Paz-Ares, L. et al.: First-line nivolumab in stage IV or recurrent non-small-cell lung cancer. N. Engl. J. Med., 376, 2415-2426 (2017)[PubMed]
- Rizvi, N. A., Hellmann, M. D., Snyder, A. et al.: Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer. Science, 348, 124-128 (2015)[PubMed]
- Gettinger, S., Horn, L., Jackman, D. et al.: Five-year follow-up of nivolumab in previously treated Aadvanced non-small-cell lung cancer: results from the CA209-003 study. J. Clin. Oncol., DOI: 10.1200/JCO.2017.77.0412[PubMed]
- Chen, D. S. & Mellman, I.: Elements of cancer immunity and the cancer-immune set point. Nature, 541, 321-330 (2017)[PubMed]
- Borghaei, H., Paz-Ares, L., Horn, L. et al.: Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N. Engl. J. Med., 373, 1627-1639 (2015)[PubMed]
- Reck, M., Rodriguez-Abreu, D., Robinson, A. G. et al.: Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N. Engl. J. Med., 375, 1823-1833 (2016)[PubMed]
- Tumeh, P. C., Harview, C. L., Yearley, J. H. et al.: PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature, 515, 568-571 (2014)[PubMed]
- Rizvi, H., Sanchez-Vega, F., La, K. et al.: Molecular determinants of response to anti-programmed cell death (PD)-1 and anti-programmed death-ligand 1 (PD-L1) blockade in patients with non-small-cell lung cancer profiled with targeted next-generation sequencing. J. Clin. Oncol., 36, 633-641 (2018)[PubMed]
- Koyama, S., Akbay, E. A., Li, Y. Y. et al.: STK11/LKB1 deficiency promotes neutrophil recruitment and proinflammatory cytokine production to suppress T-cell activity in the lung tumor microenvironment. Cancer Res., 76, 999-1008 (2016)[PubMed]
- Chowell, D., Morris, L. G. T., Grigg, C. M. et al.: Patient HLA class I genotype influences cancer response to checkpoint blockade immunotherapy. Science, 359, 582-587 (2018)[PubMed]
- Routy, B., Le Chatelier, E., Derosa, L. et al.: Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science, 359, 91-97 (2018)[PubMed]
- Mariathasan, S., Turley, S. J., Nickles, D. et al.: TGFβ attenuates tumour response to PD-L1 blockade by contributing to exclusion of T cells. Nature, 554, 544-548 (2018)[PubMed]
- Sharma, P., Hu-Lieskovan, S., Wargo, J. A. et al.: Primary, adaptive, and acquired resistance to cancer immunotherapy. Cell, 168, 707-723 (2017)[PubMed]
- Zaretsky, J. M., Garcia-Diaz, A., Shin, D. S. et al.: Mutations associated with acquired resistance to PD-1 blockade in melanoma. N. Engl. J. Med., 375, 819-829 (2016)[PubMed]
- Shin, D. S., Zaretsky, J. M., Escuin-Ordinas, H. et al.: Primary resistance to PD-1 blockade mediated by JAK1/2 mutations. Cancer Discov., 7, 188-201 (2017)[PubMed]
- Gettinger, S., Choi, J., Hastings, K. et al.: Impaired HLA class I antigen processing and presentation as a mechanism of acquired resistance to immune checkpoint inhibitors in lung cancer. Cancer Discov., 7, 1420-1435 (2017)[PubMed]
- Koyama, S., Akbay, E. A., Li, Y. Y. et al.: Adaptive resistance to therapeutic PD-1 blockade is associated with upregulation of alternative immune checkpoints. Nat. Commun., 7, 10501 (2016)[PubMed]
- Imaizumi, T., Kumagai, M., Sasaki, N. et al.: Interferon-γ stimulates the expression of galectin-9 in cultured human endothelial cells. J. Leukoc. Biol., 72, 486-491 (2002)[PubMed]
著者プロフィール
略歴:2009年 東北大学大学院医学系研究科博士課程 修了,2010年 米国Dana-Farber Cancer Institute研究員,2015年 大阪大学免疫学フロンティア研究センター 特任助教を経て,2018年より大阪大学大学院医学系研究科 助教.
研究テーマ:肺がんの微小環境,がん免疫療法,気道免疫.
© 2018 小山 正平 Licensed under CC 表示 2.1 日本