T細胞の老化と免疫老化
2018/07/18
濵﨑洋子1・湊 長博2
(1京都大学iPS細胞研究所 未来生命科学開拓部門,2京都大学大学院医学研究科 メディカルイノベーションセンター)
email:濵﨑洋子
領域融合レビュー, 7, e005 (2018) DOI: 10.7875/leading.author.7.e005
Yoko Hamazaki & Nagahiro Minato: T cell aging and immunosenescence.

近年,さまざまな加齢関連疾患の発症や病態の形成に免疫老化が重要な役割をはたすことが明らかにされてきている.免疫老化とは,免疫系の加齢にともなう変化の特徴を包括して表現した用語であり,おおむね,獲得免疫応答能の低下,炎症性素因の増大,自己免疫リスクの増大,という3つの兆候により特徴づけられる.すなわち,感染源から身体を防御しそれらを排除する正常な免疫応答が低下する一方,慢性炎症や自己免疫応答が亢進するという,二面性をもつことに特徴がある.加齢によりあらゆる免疫細胞が質的および機能的に変化をきたすが,T細胞を産生する胸腺の機能は早期に低下することから,加齢による変化はT細胞がもっとも大きいとされる.このレビューにおいては,胸腺の退縮とそれにともなう末梢のT細胞の質的および集団的な変化の実態と機序に関する知見を紹介し,多くの免疫細胞の機能に影響するT細胞の加齢による変化が免疫老化にはたす意義,そして,免疫老化の制御およびその克服の可能性について議論する.
免疫系は自己の成分と非自己成分とを識別し,細菌やウイルスなどの感染性の微生物の感染防御およびその排除に必須である.理論上,無限の応答性をもつリンパ球を体内に配置し,感染ののちにはメモリー細胞を残すことにより免疫系は成熟をとげる.しかしながら,加齢にともないその機能は徐々に低下し,その一方で,慢性炎症や自己免疫応答が亢進することにより,代謝性疾患,がん,自己免疫疾患など,いわゆる加齢関連疾患が増加する.こうした免疫系の加齢にともなう機能的な変容は“免疫老化”と総称され,とくに,抗原特異性および免疫記憶を特徴とする獲得免疫系の変化が顕著であるとされるが,その分子細胞生物学的な基盤についてはよくわかっていない.このレビューにおいては,免疫細胞のなかでもっとも加齢の影響をうけるとされるT細胞の加齢による変化および老化について,筆者らの最近の研究も含め解説し,免疫老化の原因および実態の理解,そして,さまざまな加齢関連疾患との関連および制御の可能性について議論する.
すべての系列の免疫細胞において加齢にともなう数的あるいは質的な変化は起こるが,リンパ球(T細胞およびB細胞)がかかわり抗原特異性および免疫記憶の形成を特徴とする獲得免疫系の変化がとくに顕著であるといわれる.その主たる原因のひとつは,免疫系の司令塔としてはたらくT細胞を産生する胸腺が,個体の生涯において比較的早期からサイズが小さくなり機能が低下,すなわち,退縮することにある.
これまでの研究から,胸腺の退縮の原因はおもにT細胞の産生における主要な胸腺ストロマ細胞である胸腺上皮細胞の変化に起因すると考えられており,ヒトでは1歳をすぎるころからすでに加齢による変化がはじまるとさえいわれる.70歳代であってもヒトの胸腺は新たなT細胞の産生能をもつことを示唆するエビデンスがある一方,40歳代で産生される新たなT細胞は新生児期の1/100以下に低下するといわれている.重要な免疫細胞を産生する組織の機能が早々に低下するのは不可思議な現象ともいえるが,胸腺の早期の退縮は種をこえた現象であるため,個体にとりなんらかのアドバンテージをもつ可能性も指摘されている.胸腺におけるT細胞の産生の過程においては,のちに述べる正の選択および負の選択の過程をへてT細胞に分化するのはほんの5%程度であり,獲得免疫系はメモリー細胞を残すことによりいちど感染した微生物を効率的に排除しうることを考えると,生涯にわたり新たなナイーブT細胞の産生を維持することはエネルギー効率の点から好ましくないだけでなく,そもそも,さほど必要がないのかもしれない1,2).
他方,胸腺の退縮に成長ホルモンや性ホルモンが関与しうることは古くから知られている3).このことは,発生の後期から生後の早期においてT細胞の産生に費やしたコストを,個体の成長や性成熟にともない別の生体系に使うのではないかという魅力的なモデルの根拠になっている.実際に,ヒトの前立腺がんに対するアンドロゲン除去療法により末梢のT細胞が増加するとの報告もなされている4).しかし一方で,去勢により性ホルモンを除去したマウスにおける胸腺の肥大は一過性であること,また,加齢にともない性ホルモンが低下しても胸腺の活動は回復しないことから,性ホルモン以外の作用機序の存在も強く示唆され,依然として胸腺の退縮の機構の全容は明らかではない.
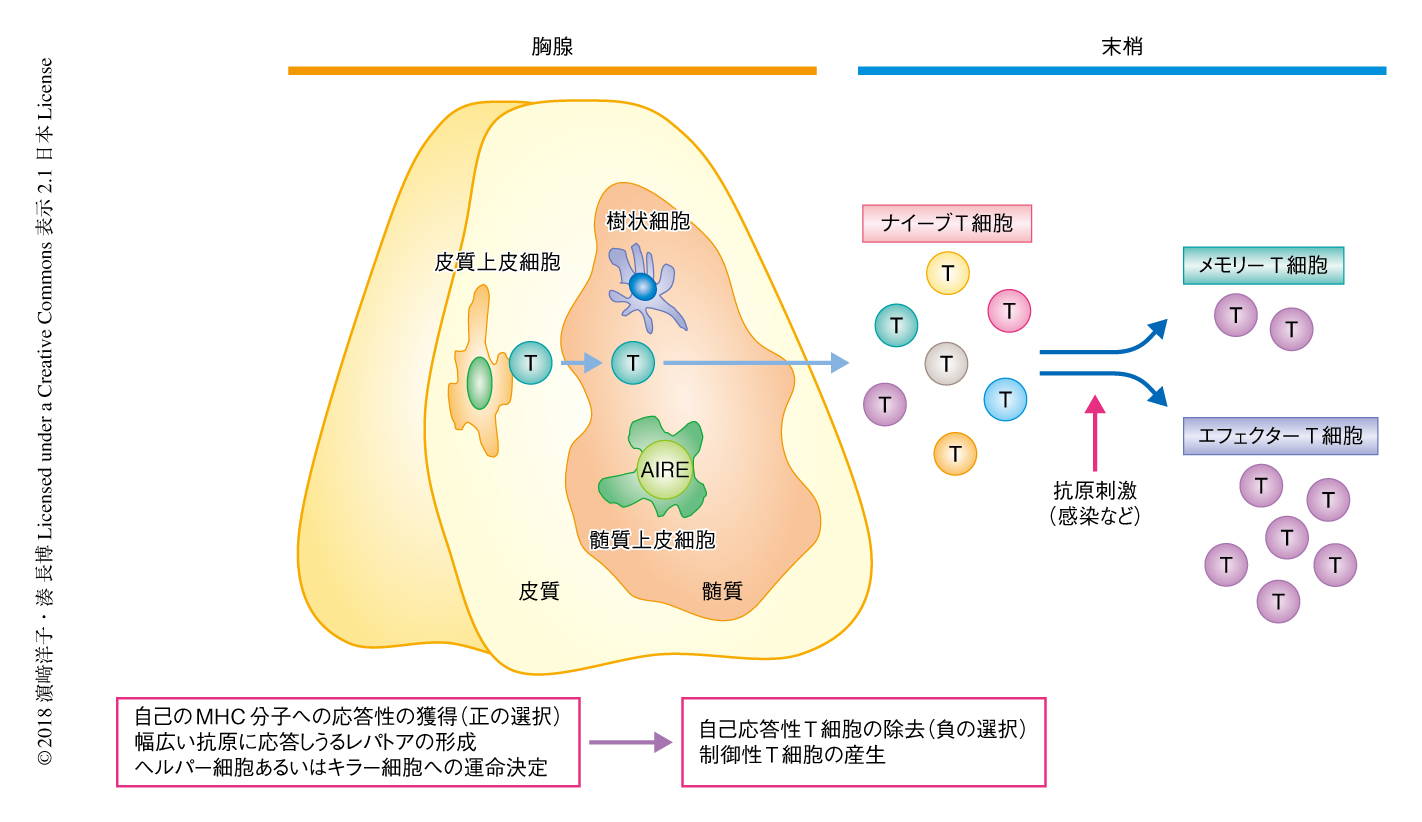
胸腺は皮質と髄質の2つの領域からなり,皮質上皮細胞は自己のMHC分子への応答性の獲得(正の選択),幅広い抗原に応答しうるレパトアの形成,ヘルパーT細胞あるいはキラーT細胞への運命決定をおもに担う.髄質においては,髄質上皮細胞と樹状細胞とが協調して自己応答性のT細胞の除去(負の選択)および免疫応答を負に制御する制御性T細胞の産生が起こり,自己を攻撃しない自己寛容の成立を可能にする(図1).髄質上皮細胞は,インスリンなど本来は胸腺に存在しないさまざまな組織抗原を攻撃してはならない自己の成分としてT細胞に提示するというきわめてユニークな性質をもつが,これは,ヒトの自己免疫性多内分泌腺症候群1型の原因遺伝子産物として同定された核タンパク質AIREのはたらきによるものであり,この系の破綻が自己免疫疾患をひき起こすことが1997年に明らかにされた.この発見以降,胸腺ストロマ細胞の重要性があらためて認識され,胸腺ストロマ細胞の発生および機能の分化に関する研究がここ20年で飛躍的に進んだ5).
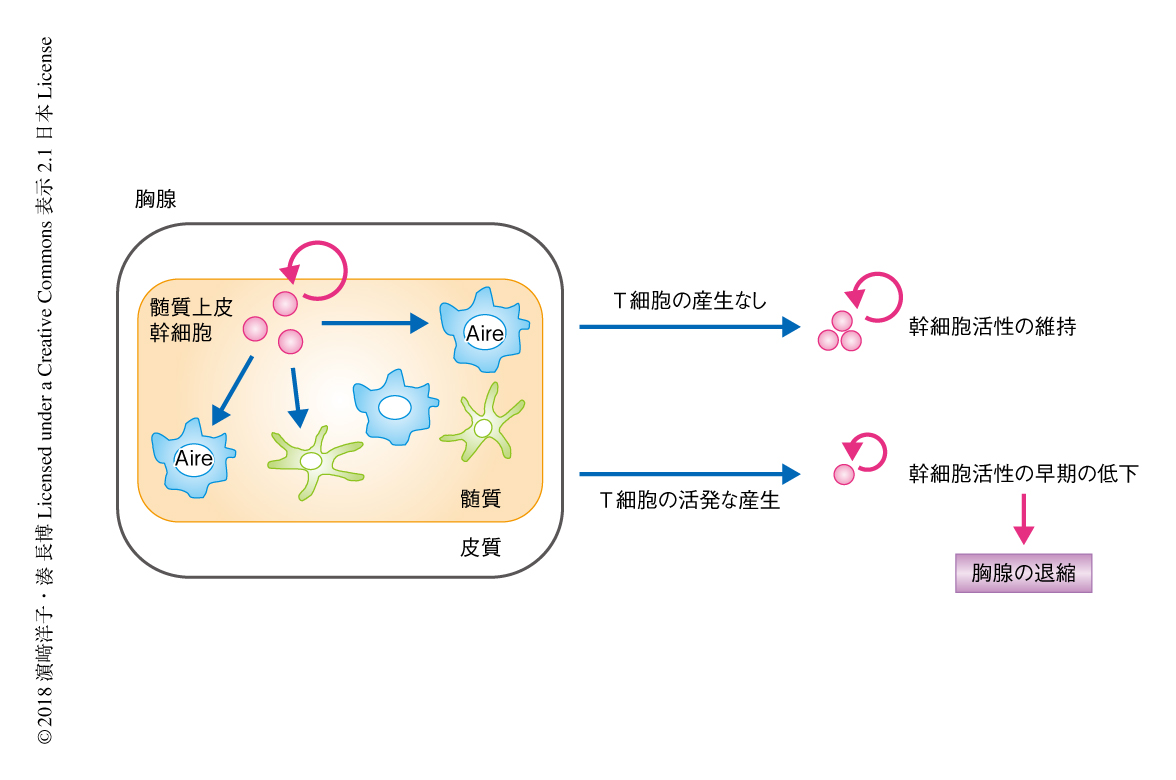
筆者らは,マウスにおいて髄質上皮細胞の幹細胞の同定に成功し,発生の初期のClaudin-3およびClaudin-4を発現する髄質上皮幹細胞の画分が,ほぼ生涯にわたり髄質上皮細胞の産生および自己寛容を維持しうることを明らかにしてきた.そして,髄質上皮幹細胞の活性の低下が胸腺の退縮に先行して生後すぐという予想より早期に起こること,さらに,T細胞が産生されないRag2ノックアウトマウスにおいては,髄質上皮幹細胞の活性が成体においても維持されることを見い出した5-8)(文献8) は 新着論文レビュー でも掲載)(図2).これらの事実から,胸腺の退縮の基盤となりうる胸腺上皮幹細胞の活性の低下が,たんに個体の加齢により起こるものではなく,出生の直後の活発なT細胞の産生に依存することが示された.また同時に,少なくともある一定の量のT細胞の産生により,髄質上皮幹細胞の活性,ひいては,胸腺の活動を抑制する機構の存在する可能性が示唆された.
こうした胸腺上皮前駆細胞および胸腺上皮幹細胞の同定や活性の制御と胸腺の退縮とのかかわりに関する知見は,胸腺の形成不全による先天性の免疫不全症の治療や,骨髄移植ののちT細胞の回復を促進する胸腺の機能の賦活化法の開発などへの応用が期待されている4).
胸腺の退縮の機構そのものにくわえ,それがどのような生理的な意義をもつのかを理解することは重要である.ほぼ無限に存在する未知の抗原への応答性の保証と免疫記憶の確立が獲得免疫系のもっとも重要な要素であるが,個体の生涯においてその系はさまざまな変化をとげる.
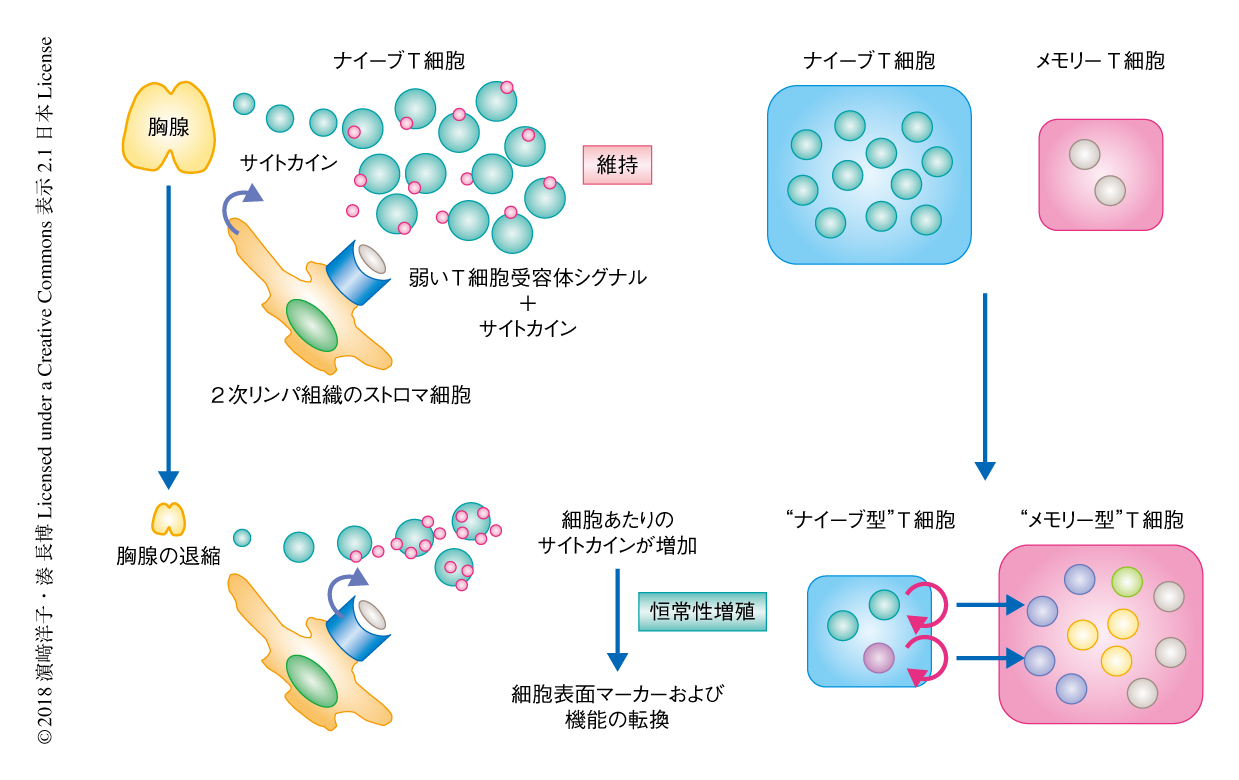
T細胞に着目すると,ヒトの一生のうち最初の10~20年で,おのおの異なる抗原特異性をもつナイーブT細胞(抗原にまだ曝露されていないT細胞を一般にこうよぶ)をある一定の量を産生し,多様な抗原に応答できるT細胞のレパトアのセットを末梢のリンパ組織に配置する.同時に,感染のたびに実動部隊であるエフェクターT細胞を産生するとともに,メモリーT細胞を残すことにより2度目の感染に迅速かつ強い応答を惹起するための系を構築する(図1).こうして成熟した獲得免疫系がいちどできあがったのちは,胸腺の退縮によりナイーブT細胞の産生が低下するなか,それを補完するかたちで増殖する恒常性増殖によりある程度の絶対数を維持する.また,急性感染だけでなく,EBウイルスやサイトメガロウイルスなどの潜伏感染をも制御する.このように,末梢のT細胞は内外からの刺激に応答しつつ維持されるという動的な平衡を保っているが,4~50歳あたりから慢性炎症や自己応答性の増大および機能の減弱が徐々に顕在化し,75歳をこえると易感染性を呈するなど実際に臨床的な意義が顕著になる.こうした免疫系の加齢による変化が起こすさまざまな免疫学的な特徴を総称して“免疫老化”(immunosenescence)とよび,大きく分けて3つの兆候,獲得免疫応答能の低下,炎症性素因の増大,自己免疫リスクの増大,により特徴づけられる9).すなわち,免疫老化とは免疫機能があまねく一般に低下するということではなく,好ましい応答が低下する一方で好ましくない応答が亢進するという,いっけん相反する二面性をもつことに特徴がある.以下,これら3つの特徴について述べる.
獲得免疫応答能の低下をもっとも端的に示すのは,加齢にともなう易感染性および感染症の重篤化であろう.たとえば,高齢者では肺炎球菌やインフルエンザウイルス感染症への罹患率が上昇するだけでなく重症化しやすいため,ときに致死的となる.一方で,ワクチンの効率の低下も免疫老化による獲得免疫応答能の低下を特徴づける現象のひとつである.ワクチンにより高齢者の免疫能を改善しようという試みはなされているが,獲得免疫応答能を利用して人為的に免疫記憶を形成するというワクチンの性質から,獲得免疫応答能が低い高齢者に対する効果は必ずしも高くないとの指摘もある10,11).中年期以降,遺伝子変異の蓄積など体細胞においてはがん細胞が発生しやすい要因が増加し,これと並行して,本来は変異した自己細胞をも非自己と識別して排除しうる免疫系も徐々に機能が低下することが,高齢者におけるがんの発症率の上昇に関係することも指摘されている.
炎症とは,感染の初期における局所での感染源の排除および獲得免疫応答の開始に重要な役割をはたす生体応答と定義される.一方で,内的な因子により非感染性に惹起され,おもにマクロファージやリンパ球の浸潤および組織のリモデリングを特徴とする低度かつ持続性の炎症,すなわち,慢性炎症のリスクが上昇することを炎症性素因の増大とよぶ12).重要なことに,この慢性炎症応答はとくに中年期以降に徐々に増大し,糖尿病におけるインスリン耐性,動脈硬化などの生活習慣病,代謝性疾患,神経変性疾患,フレイル(虚弱),がんなど,さまざまな加齢関連疾患に関与することが明らかにされてきた12).しかしながら,加齢にともない炎症性素因が増大する機序は必ずしもよく理解されてはおらず,今後の大きな検討課題である.
自己免疫疾患には単一遺伝子の異常により幼少期に発症する稀少疾患が存在するが,多くの場合は複数の遺伝子および環境要因が関与する多因子性疾患であり,そのリスク因子のひとつとしてとして加齢があげられている13).自己免疫応答の所見はしばしば健常人にも認められ,とくに高齢者において顕著である.たとえば,高齢者は多種類の自己抗体をもつこと,また,さまざまな臓器へのリンパ球の浸潤が起こることが知られている.こうした現象そのものは明らかな疾患とはいえないが,おのおのの臓器を低悪性度に傷害し機能の低下を起こす一因となる可能性は十分にある.自己免疫疾患を,このように明らかな疾患を起こすことのない自己応答の程度がたんに増大した結果と単純にとらえるべきではないが,少なくとも,自己応答の素因は加齢に応じて徐々に増加する.事実,若年性に発症する単一の遺伝子の異常による一部の疾患を除き,多因子性の多くの自己免疫疾患の発症時期の平均は30~40代以降,あるいは,50~60歳である13).自己免疫疾患の遺伝的なリスクが加齢にともない顕在化する理由はいまだ不明である.
以上の点から,免疫老化の全体像を分子レベルあるいは細胞レベルで理解することは,高齢者の易感染性への対策や効果的なワクチンの開発,中年期以降のがんの発症の抑制のみならず,さまざまな加齢関連疾患の発症の機序および病態を理解するうえできわめて重要である.
T細胞の加齢による変化のダイナミズムおよび免疫老化の分子細胞学的な実体を理解するためには,個々のT細胞の変化,および,T細胞サブセットの組成の変化を考える必要がある.個々のT細胞の変化として,加齢にともないT細胞受容体からのシグナルの閾値が高くなりT細胞が活性化しにくくなることは以前から知られていた.この現象は,T細胞受容体からのシグナルの下流のERKを脱リン酸化する酵素の発現を抑制するマイクロRNAの発現が,加齢にともない低下することにより説明しうるとの報告がなされた14).このことから,個々のT細胞の質的な変化が加齢にともなう獲得免疫応答能の低下の一端を担う可能性が示唆された11,14).
胸腺の退縮により若齢期においてT細胞の産生は顕著に低下するにもかかわらず,意外なことに,末梢におけるT細胞の数(少なくとも,末梢血中のT細胞の数)は加齢によりさほど減少しない.とくにヒトにおいては,数理モデル解析により,胸腺の退縮ののち末梢のナイーブT細胞の画分が恒常性増殖によりおもに維持されると指摘されており15),この仮説は幼少期に胸腺の摘出をうけた患者が必ずしも顕著な免疫不全におちいることはないという事実と一致する.しかしながら,胸腺を摘出した患者はある種のワクチンの効果が低く,また,末梢血中のT細胞は高齢者と似た特徴を示すといわれる16,17).くわえて,新生児期に胸腺を摘出した多くのケースにおいて,残存した断片から胸腺組織が明らかに再生しているとの報告もある18).以上の点から,末梢におけるT細胞の維持に胸腺がどのように寄与しうるのかについては,さらに慎重な解析が必要である.いずれにせよ,末梢のナイーブT細胞が生後の早期に産生されたT細胞の増殖によりおもに維持されるとすれば,比較的一定の量の産生がつづくB細胞や,日々入れ替わる好中球などのほかの免疫細胞とは異なる,T細胞に独自の大きな特徴であるといえる.
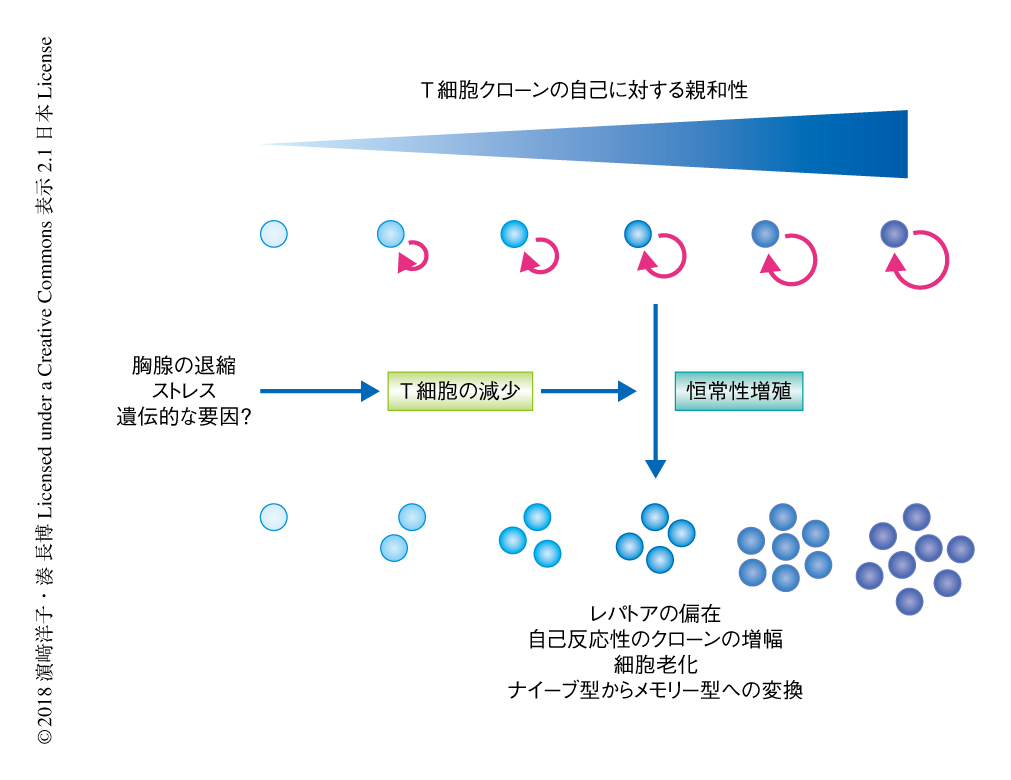
通常,T細胞は末梢において,2次リンパ組織のストロマ細胞などが発現する自己MHC分子と自己ペプチドとの複合体からの弱いT細胞受容体シグナルと,インターロイキン7やインターロイキン15などのリンパ球の維持に重要なサイトカインからのシグナルにより維持される.一方,恒常性増殖は,リンパ球の減少により個々のT細胞がインターロイキン7やインターロイキン15に過剰に曝露されることにより駆動される現象である(図3).自己に強い親和性を示すT細胞受容体を発現するT細胞クローンは負の選択により胸腺において除去されるものの,体内には自己応答性の比較的強いものから弱いものまで,ある程度のスペクトラムをもってT細胞クローンが存在する.そのため,恒常性増殖の過程においては,より強いT細胞受容体シグナルをうけるT細胞クローン(自己への親和性が強いT細胞クローン)が優先的に増殖すると想定される19,20)(図4).以上のことから,恒常性増殖はレパトアの偏向および狭小化と自己応答性クローンの効率的な増幅をもたらし,これが,獲得免疫応答能の低下や自己応答の素因の増大に寄与する可能性が指摘されている.事実,いくつかの自己免疫疾患のマウスモデルにおいて恒常性増殖がその発症に必須であるという報告があり21),こうしたエビデンスは自己免疫疾患の遺伝的な素因が時間をへる過程において,あるいは,ある確率で発現するという,ヒトにおける多くの自己免疫疾患の発症の実態と矛盾しない.
一方,ヒトにおいてはT細胞の数がもともと必要十分にあるため,恒常性増殖によるT細胞のレパトアの偏向はある程度は生じるものの,ナイーブT細胞のレパトアの多様性(未知の病原体に応答する能力)は加齢しても十分に維持され,レパトアが不足するとされるマウスとは異なるという指摘もある15).しかし,これらの研究のほとんどは健常な高齢者の末梢血の検体を用いたものであり,レパトアに過度に偏向をもたらす恒常性増殖が起こったり,ストレスなどにより過度にリンパ球が減少した状況がつづいたりすることにより,このホメオスタシスが破綻している事態も想定される.フレイルにある高齢者や,広いT細胞のレパトアによる免疫監視が重要な役割をはたすと考えられるがんの患者などにおいて,罹患するまえにナイーブT細胞のレパトアの多様性が十分に保たれていたのかは今後の検討課題である.
末梢のT細胞サブセットは加齢とともにその構成も変化する.胸腺の退縮によりナイーブT細胞が減少する一方,感染により2度目以降の感染に対し強く速い応答を可能にするメモリーT細胞が増加するのは,もっとも大きな構成の変化の例である.また,恒常性増殖の結果,メモリー型の細胞表面マーカーを発現し22),エフェクター機能の亢進したT細胞が分化することから,外来抗原の刺激をうけていないバーチャルメモリーT細胞と名づけられたT細胞がメモリー型T細胞のなかに含まれることもわかってきた23,24).また,加齢にともない制御性T細胞が増加するとの報告もある25).これはおそらく,末梢組織の自己炎症に応答しそれを抑制するとともに,正常な獲得免疫応答能の減弱にも寄与するものと考えられる.
筆者らは,加齢にともなうT細胞サブセットの構成の変化についてマウスモデルを用いて解析し,加齢に応じて出現する特徴的なT細胞サブセットを同定してきた.老化関連T細胞(senescence-associate T cell:SA-T cell)と名づけられたメモリー型のヘルパーT細胞は,抑制性受容体PD-1およびTNFスーパーファミリーに属するCD30L(CD153)の発現により特徴づけられる.老化関連T細胞はT細胞受容体への刺激に対し増殖やヘルパーT細胞において典型的なサイトカインの産生をほとんど示さないにもかかわらず,オステオポンチンなどの炎症性タンパク質や,CCL1やMip-1α/βなどの炎症性ケモカインを大量に分泌するというユニークな性質をもつ26-28).老化関連T細胞は増殖の停止にくわえて細胞老化の特徴を示すことから,この特徴的な形質はヘルパーT細胞における細胞老化関連分泌形質(senescence-associated secretory phenotype:SASP)であると考えられる.腫瘍抑制タンパク質Meninを欠損したマウスのT細胞は細胞老化が早期に起こるという報告がなされているが29),加齢にともなう老化関連T細胞の増加がMeninの発現の増減により説明しうるのかについては現在のところ明らかではない.
老化関連T細胞は若齢のマウスにおいても胸腺の摘出や放射線の照射ののちT細胞を移入することにより急激に増加する30).したがって,恒常性増殖が過度に起こった結果として誘導された可能性が高い.また,リンパ球の減少を診断基準のひとつとする自己免疫疾患である全身性エリテマトーデスのモデルマウスにおいては,老化関連T細胞と同様の特徴をもつT細胞が発症に先行して若齢で急速に増加する27).この全身性エリテマトーデスのモデルマウスにおいては自己抗体の沈着により傷害を起こした腎臓にも老化関連T細胞に似た細胞が認められるなど,リンパ臓器だけでなく末梢のさまざまな組織に老化関連T細胞が存在する27).さらに最近,老化関連T細胞は高脂肪食を負荷された内臓脂肪組織においても顕著に増加し,慢性炎症を起こすことによりインスリン耐性など2型糖尿病の病態の形成にも寄与することも明らかにされた31).細胞老化は過度な増殖によるテロメアの短縮だけでなく,DNA損傷応答を起こすさまざまなストレスによりひき起こされうるが,加齢や胸腺の摘出による恒常性増殖をともなわない状況において老化関連T細胞様の細胞が分化する機構は,現在のところ明らかではない.いずれにせよ,以上の結果から,健康な若齢のマウスにはほとんど存在しない老化関連T細胞の相対的な増加が免疫老化の一因となり,加齢関連疾患の発症および病態の制御に寄与する可能性が強く示唆された.
また,筆者らは,胸腺を摘出することにより恒常性増殖を加速させるモデルを用いて,CXCL9,CXCL10,CXCL11など炎症巣において高発現するケモカインの受容体であるCXCR3を発現し,T細胞受容体を刺激したのち短時間でインターフェロンγやTNFαなどの炎症性サイトカインを発現する,新たなナイーブCD8陽性T細胞を同定した32).CXCR3陽性のナイーブCD8陽性T細胞は恒常性増殖により分化が誘導されるものの,細胞老化の特徴は示さずナイーブT細胞の特徴である高い増殖能を維持しており,このT細胞を皮膚炎モデルに移入すると炎症応答が顕著に増悪した32).ヒトにも同様の機能的な特徴をもつT細胞の画分が存在し,その割合は健常な20~30歳代の比較的若い成人であっても個体間できわめて異なっていた32).このバラツキがどのような理由によるのか,また,個々の免疫の状態や将来的に加齢関連疾患の発症率とどう関連しうるのかは今後の興味深い課題のひとつである.
ここまで述べたように,加齢にともないナイーブT細胞の画分およびメモリーT細胞の画分にはさまざまな特徴をもつT細胞サブセットが増加すること,その相対的な増加が加齢にともなうT細胞の応答の変容に寄与する可能性のあることが強く示唆された(図3).
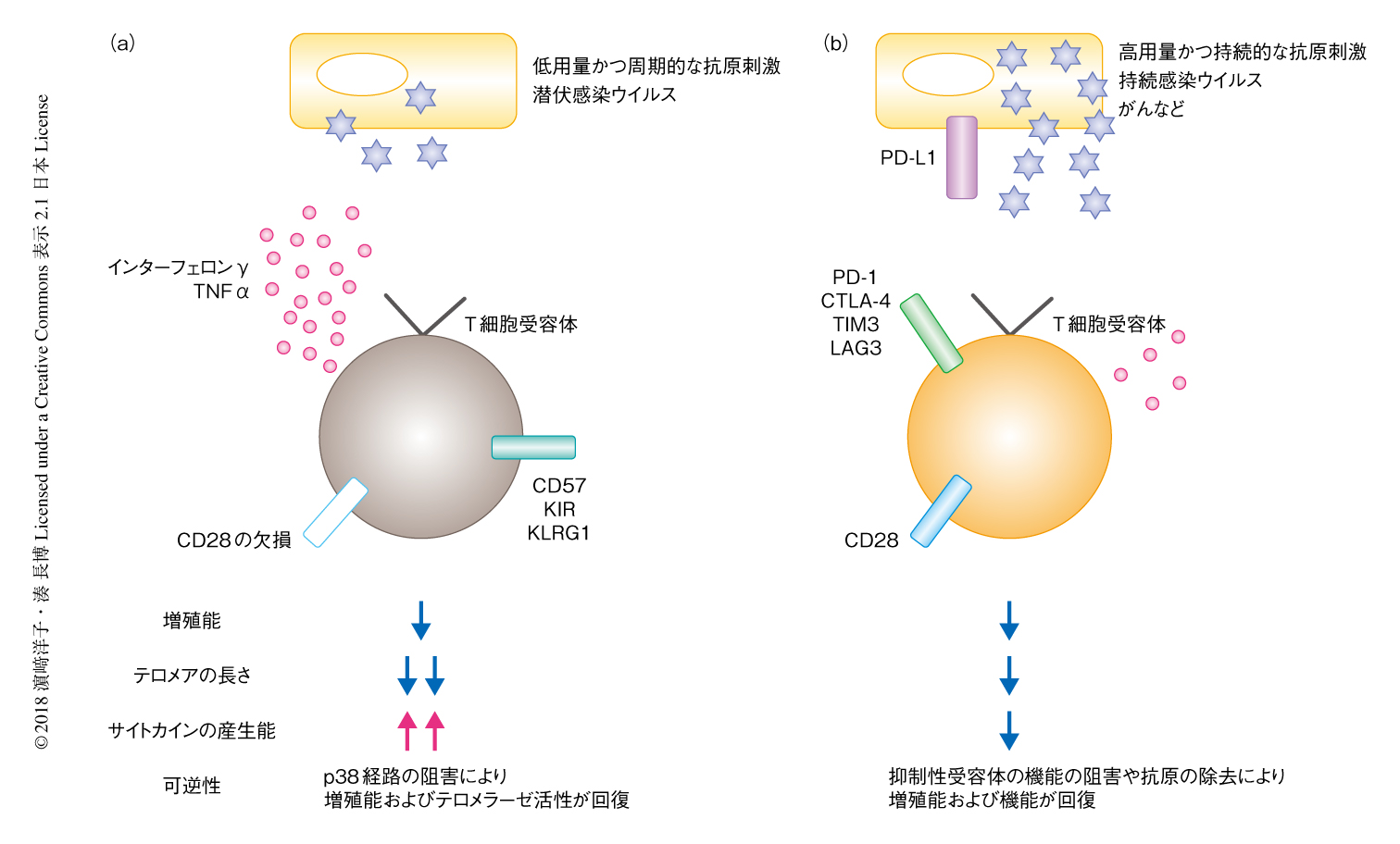
ヒトにおいては,CD27やCD28などの補助刺激受容体の欠失,および,ナチュラルキラー細胞など自然免疫系の細胞のマーカータンパク質の発現を特徴とするT細胞の画分が加齢にともない相対的に増加することが知られている.このT細胞サブセットは,おもに高度に分化したT細胞の画分に含まれ,抗原刺激ののちの増殖能が低くテロメアが短い一方で,サイトカインの産生や細胞殺傷能はむしろ高いという特徴を示し,老化(senescent)T細胞として定義されている33,34).この画分のレパトアは高度に偏向しており,サイトメガロウイルスなどの潜伏感染ウイルスに特異的なクローンを多く含む.このため,加齢というよりむしろ低容量のウイルス抗原に周期的に長く曝露されることにより分化した画分と考えられており,実際に,中高齢層においてもサイトメガロウイルスの非感染者ではこの画分のT細胞は少ない傾向がある33).健常な高齢者においてサイトメガロウイルスやEBウイルスの潜伏感染は臨床において問題のないことを考えると,潜伏感染ウイルスの再活性化を抑えるために機能は残しつつ,特異的なクローンの過度な増殖を抑えることでレパトアの多様性を保つためのしくみと考えられ,この種のT細胞の老化の表現型は良好な適応状態,あるいは,潜伏感染ウイルスの再活性化を制御するために免疫系がはらう不可避の対価というべきものであろう35,36).
最近,ヒトのT細胞の老化はp38の活性化により積極的に維持されることが明らかにされた.T細胞の老化の過程において,細胞における低グルコース濃度およびDNAの損傷をTAB1-AMPK複合体が感知し,下流のp38が持続的に活性化されるという報告がなされた37).重要なことに,この機構による増殖能やテロメラーゼの活性の低下は,p38の活性化経路を低分子化合物38,39) やshRNA 37) により遮断することにより回復した.以上の結果は,ヒトの老化T細胞は,線維芽細胞の細胞老化(cellular senescence)の過程にも認められる不可逆的な増殖の停止の前段階である可能性があり,また,介入の余地のあることを意味する.さらに最近,p38と複合体を形成するセストリンの機能を阻害することにより,抗原特異的な応答およびワクチンに対する応答が回復することが示された40).今後,T細胞の老化の多様な分子機構がさらに詳細に明らかにされ,効果的なワクチンの開発など,免疫老化の表現型を制御する方法論の確立が期待される.
老化T細胞と同様に,増殖能の減弱したT細胞サブセットとしてよく知られる疲弊(exhausted)T細胞はサイトカインの産生能も減弱しており,PD-1などの抑制性受容体の発現を特徴とする.ヒト免疫不全ウイルス(HIV),C型肝炎ウイルス,B型肝炎ウイルスなど,比較的容量の高い抗原刺激がつづく持続感染により誘導されるとされ,がんもおそらくこの範疇の抗原に入る.疲弊T細胞における増殖能および機能の低下は,PD-1などの抑制性受容体とリガンドとの相互作用を阻害したり,抗原の存在しない別の個体に移入したりすることにより一部が回復し,このしくみががん免疫を増強するチェックポイント療法として応用されている.免疫応答は諸刃の剣であり,過度の免疫応答は自らの組織も障害するため,免疫応答の度合いを制御する系としてT細胞の疲弊の機構が存在すると考えられており,抗原がなくなるとT細胞がもとの機能的な状態にもどるのも妥当である.このように,老化T細胞および疲弊T細胞は,増殖能を欠くという点では共通しているが,その分化の機構や細胞の状態および存在意義も異なり,おのおのが独立して加齢にともなう免疫応答の変容に寄与するものと考えられる33,35)(図5).
これまで述べた免疫老化に関する内容に関連して,現在,議論されている点や免疫老化を克服する試みについて述べる.
サイトメガロウイルスや老化T細胞は排除すべきか?:潜伏感染ウイルスが加齢にともなう免疫能の変容に影響するのはまちがいないであろう.ただ,サイトメガロウイルスの感染やその結果として分化した老化T細胞が免疫老化を促進するという報告がある一方,最近の研究においては否定的な報告もあいついでいる.なかでも,成人においてはむしろサイトメガロウイルスの感染者のほうがインフルエンザワクチンの効果が高いという報告は大きなインパクトをもたらした41).この結果は,個体が健康であるかぎりサイトメガロウイルスの感染はメリットとなりうることを示唆しており,むしろ,腸内細菌のように進化の過程で獲得した,免疫を賦活化する“共生生物”ととらえるべきではないかという解釈もなされている.
p38阻害剤:p38を介したシグナルはサイトカインの産生において重要であるため,さまざまな炎症性疾患に対してp38阻害剤の治験が実施された.長期の投与は肝毒性のため不可能であったが,細胞老化を阻害することにより懸念されたがんの発症率の上昇は認められていない.p38の阻害はPD-1の阻害との相加的な効果が報告されていることから39),とくにワクチンやがんの治療における一過性の免疫の賦活化を目的として,今後,検討される可能性がある34).
ラパマイシン:寿命の延長に効果があるとされるmTOR阻害剤であるラパマイシンを65歳以上の高齢者に投与することにより,末梢血中のヘルパーT細胞およびキラーT細胞におけるPD-1の陽性率が低下するとともに,インフルエンザウイルスに対するワクチンの効果が上昇するとの報告がなされている42).一方,ラパマイシンは臓器移植の際に免疫抑制剤として使用されていること,多くの細胞に対し多様な作用のあること,また,ヒトの末梢血中においてPD-1陽性の画分は濾胞T細胞を含むことなどから,ラパマイシンの標的となる細胞,使用条件,作用機序について,さらなる詳細な解析が待たれる.
T細胞の老化は,胸腺の退縮にともなうT細胞の産生の低下,および,急性感染,慢性感染,潜伏感染に応答する過程において,生体の全体におけるホメオスタシスを生涯にわたり維持するために起こるある種の適応であるともいえ,適応が失敗したとき(適応しきれなくなったとき)に免疫系に不都合が起こり,ときに病態として現われるともとらえられる.いずれにせよ,末梢血というヒトからも入手しやすい材料のおかげで,T細胞の老化はマウスにくわえヒトにおいても分子レベルでの精力的な研究が進められている.しかしながら,これまでの知見はほとんど健常人の末梢血を用いて得られたものであり,たとえば,フレイルの状態にあるヒトでレパトアの狭小化などはみられないのか,また,コホート研究などを用いて,がんやさまざまな加齢関連疾患の発症するまえのT細胞の老化の状態はどうなっているのか,といった点を明らかにすることが必要であろう.これにより,ひとりひとりの免疫老化の状態を予測するバイオマーカーの同定も可能になると思われる.その一方で,末梢血中のT細胞は全身のT細胞のごく一部であり,多くのT細胞が存在する腸管や,近年,研究が進んできた感染の最前線で戦う組織常駐型メモリーT細胞の加齢による変化,また,老化したT細胞が具体的にどのように加齢関連疾患とかかわるのかに関しては,現在,ほとんど明らかにされていない.こうした組織レベルおよび個体レベルにおける解析やT細胞の老化の分子機構の解析においては,今後もマウスモデルが大きく貢献するであろう.こうして得られた知見は,免疫老化と加齢関連疾患の予防および治療,さらには,高齢者の免疫状態の特性にあったワクチン戦略の開発などに大きく貢献するものと期待される.
略歴:2003年 京都大学大学院医学研究科にて博士号取得,同年 同 助教,2010年 同 准教授を経て,2017年より京都大学iPS細胞研究所 教授.
研究テーマ:免疫細胞および免疫関連組織(おもに,T細胞および胸腺)の発生と機能,免疫老化.
研究室URL:http://www.cira.kyoto-u.ac.jp/hmy/
湊 長博(Nagahiro Minato)
京都大学 理事・副学長.
© 2018 濵﨑洋子・湊 長博 Licensed under CC 表示 2.1 日本
(1京都大学iPS細胞研究所 未来生命科学開拓部門,2京都大学大学院医学研究科 メディカルイノベーションセンター)
email:濵﨑洋子
領域融合レビュー, 7, e005 (2018) DOI: 10.7875/leading.author.7.e005
Yoko Hamazaki & Nagahiro Minato: T cell aging and immunosenescence.
要 約
近年,さまざまな加齢関連疾患の発症や病態の形成に免疫老化が重要な役割をはたすことが明らかにされてきている.免疫老化とは,免疫系の加齢にともなう変化の特徴を包括して表現した用語であり,おおむね,獲得免疫応答能の低下,炎症性素因の増大,自己免疫リスクの増大,という3つの兆候により特徴づけられる.すなわち,感染源から身体を防御しそれらを排除する正常な免疫応答が低下する一方,慢性炎症や自己免疫応答が亢進するという,二面性をもつことに特徴がある.加齢によりあらゆる免疫細胞が質的および機能的に変化をきたすが,T細胞を産生する胸腺の機能は早期に低下することから,加齢による変化はT細胞がもっとも大きいとされる.このレビューにおいては,胸腺の退縮とそれにともなう末梢のT細胞の質的および集団的な変化の実態と機序に関する知見を紹介し,多くの免疫細胞の機能に影響するT細胞の加齢による変化が免疫老化にはたす意義,そして,免疫老化の制御およびその克服の可能性について議論する.
はじめに
免疫系は自己の成分と非自己成分とを識別し,細菌やウイルスなどの感染性の微生物の感染防御およびその排除に必須である.理論上,無限の応答性をもつリンパ球を体内に配置し,感染ののちにはメモリー細胞を残すことにより免疫系は成熟をとげる.しかしながら,加齢にともないその機能は徐々に低下し,その一方で,慢性炎症や自己免疫応答が亢進することにより,代謝性疾患,がん,自己免疫疾患など,いわゆる加齢関連疾患が増加する.こうした免疫系の加齢にともなう機能的な変容は“免疫老化”と総称され,とくに,抗原特異性および免疫記憶を特徴とする獲得免疫系の変化が顕著であるとされるが,その分子細胞生物学的な基盤についてはよくわかっていない.このレビューにおいては,免疫細胞のなかでもっとも加齢の影響をうけるとされるT細胞の加齢による変化および老化について,筆者らの最近の研究も含め解説し,免疫老化の原因および実態の理解,そして,さまざまな加齢関連疾患との関連および制御の可能性について議論する.
1.T細胞を産生する胸腺のなりたちおよび退縮
すべての系列の免疫細胞において加齢にともなう数的あるいは質的な変化は起こるが,リンパ球(T細胞およびB細胞)がかかわり抗原特異性および免疫記憶の形成を特徴とする獲得免疫系の変化がとくに顕著であるといわれる.その主たる原因のひとつは,免疫系の司令塔としてはたらくT細胞を産生する胸腺が,個体の生涯において比較的早期からサイズが小さくなり機能が低下,すなわち,退縮することにある.
これまでの研究から,胸腺の退縮の原因はおもにT細胞の産生における主要な胸腺ストロマ細胞である胸腺上皮細胞の変化に起因すると考えられており,ヒトでは1歳をすぎるころからすでに加齢による変化がはじまるとさえいわれる.70歳代であってもヒトの胸腺は新たなT細胞の産生能をもつことを示唆するエビデンスがある一方,40歳代で産生される新たなT細胞は新生児期の1/100以下に低下するといわれている.重要な免疫細胞を産生する組織の機能が早々に低下するのは不可思議な現象ともいえるが,胸腺の早期の退縮は種をこえた現象であるため,個体にとりなんらかのアドバンテージをもつ可能性も指摘されている.胸腺におけるT細胞の産生の過程においては,のちに述べる正の選択および負の選択の過程をへてT細胞に分化するのはほんの5%程度であり,獲得免疫系はメモリー細胞を残すことによりいちど感染した微生物を効率的に排除しうることを考えると,生涯にわたり新たなナイーブT細胞の産生を維持することはエネルギー効率の点から好ましくないだけでなく,そもそも,さほど必要がないのかもしれない1,2).
他方,胸腺の退縮に成長ホルモンや性ホルモンが関与しうることは古くから知られている3).このことは,発生の後期から生後の早期においてT細胞の産生に費やしたコストを,個体の成長や性成熟にともない別の生体系に使うのではないかという魅力的なモデルの根拠になっている.実際に,ヒトの前立腺がんに対するアンドロゲン除去療法により末梢のT細胞が増加するとの報告もなされている4).しかし一方で,去勢により性ホルモンを除去したマウスにおける胸腺の肥大は一過性であること,また,加齢にともない性ホルモンが低下しても胸腺の活動は回復しないことから,性ホルモン以外の作用機序の存在も強く示唆され,依然として胸腺の退縮の機構の全容は明らかではない.
胸腺は皮質と髄質の2つの領域からなり,皮質上皮細胞は自己のMHC分子への応答性の獲得(正の選択),幅広い抗原に応答しうるレパトアの形成,ヘルパーT細胞あるいはキラーT細胞への運命決定をおもに担う.髄質においては,髄質上皮細胞と樹状細胞とが協調して自己応答性のT細胞の除去(負の選択)および免疫応答を負に制御する制御性T細胞の産生が起こり,自己を攻撃しない自己寛容の成立を可能にする(図1).髄質上皮細胞は,インスリンなど本来は胸腺に存在しないさまざまな組織抗原を攻撃してはならない自己の成分としてT細胞に提示するというきわめてユニークな性質をもつが,これは,ヒトの自己免疫性多内分泌腺症候群1型の原因遺伝子産物として同定された核タンパク質AIREのはたらきによるものであり,この系の破綻が自己免疫疾患をひき起こすことが1997年に明らかにされた.この発見以降,胸腺ストロマ細胞の重要性があらためて認識され,胸腺ストロマ細胞の発生および機能の分化に関する研究がここ20年で飛躍的に進んだ5).
筆者らは,マウスにおいて髄質上皮細胞の幹細胞の同定に成功し,発生の初期のClaudin-3およびClaudin-4を発現する髄質上皮幹細胞の画分が,ほぼ生涯にわたり髄質上皮細胞の産生および自己寛容を維持しうることを明らかにしてきた.そして,髄質上皮幹細胞の活性の低下が胸腺の退縮に先行して生後すぐという予想より早期に起こること,さらに,T細胞が産生されないRag2ノックアウトマウスにおいては,髄質上皮幹細胞の活性が成体においても維持されることを見い出した5-8)(文献8) は 新着論文レビュー でも掲載)(図2).これらの事実から,胸腺の退縮の基盤となりうる胸腺上皮幹細胞の活性の低下が,たんに個体の加齢により起こるものではなく,出生の直後の活発なT細胞の産生に依存することが示された.また同時に,少なくともある一定の量のT細胞の産生により,髄質上皮幹細胞の活性,ひいては,胸腺の活動を抑制する機構の存在する可能性が示唆された.
こうした胸腺上皮前駆細胞および胸腺上皮幹細胞の同定や活性の制御と胸腺の退縮とのかかわりに関する知見は,胸腺の形成不全による先天性の免疫不全症の治療や,骨髄移植ののちT細胞の回復を促進する胸腺の機能の賦活化法の開発などへの応用が期待されている4).
2.個体の生涯におけるT細胞サブセットのダイナミズムおよび免疫老化
胸腺の退縮の機構そのものにくわえ,それがどのような生理的な意義をもつのかを理解することは重要である.ほぼ無限に存在する未知の抗原への応答性の保証と免疫記憶の確立が獲得免疫系のもっとも重要な要素であるが,個体の生涯においてその系はさまざまな変化をとげる.
T細胞に着目すると,ヒトの一生のうち最初の10~20年で,おのおの異なる抗原特異性をもつナイーブT細胞(抗原にまだ曝露されていないT細胞を一般にこうよぶ)をある一定の量を産生し,多様な抗原に応答できるT細胞のレパトアのセットを末梢のリンパ組織に配置する.同時に,感染のたびに実動部隊であるエフェクターT細胞を産生するとともに,メモリーT細胞を残すことにより2度目の感染に迅速かつ強い応答を惹起するための系を構築する(図1).こうして成熟した獲得免疫系がいちどできあがったのちは,胸腺の退縮によりナイーブT細胞の産生が低下するなか,それを補完するかたちで増殖する恒常性増殖によりある程度の絶対数を維持する.また,急性感染だけでなく,EBウイルスやサイトメガロウイルスなどの潜伏感染をも制御する.このように,末梢のT細胞は内外からの刺激に応答しつつ維持されるという動的な平衡を保っているが,4~50歳あたりから慢性炎症や自己応答性の増大および機能の減弱が徐々に顕在化し,75歳をこえると易感染性を呈するなど実際に臨床的な意義が顕著になる.こうした免疫系の加齢による変化が起こすさまざまな免疫学的な特徴を総称して“免疫老化”(immunosenescence)とよび,大きく分けて3つの兆候,獲得免疫応答能の低下,炎症性素因の増大,自己免疫リスクの増大,により特徴づけられる9).すなわち,免疫老化とは免疫機能があまねく一般に低下するということではなく,好ましい応答が低下する一方で好ましくない応答が亢進するという,いっけん相反する二面性をもつことに特徴がある.以下,これら3つの特徴について述べる.
獲得免疫応答能の低下をもっとも端的に示すのは,加齢にともなう易感染性および感染症の重篤化であろう.たとえば,高齢者では肺炎球菌やインフルエンザウイルス感染症への罹患率が上昇するだけでなく重症化しやすいため,ときに致死的となる.一方で,ワクチンの効率の低下も免疫老化による獲得免疫応答能の低下を特徴づける現象のひとつである.ワクチンにより高齢者の免疫能を改善しようという試みはなされているが,獲得免疫応答能を利用して人為的に免疫記憶を形成するというワクチンの性質から,獲得免疫応答能が低い高齢者に対する効果は必ずしも高くないとの指摘もある10,11).中年期以降,遺伝子変異の蓄積など体細胞においてはがん細胞が発生しやすい要因が増加し,これと並行して,本来は変異した自己細胞をも非自己と識別して排除しうる免疫系も徐々に機能が低下することが,高齢者におけるがんの発症率の上昇に関係することも指摘されている.
炎症とは,感染の初期における局所での感染源の排除および獲得免疫応答の開始に重要な役割をはたす生体応答と定義される.一方で,内的な因子により非感染性に惹起され,おもにマクロファージやリンパ球の浸潤および組織のリモデリングを特徴とする低度かつ持続性の炎症,すなわち,慢性炎症のリスクが上昇することを炎症性素因の増大とよぶ12).重要なことに,この慢性炎症応答はとくに中年期以降に徐々に増大し,糖尿病におけるインスリン耐性,動脈硬化などの生活習慣病,代謝性疾患,神経変性疾患,フレイル(虚弱),がんなど,さまざまな加齢関連疾患に関与することが明らかにされてきた12).しかしながら,加齢にともない炎症性素因が増大する機序は必ずしもよく理解されてはおらず,今後の大きな検討課題である.
自己免疫疾患には単一遺伝子の異常により幼少期に発症する稀少疾患が存在するが,多くの場合は複数の遺伝子および環境要因が関与する多因子性疾患であり,そのリスク因子のひとつとしてとして加齢があげられている13).自己免疫応答の所見はしばしば健常人にも認められ,とくに高齢者において顕著である.たとえば,高齢者は多種類の自己抗体をもつこと,また,さまざまな臓器へのリンパ球の浸潤が起こることが知られている.こうした現象そのものは明らかな疾患とはいえないが,おのおのの臓器を低悪性度に傷害し機能の低下を起こす一因となる可能性は十分にある.自己免疫疾患を,このように明らかな疾患を起こすことのない自己応答の程度がたんに増大した結果と単純にとらえるべきではないが,少なくとも,自己応答の素因は加齢に応じて徐々に増加する.事実,若年性に発症する単一の遺伝子の異常による一部の疾患を除き,多因子性の多くの自己免疫疾患の発症時期の平均は30~40代以降,あるいは,50~60歳である13).自己免疫疾患の遺伝的なリスクが加齢にともない顕在化する理由はいまだ不明である.
以上の点から,免疫老化の全体像を分子レベルあるいは細胞レベルで理解することは,高齢者の易感染性への対策や効果的なワクチンの開発,中年期以降のがんの発症の抑制のみならず,さまざまな加齢関連疾患の発症の機序および病態を理解するうえできわめて重要である.
3.胸腺の退縮にともなうT細胞の恒常性増殖
T細胞の加齢による変化のダイナミズムおよび免疫老化の分子細胞学的な実体を理解するためには,個々のT細胞の変化,および,T細胞サブセットの組成の変化を考える必要がある.個々のT細胞の変化として,加齢にともないT細胞受容体からのシグナルの閾値が高くなりT細胞が活性化しにくくなることは以前から知られていた.この現象は,T細胞受容体からのシグナルの下流のERKを脱リン酸化する酵素の発現を抑制するマイクロRNAの発現が,加齢にともない低下することにより説明しうるとの報告がなされた14).このことから,個々のT細胞の質的な変化が加齢にともなう獲得免疫応答能の低下の一端を担う可能性が示唆された11,14).
胸腺の退縮により若齢期においてT細胞の産生は顕著に低下するにもかかわらず,意外なことに,末梢におけるT細胞の数(少なくとも,末梢血中のT細胞の数)は加齢によりさほど減少しない.とくにヒトにおいては,数理モデル解析により,胸腺の退縮ののち末梢のナイーブT細胞の画分が恒常性増殖によりおもに維持されると指摘されており15),この仮説は幼少期に胸腺の摘出をうけた患者が必ずしも顕著な免疫不全におちいることはないという事実と一致する.しかしながら,胸腺を摘出した患者はある種のワクチンの効果が低く,また,末梢血中のT細胞は高齢者と似た特徴を示すといわれる16,17).くわえて,新生児期に胸腺を摘出した多くのケースにおいて,残存した断片から胸腺組織が明らかに再生しているとの報告もある18).以上の点から,末梢におけるT細胞の維持に胸腺がどのように寄与しうるのかについては,さらに慎重な解析が必要である.いずれにせよ,末梢のナイーブT細胞が生後の早期に産生されたT細胞の増殖によりおもに維持されるとすれば,比較的一定の量の産生がつづくB細胞や,日々入れ替わる好中球などのほかの免疫細胞とは異なる,T細胞に独自の大きな特徴であるといえる.
通常,T細胞は末梢において,2次リンパ組織のストロマ細胞などが発現する自己MHC分子と自己ペプチドとの複合体からの弱いT細胞受容体シグナルと,インターロイキン7やインターロイキン15などのリンパ球の維持に重要なサイトカインからのシグナルにより維持される.一方,恒常性増殖は,リンパ球の減少により個々のT細胞がインターロイキン7やインターロイキン15に過剰に曝露されることにより駆動される現象である(図3).自己に強い親和性を示すT細胞受容体を発現するT細胞クローンは負の選択により胸腺において除去されるものの,体内には自己応答性の比較的強いものから弱いものまで,ある程度のスペクトラムをもってT細胞クローンが存在する.そのため,恒常性増殖の過程においては,より強いT細胞受容体シグナルをうけるT細胞クローン(自己への親和性が強いT細胞クローン)が優先的に増殖すると想定される19,20)(図4).以上のことから,恒常性増殖はレパトアの偏向および狭小化と自己応答性クローンの効率的な増幅をもたらし,これが,獲得免疫応答能の低下や自己応答の素因の増大に寄与する可能性が指摘されている.事実,いくつかの自己免疫疾患のマウスモデルにおいて恒常性増殖がその発症に必須であるという報告があり21),こうしたエビデンスは自己免疫疾患の遺伝的な素因が時間をへる過程において,あるいは,ある確率で発現するという,ヒトにおける多くの自己免疫疾患の発症の実態と矛盾しない.
一方,ヒトにおいてはT細胞の数がもともと必要十分にあるため,恒常性増殖によるT細胞のレパトアの偏向はある程度は生じるものの,ナイーブT細胞のレパトアの多様性(未知の病原体に応答する能力)は加齢しても十分に維持され,レパトアが不足するとされるマウスとは異なるという指摘もある15).しかし,これらの研究のほとんどは健常な高齢者の末梢血の検体を用いたものであり,レパトアに過度に偏向をもたらす恒常性増殖が起こったり,ストレスなどにより過度にリンパ球が減少した状況がつづいたりすることにより,このホメオスタシスが破綻している事態も想定される.フレイルにある高齢者や,広いT細胞のレパトアによる免疫監視が重要な役割をはたすと考えられるがんの患者などにおいて,罹患するまえにナイーブT細胞のレパトアの多様性が十分に保たれていたのかは今後の検討課題である.
4.加齢にともない増加するT細胞サブセット
末梢のT細胞サブセットは加齢とともにその構成も変化する.胸腺の退縮によりナイーブT細胞が減少する一方,感染により2度目以降の感染に対し強く速い応答を可能にするメモリーT細胞が増加するのは,もっとも大きな構成の変化の例である.また,恒常性増殖の結果,メモリー型の細胞表面マーカーを発現し22),エフェクター機能の亢進したT細胞が分化することから,外来抗原の刺激をうけていないバーチャルメモリーT細胞と名づけられたT細胞がメモリー型T細胞のなかに含まれることもわかってきた23,24).また,加齢にともない制御性T細胞が増加するとの報告もある25).これはおそらく,末梢組織の自己炎症に応答しそれを抑制するとともに,正常な獲得免疫応答能の減弱にも寄与するものと考えられる.
筆者らは,加齢にともなうT細胞サブセットの構成の変化についてマウスモデルを用いて解析し,加齢に応じて出現する特徴的なT細胞サブセットを同定してきた.老化関連T細胞(senescence-associate T cell:SA-T cell)と名づけられたメモリー型のヘルパーT細胞は,抑制性受容体PD-1およびTNFスーパーファミリーに属するCD30L(CD153)の発現により特徴づけられる.老化関連T細胞はT細胞受容体への刺激に対し増殖やヘルパーT細胞において典型的なサイトカインの産生をほとんど示さないにもかかわらず,オステオポンチンなどの炎症性タンパク質や,CCL1やMip-1α/βなどの炎症性ケモカインを大量に分泌するというユニークな性質をもつ26-28).老化関連T細胞は増殖の停止にくわえて細胞老化の特徴を示すことから,この特徴的な形質はヘルパーT細胞における細胞老化関連分泌形質(senescence-associated secretory phenotype:SASP)であると考えられる.腫瘍抑制タンパク質Meninを欠損したマウスのT細胞は細胞老化が早期に起こるという報告がなされているが29),加齢にともなう老化関連T細胞の増加がMeninの発現の増減により説明しうるのかについては現在のところ明らかではない.
老化関連T細胞は若齢のマウスにおいても胸腺の摘出や放射線の照射ののちT細胞を移入することにより急激に増加する30).したがって,恒常性増殖が過度に起こった結果として誘導された可能性が高い.また,リンパ球の減少を診断基準のひとつとする自己免疫疾患である全身性エリテマトーデスのモデルマウスにおいては,老化関連T細胞と同様の特徴をもつT細胞が発症に先行して若齢で急速に増加する27).この全身性エリテマトーデスのモデルマウスにおいては自己抗体の沈着により傷害を起こした腎臓にも老化関連T細胞に似た細胞が認められるなど,リンパ臓器だけでなく末梢のさまざまな組織に老化関連T細胞が存在する27).さらに最近,老化関連T細胞は高脂肪食を負荷された内臓脂肪組織においても顕著に増加し,慢性炎症を起こすことによりインスリン耐性など2型糖尿病の病態の形成にも寄与することも明らかにされた31).細胞老化は過度な増殖によるテロメアの短縮だけでなく,DNA損傷応答を起こすさまざまなストレスによりひき起こされうるが,加齢や胸腺の摘出による恒常性増殖をともなわない状況において老化関連T細胞様の細胞が分化する機構は,現在のところ明らかではない.いずれにせよ,以上の結果から,健康な若齢のマウスにはほとんど存在しない老化関連T細胞の相対的な増加が免疫老化の一因となり,加齢関連疾患の発症および病態の制御に寄与する可能性が強く示唆された.
また,筆者らは,胸腺を摘出することにより恒常性増殖を加速させるモデルを用いて,CXCL9,CXCL10,CXCL11など炎症巣において高発現するケモカインの受容体であるCXCR3を発現し,T細胞受容体を刺激したのち短時間でインターフェロンγやTNFαなどの炎症性サイトカインを発現する,新たなナイーブCD8陽性T細胞を同定した32).CXCR3陽性のナイーブCD8陽性T細胞は恒常性増殖により分化が誘導されるものの,細胞老化の特徴は示さずナイーブT細胞の特徴である高い増殖能を維持しており,このT細胞を皮膚炎モデルに移入すると炎症応答が顕著に増悪した32).ヒトにも同様の機能的な特徴をもつT細胞の画分が存在し,その割合は健常な20~30歳代の比較的若い成人であっても個体間できわめて異なっていた32).このバラツキがどのような理由によるのか,また,個々の免疫の状態や将来的に加齢関連疾患の発症率とどう関連しうるのかは今後の興味深い課題のひとつである.
ここまで述べたように,加齢にともないナイーブT細胞の画分およびメモリーT細胞の画分にはさまざまな特徴をもつT細胞サブセットが増加すること,その相対的な増加が加齢にともなうT細胞の応答の変容に寄与する可能性のあることが強く示唆された(図3).
5.ヒトにおけるT細胞の老化およびその制御
ヒトにおいては,CD27やCD28などの補助刺激受容体の欠失,および,ナチュラルキラー細胞など自然免疫系の細胞のマーカータンパク質の発現を特徴とするT細胞の画分が加齢にともない相対的に増加することが知られている.このT細胞サブセットは,おもに高度に分化したT細胞の画分に含まれ,抗原刺激ののちの増殖能が低くテロメアが短い一方で,サイトカインの産生や細胞殺傷能はむしろ高いという特徴を示し,老化(senescent)T細胞として定義されている33,34).この画分のレパトアは高度に偏向しており,サイトメガロウイルスなどの潜伏感染ウイルスに特異的なクローンを多く含む.このため,加齢というよりむしろ低容量のウイルス抗原に周期的に長く曝露されることにより分化した画分と考えられており,実際に,中高齢層においてもサイトメガロウイルスの非感染者ではこの画分のT細胞は少ない傾向がある33).健常な高齢者においてサイトメガロウイルスやEBウイルスの潜伏感染は臨床において問題のないことを考えると,潜伏感染ウイルスの再活性化を抑えるために機能は残しつつ,特異的なクローンの過度な増殖を抑えることでレパトアの多様性を保つためのしくみと考えられ,この種のT細胞の老化の表現型は良好な適応状態,あるいは,潜伏感染ウイルスの再活性化を制御するために免疫系がはらう不可避の対価というべきものであろう35,36).
最近,ヒトのT細胞の老化はp38の活性化により積極的に維持されることが明らかにされた.T細胞の老化の過程において,細胞における低グルコース濃度およびDNAの損傷をTAB1-AMPK複合体が感知し,下流のp38が持続的に活性化されるという報告がなされた37).重要なことに,この機構による増殖能やテロメラーゼの活性の低下は,p38の活性化経路を低分子化合物38,39) やshRNA 37) により遮断することにより回復した.以上の結果は,ヒトの老化T細胞は,線維芽細胞の細胞老化(cellular senescence)の過程にも認められる不可逆的な増殖の停止の前段階である可能性があり,また,介入の余地のあることを意味する.さらに最近,p38と複合体を形成するセストリンの機能を阻害することにより,抗原特異的な応答およびワクチンに対する応答が回復することが示された40).今後,T細胞の老化の多様な分子機構がさらに詳細に明らかにされ,効果的なワクチンの開発など,免疫老化の表現型を制御する方法論の確立が期待される.
老化T細胞と同様に,増殖能の減弱したT細胞サブセットとしてよく知られる疲弊(exhausted)T細胞はサイトカインの産生能も減弱しており,PD-1などの抑制性受容体の発現を特徴とする.ヒト免疫不全ウイルス(HIV),C型肝炎ウイルス,B型肝炎ウイルスなど,比較的容量の高い抗原刺激がつづく持続感染により誘導されるとされ,がんもおそらくこの範疇の抗原に入る.疲弊T細胞における増殖能および機能の低下は,PD-1などの抑制性受容体とリガンドとの相互作用を阻害したり,抗原の存在しない別の個体に移入したりすることにより一部が回復し,このしくみががん免疫を増強するチェックポイント療法として応用されている.免疫応答は諸刃の剣であり,過度の免疫応答は自らの組織も障害するため,免疫応答の度合いを制御する系としてT細胞の疲弊の機構が存在すると考えられており,抗原がなくなるとT細胞がもとの機能的な状態にもどるのも妥当である.このように,老化T細胞および疲弊T細胞は,増殖能を欠くという点では共通しているが,その分化の機構や細胞の状態および存在意義も異なり,おのおのが独立して加齢にともなう免疫応答の変容に寄与するものと考えられる33,35)(図5).
6.ヒトの免疫老化の制御にむけて
これまで述べた免疫老化に関する内容に関連して,現在,議論されている点や免疫老化を克服する試みについて述べる.
サイトメガロウイルスや老化T細胞は排除すべきか?:潜伏感染ウイルスが加齢にともなう免疫能の変容に影響するのはまちがいないであろう.ただ,サイトメガロウイルスの感染やその結果として分化した老化T細胞が免疫老化を促進するという報告がある一方,最近の研究においては否定的な報告もあいついでいる.なかでも,成人においてはむしろサイトメガロウイルスの感染者のほうがインフルエンザワクチンの効果が高いという報告は大きなインパクトをもたらした41).この結果は,個体が健康であるかぎりサイトメガロウイルスの感染はメリットとなりうることを示唆しており,むしろ,腸内細菌のように進化の過程で獲得した,免疫を賦活化する“共生生物”ととらえるべきではないかという解釈もなされている.
p38阻害剤:p38を介したシグナルはサイトカインの産生において重要であるため,さまざまな炎症性疾患に対してp38阻害剤の治験が実施された.長期の投与は肝毒性のため不可能であったが,細胞老化を阻害することにより懸念されたがんの発症率の上昇は認められていない.p38の阻害はPD-1の阻害との相加的な効果が報告されていることから39),とくにワクチンやがんの治療における一過性の免疫の賦活化を目的として,今後,検討される可能性がある34).
ラパマイシン:寿命の延長に効果があるとされるmTOR阻害剤であるラパマイシンを65歳以上の高齢者に投与することにより,末梢血中のヘルパーT細胞およびキラーT細胞におけるPD-1の陽性率が低下するとともに,インフルエンザウイルスに対するワクチンの効果が上昇するとの報告がなされている42).一方,ラパマイシンは臓器移植の際に免疫抑制剤として使用されていること,多くの細胞に対し多様な作用のあること,また,ヒトの末梢血中においてPD-1陽性の画分は濾胞T細胞を含むことなどから,ラパマイシンの標的となる細胞,使用条件,作用機序について,さらなる詳細な解析が待たれる.
おわりに
T細胞の老化は,胸腺の退縮にともなうT細胞の産生の低下,および,急性感染,慢性感染,潜伏感染に応答する過程において,生体の全体におけるホメオスタシスを生涯にわたり維持するために起こるある種の適応であるともいえ,適応が失敗したとき(適応しきれなくなったとき)に免疫系に不都合が起こり,ときに病態として現われるともとらえられる.いずれにせよ,末梢血というヒトからも入手しやすい材料のおかげで,T細胞の老化はマウスにくわえヒトにおいても分子レベルでの精力的な研究が進められている.しかしながら,これまでの知見はほとんど健常人の末梢血を用いて得られたものであり,たとえば,フレイルの状態にあるヒトでレパトアの狭小化などはみられないのか,また,コホート研究などを用いて,がんやさまざまな加齢関連疾患の発症するまえのT細胞の老化の状態はどうなっているのか,といった点を明らかにすることが必要であろう.これにより,ひとりひとりの免疫老化の状態を予測するバイオマーカーの同定も可能になると思われる.その一方で,末梢血中のT細胞は全身のT細胞のごく一部であり,多くのT細胞が存在する腸管や,近年,研究が進んできた感染の最前線で戦う組織常駐型メモリーT細胞の加齢による変化,また,老化したT細胞が具体的にどのように加齢関連疾患とかかわるのかに関しては,現在,ほとんど明らかにされていない.こうした組織レベルおよび個体レベルにおける解析やT細胞の老化の分子機構の解析においては,今後もマウスモデルが大きく貢献するであろう.こうして得られた知見は,免疫老化と加齢関連疾患の予防および治療,さらには,高齢者の免疫状態の特性にあったワクチン戦略の開発などに大きく貢献するものと期待される.
文 献
- Shanley, D. P., Aw, D., Manley, N. R. et al.: An evolutionary perspective on the mechanisms of immunosenescence. Trends Immunol., 30, 374-381 (2009)[PubMed]
- Palmer, D. B.: The effect of age on thymic function. Front. Immunol., 4, 316 (2013)[PubMed]
- Dooley, J. & Liston, A.: Molecular control over thymic involution: from cytokines and microRNA to aging and adipose tissue. Eur. J. Immunol., 42, 1073-1079 (2012)[PubMed]
- Chaudhry, M. S., Velardi, E., Malard, F. et al.: Immune reconstitution after allogeneic hematopoietic stem cell transplantation: time to T up the thymus. J. Immunol., 198, 40-46 (2017)[PubMed]
- Hamazaki, Y., Sekai, M. & Minato, N.: Medullary thymic epithelial stem cells: role in thymic epithelial cell maintenance and thymic involution. Immunol. Rev., 271, 38-55 (2016)[PubMed]
- Hamazaki, Y.: Adult thymic epithelial cell (TEC) progenitors and TEC stem cells: models and mechanisms for TEC development and maintenance. Eur. J. Immunol., 45, 2985-2993 (2015)[PubMed]
- Hamazaki, Y., Fujita, H., Kobayashi, T. et al.: Medullary thymic epithelial cells expressing Aire represent a unique lineage derived from cells expressing claudin. Nat. Immunol., 8, 304-311 (2007)[PubMed]
- Sekai, M., Hamazaki, Y. & Minato, N.: Medullary thymic epithelial stem cells maintain a functional thymus to ensure lifelong central T cell tolerance. Immunity, 41, 753-761 (2014)[PubMed] [新着論文レビュー]
- Goronzy, J. J., Li, G., Yang, Z. et al.: The janus head of T cell aging: autoimmunity and immunodeficiency. Front. Immunol., 4, 131 (2013)[PubMed]
- Jackson, M. L., Nelson, J. C., Weiss, N. S. et al.: Influenza vaccination and risk of community-acquired pneumonia in immunocompetent elderly people: a population-based, nested case-control study. Lancet, 372, 398-405 (2008)[PubMed]
- Goronzy, J. J. & Weyand, C. M.: Understanding immunosenescence to improve responses to vaccines. Nat. Immunol., 14, 428-436 (2013)[PubMed]
- Medzhitov, R.: Origin and physiological roles of inflammation. Nature, 454, 428-435 (2008)[PubMed]
- Cooper, G. S. & Stroehla, B. C.: The epidemiology of autoimmune diseases. Autoimmun. Rev., 2, 119-125 (2003)[PubMed]
- Li, G., Yu, M., Lee, W. W. et al.: Decline in miR-181a expression with age impairs T cell receptor sensitivity by increasing DUSP6 activity. Nat. Med., 18, 1518-1524 (2012)[PubMed]
- den Braber, I., Mugwagwa, T., Vrisekoop, N. et al.: Maintenance of peripheral naive T cells is sustained by thymus output in mice but not humans. Immunity, 36, 288-297 (2012)[PubMed]
- Sauce, D., Larsen, M., Fastenackels, S. et al.: Evidence of premature immune aging in patients thymectomized during early childhood. J. Clin. Invest., 119, 3070-3078 (2009)[PubMed]
- Appay, V., Sauce, D. & Prelog, M.: The role of the thymus in immunosenescence: lessons from the study of thymectomized individuals. Aging, 2, 78-81 (2010)[PubMed]
- van Gent, R., Schadenberg, A. W., Otto, S. A. et al.: Long-term restoration of the human T-cell compartment after thymectomy during infancy: a role for thymic regeneration? Blood, 118, 627-634 (2011)[PubMed]
- Dowling, M. R. & Hodgkin, P. D.: Why does the thymus involute? A selection-based hypothesis. Trends Immunol., 30, 295-300 (2009)[PubMed]
- Baccala, R. & Theofilopoulos, A. N.: The new paradigm of T-cell homeostatic proliferation-induced autoimmunity. Trends Immunol., 26, 5-8 (2005)[PubMed]
- Goronzy, J. J. & Weyand, C. M.: Immune aging and autoimmunity. Cell. Mol. Life Sci., 69, 1615-1623 (2012)[PubMed]
- Sprent, J. & Surh, C. D.: Normal T cell homeostasis: the conversion of naive cells into memory-phenotype cells. Nat. Immunol., 12, 478-484 (2011)[PubMed]
- Van Kaer, L.: Innate and virtual memory T cells in man. Eur. J. Immunol., 45, 1916-1920 (2015)[PubMed]
- Nikolich-Zugich, J.: Aging of the T cell compartment in mice and humans: from no naive expectations to foggy memories. J. Immunol., 193, 2622-2629 (2014)[PubMed]
- Lages, C. S., Suffia, I., Velilla, P. A. et al.: Functional regulatory T cells accumulate in aged hosts and promote chronic infectious disease reactivation. J. Immunol., 181, 1835-1848 (2008)[PubMed]
- Shimatani, K., Nakashima, Y., Hattori, M. et al.: PD-1+ memory phenotype CD4+ T cells expressing C/EBPα underlie T cell immunodepression in senescence and leukemia. Proc. Natl. Acad. Sci. USA, 106, 15807-15812 (2009)[PubMed]
- Tahir, S., Fukushima, Y., Sakamoto, K. et al.: A CD153+CD4+ T follicular cell population with cell-senescence features plays a crucial role in lupus pathogenesis via osteopontin production. J. Immunol., 194, 5725-5735 (2015)[PubMed]
- Sakamoto, K., Fukushima, Y., Ito, K. et al.: Osteopontin in spontaneous germinal centers inhibits apoptotic cell engulfment and promotes anti-nuclear antibody production in lupus-prone mice. J. Immunol., 197, 2177-2186 (2016)[PubMed]
- Kuwahara, M., Suzuki, J., Tofukuji, S. et al.: The Menin-Bach2 axis is critical for regulating CD4 T-cell senescence and cytokine homeostasis. Nat. Commun., 5, 3555 (2014)[PubMed]
- Sato, K., Kato, A., Sekai, M. et al.: Physiologic thymic involution underlies age-dependent accumulation of senescence-associated CD4+ T cells. J. Immunol., 199, 138-148 (2017)[PubMed]
- Shirakawa, K., Yan, X., Shinmura, K. et al.: Obesity accelerates T cell senescence in murine visceral adipose tissue. J. Clin. Invest., 126, 4626-4639 (2016)[PubMed]
- Kato, A., Takaori-Kondo, A., Minato, N. et al.: CXCR3high CD8+ T cells with naive phenotype and high capacity for interferon-γ production are generated during homeostatic T-cell proliferation. Eur. J. Immunol., 48, 1663-1678 (2018)[PubMed]
- Akbar, A. N. & Henson, S. M.: Are senescence and exhaustion intertwined or unrelated processes that compromise immunity? Nat. Rev. Immunol., 11, 289-295 (2011)[PubMed]
- Akbar, A. N., Henson, S. M. & Lanna, A.: Senescence of T lymphocytes: implications for enhancing human immunity. Trends Immunol., 37, 866-876 (2016)[PubMed]
- Schurich, A. & Henson, S. M.: The many unknowns concerning the bioenergetics of exhaustion and senescence during chronic viral infection. Front. Immunol., 5, 468 (2014)[PubMed]
- Nikolich-Zugich, J.: Ageing and life-long maintenance of T-cell subsets in the face of latent persistent infections. Nat. Rev. Immunol., 8, 512-522 (2008)[PubMed]
- Lanna, A., Henson, S. M., Escors, D. et al.: The kinase p38 activated by the metabolic regulator AMPK and scaffold TAB1 drives the senescence of human T cells. Nat. Immunol., 15, 965-972 (2014)[PubMed]
- Di Mitri, D., Azevedo, R. I., Henson, S. M. et al.: Reversible senescence in human CD4+CD45RA+CD27- memory T cells. J. Immunol., 187, 2093-2100 (2011)[PubMed]
- Henson, S. M., Macaulay, R., Riddell, N. E. et al.: Blockade of PD-1 or p38 MAP kinase signaling enhances senescent human CD8+ T-cell proliferation by distinct pathways. Eur. J. Immunol., 45, 1441-1451 (2015)[PubMed]
- Lanna, A., Gomes, D. C., Muller-Durovic, B. et al.: A sestrin-dependent Erk-Jnk-p38 MAPK activation complex inhibits immunity during aging. Nat. Immunol., 18, 354-363 (2017)[PubMed]
- Furman, D., Jojic, V., Sharma, S. et al.: Cytomegalovirus infection enhances the immune response to influenza. Sci. Transl. Med., 7, 281ra243 (2015)[PubMed]
- Mannick, J. B., Del Giudice, G., Lattanzi, M. et al.: mTOR inhibition improves immune function in the elderly. Sci. Transl. Med., 6, 268ra179 (2014)[PubMed]
著者プロフィール
略歴:2003年 京都大学大学院医学研究科にて博士号取得,同年 同 助教,2010年 同 准教授を経て,2017年より京都大学iPS細胞研究所 教授.
研究テーマ:免疫細胞および免疫関連組織(おもに,T細胞および胸腺)の発生と機能,免疫老化.
研究室URL:http://www.cira.kyoto-u.ac.jp/hmy/
湊 長博(Nagahiro Minato)
京都大学 理事・副学長.
© 2018 濵﨑洋子・湊 長博 Licensed under CC 表示 2.1 日本