被子植物における自他の花粉の識別システムおよびその進化の動態
2018/08/30
藤井壮太・高山誠司
(東京大学大学院農学生命科学研究科 応用生命化学専攻生物有機化学研究室)
email:藤井壮太,高山誠司
領域融合レビュー, 7, e006 (2018) DOI: 10.7875/leading.author.7.e006
Sota Fujii & Seiji Takayama: Self/non-self discrimination systems in angiosperms and their evolutionary dynamics.

多くの被子植物はなんらかの手段により自己と非自己とを識別し,交配の相手として非自己を選択する.これは短期的には自殖劣勢を回避する意味あいがあり,長期的には集団の多様性を維持する効果があると考えられている.この研究分野においては,1990年代から最近にいたるまで,自己と非自己を識別する分子機構について多くの報告がなされてきた.その結果,植物は進化の過程において自己と非自己とを識別する分子機構の獲得と損失をくり返してきたことが明らかにされた.このレビューにおいては,植物がどのようにして多様な生殖システムを形成するにいたったのか,この研究分野における議論の経緯や,近年,解明されてきた分子機構をもとに解説する.そして,この研究分野における進化の動態モデルの重要性や,残された重要な課題および将来の展開について述べる.
動物の細胞において自他の識別は重要であり,細菌など非自己が侵入してきた場合にはこれを攻撃する一方,自己の細胞は標的としない.一方,被子植物が生殖の場において自他を厳密に識別することも,19世紀から知られていた(他家受粉の動画,および,自家受粉の動画 を参照されたい).そのしくみは“自家不和合性”とよばれ,地球上の40%以上の種,あるいは,100以上の科において発見されてきた1).自家不和合性は両性花の植物においてみられる性質であり,雌しべにおける自己の花粉による受精,すなわち,自殖がさまたげられる現象の総称である.この現象により結果的に,異なる個体に由来する精細胞と卵細胞による受精,つまり,他殖が促進される.
それでは,なぜ植物はこのようなしくみをもつのか? のちほど,自家不和合性の分子機構について解説するが,この疑問は,なぜその状態にいたったのかを理解するうえで重要である.そして,その結論を述べるまえに,生物の集団における遺伝的な多様性の動力学について解説する.たとえば,ある世代において複数の対立遺伝子が同じ頻度で存在したとして,無作為の抽出によりつぎの世代へ子孫を残すという作業がくり返されるとする.ランダムな選抜の過程において対立遺伝子が同じ頻度で維持されることはなく,機会的にどちらかが失われうる.この効果は,遺伝的浮動とよばれている.
つぎに,自然選択の効果がある.たとえば,生存や子孫の繁殖のために不利な遺伝子は負の選択の効果により集団から除かれる.一方,まれに有利な変異の生じることがあり,そのような対立遺伝子は正の選択の効果により集団において頻度が高まる.集団において有利な変異がすばやく固定にむかう場合,その周辺の遺伝的な多様性が低下する選択一掃という現象が起こる.そして,平衡選択は2つ以上の対立遺伝子が長期間にわたり維持される効果である.そのひとつは,負の頻度に依存した選択であり,対立遺伝子のマイノリティが有利となる場合である.たとえば一般的に,捕食者は1種類の獲物に狙いをさだめるため,被食者の体色の多様性は負の頻度に依存した選択のもとにあるといわれている.植物の自家不和合性は,対立遺伝子のタイプが異なる相手とのみ子孫を残すという制約を課すしくみである.したがって,ある対立遺伝子が機会的に少なくなった場合,交配の相手が増加する有利性が生じるため,負の頻度に依存した選択の典型例として知られている.
自殖によりヘテロ性が低下し,集団の遺伝的な多様性は維持されづらくなる.一方,自家不和合性は他殖を強制することにより,集団における遺伝的な多様性を長期間にわたり維持する機能をもつ.遺伝的な多様性の高い集団は環境の変動に対応する遺伝子のプールが大きく,種の寿命が長いと考えられている.その一方,自殖のみの種はいわゆる進化の袋小路におちいったと考えられてきており,絶滅の可能性が高いと考えられてきた1).さらに,短期的には自殖劣勢が自家不和合性を維持する駆動力となる.自殖劣勢は近親交配による不利な有伝子の蓄積によりひき起こされ,個体は適応度の低い子孫のためにリソースを割くことになる.その一方,当然ながら自殖にも有利な点が多い.ダーウィンが考察したように,自殖により昆虫や風など不確定な花粉の媒介者の力を借りずに確実に子孫を残せるため繁殖が保証される.あるいは,自殖は他殖と比較して次世代への遺伝子の伝達の効率が2倍になるという考察もある.さらに,自家和合の状態においては集団のすべての個体と交配が可能になる有利性があり,自家不和合の状態においてはその恩恵は得られない2).このように,自家不和合性は分子認識により制御される一方,繁殖をめぐるトレードオフのなかで成立している.そのため,ミクロの分子生化学とマクロの進化生態学とを連結する格好の研究テーマともなっている.
自家不和合性は花粉因子および雌しべ因子の2つの多型性の遺伝子により決定される.多くの場合,花粉因子および雌しべ因子はS遺伝子座とよばれる1つの座位にセットになってコードされている.すなわち,花粉因子あるいは雌しべ因子をコードする遺伝子が連鎖して多様なSハプロタイプ(S1,S2,…,Sn)を形成する.古くから,受粉のときに出会った花粉因子と雌しべ因子とが同一のSハプロタイプに由来するかどうかで自他が識別されると推察されていた.自家不和合性の分子機構は分類学上の科のレベルでおおむね共有されている.現在,被子植物の3つのタイプ,アブラナ科,ナス科・バラ科・オオバコ科,ケシ科における自家不和合性の分子機構が比較的よく理解されており,実証が進んでいる.このレビューにおいては,アブラナ科,および,ナス科・バラ科・オオバコ科について詳細を述べる.ケシ科については他書3) を参照されたい.
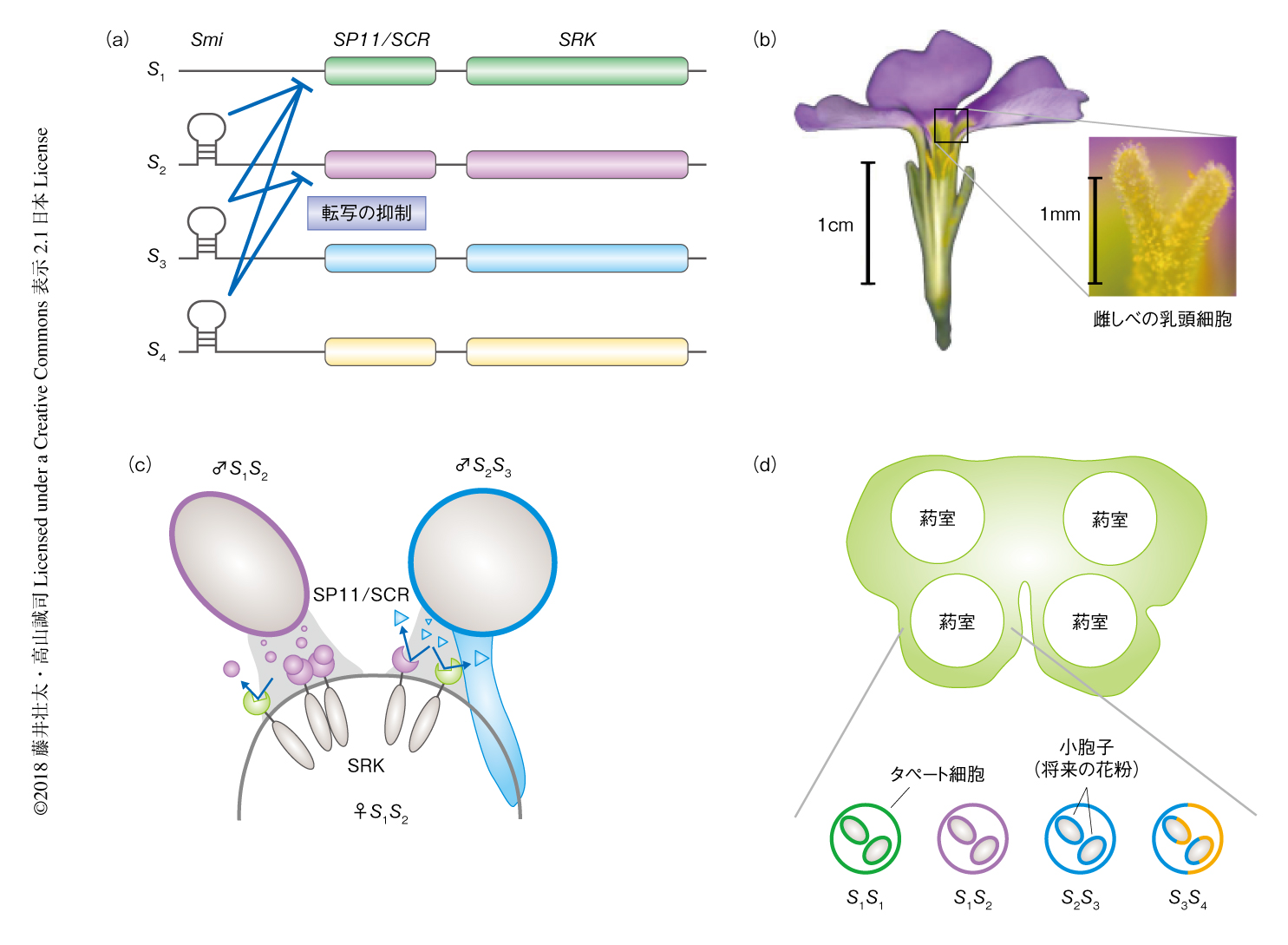
アブラナ科植物は地中海域を中心に世界中に広く分布する.ナタネ,ハクサイ,キャベツ,ダイコンなどの作物種を含むほか,モデル植物であるシロイヌナズナもここに分類される.ゲノムの大きさはコンパクトであり,もっとも分子生物学が適応しやすい植物である.アブラナ科においては,花粉側のSP11遺伝子(SCR遺伝子ともよばれる)と,雌しべ側のSRK遺伝子により自家不和合性が決定される(図1a).SP11/SCRは葯のタペート細胞において産生される分泌型のタンパク質であり,花粉の成熟にともないタペート細胞から花粉の表面へと移行する.一方,SRKは雌しべの先端にある乳頭細胞の細胞膜に局在する受容体型キナーゼである.アブラナ科植物の雌しべの先端にある乳頭細胞はワックス層におおわれたdry stigmaとよばれ,雌しべが水分を供給することにより花粉が発芽する(図1b).同一のSハプロタイプにコードされたSP11/SCRとSRKが特異的かつ直接的に結合することにより自己認識による自他の識別が可能になる4)(図1c).Brassica属においては,100種類にもおよぶSハプロタイプの存在が予測されている.
このアブラナ科のシステムにおいては,優劣性ヒエラルキーとよばれる遺伝的な制御が知られている.被子植物は2倍体であるため,多くの個体は2種類のSP11/SCR遺伝子をもつ.一方,Sハプロタイプのあいだに優劣性が存在する場合,葯のタペート細胞においてそのうち1種類のmRNAのみが発現し,花粉は抑制されるほうのSP11/SCRはもたない(図1d).この抑制には優性側のSハプロタイプより産生される小分子RNAがかかわる.Brassica属においては,24塩基からなる小分子RNAであるSmiあるいはSmi2の作用により劣性側の転写制御領域はDNAメチル化をうけ転写が抑制される5)(新着論文レビュー でも掲載).さらに,優劣性には多段階かつ線形の関係のあることがわかっている6,7).最上位は自己のほかすべてのクラスのSハプロタイプの発現を抑制する一方,最下位はホモ接合体においてはじめてSP11/SCR遺伝子を発現する.なぜこのようなヒエラルキーが形成されたのかについては不明な点が多い.2種類のSP11/SCRを同時に発現してしまうと,自己のみならず2種類のSRKのいずれかをもつ個体とはすべて不和合になってしまう.したがって,Sハプロタイプの数が少ない場合など,集団において交配の可能な相手が限定された状況においてこのような優劣性が有利にはたらくと推察される.なお,アブラナ科においては雌しべ因子であるSRKにもSハプロタイプのあいだの優劣性が知られており8,9),その分子機構は花粉因子とは異なり転写レベルでの制御ではないことが示唆されているが,詳細は不明である.
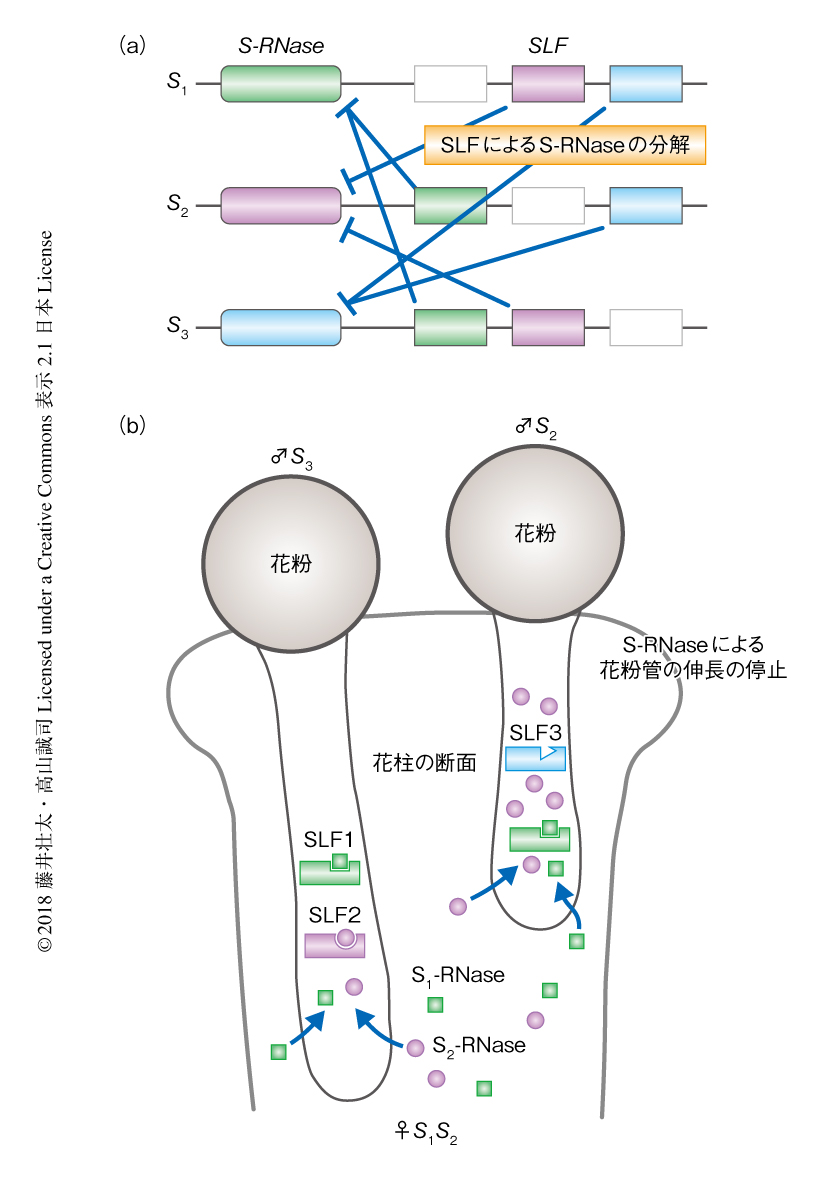
ナス科植物は南米を中心に世界各地でみられる.自家不和合性の研究モデルとしての歴史は古く,Nicotiana属,Solanum属,Petunia属を中心に,分子生物学的な研究が進められてきた.雌しべ因子はS-RNaseとよばれる糖タンパク質である(図2a).ナス科の雌しべはアブラナ科とは異なりwet stigmaとよばれており,柱頭は分泌物にみちている(図3).S-RNaseにはRNAを分解する活性があり,花柱に侵入する花粉管に対し毒性を発揮する10).S-RNaseは花柱のマトリクスとよばれる細胞外の空間に1 cm3あたり0.25~1.0 mgの単位で蓄積する.一方で,花粉管は無防備ではなく,SLFとよばれる花粉因子により対抗する11)(図2a).SLFはFボックスドメインをもち,ユビキチンリガーゼ複合体の基質認識サブユニットとして機能する.このユビキチンリガーゼがS-RNaseをユビキチン化し,プロテアソームにより分解している可能性が考えられる.その結果,花粉管はS-RNaseを取り込んで不活性化しながら伸長し,さながら毒の海をわたるようにして胚珠との受精にいたる(図2b).
SLFとS-RNaseを主役とするこの自家不和合性システムは,協調的な非自己の認識モデルとよばれている12)(新着論文レビュー でも掲載).Petunia属においては1つのSハプロタイプが複数のSLF遺伝子をコードする.1つのSLFのタイプはそれぞれいくつかのS-RNaseを特異的に分解する.シミュレーションによると,かりに集団に40種類の異なるS-RNaseが存在したとしても,16~20種類のSLF遺伝子があればそのすべてが分解されると推測されている13).実際,ひとつのSハプロタイプからはその予測とほぼ合致した数のSLFのタイプが見い出されている12,13).さらに,おのおののSLFはいずれも自己のS-RNaseを分解する活性をもたず,自己認識を回避している.これは,SLFにアミノ酸変異が起こることや,対応する遺伝子が欠損することにより可能になっている.結果として,ひとつのSハプロタイプは自己を除くすべてと受精する.
実験的な確証は少ないが,Prunus属を除くバラ科植物やオオバコ科植物も,ナス科植物と同じくS-RNaseおよびSLFを用いた非自己認識型の自家不和合性を採用していると考えられている14).したがって,双子葉類の共通祖先はこの非自己認識型の自家不和合性を用いていた可能性がある13,15).実際に,分子系統解析からはナス科,バラ科,オオバコ科のS-RNase遺伝子およびSLF遺伝子はそれぞれ単一起源であることが支持されている13).非自己認識型の自家不和合性の分子機構や進化の動態に関しては,日本語総説16) にくわしい.
アブラナ科のシステムにおいては,SP11/SCR遺伝子とSRK遺伝子は共進化の関係にあり,同一のSハプロタイプに由来するものが系統樹において対応した位置にある17).SP11/SCR遺伝子とSRK遺伝子は長い進化の期間にわたりセットで遺伝しており,変異を蓄積した時期が同期していると考えられる.一方,ナス科のシステムにおいて,SLF遺伝子とS-RNase遺伝子のあいだにそのような対応関係はみられない.たとえば,SLF1遺伝子は複数のSハプロタイプにおいてアミノ酸配列のレベルで100%の相同性をもつものがみつかっている12).それ以外のタイプについても,相同性が高いものが複数のSハプロタイプのあいだで共有されている13).このことから,明らかに最近になり遺伝子変換などによりSLF遺伝子が複数のSハプロタイプに広まったと考えられ,非自己認識型の自家不和合性システムの特徴であると考えられている.
理論上,最小で2つのSハプロタイプがあれば自他の識別による生殖システムは構築される.サクラソウ科,アマ科,タデ科などでみられる異形花型の自家不和合性はその実例である1).しかし,これまで述べてきたように,被子植物の自家不和合性はときとして100種類のSハプロタイプにまでおよぶ巨大な生殖システムにふくれあがっている.Sハプロタイプはどのようにして増えたのか,どのようにして複雑化したのかは,生物の進化を問ううえで非常に重要な疑問である一方,多くの研究者を悩ませてきた.
自家不和合性が多様化する過程を考察するうえでは,その中間状態が重要であると考えられてきた.遺伝的浮動の効果のもとでは新しい変異は有利でないかぎりすぐに淘汰されてしまう.不利ならばさらに迅速に淘汰されるはずである.したがって,議論の的は中間状態が安定するにはどのような条件が必要なのか,という点にしぼられる.
以前の研究においては,中間状態が自家和合であるという可能性が考えられてきた.進化生物学では変異が2つの遺伝子に同時に起こる可能性はほぼ皆無であるとされている18,19).アブラナ科のシステムを例にとると,まずはSP11/SCRあるいはSRKのどちらか一方が新しい認識特異性を獲得しなければならない.すると,中間状態はSP11/SCRとSRKの認識特異性が適合していない状態になり,いったん自家和合性を経由すると考えられる.その前提にしたがうと,自殖劣勢や自殖率などといった係数が重要と考えられる.たとえば,自殖劣勢は自家和合性へのペナルティとなり,中間状態が不安定となる一因である.自殖劣勢が高ければそのペナルティはより強化されるが,低い場合はさほど問題にならない.自殖劣勢の程度は当該の環境において適応度の低下をひき起こす遺伝子がどれほど蓄積しているかに依存するし,自殖率も花粉の媒介者と花の構造との関係により集団のあいだで異なると考えられる.したがって,これらのペナルティ係数による不利性と,集団のどの個体とも交配するという自家和合性の有利性とのあいだで均衡が保たれる条件が数理生物学的に探索されてきた20).いい換えれば,新しいタイプが誕生するうえで望ましい環境条件,すなわち,集団あるいは気候が存在し,それが整ったとき,自家不和合性が進化するという点がこれまでの議論の中心であった.
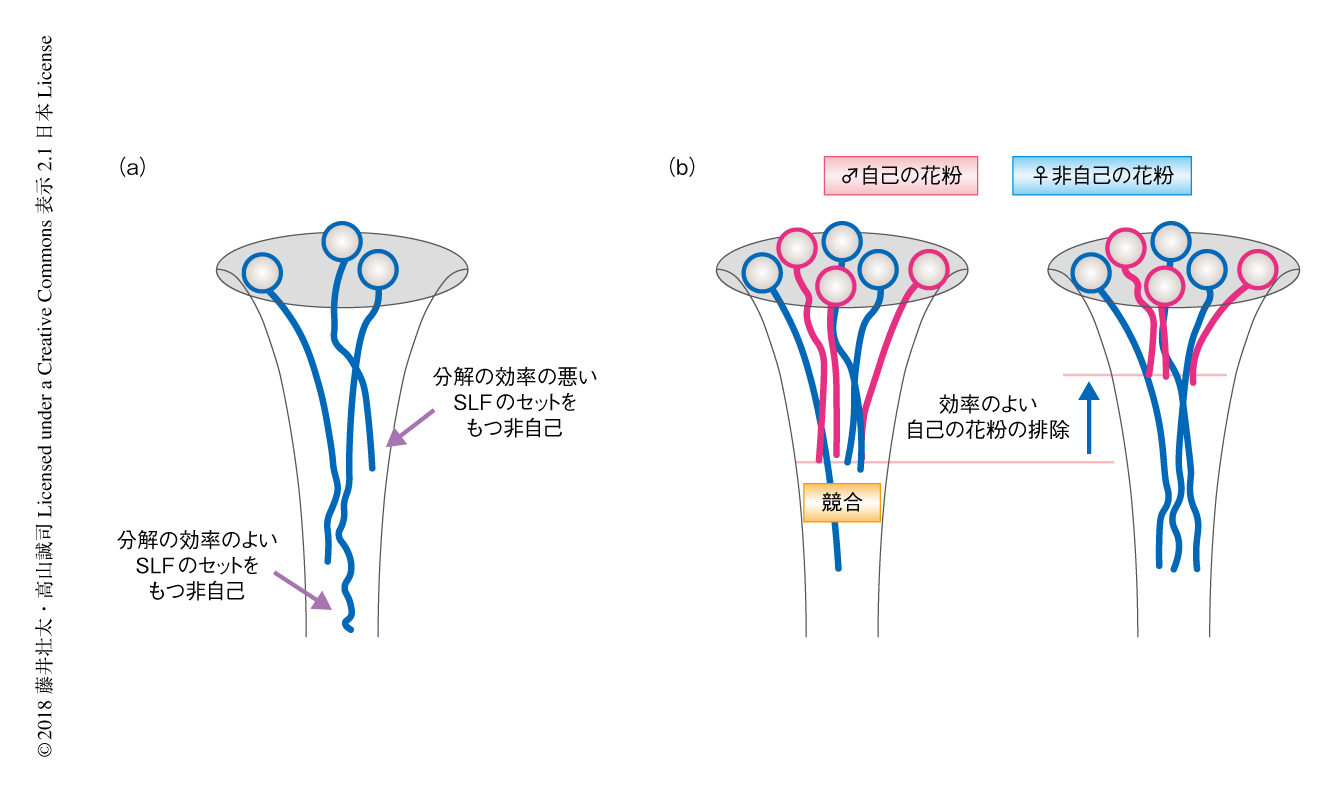
その一方で,これまでの論議においては,基本的にどのSハプロタイプも同じように自己の花粉を排除し,機能を失うと自家和合になるという,1か0かの,いわば定性的なとらえ方がなされてきた.そして,量的な効果が分子進化におよぼす役割についてはあまり考察されていなかった.たとえば,ナス科のシステムについて考えてみると,S-RNaseに対しより分解の効率のよいSLFのセットをもつ花粉が優先的に受精すると推測される.したがって,この“優秀な”SLFのセットをもつSハプロタイプは有利であると考えられる(図4a).SLF遺伝子には最近になり分岐したような分子進化の形跡がみられることをさきに述べたが13),これは,有利なSLF遺伝子が集団においてほかの対立遺伝子を駆逐する選択一掃のようにすばやく広まったためと考えられ,強い正の選択圧がかかっているのではないかと推測される.このように,同じ認識特異性をもつSハプロタイプでも,ニッチにおいてより有利な変異をもつものが性淘汰により数を増やすことが考えられる.
自殖が不利な環境条件においては,雌しべはよりすばやく特異的に“望ましくない自己の花粉”を排除したほうが有利である21)(図4b).これは雌しべにおいて花粉管が通過する空間がかぎられていることから合理的であり,排除が遅れるとそのぶん“望ましい非自己の花粉”と受精する確率が低下する.したがって,ナス科のシステムを例にとると,自殖が抑制される条件においては単に自己の花粉を排除するだけではなく,効率よく自己の花粉を排除するS-RNaseが選択されやすいと考えられる.今後は,理論モデルのみではなく,SLFやS-RNaseの機能効率の差を実験的に検証することが重要であると考えられる.
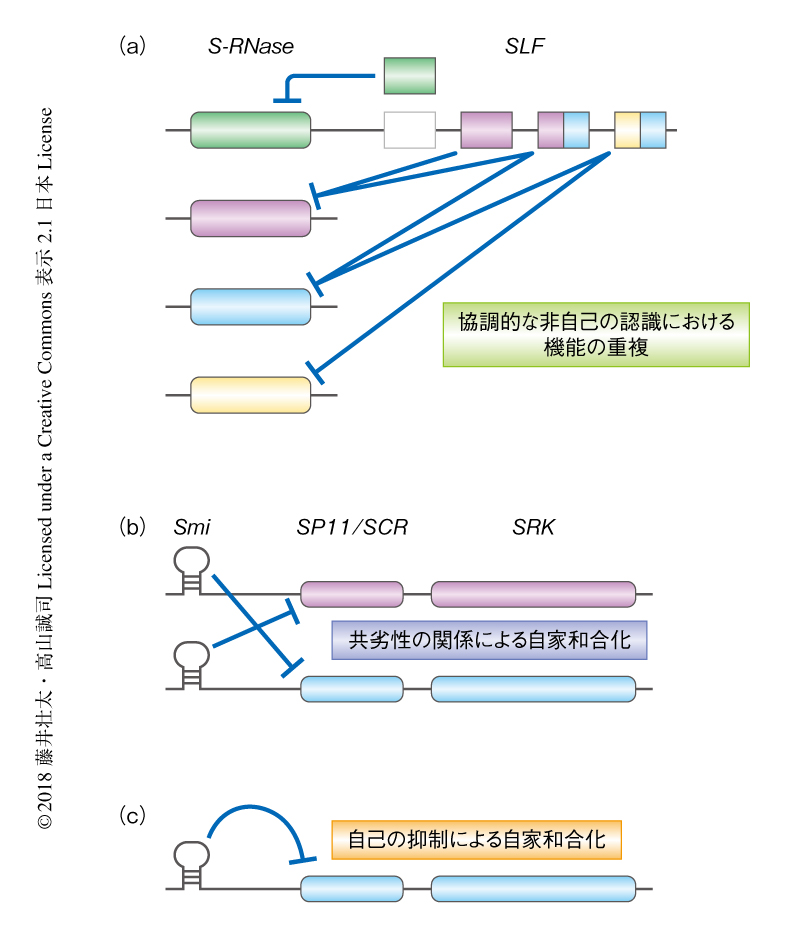
SLFはそれぞれが複数のS-RNaseを認識して分解するが,そのカバーする範囲はしばしばオーバーラップする12,13,22)(図5a).実際に,SLF遺伝子は比較的最近になり遺伝子重複,欠損,遺伝子変換を経験している13).機能の重複により個々のSLF遺伝子にかかる純化選択は軽減されており,新しい基質認識性を獲得しやすいのではないかと考えられる.
筆者らは,実際に,この考えをもとにシミュレーションモデルを作成し,SLF遺伝子とS-RNaseのどちらがさきに進化するのかを考察した15).さらに,SLF遺伝子は遺伝子変換により集団において広まることを考慮した.その結果,予測どおり,新しい特異性をもつSLF遺伝子がさきに集団に広まり,そののち,対応するS-RNaseが進化するようすが観察された.毒より解毒剤のほうがさきに広まるというと奇妙に思えるかもしれない.しかしこの場合,S-RNaseがどのSLFにも分解されなくなるとすべての花粉が排除されてしまい,交配の相手が減少するため不利である.最近,ほかの研究グループも,同じナス科のシステムについてSLF遺伝子とS-RNase遺伝子の進化の順番および自殖劣勢係数を考慮した数理モデルを構築しており23),この議論に対する国際的な注目があつまっている.
アブラナ科の自家不和合性はSP11/SCRとSRKによる自己認識システムであり,ナス科の非自己認識システムとは進化の動態は異なる.まず,古くから考えられてきたように,SP11/SCRとSRKの関係がいったん解消され,どちらかが新しい認識特異性を獲得する経路が考えられる.一方,キメラ実験により,SP11/SCRが2つのSハプロタイプとしての認識特異性をあわせもつことが可能であるとされた24,25).さらにこの場合,SP11/SCRとSRKとの特異的な結合によるものか,キメラのSP11/SCRの安定性によるものかは不明であるが,部分的な,あるいは,弱い自家不和合性を発現する例も知られている.SP11/SCRとSRKとの部分的な結合性を考慮すると,新しいSハプロタイプが進化する条件は以前考えられていたもの20) よりも,広い多次元空間であることが考えられる.SP11/SCRとSRKの結合性のさらなる実験データや,定量性をモデルに組み込んだ進化理論的な研究への展開が期待される.
アブラナ科においてはSP11/SCR遺伝子あるいはSRK遺伝子のどちらか,ナス科においてはS-RNase遺伝子が破壊されると自家和合性を獲得する.遺伝子は特定の塩基が連続して結合することによりはじめて意味のある配列として成立するため,ランダムに欠損や挿入を導入してそれを破壊するのは簡単である.しかし,いちど破壊された遺伝子が機能をとりもどすことは容易ではなく,一般に起こりえないとされている.このように,いったん遺伝子が破壊されて自家和合性を獲得してから自家不和合性を復興するのはむずかしく,自家和合性は不可逆的に進化の袋小路につながると考えられてきた.実際,シロイヌナズナのような自植性のモデル植物においては,最終氷河期において自家不和合性の共通祖先からどのようにして自家和合性が適応進化し,どのように変異が広まったのかについての詳細が調べられている2,26).
集団においてはそれぞれの個体が自身のリソースを自殖と他殖に割りあてる必要があるが,その最適な配分は環境条件により決定されると考えられる.一方,自家不和合性は以前に考えられていたよりも柔軟に制御されていることが近年の分子モデルからわかってきた.たとえば,ナス科のシステムにおいては,自己のS-RNaseを分解するSLFが進化すれば,そのSハプロタイプは自家和合化する(図5a).この場合,どの遺伝子も機能を維持したままであり,自己認識するSLFが欠失すれば自家不和合性も簡単に回復する.実際,遺伝子変換により自己のS-RNaseを抑制するSLFを獲得することにより自家和合化したと推察されるペチュニアも野外で発見されており13,27),このような変異はまれではないと考えられる.
アブラナ科のシステムの場合,SP11/SCR遺伝子とSRK遺伝子との関係だけではこのような経路は生じないが,優劣性にかかわる小分子RNAであるSmiやSmi2が介在することで可能になる(図5 b, c).とくに,Smi2は塩基配列に依存してヒエラルキーが下位のSP11/SCR遺伝子のプロモーターの配列をDNAメチル化する6).これは,少しの塩基置換により自己のものも標的にするしくみである.一般的に,miRNAは既存の塩基配列を鋳型として逆位反復配列が生じることで進化すると考えられている28).すると,SmiやSmi2の進化初期の状態は自己のSP11/SCR遺伝子のプロモーターを抑制していたのではないかと推察される(図5c).また,アブラナ科の自家不和合性のSハプロタイプのあいだには,それぞれ単独では自家不和合性を発揮するが,ヘテロになると互いの発現を抑制しあう共劣性の関係もときおり存在する29)(図5b).このような関係が野外でどれほど普遍的に分布しているのかは,今後,検証していく必要があろう.さらに,雌しべ側でもSハプロタイプのあいだの優劣性が知られていることから8,9),こうした優劣性の発現の機構が進化にどのようにかかわるのかについても,今後,さらに解明が進むと期待される.
進化の過程において大きな構成の変動が起こった自家不和合性の集団の例も多く知られている.アブラナ科のBrassica属とArabidopsis属とではSハプロタイプの数に大きな違いはないが,Brassica属ではSRKのアミノ酸配列の多様性が低いことが知られている30).ナス科のLycium属は南米および旧世界に分布するが,アフリカの種からは南米の種にみられる多様なS-RNase遺伝子のタイプのうち一部のみが発見されている31).同様のパターンが同じくナス科のPhysalis属においても見い出されていて,Solanum属のもつ一部のSハプロタイプのみがPhysalis属においてみつかっている32).これらの種においては過去の環境の変動や地理的な隔離などの要因によりSハプロタイプの数が激減し,その遺伝的なボトルネックののち正の選択により多様化したと推測されている.更新世における氷期と間氷期のサイクルにみられるように,地球の環境はたえず変動している.たとえば,氷期においては昆虫など花粉の媒介者の数が減少し自殖に有利な条件にかたよると考えられる2).気候の変動により他殖と自殖の有利性が変化するなかで,植物の多様な自家不和合性の形態が生じてきたと思われる.
自家不和合性は高温や多湿により打破されやすく,古くから,これらの条件において人工的に自家受精して種子を得る方法が検討されてきた33).アブラナ科の作物においてはビニールハウスのCO2の濃度を5%まで増加させることにより自家不和合性が弱化される.多くの植物種に共通であるが,自家不和合性は開花の当日がもっとも強いため,開花のまえに自家受粉することにより種子を得ることも可能である34).また,老化によっても自殖により種子が得られる確率が高くなる35).これらの現象の解明は育種学的に重要であるが,その分子機構や生理学的な意義は不明であり,今後,さらに解明を進める必要がある.自家不和合性の強度にかかわる量的形質遺伝子座も探索されており36),S遺伝子座の領域にあるという例もある37).このようなケースでは,SP11/SCRとSRKとの結合の特性が表現型を決定する可能性も考えられる.一方で,自家不和合性の強度は自殖と他殖のリソースの配分に関係するため,適応的な進化である可能性も考えられる.
自家不和合性は花粉をあえて排除するシステムであるという点でユニークである.その一方で,植物においてはほかの種の花粉を排除する種間不和合性もよく知られている38).種間不和合性は一般に2つの異なる機構,不一致性と不和合性にさらに分解されると考えられている.不一致性は2つの種が進化の過程で分岐したのち,受精するために必要な花粉因子と雌しべ因子とのあいだに独自の遺伝的な変異が蓄積することにより生じる.花粉因子と雌しべ因子とが合致せず相互作用しなくなっているようなケースである.たとえば,雌しべの助細胞における花粉管誘導タンパク質であるLURE1と,花粉管側の受容体であるPRK6とのあいだには,そのような種に特異的な関係がある39)(新着論文レビュー でも掲載).
一方で,ほかの種の花粉を積極的に排除する不和合性の機構も存在するのではないかと推察されてきた.その根拠がSI×SCルールである.多くの科に共通していえることであるが,自家和合(self-compatible:SC)種の雌しべは自家不和合(self-incompatible:SI)種の花粉を受け入れるのに対し,その逆においては花粉管の侵入がみられない40).このような関係は一側性の不和合性とよばれており,自家不和合性の種間不和合性へのかかわりを示す根拠とされていた.種間不和合性の分子機構に関する多くの仮説は自家不和合性のS遺伝子座がかかわることが前提とされており,実際,近年になり見い出されてきた因子もS遺伝子にかかわるものが多い.たとえば,ナス科においてはS-RNaseがほかの種の花粉管の排除にかかわる例が明らかにされた41).さらに,自家和合種の花粉管が自家不和合種の雌しべに侵入しない原因が,SLFの欠損や,SLFと複合体を形成するCUL1の欠損により説明される例もみつかってきた42,43).最近,アブラナ科において,日本の集団とトルコの集団とのあいだの不和合性が,重複により生じたS遺伝子座によりひき起こされることが明らかにされた44)(新着論文レビュー でも掲載).このように,自家不和合性と種間不和合性とのあいだに直接的な関係のあるケースも多い.
自家不和合性はなんども並行進化してきており,そのたびに異なる因子を採用した新たな分子機構が形成されてきた.イネ科,ヒルガオ科,キク科など,責任因子が近いうちに同定されそうな例は数多くあり,研究の発展が期待される.さらに,自家不和合性の進化の動態の原理についても再議論がはじまったばかりである.因子の実態が明らかにされてきたことで,これまで考えられてきた以上に自家不和合性が流動的であることがわかってきた.理論と実験とが深く結びついたアプローチによりダーウィンの時代からとなえられてきた仮説を見直し,自家不和合性の進化生物学的な価値を問い直す必要があると考えられる.塩基配列の決定技術の発展によりフィールドの試料から大量のデータを得ることも可能になってきた.分子の相互作用がどのようにして現実の世界で躍動しているのかを理解するのはこれからである.
略歴:2009年 東北大学大学院農学研究科 修了,同年 オーストラリアWestern Australia大学 博士研究員.2011年 京都大学大学院理学研究科 研究員,2014年 奈良先端科学技術大学院大学バイオサイエンス研究科 助教を経て,2017年より東京大学大学院農学生命科学研究科 助教.2016年より科学技術振興機構さきがけ研究者 兼任.
抱負:生物多様性の誕生,維持,喪失にかかわる分子を同定し,その理屈について納得したい.
高山 誠司(Seiji Takayama)
東京大学大学院農学生命科学研究科 教授.
研究室URL:http://park.itc.u-tokyo.ac.jp/seiyu/
© 2018 藤井壮太・高山誠司 Licensed under CC 表示 2.1 日本
(東京大学大学院農学生命科学研究科 応用生命化学専攻生物有機化学研究室)
email:藤井壮太,高山誠司
領域融合レビュー, 7, e006 (2018) DOI: 10.7875/leading.author.7.e006
Sota Fujii & Seiji Takayama: Self/non-self discrimination systems in angiosperms and their evolutionary dynamics.
要 約
多くの被子植物はなんらかの手段により自己と非自己とを識別し,交配の相手として非自己を選択する.これは短期的には自殖劣勢を回避する意味あいがあり,長期的には集団の多様性を維持する効果があると考えられている.この研究分野においては,1990年代から最近にいたるまで,自己と非自己を識別する分子機構について多くの報告がなされてきた.その結果,植物は進化の過程において自己と非自己とを識別する分子機構の獲得と損失をくり返してきたことが明らかにされた.このレビューにおいては,植物がどのようにして多様な生殖システムを形成するにいたったのか,この研究分野における議論の経緯や,近年,解明されてきた分子機構をもとに解説する.そして,この研究分野における進化の動態モデルの重要性や,残された重要な課題および将来の展開について述べる.
はじめに
動物の細胞において自他の識別は重要であり,細菌など非自己が侵入してきた場合にはこれを攻撃する一方,自己の細胞は標的としない.一方,被子植物が生殖の場において自他を厳密に識別することも,19世紀から知られていた(他家受粉の動画,および,自家受粉の動画 を参照されたい).そのしくみは“自家不和合性”とよばれ,地球上の40%以上の種,あるいは,100以上の科において発見されてきた1).自家不和合性は両性花の植物においてみられる性質であり,雌しべにおける自己の花粉による受精,すなわち,自殖がさまたげられる現象の総称である.この現象により結果的に,異なる個体に由来する精細胞と卵細胞による受精,つまり,他殖が促進される.
それでは,なぜ植物はこのようなしくみをもつのか? のちほど,自家不和合性の分子機構について解説するが,この疑問は,なぜその状態にいたったのかを理解するうえで重要である.そして,その結論を述べるまえに,生物の集団における遺伝的な多様性の動力学について解説する.たとえば,ある世代において複数の対立遺伝子が同じ頻度で存在したとして,無作為の抽出によりつぎの世代へ子孫を残すという作業がくり返されるとする.ランダムな選抜の過程において対立遺伝子が同じ頻度で維持されることはなく,機会的にどちらかが失われうる.この効果は,遺伝的浮動とよばれている.
つぎに,自然選択の効果がある.たとえば,生存や子孫の繁殖のために不利な遺伝子は負の選択の効果により集団から除かれる.一方,まれに有利な変異の生じることがあり,そのような対立遺伝子は正の選択の効果により集団において頻度が高まる.集団において有利な変異がすばやく固定にむかう場合,その周辺の遺伝的な多様性が低下する選択一掃という現象が起こる.そして,平衡選択は2つ以上の対立遺伝子が長期間にわたり維持される効果である.そのひとつは,負の頻度に依存した選択であり,対立遺伝子のマイノリティが有利となる場合である.たとえば一般的に,捕食者は1種類の獲物に狙いをさだめるため,被食者の体色の多様性は負の頻度に依存した選択のもとにあるといわれている.植物の自家不和合性は,対立遺伝子のタイプが異なる相手とのみ子孫を残すという制約を課すしくみである.したがって,ある対立遺伝子が機会的に少なくなった場合,交配の相手が増加する有利性が生じるため,負の頻度に依存した選択の典型例として知られている.
自殖によりヘテロ性が低下し,集団の遺伝的な多様性は維持されづらくなる.一方,自家不和合性は他殖を強制することにより,集団における遺伝的な多様性を長期間にわたり維持する機能をもつ.遺伝的な多様性の高い集団は環境の変動に対応する遺伝子のプールが大きく,種の寿命が長いと考えられている.その一方,自殖のみの種はいわゆる進化の袋小路におちいったと考えられてきており,絶滅の可能性が高いと考えられてきた1).さらに,短期的には自殖劣勢が自家不和合性を維持する駆動力となる.自殖劣勢は近親交配による不利な有伝子の蓄積によりひき起こされ,個体は適応度の低い子孫のためにリソースを割くことになる.その一方,当然ながら自殖にも有利な点が多い.ダーウィンが考察したように,自殖により昆虫や風など不確定な花粉の媒介者の力を借りずに確実に子孫を残せるため繁殖が保証される.あるいは,自殖は他殖と比較して次世代への遺伝子の伝達の効率が2倍になるという考察もある.さらに,自家和合の状態においては集団のすべての個体と交配が可能になる有利性があり,自家不和合の状態においてはその恩恵は得られない2).このように,自家不和合性は分子認識により制御される一方,繁殖をめぐるトレードオフのなかで成立している.そのため,ミクロの分子生化学とマクロの進化生態学とを連結する格好の研究テーマともなっている.
1.アブラナ科植物における自家不和合性の分子機構
自家不和合性は花粉因子および雌しべ因子の2つの多型性の遺伝子により決定される.多くの場合,花粉因子および雌しべ因子はS遺伝子座とよばれる1つの座位にセットになってコードされている.すなわち,花粉因子あるいは雌しべ因子をコードする遺伝子が連鎖して多様なSハプロタイプ(S1,S2,…,Sn)を形成する.古くから,受粉のときに出会った花粉因子と雌しべ因子とが同一のSハプロタイプに由来するかどうかで自他が識別されると推察されていた.自家不和合性の分子機構は分類学上の科のレベルでおおむね共有されている.現在,被子植物の3つのタイプ,アブラナ科,ナス科・バラ科・オオバコ科,ケシ科における自家不和合性の分子機構が比較的よく理解されており,実証が進んでいる.このレビューにおいては,アブラナ科,および,ナス科・バラ科・オオバコ科について詳細を述べる.ケシ科については他書3) を参照されたい.
アブラナ科植物は地中海域を中心に世界中に広く分布する.ナタネ,ハクサイ,キャベツ,ダイコンなどの作物種を含むほか,モデル植物であるシロイヌナズナもここに分類される.ゲノムの大きさはコンパクトであり,もっとも分子生物学が適応しやすい植物である.アブラナ科においては,花粉側のSP11遺伝子(SCR遺伝子ともよばれる)と,雌しべ側のSRK遺伝子により自家不和合性が決定される(図1a).SP11/SCRは葯のタペート細胞において産生される分泌型のタンパク質であり,花粉の成熟にともないタペート細胞から花粉の表面へと移行する.一方,SRKは雌しべの先端にある乳頭細胞の細胞膜に局在する受容体型キナーゼである.アブラナ科植物の雌しべの先端にある乳頭細胞はワックス層におおわれたdry stigmaとよばれ,雌しべが水分を供給することにより花粉が発芽する(図1b).同一のSハプロタイプにコードされたSP11/SCRとSRKが特異的かつ直接的に結合することにより自己認識による自他の識別が可能になる4)(図1c).Brassica属においては,100種類にもおよぶSハプロタイプの存在が予測されている.
このアブラナ科のシステムにおいては,優劣性ヒエラルキーとよばれる遺伝的な制御が知られている.被子植物は2倍体であるため,多くの個体は2種類のSP11/SCR遺伝子をもつ.一方,Sハプロタイプのあいだに優劣性が存在する場合,葯のタペート細胞においてそのうち1種類のmRNAのみが発現し,花粉は抑制されるほうのSP11/SCRはもたない(図1d).この抑制には優性側のSハプロタイプより産生される小分子RNAがかかわる.Brassica属においては,24塩基からなる小分子RNAであるSmiあるいはSmi2の作用により劣性側の転写制御領域はDNAメチル化をうけ転写が抑制される5)(新着論文レビュー でも掲載).さらに,優劣性には多段階かつ線形の関係のあることがわかっている6,7).最上位は自己のほかすべてのクラスのSハプロタイプの発現を抑制する一方,最下位はホモ接合体においてはじめてSP11/SCR遺伝子を発現する.なぜこのようなヒエラルキーが形成されたのかについては不明な点が多い.2種類のSP11/SCRを同時に発現してしまうと,自己のみならず2種類のSRKのいずれかをもつ個体とはすべて不和合になってしまう.したがって,Sハプロタイプの数が少ない場合など,集団において交配の可能な相手が限定された状況においてこのような優劣性が有利にはたらくと推察される.なお,アブラナ科においては雌しべ因子であるSRKにもSハプロタイプのあいだの優劣性が知られており8,9),その分子機構は花粉因子とは異なり転写レベルでの制御ではないことが示唆されているが,詳細は不明である.
2.ナス科植物・バラ科植物・オオバコ科植物における自家不和合性の分子機構
ナス科植物は南米を中心に世界各地でみられる.自家不和合性の研究モデルとしての歴史は古く,Nicotiana属,Solanum属,Petunia属を中心に,分子生物学的な研究が進められてきた.雌しべ因子はS-RNaseとよばれる糖タンパク質である(図2a).ナス科の雌しべはアブラナ科とは異なりwet stigmaとよばれており,柱頭は分泌物にみちている(図3).S-RNaseにはRNAを分解する活性があり,花柱に侵入する花粉管に対し毒性を発揮する10).S-RNaseは花柱のマトリクスとよばれる細胞外の空間に1 cm3あたり0.25~1.0 mgの単位で蓄積する.一方で,花粉管は無防備ではなく,SLFとよばれる花粉因子により対抗する11)(図2a).SLFはFボックスドメインをもち,ユビキチンリガーゼ複合体の基質認識サブユニットとして機能する.このユビキチンリガーゼがS-RNaseをユビキチン化し,プロテアソームにより分解している可能性が考えられる.その結果,花粉管はS-RNaseを取り込んで不活性化しながら伸長し,さながら毒の海をわたるようにして胚珠との受精にいたる(図2b).
SLFとS-RNaseを主役とするこの自家不和合性システムは,協調的な非自己の認識モデルとよばれている12)(新着論文レビュー でも掲載).Petunia属においては1つのSハプロタイプが複数のSLF遺伝子をコードする.1つのSLFのタイプはそれぞれいくつかのS-RNaseを特異的に分解する.シミュレーションによると,かりに集団に40種類の異なるS-RNaseが存在したとしても,16~20種類のSLF遺伝子があればそのすべてが分解されると推測されている13).実際,ひとつのSハプロタイプからはその予測とほぼ合致した数のSLFのタイプが見い出されている12,13).さらに,おのおののSLFはいずれも自己のS-RNaseを分解する活性をもたず,自己認識を回避している.これは,SLFにアミノ酸変異が起こることや,対応する遺伝子が欠損することにより可能になっている.結果として,ひとつのSハプロタイプは自己を除くすべてと受精する.
実験的な確証は少ないが,Prunus属を除くバラ科植物やオオバコ科植物も,ナス科植物と同じくS-RNaseおよびSLFを用いた非自己認識型の自家不和合性を採用していると考えられている14).したがって,双子葉類の共通祖先はこの非自己認識型の自家不和合性を用いていた可能性がある13,15).実際に,分子系統解析からはナス科,バラ科,オオバコ科のS-RNase遺伝子およびSLF遺伝子はそれぞれ単一起源であることが支持されている13).非自己認識型の自家不和合性の分子機構や進化の動態に関しては,日本語総説16) にくわしい.
アブラナ科のシステムにおいては,SP11/SCR遺伝子とSRK遺伝子は共進化の関係にあり,同一のSハプロタイプに由来するものが系統樹において対応した位置にある17).SP11/SCR遺伝子とSRK遺伝子は長い進化の期間にわたりセットで遺伝しており,変異を蓄積した時期が同期していると考えられる.一方,ナス科のシステムにおいて,SLF遺伝子とS-RNase遺伝子のあいだにそのような対応関係はみられない.たとえば,SLF1遺伝子は複数のSハプロタイプにおいてアミノ酸配列のレベルで100%の相同性をもつものがみつかっている12).それ以外のタイプについても,相同性が高いものが複数のSハプロタイプのあいだで共有されている13).このことから,明らかに最近になり遺伝子変換などによりSLF遺伝子が複数のSハプロタイプに広まったと考えられ,非自己認識型の自家不和合性システムの特徴であると考えられている.
3.自家不和合性はどのように複雑化するのか
理論上,最小で2つのSハプロタイプがあれば自他の識別による生殖システムは構築される.サクラソウ科,アマ科,タデ科などでみられる異形花型の自家不和合性はその実例である1).しかし,これまで述べてきたように,被子植物の自家不和合性はときとして100種類のSハプロタイプにまでおよぶ巨大な生殖システムにふくれあがっている.Sハプロタイプはどのようにして増えたのか,どのようにして複雑化したのかは,生物の進化を問ううえで非常に重要な疑問である一方,多くの研究者を悩ませてきた.
自家不和合性が多様化する過程を考察するうえでは,その中間状態が重要であると考えられてきた.遺伝的浮動の効果のもとでは新しい変異は有利でないかぎりすぐに淘汰されてしまう.不利ならばさらに迅速に淘汰されるはずである.したがって,議論の的は中間状態が安定するにはどのような条件が必要なのか,という点にしぼられる.
以前の研究においては,中間状態が自家和合であるという可能性が考えられてきた.進化生物学では変異が2つの遺伝子に同時に起こる可能性はほぼ皆無であるとされている18,19).アブラナ科のシステムを例にとると,まずはSP11/SCRあるいはSRKのどちらか一方が新しい認識特異性を獲得しなければならない.すると,中間状態はSP11/SCRとSRKの認識特異性が適合していない状態になり,いったん自家和合性を経由すると考えられる.その前提にしたがうと,自殖劣勢や自殖率などといった係数が重要と考えられる.たとえば,自殖劣勢は自家和合性へのペナルティとなり,中間状態が不安定となる一因である.自殖劣勢が高ければそのペナルティはより強化されるが,低い場合はさほど問題にならない.自殖劣勢の程度は当該の環境において適応度の低下をひき起こす遺伝子がどれほど蓄積しているかに依存するし,自殖率も花粉の媒介者と花の構造との関係により集団のあいだで異なると考えられる.したがって,これらのペナルティ係数による不利性と,集団のどの個体とも交配するという自家和合性の有利性とのあいだで均衡が保たれる条件が数理生物学的に探索されてきた20).いい換えれば,新しいタイプが誕生するうえで望ましい環境条件,すなわち,集団あるいは気候が存在し,それが整ったとき,自家不和合性が進化するという点がこれまでの議論の中心であった.
4.自家不和合性因子の動的な分子進化
その一方で,これまでの論議においては,基本的にどのSハプロタイプも同じように自己の花粉を排除し,機能を失うと自家和合になるという,1か0かの,いわば定性的なとらえ方がなされてきた.そして,量的な効果が分子進化におよぼす役割についてはあまり考察されていなかった.たとえば,ナス科のシステムについて考えてみると,S-RNaseに対しより分解の効率のよいSLFのセットをもつ花粉が優先的に受精すると推測される.したがって,この“優秀な”SLFのセットをもつSハプロタイプは有利であると考えられる(図4a).SLF遺伝子には最近になり分岐したような分子進化の形跡がみられることをさきに述べたが13),これは,有利なSLF遺伝子が集団においてほかの対立遺伝子を駆逐する選択一掃のようにすばやく広まったためと考えられ,強い正の選択圧がかかっているのではないかと推測される.このように,同じ認識特異性をもつSハプロタイプでも,ニッチにおいてより有利な変異をもつものが性淘汰により数を増やすことが考えられる.
自殖が不利な環境条件においては,雌しべはよりすばやく特異的に“望ましくない自己の花粉”を排除したほうが有利である21)(図4b).これは雌しべにおいて花粉管が通過する空間がかぎられていることから合理的であり,排除が遅れるとそのぶん“望ましい非自己の花粉”と受精する確率が低下する.したがって,ナス科のシステムを例にとると,自殖が抑制される条件においては単に自己の花粉を排除するだけではなく,効率よく自己の花粉を排除するS-RNaseが選択されやすいと考えられる.今後は,理論モデルのみではなく,SLFやS-RNaseの機能効率の差を実験的に検証することが重要であると考えられる.
SLFはそれぞれが複数のS-RNaseを認識して分解するが,そのカバーする範囲はしばしばオーバーラップする12,13,22)(図5a).実際に,SLF遺伝子は比較的最近になり遺伝子重複,欠損,遺伝子変換を経験している13).機能の重複により個々のSLF遺伝子にかかる純化選択は軽減されており,新しい基質認識性を獲得しやすいのではないかと考えられる.
筆者らは,実際に,この考えをもとにシミュレーションモデルを作成し,SLF遺伝子とS-RNaseのどちらがさきに進化するのかを考察した15).さらに,SLF遺伝子は遺伝子変換により集団において広まることを考慮した.その結果,予測どおり,新しい特異性をもつSLF遺伝子がさきに集団に広まり,そののち,対応するS-RNaseが進化するようすが観察された.毒より解毒剤のほうがさきに広まるというと奇妙に思えるかもしれない.しかしこの場合,S-RNaseがどのSLFにも分解されなくなるとすべての花粉が排除されてしまい,交配の相手が減少するため不利である.最近,ほかの研究グループも,同じナス科のシステムについてSLF遺伝子とS-RNase遺伝子の進化の順番および自殖劣勢係数を考慮した数理モデルを構築しており23),この議論に対する国際的な注目があつまっている.
アブラナ科の自家不和合性はSP11/SCRとSRKによる自己認識システムであり,ナス科の非自己認識システムとは進化の動態は異なる.まず,古くから考えられてきたように,SP11/SCRとSRKの関係がいったん解消され,どちらかが新しい認識特異性を獲得する経路が考えられる.一方,キメラ実験により,SP11/SCRが2つのSハプロタイプとしての認識特異性をあわせもつことが可能であるとされた24,25).さらにこの場合,SP11/SCRとSRKとの特異的な結合によるものか,キメラのSP11/SCRの安定性によるものかは不明であるが,部分的な,あるいは,弱い自家不和合性を発現する例も知られている.SP11/SCRとSRKとの部分的な結合性を考慮すると,新しいSハプロタイプが進化する条件は以前考えられていたもの20) よりも,広い多次元空間であることが考えられる.SP11/SCRとSRKの結合性のさらなる実験データや,定量性をモデルに組み込んだ進化理論的な研究への展開が期待される.
5.自家不和合性の発現の柔軟性と環境への適応進化
アブラナ科においてはSP11/SCR遺伝子あるいはSRK遺伝子のどちらか,ナス科においてはS-RNase遺伝子が破壊されると自家和合性を獲得する.遺伝子は特定の塩基が連続して結合することによりはじめて意味のある配列として成立するため,ランダムに欠損や挿入を導入してそれを破壊するのは簡単である.しかし,いちど破壊された遺伝子が機能をとりもどすことは容易ではなく,一般に起こりえないとされている.このように,いったん遺伝子が破壊されて自家和合性を獲得してから自家不和合性を復興するのはむずかしく,自家和合性は不可逆的に進化の袋小路につながると考えられてきた.実際,シロイヌナズナのような自植性のモデル植物においては,最終氷河期において自家不和合性の共通祖先からどのようにして自家和合性が適応進化し,どのように変異が広まったのかについての詳細が調べられている2,26).
集団においてはそれぞれの個体が自身のリソースを自殖と他殖に割りあてる必要があるが,その最適な配分は環境条件により決定されると考えられる.一方,自家不和合性は以前に考えられていたよりも柔軟に制御されていることが近年の分子モデルからわかってきた.たとえば,ナス科のシステムにおいては,自己のS-RNaseを分解するSLFが進化すれば,そのSハプロタイプは自家和合化する(図5a).この場合,どの遺伝子も機能を維持したままであり,自己認識するSLFが欠失すれば自家不和合性も簡単に回復する.実際,遺伝子変換により自己のS-RNaseを抑制するSLFを獲得することにより自家和合化したと推察されるペチュニアも野外で発見されており13,27),このような変異はまれではないと考えられる.
アブラナ科のシステムの場合,SP11/SCR遺伝子とSRK遺伝子との関係だけではこのような経路は生じないが,優劣性にかかわる小分子RNAであるSmiやSmi2が介在することで可能になる(図5 b, c).とくに,Smi2は塩基配列に依存してヒエラルキーが下位のSP11/SCR遺伝子のプロモーターの配列をDNAメチル化する6).これは,少しの塩基置換により自己のものも標的にするしくみである.一般的に,miRNAは既存の塩基配列を鋳型として逆位反復配列が生じることで進化すると考えられている28).すると,SmiやSmi2の進化初期の状態は自己のSP11/SCR遺伝子のプロモーターを抑制していたのではないかと推察される(図5c).また,アブラナ科の自家不和合性のSハプロタイプのあいだには,それぞれ単独では自家不和合性を発揮するが,ヘテロになると互いの発現を抑制しあう共劣性の関係もときおり存在する29)(図5b).このような関係が野外でどれほど普遍的に分布しているのかは,今後,検証していく必要があろう.さらに,雌しべ側でもSハプロタイプのあいだの優劣性が知られていることから8,9),こうした優劣性の発現の機構が進化にどのようにかかわるのかについても,今後,さらに解明が進むと期待される.
進化の過程において大きな構成の変動が起こった自家不和合性の集団の例も多く知られている.アブラナ科のBrassica属とArabidopsis属とではSハプロタイプの数に大きな違いはないが,Brassica属ではSRKのアミノ酸配列の多様性が低いことが知られている30).ナス科のLycium属は南米および旧世界に分布するが,アフリカの種からは南米の種にみられる多様なS-RNase遺伝子のタイプのうち一部のみが発見されている31).同様のパターンが同じくナス科のPhysalis属においても見い出されていて,Solanum属のもつ一部のSハプロタイプのみがPhysalis属においてみつかっている32).これらの種においては過去の環境の変動や地理的な隔離などの要因によりSハプロタイプの数が激減し,その遺伝的なボトルネックののち正の選択により多様化したと推測されている.更新世における氷期と間氷期のサイクルにみられるように,地球の環境はたえず変動している.たとえば,氷期においては昆虫など花粉の媒介者の数が減少し自殖に有利な条件にかたよると考えられる2).気候の変動により他殖と自殖の有利性が変化するなかで,植物の多様な自家不和合性の形態が生じてきたと思われる.
自家不和合性は高温や多湿により打破されやすく,古くから,これらの条件において人工的に自家受精して種子を得る方法が検討されてきた33).アブラナ科の作物においてはビニールハウスのCO2の濃度を5%まで増加させることにより自家不和合性が弱化される.多くの植物種に共通であるが,自家不和合性は開花の当日がもっとも強いため,開花のまえに自家受粉することにより種子を得ることも可能である34).また,老化によっても自殖により種子が得られる確率が高くなる35).これらの現象の解明は育種学的に重要であるが,その分子機構や生理学的な意義は不明であり,今後,さらに解明を進める必要がある.自家不和合性の強度にかかわる量的形質遺伝子座も探索されており36),S遺伝子座の領域にあるという例もある37).このようなケースでは,SP11/SCRとSRKとの結合の特性が表現型を決定する可能性も考えられる.一方で,自家不和合性の強度は自殖と他殖のリソースの配分に関係するため,適応的な進化である可能性も考えられる.
6.自家不和合性と種を識別する分子機構とのかかわり
自家不和合性は花粉をあえて排除するシステムであるという点でユニークである.その一方で,植物においてはほかの種の花粉を排除する種間不和合性もよく知られている38).種間不和合性は一般に2つの異なる機構,不一致性と不和合性にさらに分解されると考えられている.不一致性は2つの種が進化の過程で分岐したのち,受精するために必要な花粉因子と雌しべ因子とのあいだに独自の遺伝的な変異が蓄積することにより生じる.花粉因子と雌しべ因子とが合致せず相互作用しなくなっているようなケースである.たとえば,雌しべの助細胞における花粉管誘導タンパク質であるLURE1と,花粉管側の受容体であるPRK6とのあいだには,そのような種に特異的な関係がある39)(新着論文レビュー でも掲載).
一方で,ほかの種の花粉を積極的に排除する不和合性の機構も存在するのではないかと推察されてきた.その根拠がSI×SCルールである.多くの科に共通していえることであるが,自家和合(self-compatible:SC)種の雌しべは自家不和合(self-incompatible:SI)種の花粉を受け入れるのに対し,その逆においては花粉管の侵入がみられない40).このような関係は一側性の不和合性とよばれており,自家不和合性の種間不和合性へのかかわりを示す根拠とされていた.種間不和合性の分子機構に関する多くの仮説は自家不和合性のS遺伝子座がかかわることが前提とされており,実際,近年になり見い出されてきた因子もS遺伝子にかかわるものが多い.たとえば,ナス科においてはS-RNaseがほかの種の花粉管の排除にかかわる例が明らかにされた41).さらに,自家和合種の花粉管が自家不和合種の雌しべに侵入しない原因が,SLFの欠損や,SLFと複合体を形成するCUL1の欠損により説明される例もみつかってきた42,43).最近,アブラナ科において,日本の集団とトルコの集団とのあいだの不和合性が,重複により生じたS遺伝子座によりひき起こされることが明らかにされた44)(新着論文レビュー でも掲載).このように,自家不和合性と種間不和合性とのあいだに直接的な関係のあるケースも多い.
おわりに
自家不和合性はなんども並行進化してきており,そのたびに異なる因子を採用した新たな分子機構が形成されてきた.イネ科,ヒルガオ科,キク科など,責任因子が近いうちに同定されそうな例は数多くあり,研究の発展が期待される.さらに,自家不和合性の進化の動態の原理についても再議論がはじまったばかりである.因子の実態が明らかにされてきたことで,これまで考えられてきた以上に自家不和合性が流動的であることがわかってきた.理論と実験とが深く結びついたアプローチによりダーウィンの時代からとなえられてきた仮説を見直し,自家不和合性の進化生物学的な価値を問い直す必要があると考えられる.塩基配列の決定技術の発展によりフィールドの試料から大量のデータを得ることも可能になってきた.分子の相互作用がどのようにして現実の世界で躍動しているのかを理解するのはこれからである.
文 献
- Igic, B., Lande, R. & Kohn, J. R.: Loss of self-incompatibility and its evolutionary consequences. Int. J. Plant Sci., 169, 93-104 (2008)
- Shimizu, K. K. & Tsuchimatsu, T.: Evolution of selfing: recurrent patterns in molecular adaptation. Annu. Rev. Ecol. Evol. Syst., 46, 593-622 (2015)
- 沢田 均: 動植物の受精学:共通機構と多様性. 化学同人 (2014)
- Takayama, S., Shimosato, H., Shiba, H. et al.: Direct ligand-receptor complex interaction controls Brassica self-incompatibility. Nature, 413, 534-538 (2001)[PubMed]
- Tarutani, Y., Shiba, H., Iwano, M. et al.: Trans-acting small RNA determines dominance relationships in Brassica self-incompatibility. Nature, 466, 983-986 (2010)[PubMed] [新着論文レビュー]
- Yasuda, S., Wada, Y., Kakizaki, T. et al.: A complex dominance hierarchy is controlled by polymorphism of small RNAs and their targets. Nat. Plants, 3, 16206 (2016)[PubMed]
- Durand, E., Meheust, R., Soucaze, M. et al.: Dominance hierarchy arising from the evolution of a complex small RNA regulatory network. Science, 346, 1200-1205 (2014)[PubMed]
- Llaurens, V., Billiard, S., Leducq, J. B. et al.: Does frequency-dependent selection with complex dominance interactions accurately predict allelic frequencies at the self-incompatibility locus in Arabidopsis halleri? Evolution, 62, 2545-2557 (2008)[PubMed]
- Hatakeyama, K., Takasaki, T., Suzuki, G. et al.: The S receptor kinase gene determines dominance relationships in stigma expression of self-incompatibility in Brassica. Plant J.. 26, 69-76 (2001)[PubMed]
- McClure, B. A., Gray, J. E., Anderson, M. A. et al.: Self-incompatibility in Nicotiana alata involves degradation of pollen rRNA. Nature, 347, 757-760 (1990)
- Sijacic, P., Wang, X., Skirpan, A. L. et al.: Identification of the pollen determinant of S-RNase-mediated self-incompatibility. Nature, 429, 302-305 (2004)[PubMed]
- Kubo, K., Entani, T., Takara, A. et al.: Collaborative non-self recognition system in S-RNase-based self-incompatibility. Science, 330, 796-799 (2010)[PubMed] [新着論文レビュー]
- Kubo, K., Paape, T., Hatakeyama, M. et al.: Gene duplication and genetic exchange drive the evolution of S-RNase-based self-incompatibility in Petunia. Nat. Plants, 1, 14005 (2015)[PubMed]
- Kakui, H., Kato, M., Ushijima, K. et al.: Sequence divergence and loss-of-function phenotypes of S locus F-box brothers genes are consistent with non-self recognition by multiple pollen determinants in self-incompatibility of Japanese pear (Pyrus pyrifolia). Plant J., 68, 1028-1038 (2011)[PubMed]
- Fujii, S., Kubo, K. & Takayama, S.et al.: Non-self- and self-recognition models in plant self-incompatibility. Nat. Plants, 2, 16130 (2016)[PubMed]
- 久保健一, 円谷徹之, 高山誠司: ナス科ペチュニアの自家不和合性の分子機構と分子進化. 植物の生長調節, 51, 41-47 (2016)
- Takuno, S., Fujimoto, R., Sugimura, T. et al.: Effects of recombination on hitchhiking diversity in the Brassica self-incompatibility locus complex. Genetics, 177, 949-958 (2007)[PubMed]
- Uyenoyama, M. K. & Newbigin, E.: Evolutionary dynamics of dual-specificity self-incompatibility alleles. Plant Cell, 12, 310-312 (2000)[PubMed]
- Charlesworth, D.: How can two-gene models of self-incompatibility generate new specificities? Plant Cell, 12, 309-310 (2000)[PubMed]
- Uyenoyama, M. K., Zhang, Y., Newbigin, E. et al.: On the origin of self-incompatibility haplotypes: transition through self-compatible intermediates. Genetics, 157, 1805-1817 (2001)[PubMed]
- Newbigin, E. & Uyenoyama, M. K.: The evolutionary dynamics of self-incompatibility systems. Trends Genet., 21, 500-505 (2005)[PubMed]
- Williams, J. S., Der, J. P., dePamphilis, C. W. et al.: Transcriptome analysis reveals the same 17 S-Locus F-Box genes in two haplotypes of the self-incompatibility locus of Petunia inflata. Plant Cell, 26, 2873-2888 (2014)[PubMed]
- Bod’ova, K., Priklopil, T., Field, D. L. et al.: Evolutionary pathways for the generation of new self-incompatibility haplotypes in a non-self recognition system. Genetics, 209, 861-883 (2018)[PubMed]
- Chookajorn, T., Kachroo, A., Ripoll, D. R. et al.: Specificity determinants and diversification of the Brassica self-incompatibility pollen ligand. Proc. Natl. Acad. Sci. USA, 101, 911-917 (2004)[PubMed]
- Sato, Y., Okamoto, S. & Nishio, T. et al.: Diversification and alteration of recognition specificity of the pollen ligand SP11/SCR in self-incompatibility of Brassica and Raphanus. Plant Cell, 16, 3230-3241 (2004)[PubMed]
- Tsuchimatsu, T., Suwabe, K., Shimizu-Inatsugi, R. et al.: Evolution of self-compatibility in Arabidopsis by a mutation in the male specificity gene. Nature, 464, 1342-1346 (2010)[PubMed]
- Tsukamoto, T., Ando, T., Watanabe, H. et al.: Duplication of the S-locus F-box gene is associated with breakdown of pollen function in an S-haplotype identified in a natural population of self-incompatible Petunia axillaris. Plant Mol. Biol., 57, 141-153 (2005)[PubMed]
- Allen, E. Xie, Z., Gustafson, A. M. et al.: Evolution of microRNA genes by inverted duplication of target gene sequences in Arabidopsis thaliana. Nat. Genet., 36, 1282-1290 (2004)[PubMed]
- Hatakeyama, K., Watanabe, M., Takasaki, T. et al.: Dominance relationships between S -alleles in self-incompatible Brassica campestris L. Heredity, 80, 241-247 (1998)
- Castric, V. & Vekemans, X.: Evolution under strong balancing selection: how many codons determine specificity at the female self-incompatibility gene SRK in Brassicaceae? BMC Evol. Biol., 7, 132 (2007)[PubMed]
- Miller, J. S., Kamath, A., Damashek, J. et al.: Out of America to Africa or Asia: inference of dispersal histories using nuclear and plastid DNA and the S-RNase self-incompatibility locus. Mol. Biol. Evol., 28, 793-801 (2011)[PubMed]
- Paape, T. & Kohn, J. R.: Differential strengths of selection on S-RNases from Physalis and Solanum (Solanaceae). BMC Evol. Biol., 11, 243 (2011)[PubMed]
- Okazaki, K. & Hinata, K.: Repressing the expression of self-incompatibility in crucifers by short-term high temperature treatment. Theor. Appl. Genet., 73, 496-500 (1987)[PubMed]
- Thompson, K. F. & Taylor, J. P.: Self-compatibility in kale. Heredity, 27, 459 (1971)
- 郷内 浩, 日向康吉: カンランの雌ずいの生長と自家不和合性の発現に及ぼす温度の影響. 育種学雑誌, 21, 195-198 (1971)
- 新倉 聡: アブラナ科野菜における生殖形質の遺伝学的研究とその育種への展開. 育種学研究, 9, 153-160 (2007)
- Hatakeyama, K., Horisaki, A., Niikura, S. et al.: Mapping of quantitative trait loci for high level of self-incompatibility in Brassica rapa L. Genome, 53, 257-265 (2010)[PubMed]
- de Nettancourt, D.: Incompatibility and Incongruity in Wild and Cultivated Plants. Springer-Verlag, Berlin (2001)
- Takeuchi, H. & Higashiyama, T.: Tip-localized receptors control pollen tube growth and LURE sensing in Arabidopsis. Nature, 531, 245-248 (2016)[PubMed] [新着論文レビュー]
- Lewis, D. & Crowe, L. K.: Unilateral interspecific incompatibility in flowering plants. Heredity, 12, 233-256 (1958)
- Murfett, J., Strabala, T. J., Zurek, D. M. et al.: S RNase and interspecific pollen rejection in the genus Nicotiana: multiple pollen-rejection pathways contribute to unilateral incompatibility between self-incompatible and self-compatible species. Plant Cell, 8, 943-958 (1996)[PubMed]
- Li, W. & Chetelat, R. T.: A pollen factor linking inter- and intraspecific pollen rejection in tomato. Science, 330, 1827-1830 (2010)[PubMed]
- Li, W. & Chetelat, R. T.: Unilateral incompatibility gene ui1.1 encodes an S-locus F-box protein expressed in pollen of Solanum species. Proc. Natl. Acad. Sci. USA, 112, 4417-4422 (2015)[PubMed]
- Takada, Y., Murase, K., Shimosato-Asano, H. et al.: Duplicated pollen-pistil recognition loci control intraspecific unilateral incompatibility in Brassica rapa. Nat. Plants, 3, 17096 (2017)[PubMed] [新着論文レビュー]
著者プロフィール
略歴:2009年 東北大学大学院農学研究科 修了,同年 オーストラリアWestern Australia大学 博士研究員.2011年 京都大学大学院理学研究科 研究員,2014年 奈良先端科学技術大学院大学バイオサイエンス研究科 助教を経て,2017年より東京大学大学院農学生命科学研究科 助教.2016年より科学技術振興機構さきがけ研究者 兼任.
抱負:生物多様性の誕生,維持,喪失にかかわる分子を同定し,その理屈について納得したい.
高山 誠司(Seiji Takayama)
東京大学大学院農学生命科学研究科 教授.
研究室URL:http://park.itc.u-tokyo.ac.jp/seiyu/
© 2018 藤井壮太・高山誠司 Licensed under CC 表示 2.1 日本