新しいモデル生物:苔類ゼニゴケ
2018/11/01
西浜竜一・河内孝之
(京都大学大学院生命科学研究科 遺伝子特性学分野)
email:西浜竜一,河内孝之
領域融合レビュー, 7, e008 (2018) DOI: 10.7875/leading.author.7.e008
Ryuichi Nishihama & Takayuki Kohchi: The liverwort Marchantia polymorpha: an emerging model organism.

ゲノムの解読が容易になった現代の生命科学において,遺伝子の機能を進化軸にそって理解する研究がますますおもしろくなってきている.約4億8千年前に水生の緑藻から陸上化をはたし,そののち,さまざまな適応をなしとげてきた植物においても,そのような研究が熱をおびている.陸上植物の進化において鍵となるのが,もっとも基部に位置するコケ植物である.2017年,コケ植物である苔類ゼニゴケの全ゲノム配列が発表された.ゼニゴケのゲノムはとくに制御系の遺伝子について冗長性の低いことが明らかにされ,陸上植物の共通祖先のゲノムを連想させるものであった.ここ10年ほどのあいだに開発された分子遺伝学的なツールの充実ともあいまって,ゼニゴケは分子遺伝学やシステム生物学にもとづく自在な解析の可能な,日本発のモデル生物として確立された.このレビューにおいては,ゼニゴケの進化的な位置づけや1倍体の優占する生活環など生物学的な特徴,および,研究の基盤について解説する.また,ゼニゴケの特徴を活かした研究例を紹介し,植物の枠をこえたモデル生物としての活用の方向性について議論する.
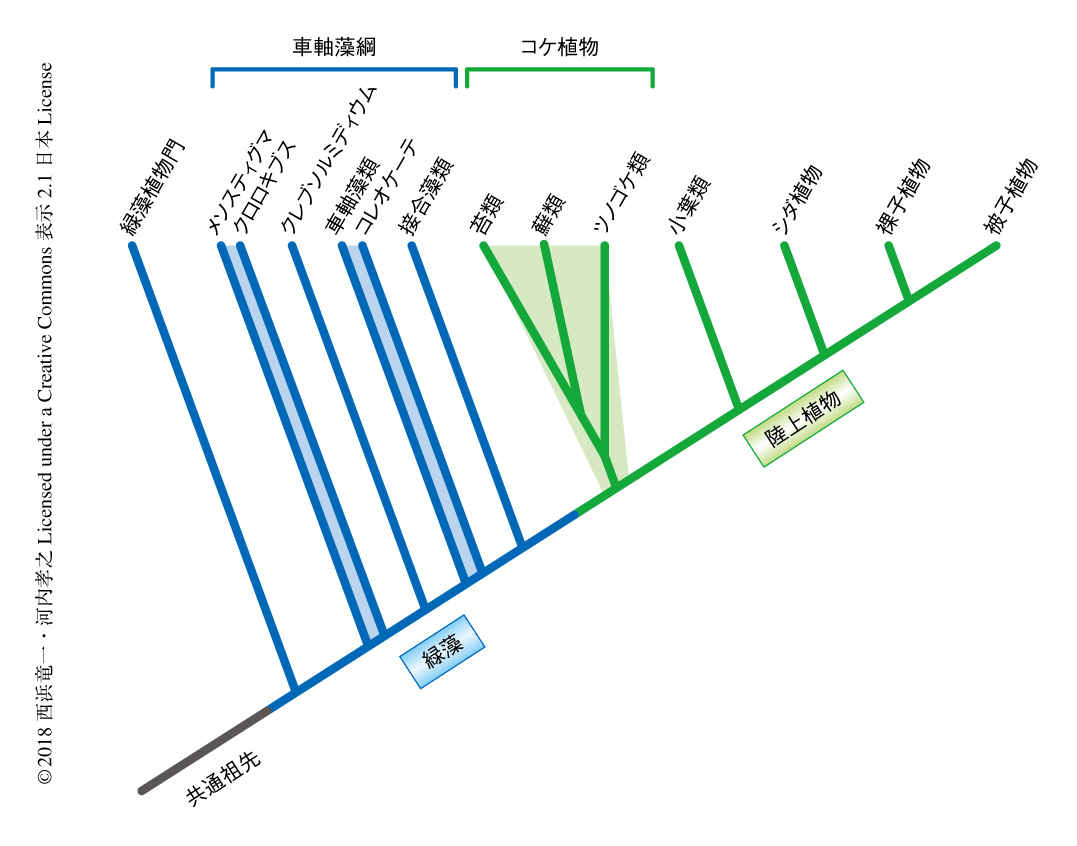
生命はその誕生から刻々と進化をつづけてきた.生物の多様性はこの営みの産物である.その根底にあるのは遺伝情報の微々たる変化の積み重ねであり,種における進化や新しい種の誕生の原動力となっている.この道筋は枝分かれをくり返しながらとぎれることなくつづいている.つまり,遺伝情報には進化の歴史が刻まれている.地球史における重大なイベントのひとつとして,およそ4億8千万年前に起こったとされる植物の陸上化があげられる1).それにより環境や地勢が変化し,さらに,動物の上陸も加速された.水生の緑藻から上陸をはたしたのち,植物は陸上においてさまざまな適応をなしとげ大繁栄するにいたった.植物のとった適応戦略の変遷をたどることは,食糧問題やエネルギー問題をかかえる人類の未来にとっても貴重な道標となる.上陸した当初の植物は絶滅しておりそのすがたをみることはできないが,現生の陸上植物においてもっとも進化的な基部に位置する系統はコケ植物である.コケ植物は根や花をつくらず,比較的単純な葉状性あるいは茎葉性のからだをしている.コケ植物ののち,維管束組織をもつシダ植物が分岐し,さらに,種子および花が順に発明され裸子植物および被子植物が誕生した.このように,陸上植物は共通の祖先をもつ単系統性である(図1).
次世代シークエンサーの普及により短期間かつ低コストでゲノムを解読できるようになると,植物の進化を分子の言葉で説明する研究がさかんになってきた.分子系統解析により植物の詳細な系統関係が明らかにされ,植物の多様性の理解は格段に進んだ.20世紀後半には分子生物学が台頭した.分子生物学のモデル生物にもとめられる重要な要件として,形質転換が可能であること,順遺伝学的および逆遺伝学的な解析が可能なこと,そして,ゲノムが解読されていることがあげられる.これらをすべてみたす植物として,双子葉植物のシロイヌナズナ(Arabidopsis thaliana)や単子葉植物のイネ(Oryza sativa)がいちはやく整備され,とくに1990年代から2000年代における植物の研究はこれらモデル植物に集中した.その戦略は成功し,発生,環境応答,光合成などについての膨大な知見がもたらされ植物の理解に大きく貢献した.そののち,緑藻のクラミドモナス(Chlamydomonas reinhardtii)やコケ植物のヒメツリガネゴケ(Physcomitrella patens)がモデル植物として確立されたことは,植物の進化の研究における一里塚であり,より総合的な議論が可能になった.一方で,そもそもモデル植物に形質や現象が存在しない,あるいは,複雑すぎるなどの理由により,未解明である重要な問題も植物の分野には多く残されている.このような問題に取り組むには,できるだけ多様な系統に属する種を対象とする必要がある.動物を含むほかの系統と同様に,植物においても進化の過程でゲノムの重複が起こり,遺伝子の機能の冗長性が増加し,機能の分担(subfunctionalization)や新しい機能の獲得(neofunctionalization)が進んだことを考えると,できるだけ単純な体制やゲノムをもつ種に注目するのはひとつの方略であろう.根源的な生命活動のモデルとしての大腸菌,真核生物のモデルとしての酵母が,生物学の進展にはたした役割については述べるまでもない.
筆者らは,コケ植物に属し単純な体制をもつゼニゴケ(Marchantia polymorpha)に着目して,さまざまな研究手法やツールを開発してきた.また,ゼニゴケのゲノムにはゲノムレベルでの重複が起こっていないことも明らかにされた.このような背景をもとに,ゼニゴケはシステム生物学や分子遺伝学にもとづく遺伝子の機能の自在な解析の可能なモデル生物として注目されるようになった.また,その扱いやすさや実験の迅速さは植物では群をぬく.このレビューにおいては,おもにこれから生物の研究を本格的にはじめたい人,なかでも,生物の多様性を理解したいと考えている人を対象として,モデル生物としてのゼニゴケの特徴および有用性について述べる.
陸上植物は緑藻と共通の祖先をもち,そのなかでも車軸藻綱から分岐した(図1).車軸藻綱は側系統群であり,そのうち比較的基部に位置するクレブソルミディウム(Klebsormidium nitens)のゲノム2),および,シャジクモ(Chara braunii)のゲノム3)(新着論文レビュー でも掲載)が解読されている.最近の分子系統解析により,アオミドロ(Spirogyra)やミカヅキモ(Closterium)などを含む接合藻類が陸上植物にもっとも近縁な車軸藻綱の姉妹群であるとされている4).車軸藻綱から分岐した陸上植物の共通祖先は現存しないが,それにもっとも近縁な現生の陸上植物はコケ植物である.コケ植物は,苔類,蘚類,ツノゴケ類の3群からなる総称であり,ゼニゴケは苔類に属する.これら3群の系統関係については,分子系統解析のレベルではこれまでに3群側系統説から単系統説までさまざまな説が提案されており5),最新の解析によると苔類と蘚類の共通祖先がツノゴケ類と分岐したコケ植物単系統説が有力視されている6)(図1).化石の記録からは苔類がもっとも初期に分岐したのではないかともいわれている7,8).コケ植物の系統関係については議論があるものの,陸上植物が単系統性であることに疑いはない.いい換えると,すべての陸上植物は共通の祖先をもつ.このことは,共通祖先のもっていた遺伝子が数や役割を変えながら,コケ植物,シダ植物,裸子植物,被子植物と代々うけつがれて陸上植物は進化したことを意味する.そのため,とくに保存された遺伝子ファミリーについて,苔類のような共通祖先により近縁な植物(現生の苔類は祖先ではないことに注意)における機能を調べることにより,陸上化への貢献,機能や制御の原形,機能の普遍性と多様性,などについての理解が深まることが期待される.
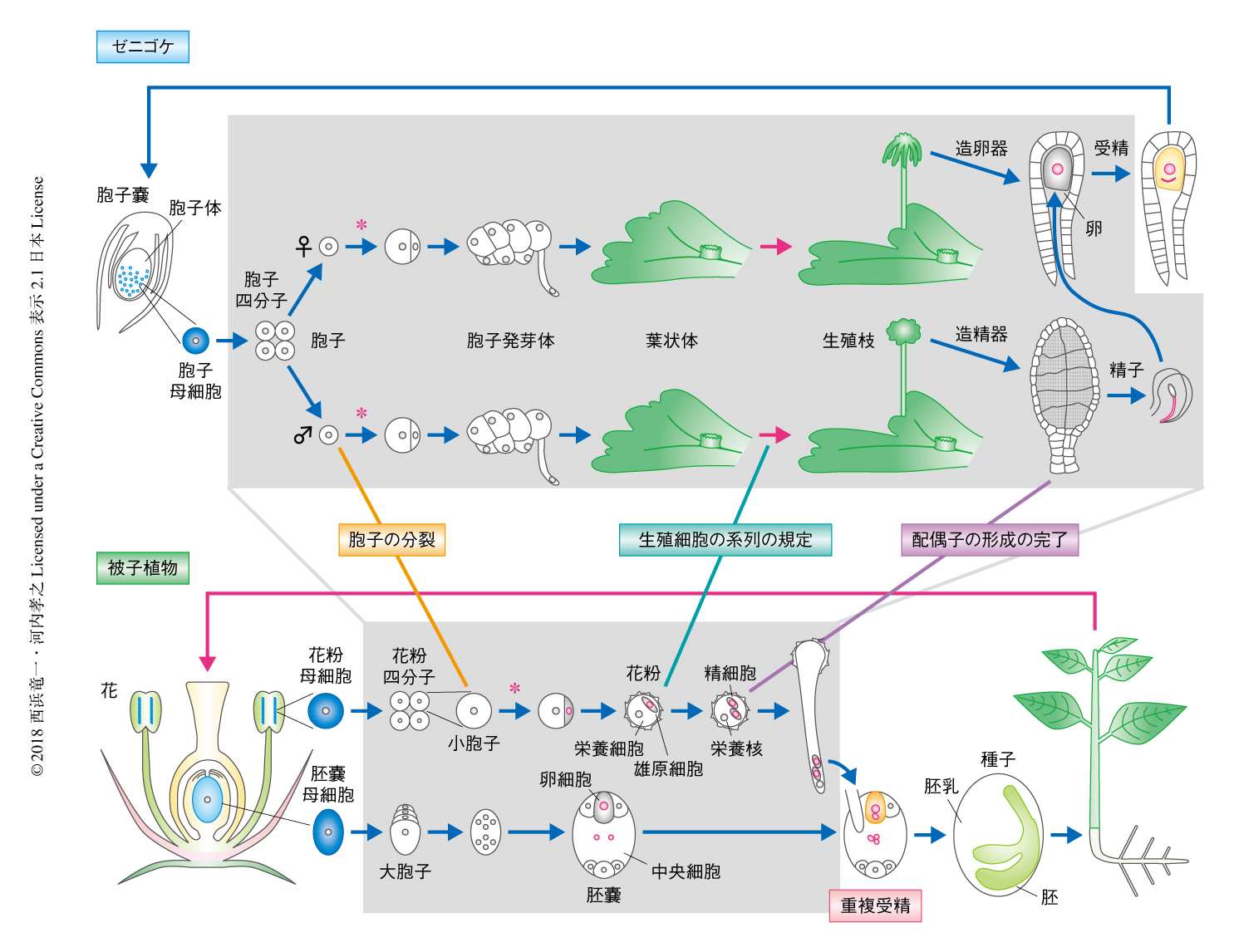
緑藻は単細胞あるいは多細胞をとわず1倍体である.有性生殖により生じた2倍体の受精卵はただちに減数分裂を起こして1倍体の胞子を形成する.一方,コケ植物は配偶子(精子および卵細胞)が受精してもすぐには減数分裂を起こさず,体細胞分裂により2倍体の多細胞体である胞子体を形成する(図2).そのため,陸上植物は有胚植物ともいわれる.胞子体の細胞は決められた発生プログラムにそって増殖したのち,減数分裂により多数の1倍体胞子を形成する.接合ののちの2倍体細胞の増殖が初期の陸上植物の遺伝的な多様性の増加に貢献したと考えられる.また,1倍体世代(配偶体世代)と2倍体世代(胞子体世代)のどちらでも多細胞体をつくる世代交代は,陸上植物の特徴のひとつである(図2).このような世代交代がどのようなしくみで生じたかについては研究の的となっている.
以下,ゼニゴケの生活環について解説する.なお,その詳細は文献9) にくわしい.ゼニゴケの発芽は細胞伸長をともなわず,非対称な細胞分裂として起こる(図2).一般に,コケ植物の胞子の発芽には吸水にくわえ光の刺激が必要な場合が多い10,11).ゼニゴケの場合は光合成により合成された糖に依存する12).非対称分裂により生じた小さい細胞は仮根に分化し,大きい細胞はそののちさかんに細胞分裂する胞子発芽体になる.胞子発芽体のある段階で,頂端細胞とよばれる幹細胞が形成される.すると,形態形成がはじまり葉状体ができあがる.葉状体はその背側に規則的に気室をはりめぐらせ,腹側には単細胞性の仮根を伸ばして地面に固着する.このような3次元的な発生は陸上化にともない確立されたと考えられている.緑藻の体制は単細胞,直鎖状の細胞列,あるいは,1層の平面構造であり,2次元どまりであるからである.これは,幹細胞から娘細胞を切り出すときの分裂面の増加に依拠したといわれている.細胞が細胞壁によりかこまれ移動のできない植物に特有の進化の様式であるともいえる.ゼニゴケは生活環の大半をこの葉状体としてすごす.頂端細胞を含む分裂組織(メリステム)はノッチとよばれる葉状体の先端のくぼみにあり,ノッチが周期的に水平方向に倍加する.頂端の成長と二叉分枝のバランスがそろうと,むだなく平面をおおうように成長できる.栄養条件さえ整えばこの様式により無限に成長できるため,寿命という概念はあてはまらないのかもしれない.このように,当代を半永久的に維持できるのも,ゼニゴケのモデル生物としての利点である.二叉分枝と連動した頻度で,ゼニゴケの葉状体の背側には杯状体が形成される.筒状の壁にかこまれたその空間には直径1 mmにもみたない円盤状の構造体である無性芽が充填される.杯状体の底面部の1細胞が非対称分裂し,将来は無性芽になる頂端側の細胞と柄になる基部側の細胞を生じる.頂端側の細胞は発生プログラムにしたがい特定の分裂面で細胞分裂し,胞子発芽体と同様に,ある段階で左右軸の先端に頂端細胞を規定し,最終的に周縁部は1細胞層,中央部は5~6細胞層の円盤状の構造体をつくりだす.このように,無性芽は1細胞に由来するクローン体である.この特徴は,形質転換や変異原による処理により得られた個体を世代をへることなく純系化するのに非常に都合がよく,ゼニゴケの実験が迅速に進む大きな理由のひとつである.
種子植物の胚発生は,受精卵が非対称分裂をするところからはじまり,柄細胞をもち決まったパターンで分裂するなど,無性芽の発生と類似した部分が多い.また,どちらにおいても,植物ホルモンのオーキシンによる転写制御が細胞分裂のパターンの形成に重要なはたらきをする点も共通している13,14).ただし,最終的につくりだされる無性芽は厚みのある円盤状の構造であり,胚発生と違って無性芽の発生においては放射状の体軸パターンの形成は起こらない.無性芽の発生は,体軸の形成のための細胞分裂のパターンの形成を研究するのにより単純なモデルとなりうる.
成熟した無性芽は杯状体のなかでは休眠状態にあり,杯状体の外にでると発芽して葉状体へと発生をはじめる.この発芽にも光がかかわっており,この場合は,胞子と違い光合成による糖の合成には依存せず,フィトクロムによる赤色光の受容がひき金となる15).また,無性芽のどちらの面が背腹になるかは発芽のまえには決まっておらず,発芽ののちの環境,とくに光および重力に依存して決定される.無性芽はその名のとおり無性的な繁殖器官であるが,ゼニゴケはそれ以外の無性繁殖法も備えている.動物に踏みつけられるなどして葉状体が切断されると,おもにノッチを含まない断片の中肋の付近の切断面に再生芽が形成され,やがて新たな葉状体を再生する.この効率は非常に高く,実験室においても植物ホルモンを含まない通常の培地で容易に再現される16,17).一方,ノッチを含む断片の切断面から再生芽は形成されず,ひきつづきノッチから成長する頂芽優勢を示す16).切断をうけても高い効率で再生するという特徴が,苔類が5億年近くも生きのびてきた理由のひとつかもしれない.
ゼニゴケは無性生殖にくわえ有性生殖によっても繁殖する.有性生殖への切り替えは光環境に依存し,この場合は遠赤色光が重要である.遠赤色光の割合の高い光をうけると,ノッチから生殖枝を形成するようになる.実験室では培養用の白色光の環境に遠赤色光を補光することにより,通常,2週間前後で生殖枝の形成が開始する18,19).ゼニゴケは雌雄異株であり,雌株は雌器托を,雄株は雄器托を形成する.それらの先端には指状の雌器床および円盤状の雄器床が形成され,それぞれ,卵細胞をつくる造卵器および精子をつくる造精器を多く分化する.最近の研究により,遠赤色光により造卵器や造精器などの生殖器の始原細胞の形成がさきに誘導され,それに依存するかたちで生殖器托が形成されることが明らかにされた20).雄器床の上面に水をたらすとほどなくして放出される精子を採取し,雌器床の根元に添加することにより,人工交配を容易に実施できる.交配ののち2~3週間ほどで胞子嚢が形成され,さらに2~3週間ほどで成熟し採取が可能になる.
ゼニゴケは,8本の常染色体および1本の性染色体XあるいはY(1倍体生物の性染色体はUおよびVとよぶことが提唱されている)を雌雄それぞれがもつ.2017年,苔類からははじめて,ゼニゴケの全ゲノム配列が発表された21).ゼニゴケのゲノムの解読は,オーストラリアMonash大学の研究グループと筆者らの共同計画として米国Joint Genome Instituteにおいて開始され,解析は国内外の50弱の研究グループにより進められた.その結果,225.8 Mbをカバーする約3000のスキャッフォールドに約19,000個の遺伝子が見い出された.すでに解読されていたY染色体にくわえ22),X染色体の配列も明らかにされた.また,筆者らは国立遺伝学研究所の研究グループと共同でMarpolBase(URL:http://marchantia.info)を開発した.MarpolBaseは,遺伝子の構造,発現,命名などに関する情報を提供する機能,遺伝子配列の取得をアシストする機能,ゲノム編集のためのガイド配列の設計プログラム,などを備えたユーザーフレンドリーなゼニゴケのゲノムデータベースである.今後は,アノテーションをさらに充実させていくとともに,トランスクリプトームやエピゲノムなどに関するさまざまな情報を閲覧できるよう更新していく予定である.
ゼニゴケのゲノムのもっとも大きな特徴は,陸上植物のもつ転写因子やシグナル伝達因子などをコードする制御系の遺伝子をほぼ一通りもち,かつ,それらの冗長性が非常に低いことである.陸上植物のもつ50の転写因子ファミリーのうち,ゼニゴケには47が見い出された.シロイヌナズナには約2000個の転写因子の遺伝子が存在するが,ゼニゴケは398個(常染色体に387個,X染色体に7個,Y染色体に4個)をもち,ほとんどの場合,各ファミリーのサブファミリーごとにひとつあるいは少数の遺伝子を保持する21).発生は転写因子により制御されることを考えると,種子や花などの発明は,新たに獲得した転写因子により遺伝子制御ネットワークが付加されたことよりも,すでにもっていた転写因子の遺伝子制御ネットワークの転用や,遺伝子重複ののちの機能の分担あるいは新しい機能の獲得によるところが大きいと示唆される.ゼニゴケには花芽メリステムの形成に必須なLEAFYファミリーや花器官の形成に中心的な役割をはたすMADSボックスファミリーが存在すること,そして,MADSボックスファミリーの被子植物における爆発的な増加は,そのような進化の様式を如実に物語る.
雌の標準株としてTakaragaike-2(Tak-2)株,雄の標準株としてTakaragaike-1(Tak-1)株が使われている.ゲノムの解読にはTak-2とTak-1の雑種第1代をTak-1に4回戻し交配した雌株を用いた21).ゼニゴケは生活環をとおして寒天培地を含む容器のなかで無菌的に生育させることができる.市販のフィルター付き培養容器を用いることにより,生殖器托の分化から人工交配,胞子嚢の形成までが行える.得られた胞子をそのまま寒天培地にまくことにより,滅菌作業なしに次世代の無菌個体を取得できる.研究で得られた変異体や形質転換体などの株の長期の保存は大切である.ゼニゴケは胞子や無性芽など,もともと長期間にわたり維持される細胞や器官があり,それらは簡単な処理をすることで冷凍庫や冷蔵庫において年単位で保存できる.滅菌処理をした胞子の懸濁液も市販の器具を用いることで凍結保存が可能である.最近,細胞内をガラス化し液体窒素において保存することにより無性芽や葉状体を半永久的に保存する手法が開発された23).さらに,精子の凍結保存法も開発された24).植え継ぎでしか維持できないのであればそれに相当の労力を費やさねばならないが,ゼニゴケは大切な研究資源の維持も簡単である.
ゼニゴケの研究者コミュニティにおいて承認された遺伝子命名法および遺伝子型表記法については,文献25) を参照されたい.
形質転換が可能であることは,モデル生物としての最大の要件であるといっても過言ではない.ゼニゴケにおいてはアグロバクテリウムを用いた高効率な形質転換法が開発され26),さまざまな実験が可能になった.この手法は胞子発芽体を用いるもので,ひとつの胞子嚢あたり1000以上もの独立した形質転換の系統が得られる.T-DNAタギング法による変異体の探索や,のちに述べる相同組換えによる遺伝子の破壊など,大量の形質転換体を得る必要があるときにはこの手法を用いる.ただし,胞子を用いるため,得られる形質転換体は雌雄親株の混合した遺伝的な背景をもつことに注意する必要がある.さらに,葉状体の断片に形成される再生芽に対しアグロバクテリウムを用いてDNAを導入する手法も開発された17).これは,被子植物において用いられるリーフディスク形質転換法と同様に,植物の高い再生能を利用するものである.数百の形質転換体をいちどに得ることにはむかないが,すでに確立した形質転換体など特定の株にDNAを導入できること,また,胞子を取得する必要のないことなどが利点である.ゼニゴケとアグロバクテリウムの共培養と.そののちのアグロバクテリウムの洗浄,薬剤による選抜まで,寒天培地を取り替えることなく1枚ですべて行えるAgarTrap法という手法も報告された27).胞子発芽体,葉状体,無性芽など,さまざまな細胞や組織に適用されている.
これまでに,アグロバクテリウムによる形質転換に用いるための種々のバイナリーベクターが構築された.選抜に用いる薬剤としては,ハイグロマイシン,ゲンタマイシン,クロロスルフロン,G418の4種類がある.実験によっては,複数の外来遺伝子を導入したい場合がある.ゼニゴケにおいては,異なるバイナリーベクターをもつアグロバクテリウムを混合して胞子発芽体に感染させることにより,多重の形質転換体をいちどに取得できる.2種類のベクターを用いた場合,一方のベクターの薬剤マーカーだけを用いて得られた形質転換体の約3割に,もう一方のベクターも導入される28).複数の同一の薬剤マーカーのベクターを用いて,多重の形質転換体を遺伝子タイピングなどにより選抜することも可能であり,そうすることでマーカーを節約できる.
任意の遺伝子を,恒常発現プロモーター,蛍光タンパク質タグ,エピトープタグ,発現レポーターなどにGateway技術を用いて融合できるようにしたpMpGWBバイナリーベクターシリーズが,4種類の薬剤マーカーのすべてについて作製された28).過剰な発現により生育が阻害されるような遺伝子は,恒常的なプロモーターでは高過剰な発現体を得ることができない.それを回避するには,誘導的な発現が有効である.転写因子など核において機能するタンパク質の場合にはグルココルチコイド受容体との融合タンパク質発現系が有効であり,pMpGWBバイナリーベクターシリーズに含まれる.形質転換体にデキサメタゾンを処理することにより,目的のタンパク質の核への移行がひき起こされる.細胞質やオルガネラなどにおいて機能するタンパク質や,miRNAなどのRNAを誘導的に発現させたい場合にはトランスアクチベーション系が有効であり,XVE系をゼニゴケ用に改変したベクターが報告された29).人工の転写因子XVEを発現させ,エストラジオールを処理することにより目的の遺伝子の転写を誘導する.
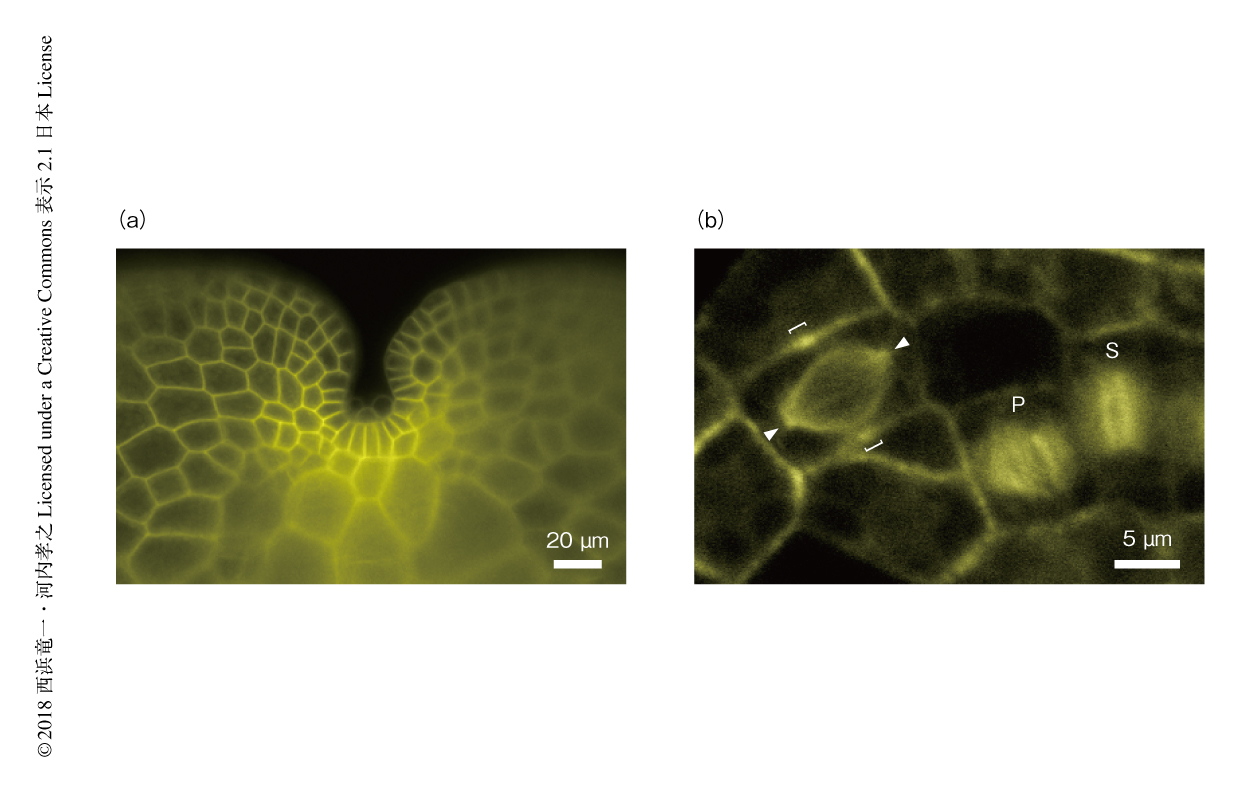
タンパク質の機能を解析するうえで,細胞における局在を知ることは重要である.これまでに,核28),細胞膜28,30),液胞30),小胞体28,30),ゴルジ体30),トランスゴルジネットワーク30),ペルオキシソーム31),油体膜30),Fアクチン31,32),微小管31,33,34) などの構造やオルガネラに局在するタンパク質が報告されており,今後の解析においてマーカーとして使うことができる.ここでは,細胞膜および微小管の例を示す(図3).
遺伝子の機能の理解において,変異体の表現型の解析から得られる情報は多い.ある遺伝子をみつけたなら,まずはその変異体を得ることを考えるであろう.そのためには,逆遺伝学的なアプローチが欠かせない.パラログの少ないゼニゴケにおいては,単一または少数の遺伝子を破壊するだけで表現型が現われることの多いのが利点であり,それに着目した研究が多い.ゼニゴケにおいて遺伝子の破壊を可能にした最初の手法は,相同組換えを利用した遺伝子ターゲッティングによるノックアウトである35).3~4 kbの相同アーム配列の内側の薬剤マーカーによる正の選抜と,相同アーム配列の外側の致死遺伝子による負の選抜とを組み合わせることにより,標的となる遺伝子が効率的にノックアウトされた株を選抜できる.平均すると,正の選抜を通過した形質転換体の約1%のノックアウト株が得られる.これまで,未発表のものも含めこの手法により100近い遺伝子が破壊された.通常,100個体以上の形質転換体を遺伝子タイピングする必要があるため,胞子発芽体の形質転換を用いる必要がある.
遺伝子破壊と同じ原理でタンパク質のC末端にCitrineまたはTagRFPを導入するノックインベクターも作製された20).この手法で取得される株は標的となる遺伝子の座位から蛍光タンパク質との融合タンパク質を発現するので,より本来の発現制御に近いかたちで標的となるタンパク質が蓄積する細胞や組織の同定および細胞における局在の解析が行える.pMpGWBベクターなどを用いて,その遺伝子のプロモーター+コーディング配列+蛍光タンパク質+ターミネーターを外来遺伝子として導入しても,T-DNAの挿入部位のポジション効果による発現のばらつきや,制御領域が含まれていないなどの理由から,正確な発現パターンを解明できないことが往々にある.外来遺伝子としては発現が検出されなかったが,ノックイン株では検出された例もある.ただし,現在のベクターは構造上,3’側非翻訳領域およびターミネーターによる制御ははたらかないことに留意する必要がある.また,現在のところ,N末端にタグをノックインする系は構築されていない.これらは今後の課題である.
エンドヌクレアーゼにより部位特異的に2本鎖DNA切断を導入し,非相同末端結合や相同組換えなどによる修復を利用してゲノム配列を改変するゲノム編集技術は,多くの種において遺伝子改変を可能にした.なかでも,簡便さと応用範囲の広さから,最近はCRISPR-Cas9を用いる手法が主流となっている.ゼニゴケにおいては,2014年初頭にCRISPR-Cas9によるゲノム編集が報告された36).しかし,ゲノム編集の効率は低く,標的となる遺伝子の変異体の表現型を指標にしてようやくゲノム編集の起こった株を同定できる程度であった.筆者らは,シロイヌナズナにコドンを最適化したCas9を用いることにより,表現型を指標にせずとも,無作為に選択した株を遺伝子タイピングすることによりゲノム編集の起こった株を同定できるレベルにまでゲノム編集の効率を格段に上昇させる手法を開発した37).発現カセットに効率よくガイドRNAをクローニングできるエントリーベクターと,Cas9の発現カセットとGatewayカセットの両方をもつバイナリーベクターの系が構築され,GatewayカセットをガイドRNAの発現カセットに組換えた単一のバイナリーベクターにより得られる形質転換体を10個体ほど遺伝子タイピングすれば,たいていの場合,複数の個体においてゲノム編集が確認されるようになった.このようにして得られたゲノム編集の起こった株においてはCas9およびガイドRNAが恒常的に発現しつづけるが,それ自体はゼニゴケの生育に影響をおよぼすことはなく,また,オフターゲットの候補と予想される配列における編集も認められていない.また,2つのガイドRNAを発現させることにより,そのあいだの領域を大きく欠失させることにも成功した37).
2倍体生物においては,必須となる遺伝子の変異はヘテロ接合体として維持し,次世代でホモ接合体として分離した個体において(最初に必須の機能を発揮する発生の段階の)表現型を解析することが可能である.しかし,1倍体生物においては必須となる遺伝子の変異体は取得できない.解析の対象となる遺伝子が細胞の生存にとり必須の機能をもつ場合,また,生活環において複数の発生の段階にて必須の役割をはたす場合には,ある条件でのみその遺伝子の機能を喪失させられる変異体が必要である.さきに述べたXVE系を用いて人工のmiRNAを発現させることにより,薬剤により誘導的に標的となる遺伝子をノックダウンできることが示された29).発現の抑制のレベルは系統によりほぼ完全なものから部分的なものまでさまざまであり,また,薬剤の濃度によっても抑制のレベルは制御できると考えられ,幅広い表現型を観察できる.
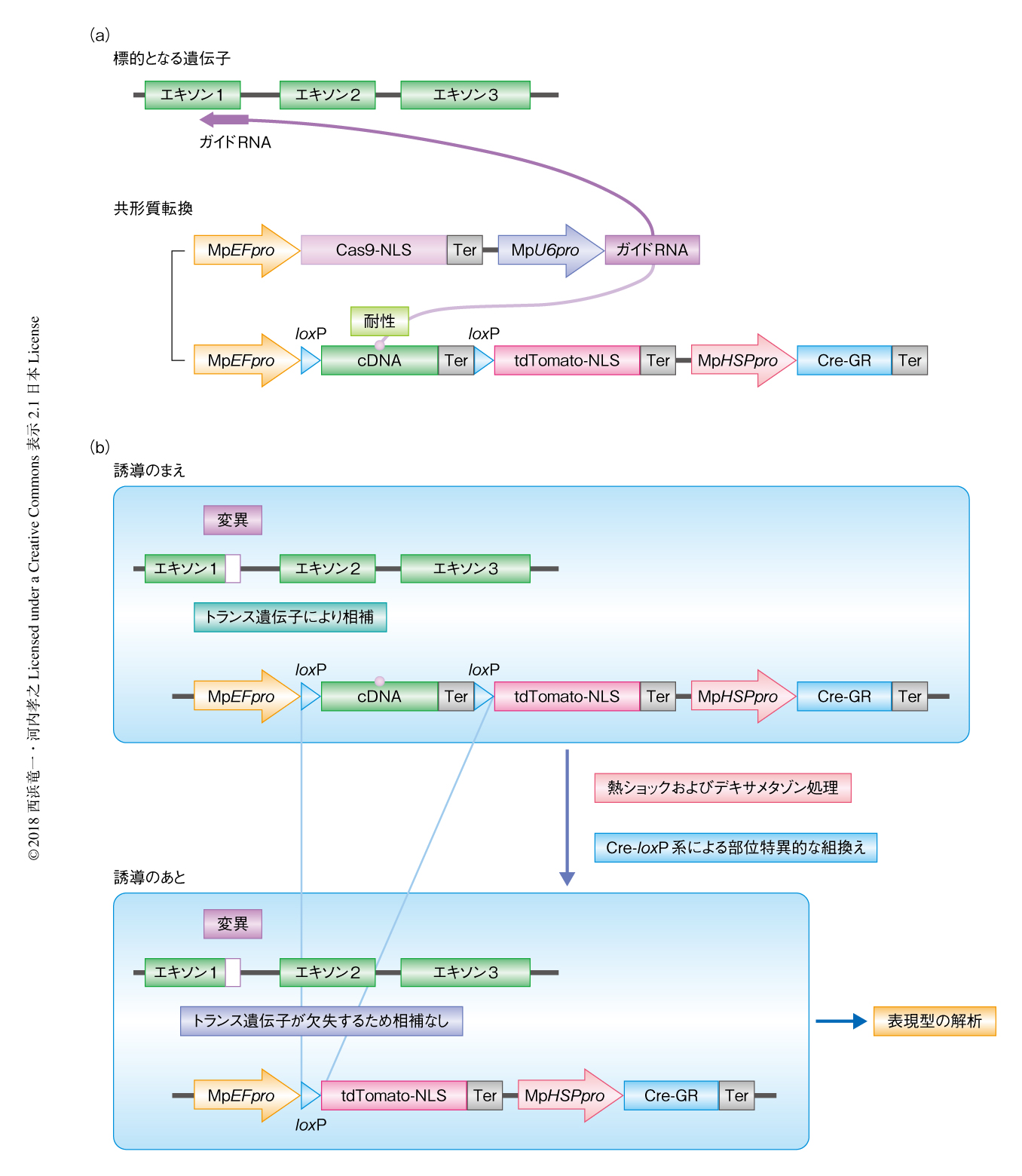
筆者らは,別の手法として,条件的に遺伝子を欠損させることのできる株を1回の形質転換により取得する方法を開発した37)(図4).これは,CRISPR-Cas9による標的となる遺伝子への変異の導入と,条件的に除去を可能とした標的となる遺伝子の相補のためのトランス遺伝子の導入を同時に行うものである.標的となる遺伝子の相補のためのトランス遺伝子はガイドRNAに耐性である必要があり,アミノ酸配列を変化させないよう同義置換を導入することにより耐性をあたえる.また,ガイドRNAをエキソンとイントロンのジャンクションに設計できれば,野生型のcDNAをそのまま標的となる遺伝子の相補のためのトランス遺伝子として用いることができ,もっとも簡便である.標的となる遺伝子の相補のためのトランス遺伝子の除去にはCre-loxP系による部位特異的な組換えを用いる.グルココルチコイド受容体と融合したCre組換え酵素をコードする遺伝子を熱ショックプロモーターと連結することにより,デキサメタゾンの処理および熱ショックの2つの条件による,もれの少ない効率的な組換えの誘導が実現された38).条件的なノックアウト株として用いるには,できるかぎり1コピーで導入されたトランス遺伝子をもち,Cre-loxP系による組換えの効率の高い株を選抜することが重要である.
ゼニゴケを用いることにより,ある遺伝子が陸上化にはたした役割や,ある遺伝子ファミリーの陸上植物における機能や制御の進化について,さまざまな知見を得られることが期待される.そのような視点について,以下,いくつか述べる.
ゼニゴケは雌雄異株であるため,生殖器托,造卵器および造精器,卵および精子といった生殖器官や配偶子の形成を制御する機構について,反対の性の影響をうけることなく解析できる.また,生殖器官を比較的容易に取り出したり集めたりできることもゼニゴケの特徴である.くわえて,精子の形成や機能の解析に対し分子遺伝学的なアプローチを適用できることは39-42),動物を含めた生命科学において魅力的である.さらに,のちに述べるように,ゼニゴケにおいては減数分裂と有性生殖が時間的かつ発生的に完全に切り離されている.これは,維管束植物や動物における有性生殖の機構とは異なる大きな特徴であり,その解析には格好の材料といえる.そのような背景をもとに,ゼニゴケの有性生殖に関連した研究がさかんになっている.
配偶体世代はその名のとおり配偶子をつくる世代であり,胞子からはじまり,配偶子の形成をへて,受精までをさす.被子植物において配偶体世代は極度に縮退し,時間的にも非常に短い(図2).減数分裂により生じた大胞子および小胞子が胚嚢および花粉を形成し,それぞれ数回の体細胞分裂をへて配偶子を分化する.その際,大胞子では核のみが8個に増加したのちに細胞化により卵細胞や中央細胞を生じるのに対し,小胞子では非対称分裂により大きい栄養細胞と小さい雄原細胞とに分かれ,雄原細胞が栄養細胞に取り込まれたのちさらに均等分裂して2個の精細胞になる.受粉ののち花粉管が伸長し胚嚢に達すると,花粉管から放出された精細胞がひとつずつ卵細胞および中央細胞と受精する重複受精が起こり,配偶体世代は終了する.一方,ゼニゴケは胞子が発芽するとさかんに細胞分裂し葉状体を形成して栄養成長するため,配偶子の形成を開始するまでの時間が長い(図2).しかも,そのような有性生殖期への移行は光や温度などの環境からの刺激に依存するため,適切な条件が整わないかぎり配偶子は形成されない.ゼニゴケの解析により,ゼニゴケの日長に依存的な配偶子の形成と被子植物の花成とのあいだに制御因子の共通性が見い出された18).つまり,日長に依存的な制御のしくみは配偶体世代において発明され,陸上植物の進化の過程において胞子体世代の成長相の転換に転用されたことが明らかにされた18,43).そのあいだに,コケ植物にはない花を咲かせるためのさまざまなしかけが発明され胞子体世代に追加されたことが想像される.また,コケ植物においては配偶子の形成そのものにも多くのステップがかかわる.まず,生殖器(造卵器および造精器)の単一の始原細胞が規定される.それが特定のパターンで非対称分裂することにより,将来は配偶子になる前駆体細胞とそれをとりかこむジャケット細胞が生じる.前駆体細胞は,雌においてはさらなる数回の非対称分裂をへて卵細胞を生じる.雄においては同調的な細胞分裂により細胞を増加させたのち,特徴的な対角線の方向の分裂によりおのおのの細胞は精子に分化する44).
2016年,国内外の2つの研究グループによりあいついで,転写因子であるRKD(ゼニゴケにおいては,MpRKDのひとつのみ)がゼニゴケにおいて卵細胞の分化の制御にかかわると報告された42,45).MpRKDの機能欠損株においては卵細胞の前駆体は形成されたものの,卵細胞は成熟せず未成熟なまま細胞分裂が起こった.2017年には,シロイヌナズナにおいてもRKDの複数のホモログが雌性配偶子の発生において機能することが報告され46),RKDは進化的に保存された機能をもつことがわかった.さらに,雄性配偶子の形成の過程が詳細に観察されてステージに分けられるとともに,造精器におけるトランスクリプトーム解析が実施された.花粉や精細胞の発生あるいは分化にかかわる遺伝子がそれぞれ特異的なステージにおいて発現していたことから,雄性配偶子の形成の機構は進化の過程において大枠では保存されていることが示唆された39).
さて,植物の生殖系列はどのように規定されるのであろうか.被子植物における胞子の形成から配偶子の形成までの短い期間では,生殖系列の規定と配偶子の分化がほぼ同時に起こるためそれらの区別ははっきりしなかった.最近のゼニゴケを用いた研究により,MpBONOBOと命名された塩基性ヘリックス-ループ-ヘリックス型の転写因子の機能が生殖器の形成に必要十分であること,MpBONOBOは生殖器の始原細胞および配偶子の前駆体細胞において一過的に蓄積することが示された20).シロイヌナズナのオルソログとして見い出されたBNB1およびBNB2の二重欠損株においては,小胞子の非対称分裂は起こったものの,小さい細胞が雄原細胞として機能しなくなった.さらに,BNB2は小さい細胞において一過的に蓄積した20).以上のことから,MpBONOBOのホモログは配偶体世代において生殖系列を規定する進化的に保存された転写因子であると考えられた.ゼニゴケの発見を起点として,植物において共通の原理が見い出された好例である.MpBONOBOのホモログの発現を基準に考えると,コケ植物においてみられる,胞子から栄養成長をへて生殖細胞の系列が決まるまでの期間と,生殖細胞の系列が規定されてから配偶子が形成されるまでの期間が,被子植物においてはどちらも1回の細胞分裂に縮退したといえる(図2).ゼニゴケにおいてはMpRKDが精子の形成においても必須ではないが重要なはたらきをすることが示されているが42),シロイヌナズナにおいてはRKDの雄性配偶子の形成への関与は示唆されていないことから,その機能は縮退の過程で失われた可能性が高い.
ゼニゴケのゲノムは制御系の遺伝子について遺伝子の重複が少ない.シロイヌナズナやイネなど被子植物のモデル生物において,ある現象への関与はわかっているものの高い冗長性などの理由からまだ十分に解明されていない遺伝子の機能やしくみについて,ゼニゴケはその解明に貢献する可能性がある.それにくわえて,遺伝子重複により生じたパラログの機能の分担や新しい機能の獲得について進化的な道筋を理解するのにも適している.好例はフィトクロムである.被子植物においてフィトクロムはI型とII型に大別される.I型は光の照射により急速に分解されるのに対し,II型は光に対し安定である.また,I型は赤色光と遠赤色光のどちらの照射によっても核に移行するのに対し,II型は赤色光下においてのみ核に移行するという違いもある.ゼニゴケにおいて,フィトクロムはMpphyのひとつしか存在しないが,Mpphyは光安定性が高く,かつ,核への移行は赤色光と遠赤色光のどちらでも起こることから,I型とII型の特徴をあわせもつことが明らかにされた15).さらに,I型は超低光量の応答および遠赤色光の高照射の応答に,II型は赤色光と遠赤色光との可逆性を示す低光量の応答をつかさどるが,Mpphyは低光量の応答だけでなく15),最近の解析から,遠赤色光の高照射の応答においても機能することがわかってきた.このように,もともとはひとつで低光量の応答と遠赤色光の高照射の応答の両方を制御していたが,陸上植物の進化の過程,おそらく,種子植物の分岐の前後に,パラログの機能の分担(I型およびII型)および新しい機能の獲得(超低光量の応答)が起こったことが推測された47).
新たなしくみや遺伝子の新しい機能などの意外な発見は,順遺伝学的な解析によりもたらされることがよくある.ゼニゴケにおいて遺伝子の冗長性が低いことは,順遺伝学的なアプローチが有効であることも意味する.さきに述べたMpBONOBOも,生殖器托の形成に遠赤色光を必要としない変異体48) の責任遺伝子の産物として同定された.T-DNAタギング法を用いた変異体の探索および責任遺伝子の同定も行われており,気室の形成に必須なMpNOPPERABO1遺伝子をはじめ49),複数の遺伝子が同定されている13,50,51).特筆すべきは,T-DNAタギング法による336,000個の形質転換体を探索し,仮根の伸長にかかわる33個の遺伝子を同定した例である51).ここでは,1次スクリーニングにより301個の仮根の伸長が不全の変異体を単離し,交配ができた165株のうち62株がT-DNAのハイグロマイシン耐性遺伝子と連鎖していたと報告された.さらに,そのうちの57株のT-DNAの挿入部位がTAIL-PCR法により同定された.また,化学変異原やガンマ線を用いた突然変異の誘発も可能であり,未発表ではあるが,これまでに筆者らは興味深い表現型を示す変異体を得ている.1株ずつ分離して変異体を探索するのは骨の折れる作業であるが,たとえば,変異体だけが生育する条件での探索であれば,T-DNAタギング法による形質転換体やエチルメタンスルホン酸などの変異原により処理した個体を数多く探索することができる.筆者らは,T-DNAタギング法による約200,000個の形質転換体のなかから,高濃度のオーキシンに耐性を示す変異体のひとつとしてMpARF1遺伝子の挿入変異株を単離した経験がある13).
このレビューにおいては,ゼニゴケのモデル生物としての特徴について述べてきたが,ここでとりあげたこと以外にも,さまざまな生理応答や細胞制御のモデルとして有効である.実際,植物ホルモン,分泌ペプチドによる細胞間コミュニケーション,光合成,細胞骨格,病害菌への応答などについての研究が進んでいる,植物の研究は食糧としての被子植物に集中しがちであるが,地球規模の環境問題などに目をむければ,植物の全体を意識しさまざまな種の知見を比較しながら総合的に考察することによりみえてくることも多い.ゲノム情報とツールのそろったゼニゴケがもたらす貢献は,これからますます大きくなっていくと予想される.現在,コケ植物のうちモデル植物として実用的なのはヒメツリガネゴケおよびゼニゴケだけであるが,ゼニゴケの実験手法やツールはほかのコケ植物の機能の解析にも転用できるかもしれない.今後,さらに多くのコケ植物,また,シダ植物や緑藻についてもモデル生物化が進めば,植物の陸上化や進化のしくみについての理解は急速に深まるであろう.
タイトルを“モデル生物”としたのは,ゼニゴケはモデル植物としてだけでなく,生物全般のモデルとしても活用できると考えているからである.多様なツールを備え,迅速に実験のできるゼニゴケを細胞のハコとして用いて,動物も含むほかの生物に由来する遺伝子を発現させることにより,物質なり構造なり反応系なりを産生あるいは再構築することは比較的容易である.このような生物工学的あるいは合成生物学的な利用や,生命科学におけるさまざまな研究のプラットフォームとしての活用も有用であろう.また,生死を利用した変異体の探索は,オーキシンの例だけでなくほかの化合物にも適用が可能で,ケミカルバイオロジーとの相性もよいと考えられる.たとえば,毒性を示す化合物に対する耐性変異体を得ることにより,その化合物の作用機作の理解が促進されるだろう.1倍体で実験のできる酵母と同じような感覚でゼニゴケを用いることにより,被子植物や動物では得ることのむずかしい知見にたどりつく可能性がある.
目のつけどころしだいで,さまざまに,そして,手軽に活用できるのがゼニゴケである.このレビューがこれからの研究材料を考える一助となれば幸いである.
略歴:1997年 名古屋大学大学院理学研究科にて博士号取得,同年 同 博士研究員,2000年 米国Michigan大学 博士研究員,2001年 米国North Carolina大学 博士研究員,2005年 米国Stanford大学School of Medicineリサーチアソシエイト,2011年 京都大学大学院生命科学研究科 講師を経て,2017年より同 准教授.
研究テーマ:植物の環境に依存的な増殖および発生の制御機構.
抱負:細胞分裂の制御の研究を基軸として,植物の生存戦略を理解したい.
河内 孝之(Takayuki Kohchi)
京都大学大学院生命科学研究科 教授.
研究室URL:http://www.plantmb.lif.kyoto-u.ac.jp/
© 2018 西浜竜一・河内孝之 Licensed under CC 表示 2.1 日本
(京都大学大学院生命科学研究科 遺伝子特性学分野)
email:西浜竜一,河内孝之
領域融合レビュー, 7, e008 (2018) DOI: 10.7875/leading.author.7.e008
Ryuichi Nishihama & Takayuki Kohchi: The liverwort Marchantia polymorpha: an emerging model organism.
要 約
ゲノムの解読が容易になった現代の生命科学において,遺伝子の機能を進化軸にそって理解する研究がますますおもしろくなってきている.約4億8千年前に水生の緑藻から陸上化をはたし,そののち,さまざまな適応をなしとげてきた植物においても,そのような研究が熱をおびている.陸上植物の進化において鍵となるのが,もっとも基部に位置するコケ植物である.2017年,コケ植物である苔類ゼニゴケの全ゲノム配列が発表された.ゼニゴケのゲノムはとくに制御系の遺伝子について冗長性の低いことが明らかにされ,陸上植物の共通祖先のゲノムを連想させるものであった.ここ10年ほどのあいだに開発された分子遺伝学的なツールの充実ともあいまって,ゼニゴケは分子遺伝学やシステム生物学にもとづく自在な解析の可能な,日本発のモデル生物として確立された.このレビューにおいては,ゼニゴケの進化的な位置づけや1倍体の優占する生活環など生物学的な特徴,および,研究の基盤について解説する.また,ゼニゴケの特徴を活かした研究例を紹介し,植物の枠をこえたモデル生物としての活用の方向性について議論する.
はじめに
生命はその誕生から刻々と進化をつづけてきた.生物の多様性はこの営みの産物である.その根底にあるのは遺伝情報の微々たる変化の積み重ねであり,種における進化や新しい種の誕生の原動力となっている.この道筋は枝分かれをくり返しながらとぎれることなくつづいている.つまり,遺伝情報には進化の歴史が刻まれている.地球史における重大なイベントのひとつとして,およそ4億8千万年前に起こったとされる植物の陸上化があげられる1).それにより環境や地勢が変化し,さらに,動物の上陸も加速された.水生の緑藻から上陸をはたしたのち,植物は陸上においてさまざまな適応をなしとげ大繁栄するにいたった.植物のとった適応戦略の変遷をたどることは,食糧問題やエネルギー問題をかかえる人類の未来にとっても貴重な道標となる.上陸した当初の植物は絶滅しておりそのすがたをみることはできないが,現生の陸上植物においてもっとも進化的な基部に位置する系統はコケ植物である.コケ植物は根や花をつくらず,比較的単純な葉状性あるいは茎葉性のからだをしている.コケ植物ののち,維管束組織をもつシダ植物が分岐し,さらに,種子および花が順に発明され裸子植物および被子植物が誕生した.このように,陸上植物は共通の祖先をもつ単系統性である(図1).
次世代シークエンサーの普及により短期間かつ低コストでゲノムを解読できるようになると,植物の進化を分子の言葉で説明する研究がさかんになってきた.分子系統解析により植物の詳細な系統関係が明らかにされ,植物の多様性の理解は格段に進んだ.20世紀後半には分子生物学が台頭した.分子生物学のモデル生物にもとめられる重要な要件として,形質転換が可能であること,順遺伝学的および逆遺伝学的な解析が可能なこと,そして,ゲノムが解読されていることがあげられる.これらをすべてみたす植物として,双子葉植物のシロイヌナズナ(Arabidopsis thaliana)や単子葉植物のイネ(Oryza sativa)がいちはやく整備され,とくに1990年代から2000年代における植物の研究はこれらモデル植物に集中した.その戦略は成功し,発生,環境応答,光合成などについての膨大な知見がもたらされ植物の理解に大きく貢献した.そののち,緑藻のクラミドモナス(Chlamydomonas reinhardtii)やコケ植物のヒメツリガネゴケ(Physcomitrella patens)がモデル植物として確立されたことは,植物の進化の研究における一里塚であり,より総合的な議論が可能になった.一方で,そもそもモデル植物に形質や現象が存在しない,あるいは,複雑すぎるなどの理由により,未解明である重要な問題も植物の分野には多く残されている.このような問題に取り組むには,できるだけ多様な系統に属する種を対象とする必要がある.動物を含むほかの系統と同様に,植物においても進化の過程でゲノムの重複が起こり,遺伝子の機能の冗長性が増加し,機能の分担(subfunctionalization)や新しい機能の獲得(neofunctionalization)が進んだことを考えると,できるだけ単純な体制やゲノムをもつ種に注目するのはひとつの方略であろう.根源的な生命活動のモデルとしての大腸菌,真核生物のモデルとしての酵母が,生物学の進展にはたした役割については述べるまでもない.
筆者らは,コケ植物に属し単純な体制をもつゼニゴケ(Marchantia polymorpha)に着目して,さまざまな研究手法やツールを開発してきた.また,ゼニゴケのゲノムにはゲノムレベルでの重複が起こっていないことも明らかにされた.このような背景をもとに,ゼニゴケはシステム生物学や分子遺伝学にもとづく遺伝子の機能の自在な解析の可能なモデル生物として注目されるようになった.また,その扱いやすさや実験の迅速さは植物では群をぬく.このレビューにおいては,おもにこれから生物の研究を本格的にはじめたい人,なかでも,生物の多様性を理解したいと考えている人を対象として,モデル生物としてのゼニゴケの特徴および有用性について述べる.
1.ゼニゴケの生物学的な特徴
陸上植物は緑藻と共通の祖先をもち,そのなかでも車軸藻綱から分岐した(図1).車軸藻綱は側系統群であり,そのうち比較的基部に位置するクレブソルミディウム(Klebsormidium nitens)のゲノム2),および,シャジクモ(Chara braunii)のゲノム3)(新着論文レビュー でも掲載)が解読されている.最近の分子系統解析により,アオミドロ(Spirogyra)やミカヅキモ(Closterium)などを含む接合藻類が陸上植物にもっとも近縁な車軸藻綱の姉妹群であるとされている4).車軸藻綱から分岐した陸上植物の共通祖先は現存しないが,それにもっとも近縁な現生の陸上植物はコケ植物である.コケ植物は,苔類,蘚類,ツノゴケ類の3群からなる総称であり,ゼニゴケは苔類に属する.これら3群の系統関係については,分子系統解析のレベルではこれまでに3群側系統説から単系統説までさまざまな説が提案されており5),最新の解析によると苔類と蘚類の共通祖先がツノゴケ類と分岐したコケ植物単系統説が有力視されている6)(図1).化石の記録からは苔類がもっとも初期に分岐したのではないかともいわれている7,8).コケ植物の系統関係については議論があるものの,陸上植物が単系統性であることに疑いはない.いい換えると,すべての陸上植物は共通の祖先をもつ.このことは,共通祖先のもっていた遺伝子が数や役割を変えながら,コケ植物,シダ植物,裸子植物,被子植物と代々うけつがれて陸上植物は進化したことを意味する.そのため,とくに保存された遺伝子ファミリーについて,苔類のような共通祖先により近縁な植物(現生の苔類は祖先ではないことに注意)における機能を調べることにより,陸上化への貢献,機能や制御の原形,機能の普遍性と多様性,などについての理解が深まることが期待される.
緑藻は単細胞あるいは多細胞をとわず1倍体である.有性生殖により生じた2倍体の受精卵はただちに減数分裂を起こして1倍体の胞子を形成する.一方,コケ植物は配偶子(精子および卵細胞)が受精してもすぐには減数分裂を起こさず,体細胞分裂により2倍体の多細胞体である胞子体を形成する(図2).そのため,陸上植物は有胚植物ともいわれる.胞子体の細胞は決められた発生プログラムにそって増殖したのち,減数分裂により多数の1倍体胞子を形成する.接合ののちの2倍体細胞の増殖が初期の陸上植物の遺伝的な多様性の増加に貢献したと考えられる.また,1倍体世代(配偶体世代)と2倍体世代(胞子体世代)のどちらでも多細胞体をつくる世代交代は,陸上植物の特徴のひとつである(図2).このような世代交代がどのようなしくみで生じたかについては研究の的となっている.
以下,ゼニゴケの生活環について解説する.なお,その詳細は文献9) にくわしい.ゼニゴケの発芽は細胞伸長をともなわず,非対称な細胞分裂として起こる(図2).一般に,コケ植物の胞子の発芽には吸水にくわえ光の刺激が必要な場合が多い10,11).ゼニゴケの場合は光合成により合成された糖に依存する12).非対称分裂により生じた小さい細胞は仮根に分化し,大きい細胞はそののちさかんに細胞分裂する胞子発芽体になる.胞子発芽体のある段階で,頂端細胞とよばれる幹細胞が形成される.すると,形態形成がはじまり葉状体ができあがる.葉状体はその背側に規則的に気室をはりめぐらせ,腹側には単細胞性の仮根を伸ばして地面に固着する.このような3次元的な発生は陸上化にともない確立されたと考えられている.緑藻の体制は単細胞,直鎖状の細胞列,あるいは,1層の平面構造であり,2次元どまりであるからである.これは,幹細胞から娘細胞を切り出すときの分裂面の増加に依拠したといわれている.細胞が細胞壁によりかこまれ移動のできない植物に特有の進化の様式であるともいえる.ゼニゴケは生活環の大半をこの葉状体としてすごす.頂端細胞を含む分裂組織(メリステム)はノッチとよばれる葉状体の先端のくぼみにあり,ノッチが周期的に水平方向に倍加する.頂端の成長と二叉分枝のバランスがそろうと,むだなく平面をおおうように成長できる.栄養条件さえ整えばこの様式により無限に成長できるため,寿命という概念はあてはまらないのかもしれない.このように,当代を半永久的に維持できるのも,ゼニゴケのモデル生物としての利点である.二叉分枝と連動した頻度で,ゼニゴケの葉状体の背側には杯状体が形成される.筒状の壁にかこまれたその空間には直径1 mmにもみたない円盤状の構造体である無性芽が充填される.杯状体の底面部の1細胞が非対称分裂し,将来は無性芽になる頂端側の細胞と柄になる基部側の細胞を生じる.頂端側の細胞は発生プログラムにしたがい特定の分裂面で細胞分裂し,胞子発芽体と同様に,ある段階で左右軸の先端に頂端細胞を規定し,最終的に周縁部は1細胞層,中央部は5~6細胞層の円盤状の構造体をつくりだす.このように,無性芽は1細胞に由来するクローン体である.この特徴は,形質転換や変異原による処理により得られた個体を世代をへることなく純系化するのに非常に都合がよく,ゼニゴケの実験が迅速に進む大きな理由のひとつである.
種子植物の胚発生は,受精卵が非対称分裂をするところからはじまり,柄細胞をもち決まったパターンで分裂するなど,無性芽の発生と類似した部分が多い.また,どちらにおいても,植物ホルモンのオーキシンによる転写制御が細胞分裂のパターンの形成に重要なはたらきをする点も共通している13,14).ただし,最終的につくりだされる無性芽は厚みのある円盤状の構造であり,胚発生と違って無性芽の発生においては放射状の体軸パターンの形成は起こらない.無性芽の発生は,体軸の形成のための細胞分裂のパターンの形成を研究するのにより単純なモデルとなりうる.
成熟した無性芽は杯状体のなかでは休眠状態にあり,杯状体の外にでると発芽して葉状体へと発生をはじめる.この発芽にも光がかかわっており,この場合は,胞子と違い光合成による糖の合成には依存せず,フィトクロムによる赤色光の受容がひき金となる15).また,無性芽のどちらの面が背腹になるかは発芽のまえには決まっておらず,発芽ののちの環境,とくに光および重力に依存して決定される.無性芽はその名のとおり無性的な繁殖器官であるが,ゼニゴケはそれ以外の無性繁殖法も備えている.動物に踏みつけられるなどして葉状体が切断されると,おもにノッチを含まない断片の中肋の付近の切断面に再生芽が形成され,やがて新たな葉状体を再生する.この効率は非常に高く,実験室においても植物ホルモンを含まない通常の培地で容易に再現される16,17).一方,ノッチを含む断片の切断面から再生芽は形成されず,ひきつづきノッチから成長する頂芽優勢を示す16).切断をうけても高い効率で再生するという特徴が,苔類が5億年近くも生きのびてきた理由のひとつかもしれない.
ゼニゴケは無性生殖にくわえ有性生殖によっても繁殖する.有性生殖への切り替えは光環境に依存し,この場合は遠赤色光が重要である.遠赤色光の割合の高い光をうけると,ノッチから生殖枝を形成するようになる.実験室では培養用の白色光の環境に遠赤色光を補光することにより,通常,2週間前後で生殖枝の形成が開始する18,19).ゼニゴケは雌雄異株であり,雌株は雌器托を,雄株は雄器托を形成する.それらの先端には指状の雌器床および円盤状の雄器床が形成され,それぞれ,卵細胞をつくる造卵器および精子をつくる造精器を多く分化する.最近の研究により,遠赤色光により造卵器や造精器などの生殖器の始原細胞の形成がさきに誘導され,それに依存するかたちで生殖器托が形成されることが明らかにされた20).雄器床の上面に水をたらすとほどなくして放出される精子を採取し,雌器床の根元に添加することにより,人工交配を容易に実施できる.交配ののち2~3週間ほどで胞子嚢が形成され,さらに2~3週間ほどで成熟し採取が可能になる.
ゼニゴケは,8本の常染色体および1本の性染色体XあるいはY(1倍体生物の性染色体はUおよびVとよぶことが提唱されている)を雌雄それぞれがもつ.2017年,苔類からははじめて,ゼニゴケの全ゲノム配列が発表された21).ゼニゴケのゲノムの解読は,オーストラリアMonash大学の研究グループと筆者らの共同計画として米国Joint Genome Instituteにおいて開始され,解析は国内外の50弱の研究グループにより進められた.その結果,225.8 Mbをカバーする約3000のスキャッフォールドに約19,000個の遺伝子が見い出された.すでに解読されていたY染色体にくわえ22),X染色体の配列も明らかにされた.また,筆者らは国立遺伝学研究所の研究グループと共同でMarpolBase(URL:http://marchantia.info)を開発した.MarpolBaseは,遺伝子の構造,発現,命名などに関する情報を提供する機能,遺伝子配列の取得をアシストする機能,ゲノム編集のためのガイド配列の設計プログラム,などを備えたユーザーフレンドリーなゼニゴケのゲノムデータベースである.今後は,アノテーションをさらに充実させていくとともに,トランスクリプトームやエピゲノムなどに関するさまざまな情報を閲覧できるよう更新していく予定である.
ゼニゴケのゲノムのもっとも大きな特徴は,陸上植物のもつ転写因子やシグナル伝達因子などをコードする制御系の遺伝子をほぼ一通りもち,かつ,それらの冗長性が非常に低いことである.陸上植物のもつ50の転写因子ファミリーのうち,ゼニゴケには47が見い出された.シロイヌナズナには約2000個の転写因子の遺伝子が存在するが,ゼニゴケは398個(常染色体に387個,X染色体に7個,Y染色体に4個)をもち,ほとんどの場合,各ファミリーのサブファミリーごとにひとつあるいは少数の遺伝子を保持する21).発生は転写因子により制御されることを考えると,種子や花などの発明は,新たに獲得した転写因子により遺伝子制御ネットワークが付加されたことよりも,すでにもっていた転写因子の遺伝子制御ネットワークの転用や,遺伝子重複ののちの機能の分担あるいは新しい機能の獲得によるところが大きいと示唆される.ゼニゴケには花芽メリステムの形成に必須なLEAFYファミリーや花器官の形成に中心的な役割をはたすMADSボックスファミリーが存在すること,そして,MADSボックスファミリーの被子植物における爆発的な増加は,そのような進化の様式を如実に物語る.
2.ゼニゴケの実験系
雌の標準株としてTakaragaike-2(Tak-2)株,雄の標準株としてTakaragaike-1(Tak-1)株が使われている.ゲノムの解読にはTak-2とTak-1の雑種第1代をTak-1に4回戻し交配した雌株を用いた21).ゼニゴケは生活環をとおして寒天培地を含む容器のなかで無菌的に生育させることができる.市販のフィルター付き培養容器を用いることにより,生殖器托の分化から人工交配,胞子嚢の形成までが行える.得られた胞子をそのまま寒天培地にまくことにより,滅菌作業なしに次世代の無菌個体を取得できる.研究で得られた変異体や形質転換体などの株の長期の保存は大切である.ゼニゴケは胞子や無性芽など,もともと長期間にわたり維持される細胞や器官があり,それらは簡単な処理をすることで冷凍庫や冷蔵庫において年単位で保存できる.滅菌処理をした胞子の懸濁液も市販の器具を用いることで凍結保存が可能である.最近,細胞内をガラス化し液体窒素において保存することにより無性芽や葉状体を半永久的に保存する手法が開発された23).さらに,精子の凍結保存法も開発された24).植え継ぎでしか維持できないのであればそれに相当の労力を費やさねばならないが,ゼニゴケは大切な研究資源の維持も簡単である.
ゼニゴケの研究者コミュニティにおいて承認された遺伝子命名法および遺伝子型表記法については,文献25) を参照されたい.
形質転換が可能であることは,モデル生物としての最大の要件であるといっても過言ではない.ゼニゴケにおいてはアグロバクテリウムを用いた高効率な形質転換法が開発され26),さまざまな実験が可能になった.この手法は胞子発芽体を用いるもので,ひとつの胞子嚢あたり1000以上もの独立した形質転換の系統が得られる.T-DNAタギング法による変異体の探索や,のちに述べる相同組換えによる遺伝子の破壊など,大量の形質転換体を得る必要があるときにはこの手法を用いる.ただし,胞子を用いるため,得られる形質転換体は雌雄親株の混合した遺伝的な背景をもつことに注意する必要がある.さらに,葉状体の断片に形成される再生芽に対しアグロバクテリウムを用いてDNAを導入する手法も開発された17).これは,被子植物において用いられるリーフディスク形質転換法と同様に,植物の高い再生能を利用するものである.数百の形質転換体をいちどに得ることにはむかないが,すでに確立した形質転換体など特定の株にDNAを導入できること,また,胞子を取得する必要のないことなどが利点である.ゼニゴケとアグロバクテリウムの共培養と.そののちのアグロバクテリウムの洗浄,薬剤による選抜まで,寒天培地を取り替えることなく1枚ですべて行えるAgarTrap法という手法も報告された27).胞子発芽体,葉状体,無性芽など,さまざまな細胞や組織に適用されている.
これまでに,アグロバクテリウムによる形質転換に用いるための種々のバイナリーベクターが構築された.選抜に用いる薬剤としては,ハイグロマイシン,ゲンタマイシン,クロロスルフロン,G418の4種類がある.実験によっては,複数の外来遺伝子を導入したい場合がある.ゼニゴケにおいては,異なるバイナリーベクターをもつアグロバクテリウムを混合して胞子発芽体に感染させることにより,多重の形質転換体をいちどに取得できる.2種類のベクターを用いた場合,一方のベクターの薬剤マーカーだけを用いて得られた形質転換体の約3割に,もう一方のベクターも導入される28).複数の同一の薬剤マーカーのベクターを用いて,多重の形質転換体を遺伝子タイピングなどにより選抜することも可能であり,そうすることでマーカーを節約できる.
任意の遺伝子を,恒常発現プロモーター,蛍光タンパク質タグ,エピトープタグ,発現レポーターなどにGateway技術を用いて融合できるようにしたpMpGWBバイナリーベクターシリーズが,4種類の薬剤マーカーのすべてについて作製された28).過剰な発現により生育が阻害されるような遺伝子は,恒常的なプロモーターでは高過剰な発現体を得ることができない.それを回避するには,誘導的な発現が有効である.転写因子など核において機能するタンパク質の場合にはグルココルチコイド受容体との融合タンパク質発現系が有効であり,pMpGWBバイナリーベクターシリーズに含まれる.形質転換体にデキサメタゾンを処理することにより,目的のタンパク質の核への移行がひき起こされる.細胞質やオルガネラなどにおいて機能するタンパク質や,miRNAなどのRNAを誘導的に発現させたい場合にはトランスアクチベーション系が有効であり,XVE系をゼニゴケ用に改変したベクターが報告された29).人工の転写因子XVEを発現させ,エストラジオールを処理することにより目的の遺伝子の転写を誘導する.
タンパク質の機能を解析するうえで,細胞における局在を知ることは重要である.これまでに,核28),細胞膜28,30),液胞30),小胞体28,30),ゴルジ体30),トランスゴルジネットワーク30),ペルオキシソーム31),油体膜30),Fアクチン31,32),微小管31,33,34) などの構造やオルガネラに局在するタンパク質が報告されており,今後の解析においてマーカーとして使うことができる.ここでは,細胞膜および微小管の例を示す(図3).
遺伝子の機能の理解において,変異体の表現型の解析から得られる情報は多い.ある遺伝子をみつけたなら,まずはその変異体を得ることを考えるであろう.そのためには,逆遺伝学的なアプローチが欠かせない.パラログの少ないゼニゴケにおいては,単一または少数の遺伝子を破壊するだけで表現型が現われることの多いのが利点であり,それに着目した研究が多い.ゼニゴケにおいて遺伝子の破壊を可能にした最初の手法は,相同組換えを利用した遺伝子ターゲッティングによるノックアウトである35).3~4 kbの相同アーム配列の内側の薬剤マーカーによる正の選抜と,相同アーム配列の外側の致死遺伝子による負の選抜とを組み合わせることにより,標的となる遺伝子が効率的にノックアウトされた株を選抜できる.平均すると,正の選抜を通過した形質転換体の約1%のノックアウト株が得られる.これまで,未発表のものも含めこの手法により100近い遺伝子が破壊された.通常,100個体以上の形質転換体を遺伝子タイピングする必要があるため,胞子発芽体の形質転換を用いる必要がある.
遺伝子破壊と同じ原理でタンパク質のC末端にCitrineまたはTagRFPを導入するノックインベクターも作製された20).この手法で取得される株は標的となる遺伝子の座位から蛍光タンパク質との融合タンパク質を発現するので,より本来の発現制御に近いかたちで標的となるタンパク質が蓄積する細胞や組織の同定および細胞における局在の解析が行える.pMpGWBベクターなどを用いて,その遺伝子のプロモーター+コーディング配列+蛍光タンパク質+ターミネーターを外来遺伝子として導入しても,T-DNAの挿入部位のポジション効果による発現のばらつきや,制御領域が含まれていないなどの理由から,正確な発現パターンを解明できないことが往々にある.外来遺伝子としては発現が検出されなかったが,ノックイン株では検出された例もある.ただし,現在のベクターは構造上,3’側非翻訳領域およびターミネーターによる制御ははたらかないことに留意する必要がある.また,現在のところ,N末端にタグをノックインする系は構築されていない.これらは今後の課題である.
エンドヌクレアーゼにより部位特異的に2本鎖DNA切断を導入し,非相同末端結合や相同組換えなどによる修復を利用してゲノム配列を改変するゲノム編集技術は,多くの種において遺伝子改変を可能にした.なかでも,簡便さと応用範囲の広さから,最近はCRISPR-Cas9を用いる手法が主流となっている.ゼニゴケにおいては,2014年初頭にCRISPR-Cas9によるゲノム編集が報告された36).しかし,ゲノム編集の効率は低く,標的となる遺伝子の変異体の表現型を指標にしてようやくゲノム編集の起こった株を同定できる程度であった.筆者らは,シロイヌナズナにコドンを最適化したCas9を用いることにより,表現型を指標にせずとも,無作為に選択した株を遺伝子タイピングすることによりゲノム編集の起こった株を同定できるレベルにまでゲノム編集の効率を格段に上昇させる手法を開発した37).発現カセットに効率よくガイドRNAをクローニングできるエントリーベクターと,Cas9の発現カセットとGatewayカセットの両方をもつバイナリーベクターの系が構築され,GatewayカセットをガイドRNAの発現カセットに組換えた単一のバイナリーベクターにより得られる形質転換体を10個体ほど遺伝子タイピングすれば,たいていの場合,複数の個体においてゲノム編集が確認されるようになった.このようにして得られたゲノム編集の起こった株においてはCas9およびガイドRNAが恒常的に発現しつづけるが,それ自体はゼニゴケの生育に影響をおよぼすことはなく,また,オフターゲットの候補と予想される配列における編集も認められていない.また,2つのガイドRNAを発現させることにより,そのあいだの領域を大きく欠失させることにも成功した37).
2倍体生物においては,必須となる遺伝子の変異はヘテロ接合体として維持し,次世代でホモ接合体として分離した個体において(最初に必須の機能を発揮する発生の段階の)表現型を解析することが可能である.しかし,1倍体生物においては必須となる遺伝子の変異体は取得できない.解析の対象となる遺伝子が細胞の生存にとり必須の機能をもつ場合,また,生活環において複数の発生の段階にて必須の役割をはたす場合には,ある条件でのみその遺伝子の機能を喪失させられる変異体が必要である.さきに述べたXVE系を用いて人工のmiRNAを発現させることにより,薬剤により誘導的に標的となる遺伝子をノックダウンできることが示された29).発現の抑制のレベルは系統によりほぼ完全なものから部分的なものまでさまざまであり,また,薬剤の濃度によっても抑制のレベルは制御できると考えられ,幅広い表現型を観察できる.
筆者らは,別の手法として,条件的に遺伝子を欠損させることのできる株を1回の形質転換により取得する方法を開発した37)(図4).これは,CRISPR-Cas9による標的となる遺伝子への変異の導入と,条件的に除去を可能とした標的となる遺伝子の相補のためのトランス遺伝子の導入を同時に行うものである.標的となる遺伝子の相補のためのトランス遺伝子はガイドRNAに耐性である必要があり,アミノ酸配列を変化させないよう同義置換を導入することにより耐性をあたえる.また,ガイドRNAをエキソンとイントロンのジャンクションに設計できれば,野生型のcDNAをそのまま標的となる遺伝子の相補のためのトランス遺伝子として用いることができ,もっとも簡便である.標的となる遺伝子の相補のためのトランス遺伝子の除去にはCre-loxP系による部位特異的な組換えを用いる.グルココルチコイド受容体と融合したCre組換え酵素をコードする遺伝子を熱ショックプロモーターと連結することにより,デキサメタゾンの処理および熱ショックの2つの条件による,もれの少ない効率的な組換えの誘導が実現された38).条件的なノックアウト株として用いるには,できるかぎり1コピーで導入されたトランス遺伝子をもち,Cre-loxP系による組換えの効率の高い株を選抜することが重要である.
3.ゼニゴケの利点を活かした研究の例
ゼニゴケを用いることにより,ある遺伝子が陸上化にはたした役割や,ある遺伝子ファミリーの陸上植物における機能や制御の進化について,さまざまな知見を得られることが期待される.そのような視点について,以下,いくつか述べる.
ゼニゴケは雌雄異株であるため,生殖器托,造卵器および造精器,卵および精子といった生殖器官や配偶子の形成を制御する機構について,反対の性の影響をうけることなく解析できる.また,生殖器官を比較的容易に取り出したり集めたりできることもゼニゴケの特徴である.くわえて,精子の形成や機能の解析に対し分子遺伝学的なアプローチを適用できることは39-42),動物を含めた生命科学において魅力的である.さらに,のちに述べるように,ゼニゴケにおいては減数分裂と有性生殖が時間的かつ発生的に完全に切り離されている.これは,維管束植物や動物における有性生殖の機構とは異なる大きな特徴であり,その解析には格好の材料といえる.そのような背景をもとに,ゼニゴケの有性生殖に関連した研究がさかんになっている.
配偶体世代はその名のとおり配偶子をつくる世代であり,胞子からはじまり,配偶子の形成をへて,受精までをさす.被子植物において配偶体世代は極度に縮退し,時間的にも非常に短い(図2).減数分裂により生じた大胞子および小胞子が胚嚢および花粉を形成し,それぞれ数回の体細胞分裂をへて配偶子を分化する.その際,大胞子では核のみが8個に増加したのちに細胞化により卵細胞や中央細胞を生じるのに対し,小胞子では非対称分裂により大きい栄養細胞と小さい雄原細胞とに分かれ,雄原細胞が栄養細胞に取り込まれたのちさらに均等分裂して2個の精細胞になる.受粉ののち花粉管が伸長し胚嚢に達すると,花粉管から放出された精細胞がひとつずつ卵細胞および中央細胞と受精する重複受精が起こり,配偶体世代は終了する.一方,ゼニゴケは胞子が発芽するとさかんに細胞分裂し葉状体を形成して栄養成長するため,配偶子の形成を開始するまでの時間が長い(図2).しかも,そのような有性生殖期への移行は光や温度などの環境からの刺激に依存するため,適切な条件が整わないかぎり配偶子は形成されない.ゼニゴケの解析により,ゼニゴケの日長に依存的な配偶子の形成と被子植物の花成とのあいだに制御因子の共通性が見い出された18).つまり,日長に依存的な制御のしくみは配偶体世代において発明され,陸上植物の進化の過程において胞子体世代の成長相の転換に転用されたことが明らかにされた18,43).そのあいだに,コケ植物にはない花を咲かせるためのさまざまなしかけが発明され胞子体世代に追加されたことが想像される.また,コケ植物においては配偶子の形成そのものにも多くのステップがかかわる.まず,生殖器(造卵器および造精器)の単一の始原細胞が規定される.それが特定のパターンで非対称分裂することにより,将来は配偶子になる前駆体細胞とそれをとりかこむジャケット細胞が生じる.前駆体細胞は,雌においてはさらなる数回の非対称分裂をへて卵細胞を生じる.雄においては同調的な細胞分裂により細胞を増加させたのち,特徴的な対角線の方向の分裂によりおのおのの細胞は精子に分化する44).
2016年,国内外の2つの研究グループによりあいついで,転写因子であるRKD(ゼニゴケにおいては,MpRKDのひとつのみ)がゼニゴケにおいて卵細胞の分化の制御にかかわると報告された42,45).MpRKDの機能欠損株においては卵細胞の前駆体は形成されたものの,卵細胞は成熟せず未成熟なまま細胞分裂が起こった.2017年には,シロイヌナズナにおいてもRKDの複数のホモログが雌性配偶子の発生において機能することが報告され46),RKDは進化的に保存された機能をもつことがわかった.さらに,雄性配偶子の形成の過程が詳細に観察されてステージに分けられるとともに,造精器におけるトランスクリプトーム解析が実施された.花粉や精細胞の発生あるいは分化にかかわる遺伝子がそれぞれ特異的なステージにおいて発現していたことから,雄性配偶子の形成の機構は進化の過程において大枠では保存されていることが示唆された39).
さて,植物の生殖系列はどのように規定されるのであろうか.被子植物における胞子の形成から配偶子の形成までの短い期間では,生殖系列の規定と配偶子の分化がほぼ同時に起こるためそれらの区別ははっきりしなかった.最近のゼニゴケを用いた研究により,MpBONOBOと命名された塩基性ヘリックス-ループ-ヘリックス型の転写因子の機能が生殖器の形成に必要十分であること,MpBONOBOは生殖器の始原細胞および配偶子の前駆体細胞において一過的に蓄積することが示された20).シロイヌナズナのオルソログとして見い出されたBNB1およびBNB2の二重欠損株においては,小胞子の非対称分裂は起こったものの,小さい細胞が雄原細胞として機能しなくなった.さらに,BNB2は小さい細胞において一過的に蓄積した20).以上のことから,MpBONOBOのホモログは配偶体世代において生殖系列を規定する進化的に保存された転写因子であると考えられた.ゼニゴケの発見を起点として,植物において共通の原理が見い出された好例である.MpBONOBOのホモログの発現を基準に考えると,コケ植物においてみられる,胞子から栄養成長をへて生殖細胞の系列が決まるまでの期間と,生殖細胞の系列が規定されてから配偶子が形成されるまでの期間が,被子植物においてはどちらも1回の細胞分裂に縮退したといえる(図2).ゼニゴケにおいてはMpRKDが精子の形成においても必須ではないが重要なはたらきをすることが示されているが42),シロイヌナズナにおいてはRKDの雄性配偶子の形成への関与は示唆されていないことから,その機能は縮退の過程で失われた可能性が高い.
ゼニゴケのゲノムは制御系の遺伝子について遺伝子の重複が少ない.シロイヌナズナやイネなど被子植物のモデル生物において,ある現象への関与はわかっているものの高い冗長性などの理由からまだ十分に解明されていない遺伝子の機能やしくみについて,ゼニゴケはその解明に貢献する可能性がある.それにくわえて,遺伝子重複により生じたパラログの機能の分担や新しい機能の獲得について進化的な道筋を理解するのにも適している.好例はフィトクロムである.被子植物においてフィトクロムはI型とII型に大別される.I型は光の照射により急速に分解されるのに対し,II型は光に対し安定である.また,I型は赤色光と遠赤色光のどちらの照射によっても核に移行するのに対し,II型は赤色光下においてのみ核に移行するという違いもある.ゼニゴケにおいて,フィトクロムはMpphyのひとつしか存在しないが,Mpphyは光安定性が高く,かつ,核への移行は赤色光と遠赤色光のどちらでも起こることから,I型とII型の特徴をあわせもつことが明らかにされた15).さらに,I型は超低光量の応答および遠赤色光の高照射の応答に,II型は赤色光と遠赤色光との可逆性を示す低光量の応答をつかさどるが,Mpphyは低光量の応答だけでなく15),最近の解析から,遠赤色光の高照射の応答においても機能することがわかってきた.このように,もともとはひとつで低光量の応答と遠赤色光の高照射の応答の両方を制御していたが,陸上植物の進化の過程,おそらく,種子植物の分岐の前後に,パラログの機能の分担(I型およびII型)および新しい機能の獲得(超低光量の応答)が起こったことが推測された47).
新たなしくみや遺伝子の新しい機能などの意外な発見は,順遺伝学的な解析によりもたらされることがよくある.ゼニゴケにおいて遺伝子の冗長性が低いことは,順遺伝学的なアプローチが有効であることも意味する.さきに述べたMpBONOBOも,生殖器托の形成に遠赤色光を必要としない変異体48) の責任遺伝子の産物として同定された.T-DNAタギング法を用いた変異体の探索および責任遺伝子の同定も行われており,気室の形成に必須なMpNOPPERABO1遺伝子をはじめ49),複数の遺伝子が同定されている13,50,51).特筆すべきは,T-DNAタギング法による336,000個の形質転換体を探索し,仮根の伸長にかかわる33個の遺伝子を同定した例である51).ここでは,1次スクリーニングにより301個の仮根の伸長が不全の変異体を単離し,交配ができた165株のうち62株がT-DNAのハイグロマイシン耐性遺伝子と連鎖していたと報告された.さらに,そのうちの57株のT-DNAの挿入部位がTAIL-PCR法により同定された.また,化学変異原やガンマ線を用いた突然変異の誘発も可能であり,未発表ではあるが,これまでに筆者らは興味深い表現型を示す変異体を得ている.1株ずつ分離して変異体を探索するのは骨の折れる作業であるが,たとえば,変異体だけが生育する条件での探索であれば,T-DNAタギング法による形質転換体やエチルメタンスルホン酸などの変異原により処理した個体を数多く探索することができる.筆者らは,T-DNAタギング法による約200,000個の形質転換体のなかから,高濃度のオーキシンに耐性を示す変異体のひとつとしてMpARF1遺伝子の挿入変異株を単離した経験がある13).
おわりに
このレビューにおいては,ゼニゴケのモデル生物としての特徴について述べてきたが,ここでとりあげたこと以外にも,さまざまな生理応答や細胞制御のモデルとして有効である.実際,植物ホルモン,分泌ペプチドによる細胞間コミュニケーション,光合成,細胞骨格,病害菌への応答などについての研究が進んでいる,植物の研究は食糧としての被子植物に集中しがちであるが,地球規模の環境問題などに目をむければ,植物の全体を意識しさまざまな種の知見を比較しながら総合的に考察することによりみえてくることも多い.ゲノム情報とツールのそろったゼニゴケがもたらす貢献は,これからますます大きくなっていくと予想される.現在,コケ植物のうちモデル植物として実用的なのはヒメツリガネゴケおよびゼニゴケだけであるが,ゼニゴケの実験手法やツールはほかのコケ植物の機能の解析にも転用できるかもしれない.今後,さらに多くのコケ植物,また,シダ植物や緑藻についてもモデル生物化が進めば,植物の陸上化や進化のしくみについての理解は急速に深まるであろう.
タイトルを“モデル生物”としたのは,ゼニゴケはモデル植物としてだけでなく,生物全般のモデルとしても活用できると考えているからである.多様なツールを備え,迅速に実験のできるゼニゴケを細胞のハコとして用いて,動物も含むほかの生物に由来する遺伝子を発現させることにより,物質なり構造なり反応系なりを産生あるいは再構築することは比較的容易である.このような生物工学的あるいは合成生物学的な利用や,生命科学におけるさまざまな研究のプラットフォームとしての活用も有用であろう.また,生死を利用した変異体の探索は,オーキシンの例だけでなくほかの化合物にも適用が可能で,ケミカルバイオロジーとの相性もよいと考えられる.たとえば,毒性を示す化合物に対する耐性変異体を得ることにより,その化合物の作用機作の理解が促進されるだろう.1倍体で実験のできる酵母と同じような感覚でゼニゴケを用いることにより,被子植物や動物では得ることのむずかしい知見にたどりつく可能性がある.
目のつけどころしだいで,さまざまに,そして,手軽に活用できるのがゼニゴケである.このレビューがこれからの研究材料を考える一助となれば幸いである.
文 献
- Kenrick, P. & Crane, P. R.: The origin and early evolution of plants on land. Nature, 389, 33-39 (1997)
- Hori, K., Maruyama, F., Fujisawa T. et al.: Klebsormidium flaccidum genome reveals primary factors for plant terrestrial adaptation. Nat. Commun., 5, 3978 (2014)[PubMed]
- Nishiyama, T., Sakayama, H., de Vries, J. et al.: The Chara genome: secondary complexity and implications for plant terrestrialization. Cell, 174, 448-464.e24 (2018)[PubMed] [新着論文レビュー]
- Wickett, N. J., Mirarab, S., Nguyen, N. et al.: Phylotranscriptomic analysis of the origin and early diversification of land plants. Proc. Natl. Acad. Sci. USA, 111, E4859-E4868 (2014)[PubMed]
- Harrison, C. J.: Development and genetics in the evolution of land plant body plans. Phil. Trans. R. Soc. B., 372, 20150490 (2017)[PubMed]
- Puttick, M. N., Morris, J. L., Williams, T. A. et al.: The interrelationships of land plants and the nature of the ancestral embryophyte. Curr. Biol., 28, 733-745.e2 (2018)[PubMed]
- Edwards, D., Duckett, J. G. & Richardson, J. B.: Hepatic characters in the earliest land plants. Nature, 374, 635-636 (1995)
- Wellman, C. H., Osterloff, P. L. & Mohiuddin, U.: Fragments of the earliest land plants. Nature, 425, 282-285 (2003)[PubMed]
- Shimamura, M.: Marchantia polymorpha: taxonomy, phylogeny and morphology of a model system. Plant Cell Physiol., 57, 230-256 (2016)[PubMed]
- Nishihama, R. & Kohchi, T.: Evolutionary insights into photoregulation of the cell cycle in the green lineage. Curr. Opin. Plant Biol., 16, 630-637 (2013)[PubMed]
- 西浜竜一, 河内孝之: 陸上植物の細胞分裂の光制御とその進化. 植物科学の最前線, 6, 51-62 (2015)
- Nakazato, T., Kadota, A. & Wada, M.: Photoinduction of spore germination in Marchantia polymorpha L. is mediated by photosynthesis. Plant Cell Physiol., 40, 1014-1020 (1999)
- Kato, H., Kouno, M., Takeda, M. et al.: The roles of the sole activator-type auxin response factor in pattern formation of Marchantia polymorpha. Plant Cell Physiol., 58, 1642-1651 (2017)[PubMed]
- Kato, H., Nishihama, R., Weijers, D. et al.: Evolution of nuclear auxin signaling: lessons from genetic studies with basal land plants. J. Exp. Bot., 69, 291-301 (2018)[PubMed]
- Inoue, K., Nishihama, R., Kataoka, H. et al.: Phytochrome signaling is mediated by PHYTOCHROME INTERACTING FACTOR in the liverwort Marchantia polymorpha. Plant Cell, 28, 1406-1421 (2016)[PubMed]
- Nishihama, R., Ishizaki, K., Hosaka, M. et al.: Phytochrome-mediated regulation of cell division and growth during regeneration and sporeling development in the liverwort Marchantia polymorpha. J. Plant Res., 128, 407-421 (2015)[PubMed]
- Kubota, A., Ishizaki, K., Hosaka, M. et al.: Efficient Agrobacterium-mediated transformation of the liverwort Marchantia polymorpha using regenerating thalli. Biosci. Biotechnol. Biochem., 77, 167-172 (2013)[PubMed]
- Kubota, A., Kita, S., Ishizaki, K. et al.: Co-option of a photoperiodic growth-phase transition system during land plant evolution. Nat. Commun., 5, 3668 (2014)[PubMed]
- Chiyoda, S., Ishizaki, K., Kataoka, H. et al.: Direct transformation of the liverwort Marchantia polymorpha L. by particle bombardment using immature thalli developing from spores. Plant Cell Rep., 27, 1467-1473 (2008)[PubMed]
- Yamaoka, S., Nishihama, R., Yoshitake, Y. et al.: Generative cell specification requires transcription factors evolutionarily conserved in land plants. Curr. Biol., 28, 479-486.e5 (2018)[PubMed]
- Bowman, J. L., Kohchi, T., Yamato, K. T. et al.: Insights into land plant evolution garnered from the Marchantia polymorpha genome. Cell, 171, 287-304.e15 (2017)[PubMed]
- Yamato, K. T., Ishizaki, K., Fujisawa, M. et al.: Gene organization of the liverwort Y chromosome reveals distinct sex chromosome evolution in a haploid system. Proc. Natl. Acad. Sci. USA, 104, 6472-6477 (2007)[PubMed]
- Tanaka, D., Ishizaki, K., Kohchi, T. et al.: Cryopreservation of gemmae from the liverwort Marchantia polymorpha L. Plant Cell Physiol., 57, 300-306 (2016)[PubMed]
- Togawa, T., Adachi, T., Harada, D. et al.: Cryopreservation of Marchantia polymorpha spermatozoa. J. Plant Res., 131, 1047-1054 (2018)[PubMed]
- Bowman, J. L., Araki, T., Arteaga-Vazquez, M. A. et al.: The naming of names: guidelines for gene nomenclature in Marchantia. Plant Cell Physiol., 57, 257-261 (2016)[PubMed]
- Ishizaki, K., Chiyoda, S., Yamato, K. T. et al.: Agrobacterium-mediated transformation of the haploid liverwort Marchantia polymorpha L., an emerging model for plant biology. Plant Cell Physiol., 49, 1084-1091 (2008)[PubMed]
- Tsuboyama, S. & Kodama, Y.: AgarTrap protocols on your benchtop: simple methods for Agrobacterium-mediated genetic transformation of the liverwort Marchantia polymorpha. Plant Biotechnol., 35, 93-99 (2018)
- Ishizaki, K., Nishihama, R., Ueda, M. et al.: Development of Gateway binary vector series with four different selection markers for the liverwort Marchantia polymorpha. PLoS One, 10, e0138876 (2015)[PubMed]
- Flores-Sandoval, E., Dierschke, T., Fisher, T. J. et al.: Efficient and inducible use of artificial microRNAs in Marchantia polymorpha. Plant Cell Physiol., 57, 281-290 (2016)[PubMed]
- Kanazawa, T., Era, A., Minamino, N. et al.: SNARE molecules in Marchantia polymorpha: unique and conserved features of the membrane fusion machinery. Plant Cell Physiol., 57, 307-324 (2016)[PubMed]
- Kimura, S. & Kodama, Y.: Actin-dependence of the chloroplast cold positioning response in the liverwort Marchantia polymorpha L. PeerJ, 4, e2513 (2016)[PubMed]
- Era, A., Tominaga, M., Ebine, K. et al.: Application of Lifeact reveals F-actin dynamics in Arabidopsis thaliana and the liverwort, Marchantia polymorpha. Plant Cell Physiol., 50, 1041-1048 (2009)[PubMed]
- Buschmann, H., Holtmannspotter, M., Borchers, A. et al.: Microtubule dynamics of the centrosome-like polar organizers from the basal land plant Marchantia polymorpha. New Phytol., 209, 999-1013 (2016)[PubMed]
- Otani, K., Ishizaki, K., Nishihama, R. et al.: An evolutionarily conserved NIMA-related kinase directs rhizoid tip growth in the basal land plant Marchantia polymorpha. Development, 145, dev154617 (2018)[PubMed]
- Ishizaki, K., Johzuka-Hisatomi, Y., Ishida, S. et al.: Homologous recombination-mediated gene targeting in the liverwort Marchantia polymorpha L. Sci. Rep., 3, 1532 (2013)[PubMed]
- Sugano, S. S., Shirakawa, M., Takagi, J. et al.: CRISPR/Cas9-mediated targeted mutagenesis in the liverwort Marchantia polymorpha L. Plant Cell Physiol., 55, 475-481 (2014)[PubMed]
- Sugano, S. S., Nishihama, R., Shirakawa, M. et al.: Efficient CRISPR/Cas9-based genome editing and its application to conditional genetic analysis in Marchantia polymorpha. PLoS One, 13, e0205117 (2018)[PubMed]
- Nishihama, R., Ishida, S., Urawa, H. et al.: Conditional gene expression/deletion systems for Marchantia polymorpha using its own heat-shock promoter and Cre/loxP-mediated site-specific recombination. Plant Cell Physiol., 57, 271-280 (2016)[PubMed]
- Higo, A., Niwa, M., Yamato, K. T. et al.: Transcriptional framework of male gametogenesis in the liverwort Marchantia polymorpha L. Plant Cell Physiol. 57, 325-338 (2016)[PubMed]
- Minamino, N., Kanazawa, T., Nishihama, R. et al.: Dynamic reorganization of the endomembrane system during spermatogenesis in Marchantia polymorpha. J Plant Res., 130, 433-441 (2017)[PubMed]
- Kasahara, M., Suetsugu, N., Urano, Y. et al.: An adenylyl cyclase with a phosphodiesterase domain in basal plants with a motile sperm system. Sci. Rep., 6, 39232 (2016)[PubMed]
- Koi, S., Hisanaga, T., Sato, K. et al.: An evolutionarily conserved plant RKD factor controls germ cell differentiation. Curr. Biol., 26, 1775-1781 (2016)[PubMed]
- 山岡尚平, 河内孝之: 植物における日長による成長相転換制御のメカニズムとその進化. 植物科学の最前線, 7, 78-86 (2016)
- Durand, E. J.: The development of the sexual organs and sporogonium of Marchantia polymorpha. Bull. Torrey Bot. Club, 35, 321-335 (1908)
- Rovekamp, M., Bowman, J. L., & Grossniklaus, U.: Marchantia MpRKD regulates the gametophyte-sporophyte transition by keeping egg cells quiescent in the absence of fertilization. Curr. Biol., 26, 1782-1789 (2016)[PubMed]
- Tedeschi, F., Rizzo, P., Rutten, T. et al.: RWP-RK domain-containing transcription factors control cell differentiation during female gametophyte development in Arabidopsis. New Phytol., 213, 1909-1924 (2017)[PubMed]
- Inoue, K., Nishihama, R. & Kohchi, T.: Evolutionary origin of phytochrome responses and signaling in land plants. Plant Cell Environ., 40, 2502-2508 (2017)[PubMed]
- Yamaoka, S., Takenaka, M., Hanajiri, T. et al.: A mutant with constitutive sexual organ development in Marchantia polymorpha L. Sex. Plant Reprod., 16, 253-257 (2004)
- Ishizaki, K., Mizutani, M., Shimamura, M. et al.: Essential role of the E3 ubiquitin ligase NOPPERABO1 in schizogenous intercellular space formation in the liverwort Marchantia polymorpha. Plant Cell, 25, 4075-4084 (2013)[PubMed]
- Jones, V. A. & Dolan, L.: MpWIP regulates air pore complex development in the liverwort Marchantia polymorpha. Development, 144, 1472-1476 (2017)[PubMed]
- Honkanen, S., Jones, V. A., Morieri, G. et al.: The mechanism forming the cell surface of tip-growing rooting cells is conserved among land plants. Curr. Biol., 26, 3238-3244 (2016)[PubMed]
著者プロフィール
略歴:1997年 名古屋大学大学院理学研究科にて博士号取得,同年 同 博士研究員,2000年 米国Michigan大学 博士研究員,2001年 米国North Carolina大学 博士研究員,2005年 米国Stanford大学School of Medicineリサーチアソシエイト,2011年 京都大学大学院生命科学研究科 講師を経て,2017年より同 准教授.
研究テーマ:植物の環境に依存的な増殖および発生の制御機構.
抱負:細胞分裂の制御の研究を基軸として,植物の生存戦略を理解したい.
河内 孝之(Takayuki Kohchi)
京都大学大学院生命科学研究科 教授.
研究室URL:http://www.plantmb.lif.kyoto-u.ac.jp/
© 2018 西浜竜一・河内孝之 Licensed under CC 表示 2.1 日本