腸管上皮細胞と腸内細菌との相互作用
2016/08/31
奥村 龍・竹田 潔
(大阪大学大学院医学系研究科 免疫制御学)
email:奥村 龍
領域融合レビュー, 5, e007 (2016) DOI: 10.7875/leading.author.5.e007
Ryu Okumura & Kiyoshi Takeda: Crosstalk between intestinal epithelial cells and commensal bacteria.

腸管上皮細胞は栄養や水分の吸収という機能とともに,多くの腸内細菌から腸管の組織をまもり,腸内細菌に対する過剰な免疫応答を回避するための粘膜バリアを構築する.また,腸内細菌と粘膜固有層に存在する免疫担当細胞とのあいだに存在し,病原細菌を含む腸内細菌からの刺激あるいはそれらに由来する抗原を免疫担当細胞に伝達することにより腸管免疫系を制御し,腸管における恒常性の維持に大きく貢献する.それゆえ,腸管上皮細胞の機能が遺伝的な素因により失われる,あるいは,環境要因により腸内フローラに乱れが生じると,宿主と腸内フローラとのバランスがくずれ,その結果,腸管に炎症がひき起こされる.
ヒトを含む脊椎動物は水や食物を摂取し吸収することにより生命を維持する.いうまでもなく,消化管はその吸収を担う唯一の器官であり,口から摂取する食物を含む外来の異物は消化管を通過する.また,それとともにさまざまな細菌が腸管に侵入し,栄養が豊富な環境のもと腸管に定着して増殖し,腸内フローラといわれる細菌叢を形成する.腸内細菌はたんに共生するのみならず,食物に由来する栄養素を発酵し宿主にさらなる代謝産物を提供することにより宿主とウィン-ウィンの関係を築く.本来は外敵となりうる腸内細菌との良好な関係性の維持に不可欠なのが腸管に特有の免疫機構であり,腸内細菌と粘膜固有層に存在する免疫担当細胞とのあいだに存在する腸管上皮細胞は粘膜バリアを構築することにより腸内細菌と腸管上皮組織とを分けへだて,さらに,免疫担当細胞にシグナルを伝達することにより腸管免疫系を制御する.このレビューにおいては,腸管上皮細胞の腸管免疫系における機能を腸内細菌との相互作用を中心に解説する.
なお,腸内細菌と腸管免疫については,本田 賢也, 領域融合レビュー, 2, e011 (2013) も参照されたい.
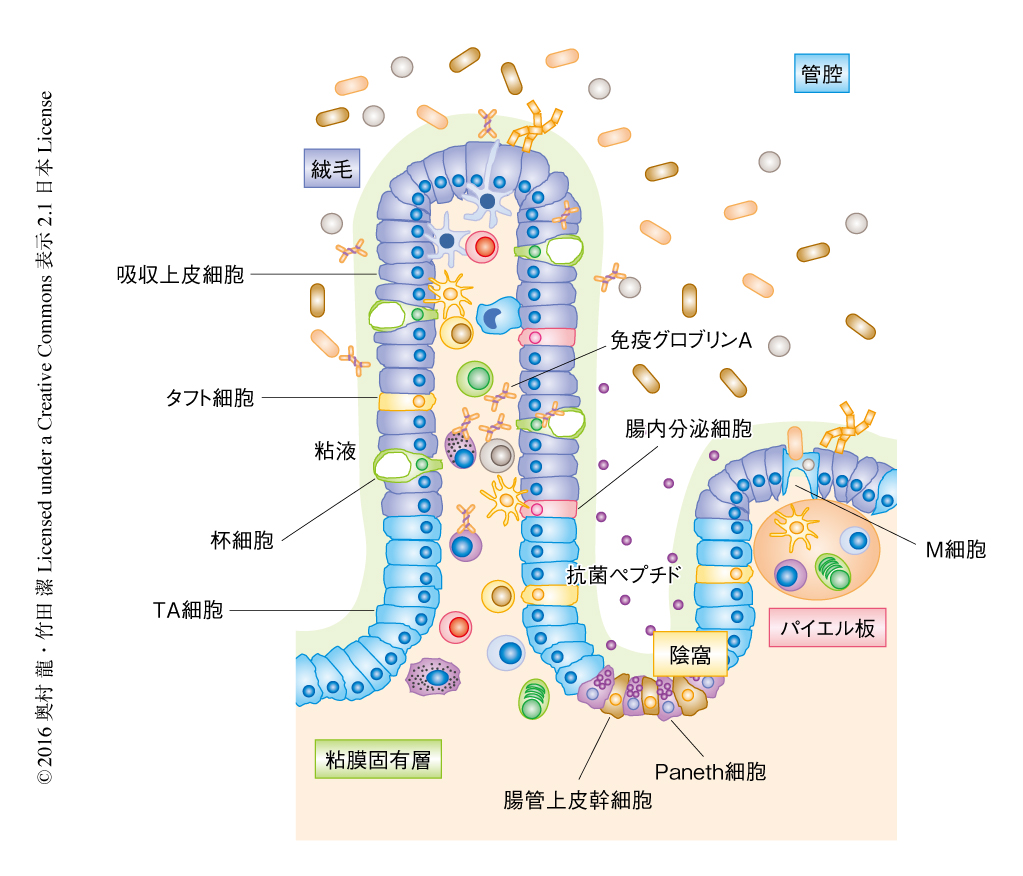
多くの腸内細菌を含む外来の異物の存在する腸管において,腸管免疫系は腸管上皮細胞や免疫担当細胞などさまざまなタイプの細胞により制御される(図1).腸の粘膜をおおうすべての腸管上皮細胞は陰窩に存在する腸管上皮幹細胞からTA細胞(transit-amplifying細胞)をへて分化し,分化とともに絨毛のほうへ移動し,分化の開始から3~4日で絨毛の頂上においてアポトーシスを起こし管腔へと脱落する.成熟した機能的な腸管上皮細胞は,吸収上皮細胞,杯細胞,Paneth細胞,腸内分泌細胞,タフト細胞,M細胞に分けられる(図1).
吸収上皮細胞は栄養や水分の吸収に特化した細胞であり,腸管上皮細胞の大部分をしめる.頂端面の細胞膜には刷子縁とよばれる微絨毛からなる構造があり,栄養素は微絨毛の細胞膜に存在する消化酵素により消化され吸収上皮細胞に吸収される.また,吸収上皮細胞の頂端面の表面は糖衣とよばれる糖鎖の集合体によりおおわれており,腸内細菌の腸管上皮細胞への侵入を障害する1).杯細胞は粘液の主成分であるムチンという糖タンパク質を多量に産生し分泌することにより腸の粘膜をおおう粘液の恒常性を維持し,腸管上皮細胞への腸内細菌の侵入をふせぐ.小腸の陰窩に存在するPaneth細胞は抗菌ペプチドの産生および分泌に特化した細胞であり,ディフェンシンファミリータンパク質やRegIIIファミリータンパク質などの抗菌ペプチドを産生し腸内細菌の侵入に対する防御に不可欠であるとともに2),近接する腸管上皮幹細胞にNotchシグナルを伝達することにより腸管上皮幹細胞の幹細胞としての機能を維持するニッチとしても重要な役割をはたす3).腸内分泌細胞は上皮細胞の1%程度をしめるマイナーな細胞であるが,食餌性の脂質や糖質を感知しコレシストキニン,ガストリン,セロトニンなどの消化管ホルモンを分泌することにより胃液や膵液の分泌および蠕動運動を促進し消化の制御に重要な役割をはたす.その一方,近年,コレシストキニンはマクロファージによる誘導型一酸化窒素合成酵素の産生を抑制するといった,消化管ホルモンと腸管免疫系との相互作用も明らかにされた4).腸内分泌細胞と同じ分泌系の細胞のひとつで,最近,注目をあつめているのがタフト細胞であり,頂端面に微細な毛の密集したような構造(タフト,房)をもつことからから名づけられた.これまで,その役割はほとんど明らかにされていなかったが,2016年初頭,3つの研究グループにより,タフト細胞は小腸に蠕虫が感染するとインターロイキン25を産生し,2型自然リンパ球を活性化することにより蠕虫の排除に大きく寄与することが明らかにされた5-7).M細胞は抗原の取り込みに特化した細胞で,パイエル板などリンパ濾胞をおおう腸管上皮組織に散在する.Gp-2といわれる細菌の受容体などを介して管腔から抗原を取り込み8),リンパ濾胞の樹状細胞に抗原を供給することにより免疫グロブリンAの産生に大きく寄与する.
これらの多種多様な腸管上皮細胞が腸内細菌や粘膜固有層に存在する免疫担当細胞と相互作用することにより,腸管免疫系は巧妙に制御されている.
約100兆個といわれるおびただしい数の腸内細菌が存在する腸管には,腸内細菌から腸管の組織を保護する,あるいは,腸内細菌に対する過剰な免疫応答を回避するため,腸管上皮細胞により形成される粘膜バリアが存在する.粘膜バリアは物理的なバリアと化学的なバリアの2つに大別される.物理的なバリアには,腸の粘膜を被覆する粘液層,腸管上皮細胞の表面に存在する糖タンパク質の糖鎖により形成される糖衣,細胞接着装置である密着結合および接着結合があり,物理的な障壁として腸管上皮組織への腸内細菌の侵入をふせぐ.化学的なバリアにはディフェンシンファミリータンパク質,RegIIIファミリータンパク質,ラクトフェリン,リゾチームなどPaneth細胞を中心に腸管上皮細胞から産生される抗菌ペプチドが含まれる.遺伝的な素因などによりそれらの粘膜バリアの機能が破綻すると腸内フローラの変化や腸管上皮組織への腸内細菌の侵入により腸管の炎症が起こり,共生する宿主と腸内細菌との良好な関係は大きくくずれる.
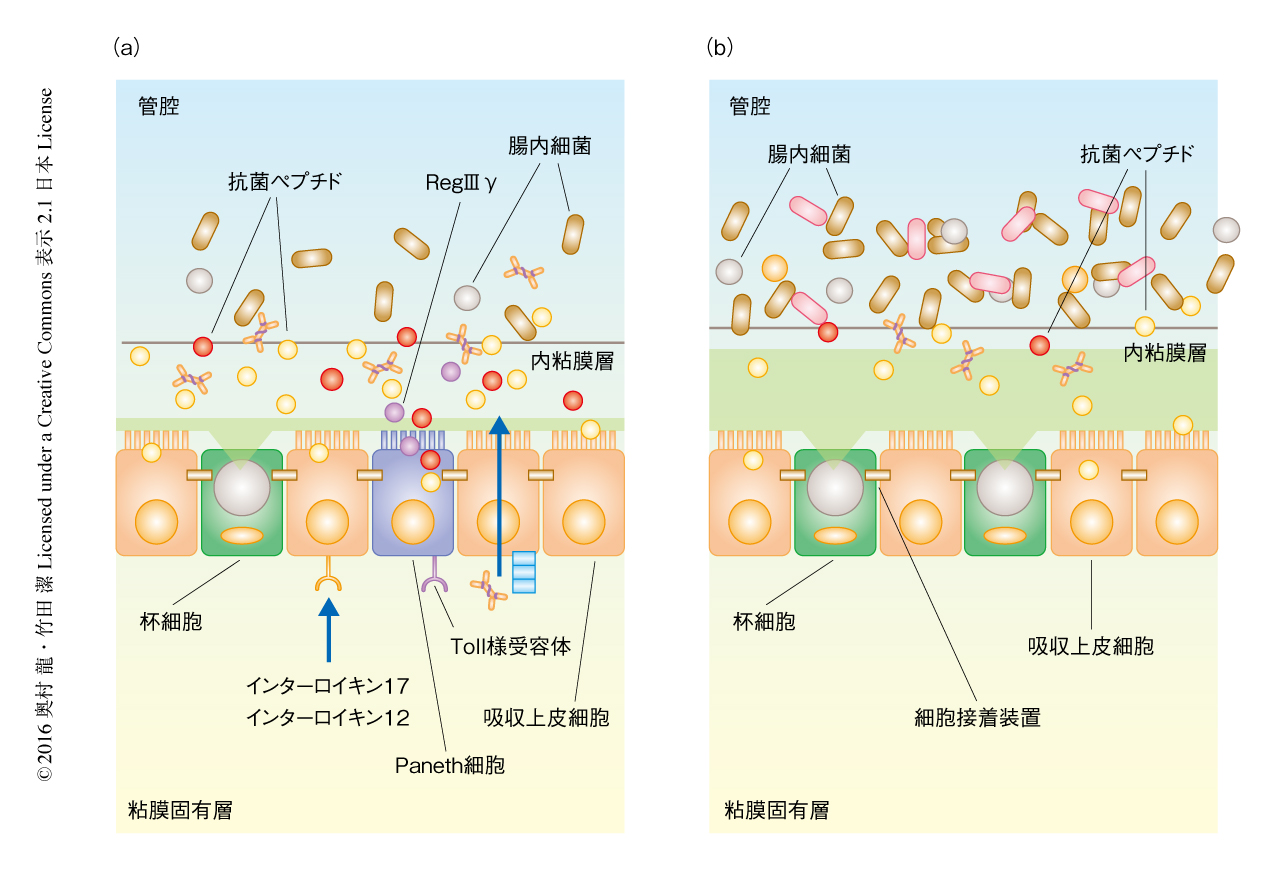
小腸と大腸は同じ消化管ではあるが,その組織の構造や腸管上皮細胞の構成は異なるとともに,粘膜バリアの機構も大きく異なる(図2).小腸では粘液を産生する杯細胞の数が大腸と比べ少なく,腸管上皮細胞をおおう粘液層も薄い.その一方で,小腸の陰窩には大腸には存在しない抗菌ペプチドの産生に特化したPaneth細胞が存在し,腸内細菌と腸管上皮組織とを分けへだてるのに重要な役割をはたす.Paneth細胞を含む腸管上皮細胞から分泌される抗菌ペプチドは昆虫,植物,脊椎動物にいたるまで広く保存されており,塩基性アミノ酸残基を多く含むことにより正に荷電し,負に帯電した腸内細菌の細胞膜と結合したのち,疎水性の領域が細胞膜の透過性を亢進させることにより活性を発揮する.腸管上皮細胞がパターン認識受容体(pattern-recognition receptor:PRR)であるToll様受容体やNod様受容体を介し腸内細菌により刺激されると抗菌ペプチドの産生が亢進し,病原細菌に感染したときには粘膜固有層に存在するTh17細胞や3型自然リンパ球により産生されるインターロイキン17やインターロイキン22などのサイトカインにより腸管上皮細胞による抗菌ペプチドの産生はさらに亢進する9).腸管上皮細胞により産生される抗菌ペプチドとして,以前から,ディフェンシンファミリータンパク質やカテリシジンが代表的ものとして知られていたが,近年,新たにC型レクチンであるRegIIIファミリータンパク質が同定された.RegIIIファミリータンパク質のひとつであるRegIIIγがとくにPaneth細胞によりToll様受容体-MyD88シグナル伝達系を介して産生され,グラム陽性球菌に対し抗菌活性を発揮する10).さらに,腸管上皮細胞に特異的なMyD88ノックアウトマウスやRegIIIγノックアウトマウスの小腸においては腸内細菌と腸管上皮細胞とが近接していたことから,RegIIIγは小腸において腸内細菌と腸管上皮組織とを分けへだてるのに重要な役割をはたすことが明らかにされた11).
小腸の約100倍といわれるおびただしい数の腸内細菌が存在する大腸にはPaneth細胞は存在しないが,杯細胞の数が多く分厚い粘液層が腸管上皮細胞をおおっており,その粘液層は外粘液層と内粘液層の2つの層に分けられる12).粘液の主成分は杯細胞から産生される糖タンパク質のムチンであり,ムチンは分泌型ムチンと膜結合型ムチンの2つに分けられる.小腸および大腸においては分泌型ムチンであるMuc2が粘液の主成分であり,多量に付加されるO-結合型糖鎖が粘液の粘性を生じ,また,腸管上皮細胞の表面の糖鎖と結合し接着しようとする腸内細菌に対し競合的に結合することにより腸内細菌の侵入あるいは接着をふせぐ.大腸の腸管上皮細胞の直上にある内粘液層においてはMuc2が密に結合した構造をとり,外粘液層はそのMuc2の密な構造が宿主あるいは腸内細菌のプロテアーゼにより分解されゆるんだ状態にある.また,ほとんどの腸内細菌は外粘液層に生息し,内粘液層はほぼ無菌状態に保たれ,大腸においては内粘液層により腸内細菌と腸管上皮組織とは分けへだてられている12).それゆえ,粘液層を構成するMuc2を欠損したマウスやMuc2のO-結合型糖鎖の付加に不可欠な酵素であるC1galt1を欠損したマウスは内粘液層を欠き,腸内細菌の腸管上皮組織への侵入が認められる.
抗菌ペプチドの産生に特化したPaneth細胞が存在しないのにもかかわらず,おびただしい数の腸内細菌が存在する大腸において内粘液層が無菌に保たれ,腸内細菌と腸管上皮組織とが分けへだてられる機構はこれまで明らかにされていなかった.筆者らは,この内粘液層が無菌に保たれることに大腸の吸収上皮細胞に特異的に高発現するLypd8というGPIアンカー型タンパク質が重要な役割をはたすことを明らかにした13)(新着論文レビュー でも掲載).Lypd8はN-結合型糖鎖により高度に修飾されており,腸管上皮細胞の頂端側の表面に発現し,腸管上皮細胞の表面から恒常的に遊離し大腸の管腔に分泌される.遊離したLypd8は大腸菌やProteus属細菌など鞭毛をもつ細菌の鞭毛と優先的に結合し,その運動性を抑制することにより腸管上皮組織への侵入をふせいでいた.また,Lypd8ノックアウトマウスにおいては内粘液層および腸管上皮組織への腸内細菌の侵入が観察され,運動性の高い大腸菌やProteus属細菌が有意に多く検出された.Lypd8ノックアウトマウスはデキストラン硫酸ナトリウムによる実験的な腸炎に対する感受性が亢進しており,このことから,Lypd8が大腸において腸内細菌と腸管上皮組織を分けへだてることにより腸管の炎症をふせぐことが明らかにされた(図3).
以上のように,さまざまな腸管上皮細胞により構築される粘膜バリアにより,腸管の組織は病原細菌を含む腸内細菌からまもられ,それにより腸管における恒常性は維持されている.
腸管には100兆個をこえるBacteroides門やFirmicutes門を中心とした多種多様な細菌が生息し,それらの腸内細菌は短鎖脂肪酸やビタミンなどを産生することにより宿主に栄養面で恩恵をあたえるとともに,神経伝達物質であるセロトニンの分泌を促進するなど,近年は,神経系への影響も注目されている14).また,腸管免疫系は腸内細菌あるいはその代謝産物,食物の栄養素といった環境要因により制御される.実際,腸内細菌の存在しない無菌マウスにおいてはパイエル板,孤立リンパ濾胞,腸間膜リンパ節など腸管に関連するリンパ組織は低形成であり,粘膜固有層に存在する免疫グロブリンA産生細胞やTh17細胞の数も少なく,病原細菌の感染や実験的な腸炎モデルに対する感受性の亢進が認められる15,16).
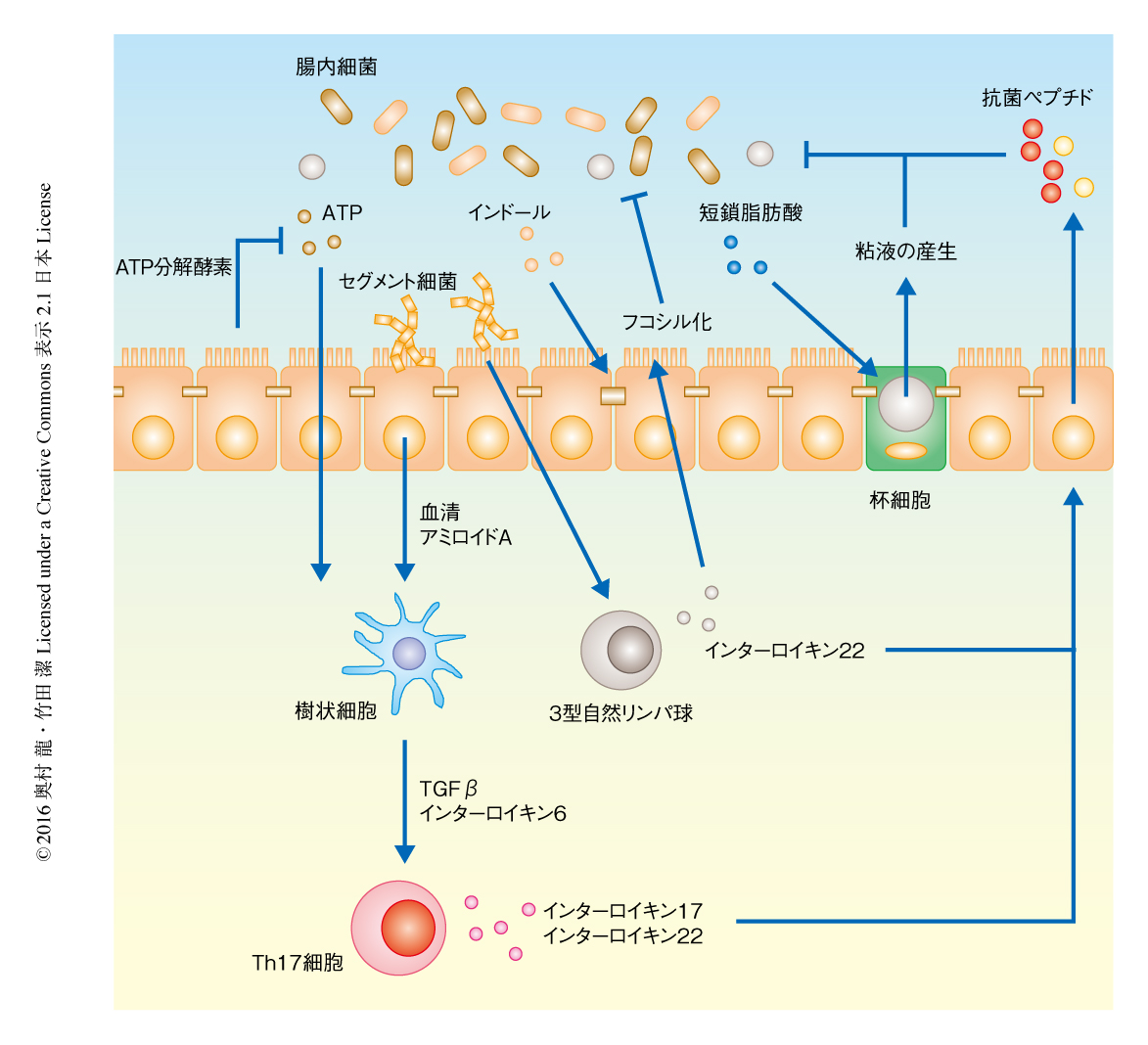
腸管における恒常性の維持に一役を担う腸管上皮細胞もまた腸内細菌からさまざまな影響をうけていることが,無菌マウスにある種の腸内細菌を定着させるノトバイオート技術を用いた研究などにより明らかにされた.腸内細菌のひとつであるセグメント細菌を無菌マウスに定着させることにより,セグメント細菌が小腸の腸管上皮細胞に接着することにより腸管上皮細胞からの血清アミロイドAなどの産生が促進され,この血清アミロイドAは粘膜固有層におけるTh17細胞の分化を誘導する17,18).筆者らの研究グループは,腸内細菌に由来するATPが粘膜固有層におけるTh17細胞の分化を誘導することを明らかにし19),また,ATP加水分解酵素のひとつであるEntpd7を欠損したマウスにおいては小腸の管腔におけるATPの濃度が上昇し粘膜固有層においてTh17細胞が増加することを報告した20).ある種の腸内細菌あるいはそれらに由来するATPにより分化の誘導されたTh17細胞は,インターロイキン17やインターロイキン22といった炎症性サイトカインを産生することにより腸管上皮細胞からの抗菌ペプチドの産生を促進し,それらの抗菌ペプチドが腸内細菌を制御するという連鎖が成立する.
近年,腸管上皮細胞においてタンパク質のフコシル化を担うFut2を欠損したマウスにおいては腸管上皮細胞に発現する膜タンパク質がフコシル化されず,Salmonella thyphimuriumやCitrobacter rodentiumといった病原細菌の感染に対する感受性が亢進していたことから,腸管上皮細胞における膜タンパク質のフコシル化が感染防御に重要であることが示され,そのフコシル化が粘膜固有層に存在する3型自然リンパ球からセグメント細菌などの腸内細菌に依存して分泌されるインターロイキン22により誘導されることが明らかにされた.このように,膜タンパク質とともに腸管上皮細胞に発現する糖鎖は粘膜バリアの機能において重要であり,また,その糖鎖の構造も腸内細菌により変化しうる.
腸内細菌はToll様受容体-MyD88シグナル伝達系やNod様受容体のひとつであるNLRP6を介して杯細胞による粘液の産生を促進させる.とくに,杯細胞からの粘液の分泌にはNLRP6-インフラマソーム経路が重要であり,インフラマソームの活性化によるオートファジーの活性化を介し杯細胞からの粘液の分泌が誘導され,インフラマソームに関連するタンパク質を欠損したマウスにおいては杯細胞からの粘液の放出が障害され,内粘液層が欠け腸内フローラの乱れ(dysbiosis)が起こるとともに,腸管の炎症に対する感受性が増大する21).また,さきに述べたように,Paneth細胞は腸内細菌からのToll様受容体-MyD88シグナルに依存してRegIIIγなどの抗菌ペプチドを産生する.さらに,腸管上皮細胞はToll様受容体を介して腸内細菌により刺激されるとBAFFやAPRILの産生を誘導し,BAFFあるいはAPRILによりB細胞のCD40に非依存的なクラススイッチが誘導されることにより,病原細菌の定着およびそれらの毒素に対し防御的にはたらく免疫グロブリンAの産生に寄与する22).
腸内細菌の代謝産物もまた腸管上皮細胞に直接的または間接的に影響する.腸内細菌が炭水化物や食物繊維を異化することにより産生される酪酸,プロピオン酸,乳酸などの短鎖脂肪酸は,生体のエネルギー源として利用されるのみならず,腸管上皮細胞の増殖を促進し杯細胞からの粘液の産生を亢進させるといった粘膜バリアの維持にも重要である.筆者らの研究グループは,腸内細菌により産生されるトリプトファンの代謝産物であるインドールが腸管上皮細胞におけるClaudin-7やOcculudinなど密着結合あるいは接着結合に関連するタンパク質の発現を亢進させ粘膜バリアを増強させることを明らかにした23).別の研究グループは,インドールが腸管上皮細胞のPXRという受容体を刺激することによりToll様受容体シグナルに依存して細胞接着分子の発現を亢進させることを報告した24).
以上のように,腸内細菌やその代謝産物により腸管上皮細胞の粘膜バリアに関連するタンパク質の発現や機能は制御され,腸管上皮細胞もまたさまざまな機構により腸内細菌を制御し,腸内細菌と腸管上皮細胞はそれぞれ相互に作用しあうことにより腸管における恒常性は維持される(図4).今後,腸管の内容物のメタゲノム解析やメタボローム解析が進むことにより,さらに腸内細菌やそれらの代謝経路,さらには未知の代謝産物が明らかにされ,粘膜バリアの機能を制御する新たな因子が同定されることが期待される.
潰瘍性大腸炎やクローン病に代表される炎症性腸疾患は,さまざまな遺伝的な素因あるいは環境要因があいまって発症する多因子性の疾患である.遺伝的な素因に関しては,近年のゲノムワイド関連解析により,FUT2遺伝子,MUC1遺伝子,MUC19遺伝子,NOD2遺伝子といった粘膜バリアの機能に関与する遺伝子が疾患に関連する候補遺伝子としてあげられている.さらに,炎症性腸疾患の患者の腸管においては実際にディフェンシンなどの抗菌ペプチドの産生や粘液の産生の低下といった粘膜バリアの機能の低下が認められる一方,腸内フローラの多様性の低下,Firmicutes門に属する細菌の減少,大腸菌などの腸内細菌科を含むProteobacteria門に属する細菌の増加といった腸内フローラの乱れが確認されている.こういったことから,遺伝的な素因による粘膜バリアの機能の低下あるいは環境要因による腸内フローラの異常により,宿主の粘膜バリアと腸内フローラとのバランスがくずれることにより腸内細菌の腸管上皮組織への侵入が容易になると,それらに対する宿主の免疫応答により炎症が惹起されると考えられる.実際に,粘膜バリアの機能に関連する遺伝子を欠損したマウスにおいて腸炎が自然発症すること,あるいは,実験的な腸炎モデルに対する感受性が亢進することが多く報告されている.
小腸および大腸における粘液の主成分であるMuc2を欠損したマウス,あるいは,O-結合型糖鎖の修飾が障害されるC1galt1を欠損したマウスにおいては,大腸において内粘液層が形成されず腸管上皮組織への腸内細菌の侵入やそれにともなう腸炎の自然発症が認められる25,26).腸管上皮細胞に発現するNod様受容体のひとつであるNLRP6を欠損したマウスにおいては杯細胞からの粘液の分泌がうまく起こらず,それにより大腸の内粘液層が低形成となり腸内フローラの変化により実験的な腸炎および病原細菌の感染に対する感受性が亢進する27).さらに,腸内フローラの乱れのみられる遺伝子改変マウスと野生型マウスとを同じケージで飼育すると,腸内フローラの乱れが野生型マウスに伝播し腸管の炎症の感受性も亢進する.また,MyD88ノックアウトマウスにおいては腸管上皮細胞からの抗菌ペプチドの産生の低下といった粘膜バリアの機能の低下が起こり,実験的な腸炎に対する感受性が亢進する28).クローン病に対する感受性遺伝子であるNOD2遺伝子を欠損したマウスではPaneth細胞においてNF-κBの活性化が起こらずディフェンシンなどの抗菌ペプチドの産生が低下する29).NOD2ノックアウトマウスは腸炎を自然発症しないが,Helicobacter hepaticus感染モデルにおいて野生型マウスと比較して回腸の末端にクローン病様の肉芽腫性炎症が認められる30).また,腸管上皮細胞に発現し膜タンパク質の輸送にかかわるAP-1Bを欠損したマウスにおいて腸管上皮細胞におけるディフェンシンなどの抗菌ペプチドの産生が低下し,また,分泌型免疫グロブリンAの腸管への輸送が障害され,これらの粘膜バリアの機能の低下によりクローン病様の慢性炎症像がみられる31).
筆者らは,さきに述べたように,腸管上皮細胞に発現するLypd8がとくに鞭毛をもつ細菌の腸管上皮細胞への侵入を抑制することを報告し,Lypd8ノックアウトマウスにおいては内粘液層への腸内細菌の侵入が認められ,実験的な腸炎に対する感受性が亢進することを明らかにした13).さらに,その感受性は鞭毛をもつ細菌に対し感受性のある抗生剤であるゲンタマイシンを前投与した場合には低下し,反対に,鞭毛をもつ細菌に対し感受性のないバンコマイシン前投与では細菌の交代の減少により鞭毛をもつグラム陰性桿菌が増加し,それにともない実験的な腸炎に対する感受性がさらに亢進することが明らかにされた.
以上のような遺伝子改変マウスを用いた研究により,腸管上皮細胞により形成される粘膜バリアの機能の低下やそれにともなう腸内フローラの乱れにより腸管の炎症に対する感受性が亢進することが示され,腸管上皮細胞と腸内細菌との相互作用により腸管における恒常性が維持されることが明らかにされた.
さまざまな腸管上皮細胞とその機能,また,腸管上皮細胞により構築される粘膜バリアの詳細と腸内細菌やその代謝産物による腸管上皮細胞の機能の制御,さらに,粘膜バリアの異常と腸内フローラの異常にともなう腸管の炎症について解説した.腸管上皮細胞は粘膜バリアを構築することにより腸内細菌を制御し,さらに,腸内細菌からの刺激により粘膜バリアは成熟し,また,腸管上皮細胞は腸内細菌からの刺激を免疫担当細胞に伝達することにより腸管免疫系の制御を担う.潰瘍性大腸炎やクローン病といった炎症性腸疾患については,病因について徐々に解明は進んでいるものの依然として不明な点も多い.とくに,潰瘍性大腸炎についてはその病因として粘膜バリアの異常が注目されている.粘膜バリアの機構,また,腸管上皮細胞と腸内細菌との相互作用の解明がさらに進むことにより,炎症性腸疾患の病因および病態の解明とそれによる新たな治療戦略の開発が期待される.
略歴:2016年 大阪大学大学院医学系研究科にて博士号取得,同年より大阪大学大学院医学系研究科 助教.
研究テーマ:大腸における粘膜バリアの機構.
抱負:基礎医学の研究から小児医療へ貢献したい.
竹田 潔(Kiyoshi Takeda)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/ongene/
© 2016 奥村 龍・竹田 潔 Licensed under CC 表示 2.1 日本
(大阪大学大学院医学系研究科 免疫制御学)
email:奥村 龍
領域融合レビュー, 5, e007 (2016) DOI: 10.7875/leading.author.5.e007
Ryu Okumura & Kiyoshi Takeda: Crosstalk between intestinal epithelial cells and commensal bacteria.
要 約
腸管上皮細胞は栄養や水分の吸収という機能とともに,多くの腸内細菌から腸管の組織をまもり,腸内細菌に対する過剰な免疫応答を回避するための粘膜バリアを構築する.また,腸内細菌と粘膜固有層に存在する免疫担当細胞とのあいだに存在し,病原細菌を含む腸内細菌からの刺激あるいはそれらに由来する抗原を免疫担当細胞に伝達することにより腸管免疫系を制御し,腸管における恒常性の維持に大きく貢献する.それゆえ,腸管上皮細胞の機能が遺伝的な素因により失われる,あるいは,環境要因により腸内フローラに乱れが生じると,宿主と腸内フローラとのバランスがくずれ,その結果,腸管に炎症がひき起こされる.
はじめに
ヒトを含む脊椎動物は水や食物を摂取し吸収することにより生命を維持する.いうまでもなく,消化管はその吸収を担う唯一の器官であり,口から摂取する食物を含む外来の異物は消化管を通過する.また,それとともにさまざまな細菌が腸管に侵入し,栄養が豊富な環境のもと腸管に定着して増殖し,腸内フローラといわれる細菌叢を形成する.腸内細菌はたんに共生するのみならず,食物に由来する栄養素を発酵し宿主にさらなる代謝産物を提供することにより宿主とウィン-ウィンの関係を築く.本来は外敵となりうる腸内細菌との良好な関係性の維持に不可欠なのが腸管に特有の免疫機構であり,腸内細菌と粘膜固有層に存在する免疫担当細胞とのあいだに存在する腸管上皮細胞は粘膜バリアを構築することにより腸内細菌と腸管上皮組織とを分けへだて,さらに,免疫担当細胞にシグナルを伝達することにより腸管免疫系を制御する.このレビューにおいては,腸管上皮細胞の腸管免疫系における機能を腸内細菌との相互作用を中心に解説する.
なお,腸内細菌と腸管免疫については,本田 賢也, 領域融合レビュー, 2, e011 (2013) も参照されたい.
1.さまざまな腸管上皮細胞とその機能
多くの腸内細菌を含む外来の異物の存在する腸管において,腸管免疫系は腸管上皮細胞や免疫担当細胞などさまざまなタイプの細胞により制御される(図1).腸の粘膜をおおうすべての腸管上皮細胞は陰窩に存在する腸管上皮幹細胞からTA細胞(transit-amplifying細胞)をへて分化し,分化とともに絨毛のほうへ移動し,分化の開始から3~4日で絨毛の頂上においてアポトーシスを起こし管腔へと脱落する.成熟した機能的な腸管上皮細胞は,吸収上皮細胞,杯細胞,Paneth細胞,腸内分泌細胞,タフト細胞,M細胞に分けられる(図1).
吸収上皮細胞は栄養や水分の吸収に特化した細胞であり,腸管上皮細胞の大部分をしめる.頂端面の細胞膜には刷子縁とよばれる微絨毛からなる構造があり,栄養素は微絨毛の細胞膜に存在する消化酵素により消化され吸収上皮細胞に吸収される.また,吸収上皮細胞の頂端面の表面は糖衣とよばれる糖鎖の集合体によりおおわれており,腸内細菌の腸管上皮細胞への侵入を障害する1).杯細胞は粘液の主成分であるムチンという糖タンパク質を多量に産生し分泌することにより腸の粘膜をおおう粘液の恒常性を維持し,腸管上皮細胞への腸内細菌の侵入をふせぐ.小腸の陰窩に存在するPaneth細胞は抗菌ペプチドの産生および分泌に特化した細胞であり,ディフェンシンファミリータンパク質やRegIIIファミリータンパク質などの抗菌ペプチドを産生し腸内細菌の侵入に対する防御に不可欠であるとともに2),近接する腸管上皮幹細胞にNotchシグナルを伝達することにより腸管上皮幹細胞の幹細胞としての機能を維持するニッチとしても重要な役割をはたす3).腸内分泌細胞は上皮細胞の1%程度をしめるマイナーな細胞であるが,食餌性の脂質や糖質を感知しコレシストキニン,ガストリン,セロトニンなどの消化管ホルモンを分泌することにより胃液や膵液の分泌および蠕動運動を促進し消化の制御に重要な役割をはたす.その一方,近年,コレシストキニンはマクロファージによる誘導型一酸化窒素合成酵素の産生を抑制するといった,消化管ホルモンと腸管免疫系との相互作用も明らかにされた4).腸内分泌細胞と同じ分泌系の細胞のひとつで,最近,注目をあつめているのがタフト細胞であり,頂端面に微細な毛の密集したような構造(タフト,房)をもつことからから名づけられた.これまで,その役割はほとんど明らかにされていなかったが,2016年初頭,3つの研究グループにより,タフト細胞は小腸に蠕虫が感染するとインターロイキン25を産生し,2型自然リンパ球を活性化することにより蠕虫の排除に大きく寄与することが明らかにされた5-7).M細胞は抗原の取り込みに特化した細胞で,パイエル板などリンパ濾胞をおおう腸管上皮組織に散在する.Gp-2といわれる細菌の受容体などを介して管腔から抗原を取り込み8),リンパ濾胞の樹状細胞に抗原を供給することにより免疫グロブリンAの産生に大きく寄与する.
これらの多種多様な腸管上皮細胞が腸内細菌や粘膜固有層に存在する免疫担当細胞と相互作用することにより,腸管免疫系は巧妙に制御されている.
2.腸管上皮細胞により形成される粘膜バリア
約100兆個といわれるおびただしい数の腸内細菌が存在する腸管には,腸内細菌から腸管の組織を保護する,あるいは,腸内細菌に対する過剰な免疫応答を回避するため,腸管上皮細胞により形成される粘膜バリアが存在する.粘膜バリアは物理的なバリアと化学的なバリアの2つに大別される.物理的なバリアには,腸の粘膜を被覆する粘液層,腸管上皮細胞の表面に存在する糖タンパク質の糖鎖により形成される糖衣,細胞接着装置である密着結合および接着結合があり,物理的な障壁として腸管上皮組織への腸内細菌の侵入をふせぐ.化学的なバリアにはディフェンシンファミリータンパク質,RegIIIファミリータンパク質,ラクトフェリン,リゾチームなどPaneth細胞を中心に腸管上皮細胞から産生される抗菌ペプチドが含まれる.遺伝的な素因などによりそれらの粘膜バリアの機能が破綻すると腸内フローラの変化や腸管上皮組織への腸内細菌の侵入により腸管の炎症が起こり,共生する宿主と腸内細菌との良好な関係は大きくくずれる.
小腸と大腸は同じ消化管ではあるが,その組織の構造や腸管上皮細胞の構成は異なるとともに,粘膜バリアの機構も大きく異なる(図2).小腸では粘液を産生する杯細胞の数が大腸と比べ少なく,腸管上皮細胞をおおう粘液層も薄い.その一方で,小腸の陰窩には大腸には存在しない抗菌ペプチドの産生に特化したPaneth細胞が存在し,腸内細菌と腸管上皮組織とを分けへだてるのに重要な役割をはたす.Paneth細胞を含む腸管上皮細胞から分泌される抗菌ペプチドは昆虫,植物,脊椎動物にいたるまで広く保存されており,塩基性アミノ酸残基を多く含むことにより正に荷電し,負に帯電した腸内細菌の細胞膜と結合したのち,疎水性の領域が細胞膜の透過性を亢進させることにより活性を発揮する.腸管上皮細胞がパターン認識受容体(pattern-recognition receptor:PRR)であるToll様受容体やNod様受容体を介し腸内細菌により刺激されると抗菌ペプチドの産生が亢進し,病原細菌に感染したときには粘膜固有層に存在するTh17細胞や3型自然リンパ球により産生されるインターロイキン17やインターロイキン22などのサイトカインにより腸管上皮細胞による抗菌ペプチドの産生はさらに亢進する9).腸管上皮細胞により産生される抗菌ペプチドとして,以前から,ディフェンシンファミリータンパク質やカテリシジンが代表的ものとして知られていたが,近年,新たにC型レクチンであるRegIIIファミリータンパク質が同定された.RegIIIファミリータンパク質のひとつであるRegIIIγがとくにPaneth細胞によりToll様受容体-MyD88シグナル伝達系を介して産生され,グラム陽性球菌に対し抗菌活性を発揮する10).さらに,腸管上皮細胞に特異的なMyD88ノックアウトマウスやRegIIIγノックアウトマウスの小腸においては腸内細菌と腸管上皮細胞とが近接していたことから,RegIIIγは小腸において腸内細菌と腸管上皮組織とを分けへだてるのに重要な役割をはたすことが明らかにされた11).
小腸の約100倍といわれるおびただしい数の腸内細菌が存在する大腸にはPaneth細胞は存在しないが,杯細胞の数が多く分厚い粘液層が腸管上皮細胞をおおっており,その粘液層は外粘液層と内粘液層の2つの層に分けられる12).粘液の主成分は杯細胞から産生される糖タンパク質のムチンであり,ムチンは分泌型ムチンと膜結合型ムチンの2つに分けられる.小腸および大腸においては分泌型ムチンであるMuc2が粘液の主成分であり,多量に付加されるO-結合型糖鎖が粘液の粘性を生じ,また,腸管上皮細胞の表面の糖鎖と結合し接着しようとする腸内細菌に対し競合的に結合することにより腸内細菌の侵入あるいは接着をふせぐ.大腸の腸管上皮細胞の直上にある内粘液層においてはMuc2が密に結合した構造をとり,外粘液層はそのMuc2の密な構造が宿主あるいは腸内細菌のプロテアーゼにより分解されゆるんだ状態にある.また,ほとんどの腸内細菌は外粘液層に生息し,内粘液層はほぼ無菌状態に保たれ,大腸においては内粘液層により腸内細菌と腸管上皮組織とは分けへだてられている12).それゆえ,粘液層を構成するMuc2を欠損したマウスやMuc2のO-結合型糖鎖の付加に不可欠な酵素であるC1galt1を欠損したマウスは内粘液層を欠き,腸内細菌の腸管上皮組織への侵入が認められる.
抗菌ペプチドの産生に特化したPaneth細胞が存在しないのにもかかわらず,おびただしい数の腸内細菌が存在する大腸において内粘液層が無菌に保たれ,腸内細菌と腸管上皮組織とが分けへだてられる機構はこれまで明らかにされていなかった.筆者らは,この内粘液層が無菌に保たれることに大腸の吸収上皮細胞に特異的に高発現するLypd8というGPIアンカー型タンパク質が重要な役割をはたすことを明らかにした13)(新着論文レビュー でも掲載).Lypd8はN-結合型糖鎖により高度に修飾されており,腸管上皮細胞の頂端側の表面に発現し,腸管上皮細胞の表面から恒常的に遊離し大腸の管腔に分泌される.遊離したLypd8は大腸菌やProteus属細菌など鞭毛をもつ細菌の鞭毛と優先的に結合し,その運動性を抑制することにより腸管上皮組織への侵入をふせいでいた.また,Lypd8ノックアウトマウスにおいては内粘液層および腸管上皮組織への腸内細菌の侵入が観察され,運動性の高い大腸菌やProteus属細菌が有意に多く検出された.Lypd8ノックアウトマウスはデキストラン硫酸ナトリウムによる実験的な腸炎に対する感受性が亢進しており,このことから,Lypd8が大腸において腸内細菌と腸管上皮組織を分けへだてることにより腸管の炎症をふせぐことが明らかにされた(図3).
以上のように,さまざまな腸管上皮細胞により構築される粘膜バリアにより,腸管の組織は病原細菌を含む腸内細菌からまもられ,それにより腸管における恒常性は維持されている.
3.腸内細菌が腸管上皮細胞におよぼす影響
腸管には100兆個をこえるBacteroides門やFirmicutes門を中心とした多種多様な細菌が生息し,それらの腸内細菌は短鎖脂肪酸やビタミンなどを産生することにより宿主に栄養面で恩恵をあたえるとともに,神経伝達物質であるセロトニンの分泌を促進するなど,近年は,神経系への影響も注目されている14).また,腸管免疫系は腸内細菌あるいはその代謝産物,食物の栄養素といった環境要因により制御される.実際,腸内細菌の存在しない無菌マウスにおいてはパイエル板,孤立リンパ濾胞,腸間膜リンパ節など腸管に関連するリンパ組織は低形成であり,粘膜固有層に存在する免疫グロブリンA産生細胞やTh17細胞の数も少なく,病原細菌の感染や実験的な腸炎モデルに対する感受性の亢進が認められる15,16).
腸管における恒常性の維持に一役を担う腸管上皮細胞もまた腸内細菌からさまざまな影響をうけていることが,無菌マウスにある種の腸内細菌を定着させるノトバイオート技術を用いた研究などにより明らかにされた.腸内細菌のひとつであるセグメント細菌を無菌マウスに定着させることにより,セグメント細菌が小腸の腸管上皮細胞に接着することにより腸管上皮細胞からの血清アミロイドAなどの産生が促進され,この血清アミロイドAは粘膜固有層におけるTh17細胞の分化を誘導する17,18).筆者らの研究グループは,腸内細菌に由来するATPが粘膜固有層におけるTh17細胞の分化を誘導することを明らかにし19),また,ATP加水分解酵素のひとつであるEntpd7を欠損したマウスにおいては小腸の管腔におけるATPの濃度が上昇し粘膜固有層においてTh17細胞が増加することを報告した20).ある種の腸内細菌あるいはそれらに由来するATPにより分化の誘導されたTh17細胞は,インターロイキン17やインターロイキン22といった炎症性サイトカインを産生することにより腸管上皮細胞からの抗菌ペプチドの産生を促進し,それらの抗菌ペプチドが腸内細菌を制御するという連鎖が成立する.
近年,腸管上皮細胞においてタンパク質のフコシル化を担うFut2を欠損したマウスにおいては腸管上皮細胞に発現する膜タンパク質がフコシル化されず,Salmonella thyphimuriumやCitrobacter rodentiumといった病原細菌の感染に対する感受性が亢進していたことから,腸管上皮細胞における膜タンパク質のフコシル化が感染防御に重要であることが示され,そのフコシル化が粘膜固有層に存在する3型自然リンパ球からセグメント細菌などの腸内細菌に依存して分泌されるインターロイキン22により誘導されることが明らかにされた.このように,膜タンパク質とともに腸管上皮細胞に発現する糖鎖は粘膜バリアの機能において重要であり,また,その糖鎖の構造も腸内細菌により変化しうる.
腸内細菌はToll様受容体-MyD88シグナル伝達系やNod様受容体のひとつであるNLRP6を介して杯細胞による粘液の産生を促進させる.とくに,杯細胞からの粘液の分泌にはNLRP6-インフラマソーム経路が重要であり,インフラマソームの活性化によるオートファジーの活性化を介し杯細胞からの粘液の分泌が誘導され,インフラマソームに関連するタンパク質を欠損したマウスにおいては杯細胞からの粘液の放出が障害され,内粘液層が欠け腸内フローラの乱れ(dysbiosis)が起こるとともに,腸管の炎症に対する感受性が増大する21).また,さきに述べたように,Paneth細胞は腸内細菌からのToll様受容体-MyD88シグナルに依存してRegIIIγなどの抗菌ペプチドを産生する.さらに,腸管上皮細胞はToll様受容体を介して腸内細菌により刺激されるとBAFFやAPRILの産生を誘導し,BAFFあるいはAPRILによりB細胞のCD40に非依存的なクラススイッチが誘導されることにより,病原細菌の定着およびそれらの毒素に対し防御的にはたらく免疫グロブリンAの産生に寄与する22).
腸内細菌の代謝産物もまた腸管上皮細胞に直接的または間接的に影響する.腸内細菌が炭水化物や食物繊維を異化することにより産生される酪酸,プロピオン酸,乳酸などの短鎖脂肪酸は,生体のエネルギー源として利用されるのみならず,腸管上皮細胞の増殖を促進し杯細胞からの粘液の産生を亢進させるといった粘膜バリアの維持にも重要である.筆者らの研究グループは,腸内細菌により産生されるトリプトファンの代謝産物であるインドールが腸管上皮細胞におけるClaudin-7やOcculudinなど密着結合あるいは接着結合に関連するタンパク質の発現を亢進させ粘膜バリアを増強させることを明らかにした23).別の研究グループは,インドールが腸管上皮細胞のPXRという受容体を刺激することによりToll様受容体シグナルに依存して細胞接着分子の発現を亢進させることを報告した24).
以上のように,腸内細菌やその代謝産物により腸管上皮細胞の粘膜バリアに関連するタンパク質の発現や機能は制御され,腸管上皮細胞もまたさまざまな機構により腸内細菌を制御し,腸内細菌と腸管上皮細胞はそれぞれ相互に作用しあうことにより腸管における恒常性は維持される(図4).今後,腸管の内容物のメタゲノム解析やメタボローム解析が進むことにより,さらに腸内細菌やそれらの代謝経路,さらには未知の代謝産物が明らかにされ,粘膜バリアの機能を制御する新たな因子が同定されることが期待される.
4.粘膜バリアの破綻や腸内フローラの乱れによりひき起こされる腸管の炎症
潰瘍性大腸炎やクローン病に代表される炎症性腸疾患は,さまざまな遺伝的な素因あるいは環境要因があいまって発症する多因子性の疾患である.遺伝的な素因に関しては,近年のゲノムワイド関連解析により,FUT2遺伝子,MUC1遺伝子,MUC19遺伝子,NOD2遺伝子といった粘膜バリアの機能に関与する遺伝子が疾患に関連する候補遺伝子としてあげられている.さらに,炎症性腸疾患の患者の腸管においては実際にディフェンシンなどの抗菌ペプチドの産生や粘液の産生の低下といった粘膜バリアの機能の低下が認められる一方,腸内フローラの多様性の低下,Firmicutes門に属する細菌の減少,大腸菌などの腸内細菌科を含むProteobacteria門に属する細菌の増加といった腸内フローラの乱れが確認されている.こういったことから,遺伝的な素因による粘膜バリアの機能の低下あるいは環境要因による腸内フローラの異常により,宿主の粘膜バリアと腸内フローラとのバランスがくずれることにより腸内細菌の腸管上皮組織への侵入が容易になると,それらに対する宿主の免疫応答により炎症が惹起されると考えられる.実際に,粘膜バリアの機能に関連する遺伝子を欠損したマウスにおいて腸炎が自然発症すること,あるいは,実験的な腸炎モデルに対する感受性が亢進することが多く報告されている.
小腸および大腸における粘液の主成分であるMuc2を欠損したマウス,あるいは,O-結合型糖鎖の修飾が障害されるC1galt1を欠損したマウスにおいては,大腸において内粘液層が形成されず腸管上皮組織への腸内細菌の侵入やそれにともなう腸炎の自然発症が認められる25,26).腸管上皮細胞に発現するNod様受容体のひとつであるNLRP6を欠損したマウスにおいては杯細胞からの粘液の分泌がうまく起こらず,それにより大腸の内粘液層が低形成となり腸内フローラの変化により実験的な腸炎および病原細菌の感染に対する感受性が亢進する27).さらに,腸内フローラの乱れのみられる遺伝子改変マウスと野生型マウスとを同じケージで飼育すると,腸内フローラの乱れが野生型マウスに伝播し腸管の炎症の感受性も亢進する.また,MyD88ノックアウトマウスにおいては腸管上皮細胞からの抗菌ペプチドの産生の低下といった粘膜バリアの機能の低下が起こり,実験的な腸炎に対する感受性が亢進する28).クローン病に対する感受性遺伝子であるNOD2遺伝子を欠損したマウスではPaneth細胞においてNF-κBの活性化が起こらずディフェンシンなどの抗菌ペプチドの産生が低下する29).NOD2ノックアウトマウスは腸炎を自然発症しないが,Helicobacter hepaticus感染モデルにおいて野生型マウスと比較して回腸の末端にクローン病様の肉芽腫性炎症が認められる30).また,腸管上皮細胞に発現し膜タンパク質の輸送にかかわるAP-1Bを欠損したマウスにおいて腸管上皮細胞におけるディフェンシンなどの抗菌ペプチドの産生が低下し,また,分泌型免疫グロブリンAの腸管への輸送が障害され,これらの粘膜バリアの機能の低下によりクローン病様の慢性炎症像がみられる31).
筆者らは,さきに述べたように,腸管上皮細胞に発現するLypd8がとくに鞭毛をもつ細菌の腸管上皮細胞への侵入を抑制することを報告し,Lypd8ノックアウトマウスにおいては内粘液層への腸内細菌の侵入が認められ,実験的な腸炎に対する感受性が亢進することを明らかにした13).さらに,その感受性は鞭毛をもつ細菌に対し感受性のある抗生剤であるゲンタマイシンを前投与した場合には低下し,反対に,鞭毛をもつ細菌に対し感受性のないバンコマイシン前投与では細菌の交代の減少により鞭毛をもつグラム陰性桿菌が増加し,それにともない実験的な腸炎に対する感受性がさらに亢進することが明らかにされた.
以上のような遺伝子改変マウスを用いた研究により,腸管上皮細胞により形成される粘膜バリアの機能の低下やそれにともなう腸内フローラの乱れにより腸管の炎症に対する感受性が亢進することが示され,腸管上皮細胞と腸内細菌との相互作用により腸管における恒常性が維持されることが明らかにされた.
おわりに
さまざまな腸管上皮細胞とその機能,また,腸管上皮細胞により構築される粘膜バリアの詳細と腸内細菌やその代謝産物による腸管上皮細胞の機能の制御,さらに,粘膜バリアの異常と腸内フローラの異常にともなう腸管の炎症について解説した.腸管上皮細胞は粘膜バリアを構築することにより腸内細菌を制御し,さらに,腸内細菌からの刺激により粘膜バリアは成熟し,また,腸管上皮細胞は腸内細菌からの刺激を免疫担当細胞に伝達することにより腸管免疫系の制御を担う.潰瘍性大腸炎やクローン病といった炎症性腸疾患については,病因について徐々に解明は進んでいるものの依然として不明な点も多い.とくに,潰瘍性大腸炎についてはその病因として粘膜バリアの異常が注目されている.粘膜バリアの機構,また,腸管上皮細胞と腸内細菌との相互作用の解明がさらに進むことにより,炎症性腸疾患の病因および病態の解明とそれによる新たな治療戦略の開発が期待される.
文 献
- Merga, Y., Campbell, B. J. & Rhodes, J. M.: Mucosal barrier, bacteria and inflammatory bowel disease: possibilities for therapy. Dig. Dis., 32, 475-483 (2014)[PubMed]
- Ayabe, T., Satchell, D. P, Wilson, C. L. et al.: Secretion of microbicidal α-defensins by intestinal Paneth cells in response to bacteria. Nat. Immunol., 1, 113-118 (2000)[PubMed]
- Sato, T., van Es, J. H, Snippert, H. J. et al.: Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature, 469, 415-418 (2011)[PubMed]
- Saia, R. S., Mestriner, F. L., Bertozi, G. et al.: Cholecystokinin inhibits inducible nitric oxide synthase expression by lipopolysaccharide-stimulated peritoneal macrophages. Mediators Inflamm., 2014, 896029 (2014)[PubMed]
- Gerbe, F., Sidot, E., Smyth, D. J. et al.: Intestinal epithelial tuft cells initiate type 2 mucosal immunity to helminth parasites. Nature, 529, 226-230 (2016)[PubMed]
- von Moltke, J., Ji, M., Liang, H. E. et al.: Tuft-cell-derived IL-25 regulates an intestinal ILC2-epithelial response circuit. Nature, 529, 221-225 (2016)[PubMed]
- Howitt, M. R., Lavoie, S., Michaud, M. et al.: Tuft cells, taste-chemosensory cells, orchestrate parasite type 2 immunity in the gut. Science, 351, 1329-1333 (2016)[PubMed]
- Hase, K., Kawano, K., Nochi, T. et al.: Uptake through glycoprotein 2 of FimH+ bacteria by M cells initiates mucosal immune response. Nature, 462, 226-230 (2009)[PubMed]
- Rubino, S. J., Geddes, K. & Girardin, S. E.: Innate IL-17 and IL-22 responses to enteric bacterial pathogens. Trends Immunol., 33, 112-118 (2012)[PubMed]
- Cash, H. L., Whitham, C. V., Behrendt, C. L. et al.: Symbiotic bacteria direct expression of an intestinal bactericidal lectin. Science, 313, 1126-1130 (2006)[PubMed]
- Vaishnava, S., Yamamoto, M., Severson, K. M. et al.: The antibacterial lectin RegIIIγ promotes the spatial segregation of microbiota and host in the intestine. Science, 334, 255-258 (2011)[PubMed]
- Johansson, M. E., Philipson, M., Petersson, J. et al.: The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. USA, 105, 15064-15069 (2008)[PubMed]
- Okumura, R., Kurakawa, T., Nakano, T. et al.: Lypd8 promotes the segregation of flagellated microbiota and colonic epithelia. Nature, 532, 117-121 (2016)[PubMed] [新着論文レビュー]
- Yano, J. M., Yu, K., Donaldson, G. P. et al.: Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis. Cell, 161, 264-276 (2015)[PubMed]
- Kamada, N., Kim, Y. G., Sham, H. P. et al.: Regulated virulence controls the ability of a pathogen to compete with the gut microbiota. Science, 336, 1325-1329 (2012)[PubMed] [新着論文レビュー]
- Kitajima, S., Morimoto, M., Sagara, E. et al.: Dextran sodium sulfate-induced colitis in germ-free IQI/Jic mice. Exp. Anim., 50, 387-395 (2001)[PubMed]
- Ivanov, I. I., Atarashi, K., Manel, M. et al.: Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell, 139, 485-498 (2009)[PubMed]
- Atarashi, K., Tanoue, T., Ando, M. et al.: Th17 cell induction by adhesion of microbes to intestinal epithelial cells. Cell, 163, 367-380 (2015)[PubMed]
- Atarashi, K., Nishimura, J., Shima, T. et al.: ATP drives lamina propria TH17 cell differentiation. Nature, 455, 808-812 (2008)[PubMed]
- Kusu, T., Kayama, H., Kinoshita, M. et al.: Ecto-nucleoside triphosphate diphosphohydrolase 7 controls Th17 cell responses through regulation of luminal ATP in the small intestine. J Immunol, 190, 774-783 (2013)[PubMed]
- Wlodarska, M., Thaiss, C. A, Nowarski, R. et al.: NLRP6 inflammasome orchestrates the colonic host-microbial interface by regulating goblet cell mucus secretion. Cell, 156, 1045-1059 (2014)[PubMed]
- He, B., Xu, W., Santini, P. A. et al.: Intestinal bacteria trigger T cell-independent immunoglobulin A2 class switching by inducing epithelial-cell secretion of the cytokine APRIL. Immunity, 26, 812-826 (2007)[PubMed]
- Shimada, Y., Kinoshita, M., Harada, K. et al.: Commensal bacteria-dependent indole production enhances epithelial barrier function in the colon. PLoS One, 8, e80604 (2013)[PubMed]
- Venkatesh, M., Mukherjee, S., Wang, H. et al.: Symbiotic bacterial metabolites regulate gastrointestinal barrier function via the xenobiotic sensor PXR and Toll-like receptor 4. Immunity, 41, 296-310 (2014)[PubMed]
- Van der Sluis, M., De Koning, B. A., De Bruijn, A. C. et al.: Muc2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection. Gastroenterology, 131, 117-129 (2006)[PubMed]
- Fu, J., Wei, B., Wen, T. et al.: Loss of intestinal core 1-derived O-glycans causes spontaneous colitis in mice. J. Clin. Invest., 121, 1657-1666 (2011)[PubMed]
- Elinav, E., Strowig, T., Kau, A. L. et al.: NLRP6 inflammasome regulates colonic microbial ecology and risk for colitis. Cell, 145, 745-757 (2011)[PubMed]
- Araki, A., Kanai, T., Ishikura, T. et al.: MyD88-deficient mice develop severe intestinal inflammation in dextran sodium sulfate colitis. J. Gastroenterol., 40, 16-23 (2005)[PubMed]
- Kobayashi, K. S., Chamaillard, M., Ogura, Y. et al.: Nod2-dependent regulation of innate and adaptive immunity in the intestinal tract. Science, 307, 731-734 (2005)[PubMed]
- Biswas, A., Liu, Y. J., Hao, L. et al.: Induction and rescue of Nod2-dependent Th1-driven granulomatous inflammation of the ileum. Proc. Natl. Acad. Sci. USA, 107, 14739-14744 (2010)[PubMed]
- Takahashi, D., Hase, K., Kimura, S. et al.: The epithelia-specific membrane trafficking factor AP-1B controls gut immune homeostasis in mice. Gastroenterology, 141, 621-632 (2011)[PubMed]
著者プロフィール
略歴:2016年 大阪大学大学院医学系研究科にて博士号取得,同年より大阪大学大学院医学系研究科 助教.
研究テーマ:大腸における粘膜バリアの機構.
抱負:基礎医学の研究から小児医療へ貢献したい.
竹田 潔(Kiyoshi Takeda)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/ongene/
© 2016 奥村 龍・竹田 潔 Licensed under CC 表示 2.1 日本